高一化学专题练习-原电池的构成
原电池、电解池专题(含答案解析)

原电池化学能转化为电能的装置。
无外加电源的装置一定是原电池。
原电池组成条件:1.两极材料活泼性不同2.电极直接与电解质溶液接触3.形成闭合回路原电池工作原理:活泼金属为负极(失电子,被氧化),不活泼金属或碳棒为负极(得电子,被还原)如锌铜原电池:锌为负极,铜为正极由于锌比铜活泼,锌原子失去电子通过导线流向铜原子,形成电流,溶液中的H +从铜片上获得电子,被还原成H 原子,并形成H 2阴离子向负极移动,阳离子向正极移动。
离子方程式为:↑+−→−+++222H ZnH Zn练习11.下列说法正确的是( )A .原电池是把电能转化为化学能的装置B .原电池中电子流出的一极是正极发生氧化反应C .原电池的两极发生的反应均为氧化还原反应D .形成原电池后,原电池中的阳离子向正极移动2.下列关于实验现象的描述不正确...的是( ) A .把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡B .用铜板和锌板紧靠在一起浸入硫酸铜溶液,负极铜板质量增加C .把铜片插入三氯化铁溶液中,在铜片表面出现一层铁D .把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快。
3.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag +Zn(OH)2Ag 2O +Zn +H 2O ,在此电池放电时,负极上发生反应的物质是 A .Ag B .Zn(OH)2 C .Ag 2OD .Zn4.白铁皮发生析氢腐蚀,若有0.2摩电子发生转移,下列说法中不正确的是A.有6.5克锌被腐蚀B.2.8克铁被腐蚀C.正极上H+被还原D.在标准状况下有2.24升气体放出5.铜片和锌片用导线连接后插入稀硫酸中,锌片是 A 阴极 B 正极 C 阳极D 负极6.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:实验装置部分实验现象a极质量减小,b极质量增加b极有气体产生,c极无变化d极溶解,c极有气体产生电流计指示在导线中电流从a极流向d极由此可判断这四种金属的活动性顺序是 A.a>b>c>d B.b>c>d>a C.d>a>b>cD.a>b>d>c7.下列变化中属于原电池反应的是()A.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化B.在空气中金属铝表面迅速被氧化形成保护膜C.红热的铁丝与水接触表面形成蓝色保护层D.在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生8.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成甲烷燃料电池。
高中化学《原电池》习题含解析
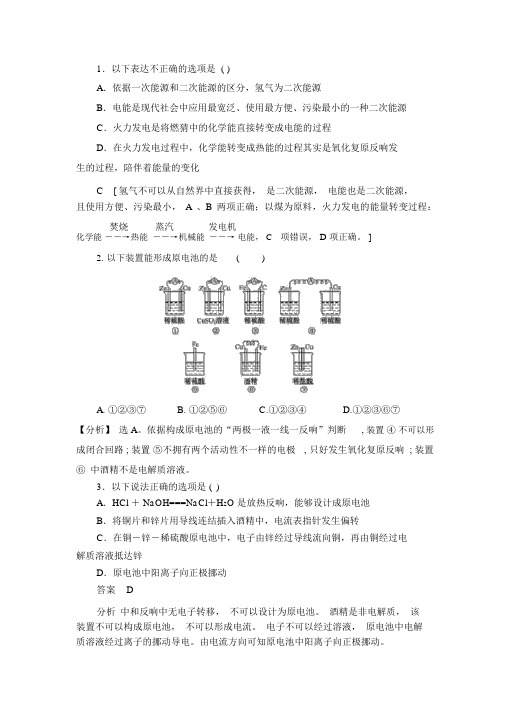
1.以下表达不正确的选项是 ()A.依据一次能源和二次能源的区分,氢气为二次能源B.电能是现代社会中应用最宽泛、使用最方便、污染最小的一种二次能源C.火力发电是将燃猜中的化学能直接转变成电能的过程D.在火力发电过程中,化学能转变成热能的过程其实是氧化复原反响发生的过程,陪伴着能量的变化C[ 氢气不可以从自然界中直接获得,是二次能源,电能也是二次能源,且使用方便、污染最小,A 、B 两项正确;以煤为原料,火力发电的能量转变过程:焚烧蒸汽发电机化学能――→热能――→机械能――→电能, C项错误, D 项正确。
]2. 以下装置能形成原电池的是()A. ①②③⑦B. ①②⑤⑥C.①②③④D.①②③⑥⑦【分析】选 A。
依据构成原电池的“两极一液一线一反响”判断, 装置④不可以形成闭合回路 ; 装置⑤不拥有两个活动性不一样的电极, 只好发生氧化复原反响 ; 装置⑥ 中酒精不是电解质溶液。
3.以下说法正确的选项是 ()A.HCl + NaOH===NaCl+H2O 是放热反响,能够设计成原电池B.将铜片和锌片用导线连结插入酒精中,电流表指针发生偏转C.在铜-锌-稀硫酸原电池中,电子由锌经过导线流向铜,再由铜经过电解质溶液抵达锌D.原电池中阳离子向正极挪动答案D分析中和反响中无电子转移,不可以设计为原电池。
酒精是非电解质,该装置不可以构成原电池,不可以形成电流。
电子不可以经过溶液,原电池中电解质溶液经过离子的挪动导电。
由电流方向可知原电池中阳离子向正极挪动。
4.以下对于铜-锌-稀硫酸构成的原电池的有关表达,错误的选项是() A.锌为负极,锌发生氧化反响B.铜为正极,铜不易失掉电子而遇到保护C.负极发生复原反响,正极发生氧化反响D.外电路电子流入的一极为正极,电子流出的一极为负极答案C分析在铜-锌-稀硫酸构成的原电池中,锌是负极,铜是正极,因此锌极发生氧化反响;铜电极上是溶液中的阳离子 H+得电子,发生复原反响;外电路电子的流向应当是由负极流向正极。
高中化学原电池练习题

高中化学原电池练习题原电池,是指由两种不同金属电极和相应电解质组成的电池。
原电池是化学反应生成电流的简单装置,其工作原理基于金属的离子间的电子传递。
在高中化学中,对原电池的理解是十分重要的知识点。
下面将给出几道高中化学原电池练习题,帮助同学们巩固对原电池的理解。
1. 下列反应中,哪一个能够组成原电池?A. 2H₂ + O₂ → 2H₂OB. Zn + Cu²⁺ → Zn²⁺ + CuC. Fe + 2H⁺ → Fe²⁺ + H₂D. Mg + 2Cl → MgCl₂2. 以下哪一个金属能够用于制作原电池中的阴极?A. 铝B. 锌C. 铜D. 锡3. 如果想要构建一个氢气电极,应该选择下列哪一种金属?A. 铜B. 银C. 铝D. 镍4. 在一个铜原电池中,下列哪一种粉末的溶液可以作为电解质?A. 氢氧化铁(III)溶液B. 铝氧化物溶液C. 硫酸铜溶液D. 碳酸镁溶液5. 当镍棒浸泡在硫酸镍的溶液中,同时有一个金片浸泡在硫酸铁的溶液中,连接两者后形成的电池是什么电池?A. 镍电池B. 铁电池C. 镍铁电池D. 锌铜电池6. 在铅板浸泡的硝酸铅溶液中,铁片浸泡在硫酸铁的溶液中,下列哪一种连接方式可以构成最简单的原电池?A. 铅板与铁片直接连接B. 铅板与铁片通过电解液连接C. 铅板通过导线连接铁片D. 铅板与铁片间没有联系7. 如果我们想要增加原电池的电动势,下列哪一种操作是可行的?A. 增加电解质浓度B. 更换阳极和阴极的金属C. 减小电解质浓度D. 加热电池中的电解液8. 下列哪一项不是原电池的特点?A. 金属电极必须有差异B. 电解液是电解质C. 电池产生电流的原理是化学反应D. 电解质中必须含有阴离子9. 原电池中,金属电极上的反应为氧化还是还原?A. 氧化B. 还原10. 在原电池中,正极电极对应于哪一个位置?A. 当电池放电时,正极为阳极B. 当电池放电时,正极为阴极C. 当电池充电时,正极为阳极D. 当电池充电时,正极为阴极通过这些练习题的答题学习,相信同学们对于高中化学中的原电池知识有了更深入的了解。
原电池的练习题

原电池的练习题一、选择题1. 原电池中,正极发生的反应是:A. 氧化反应B. 还原反应C. 电离反应D. 水解反应2. 以下哪个不是原电池的组成部分:A. 电极B. 电解质C. 导线D. 催化剂3. 原电池放电时,电子从哪个电极流出:A. 正极B. 负极C. 电解质D. 导线4. 原电池中,较活泼的金属通常作为:A. 正极B. 负极C. 电解质D. 导线5. 原电池的电压大小取决于:A. 电极材料B. 电解质浓度C. 电极间距离D. 外部温度二、填空题6. 原电池的工作原理基于_______反应和_______反应。
7. 原电池中,较不活泼的金属或非金属通常作为_______极。
8. 原电池放电时,电流从_______极流向_______极。
9. 原电池的电压大小与电极材料的_______有关。
10. 原电池中,电解质溶液的pH值会影响电极的_______。
三、简答题11. 描述原电池的基本工作原理。
12. 解释为什么锌铜原电池中锌作为负极,铜作为正极。
13. 原电池的电压大小受哪些因素影响?14. 举例说明原电池在日常生活中的应用。
15. 简述原电池与电解池的区别。
四、计算题16. 假设一个锌铜原电池,锌电极的质量为65.38g,铜电极的质量为32.65g。
锌的摩尔质量为65.38g/mol,铜的摩尔质量为63.55g/mol。
计算锌电极和铜电极的摩尔数,并确定哪个电极会先耗尽。
五、实验题17. 设计一个简单的实验来验证原电池的工作原理。
18. 描述实验中所需材料、步骤以及预期结果。
19. 如果实验结果与预期不符,分析可能的原因。
六、论述题20. 论述原电池在能源存储和转换中的重要性,并探讨其在现代科技中的应用前景。
请在答题时注意审题,确保答案的准确性和完整性。
高中化学《原电池》练习题(附答案解析)

高中化学《原电池》练习题(附答案解析)学校:___________姓名___________班级___________一、单选题1.下列各组的电极材料和电解液,不能组成原电池的是 ( ) A .铜片、石墨棒,稀硫酸 B .铜片、石墨棒,硝酸银溶液 C .锌片、铜片,稀盐酸D .铜片、银片,FeCl 3溶液2.食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按照一定比例组成的混合物,可同时吸收氧气和水,起到抗氧化和干燥的作用。
下列说法不正确的是( ) A .“双吸剂”中的生石灰有吸水作用 B .“双吸剂”吸收氧气时,发生了原电池反应 C .氯化钠的作用是作电解质,传导离子构成回路D .炭粉上发生的电极反应为22O 4e 4H =2H O -+++3.下列关于原电池的叙述中正确的是( ) A .正极和负极必须是金属B .原电池是把化学能转化成电能的装置C .原电池工作时,正极和负极上发生的都是氧化还原反应D .锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g 锌溶解,正极上就有0.1 g 氢气生成 4.下列装置中,能构成原电池的是( )A .B .C .D .5.下列关于原电池的叙述中错误的是( ) A .原电池内部的阳离子向正极移动 B .原电池是将化学能转变为电能的装置C .在原电池中,电子流入的一极是正极,发生还原反应D .构成原电池的正极和负极必须是两种不同的金属 6.下列说法正确的是( ) A .石油是可再生能源 B .化学反应必然伴随着能量变化 C .原电池的正极发生氧化反应D .加入催化剂一定能加快化学反应速率7.用铜片、铁片和硝酸银组成的原电池,负极上发生的是( )A .+-Ag e +=AgB .-2+Cu-2e =CuC .+-3Fe-3e =FeD .+-2Fe-2e =Fe8.下列有关实验装置进行的相应实验,能达到实验目的的是( )A .用图1装置用电流计检验电流的方向B .用图2装置制备Fe (OH )2并能较长时间观察其颜色C .用图3装置可分离CH 3COOC 2H 5和饱和碳酸钠溶液D .用图4装置除去C 2H 4中少量SO 29.化学课外活动小组设计的用化学电源使LED 灯发光的装置示意图如图。
高一化学原电池基础知识练习题(附答案)
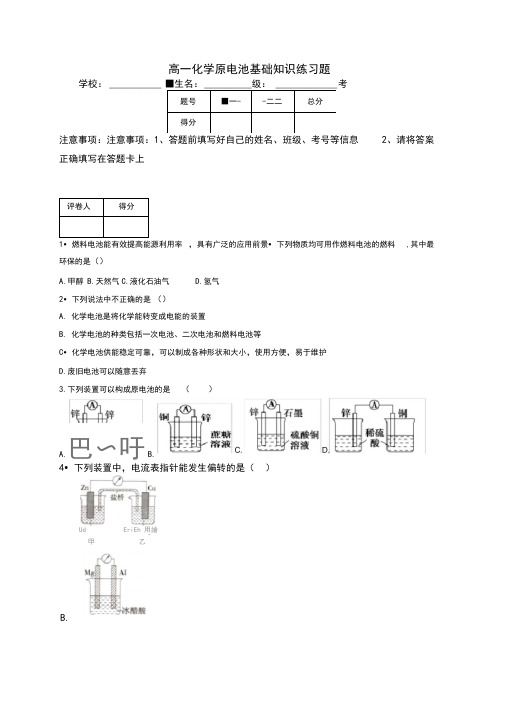
高一化学原电池基础知识练习题学校:___________ ■生名: __________ 级: _____________ 考注意事项:注意事项:1、答题前填写好自己的姓名、班级、考号等信息2、请将答案正确填写在答题卡上评卷人得分1•燃料电池能有效提高能源利用率 ,具有广泛的应用前景•下列物质均可用作燃料电池的燃料 ,其中最环保的是()A.甲醇B.天然气C.液化石油气D.氢气2•下列说法中不正确的是 ()A. 化学电池是将化学能转变成电能的装置B. 化学电池的种类包括一次电池、二次电池和燃料电池等C •化学电池供能稳定可靠,可以制成各种形状和大小,使用方便,易于维护 D.废旧电池可以随意丢弃3.下列装置可以构成原电池的是 ()4•下列装置中,电流表指针能发生偏转的是( )题号■一-得分-二二总分A.巴〜吁B.B.Ud EriEh 用繪■ 一 - -甲乙B. 放电过程中,Li +向负极移动C. 每转移0.1mol 电子,理论上生成20.7g PbD. 常温时,在正负极间接上电流表或检流计,指针不偏转6. 如图,在盛有稀H 2SO 4的烧杯中放入用导线连接的电极 X 、Y,外电路中电子流向如图所示 ,关于该 装置的下列说法正确的是 ();门:±±,≡ ≡∙ t≡ ■■ ■ J"8* = ∖∙" J*■ "JA. 外电路的电流方向为:X →外电路→YB. 若两电极分别为 Fe 和碳棒 则X 为碳棒,Y 为FeC. X 极上发生的是还原反应,Y 极上发生的是氧化反应D. 若两电极都是金属,则它们的活动性顺序为 X>Y7. 某原电池的电池反应为 Fe + 2Fe 3= 3Fe 2+,与此电池反应不符的原电池是( A. 铜片、铁片、FeCl 溶液组成的原电池C.D.5•热激活电池可用作火箭、导弹的工作电源。
一种热激活电池的基本结构如图所示质的无水LiCl — KCl 混合物受热熔融后,电池即可瞬间输出电能。
(完整word)高一化学原电池练习题

1页,总4页 原电池练习题 1.下列有关原电池的叙述中不正确的是 A. 原电池是将化学能转化为电能的装置 B. 在原电池中,电子流出的一极是负极,发生氧化反应 C. 锌、铜、硫酸组成的原电池中,溶液中的 Zn2+、 H+均向正极移动 D. 构成原电池的两个电极必须是活泼性不同的两种金属 2.下列装置能形成原电池的是( ) A. A B. B C. C D. D 3.A、B、C三种金属,A中混有C时A先腐蚀,A与B组成原电池,A为电池正极,则A、B、C三种金属的活动性顺序为 A.A>B>C B.A>C>B C.B>A>C D.B>C>A 4.下列关于实验现象的描述不正确的是 A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 B.原电池放电时,电流的方向是从正极到负极 C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 5.下列各组金属均有导线相连,并插入稀H2SO4液体中,其中铁被腐蚀由快到慢的顺序是①Fe-Fe ② Cu-Fe ③ Fe-Zn( ) A. ②>①>③ B. ②>③>① C. ③>①>② D.①>②>③ 6.下列有关图所示原电池装置描述正确的是 A.石墨电极作负极 B.铁片上的反应:Fe-2e-=Fe2+ C.铁电极附近溶液中氢离子浓度增大 D.电子由石墨电极通过导线流向铁电极 7.如图为铜锌原电池示意图,下列说法正确的是( ) A.负极发生氧化反应 B.烧杯中的溶液变为蓝色 C.电子由铜片通过导线流向锌片 D.该装置能将电能转变为化学能
4页,总4页 15.由A、B、C、D四种金属按下表中装置图进行实验. 根据实验现象回答下列问题: (1)装置甲中负极的电极反应式是_____________________________________. (2)装置乙中正极的电极反应式是____________________________________.. (3)四种金属活泼性由强到弱的顺序是__________________________________. (4)A、C形成合金,露置在潮湿空气中,_______先被腐蚀。 16.下图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下: Date:2016.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Cu极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol ⑥正极的电极反应式:Zn―2e―=Zn2+ (1)在卡片上,叙述合理的是 (填序号)。 (2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是 。 (3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是 。 (4)如果把硫酸换成硫酸铜溶液,猜测 (填“锌极”或“铜极”)变粗,原因是 (用电极方程式表示)。
高一化学必修2原电池专题

高一化学必修2原电池专题work Information Technology Company.2020YEAR化学能与电能的转化—原电池专题1、概念:把化学能直接转化为电能的装置叫做原电池。
2、原电池的工作原理:通过氧化还原反应(有电子的转移)把化学能转变为电能。
3、构成原电池的条件:(1)电极为导体且活泼性不同;(2)两个电极接触(导线连接或直接接触);(3)两个相互连接的电极插入电解质溶液构成闭合回路。
【例题分析】例1、在如图所示的8个装置中,属于原电池的是()A.①④ B.③④⑤C.④⑧D.②④⑥⑦4、电极名称及发生的反应:负极:较活泼的金属作负极,负极发生氧化反应,电极反应式:较活泼金属-ne-=金属阳离子负极现象:负极溶解,负极质量减少。
正极:较不活泼的金属或石墨作正极,正极发生还原反应,电极反应式:溶液中阳离子+ne-=单质正极的现象:一般有气体放出或正极质量增加。
5、原电池正负极的判断方法:①依据原电池两极的材料:较活泼的金属作负极(K、Ca、Na太活泼,不能作电极);较不活泼金属或可导电非金属(石墨)、氧化物(MnO2)等作正极。
②根据电流方向或电子流向:(外电路)的电流由正极流向负极;电子则由负极经外电路流向原电池的正极。
③根据内电路离子的迁移方向:阳离子流向原电池正极,阴离子流向原电池负极。
④根据原电池中的反应类型:负极:失电子,发生氧化反应,现象通常是电极本身消耗,质量减小。
正极:得电子,发生还原反应,现象是常伴随金属的析出或H2的放出。
6、原电池电极反应的书写方法:(i)原电池反应所依托的化学反应原理是氧化还原反应,负极反应是氧化反应,正极反应是还原反应。
因此书写电极反应的方法归纳如下:①写出总反应方程式。
②把总反应根据电子得失情况,分成氧化反应、还原反应。
③氧化反应在负极发生,还原反应在正极发生,反应物和生成物对号入座,注意酸碱介质和水等参与反应。
(ii)原电池的总反应式一般把正极和负极反应式相加而得。
高中化学原电池试题及答案

高中化学原电池试题及答案一、选择题1. 原电池的工作原理是什么?A. 将化学能直接转化为电能B. 将电能转化为化学能C. 将机械能转化为电能D. 将热能转化为电能答案:A2. 以下哪个选项不是原电池的组成部分?A. 电极B. 电解质C. 导线D. 电源答案:D3. 原电池放电时,正极发生的反应类型是?A. 氧化反应B. 还原反应C. 置换反应D. 聚合反应答案:B4. 原电池中,较活泼的金属通常作为哪个电极?A. 正极B. 负极C. 两极D. 不参与电极答案:B5. 原电池中,电子的流动方向是?A. 从正极到负极B. 从负极到正极C. 在两极之间循环D. 不流动答案:B二、填空题6. 原电池的两个电极分别是________和________。
答案:正极;负极7. 原电池中,较不活泼的金属或非金属通常作为正极,正极上发生的是________反应。
答案:还原8. 原电池工作时,溶液中的阳离子向________极移动,阴离子向________极移动。
答案:正;负9. 原电池中,较活泼的金属失去电子,发生________反应,成为阳离子进入溶液。
答案:氧化10. 原电池的总反应可以表示为________极上的反应加上________极上的反应。
答案:正;负三、简答题11. 描述锌铜硫酸原电池的工作原理。
答案:锌铜硫酸原电池中,锌作为负极,铜作为正极。
锌在负极上失去电子,发生氧化反应,生成锌离子进入溶液。
铜在正极上接受电子,发生还原反应,从溶液中得到锌离子。
电子从锌极通过导线流向铜极,形成闭合电路,产生电流。
四、计算题12. 假设一个锌铜硫酸原电池,锌电极的质量为65.38g,铜电极的质量为64g,硫酸的浓度为1M。
如果电池放电1小时,计算锌电极减少的质量。
答案:首先,我们需要知道锌的摩尔质量是65.38g/mol。
锌在电池中的氧化反应为:Zn → Zn^2+ + 2e^-。
根据法拉第定律,1 mol电子转移对应1法拉第的电量。
高中化学-原电池(人教版精编讲义+习题)

201 年高中化学专属讲义课题:原电池学生姓名:授课教师:201 年月日原电池1.概念及反应本质把化学能转化为电能的装置,其本质是发生了氧化还原反应。
2.构成条件(1)有两个的电极(常见为金属或石墨)。
(2)将电极插入中。
(3)两电极间构成(两电极接触或用导线连接)。
(4)能自发发生氧化还原反应。
3.工作原理如图是Cu-Zn原电池,请填空:(1)反应原理电极名称负极正极电极材料Zn Cu电极反应Zn-2e-===Zn2+Cu2++2e-===Cu反应类型氧化反应还原反应(2)原电池中的三个方向①电子方向:从负极流出沿导线流入正极;②电流方向:从正极沿导线流向负极;③离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
(3)两种装置的比较图Ⅰ中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。
图Ⅱ中Zn和CuSO4溶液分别在两个池中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。
(4)盐桥作用①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流。
4.原电池原理的三个应用(1)设计制作化学电源①首先将氧化还原反应分成两个半反应。
②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
(2)比较金属活动性强弱两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
(3)加快氧化还原反应的速率一个自发进行的氧化还原反应,设计成原电池时反应速率加快。
例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
知识点1 原电池的组成【例题1-1】(2015秋巴彦校级期末)选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成原电池装置(只有两个电极),能产生电流的可能组合共有()A.3种B.4种C.5种D.6种【练习1-1】(2016春蚌山区校级期中)选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成右图所示的原电池装置(只有两个电极),观察到电流计Ⓖ的指针均明显转偏,则其可能的组合共有()A.4种B.5种C.6种D.7种知识点2 原电池判断金属活泼性【例题2-1】有A、B、C、D、E五块金属片,进行如下实验,试比较金属活动性的强弱:(1)A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极,活动性________;(2)C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C,活动性________;(3)A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡,活动性________;(4)B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应,活动性________;(5)用惰性电极电解含B离子和E离子的溶液,E先析出,活动性________。
高中化学(新人教版)选择性必修一课后习题:原电池的工作原理(课后习题)【含答案及解析】
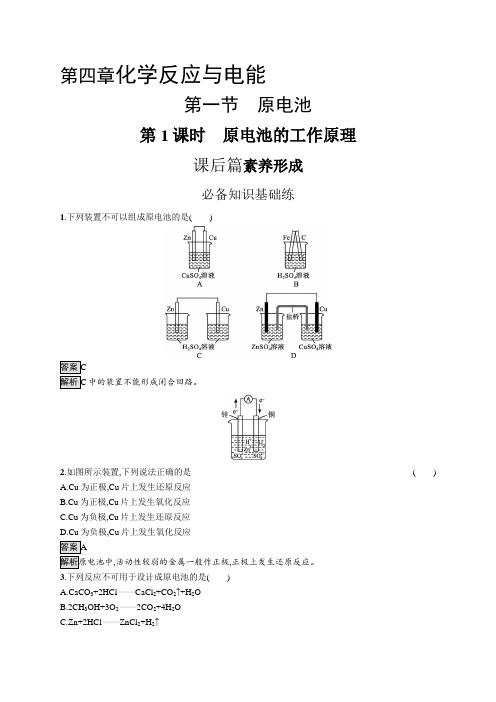
第四章化学反应与电能第一节原电池第1课时原电池的工作原理课后篇素养形成必备知识基础练1.下列装置不可以组成原电池的是()中的装置不能形成闭合回路。
2.如图所示装置,下列说法正确的是()A.Cu为正极,Cu片上发生还原反应B.Cu为正极,Cu片上发生氧化反应C.Cu为负极,Cu片上发生还原反应D.Cu为负极,Cu片上发生氧化反应,活动性较弱的金属一般作正极,正极上发生还原反应。
3.下列反应不可用于设计成原电池的是()A.CaCO3+2HCl CaCl2+CO2↑+H2OB.2CH3OH+3O22CO2+4H2OC.Zn+2HCl ZnCl2+H2↑D.4Al+3O2+6H2O4Al(OH)3A项为非氧化还原反应,不能设计成原电池。
4.下列说法正确的是()A.原电池中,负极上发生的反应是还原反应B.原电池中,电流的方向是负极—导线—正极C.双液原电池中的盐桥也可以用金属导线代替D.在原电池中,阳离子移向正极,阴离子移向负极项,原电池负极上发生氧化反应;B项,电流的方向应是正极—导线—负极;C项,盐桥不能用导线代替。
5.某原电池反应的离子方程式为Fe+2H+Fe2++H2↑,则下列说法正确的是()A.用稀硝酸作电解质溶液B.用锌作原电池正极C.用铁作负极,铁的质量不变D.用铜作原电池正极解析根据原电池反应可以确定原电池负极为Fe,电解质溶液可以为稀盐酸或稀硫酸等,但不能为稀硝酸,若为稀硝酸,则原电池反应为3Fe+8H++2N O3-2NO↑+3Fe2++4H2O。
6.关于锌、铜和稀硫酸构成的原电池的下列说法正确的是()A.锌是正极,铜是负极B.电子从铜片经导线流向锌片C.负极的反应式为2H++2e-H2↑D.反应一段时间后,溶液的pH升高7.右图是某同学设计的原电池装置,下列叙述正确的是()A.电极Ⅰ上发生还原反应,作原电池的负极B.电极Ⅱ的电极反应为Cu2++2e-CuC.该原电池的总反应为2Fe3++Cu Cu2++2Fe2+D.盐桥中装有含氯化钾饱和溶液的琼胶,其作用是传递电子解析A项,该原电池中,电极Ⅱ为负极,负极发生氧化反应,电极反应为Cu-2e-Cu2+,A、B两项均错误;C项,正极反应为2Fe3++2e-2Fe2+,电池总反应为2Fe3++Cu Cu2++2Fe2+,C项正确;D项,盐桥的作用是形成闭合回路,通过阴、阳离子的移动平衡两溶液中的电荷,故传递的是阴、阳离子,而不是电子,D项错误。
2019高一化学:原电池练习题(鲁科版2)

2019高一化学:原电池练习题(鲁科版2)注意事项:认真阅读理解,结合历年的真题,总结经验,查找不足!重在审题,多思考,多理解!无论是单选、多选还是论述题,最重要的就是看清题意。
在论述题中,问题大多具有委婉性,尤其是历年真题部分,在给考生较大发挥空间的同时也大大增加了考试难度。
考生要认真阅读题目中提供的有限材料,明确考察要点,最大限度的挖掘材料中的有效信息,建议考生答题时用笔将重点勾画出来,方便反复细读。
只有经过仔细推敲,揣摩命题老师的意图,积极联想知识点,分析答题角度,才能够将考点锁定,明确题意。
1.以下各装置能构成原电池的是〔〕答案:BD2、关于铜--锌和稀H2SO4构成原电池说法正确的选项是〔〕。
A、锌是正极,铜是负极B、构成原电池正极和负极的必须是两种不同的金属C、电流由锌流向铜D、电子经外电路由锌流向铜答案:D3.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下表达正确的选项是A两烧杯中铜片表面均无气泡产生B甲中铜片是正极,乙中铜片是负极C两烧杯中溶液的pH均增大D产生气泡的速度甲比乙慢答案:C4、纯锌跟稀H2SO4反应速率很小,为了加快锌的溶解和放出H2的速率,并且使产生H2的量不变,当稀H2SO4过量时,可向其中加少量〔〕A、CuSO4溶液B、CuS固体C、铜D、镁条答案:C5、以下四组原电池放电后,电解质溶液质量增加,且在正极有单质生成的是〔〕。
A、Cu、Ag、AgNO3溶液B、Zn、Cu稀H2SO4C、Fe、Zn、CuSO4溶液D、Fe、C、Fe2(SO4)3溶液答案:BC6、常用的钮扣电池为银锌电池,它分别以锌和氧化银为电极。
放电时锌极上的电极反应是:Zn+2OH――2e→Zn(OH)2,氧化银极上的反应是:Ag2O+H2O+2e→Ag+2OH-,以下判断中,正确的选项是〔〕。
A 、锌是负极,发生氧化反应,氧化银是正极,发生还原反应B 、锌是正极,发生氧化反应,氧化银是负极,发生还原反应C 、锌是负极,发生还原反应,氧化银是正极,发生氧化反应D 、锌是正极,发生还原反应,氧化银是负极,发生氧化反应答案:A7、有A 、B 、C 、D 、E 五种金属,A 的溴化物在常温下分解生成黑色的A ,B 的氧化物在空气中加热到熔融时不分解,B 和C 用导线相连,在稀硫酸溶液中组成原电池时,C 上有气体产生,D 放入C 的硫酸盐溶液中得到C 的稳定氢氧化物沉淀,用E 作电极电解C 的盐酸盐溶液时,阴极上放出氢气,阳极上放出氯气,那么关于五种金属活动顺序的表达正确的选项是〔〕。
高中化学原电池(含答案解析)

第一节原电池知识点一原电池1.下列装置中能构成原电池产生电流的是( )答案 B解析A、D项中电极与电解质溶液之间不发生反应,不能构成原电池;B项符合原电池的构成条件,两电极发生的反应分别是Zn-2e-===Zn2+,2H++2e-===H2↑;C项中酒精不是电解质,故不能构成原电池。
2.下列各装置能形成原电池的是( )答案 D解析判断一个装置能否构成原电池,要看是否符合原电池的构成条件:①电极材料(活动性不同的金属、金属与非金属、金属与金属氧化物);②电解质溶液;③构成闭合回路;④能自发进行的氧化还原反应。
A装置:由于两个电极是同种金属,不能形成原电池;B装置:酒精不是电解质溶液,不能构成原电池;C 装置:没有形成闭合回路,不能形成原电池;D装置:符合原电池构成的条件,能形成原电池。
知识点二原电池的原理3.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )A.两烧杯中铜片表面均无气泡产生B.甲中铜片是正极,乙中铜片是负极C.两烧杯中溶液的pH均增大D.产生气泡的速率甲比乙慢答案 C解析因乙杯中锌片和铜片没有接触,故不能构成原电池,A、B皆错;因甲烧杯中Zn、Cu用导线连接后构成原电池,加快了Zn的溶解,故D错;又因两杯中的Zn都能与稀H2SO4反应产生H2而消耗H+,故C正确。
4.把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。
A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A 极减轻;B、D相连时,B为正极。
则四种金属的活动性顺序由大到小排列为( )A .A>B>C>DB .A>C>B>DC .A>C>D>BD .B>D>C>A 答案 C解析 金属组成原电池,相对活泼的金属失去电子作负极,相对不活泼的金属作正极。
负极被氧化,质量减轻,正极发生还原反应,有物质析出,由题意得活动性A>B 、A>C 、C>D 、D>B ,故正确答案为C 。
高一化学下学期原电池基础知识点练习题(附答案)
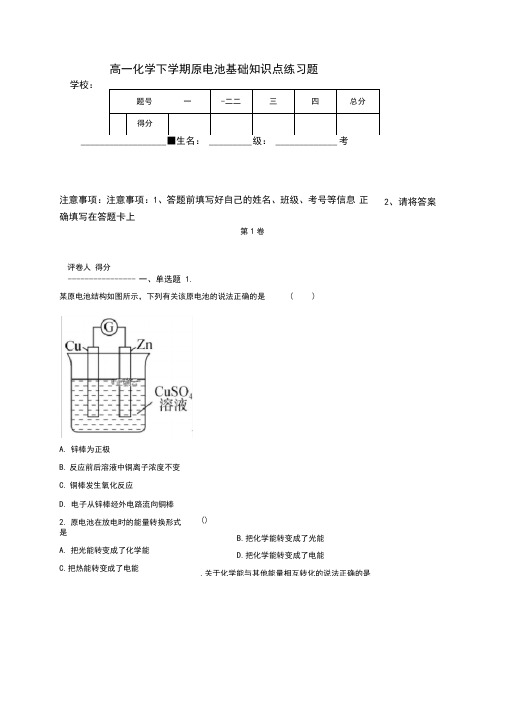
高一化学下学期原电池基础知识点练习题学校:__________________ ■生名: _________ 级: _____________ 考注意事项:注意事项:1、答题前填写好自己的姓名、班级、考号等信息正确填写在答题卡上第1卷评卷人得分---------------- 一、单选题 1.某原电池结构如图所示,下列有关该原电池的说法正确的是( )题号一-二二三四总分得分2、请将答案A.锌棒为正极B.反应前后溶液中铜离子浓度不变C.铜棒发生氧化反应D.电子从锌棒经外电路流向铜棒2.原电池在放电时的能量转换形式是A.把光能转变成了化学能C.把热能转变成了电能()B.把化学能转变成了光能D.把化学能转变成了电能.关于化学能与其他能量相互转化的说法正确的是ffl2A. 图1所示的装置能将化学能转变为电能B. 图2所示的反应为吸热反应C. 中和反应中,反应物的总能量比生成物的总能量低D. 化学反应中能量变化的根本原因是化学键的断裂与生成4•根据反应:2Ag ++Cu=Cu 2++2Ag,设计如图所示原电池,下列说法错误的是()A 、 锌片做负极B 、 电子由铜片经导线流向锌片C 、 铜片上有气泡产生D 、 一段时间后,溶液中氢离子的物质的量减少6.某同学控制适当条件,将反应 Ag + Fe 3+=2 Ag + + Fe 2+设计成如图所示的原电池装置指针偏向与电子的流向相同)。
下列有关判断不正确的是()A. X 可以是银或石墨 C.电子从铜电极经外电路流向 X 电极 5•下所示为铜锌原电池,下列有关说法不正确B.Y 是硫酸铜溶液D.X 极上的电极反应式为:Ag ++e -=Ag(已知电流表反应迟和A .若电流表指针向右偏转,则银电极发生氧化反应B •若电流表指针归零时,则反应达到平衡状态C .电流表指针归零时,若向左烧瓶中滴加几滴AgNO 3溶液,则石墨为正极 D •上述实验能说明其他条件不变时 Ag +与Fe 3+的氧化性强弱与其离子浓度有关7.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是()8•实验探究是提高学习效果的有力手段。
高一化学原电池试题

高一化学原电池试题,b为碳棒,关于此装置的各种叙述中不正确的1.如图所示的装置中,金属a能从酸中置换出H2是()A.碳棒上有气体放出,溶液pH值变大B.a是正极,b是负极C.导线中有电子流动,电子从a极到b极D.a极上发生了氧化反应【答案】B【解析】a的活动性比氢要强,b为碳棒,该装置能自发的发生氧化还原反应而构成原电池,a作负极,碳棒作正极,负极上金属失电子发生氧化反应,碳棒上氢离子得电子发生还原反应,电子从负极沿导线流向正极。
A、该原电池中金属作负极,碳棒b作正极,负极上金属失电子发生氧化反应,正极碳上氢离子得电子发生还原反应,所以溶液中氢离子浓度减小,溶液的pH增大,故A正确;B、该原电池中,金属的金属性大于氢元素,所以金属a作负极,碳棒b作正极,故B错误;C、该装置能构成原电池,所以有电流产生,电子从负极a沿导线流向正极b,故C正确;D、a作负极,负极上失电子发生氧化反应,故D正确;故选:B。
【考点】考查原电池工作原理=2AgCl。
下列说法正确的是2.某原电池装置如下图所示,电池总反应为2Ag+Cl2A.正极反应为AgCl +e-=Ag +Cl-B.放电时,交换膜右侧溶液中有大量白色沉淀生成C.若用NaCl溶液代替盐酸,则电池总反应随之改变D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子【答案】D【解析】根据电池总反应为2Ag+Cl═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电2+2e-═2Cl-,故A错误;B、子生成氯离子,A、正极上氯气得电子生成氯离子,其电极反应为:Cl2放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀,所以交换膜左侧═2AgCl可知,用NaCl溶液中有大量白色沉淀生成,故B错误;C、根据电池总反应为2Ag+Cl2溶液代替盐酸,电池的总反应不变,故C错误;D、放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中约减少0.02mol离子,故D正确.故选:D.【考点】考查了原电池原理的应用及沉淀反应的相关知识点。
高一化学(下)原电池电解池练习(附答案)

高一化学(下)原电池电解池练习一、单选题1.把A 、B 、C 、D 4块金属片浸入稀硫酸中,用导线两两相连组成原电池.若A 、B 相连时,A 为负极;C 、D 相连时,D 上产生大量气泡;A 、C 相连时,电流由C 经导线流向A;B 、D 相连时,电子由D 经导线流向B,则此4种金属的活动性由强到弱的顺序为( ) A.A>B>C>DB.A>C>D>BC.C>A>B>DD.B>A>C>D2.利用如图所示装置可以在铜牌表面电镀一层银。
下列有关说法正确的是( )A.通电后,Ag +向阳极移动 B.银片与电源负极相连C.该电解池的阴极反应可表示为Ag ++e-AgD.当电镀一段时间后,将电源反接,铜牌可恢复如初3.若将两个铂电极插入KOH 溶液中,向两极分别通入CH 4和O 2,即构成甲烷燃料电池。
已知通入甲烷的一极,其电极反应为2432CH 10OH 8e =CO 7H O ---+-+,下列叙述正确的是( ) A .通入甲烷的一极为正极 B .通入氧气的一极发生氧化反应C .该电池总反应为42223CH 2O 2OH =3CO H O --+++ D .该电池在工作时,溶液中的阴离子向正极移动4.电解100mL c (H +)=0.30mol/L 的下列溶液,当电路中通过0.04mol 电子时,理论上析出金属的质量最大的是( )A.含0.10mol/L Ag +的溶液B.含0.20mol/L Zn 2+的溶液C.含0.20mol/L Cu 2+的溶液D.含0.20mol/L Pb 2+的溶液5.已知蓄电池在充电时作电解池,放电时作原电池。
铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。
关于标有“-”的接线柱,下列说法正确的是( ) A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极 C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极6.为了防止钢铁锈蚀,下列防护方法中正确的是( ) A .在精密机床的铁床上安装铜螺钉B .在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中C .在海轮舷上用铁丝系住锌板浸在海水里D.在地下输油的铸铁管上接直流电源的正极7.某同学组装了如图所示的电化学装置,电极I为Al,其他均为Cu,则( )A.电流方向:电极IV→A→电极IB.电极I发生还原反应C.电极II逐渐溶解D.电极III的电极反应:2+-Cu+2e=Cu8.如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )A.杠杆为导体和绝缘体时,均为A端高B端低B.杠杆为导体和绝缘体时,均为A端低B端高C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高9.银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。
高中化学复习知识点:原电池的结构
高中化学复习知识点:原电池的结构一、单选题1.下列装置能构成原电池的是()A.B.C.D.2.下列装置中,能构成原电池的是A.只有甲B.只有乙C.只有丙D.除乙均可以3.下列装置能构成原电池的是()A.B.C.D.4.用如图所示装置进行实验:若图中x 轴表示流入正极的电子的物质的量,则y 轴可以表示:①()+c Ag ,②()-3c NO ,③a 棒的质量,④b 棒的质量,⑤溶液的质量中的( )A .①③B .②④C .①③⑤D .②④⑤5.下列可设计成原电池的化学反应是( ) A .22H O(1)CaO(s)=Ca(OH)(s)+B .224232Ba(OH)8H O 2NH Cl=BaCl 2NH 10H O ⋅++↑+C .232ΔMnO 2KClO 2KCl 3O +↑D .4222()2()()2(点燃CH g O g CO g H O l)+−−−→+6.以下反应不能设计成原电池的是( ) A .NaOH+HNO 3 =NaNO 3+H 2O B .CH 4+2O 2 = CO 2+2H 2O C .Zn+H 2SO 4 = ZnSO 4+H 2↑ D .Fe+2FeCl 3 =3FeCl 27.下列装置中能形成原电池的是( )①②③④⑤⑥⑦A.①③⑤B.②④⑥C.①⑤⑥D.②③④8.把金属A放入盐B(NO3)2的溶液中,发生如下反应:A+B2+===A2++B,以下叙述正确的是()A.常温下金属A一定能与水反应,B一定不能与水反应B.A与B用导线连接后放入酒精中,一定形成原电池C.A、B用导线连接后放入B(NO3)2的溶液中,一定有电流产生D.由A与B形成的原电池,A一定是正极,B一定是负极9.下列各图表示的装置属于原电池的是()A.①②B.③④C.⑤D.③⑤10.利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。
下图为一套浓差电池和电解质溶液再生的配套装置示意图,闭合开关K之前,两个Cu电极的质量相等。
高一化学原电池练习题

高一化学原电池练习题高一化学原电池练习题导语:在高一学习化学的过程中,原电池是一个重要的概念。
原电池是一种将化学能转化为电能的装置,通过化学反应产生电流。
为了提高对原电池的理解和掌握,下面将给出一些高一化学原电池的练习题,帮助同学们巩固知识。
练习题一:选择题1. 下列哪个不是原电池的特点?A. 产生电能B. 化学能转化为电能C. 通过化学反应产生电流D. 可以反复使用2. 下列哪个不是原电池的组成部分?A. 阳极B. 阴极C. 电解质溶液D. 电阻器3. 下列哪个不是原电池的常见类型?A. 锂电池B. 铅酸电池C. 干电池D. 碳酸电池4. 下列哪个不是原电池的工作原理?A. 氧化还原反应B. 离子迁移C. 电子流动D. 热能转化为电能5. 下列哪个不是原电池的应用领域?A. 电子产品B. 交通工具C. 医疗设备D. 建筑工程练习题二:填空题1. 原电池是一种将化学能转化为电能的装置,通过化学反应产生________。
2. 原电池的基本组成部分包括阳极、阴极和________。
3. 原电池的工作原理是通过氧化还原反应,使阳极发生________反应,阴极发生________反应。
4. 原电池的电动势是指电池在闭路中产生的电压,单位是________。
5. 锂电池是一种常见的原电池,其正极材料通常是________。
练习题三:解答题1. 请简要描述原电池的工作原理。
2. 举例说明原电池在日常生活中的应用。
3. 解释原电池的电动势和电流之间的关系。
答案解析:练习题一:选择题1. D。
原电池可以反复使用是不正确的,一般使用一段时间后会失效。
2. D。
电阻器不是原电池的组成部分,它是用来控制电流的元件。
3. D。
碳酸电池不是原电池的常见类型。
4. D。
热能转化为电能不是原电池的工作原理。
5. D。
建筑工程不是原电池的应用领域。
练习题二:填空题1. 电流2. 电解质溶液3. 氧化,还原4. 伏特5. 锂离子练习题三:解答题1. 原电池的工作原理是通过氧化还原反应,在阳极发生氧化反应,阴极发生还原反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原电池的构成条件分析
例1、某同学设计实验探究构成原电池的条
件,装置如下:
实验一:实验探究电极的构成〈甲图〉
①A、B 两极均选用石墨作电极,发现电流
计指针不偏转;② A、B 两极均选用铜片作
电极,发现电流计指针不偏转;③ A极用锌
片,B极用铜片,发现电流计指针向左偏转;
④ A极用锌片,B极用石墨,发现电流计指针向左偏转。
⑤⑥
结论一:____________________________________。
实验二:探究溶液的构成〈甲图,A极用锌片,B极用铜片)
①液体采用无水乙醇,发现电流计指针不偏转;
②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。
结论二:____________________________________。
实验三:对比实验,探究乙图装置能否构成原电池
将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转。
结论三:____________________________________。
思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。
(1)在甲图装置中,若 A 为镁片,B为铝片,电解质溶液为NaOH溶液,电流计的指针应向_______偏转。
(2)一根金属丝两端分别放在图乙的两个烧杯之中,电流计指针_______(填“能”或“不能”)偏转。
(3)用一个填充琼脂和KCL饱和溶液的盐桥连接图乙的两个烧杯,电流计指针
_______(填“能”或“不能”)偏转。
总结
一、原电池的构成条件:
1、两种活泼行不同的金属(或一种非金属导体)做电极,一般的活泼电极为负
极。
2、电极材料均插入电解质溶液且形成闭合回路。
3、氧化还原反应能自发进行,一般是负极能与电解质溶液中的成分反应。
例2.把铝、镁和稀硫酸设计为原电池;铝、镁和氢氧化钠设计为原电池,分析原
电池的正负极材料;把铜、铁和浓硝酸设计为原电池呢?
二、电极判断
1、电极材料:一般是活泼金属做负极,有时还要看电解质溶液的性质,谁更容
易和电解质溶液的成分反应,谁就是负极材料。
负极发生失电子的氧化反应。
正极发生得电子的还原反应。
2、电流和电子的流向:电流经外电路由正极流向负极,电子则由负极经外电流
流向正极
3.溶液中的离子移动方向:阳离子移向正极,阴离子移向负极。
