亮氨酸氨基肽酶测定试剂盒(L-亮氨酸-p-硝基苯胺底物法)产品技术要求baiding
土壤亮氨酸氨基肽酶(S-LAP)活性检测试剂盒说明书 微量法

土壤亮氨酸氨基肽酶(S-LAP)活性检测试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4025规格:100T/48S产品内容:试剂一:液体30mL×1瓶,4℃保存;试剂二:粉剂×1瓶,4℃避光保存;临用前加入3mL丙酮溶解。
产品说明:S-LAP是一类能水解肽链N-末端为亮氨酸的酶,由土壤微生物分泌。
S-LAP活性变化与机体某些病理状态密切相关。
S-LAP分解L-亮氨酸对硝基苯胺生成对硝基苯胺,后者在405nm有最大吸收峰,通过测定吸光值升高速率来计算S-LAP活性。
自备实验用品及仪器:天平、离心机、可见分光光度计/酶标仪、微量玻璃比色皿/96孔板、甲苯、丙酮、30目筛(或更小)。
操作步骤:一、样本处理土样自然风干,过30-50目筛。
二、测定步骤1、分光光度计/酶标仪预热30min以上,波长调至405nm,蒸馏水调零。
2、加样表:测定管对照管土样(g)0.030.03甲苯(μL)1515震荡混匀,室温静置15min。
试剂一(μL)255255试剂二(μL)30-30℃水浴反应1h后立刻煮沸5min。
流水冷却至室温。
试剂二(μL)-3014000g常温离心10min,取200μL上清于405nm处测定吸光值,分别记为A测定管、A对照管,计算ΔA=A测定管-A对照顾管。
三、酶活计算公式(1)按微量比色皿计算:酶活性定义:每克土壤每分钟生成1nmol对硝基苯胺为一个酶活力单位。
S-LAP活性(U/g)=△A÷(ε×d)×109×V反总÷W÷T=0.507×△A÷W。
ε:对硝基苯胺摩尔消光系数:9.87×103L/mol/cm;d:比色皿光径,1cm;V反总:反应总体积,300μL=3×10-4L;W:土样质量,g;T:反应时间,60min;109:单位换算系数,1mol=109nmol。
氨(AMM)测定试剂盒(谷氨酸脱氢酶法)产品技术要求sainuopu

氨(AMM)测定试剂盒(谷氨酸脱氢酶法)适用范围:用于体外定量测定人体血清中氨的含量。
1.1 试剂盒包装规格试剂:1×20ml;2×60ml;3×40ml;4×60ml;4×400ml;2×30ml。
校准品(选配):1×1ml;1×3ml。
质控品(选配):1×1ml;1×3ml。
1.2 试剂盒主要组成成分2.1 外观试剂:无色至淡黄色澄清液体。
校准品:无色至淡黄色澄清液体。
质控品:无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、340nm波长、1cm光径条件下,试剂空白吸光度应不小于1.0。
2.4 分析灵敏度测定浓度为88μmol/L样本时,吸光度变化值(ΔA)应在(0.02,0.2)范围内。
2.5 线性范围在(0,350)μmol/L线性范围内,线性相关系数r不小于0.996。
在(100,350)μmol/L范围内的线性相对偏差不大于±10%;测定结果(0,100]μmol/L时线性绝对偏差不大于±10μmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
2.8 准确度回收试验:回收率应在85%~115%之间。
2.9质控品赋值有效性测定结果在靶值范围内。
2.10 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至企业工作校准品。
2.11 稳定性效期稳定性:试剂盒在2℃~8℃下有效期为12个月,取失效期的试剂盒进行检验,试验结果满足2.1、2.3、2.4、2.5、2.6、2.8、2.9的要求。
丙氨酸氨基转移酶测定试剂盒(丙氨酸底物法)产品技术要求lepu

丙氨酸氨基转移酶测定试剂盒(丙氨酸底物法)适用范围:用于体外定量测定人血清中丙氨酸氨基转移酶的活性。
1.1 规格试剂1:3×60 mL,试剂2:1×45 mL;试剂1:1×60 mL,试剂2:1×20 mL;试剂1:1×60 mL,试剂2:1×12 mL;试剂1:4×60 mL,试剂2:4×15 mL;试剂1:2×40 mL,试剂2:2×10 mL;试剂1:3×28 mL,试剂2:3×7 mL;试剂1: 1×4L,试剂2: 1×1L;试剂1: 2×4L,试剂2: 1×2L。
1.2 主要组成成分试剂1主要组分:试剂2主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1:无色或淡黄色透明溶液;试剂2:无色或淡黄色透明溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白2.3.1 试剂空白吸光度应不小于1.0(波长340nm,光径1cm)。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率(△A/min)应不大于0.004。
2.4 分析灵敏度测试100U/L的被测物时,吸光度变化率(ΔA/min)应不低于0.0025。
2.5 准确度用参考物质(GBW09177)定值的血清测定,实测值与标示值的偏差不超过±12.0%。
2.6 重复性批内变异系数(CV)应不大于5%。
2.7 线性2.7.1在[0.5,800]U/L区间内,线性相关系数r应不低于0.9900;2.7.2[0.5,96)U/L区间内,线性绝对偏差应不超过±11.52U/L;[96,800]U/L 区间内,线性相对偏差应不超过±12%。
2.8 批间差批间差应不大于10%。
2.9 稳定性取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,检测结果应符合2.2、2.3、2.4、2.5、2.6、2.7的要求。
亮氨酸氨基肽酶在肝病中的变化探讨

【 e w rs Lui i pp ds;ae s i p i d e e K y od 】ec e m n et a Ptn t h ac i a n a o i e i t w h e t s s
亮氨 酸氨 基肽 酶 (ee em i ppiaeL P 是 广泛 分 布 于各 组 织 中 , 1ui nn et s A ) n o d 由( 2显示 )在 不 同 临床 类 型 的 肝 病 患 者 中 ,A 表 , L P活 性 和 阳性 率 依 尤 以肝胆 、 含量 丰 富的一 种蛋 白水解 酶 , 胰 为探 讨其 在 各种 肝 病诊 治 中 的意 照 : 性黄 疸性 肝炎 、 性活 动性肝 炎 、 急 慢 肝硬 化 、 原发 性肝 癌 顺序 显著 增 高 ( P 义 , 选择 了 17例该 病患 者作 为研 究对 象 , 我们 5 观察 其病 变及 治疗 过程 中血 < . 1 其 以原发 性 肝 癌 增 高 幅 度 最大 , 性 率 最 高 , 诊 断 敏 感 性 达 0 O )尤 , 阳 其 8 5 。 9. % 清 L P的活 性变 化 , 探讨 I A 旨在 AP对肝病 患 者的诊 治价 值 。 1 对 象与方 法 . 23 经过疗 后 的肝 病 患 者患病 期 与康 复 期 或 者稳 定 期血 清 L P检 测 . A 见 ) 11 对象 : . 观察组 :3 例各类肝病患者来 自我院20 17 03年 1 2月至 20 结果 比较 ( 表 3 。 06 年l 0月期 间住 院患 者 , 9 例 , 4 男 1 女 6例 , 均年 龄 3. ±1 . 。包 括 急 平 5 1 35岁 表 3 肝病 患 者患病 期 与康复期 或者 稳定 期血 清 L P检测 结果 比较 A
c e c la alz r o ln o n tr g a sy meh d . ee td t ea tvt fs F m P i 3 a e t w t e ai ie s n o  ̄e i 3 h at yc nr l. h mia n y e ni u smo i i sa t o s wed tce c ii o a LA 1 7 p t n s h h p tcds a ea d c mp d w t 9 e l o tos c on h y e n i i h h
γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)产品技术要求zenmeixikema

γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)适用范围:用于体外定量检测人血清中γ-谷氨酰基转移酶的活性。
1.1规格a) 试剂1:2×40ml,试剂2:2×10ml;b) 试剂1:2×80ml,试剂2:2×20ml;c) 试剂1:4×60ml,试剂2:4×15ml;d) 试剂1:2×60ml,试剂2:2×15ml;e) 试剂1:2×72ml,试剂2:2×18ml;f) 试剂1:12×16ml,试剂2:12×4ml;g) 试剂1:2×400ml,试剂2:2×100ml;h) 试剂1:8×60ml,试剂2:2×60ml;i) 试剂1:3×80ml,试剂2:3×20ml;j) 试剂1:1×40ml,试剂2:1×10ml;k) 试剂1:4×40ml,试剂2:4×10ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂1应为无色或淡黄色透明溶液;试剂2应为淡黄色溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1 试剂空白吸光度在405nm处测定试剂空白吸光度,应<0.8。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率(△A/min)应≤0.005。
2.4 分析灵敏度测定浓度为50U/L的样品,吸光度变化率(△A/min)应不低于0.012。
2.5 线性2.5.1在[5,450]U/L范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度(50,450]U/L的样品,相对偏差应不超过±10%;测试浓度[5,50]U/L的样品,绝对偏差应不超过±5U/L。
2.6 重复性2.6.1 批内重复性变异系数(CV)应不超过5%。
γ-谷氨酰基转移酶(GGT)测定试剂盒(GCANA底物法)产品技术要求科美

γ-谷氨酰基转移酶(GGT)测定试剂盒(GCANA底物法)适用范围:本试剂盒用于体外定量测定人血清中的γ-谷氨酰基转移酶(GGT)的活性。
1.1包装规格1.2主要组成成分试剂1主要组分:双甘肽125mmol/L 试剂2主要组分:L-γ-谷氨酰-3-羧基-对硝基苯胺14mmol/L2.1外观2.1.1试剂1应为无色或淡黄色透明溶液,无混浊,无未溶解物。
2.1.2试剂2应为无色或淡黄色透明溶液,无混浊,无未溶解物。
2.2装量液体试剂的净含量应不少于标示值。
2.3试剂空白2.3.1试剂空白吸光度:GGT试剂盒在波长395~415nm处测定试剂的空白吸光度值,应不大于0.7。
2.3.2试剂空白吸光度变化率:GGT试剂盒在波长395~415nm处测定试剂的空白吸光度变化率,每分钟的变化值应不大于0.005。
2.4分析灵敏度测试50U/L的γ-谷氨酰基转移酶时,吸光度变化率应不小于0.01。
2.5准确度测定国家标准物质GBW(E)090283,相对偏差应不超过15%。
2.6精密度2.6.1重复性重复测试(50±5)U/L的样本,所得结果的变异系数CV应不大于5%;2.6.2批间差测试(50±5)U/L的样本,所得结果的批间相对极差应不大于10%。
2.7线性范围GGT试剂盒在(10,450)U/L范围内,线性相关系数(r)应不小于0.990;在(10,50]U/L区间内,线性绝对偏差应不超过±5U/L;在(50,450)U/L区间内,线性相对偏差应不超过±10%。
2.8稳定性原包装的试剂盒在2℃~8℃避光保存,有效期为12个月。
在GGT试剂盒有效期满后2个月内,分别检测2.1、2.3、2.4、2.5、2.6.1、2.7项,结果应符合各项目的要求。
γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)产品技术要求lepu

γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)适用范围:用于体外定量测定人血清中的γ-谷氨酰基转移酶的活性。
1.1 规格试剂盒是由试剂1和试剂2组成的液体双试剂。
规格及装量见表1。
表1 规格及装量1.2主要组成成分试剂1主要组分:试剂2主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1:无色或淡黄色透明溶液;试剂2:淡黄色或黄色溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白2.3.1试剂空白吸光度在405nm处测定试剂空白吸光度,应≤1.5。
2.3.2试剂空白吸光度变化率在37℃、405nm波长、1cm光径条件下,用生理盐水作为样品加入试剂测试时,试剂空白吸光度变化率△A/min应不大于0.005。
2.4 分析灵敏度测试50U/L的被测物时,吸光度变化率(ΔA/min)应不低于0.0015。
2.5 准确度用参考物质(GBW09177)对试剂(盒)进行测试,相对偏差不超过±10%。
2.6 重复性用血清样品或质控样品重复测试所得结果的变异系数(CV)应不大于5%。
2.7 线性2.7.1测试血清样本在[3,1200]U/L(37℃)区间内,线性相关系数r应不小于0.990;2.7.2 [3,50]U/L区间内,线性绝对偏差应不超过±5U/L;(50,1200]U/L区间内,线性相对偏差应不超过±10%。
2.8 批间差试剂(盒)批间相对极差应不大于10%。
2.9 稳定性取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,检测结果应符合2.2、2.3、2.4、2.5、2.6、2.7的要求。
体外诊断试剂-产品临床意义化验产品临床意义

医学体外诊断试剂---产品临床意义1.D-二聚体测定试剂盒(D-Dimer)2.纤维蛋白(原)降解产物测定试剂盒(FDP)13.抗凝血酶III测定试剂盒(AT-III)4.纤维蛋白溶酶原测定试剂盒(S-PLG)5.凝血酶原时间测定试剂盒(PT)6.活化部分凝血活酶时间测定试剂盒(APTT)37.凝血酶时间测定试剂盒(TT)8.纤维蛋白原测定试剂盒(FIB)9.a2纤溶酶抑制物测定试剂盒(S-APL)10.铜兰蛋白(CP)11.总胆汁酸(TBA )12.前白蛋白(PA)13.腺苷脱氨酶(ADA )14.5 ‘ -核苷酸酶(5 ‘-NT)15.胆碱酯酶(CHE )16.a-L岩藻糖苷酶(AFU)17.甘胆酸(CG )18.亮氨酸氨基肽酶(LAP)19.总胆红素(TBIL)20.直接胆红素(DBIL)21.丙氨酸氨基转移酶(ALT)22.天门冬氨酸氨基转移酶(AST)23.天冬氨酸氨基转移酶线粒体同工酶(ASTm )124.碱性磷酸酶(ALP)25.Y -谷氨酰氨基转移酶(GGT )26.总蛋白(TP)27.白蛋白(ALB)28.胱抑素 C (Cysc)29.视黄醇结合蛋白(RBP )30.0 2微球蛋白(0 2MG )31.a1微球蛋白测定试剂盒(a1-MG )32.N-乙酰-0-D-M基葡萄糖苷酶(NAG )33.肌酐(CR )34.尿酸(UA)35.尿素氮(BUN )36.尿总蛋白(UTP )37.尿微量白蛋白(MALB)38.纤维蛋白(原)降解产物(FDP )39.同型半胱氨酸(HCY)40.游离脂肪酸(NEFA)41.血管紧张素转化酶(ACE )42.超敏C反应蛋白(HS-CRP)43.甘油三酯(TG )44.总胆固醇(TCH)45.高密度脂蛋白胆固醇(HDL-C)46.低密度脂蛋白胆固醇(LDL-C)47.载脂蛋白 AI(ApoAI)48.载脂蛋白B(ApoB)49.载脂蛋白E( ApoE)50.脂蛋白(a)(LP(a))51.肌红蛋白(Mb)52.肌钙蛋白I(cTn I)53.肌酸激酶同工酶(CKMB )54.肌酸激酶(CK)55.乳酸脱氢酶(LDH)56.a-羟丁酸脱氢酶(HBDH )57.葡萄糖(GLU )58.糖化血清蛋白(GSP )59.糖化血红蛋白(HBAIC)60.糖化白蛋白(GA )61.0-羟丁酸(0-DH)62.乳酸(Lac)63.丙酮酸(PYR)64.a-淀粉酶(a-AMY )65.脂肪酶(LIP)66.钙离子(Ca)67.镁离子(Mg )68.无机磷(P)69.二氧化碳(Co2 )70.钾离子(K)71.钠离子(Na )72.氯离子(CI)73.锌离子(Zn)74.铁离子(Fe)75.抗链球菌溶血素O(ASO )76.类风湿因子(RF)77.C-反应蛋白(CRP)78.铁蛋白(Ferr)79.转铁蛋白(Tf)80.免疫球蛋白G (IgG)81.补体C3(C3)82.B 因子(BF)83.al-酸性糖蛋白(a 1-AG )84.al-抗胰蛋白酶(a1-AT)85.尿a2巨球蛋白(Ua2-MG )86,唾液酸(SIA)87.超氧化物歧化酶(SOD )尿液蛋白临床意义体外诊断试剂产品临床意义1.D-二聚体测定试剂盒(D-Dimer)方法学:乳胶增强免疫比浊法参考值:血浆:01.0mg/L线性范围:0.520mg/LD-二聚体是在血液凝固与纤溶系统中,由于凝固第十三因子的作用,安定的交联纤维蛋白被纤溶酶分解的FDP的一种,血液中存在YY/DXD、YD/DY、DD/E、DD复合体等各种分子类的D-二聚体。
γ—谷氨酰基转移酶测定试剂盒(GCANA底物法)产品技术要求danda
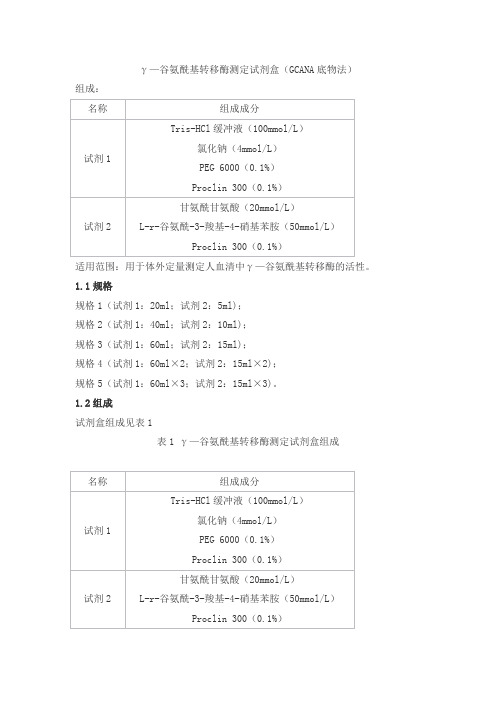
γ—谷氨酰基转移酶测定试剂盒(GCANA底物法)组成:适用范围:用于体外定量测定人血清中γ—谷氨酰基转移酶的活性。
1.1规格规格1(试剂1:20ml;试剂2:5ml);规格2(试剂1:40ml;试剂2:10ml);规格3(试剂1:60ml;试剂2:15ml);规格4(试剂1:60ml×2;试剂2:15ml×2);规格5(试剂1:60ml×3;试剂2:15ml×3)。
1.2组成试剂盒组成见表1表1 γ—谷氨酰基转移酶测定试剂盒组成2. 性能指标2.1外观试剂盒外观应整洁,液体无渗漏,文字符号标识清晰;试剂1为无色透明液体,不得有沉淀和絮状物;试剂2为淡黄色透明液体,不得有沉淀和絮状物。
2.2装量每瓶不少于标示值。
2.3试剂空白吸光度用指定的空白样品测试试剂(盒),在光径1cm下,在405nm处测定试剂空白吸光度 A≤1.2,空白吸光度变化率ΔA/min≤0.005。
2.4分析灵敏度试剂测定50U/L被测物,吸光度变化率△A/min≥0.005。
2.5线性范围2.5.1在[10,450]U/L内,相关系数R≥0.990。
2.5.2在 [10,50]U/L内,线性绝对偏差不超过±5U/L;(50,450] U/L内,线性相对偏差不超过±10%。
2.6精密度2.6.1 重复性重复测试(50±5)U/L的样本,所得结果的变异系数(CV%)应不大于5%。
2.6.2批间差测定(50±5)U/L样本,所得结果的批间相对极差(R)应不大于10%。
2.7准确度测定国家标准物质GBW(E)090593,相对偏差不超过±15%。
2.8效期稳定性试剂有效期为12个月,取到效期后一个月内进行检测,测定结果应符合2.3-2.6.1、2.7项要求。
亮氨酸氨肽酶测定试剂盒(L-亮氨酰-p-硝基苯胺底物法)产品技术要求丹大

亮氨酸氨肽酶测定试剂盒(L-亮氨酰-p-硝基苯胺底物法)组成:适用范围:用于体外定量测定人血清中亮氨酸氨基肽酶的活性。
规格1(试剂1:15ml;试剂2:5ml);规格2(试剂1:30ml;试剂2:10ml);规格3(试剂1:45ml;试剂2:15ml);规格4(试剂1:60ml;试剂2:20ml);规格5(试剂1:60ml×2;试剂2:20ml×2);规格6(试剂1:60ml×3;试剂2:20ml×3);试剂盒组成见表1表1 亮氨酸氨肽酶测定试剂盒组成2.1外观试剂盒外观应整洁,液体无渗漏,文字符号标识清晰;试剂1为无色透明液体,不得有沉淀和絮状物;试剂2为淡黄色液体,不得有沉淀絮状物.2.2 装量每瓶不少于标示值。
2.3试剂空白吸光度用指定的空白样品测试试剂(盒),在光径1cm下,在波长405nm处测定试剂空白吸光度A≤0.8,试剂空白吸光度变化率△A/min≤0.005。
2.4分析灵敏度试剂测定50 U/L被测物,吸光度变化率△A/min≥0.01。
2.5线性范围2.5.1在[5,200]U/L内,相关系数R≥0.990。
2.5.2在[5,50]U/L内,线性绝对偏差不超过±5U/L;(50,200] U/L内,线性相对偏差不超过±10%。
2.6精密度2.6.1重复性重复测试(20±4)U/L和(60±12)U/L的样本,所得结果的变异系数(CV%)应不大于5%。
2.6.2批间差测定(20±4)U/L样本,所得结果的批间相对极差(R)应不大于10%。
2.7准确度回收率应在85%-115%范围内。
2.8稳定性试剂有效期为12个月,取到效期后一个月内进行检测,测定结果应符合2.3-2.6.1、2.7项要求。
亮氨酸氨基肽酶说明书

亮氨酸氨基肽酶(Leucine Aminopeptidase, LAP)试剂盒说明书微量法100管/96样正式测定前务必取2-3个预期差异较大的样本做预测定测定意义:LAP是一类能水解肽链N-末端为亮氨酸的酶,广泛存在于肝、肾、胰等组织中,尤其以肝脏中含量最为丰富。
各类肝病患者因肝细胞损伤,血清LAP的活性均有不同程度的升高,因此,血清LAP活性的检测能从不同侧面反映各种肝病的发生和发展。
测定原理:LAP分解L-亮氨酰对硝基苯胺生成对硝基苯胺,后者在405nm有最大吸收峰,通过测定吸光值升高速率来计算LAP活性。
自备用品:酶标仪/可见分光光度计、台式离心机、水浴锅、可调式移液器、96孔板/微量石英比色皿、研钵、冰和蒸馏水。
试剂的组成和配制:提取液:液体100mL×1瓶,4℃保存;试剂一:液体15mL×1瓶,4℃保存;试剂二:粉剂×1瓶,-20℃保存;样本的前处理:1、细菌、细胞或组织样品的制备:细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为1000~5000:1的比例(建议2000万细菌或细胞加入1mL 提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g 4℃离心10min,取上清,置冰上待测。
组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
8000g 4℃离心10min,取上清,置冰上待测。
2、血清(浆)样品:直接检测。
LAP测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至405nm,蒸馏水调零。
2、将试剂二转移至试剂一中充分溶解(如较难溶解,可50℃水浴加热约30min促进溶解);在37℃(哺乳动物)或25℃(其它物种)水浴10min以上;用不完的试剂分装后-20℃保存,禁止反复冻融。
亮氨酸氨基肽酶检测

5
6
4
亮氨酸氨基肽酶
【临床意义】 LAP是一种蛋白酶,肝内含量很丰富。肝内外胆淤时, LAP活力显著增高,尤其在恶性胆淤时,其活力随病情进 展而持续增高。试剂对肝道梗阻及胰腺癌的诊断有价值。 肝坏疽、肝肿瘤、肝炎、乳腺癌、 肝癌、胆道癌、胰腺 癌、子宫内膜癌、卵巢癌明显增高。肝硬化、传染性肝炎 可中度增高,常为参考值的2-4倍。阻塞性黄疸明显增高, 常达参考值5倍以上,并出现在胆红素或ALP上升之前。 不像其他肝功的酶,只能检测血液样本,LAP还可以检测 尿液。在一些病例中可以检测尿液中LAP的变化,而不必 采血。亮氨酸氨基肽酶(LAP)LAP在人体各组织中广泛存 在,在毒性物质或疾病影响到富含LAP的近端小管时,尿 LAP活性最高。肾小球基底膜通透性增高、肾小管上皮细 胞损害、药物致中毒性肾损害和肾肿瘤时LAP增高。肿瘤 治疗后尿LAP增高提示肿瘤复发。对各种肾脏病例进行分 析,发现LAP阳性率最高。
1
亮氨酸氨基肽酶
LAP是一种蛋白酶,LAP广泛分布于人体各组织,以 肝、胆、肾、小肠以及子宫肌层内含量最多。肝内外胆淤 时,LAP活力显著增高,尤其在恶性胆淤时,其活力随病 情进展而持续增高。对肝道梗阻及胰腺癌的诊断有价值。 【检测方法】 一般采用L-Leucine-p-nitroanilide作为底物通过 LAP水解,通过检测P-nitroaniline来测定LAP的活性,此 方法在六十年代即为推荐方法。 【原理】 L-亮氨酸-p-硝基苯胺被标本中的LAP分解,游离出 L-亮氨酸-p-硝基胺,在405nm处检测吸光度变化率,测 得LAP活性值。
肌红蛋白质控品产品技术要求zhongshengbeikong

亮氨酸氨基肽酶测定试剂盒(L-亮氨酰-P-硝基苯胺底物法)适用范围:本产品用于体外定量测定人血清或血浆中亮氨酸氨肽酶的浓度。
1.1规格液体双剂型试剂1(R1):60mL×4,试剂2(R2):30mL×2;试剂1(R1):60mL×2,试剂2(R2):15mL×2;试剂1(R1):50mL×4,试剂2(R2):25mL×2;试剂1(R1):24mL×2,试剂2(R2):12mL×1;选配质控品:冻干粉型(2个水平):5mL×2。
1.2规格划分说明根据净含量、复溶体积划分规格。
1.3主要组成成分试剂盒由试剂1(R1)液体、试剂2(R2)液体和选配质控品冻干粉组成。
1.3.1 试剂1(R1)液体:磷酸缓冲液100mmol/L1.3.2 试剂2(R2)液体:L-亮氨酰-P-硝基苯胺 20mmol/L1.3.3 质控品冻干粉:人血清水平1:15 U/L~70U/L;水平2:20 U/L~350U/L(每批定值)。
2.1 外观试剂盒中各组件的外观应满足:a) 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;b) 试剂2(R2)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;c) 质控品应为白色或淡黄色冻干粉,复溶后应为无色或浅黄色溶液,无混浊,无未溶解物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度和试剂空白吸光度变化率在波长405nm(400nm~420nm)(光径1cm)处,试剂空白吸光度(A)应≤1.0000,试剂空白吸光度变化率(△A/min)的绝对值≤0.0100。
2.4准确度测定亮氨酸氨基肽酶纯品,回收率在80%~120%范围内。
2.5 分析灵敏度对应于浓度为100U/L的亮氨酸氨基肽酶所引起的吸光度变化率(△A/min)的绝对值应在0.005~0.080的范围内。
γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)产品技术要求shouyi

γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)适用范围:本试剂用于体外定量测定人血清中γ-谷氨酰基转移酶的活性。
1.1产品规格试剂1:3×80ml,试剂2:3×20ml;试剂1:4×60ml,试剂2:4×15ml;试剂1:6×40ml,试剂2:3×20ml;试剂1:2×80ml,试剂2:2×20ml 1.2产品组成成分试剂1:Tris缓冲液100mmol/L,甘氨酰甘氨酸150mmol/L。
试剂2:γ-谷氨酰-3-羧基-4硝基苯胺 5.0mmol/L。
2.1 外观试剂1为无色透明溶液,试剂2为略带黄色透明溶液。
2.2 装量液体试剂的净含量应不少于标示值。
2.3 试剂空白2.3.1试剂空白吸光度A≤0.70(光径1.0cm,405nm波长)。
2.3.2 试剂空白吸光度变化率ΔA/5min≤0.01。
2.4分析灵敏度测定93.8U/L被测物,吸光度变化率在0.0278/min~0.057/min范围内。
2.5 准确度相对偏差在±13%范围内。
2.6 精密度2.6.1 重复性变异系数CV≤5%。
2.6.2 批间差批间相对极差≤6%。
2.7 线性区间a)(0,500]U/L(37℃)。
在规定的线性区间内,测定值与样本浓度值的相关系数(r)应不低于0.990。
b)(0,80]U/L区间内,线性绝对偏差应不超过±8U/L;(80,500]U/L 区间内,线性相对偏差应不超过±10%。
2.8稳定性原装试剂2~8℃避光保存,有效期12个月,有效期满后两个月内测定结果应符合2.3、2.4、2.5、2.6.1、2.7的要求。
γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)产品技术要求beiken
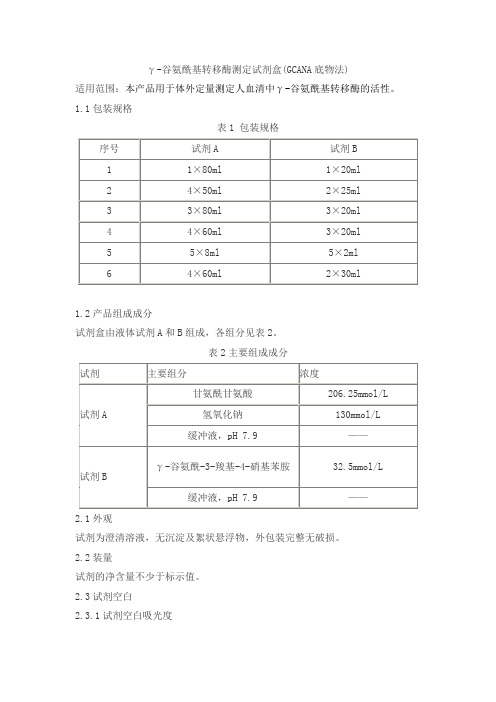
γ-谷氨酰基转移酶测定试剂盒(GCANA底物法)适用范围:本产品用于体外定量测定人血清中γ-谷氨酰基转移酶的活性。
1.1包装规格表1 包装规格1.2产品组成成分试剂盒由液体试剂A和B组成,各组分见表2。
表2主要组成成分2.1外观试剂为澄清溶液,无沉淀及絮状悬浮物,外包装完整无破损。
2.2装量试剂的净含量不少于标示值。
2.3试剂空白2.3.1试剂空白吸光度用生理盐水作为样品,按照试剂说明书的规定在37℃、405nm的波长、1cm光径条件下测试时,测定吸光度值不大于1.000。
2.3.2 试剂空白吸光度变化率用生理盐水作为样品,按照试剂说明书的规定在37℃、405nm的波长、1cm光径条件下测试时,引起的吸光度变化率△A/min应不大于0.005。
2.4 分析灵敏度测试一定浓度的γ-谷氨酰基转移酶,50U/L的γ-谷氨酰基转移酶引起的吸光度变化值ΔA/min应不小于0.025。
2.5 线性区间本产品的线性范围在[10,450]U/L(37℃)区间内:a) 线性相关系数|r|应不小于0.990;b) 在[10,50]U/L区间内,绝对偏差应不超过±5U/L;在(50,450]U/L区间内,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性:用质控品重复测试所得结果的变异系数CV应不大于5%。
2.6.2批间差:用同一水平浓度的质控品分别测试3个不同批号的试剂盒,其相对偏差不大于10%。
2.7准确度测试标准物质(编号:GBW(E)090593、GBW(E)090283),所得准确度相对偏差B不超过±15%。
2.8 稳定性:试剂盒贮存在2℃~8℃条件下,有效期为18个月。
产品在有效期末测试2.3、2.4、2.5、2.6.1、2.7,结果符合各项要求。
γ—谷氨酰基转移酶(GGT)测定试剂(盒)(GCANA底物法)产品技术要求新产业

2.性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物。
2.2装量
试剂装量的装量应按表1,液体装量的最大允许负偏差应为5%。
2.3试剂空白
2.3.1试剂空白吸光度
用试剂(盒)测试空白样本,在37 ℃±0.1 ℃ 、405 nm 波长、1 cm 光径条件下,试剂空白吸光度应≤0.400 Abs。
2.3.2试剂空白吸光度变化率
用试剂(盒)测试空白样本,在37℃ 0.1℃,405 nm 波长、1 cm 光径条件下,试剂空白吸光度变化率≤0.005 Abs/min。
2.4分析灵敏度
试剂(盒)测试63 U/L 的被测物时,吸光度变化率(ΔA/min)应在0.030 Abs/min ~0.045 Abs/min 的范围内。
2.5线性区间
试剂(盒)线性在(0.00,600.00] U/L区间内:
a) 线性相关系数r≥0.990;
b) (0.00,50.00] U/L 区间内,线性绝对偏差应在±5.00 U/L 范围内;(50.00,600.00] U/L
区间内,线性相对偏差应在±10%范围内。
2.6精密度
2.6.1重复性
试剂(盒)测试活性在(50±5)U/L 范围内的样本时,变异系数CV≤4.0%。
2.6.2批间差
试剂(盒)测试活性在(50±5)U/L 范围内的样本时,相对极差R≤6.0%。
2.7准确度
测可溯源至有证参考物质的校准品,相对偏差 B 在±10%范围内。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
亮氨酸氨基肽酶测定试剂盒(L-亮氨酸-p-硝基苯胺底物法)适用范围:用于体外定量测定人血清中的亮氨酸氨肽酶的活性。
1.1规格
1.2组成
2.1 外观
2.1.1试剂1:无色液体,无浑浊,无不溶物。
2.1.2试剂2:无色至淡黄色液体。
2.1.3包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量
液体试剂的净含量不低于标示体积。
2.3 试剂空白
2.3.1试剂空白吸光度
试剂空白吸光度≤0.3 。
2.3.2试剂空白吸光度变化率
试剂空白吸光度变化率(ΔA/分)≤0.002。
2.4 分析灵敏度
样本浓度为50 U/L时,ΔA/分≥0.010。
2.5 线性区间
在[14,300]U/L范围内,线性相关系数r≥0.990,测试浓度在[14,50]U/L 时,绝对偏差不超过±5U/L,测试浓度在(50,300]U/L时,相对偏差不超过±10%。
2.6 精密度
2.6.1 批內精密度
用高、中、低3个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于6%。
2.6.2批间差
用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度
回收率在85%-115%范围内。
2.8 稳定性
原包装试剂盒在2℃~8℃避光保存下有效期为12个月,有效期满后3个月内测试,应满足2.3、2.4、2.5、2.6.1和2.7的要求。
