各国药典比较
美国药典、欧洲药典、日本药典最新介绍

内容简介
共5卷,第1、2卷主要为药品各论,第3卷为膳食 补充剂各论,第4、5卷主要为通则(包括测试方 法及通用原则等)。共有各种测试方法178项和通 用信息168项(如离子色谱、拉曼等),其中测试 方法依次分为微生物方法6项(如无菌)、生物方 法25项(如活性和效价测定等)、化学方法69项 (一般鉴别试验1项、有机生物碱色谱鉴定以及限 度和含量测定等68项)、物理方法78项(如灰分、 pH、泄露率等);
内容简介
美国药典正文药品名录分别按法定药名字母顺序 排列,各药品条目大都列有药名、结构式、分子 式、CAS登记号、成分和含量说明、包装和贮藏 规格、鉴定方法、有关物质、含量测定等项目。
可根据书后所附的USP和NF的联合索引查阅本书。
欧洲药典
历史沿革
1977年出版第一版《欧洲药典》
从1980年到1996年期间,每年将增修订的项目与 新增品种出一本活页本,汇集为第二版《欧洲药 典》各分册,未经修订的仍按照第一版执行。
美国药典、欧洲药典、日本药 典最新介绍
一土三石 20200520
主要内容
➢药典简介 ➢美国药典(历史沿革、内容简介) ➢欧洲药典(历史沿革、内容简介) ➢日本药典(历史沿革、标准来保证人类和牲畜使用的药物的质量、 剂量和药物纯度和浓度标准的权威性出版物。它是在专业的,通常 是政府的权威人士的监督下进行编辑,并且是所有药物的制造、分 配和药物治疗所必须遵照的标准 。
年7月1日开始实施。
自1971年第8版起每五年更新一版,期
间会出版增补本。
内容简介
《日本药典》现行版为第17版,于2016年3月7日 颁布,目前共1卷和1增补本。
主要内容为凡例、生药通则、制剂通则、通用测 试处理及设备、各论、生药及成药、红外对照图 谱、紫外对照图谱、通用信息等,增补本主要为 增修订内容,类似中国药典。
各国药典 水分测定对比

各国药典水分测定对比水分测定是药品分析中常见的一项内容,对于各国药典而言,水分测定在药品质量评价中具有重要的意义。
本文将从美国药典(USP)、欧洲药典(Ph.Eur)和中国药典(ChP)三个主要药典的角度,对其水分测定方法进行对比分析,以便更好地理解各国药典在药品水分测定方面的不同之处。
首先,美国药典(USP)对于水分测定的要求非常严格,其水分测定方法以干燥为主,采用烘箱干燥法或卤素滴定法。
在USP中,也对于水分测定的仪器设备、试剂、标准、操作程序等做出了详细的规定,以确保水分测定的准确性和可靠性。
美国药典对于水分测定的标准限值也较为严格,以保证药品质量。
其次,欧洲药典(Ph.Eur)对于水分测定方法的要求也十分严格,其水分测定方法主要采用烘箱干燥法或特定试剂法。
在Ph.Eur中,还详细规定了水分测定的操作步骤、试剂纯度标准等,以确保水分测定的准确性和可靠性。
欧洲药典对于水分测定的标准限值也较为严格,以保证药品质量。
最后,中国药典(ChP)对于水分测定方法和标准限值也有自己的规定。
中国药典的水分测定方法主要采用烘箱干燥法或称量-干燥法,对于仪器设备、试剂、操作程序等也进行了详细规定,以确保水分测定的准确性和可靠性。
中国药典对于水分测定的标准限值也有一定的要求,以保证药品质量。
从以上对于美国药典、欧洲药典和中国药典的水分测定方法和标准限值的介绍来看,可以发现各国药典在水分测定方面存在一些差异。
虽然各国药典在水分测定方法上都采用了烘箱干燥法等传统方法,但在细节上还是有所不同,包括所采用的仪器设备、试剂、操作程序等都各有特点。
此外,各国药典对于水分测定的标准限值也略有不同,这也反映了各国对于药品质量的不同要求。
综上所述,各国药典对于水分测定的方法和标准限值都有自己的规定,这些规定的制定是为了保证药品质量的稳定和可靠。
通过对比分析,可以更好地理解各国药典在药品水分测定方面的不同之处,也有助于不同国家药品的贸易与合作。
中国、美国、欧洲药典比较

姓名:徐涛学号:14211020462 专业:中药生物技术学《中国药典》、《美国药典》、《欧洲药典》比较1、各国药典概况1.1 历史沿革《中国药典》英文名称Pharmacopoeia of The People’s Republic of China;简称Ch .P。
1950年4月,成立了第一届中国药典编纂委员会,药典委员会分设名词、化学药、制剂、植物药、生物制品、动物药、药理、剂量8个小组,第一版《中国药典》于1953年由卫生部编印发行。
1957年出版《中国药典》1953年增补本。
1953年药典共收载药品531中,其中化学药215种,植物药与油脂类65种,动物药13种,抗生素2种,生物制品25种,各类制剂211种。
1965年1月26日卫生部颁布《中国药典》1963年版(第二版)发行通知和实施办法。
本版药典收载药品1310种,分一、二部,各有凡例和有关的目录,一部收载中医常用的中药材446种和中药成方制剂197;二部收载化学药品667种。
此外,一部记载药品的“功能主治”,二部增加了药品的“作用与用途”。
1979年10月4日卫生部颁布《中国药典》1977年版(第三版),自1980年1月1日起执行。
本版药典共收载药品1925种,其中一部收载中草药材(包括少数民族药材)、中草药提取物、植物油脂以及单味药材制剂等882种,成方制剂(包括少数民族药成方)270种,共1152种;二部收载化学药品、生物制品等773种。
1985年9月出版《中国药典》1985年版(第四版),1986年4月1日起执行。
本版收载药品1489种,其中一部收载中药材、植物油脂及单味制剂506种,成方制剂207种,共713种,二部收载化学药品、生物制品等776种。
1990年12月3日卫生部颁布《中国药典》1990年版(第五版),自1991年7月1日起执行。
1990年版的第一、第二增补本先后于1992、1993年出版,英文版于1993年7月出版。
各国药典更新周期和特点比较

各国药典更新周期和特点⽐较药典是⼀个国家记载药品标准和规格的法典,⼀般由国家药典委员会编纂、国家药品监督管理机构批准并颁布实施。
⽽国际性药典则由公认的国际组织或者有关国家协商编订。
各个国家或者地区药典更新周期不同,同时也有不同的特点,本⽂对其进⾏⼀个总结和对⽐。
中国药典(CP):⼤家都⽐较熟悉。
/cms/home/发⾏历史和最新版本《中华⼈民共和国药典》(下称《中国药典》) 是中国药典委员会编制完成。
当前更新周期为每五年出版更新⼀次,⽬前最新版本为2015年版中国药典,也是新中国成⽴以来第⼗版药典。
中国药典的特点2015年版《中国药典》分四部,收载品种共计5608个,⼀部中药收载品种总数2598个,其中新增品种440个,修订品种517个,不收载品种7个;⼆部化学药收载品种总数2603个,其中新增品种492个,修订品种415个,不收载品种28个;三部⽣物制品收载品种总数137个,其中新增品种13个,修订品种105个;新增⽣物制品通则1个、⽣物制品总论3个;不收载品种6个;四部收载通则(附录)总数317个,其中整合和修订⼀部、⼆部、三部制剂通则38个,检测⽅法附录278个,新增检测⽅法18个、指导原则15个。
收载辅料品种总数270个,其中新增137个,修订97个,不收载2个(表1) 。
美国药典/国家处⽅集(USP/NF)U.S. Pharmacopeia / National Formulary:Pharmacopeia/发⾏历史和最新版本由美国政府所属的美国药典委员会(The United States Pharmacopeial Convention)编辑出版。
USP于1820年出第⼀版,1950年以后每5年出⼀次修订版,⼀直到2002年的USP25。
从2002年开始,以后每⼀年出版,到2017年11⽉已出⾄第41版。
NF于1883年出第⼀版,1980年15版起并⼊USP,但仍分两部分,前⾯为USP,后⾯为NF,于是出版了第⼀部USP20-NF15合订本。
各国药典包装贮藏条件比较

严封的容器,保护内容物,不受外来液体、固体或蒸汽的影响,避免物品的损失,避免风化、潮解、或挥发,并且可以重新密封。
熔封或严封
将容器熔封或用适宜的材料严封,以防止空气或水分的侵入并防止污染。
严封
将容器严封,以防止空气或其它气体进入
N.A
冷冻
-25~-10℃
冷冻
低于-15℃
N.A
冷处
2~10℃
冷处
2~8℃,仓储与运输允许在0~15℃浮动,但平均动力温度不得超过8℃
冷藏
2~8℃
冷处
1~15℃
阴凉处
不超过20℃
凉处
8~15℃
冷处或凉处
8~15℃
N.A
凉暗处
避光并不超过20℃
N.A
N.A
常温
10~30℃
室温
20~25℃
在药房、医院和仓库中允许在15~30℃范围浮动,但平均动力温度不得超过25℃,40℃不得超过24小时。
室温
15~25℃
室温
1~30℃
N.A
温暖处
30~40℃
N.A
标准温度
20℃
过热
高于40℃
一般温度
15~25℃
干燥处
室温下,平均相对湿度不超过40%RH,允许偶尔达到45%RH。
微温
30~40℃
药典贮藏条件比较
中国药典(Ch.P)
美国药典(USP)
欧洲药典(EP)
日本药局方(JP)
遮光
不透光的容器包装
未规定贮藏温度,按常温贮藏。
遮光
不透光的容器包装
未规定贮藏温度,按室温贮藏。
N.A
N.A
密闭
将容器密闭,防止尘土及异物进入
中国、美国、欧洲药典比较

:徐涛学号:专业:中药生物技术学《中国药典》、《美国药典》、《欧洲药典》比较1、各国药典概况1.1 历史沿革《中国药典》英文名称Pharmacopoeia of The People’s Republic of China;简称Ch .P。
1950年4月,成立了第一届中国药典编纂委员会,药典委员会分设名词、化学药、制剂、植物药、生物制品、动物药、药理、剂量8个小组,第一版《中国药典》于1953年由卫生部编印发行。
1957年出版《中国药典》1953年增补本。
1953年药典共收载药品531中,其中化学药215种,植物药与油脂类65种,动物药13种,抗生素2种,生物制品25种,各类制剂211种。
1965年1月26日卫生部颁布《中国药典》1963年版(第二版)发行通知和实施办法。
本版药典收载药品1310种,分一、二部,各有凡例和有关的目录,一部收载中医常用的中药材446种和中药成方制剂197;二部收载化学药品667种。
此外,一部记载药品的“功能主治”,二部增加了药品的“作用与用途”。
1979年10月4日卫生部颁布《中国药典》1977年版(第三版),自1980年1月1日起执行。
本版药典共收载药品1925种,其中一部收载中草药材(包括少数民族药材)、中草药提取物、植物油脂以及单味药材制剂等882种,成方制剂(包括少数民族药成方)270种,共1152种;二部收载化学药品、生物制品等773种。
1985年9月出版《中国药典》1985年版(第四版),1986年4月1日起执行。
本版收载药品1489种,其中一部收载中药材、植物油脂及单味制剂506种,成方制剂207种,共713种,二部收载化学药品、生物制品等776种。
1990年12月3日卫生部颁布《中国药典》1990年版(第五版),自1991年7月1日起执行。
1990年版的第一、第二增补本先后于1992、1993年出版,英文版于1993年7月出版。
本版共收载药品1751种,一部收载784种,其中中药材、植物油脂等509种,中药成方及单味制剂275种;二部收载化学制品、生物制品等967种。
甘草四国药典比较

甘草四国药典比较班级:51 学号:1045114 姓名:陈多清一、质量标准比较1.中国药典(CHP2010)来源:本品为豆科植物甘草Radix Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza in flataBat.或光果甘草Glycyrrhiza glabra L.的干燥根及根茎。
春、秋二季采挖,除去须根,晒干。
性状:1)根呈圆柱形,长25~100cm,直径0.6~3.5cm。
外皮松紧不一。
表面红棕色或灰棕色,具显著的纵皱纹、沟纹、皮孔及稀疏的细根痕。
质坚实,断面略显纤维性,黄白色,粉性,形成层环明显,射线放射状,有的有裂隙。
根茎呈圆柱形,表面有芽痕,断面中部有髓。
气微,味甜而特殊。
2)胀果甘草根及根茎木质粗壮,有的分枝,外皮粗糙,多灰棕色或灰褐色。
质坚硬,木质纤维多,粉性小。
根茎不定芽多而粗大。
3)光果甘草根及根茎质地较坚实,有的分枝,外皮不粗糙,多灰棕色,皮孔细而不明显。
鉴别:1)本品横切面:木栓层为数列棕色细胞。
栓内层较窄。
韧皮部射线宽广,多弯曲,常现裂隙;纤维多成束,非木化或微木化,周围薄壁细胞常含草酸钙方晶;筛管群常因压缩而变形。
束内形成层明显。
木质部射线宽3~5列细胞;导管较多,直径约至160μm;木纤维成束,周围薄壁细胞亦含草酸钙方晶。
根中心无髓;根茎中心有髓粉末淡棕黄色。
纤维成束,直径8~14μm,壁厚,微木化,周围薄壁细胞含草酸钙方晶,形成晶纤维。
草酸钙方晶多见。
具缘纹孔导管较大,稀有网纹导管。
木栓细胞红棕色,多角形,微木化。
2)取本品粉末1g,加乙醚40ml,加热回流1小时,滤过,药渣加甲醇30ml,加热回流1小时,滤过,滤液蒸干,残渣加水40ml使溶解,用正丁醇提取3次,每次20ml,合并正丁醇液,用水洗涤3次,蒸干,残渣加甲醇5ml使溶解,作为供试品溶液。
另取甘草对照药材1g,同法制成对照药材溶液。
再取甘草酸铵对照品,加甲醇制成每1ml含2mg的溶液,作为对照品溶液。
中国、美国、欧洲药典比较

姓名:徐涛学号:14211020462 专业:中药生物技术学《中国药典》、《美国药典》、《欧洲药典》比较1、各国药典概况1.1 历史沿革《中国药典》英文名称Pharmacopoeia of The People’s Republic of China;简称Ch .P。
1950年4月,成立了第一届中国药典编纂委员会,药典委员会分设名词、化学药、制剂、植物药、生物制品、动物药、药理、剂量8个小组,第一版《中国药典》于1953年由卫生部编印发行。
1957年出版《中国药典》1953年增补本。
1953年药典共收载药品531中,其中化学药215种,植物药与油脂类65种,动物药13种,抗生素2种,生物制品25种,各类制剂211种。
1965年1月26日卫生部颁布《中国药典》1963年版(第二版)发行通知和实施办法。
本版药典收载药品1310种,分一、二部,各有凡例和有关的目录,一部收载中医常用的中药材446种和中药成方制剂197;二部收载化学药品667种。
此外,一部记载药品的“功能主治”,二部增加了药品的“作用与用途”。
1979年10月4日卫生部颁布《中国药典》1977年版(第三版),自1980年1月1日起执行。
本版药典共收载药品1925种,其中一部收载中草药材(包括少数民族药材)、中草药提取物、植物油脂以及单味药材制剂等882种,成方制剂(包括少数民族药成方)270种,共1152种;二部收载化学药品、生物制品等773种。
1985年9月出版《中国药典》1985年版(第四版),1986年4月1日起执行。
本版收载药品1489种,其中一部收载中药材、植物油脂及单味制剂506种,成方制剂207种,共713种,二部收载化学药品、生物制品等776种。
1990年12月3日卫生部颁布《中国药典》1990年版(第五版),自1991年7月1日起执行。
1990年版的第一、第二增补本先后于1992、1993年出版,英文版于1993年7月出版。
各国药典比较ppt课件

英国药典
• 版本简介
英国 The Stationery Office出版社在 2001年五月出版发行的《英国药典 (2001)》(British Pharmacopoeia 2001) 的最新版本。收录有2760篇医药专论,其 中1305篇出自英国本土;其余1455篇套录 自欧洲药典(European Pharmacopiea) (第三版)。
内容基本介绍
• 英国药典是英国制药标准的重要来源。各
条目均以药品名称字母顺序排列,内容包 括药品性质、制法、血产品、免疫产品、 电磁药品制法及外科材料等部分。英国药 典书后附有全部内容关键词索引。不仅为 读者提供了药用和成药配方标准以及公式 配药标准,而且也向读者展示了许多明确 分类并可参照的欧洲药典专著。英国药典 出版周期不定,最新的版本为2004年的第 21版。
日本药典
• 版本简介
由日本药局方编辑委员会编纂,日本厚 生省颁布执行。分两部出版,第一部收载 原料药及其基础制剂,第二部主要收载生 药,家庭药制剂和制剂原料 。2005年11月 22日,日本厚生劳动省制定了日本药典第 15版,废除日本药典第14版。最新版本 JP15拟定生效日期为2006年4月1日。
各国药典比较
基本介绍 • 药典是通过建立国家技术标准来保证人 类和牲畜使用的药物的质量、剂量和药物纯 度和浓度标准的权威性出版物。它是在专业 的,通常是政府的权威人士的监督下进行编 辑,并且是所有药物的制造、分配和药物治 疗所必须遵照的标准 。 • 目前常用的药典标准有英国药典(BP)、 欧洲药典(EP)、美国药典(USP)、德国 药典(DAP)、日本药典(JP)、中国药典 (CP)。
该药典囊括了几千篇颇有价值医学专 题论文,其中有几百篇是医学新论。它不 仅为读者提供了药用和成药配方标准以及 公式配药标准,而且也向读者展示了所有 明确分类并可参照的欧洲药典专著。对于 制药厂和化学工业、政府管理者、医学研 究院及学习制药的学生都是一部必不可少 的工具书。
各国药典微生物方法对比

各国药典微生物方法对比本篇文章旨在比较各国药典中微生物检测方法的不同之处。
微生物检测对于保证药品的质量和安全至关重要,各国药典都提供了相应的指导和标准。
然而,由于各国的文化、法律和技术差异,各国的药典在微生物检测方法上存在一定的差异。
以下将以中括号内的内容为主题,详细介绍各国药典中微生物方法对比。
[美国药典(USP)微生物方法]美国药典(USP)是全球最主要的药典之一,其微生物检测方法有着广泛的应用。
USP推荐的微生物方法主要基于美国食品药品监督管理局(FDA)的要求,主要包括细菌计数、限度测试和特定微生物检测。
其方法的特点在于简单易行、结果可靠且易于验证。
其中,细菌计数方法主要采用菲斯特计数法或冷凝液计数法。
而在限度测试方面,则主要采用的方法是逐级稀释、涂布法和培养法。
USP还明确规定了一些特定微生物的检测方法,如大肠菌群、铜绿假单胞菌和金黄色葡萄球菌等,其检测方法主要依赖于PCR技术和传统的培养法。
[欧洲药典(Ph. Eur.)微生物方法]欧洲药典(Ph. Eur.)是欧洲地区药典的统一标准,其微生物方法与美国药典存在一定的差异。
Ph. Eur.对微生物检测也有着详细的规定,包括细菌计数、限度测试和特定微生物检测。
在细菌计数方面,Ph. Eur.主要采用薄膜过滤法或蔗糖凝胶法。
而在限度测试方面,Ph. Eur.则主要采用稀释平板法、滚珠法和过滤膜方法。
与USP 不同的是,Ph. Eur.也明确规定了一些特定微生物的检测方法,如霉菌和酵母菌等。
这些检测方法涵盖了PCR技术、酶联免疫吸附试验(ELISA)和传统的培养法。
[中国药典(ChP)微生物方法]中国药典(ChP)是中国主要的药典标准,其微生物方法也存在一定的特点。
ChP的微生物检测主要分为总菌落计数、限度测试和特定微生物检测。
与美欧药典不同的是,ChP对微生物检测方法的规定相对较为简洁。
在细菌计数方面,ChP主要采用的方法有薄膜过滤法、落下法和滚珠法等。
各国药典比较

ChP、USP、Ph.Eur.中药/天然药物质量标准比较及评述—以芦荟为例by14211第一部分中美欧药典简介1.中国药典《中华人民共和国药典》,简称《中国药典》。
是由国家药典委员会(原名卫生部药典委员会成立于1950年),根据《中华人民共和国药品管理法》的规定,负责组织编纂《中华人民共和国药典》及制定、修订国家药品标准,是法定的国家药品标准。
由国家食品药品监督管理部门批准颁布实施。
《中华人民共和国药典》(简称《中国药典》)2010年版,分一部、二部和三部,收载品种总计4567种,其中新增1386种。
药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2165种,其中新增1019种(包括439个饮片标准)、修订634种;药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等,品种共计2271种,其中新增330种、修订1500种;药典三部收载生物制品,品种共计131种,其中新增37种、修订94种。
2010版药典收载的附录亦有变化,其中药典一部新增14个、修订47个;药典二部新增15个、修订69个;药典三部新增18个、修订39个。
一、二、三部共同采用的附录分别在各部中予以收载,并尽可能做到统一协调、求同存异。
中国药典包括凡例、正文及附录,是药品研制、生产、经营、使用和监督管理等均应遵循的法定依据。
所有国家药品标准应当符合中国药典凡例及附录的相关要求。
作为我国保证药品质量的法典,本版药典在保持科学性、先进性、规范性和权威性的基础上,着力解决制约药品质量与安全的突出问题,着力提高药品标准质量控制水平,充分借鉴了国际先进技术和经验,客观反映了中国当前医药工业、临床用药及检验技术的水平,必将在提高药品质量过程中起到积极而重要的作用,并将进一步扩大和提升我国药典在国际上的积极影响。
2.美国药典《美国药典/国家处方集》U.S. Pharmacopeia / National Formulary(简称USP/NF)。
各国药典溶解性EP USP ChP差异比较
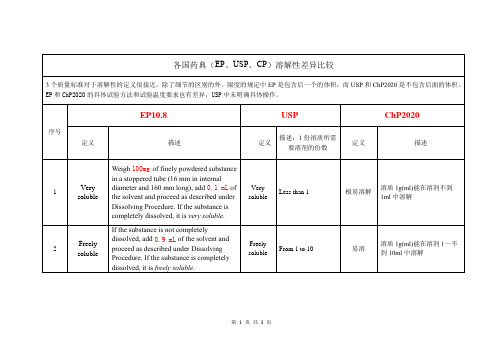
From 10 to 30
溶解
溶质1g(ml)能在溶剂10~不到30ml中溶解
4
Sparingly soluble
If the substance is not completely dissolved, add7.0 mLof the solvent and proceed as described under Dissolving Procedure. If the substance is completely dissolved, it issparingly soluble.
Very soluble
Less than 1
极易溶解
溶质1g(ml)能在溶剂不到1ml中溶解
2
Freely soluble
If the substance is not completely dissolved, add0.9 mLof the solvent and proceed as described under Dissolving Procedure. If the substance is completely dissolved, it isfreely soluble.
Practically insoluble, or insoluble
10,000 and over
几乎不溶或不溶
溶质1g(ml)在溶剂10000ml中不能完全y for 1 min and place in a constant temperature device, maintained at a temperature of 25.0 ± 0.5 °C for 15 min. If the substance is not completely dissolved, repeat the shaking for 1 min and place the tube in the constant temperature device for 15 min.
各国药典 水分测定对比

各国药典水分测定对比
药典是各个国家药物质量标准的指南,包括药物的质量要求、测试方法和标准等。
水分测定是药典中常用的一项测试,对药物的水分含量进行定量分析。
不同国家的药典对于水分测定的要求可能会有些不同,下面是一些国家药典的水分测定对比:
1. 美国药典(USP):USP对于水分测定的要求较为严格,提
供了几种方法进行水分测定,包括干燥法、卡尔费伦法和气相色谱法等。
此外,USP还要求对于不同药物形式(例如固体、液体、纳米颗粒等)的水分测定方法具体进行规定。
2. 欧洲药典(Ph. Eur.):Ph. Eur.对于水分测定的要求较为详细,提供了多种常用的方法,涵盖了固体、液体、气体和半固体样品的水分测定。
其中,几种常用的方法包括干燥法、库仑法和卡尔费伦法等。
3. 英国药典(BP):BP对于水分测定的要求与Ph. Eur.类似,提供了多种可供选择的方法,包括干燥法和库仑法等。
BP还
要求药物的水分含量必须符合规定的限制。
4. 中国药典(ChP):ChP也对水分测定进行了规定,采用干
燥法、卡尔费伦法和库仑法等方法进行测定。
此外,对于常见的不同药物形式,ChP还有专门的水分测定方法进行规定。
需要注意的是,不同药物形式对水分测定方法的要求会有所不
同,药典中会对不同药物形式的水分测定提供具体的规定和方法。
此外,药物的水分测定方法也可以根据具体需求进行选择,需要参考药典的相关规定和评估实际情况选择适用的方法。
中、日、美、英四国药典有关药品微生物限度标准的比较

四国药典有关药品微生物限度标准的比较[日期:2005-2-21] 来源:作者:胡敏[1] 胡昌勤* 刘文英2 [字体:大中小]四国药典有关药品微生物限度标准的比较微生物限度规定的作用,是为药品生产提供一个标准或指导,以确保药品使用的安全。
各国药典标准分为强制性的和非强制性的可达到的限度标准,这些指标正确、有效地规范了药品生产、检定和监督的程序。
药品要能反映不引起生物降解物和没有药源性污染的微生物存在是必要的,严格控制条件致病菌及致病菌。
一、CP、USP、BP、JP的微生物限度要求的特点及其发展趋势⒈各国药典收载微生物限度检查法的时间不同(见表1)表1 各国药典收载微生物限度检查法的时间各国药典CP USP BP JP收载微生物限度检查法的时间1995版* 1975(19)1973---方法1988---品种**第十三改正版****1978年颁布第一个药品卫生标准;1986年颁布了修改的药品卫生标准;1989年下发药品卫生标准补充规定和说明1995年版中国药典收载微生物限度检查法(标准仅为少数剂型)**品种98版43个,其中原料药品种38个,制剂品种仅5个。
***仅有6个品种。
⒉品种不断扩大USP版本(年代)19(1975)22(1990)23(1995)24(2000)微生物限度品种数35 140 150 217**217种包括原料药品种72个(占1/3);制剂品种(占2/3)。
⒊活菌数要求各有特点活菌数(个/1g或1ml)CP BP JP USP需气菌102~3×104 102~107 102~103 10~104真菌0~102 102~105 5×10~5×102 10~103⒋控制菌的要求各有特点CP BP JP USP大肠杆菌+ b + b + b + a沙门菌+ b +a + b + a铜绿色假单胞菌+b + b + b +a金黄色葡萄球菌+b + b + b + a破伤风杆菌+ b梭菌+c肠道菌及其他某些革兰阴性杆菌+ c支原体+分枝杆菌+病毒的其他因子+活螨+ da 10g或10ml样品不得检出。
各国药典比较

各国药典比较ChP、USP、Ph.Eur.中药/天然药物质量标准比较及评述—以芦荟为例by14211第一部分中美欧药典简介1.中国药典《中华人民共和国药典》,简称《中国药典》。
是由国家药典委员会(原名卫生部药典委员会成立于1950年),根据《中华人民共和国药品管理法》的规定,负责组织编纂《中华人民共和国药典》及制定、修订国家药品标准,是法定的国家药品标准。
由国家食品药品监督管理部门批准颁布实施。
《中华人民共和国药典》(简称《中国药典》)2010年版,分一部、二部和三部,收载品种总计4567种,其中新增1386种。
药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2165种,其中新增1019种(包括439个饮片标准)、修订634种;药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等,品种共计2271种,其中新增330种、修订1500种;药典三部收载生物制品,品种共计131种,其中新增37种、修订94种。
2010版药典收载的附录亦有变化,其中药典一部新增14个、修订47个;药典二部新增15个、修订69个;药典三部新增18个、修订39个。
一、二、三部共同采用的附录分别在各部中予以收载,并尽可能做到统一协调、求同存异。
中国药典包括凡例、正文及附录,是药品研制、生产、经营、使用和监督管理等均应遵循的法定依据。
所有国家药品标准应当符合中国药典凡例及附录的相关要求。
作为我国保证药品质量的法典,本版药典在保持科学性、先进性、规范性和权威性的基础上,着力解决制约药品质量与安全的突出问题,着力提高药品标准质量控制水平,充分借鉴了国际先进技术和经验,客观反映了中国当前医药工业、临床用药及检验技术的水平,必将在提高药品质量过程中起到积极而重要的作用,并将进一步扩大和提升我国药典在国际上的积极影响。
2.美国药典《美国药典/国家处方集》U.S. Pharmacopeia / National Formulary(简称USP/NF)。
各国药典标准

各国药典标准因国家而异,但一般来说,药典标准是指药品生产、使用和检测的法定标准。
药典收载的药品标准,是国家药品标准,具有法律效力。
在中国,《中华人民共和国药典》是药品生产、使用和检测的标准,由国家药典委员会负责制定和修订。
此外,各省市也会根据当地实际情况制定相应的药典标准。
在欧洲,欧洲药典(European Pharmacopoeia,简称EP)是欧洲药品质量管理局(European Directorate for the Quality of Medicines & Healthcare,简称EDQM)制定的药品质量标准。
欧洲药典涵盖了药品的原料、辅料、剂型、方法、质量控制和包装等方面的要求。
在美国,美国药典(United States Pharmacopeia,简称USP)是由美国药典委员会(United States Pharmacopeial Convention,简称USPC)制定的药品标准。
USP涵盖了药品的原料、辅料、剂型、方法、质量控制和包装等方面的要求。
此外,其他国家也有各自的药品标准制定机构和相应的药典标准,如日本的《日本药典》(The Japanese Pharmacopoeia,简称JP)等。
需要注意的是,药典标准的制定和修订是一个不断发展和完善的过程,各国的药典标准也在不断更新和改进。
各国药典热原试验

各国药典热原试验
一、中国药典
中国药典是规定中国药品标准的国家法典,其中包括对药品的各项要求和指标。
在热原试验方面,中国药典采用了家兔法进行热原试验。
该方法是通过注射一定剂量的药物,观察注射后家兔体温变化来判定药物中是否存在热原物质。
如果家兔在注射后出现体温异常升高,则表明药物中含有热原物质。
二、美国药典
美国药典是美国药品和食品的标准,其中包括对药品的各项要求和指标。
在热原试验方面,美国药典采用了家兔法和小鼠法两种方法进行热原试验。
家兔法与中国的家兔法类似,观察注射后家兔体温变化来判定药物中是否存在热原物质。
小鼠法则是通过观察注射后小鼠体温变化来进行判定。
三、欧洲药典
欧洲药典是欧洲药品质量指导委员会制定的欧洲药品质量标准,适用于整个欧洲大陆。
在热原试验方面,欧洲药典主要采用了家兔法和小鼠法进行热原试验,方法和判定标准与中国药典和美国药典类似。
四、日本药局方
日本药局方是日本药品的标准,类似于其他国家的药典。
在热原试验方面,日本药局方主要采用了家兔法进行热原试验。
该方法与中国的家兔法类似,观察注射后家兔体温变化来判定药物中是否存在热原物质。
总的来说,各国药典都十分重视药品中的热原物质问题,并制定了相应的标准和试验方法来确保药品的安全性和有效性。
虽然各国药典在具体操作上略有不同,但总体上都是通过观察动物体温变化来进行热原试验,判定药物中是否存在热原物质。
中国,美国,欧洲药典比较

姓名:徐涛学号:14211020462 专业:中药生物技术学《中国药典》、《美国药典》、《欧洲药典》比较1、各国药典概况1.1 历史沿革《中国药典》英文名称Pharmacopoeia of The People’s Republic of China;简称Ch .P。
1950年4月,成立了第一届中国药典编纂委员会,药典委员会分设名词、化学药、制剂、植物药、生物制品、动物药、药理、剂量8个小组,第一版《中国药典》于1953年由卫生部编印发行。
1957年出版《中国药典》1953年增补本。
1953年药典共收载药品531中,其中化学药215种,植物药与油脂类65种,动物药13种,抗生素2种,生物制品25种,各类制剂211种。
1965年1月26日卫生部颁布《中国药典》1963年版(第二版)发行通知和实施办法。
本版药典收载药品1310种,分一、二部,各有凡例和有关的目录,一部收载中医常用的中药材446种和中药成方制剂197;二部收载化学药品667种。
此外,一部记载药品的“功能主治”,二部增加了药品的“作用与用途”。
1979年10月4日卫生部颁布《中国药典》1977年版(第三版),自1980年1月1日起执行。
本版药典共收载药品1925种,其中一部收载中草药材(包括少数民族药材)、中草药提取物、植物油脂以及单味药材制剂等882种,成方制剂(包括少数民族药成方)270种,共1152种;二部收载化学药品、生物制品等773种。
1985年9月出版《中国药典》1985年版(第四版),1986年4月1日起执行。
本版收载药品1489种,其中一部收载中药材、植物油脂及单味制剂506种,成方制剂207种,共713种,二部收载化学药品、生物制品等776种。
1990年12月3日卫生部颁布《中国药典》1990年版(第五版),自1991年7月1日起执行。
1990年版的第一、第二增补本先后于1992、1993年出版,英文版于1993年7月出版。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
国际药典(Ph.Int) 国际药典(Ph.Int)
• 基本介绍
由联合国世界卫生组织主持编订。第一版于1951和 由联合国世界卫生组织主持编订。第一版于1951和 1955年分两卷用英、法、西班牙文出版,于1959出版增 1955年分两卷用英、法、西班牙文出版,于1959出版增 补本。第二版于1967年用英、法、俄、西班牙文出版。现 补本。第二版于1967年用英、法、俄、西班牙文出版。现 行版为第三版,于1979、1981、1988年、1994、2003分 行版为第三版,于1979、1981、1988年、1994、2003分 5卷出版,第1卷收载42项分析测试方法。第2、3两卷共 卷出版,第1卷收载42项分析测试方法。第2 收载药品383种。第4 收载药品383种。第4卷收载有关试验、方法的信息,以及 药品原料、赋形剂的一般要求和质量说明,以及剂型。第 5卷收载制剂通则以及药品原料和片剂的质量标准,这实 际上将涵盖目录上的有机合成药物以及一些抗疟疾药物及 其最广泛应用剂型的所有各论。
内容简介
• 美国药典正文药品名录分别按法定药名字
母顺序排列,各药品条目大都列有药名、 结构式、分子式、CAS登记号、成分和含量 结构式、分子式、CAS登记号、成分和含量 说明、包装和贮藏规格、鉴定方法、干燥 说明、包装和贮藏规格、鉴定方法、干燥 失重、炽灼残渣、检测方法等常规项目, 失重、炽灼残渣、检测方法等常规项目, 正文之后还有对各种药品进行测试的方法 和要求的通用章节及对各种药物的一般要 求的通则。可根据书后所附的USP和NF的 求的通则。可根据书后所附的USP和NF的 联合索引查阅本书。
图书版本
• • • • • •
最新版本: 最新版本: USP 33-NF 28重新发行版: 3328重新发行版 重新发行版: 2010年10月 日生效。 2010年10月1日生效。 增补版1 2010年 月出版,2010年10月 增补版1于2010年4月出版,2010年10月1日生效。 增补版2 2010年 月出版,2011年 增补版2于2010年6月出版,2011年1月1日生效。 U.S. Pharmacopeia / National Formulary《美国 Formulary《 药典/国家处方集》(简称USP/NF)。由美国政 药典/国家处方集》(简称USP/NF)。由美国政 府所属的美国药典委员会(The 府所属的美国药典委员会(The United States Pharmacopeial Convention)编辑出版。 Convention)编辑出版。
该药典囊括了几千篇颇有价值医学专 题论文,其中有几百篇是医学新论。它不 仅为读者提供了药用和成药配方标准以及 公式配药标准,而且也向读者展示了所有 明确分类并可参照的欧洲药典专著。对于 制药厂和化学工业、政府管理者、医学研 究院及学习制药的学生都是一部必不可少 的工具书第一版《欧洲药典》 1977年出版第一版《欧洲药典》 • 从1980年到1996年期间,每年将增修订的项目与新增品 1980年到1996年期间,每年将增修订的项目与新增品 • •
在广泛吸取国内外先进技术和实验方法 的基础上,附录内容与目前国际对药品质量 控制的方法和技术基本一致;在力争实现 “使用安全、疗效可靠、工艺合理、质量可 控、标准完善”原则的前提下。收载的品种 也基本反映了我国临床用药的实际情况。此 外,在体例、文字、单位和符号等方面也均 加以规范。
2010年版《中国药典》 2005年 2010年版《中国药典》在2005年 版的基础上,进行了大幅度的标准 修订和新增收品种标准的工作。 2010年版《中国药典》 2010年版《中国药典》注重质量可 控性和药品安全性内容的增加和提 高,注重基础性、系统性、规范性 研究,尤其在薄弱的中药材和中药 饮片标准的修订提高方面有所突破 创新。
日本药典
• 版本简介
由日本药局方编辑委员会编纂,日本厚 生省颁布执行。分两部出版,第一部收载 原料药及其基础制剂,第二部主要收载生 药,家庭药制剂和制剂原料 。2005年11月 2005年11月 22日,日本厚生劳动省制定了日本药典第 22日,日本厚生劳动省制定了日本药典第 15版,废除日本药典第14版。最新版本 15版,废除日本药典第14版。最新版本 JP15拟定生效日期为2006年 JP15拟定生效日期为2006年4月1日。
种出一本活页本,汇集为第二版《欧洲药典》 种出一本活页本,汇集为第二版《欧洲药典》各分册,未 经修订的仍按照第一版执行。 1997年出版第三版《欧洲药典》 1997年出版第三版《欧洲药典》合订本,并在随后的每一 年出版一部增补本,由于欧洲一体化及国际间药品标准协 调工作不断发展,增修订的内容显著增多。 2001年 月,第四版《欧洲药典》出版,并于2002年 2001年7月,第四版《欧洲药典》出版,并于2002年1月 生效。第四版《欧洲药典》除了主册之外,还出版了8 生效。第四版《欧洲药典》除了主册之外,还出版了8个 增补版。
相关介绍
• 《日本药典》(The Japanese 日本药典》
Pharmacopoeia)由日本药局方编集委员会 Pharmacopoeia)由日本药局方编集委员会 编篡,由厚生省颁布执行。分两部出版, 第一部收载原料药及其基础制剂,第二部 主要收载生药,家庭药制剂和制剂原料, 收载品种化学药(一部)859种、天然药物、 收载品种化学药(一部)859种、天然药物、 生物制品、辅料(二部)469种。 生物制品、辅料(二部)469种。
谢谢!
周晓婷
• 2004年7月,第五版《欧洲药典》出版,即 2004年 月,第五版《欧洲药典》
EP5.0,EP5.0于2005年 EP5.0,EP5.0于2005年1月生效 • 2007年7月,第六版《欧洲药典》出版,即 2007年 月,第六版《欧洲药典》 EP6.0,EP6.0于2008年 EP6.0,EP6.0于2008年1月生效 • 新版《欧洲药典》第六版在第五版的基础上对 新版《欧洲药典》 所有内容进行了重新修订,并于2008年 所有内容进行了重新修订,并于2008年1月开 始生效,其后每三个月出版一部增补本,截至 到2010年7月已经出版8个增补版。 2010年 月已经出版8 • 欧洲药典7为欧洲药典最新版本 ,2010年7月 欧洲药典7 2010年 出版; 2011年 出版; 2011年1月生效 。
美国药典
• 历史版本
U.S. Pharmacopeia / National Formulary《美 Formulary《 国药典/国家处方集》(简称USP/NF)。由美国 国药典/国家处方集》(简称USP/NF)。由美国 政府所属的美国药典委员会(The 政府所属的美国药典委员会(The United States Pharmacopeial Convention)编辑出版。USP于 Convention)编辑出版。USP于 1820年出第一版,1950年以后每5 1820年出第一版,1950年以后每5年出一次修订 版,到2005年已出至第29版。NF1883年第一版, 版,到2005年已出至第29版。NF1883年第一版, 1980年15版起并入USP,但仍分两部分,前面为 1980年15版起并入USP,但仍分两部分,前面为 USP,后面为NF USP,后面为NF 。
内容简介
•
《 欧洲药典》的基本组成有凡例、通用 欧洲药典》 分析方法(包括一般鉴别实验,一般检查 方法,常用物理、化学测定法,常用含量 测定法,生物检查和生物分析,生药学方 法),容器和材料、试剂、正文和索引等。 《 欧洲药典》正文品种的内容包括:品名、 欧洲药典》 分子结构式、CA登录号、化学名称及含量 分子结构式、CA登录号、化学名称及含量 限度、性状、鉴别、检查、含量测定、贮 藏、可能的杂质结构等。
中国药典
一、概况 《中华人民共和国药典》(简称《中国药 中华人民共和国药典》 简称《 典》),按照第八届药典委员会确定的设计方 ),按照第八届药典委员会确定的设计方 案和要求,经过两年多的时间编制完成。 经第八届药典委员会执行委员会审议通过, 并经国家食品药品监督管理局批准颁布实 并经国家食品药品监督管理局批准颁布实 施,为建国以来的第八版药典。
各国药典的比较
基本介绍 • 药典是通过建立国家技术标准来保证人 类和牲畜使用的药物的质量、剂量和药物纯 度和浓度标准的权威性出版物。它是在专业 的,通常是政府的权威人士的监督下进行编 辑,并且是所有药物的制造、分配和药物治 疗所必须遵照的标准 。 • 目前常用的药典标准有英国药典(BP)、 目前常用的药典标准有英国药典(BP)、 欧洲药典(EP)、美国药典(USP)、德国 欧洲药典(EP)、美国药典(USP)、德国 药典(DAP)、日本药典(JP)、中国药典 药典(DAP)、日本药典(JP)、中国药典 (CP)。 CP)。
内容基本介绍
• 英国药典是英国制药标准的重要来源。各
条目均以药品名称字母顺序排列,内容包 括药品性质、制法、血产品、免疫产品、 电磁药品制法及外科材料等部分。英国药 典书后附有全部内容关键词索引。不仅为 读者提供了药用和成药配方标准以及公式 配药标准,而且也向读者展示了许多明确 分类并可参照的欧洲药典专著。英国药典 出版周期不定,最新的版本为2004年的第 出版周期不定,最新的版本为2004年的第 21版。 21版。
英国药典
• 版本简介
英国 The Stationery Office出版社在 Office出版社在 2001年五月出版发行的《 2001年五月出版发行的《英国药典 (2001)》(British Pharmacopoeia 2001) 2001) 2001) 的最新版本。收录有2760篇医药专论,其 的最新版本。收录有2760篇医药专论,其 中1305篇出自英国本土;其余1455篇套录 1305篇出自英国本土;其余1455篇套录 自欧洲药典(European Pharmacopiea) 自欧洲药典(European Pharmacopiea) (第三版)。
