29常见氧化剂和还原剂及其产物
常见氧化剂还原剂和催化剂的应用
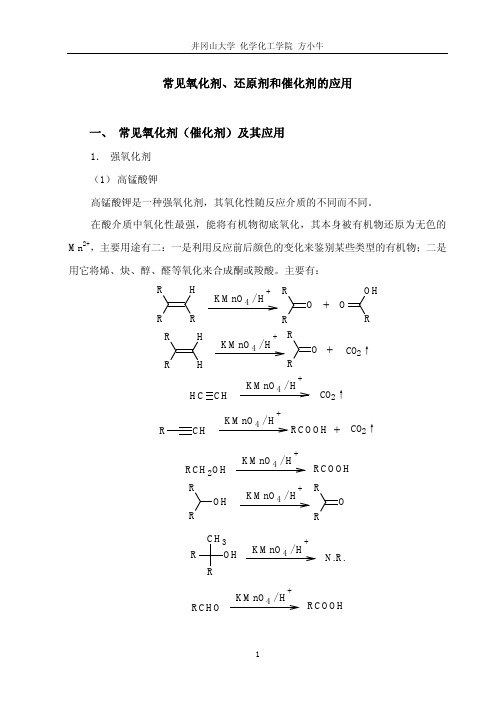
常见氧化剂、还原剂和催化剂的应用一、 常见氧化剂(催化剂)及其应用1. 强氧化剂 (1) 高锰酸钾高锰酸钾是一种强氧化剂,其氧化性随反应介质的不同而不同。
在酸介质中氧化性最强,能将有机物彻底氧化,其本身被有机物还原为无色的Mn 2+,主要用途有二:一是利用反应前后颜色的变化来鉴别某些类型的有机物;二是用它将烯、炔、醇、醛等氧化来合成酮或羧酸。
主要有:R H KMnO 4 / H+OROR OH+ R RHH KMnO 4 / H++O RRCO 2↑KMnO 4 / H+C H CH CO 2↑KMnO 4 / H++CHRCO 2↑RCOOHKMnO 4 / H+RCOOHRCH 2OHOH RRKMnO 4 / H+O RROHRR CH 3KMnO 4 / H+N.R.KMnO 4 / H+RCOOH RCHOKMnO 4 / H +N.R.RCOR' KMnO 4 / H+CO 2↑COOH COOH高锰酸钾在中性或碱性介质中的氧化性稍弱,在控制条件下可以将 π 键氧化而不断裂 σ 键,主要用于从烯烃制备邻二醇(反应的立体化学特征是顺式加成)。
四氧化锇的作用与此类似。
OO MnO(2) 重铬酸钾K 2Cr 2O 7 / H 2SO 4溶液的氧化性能与KMnO 4 / H +相似,用途也相似。
除用以氧化醇、醛等含氧衍生物外,主要用于将芳环氧化成醌。
如:O OCrO 3-H 2SO 4CrO 3-H 2SO 4OOK 2Cr 2O 7 / H 2SO 4RCH 2OHRCHO 边氧化边蒸馏(3) 稀硝酸稀硝酸具有强氧化性,它可以将芳环的侧链氧化和将醇氧化,如:Ar-CH 3Ar-COOH 稀HNO 3稀HNO 3OHO△HO 2C-(CH 2)4-CO 2H2. 温和氧化剂 (1) 二氧化锰MnO 2-H 2SO 4是一种中强氧化剂,可将甲苯氧化成苯甲醛:C 6H 5-CH 3C 6H 5-CHOMnO 2-H 2SO 4活性MnO 2则是一种温和的氧化剂,能将烯丙式醇氧化成醛而不影响C=C 双键:CH 3CH 3CH 3CHOMnO 2石油醚(2) 三氧化铬-吡啶络合物三氧化铬-吡啶络合物(CrO 3-C 5H 5N )又称为Sarett 试剂,是一种温和的氧化剂,能将醇(尤其是烯丙式的)氧化成为醛,而不影响其它基团。
常见的氧化剂和还原剂

常见的氧化剂和还原剂在化学反应中,氧化剂和还原剂是两种常见的重要概念。
氧化剂可以接受电子,使得其他物质失去电子而被氧化,还原剂则相反,它们可以提供电子,使得其他物质接受电子而被还原。
在本文中,我们将介绍一些常见的氧化剂和还原剂。
氧化剂氧气氧气是最常见的氧化剂之一,它可以参与许多氧化反应。
例如,在可燃物燃烧时,氧气就是典型的氧化剂。
氧气也可以氧化一些金属和非金属物质,使它们失去电子。
由于氧气极易与其它物质反应,加热或提高压力可以促进其反应活性。
高锰酸钾高锰酸钾(KMnO4)是一种强氧化剂,可以参与许多氧化反应,常用于工业和化学实验室中。
它可以氧化有机物和无机物,包括金属离子和离子化合物。
在有机化学中,高锰酸钾也被用于氧化剂。
双氧水双氧水(H2O2)是一种弱氧化剂,在化学反应中被广泛使用。
它可以将一些有机物转化为更易于处理的化合物,并且常用于消毒和漂白。
双氧水也可以用作氧化铁和氧化锰的原料,以及化学合成过程中的还原剂。
还原剂金属在化学反应中,金属是最常见的还原剂之一,由于其外层电子结构的特殊性质,金属具有提供电子的能力。
铁和钢铁是在建筑和机械工程中常用的金属还原剂。
氢气氢气(H2)是一种常用的还原剂,主要是因为它极易与氧气反应,从而释放出大量的能量。
在一些化学反应中,两种反应要素之一是氧化剂和还原剂。
在某些情况下,氢气可以被用作还原剂,提供电子给其他物质。
亚硫酸盐亚硫酸盐是一类含有亚硫酸根离子(SO32-)的离子化合物。
它们可以提供电子给其他物质,从而发挥还原剂的作用。
关于亚硫酸盐作为还原剂的应用,最常见的例子是在染料、药物和食品加工工业中,其中亚硫酸盐可以被用作脱色剂和防腐剂。
氧化剂和还原剂在化学反应中起着重要作用。
常见的氧化剂包括氧气、高锰酸钾和双氧水。
而在还原剂方面,金属、氢气和亚硫酸盐是其中最常见的几种。
这些物质的化学特性使得它们可以用于许多不同类型的反应,并为化学工业和实验室提供了广泛的应用。
常见的氧化剂和还原剂

常见的氧化剂和还原剂1、常见的氧化剂:(1)活泼的非金属单质(F2、CI2、B「2、丨2、Q、Q等);①(金属活动性顺序为基准)氧气与除铂、金外的其它金属均可反应。
钾、钙、钠在空气中极易和氧气反应(Na燃烧时形成过氧化物、K燃烧生成超氧化物);钾~~锡在空气中燃烧;铅~~汞在空气中不能燃烧,但加热可以反应,如铜在空气中加热生成氧化铜。
O2 可以氧化NO SO、CO Na z SQ、KI、fS、fSQ、Nf Fg+等还原性强的物质或微粒。
H t S点燃生成SO,缓慢氧化生成S单质。
亚铁盐和亚硫酸盐溶液易被氧化,所以实验中要现配现用。
②氟、氯可以氧化所有金属。
溴、碘可以氧化除铂、金金属以外的所有金属,碘与铁生成的二价的碘化亚铁Fe"。
③Cl2可以氧化N Q S、SQ、N Q SO、H2S、I —、S2—、Br —、Fe2*、NH等物质或微粒。
产物Cl2-Cl—,氧化产物化合价升至相邻价态,I T I 2(。
3 。
④B「2可以氧化Na^S、SQ、Na^SQ、H2S、I—、S2-、Fe2+、等还原性物质或微粒。
产物Br? T Br—⑤I 2可以氧化N^S、SQ、N Q SQ、H2S、S2—、等还原性强的物质或微粒。
产物I 2T I —CI2, Br2 , I 2 , Fe 3+在水溶液中都能把SQ2-氧化成SQ2-(2)元素处于高价时的含氧酸(硝酸、浓硫酸)①HNO可以氧化:S2―、Hi、H2S、SQ2-、HSQ-、SQ、I ―Fe2+> 一些金属单质、非金属单质等。
②浓硫酸可以氧化:H2S、HI、HBr、一些金属单质、非金属单质等。
⑶元素处于高价时盐:(KCIO3、KMnO、FeCl3)①KMn(4(H+)可以氧化:S2—、HS-、fS、SQ2 -、HSQ-、SQ、I —、Br-、Cl -、Fe2+、fQ 等。
产物KMn QH+) _ Mrf+②Fe3+可以氧化:S2-、HS-、H2S、SQ2-、HSQ—、SQ、I-、Fe、Cu Zn 等。
高考化学讲义氧化还原反(含解析)

目夺市安危阳光实验学校第三节氧化还原反应1.了解氧化还原反应的本质是电子的转移。
2.了解常见的氧化还原反应。
会判断有关概念。
(中频)3.掌握常见氧化还原反应的配平和相关计算。
(高频)氧化还原反应1.氧化还原反应有关概念和本质2.氧化还原反应与其他反应间的关系(1)与四种基本类型的关系(2)与电极反应的关系:①原电池:负极—氧化反应,正极—还原反应;②电解池:阳极—氧化反应,阴极—还原反应。
常见的氧化剂、还原剂及其产物1.常见氧化剂(1)某些活泼的非金属单质:如Cl2,一般被还原为Cl-。
(2)元素处于高价态的物质:如浓硫酸,一般被还原为SO2。
(3)过氧化物:如H2O2,一般被还原为H2O。
2.常见还原剂(1)活泼的金属单质:如Zn,一般被氧化为Zn2+。
(2)某些活泼的非金属单质:如H2,一般被氧化为H2O。
(3)元素处于低价态的物质:如CO,一般被氧化为CO2。
3.电子转移的表示方法(1)单线桥法用单线箭头从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。
如MnO2与浓盐酸反应中电子转移的方向和数目可表示为:(2)双线桥法用双线箭头按被氧化和被还原的元素分别从反应物指向生成物(同种元素),并注明得失及电子数目。
如Cl2和NaOH反应中电子转移的方向和数目可表示为:1.易误诊断(正确的打“√”,错误的打“×”)。
(1)有单质参加或有单质生成的化学反应一定是氧化还原反应( )(2)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原( )(3)某元素从游离态变为化合态,该元素可能被氧化也可能被还原( )(4)非金属阴离子只具有还原性,金属阳离子只具有氧化性( )(5)金属原子失电子越多,还原性越强( )(6)浓H2SO4具有强氧化性,SO2具有还原性,故浓H2SO4不能干燥SO2( )【答案】(1)×(2)×(3)√(4)×(5)×(6)×2.反应4HCl(浓)+MnO2=====△MnCl2+Cl2↑+2H2O中,氧化剂是________,氧化产物是________,生成1 mol Cl2时转移电子的物质的量为________,被氧化的HCl的物质的量是________。
高中化学--氧化还原反应专题

【专题一】氧化还原反应【考点突破】考点1 氧化还原反应的基本概念及其关系例如:方法点击为了方便记忆、快速解题可采用如下口诀:升失氧、降得还;剂性一致、其他相反。
(“升失氧、降得还”即反应后化合价升高的物质失电子被氧化,发生氧化反应;反应后化合价降低的物质得电子被还原,发生还原反应。
“剂性一致”即氧化剂具有氧化性,还原剂具有还原性。
“其他相反”即氧化剂被还原,发生还原反应,得还原产物;还原剂被氧化,发生氧化反应,得氧化产物。
)考点2 常见的氧化剂和还原剂(1)常见的氧化剂①非金属单质:如Cl2、O2、Br2等。
②含有高价态元素的化合物:浓H2SO4、HNO3、KMnO4、MnO2、KClO3、K2Cr2O7等。
③某些金属性较弱的高价态离子:Fe3+、Ag+、Pb4+、Cu2+等。
④过氧化物:Na2O2、H2O2等。
(2)常见的还原剂①活泼金属:K、Na、Mg、Al等。
②非金属离子及低价态化合物:S2-、H2S、I-、SO2、H2SO3、Na2SO3等。
③低价阳离子:Fe2+、Cu+等。
④非金属单质及其氢化物:H2、C、CO、NH3等。
方法点击强氧化剂与强还原剂相遇时,一般都会发生氧化还原反应。
如:H2SO4(浓)与金属、H2S、S2-、HI、I-、HBr、Br、Fe2+、P等。
Cl2与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、H2、SO2、-2SO、H2SO3等。
3HNO3与金属、H2S、S2-、HI、I-、HBr、Br-、Fe2+、P、SO2、-2SO、H2SO3等。
3O2与金属、H2S、S2-、HI、I-、Fe2+、P、Si、H2等。
考点3 氧化性或还原性强弱的比较规律1.依据反应式来判断氧化剂+还原剂氧化产物+还原产物氧化性:氧化剂>氧化产物还原性:还原剂>还原产物口诀:比什么“性”找什么剂,“产物”之“性”小于“剂”。
2.依据反应条件来判断当不同的氧化剂作用于同一还原剂时,如氧化产物价态相同,可依据反应条件的难易程度来判断。
氧化剂和还原剂(课件)

03
常见的氧化剂和还原剂
常见的氧化剂
01
02
03
04
氧气
在许多氧化反应中,氧气是最 常见的氧化剂,如燃烧反应。
高锰酸钾
高锰酸钾是一种强氧化剂,常 用于氧化还原反应实验。
硝酸
硝酸是一种强氧化剂,常用于 制备硝酸盐和氮肥。
过氧化氢
过氧化氢在特定条件下可以分 解产生氧原子,是一种强氧化
剂。
常见的还原剂
对于无法回收再利用的氧化剂和还原 剂废液,应按照实验室规定进行安全 处理,确保不对环境造成危害。
废弃物分类
将使用过的氧化剂和还原剂废液按照 实验室规定进行分类,并贴上相应的 废弃物标签。
THANKS
感谢观看
避免混合
氧化剂和还原剂不应与其他物质混合,特别是与易燃、易 爆或有毒物质混合,以防发生剧烈反应或产生有毒气体。
应急处理
如果不慎接触到氧化剂或还原剂,应立即用大量清水冲洗, 并寻求医疗帮助。如果发生火灾或爆炸,应立即撤离现场, 并采取适当的灭火措施。
实验操作注意事项
实验前准备
在进行实验前,应仔细阅读实验 指导书,了解实验步骤、操作方 法及注意事项。准备好所需的仪 器、试剂和材料,并确保实验场
消毒剂等。
02
还原剂的应用
还原剂在化工、医药、环保等领域也有广泛应用,如制备金属单质、脱
Байду номын сангаас
氧剂、催化剂等。
03
总结
氧化剂和还原剂是化学反应中常见的物质,它们在化工、医药、环保等
领域有广泛的应用。了解常见的氧化剂和还原剂以及它们的性质和反应
特点,有助于更好地应用它们解决实际问题。
04
氧化剂和还原剂的实验
高中化学知识点归纳与分类突破 专题四 氧化还原反应

专题四氧化还原反应知识点一氧化还原反应基本概念1.氧化还原反应基本概念图解2.常见氧化剂和还原剂(1)常见氧化剂及其还原产物氧化剂Cl2O2Fe3+HClO 还原产物Cl-H2O/O2-/OH-Fe2+/Fe Cl-氧化剂酸性KMnO4、K2Cr2O7浓H2SO4HNO3H2O2还原产物Mn2+、Cr3+SO2NO2/NO H2O(2)常见还原剂及其氧化产物还原剂金属单质非金属单质Fe2+H2S/S2-氧化产物金属离子非金属氧化物Fe3+S、SO2还原剂HI/I-NH3CO SO2/S O32-氧化产物I2N2、NO CO2SO3、S O42-3.电子转移的表示方法(1)双线桥法:①标变价;②画箭头;③算数目;④说变化。
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”“失”字样。
知识点二氧化还原反应的基本规律1.氧化还原反应的基本规律守恒律定义化合价升高总数与降低总数相等,实质是反应中失电子总数与得电子总数相等。
即n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值应用①直接计算参与氧化还原反应物质间的数量关系②配平氧化还原反应方程式强弱律定义氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物应用①判断某氧化还原反应中,氧化性、还原性的相对强弱②判断某氧化还原反应能否正常进行优先律定义当存在多种还原剂(氧化剂)时,氧化剂(还原剂)通常先和还原性(氧化性)最强的还原剂(氧化剂)反应应用①判断某氧化还原反应能否正常进行②可判断物质发生氧化还原反应的先后顺序如:向NaBr和NaI的混合溶液中通入Cl2,因I-的还原性强于Br-,则先发生反应:2I-+Cl2 2Cl-+I2,然后发生反应:2Br-+Cl22Cl-+Br2价态律定义有多种价态的元素,处于最高价态时只具有氧化性(如H2SO4中的S元素),处于最低价态时只具有还原性(如H2S中的S元素),处于中间价态时既有氧化性又有还原性(如SO2中的S元素)应用①判断氧化还原反应能不能发生②判断同种元素的不同物质间发生氧化还原反应时的化合价变化情况(续表)转化律定义同种元素不同价态间发生归中反应时,元素的化合价只接近而不交叉,最多达到同种价态应用如:H2S+H2SO4(浓)S↓+SO2↑+2H2O(H2S-2→S0,H2S+6O4→S+4O2);5Cl-+Cl O3-+6H+ 3Cl2↑+3H2O(Cl-1-→Cl20,Cl+5O3-→Cl02)2.物质氧化性、还原性强弱的应用判断物质氧化性、还原(1)依据反应条件来判断当不同的氧化剂作用于同一还原剂时,若氧化产物价态相同,可依据反应条件的难易程度来判断氧化剂氧化性的相对强弱。
氧化剂与还原剂课件

THANKS
感谢观看
反应速率常数与活化能的关系
01
反应速率常数
描述反应速率与反应物浓度的关 系。
02
03
活化能
关联
反应发生所需的最低能量。
反应速率常数与活化能之间存在 关联,活化能影响反应速率常数 的值。
温度对反应速率的影响
温度
01
反应环境的热力学参数。
反应速率
02
随着温度的升高,反应速率通常会加快。
原因
03
高温可以增加反应物分子的运动速度,从而增加它们之间碰撞
研究活性氧(ROS)在细胞信号转导 、免疫反应、细胞凋亡和坏死等过程 中的作用,以及寻找能够调节ROS生 成和清除的因子。
在工业生产中的应用
氧化剂与还原剂的合成
利用氧化还原反应合成各种氧化剂和 还原剂,如过氧化氢、高锰酸钾、二
氧化硫等。
燃料生产
通过氧化还原反应将烃类燃料转化为 燃料,如汽油、柴油等。
氧化还原反应平衡
在氧化还原反应中,氧化剂和还原剂的浓度会发生变化,最 终达到平衡状态。这个平衡状态取决于反应条件和反应物的 性质。
03
常见氧化剂与还原剂
常见的氧化剂
氧气
在常温下,氧气是良好的氧化剂,广泛用于 燃烧、呼吸和电池反应中。
高锰酸钾
高锰酸钾是一种强氧化剂,广泛用于消毒、 除臭和制造其他氧化剂。
催化氧化
在催化剂的作用下进行的氧化 反应。
氧化还原反应的实际应用
燃料电池
利用燃料和氧化剂之间的氧化还原反应产生电 流。
金属腐蚀
金属在接触空气、水或其他物质时,发生氧化 还原反应导致金属表面腐蚀。
环境保护
利用氧化还原反应处理废水、废气等污染物,以减少环境污染。
第08讲 氧化还原反应的概念和规律再深化(课件)-2023届高考化学二轮复习(全国通用)

氧化
金属
产物
离子
Fe2+ H2S/S2-
2SO2/SO3
Fe3+ S、SO2
SO3、SO4
2-
HI/II2
NH3
CO
N2、NO CO2
考向1
氧化还原反应的判断
[真题示例1]
下列叙述不涉及氧化还原反应的是(
A.谷物发酵酿造食醋
)
答案 B
B.小苏打用作食品膨松剂
C.含氯消毒剂用于环境消毒
D.大气中NO2参与酸雨形成
是(
)
A.可得出氧化性的强弱顺序:O2>Cu2+>S
B.Fe3+体现氧化性的反应:2Fe3++CuS === 2Fe2++Cu2++S
C.反应过程中FeCl3作催化剂
D.保持混合溶液中FeCl3、CuCl2的量不变,
34 g H2S反应时消耗O2的质量为16 g
答案 A
解析 根据反应机理图可知,H2S先与Cu2+反应生成CuS,CuS被Fe3+氧化,发生
是K2H3IO6,两者的物质的量之比为7∶1,D项正确。
[真题示例2]
KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步
反应为6I2+11KClO3+3H2O
的是(
6KH(IO3)2+5KCl+3Cl2↑。下列说法错误
)
A.产生22.4 L(标准状况)Cl2时,反应中转移10 mol eB.反应中氧化剂和还原剂的物质的量之比为11∶6
高中
化学
2023
二轮精准复习45讲
第08讲
常见的氧化剂和还原剂

常见的氧化剂和还原剂 Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998常见的氧化剂和还原剂1、常见的氧化剂:(1)活动的非金属单质(F2、Cl2、Br2、I2、O2、O3等);①氧气与除铂、金外的其它金属均可反应。
钾、钙、钠在空气中极易和氧气反应(Na燃烧时形成过氧化物、K燃烧生成超氧化物);钾―锡在空气中燃烧;铅―汞在空气中不能燃烧,但加热可以反应,如铜在空气中加热生成氧化铜。
O2可以氧化NO、SO2、CO、Na2SO3、KI、H2S、H2SO3、NH3、Fe2+ 等还原性强的物质或微粒。
H2S点燃生成SO2,缓慢氧化生成S单质。
亚铁盐和亚硫酸盐溶液易被氧化,所以实验中要现配现用。
②氟、氯可以氧化所有金属。
溴、碘可以氧化除贵金属以外的所有金属,碘与铁生成的二价的碘化亚铁。
③Cl2可以氧化Na2S、SO2、Na2SO3、 H2S 、 I―、S2―、 Br―、Fe2+、NH3等物质或微粒④Br2可以氧化Na2S、SO2、Na2SO3、H2S、I―、S2-、Fe2+、等还原性物质或微粒⑤I2可以氧化Na2S、SO2、Na2SO3、H2S 、S2―、等还原性强的物质或微粒Cl2, Br2 ,I2 ,Fe3+在水溶液中都能把SO32-氧化成SO42-(2)元素处于高价时的含氧酸(硝酸、浓硫酸)①HNO3:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe2+、一些金属单质、非金属单质等。
②浓硫酸: H2S、 HI、HBr、一些金属单质、非金属单质等。
(3)元素处于高价时盐:(KClO3、KMnO4、FeCl3)①KMnO4(H+):S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Br-、Cl-、Fe2+、H2O2等。
②Fe3+:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe、Cu、Zn等。
(4)过氧化物(H2O2、Na2O2)①H2O2:S2―、HS―、H2S、SO32-、HSO3-、SO2、I―、Fe2+(5)其它(HClO)2、常见还原剂金属单质:K、Na、Mg等;非金属单质:H2、C、Si等;低价态的化合物:CO、H2S、HI、Fe2+、NH3等。
氧化剂和还原剂

2.常见的还原剂 活泼的金属,如Na、Mg、Al、Zn、Fe等;
某些非金属单质,如C、H2 、 Si等;
某些低价态氧化物,如CO、SO2、NO等;
含低价元素的酸和其离子 ,如 H2S 、 HI 、 HBr、HCl等; 一些低价含氧酸及其盐,如H2SO3、Na2SO3 、 H2C2O4等;一些处于低价态的金属阳离子, 如Fe2+、Sn2+等。
注:氧化性、还原性的强弱取决于 物质得失电子的难易程度而与得失 电子数目的多少无关。
氧化性、还原性强弱的判断 (1)根据元素的化合价 物质中元素处于最高价态,该元素只有氧化性; 物质中元素处于最低价态,该元素只有还原性; 物质中元素处于中间价态,该元素既有氧化性 又结氧化还原反应的基本概念:
1.氧化剂: 得到电子,化合价 降低 的物质。
2.还原剂: 失去电子,化合价 升高 的物质。 3、氧化产物:发生氧化反应得到的产物。 4、还原产物:发生还原反应得到的产物。
5、氧化性和还原性: 氧化性:指 得 电子的性质或能力(物质越 容易得电子,即得电子能力越强,氧化性就越 强) 还原性:指 失 电子的性质或能力(物质越容 易失电子,即失电子能力越强,还原性就越强)
。
,
既有氧化性又有还原性的是
氧化剂和还原剂
总结氧化还原反应的基本概念:
1.氧化剂: 得到 电子,化合价 降低 的物质。
2.还原剂: 失去 电子,化合价 升高 的物质。
常见的氧化剂、还原剂
1.常见的氧化剂 活泼的非金属单质,如O2、X2 、O3等;
某些高价氧化物,如SO3、MnO2等;
高价氧化性含氧酸,如HNO3、浓H2SO4等; 高价含氧酸盐,如KMnO4、KNO3、KClO3等; 某些金属阳离子,如Ag+、Hg2+、Fe3+、Sn4+等; 还有王水、Na2O2 、H2O2等。
课件常见的氧化剂和还原剂_人教版必修一PPT课件_优秀版

2+
K2Cr2O7在反应中得到电子0.
结合常见氧化剂和还原剂及氧化还原反应的知识分析,元素处于最高价态、最低价态、中间价态时分别具有什么性质?
2+
典例3 24 mL 0.
2
物质氧化性、还原性强弱的比较
自主测试
二、氧化性和还原性
1.氧化性和还原性
(1)氧化性:氧化剂所表现出的得电子的性质。
(2)还原性:还原剂所表现出的失电子的性质。
2.氧化性、还原性和元素化合价之间的关系
三、氧化还原反应的影响
1.有利于人类生活和生产:金属的冶炼、电镀、燃料的燃烧等。
2.对人类生活和生产不利:易燃物的自燃、食物的腐败、钢铁的
于最低价,故H O既可作氧化剂,又可作还原剂。
答案:Cu
Mg Cl 、Fe 、H O
-7-
课堂篇
探究学习
探究一
探究二
探究三
氧化剂和还原剂
问题探究
1.在Fe2O3→Fe的转化中,Fe2O3是氧化剂还是还原剂?发生什么反
应?Fe是什么产物?
答案:Fe2O3是氧化剂,发生还原反应;Fe是还原产物。
2.结合常见氧化剂和还原剂及氧化还原反应的知识分析,元素处
K2Cr2O7在反应中得到电子0.
答案:氧化性:Zn2+<Fe2+<H+<Cu2+。
解析:在反应中,NaClO3中氯元素化合价降低,作氧化剂,得到电子,被还原;SO2中硫元素化合价升高,作还原剂,被氧化;同时1 mol SO2发生反
应转移2 mol电子,综上所述,正确的是A项。
氧化还原反应知识总结

学习必备欢迎下载氧化还原反应一、基本概念会利用化合价分析氧化还原反应,找出氧化反应、还原反应、氧化剂、还原剂、氧化产物、还原产物得失电子的物质1、失高氧还↓↓↓↓失去电子化合价升高发生氧化反应对应的物质是还原剂2、常见元素的化合价(单质中化合价为0价,化合物中化合价代数和为0)特殊的物质Na2O2 H2O2 O为—1价NaH H为—1价3、常见离子的书写阳离子:H+ NH4+所以金属阳离子M n+阴离子:硝酸根NO3-硫酸根SO42-碳酸根CO32-碳酸氢根HCO3-氯酸根ClO3-次氯酸根ClO-氢氧根OH-磷酸根PO43-磷酸一氢根HPO42- 磷酸二氢根H2PO4-醋酸根CH3COO-高锰酸根MnO4-氟F-氯Cl-溴Br-碘I-(氢氟酸,盐酸,氢溴酸和氢碘酸的酸根)硫离子S2-硫氢根HS- 硅酸根SiO32-亚硫酸根SO32-亚硫酸氢根HSO3-4、分析下列氧化还原反应(找出氧化反应、还原反应、氧化剂、还原剂、氧化产物、还原产物得失电子的物质)2KMnO4=K2MnO4+MnO2+O2↑2Na2O2+ 2CO2= 2Na2CO3+ O22FeCl3+Cu=2FeCl2+CuCl22FeCl3+Fe=3FeCl23Na2S+8HNO3(稀)=6NaNO3+2NO↑+3S↓ +4H2O3Na2SO3+2HNO3(稀)=3Na2SO4+2NO↑+H2OC + 2H2SO4(浓) ==CO2↑+ 2SO2↑ + 2H2O3Cu + 8HNO3(稀) == 3Cu(NO3)2+ 4H2O + 2NO↑HClO+H2O2=HCl+H2O+O2↑4HClO3+3H2S=3H2SO4+4HClFeO+4HNO3=Fe(NO3)3+NO2↑+2H2O14HCl+K2Cr2O7=2KCl+2CrCl3+3Cl2+7H2O11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO42Na+H2=2NaH二、氧化性、还原性强弱的比较方法1、依据氧化还原反应的方程式氧化剂+还原剂===还原产物+氧化产物氧化性:氧化剂>氧化产物氧化性:氧化剂>还原剂还原性:还原剂>还原产物还原性:还原剂>氧化剂2、依据金属活动性顺序K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au从左至右单质的还原性逐渐减弱K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Fe2+,Sn2+,Pb2+,(H+),Cu2+,Hg2+,Fe3+,Ag+从左至右阳离子的氧化性逐渐增强3、根据反应条件判断学习必备欢迎下载当不同氧化剂分别于同一还原剂反应时,如果氧化产物价态相同,可根据反应条件的难易来判断。
氧化剂

氧化剂:(1)定义:得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低。
(2)常见的氧化剂:①活泼非金属单质:如Cl2、Br2、O2等。
②某些高价氧化物,如SO3、MnO2等。
③氧化性含氧酸,如浓H2SO4、HNO3、HClO等④元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、K2Cr2O7、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
⑥某些金属阳离子:如Ag+、Fe3+等还原剂:(1)定义:失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高。
(2)常见的还原剂:①活泼金属单质:如Na、A1、Zn、Fe等。
②低价态的金属阳离子:如Fe2+等;③某些非金属单质:如H2、C等。
④元素(如C、S等)处于低价时的氧化物,如CO、NO、SO2等。
⑤元素(如Cl、S等)处于低化合价时的氢化物:如H2S、HCl、HI、NH3等。
⑥元素(如S、Fe等)处于低化合价时的盐或酸,如Na2SO3、H2SO3、H2C2O4、FeSO4等。
∙常见的氧化剂及对应的还原产物:∙常见的还原剂及对应的氧化产物:∙∙易错易混点:(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等(3)元素化合价的变化:①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如:遇到氧化剂,碘化钾被氧化为碘单质,溶液变蓝.(1)①在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,这是因为NaClO将KI氧化生成了I2,离子方程式为ClO-+2I-+H2O═I2+Cl-+2OH-.②在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠碱性溶液,发现蓝色逐渐消失,这是因为I2被Na2SO3还原生成了I-,离子方程式是SO32-+I2+2OH-═SO42-+2I-+H2O.③对比①和②实验所得的结果,将I2、ClO-、SO2-4按氧化性由强到弱的顺序排列为ClO->I2>SO42-.(2)今有铁片、铜片,设计实验证明以下事实并写出化学反应方程式.①浓硫酸的氧化性比稀硫酸强Cu与浓H2SO4在加热时反应而与稀H2SO4在加热时不反应;Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O.②氯化铁溶液中Fe3+的氧化性比硫酸铜溶液中的Cu2+强Cu与FeCl3溶液能反应;2FeCl3+Cu═2FeCl2+CuCl2.③铁的还原性比铜强Fe能与CuSO4溶液反应置换出Cu;Fe+CuSO4═FeSO4+Cu 常见的氧化剂和还原剂别是气体)的气味,不得尝任何药品的味道。
