化学:专题五《电化学问题研究》课件苏教版选修
苏教版高中化学选修六课件5.1《原电池》课件(2).pptx

K+迁入 Cl-迁入
实验表明: 电池的电流密度的大小与电极的表面积、极板之 间的距离和介质等因素有关; 无论何种材料制作的原电池,电池的极化作用都 是很强的,极化作用会使电极的放电反应变得迟 钝,影响电池的工作时间,而去极化剂(如高锰 酸钾、重铬酸钾和过氧化氢等氧化剂)由于有效 降低了电极的极化作用,提高了电池的放电效率。 为此设计了如下图的实验装置。
铜锌原电池
三、实验操作要点
1.装置的组装 取一块锌片(6cm×3.3cm)和一块铜片 (6cm×3.3cm),两者之间放一块海绵(厚度2cm), 用橡皮筋固定好,用导线把小灯泡(2.5V0.3A)和 锌片、铜片连接起来,插入放有50ml蒸馏水的100ml 小烧杯中,组装这样的装置多个备用。
2.催化剂的选择
向三个装置中分别加入10ml的稀硫酸,编号为甲 乙、丙,观察小灯泡是否发光。 向甲装置中加入5ml3%的双氧水,振荡溶液, 记录小灯泡发光的时间和亮度。
向乙装置中加入0.5g的重铬酸钾晶体,振荡溶液, 记录小灯泡发光的时间和亮度。
向丙装置中加入0.5g的高锰酸钾晶体,振荡溶液, 记录小灯泡发光的时间和亮度。
必修2第38页“化学能转变为电能的活动与探究”
一是电流微弱, 用灵敏检流计检测;
二是供电时间短暂, 电池的放电效率低;
三是锌极板有大量气泡, 干扰铜极板现象的观察。
(三)从实验视角看
选修3第12页“原电池的工作原理活动与探究”
克服了锌极板有大量气泡的现象 盐桥能说明内电路中离子的迁移 电流密度依然较小,不足以使小灯泡发亮
Zn-C-NaOH:小灯泡不亮,检流计偏转。
Al-C-NaOH:小灯泡不亮,两极有气泡。
四、实验注意事项
1.电解质用浓硫酸或固体氢氧化钠立即加水配制成溶 液,由于它们溶解放热,形成热的介质,加快了电 极反应。 2.如要灯泡持续发亮,不断振荡是关键。可以用电极 搅拌溶液。海绵比两极板稍长,以防碰破烧杯底。 3. 锌片和铜片先用碱液处理,再用酸液处理,然后用 4. 蒸馏水漂洗。
电化学问题研究——原电池PPT 苏教版

实验操作:
(2)一段时间后,向烧杯中加入1~2g重铬酸钾晶体(或高 锰酸钾晶体,或5~10mL6%H202溶液),振荡,观察现象。 实验现象:原电池重新放电,灯泡复明 重铬酸钾晶体或高锰酸钾晶体或双氧水的作用? 作去极化剂,降低电极极化作用。
实验操作: (3)改用Zn—C、Al—Cu为电极材料,分别与稀硫酸组合 成原电池,按照上述实验装置和操作方法进行实验,观察实 验现象。
实验现象:两者均有H2放出,灯泡发亮,但Zn—C比Al— Cu的发亮时间长。 解释:放电过程中均产生极化作用,但由于H2在不同电极上 的极化作用不同,所以发亮时间有差异。
二、燃料电池:是一种连续地将燃料和氧化剂的化学能直接转 换成电能的化学电池。
氢氧燃料电池 酸性电解质: 负极: 2H2-4e-=4H+ 正极: O2+4H++4e-=2H2O 总反应:2H2+O2=2H2O 碱性电解质 负极: 2H2-4e-+4OH-=4H2O 正极: O2+2H2O+4e-=4OH总反应: 2H2+O2=2H2O
(4)正负极的判断: 正极:较不活泼金属或电子流入的一极或发 生还原反应的一极。 负极:较活泼金属或电子流出的一极或发生 氧化还原反应的一极。 电路中电子流向:从负极流出,流入正极 电流流向:从正极到负极。
练一练:
图中所示装置属于原电池的是( C D E ).
E 请写出C原电池的电极并写出电极反应和总反应方程式
实验操作: (2)吸氧腐蚀 取一片铁片,用砂纸擦去铁锈,在铁片上滴1滴含酚 酞的食盐水,静置1~2min,观察现象。
实验现象:溶液变红。
解释:发生了吸氧腐蚀。
4、教学必须从学习者已有的经验开始。——杜威 5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳 6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立 7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清 8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁 9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚 10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基 11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。 53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。 61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。 62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。 63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。 64、每一个发奋努力的背后,必有加倍的赏赐。 65、再冷的石头,坐上三年也会暖。 66、淡了,散了,累了,原来的那个你呢? 67、我们的目的是什么?是胜利!不惜一切代价争取胜利! 68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。 69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。 70、平凡的脚步也可以走完伟大的行程。 71、胜利,是属于最坚韧的人。 72、因害怕失败而不敢放手一搏,永远不会成功。 73、只要路是对的,就不怕路远。 74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。3、上帝助自助者。 24、凡事要三思,但比三思更重要的是三思而行。 25、如果你希望成功,以恒心为良友,以经验为参谋,以小心为兄弟,以希望为哨兵。 26、没有退路的时候,正是潜力发挥最大的时候。 27、没有糟糕的事情,只有糟糕的心情。 28、不为外撼,不以物移,而后可以任天下之大事。 29、打开你的手机,收到我的祝福,忘掉所有烦恼,你会幸福每秒,对着镜子笑笑,从此开心到老,想想明天美好,相信自己最好。 30、不屈不挠的奋斗是取得胜利的唯一道路。 31、生活中若没有朋友,就像生活中没有阳光一样。 32、任何业绩的质变,都来自于量变的积累。 33、空想会想出很多绝妙的主意,但却办不成任何事情。 34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。 35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。 36、失败者任其失败,成功者创造成功。 37、世上没有绝望的处境,只有对处境绝望的人。 38、天助自助者,你要你就能。 39、我自信,故我成功;我行,我一定能行。 40、每个人都有潜在的能量,只是很容易:被习惯所掩盖,被时间所迷离,被惰性所消磨。 41、从现在开始,不要未语泪先流。 75、自己选择的路,跪着也要走完。
高中化学 专题5 电化学问题研究整合课件 苏教版选修6

甲
专题一 专题二
知识网络
专题归纳
乙
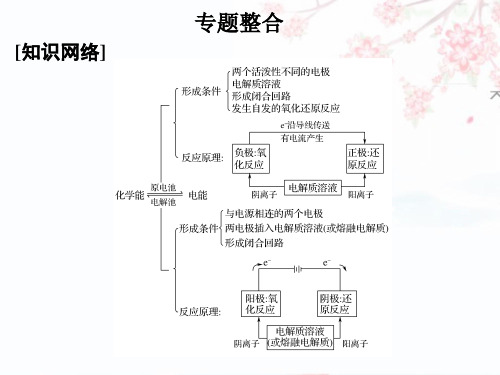
说明:①在原电池装置中,电子由负极经导线流向正极,阳离子在正极 上获得电子,通过电路中的电子和溶液中的离子的移动而形成回路,传导电 流,电子并不进入溶液也不能在溶液中迁移。
②原电池将一个完整的氧化还原反应分为两个半反应,负极发生氧化 反应,正极发生还原反应,一般将两个电极反应中得失电子的数目写为相同, 相加便得到总反应方程式。
知识网络
专题归纳
专题一 专题二
专题 2 电解池
1.电解的原理
定义
把电能转化为化学能的装置叫电解池
形成条件 两极名称 电子流向
①电源和电极 ②电解质溶液
阴极:发生还原反应的电极 阳极:发生氧化反应的电极 外电路:负极流向阴极,阳极流向正极
实例
熔融氯化钠 阳极:2Cl--2e- Cl2↑ (氧化反应) 阴极:2Na++2e- 2Na (还原反应)
专题一 专题二
知识网络
专题归纳
【例题 2】在 50 mL 0.2 mol·L-1 CuSO4 溶液中插入两个电极,通电电解 (不考虑水分蒸发),则:
(1)若两极均为铜片,电解过程中 CuSO4 溶液的浓度 大”“减小”或“不变”)
。(填“增
(2)若阳极为纯锌,阴极为铜片,阳极反应式
是
。
(3)若阳极为纯锌,阴极为铜片,如不考虑 H+在阴极上放电,当电路中有专题一专题二2.电解池两极的判断
知识网络
专题归纳
知识网络
专题归纳
专题一 专题二
3.电解池两极产物的判断 (1)阳极产物的判断: 首先看电极,如果是活性电极(金属活动性顺序 Ag 以前),则电极材料失 电子,电极被溶解,溶液中的阴离子不能失电子;如是惰性电极(Pt、Au、石墨), 则要看溶液中离子的失电子能力,此时根据阴离子放电顺序加以判断,阴离 子放电顺序:Cl->OH(2)阴极产物的判断: 直接根据阳离子放电顺序进行判断,阳离子放电顺序与金属活动顺序 相反,其中 Ag+>Fe3+>Cu2+>H+ 说明:①电解质溶液的导电过程,就是该溶液的电解过程。 ②电解质溶液的导电过程发生化学变化。 ③电解池的阴阳极取决于外接电源的正负极,与电极材料的金属活动 性无关。
高中化学专题五电化学问题研究课题1原电池第1课时课件苏教版选修6

氢氧燃料电池的制作
我们的思考
这个实验成功率很高,最关键 的就是碳棒的固定,我们可以 将碳棒固定在泡沫塑料上。
析氢腐蚀
三.金属的腐蚀
1.析氢腐蚀
实验过程
1.取两根3~5cm长的铁钉,用稀盐酸除去铁锈。在其中一 根铁钉上疏散地绕几圈光亮的细铜,使铜丝铁钉紧密接 触。
析氢腐蚀
实验注意点
1.这个反应出现蓝色沉淀很快(2秒左 右), 所以建议实验时,先在两支试管中加 好稀盐酸和铁氰化钾,再同时分别放入铁 钉和缠有铜丝的铁钉,观察颜色变化。
2.将两试管静置一段时间(5到10分钟)后观 察气泡。
吸氧腐蚀
2.吸氧腐蚀
实验过程
取一片铁片,用砂纸擦去铁锈,在铁片上滴1 滴含酚酞的食盐水,静置1~2min,观察现象。
氢氧燃料电池的制作
实验现象
1.接通电源,电极表面产生大量气泡, 并在电极表面吸附上大量气泡。 2.切断电源后,将电极接在蜂呜器上, 蜂呜器立刻发出蜂呜声。
氢氧燃料电池的制作
实验注意点
1.多孔碳棒现制现用效果好,也可直接用 砂纸打磨碳棒,后冲洗,效果也很好。 2.电解硝酸钾溶液时,课本要求接直流电 源6V,实际操作中电压可从几伏到二十几伏, 电解10至15秒即可。电解质溶液用硫酸钠、 硝酸钠等效果也很好。
2.把上述两根铁钉分别放入两支试管中,各加入 3mL0.1mol·L-1盐酸和2滴K3[Fe(CN)6](铁氰化钾)溶 液,观察现象。比较哪支铁钉上产生的气泡多,哪支铁钉 周围先出现蓝色沉淀(Fe2+能与[Fe(CN)6]3-反应生成蓝 色沉淀)。
析氢腐蚀
2024-2025学年高中化学专题五电化学问题研究5.1原电池教案苏教版选修6

D.金属电极的材料
答案:A、B、C、D
解析:原电池的电动势受到多个因素的影响,包括温度、电解质溶液的浓度、金属电极的表面积和材料等。这些因素的改变都会影响原电池的电动势。
5.例题五:
题目:以下哪个设备可以用来测量原电池的电动势?
A.电流表
B.电压表
C.电阻表
D.电导表
答案:B.电压表
3.学生可能遇到的困难和挑战:在学习原电池的知识时,学生可能会对原电池的工作原理以及电极反应的理解感到困难。此外,学生可能对如何将理论知识运用到实际问题中感到困惑。还有,对于部分学习风格偏向理论的学生,如何激发他们学习电化学的兴趣也是一个挑战。
教学方法与策略
1.选择适合教学目标和学习者特点的教学方法:针对本节课的内容,我将采用讲授法为主,结合案例研究、项目导向学习和讨论法进行教学。在讲授原电池的基本概念和工作原理时,我将运用清晰的逻辑和生动的实例,帮助学生理解和记忆。通过案例研究和项目导向学习,让学生将理论知识应用于实际问题中,提高分析和解决问题的能力。同时,组织学生进行讨论,促进学生之间的交流和思考。
然而,在教学过程中,我也发现了一些问题和不足之处。首先,在讲解原电池的基本概念和工作原理时,我发现部分学生对概念的理解存在一定的困难。因此,我需要进一步改进我的教学方法,通过更多的实例和图片来帮助学生更好地理解和记忆这些概念。其次,在课堂互动环节,我发现部分学生参与度不高,这可能是由于他们对原电池的兴趣不足。因此,我需要进一步了解学生的兴趣点,并尝试将更多的实际案例和应用场景引入课堂,以激发学生的学习兴趣。
3.确定教学媒体和资源的使用:为了提高教学效果,我将利用PPT、视频和在线工具等多种教学媒体和资源。在课堂上,我将使用PPT展示原电池的相关知识点,通过图文并茂的方式,帮助学生更好地理解和记忆。同时,播放与电化学相关的视频,让学生直观地观察实验现象,加深对原电池的认识。此外,我还将引导学生在线上查找相关资料,利用在线工具进行自主学习和讨论,提高学生的学习主动性和积极性。
2018-2019版高中化学(苏教专用)新设计同步选修六课件:专题五 电化学问题研究 课题一

(2)一段时间后,向烧杯中加入1~2 g重铬酸钾晶体(或高锰酸钾
晶体,或5~10 mL 6% H2O2溶液),振荡。 橙红色 ,小灯泡 ____________ 亮度增强 ,持续时间 实验现象:溶液显 ________ 较长 。 _______ (3)改用Zn-C、Al-Cu为电极材料,分别与稀硫酸组合成原电
在该原电池中,电流从铜电极流向锌电极(即电子由锌电极流向
负 极,电子流入的电极叫 铜 电 极 ) 。 电 子 流 出 的 电 极 叫 ______ 正 极。 _____
电极反应为: Zn-2e-===Zn2+ 负极:_____________________ Cu2++2e-===Cu 正极: _____________________ +Cu2+===Zn2++Cu 电池反应: Zn _____________________ 减小 ,铜片上有红色物质析出,质 因此,会出现锌片质量_______ 电流 产生。 量增加,电流计指针位置变化的现象,判断有_______
4Fe(OH)2+O2+2H2O===4Fe(OH)3 。 ________________________________
Fe(OH)3又可失水变成铁锈(通常以Fe2O3· nH2O表示)。
思考1:析氢腐蚀、吸氧腐蚀中的“析”和“吸”各代表什么 含义? 提示 析氢腐蚀中,H2是产物,从溶液中析出,所以为“析 氢 ” 。吸氧腐蚀中, O2 是反应物,被消耗而吸收,所以为
类似 池,按照上述实验装置和操作方法进行实验,会观察到______
的实验现象。
思考2:在Zn-Cu原电池装置中,向稀硫酸中加入1~2 g重
铬酸钾晶体,会观察到小灯泡变得更亮,这是什么原因?
提示 在稀硫酸中加入重铬酸钾晶体, 因 Cr2O2 7 氧化性更强,
2018-2019版高中化学(苏教专用)新设计同步选修六课件:专题五 电化学问题研究 课题二

[ 学习目标 ]
电解与电镀
1. 通过电解饱和食盐水实验,加深对电解原理的
认识。 2. 通过铁钉镀锌实验,加深对电镀原理的认识。 3.了解 化学实验研究的一般过程,提高利用化学实验解决问题的能力。 4.体会观察和分析实验现象对于化学研究的重要性。
一、电解和电镀
1.电解 氧化还原 反应的过 电流通过电解质溶液在阴、阳两极引起___________ 电 能转变为 ______ 化学 能的装置,叫做电解槽 程叫做电解。把 ____ 阴 极 或电解池。与直流电源的负极相连的电极是电解池的 ____ 还原 反应),与直流电源的正极相连的电极是电解池的 (发生______ 阳 极 ( 发生_______ 氧化 反应) 。通电时,电子从电源的负极流出, ____ 并沿导线流回电源的正极,可从两极分别得到不同的产物。
点拨二、电解质溶液的电解规律(惰性电极)
电解质 pH 溶液复原 所需加入
类型
电极反应特点
实例
电解 物质
电解质 溶液 浓度
物质
水 水 水
阴极:4H++4e- 电解 ===2H2↑ 水型 阳极:4OH--4e-
NaOH H2SO4 Na2SO4
水 水 水
增大 增大 增大 减小 增大 不变
===2H2O+O2↑
片上镀锌的电极反应为:
Zn2++2e-===Zn (还原反应) 阴极:__________________ Zn-2e-===Zn2+ 氧化反应) 阳极:__________________(
二、课题方案设计 1.电解饱和食盐水
(1)实验步骤:
按下图连接装置,在U形管里倒入饱和食盐水,插入一根石墨 棒作阳极,一根铁棒作阴极。同时在两边管中各滴入几滴酚 酞溶液,并用湿润的碘化钾淀粉试纸检验阳极放出的气体。 接通直流电源后,注意管内发生的现象。
高中化学 专题五 电化学问题研究 5.1 原电池教案 苏教版选修6

原电池
一、学情分析与教学设想
该部分内容概念较多,涉及原电池、氧化还原、带电粒子移动、电极及电极反应、内外电路、充放电等。
而学生对这些概念辨析不清,如分不清氧化反应与还原反应、正负极与阴阳极。
除此学生最大的问题是不会写电极反应和怕写电极反应。
因此,本人尝试在教学中变换思路,以物理中带电粒子在电场中定向移动解决阴阳离子向正负极移动问题。
采用分步反应法解决写电极反应难的问题。
二、教学目标
知识与技能:
1.基本掌握原电池的原理;
2.基本掌握电极反应方程式的书写。
过程与方法:
1.以物理中带电粒子在电场中定向移动解决阴阳离子向正负极移动问题;2.用分步反应法实践写电极反应。
情感态度与价值观:
1.能在思考交流过程中倾听他人意见,相互启发,体会到合作交流的重要;2.通过对阴阳离子向正负极移动的探讨,树立起事物间相互联系的思想。
三、教学重点和难点
重点是原电池的原理;难点是电极反应方程式的书写。
四、教学过程
五、板书设计
原电池、电源
一、原电池
离子移动示意图
二、电源
书写电极反应方法:分步反应法
第一步:电极发生的反应;
第二步:第一步的产物与电解质反应;
第三步:电极反应式是以上两步的加和式。
高中化学 专题五 电化学问题研究 课题2 电解与电镀学案 苏教版选修6

课题2 电解与电镀一、判断电解过程中的电极产物判断电解过程中电极产物的依据是:电极材料和离子放电顺序。
阴离子失去电子和阳离子得到电子的过程叫放电。
放电顺序取决于离子本身的性质,也与离子浓度及电极材料有关。
电解时所使用的电极分为两类:一类为惰性电极,只起导体的作用(如铂、石墨等),并不参与反应;另一类为活性电极(除铂、金以及在电解时很易钝化的铅、铬以外的金属),活性电极若作阴极,只起导体的作用;若为阳极,发生氧化反应的往往是电极本身。
电极上物质的变化情况以及电子的转移情况用电极反应式来表明。
当电解质溶液中存在多种阳离子或者多种阴离子时,电解质溶液中各种离子在两极上得失电子是有一定顺序的,称之为放电顺序。
放电顺序涉及多种因素,在中学阶段只要求掌握:阳极——①若为惰性电极,则阴离子放电(失电子,发生氧化反应),放电顺序为: S 2->I ->Br ->Cl ->OH ->含氧酸根离子>F -②若为活性电极,则电极本身失去电子而放电,电极溶解。
因为活性电极的还原性几乎大于一切的阴离子。
阴极——无论是惰性电极,还是活性电极,阴极总是受到保护,不会参与电极反应,始终为阳离子放电(得电子,发生还原反应),放电顺序为:Ag +>Hg 2+>Fe 3+>Cu 2+>H +(酸)>Pb 2+>Sn 2+>Fe 2+>Zn 2+>H +(H 2O)>Al 3+>Mg 2+>Na +>Ca 2+>K +因此,判断电解过程中电极产物的步骤可以概括为:①分析电解质溶液的组成,找全离子(包括水电离出的H +及OH -)并分为阴、阳两组;②分析离子的放电顺序;③确定电极,写出电极反应式。
【例1】某同学按下图所示的装置进行电解实验。
下列说法正确的是( )A .电解过程中,铜电极上不会有H 2产生B .电解初期,主反应方程式为Cu +H 2SO 4=====通电CuSO 4+H 2↑ C .电解一定时间后,石墨电极上不会有铜析出D .整个电解过程中,H +的浓度不断增大解析:从装置图可以看出铜接电源正极作阳极,石墨作阴极,应在阴极区产生H 2,且H +浓度应逐渐减小,故A 、D 错。
2018-2019版高中化学(苏教专用)新设计同步选修六课件:专题五 电化学问题研究 专题整合
充电时的阴极反应为放电时负极反应的逆过程。以铅蓄电池为
例,该过程可结合图示分析:
由此可见,放电过程中,作为负极的 Pb 需转化成 PbSO4,铅化 合价升高,被氧化,Pb 为负极;当放电完毕时,可看做 Pb 极转 化成了 PbSO4, 充电时需让 PbSO4 转化为 Pb, 铅的化合价降低, 被还原,PbSO4 一极为阴极,所以,放电时的负极就是充电时的 阴极,同理可分析放电时:PbO2(正极)―→PbSO4,充电时: PbSO4(阳极)―→PbO2,即放电时的正极就是充电时的阳极。
专题二
可充电电池的探究
本部分是原电池与电解池的融合,考查学生综合运用所学知识
的能力。若要正确理解和掌握可充电电池,需掌握以下知识: (1)可充电电池有充电和放电两个过程,放电发生的是原电池反 应,充电发生的是电解池反应。充电的电极反应与放电的电极 反应过程相反,充电时的阳极反应为放电时正极反应的逆过程,
负极:氧化反应 (负失氧) 正极:还原反应 电极 (正得还) 反应 原电池的电极反 应较为复杂,不 易总结出明显的 规律特征
阳极:氧化反应, 溶液中的阴离子或 金属电极失电子(阳 失氧) 阴极:还原反应, 一定是溶液中的阳 离子得电子(阴得 还)
阳极:氧化反应, 金属电极失电 子,并不断溶解 (阳失氧) 阴极:还原反应, 电镀液中的镀层 金属阳离子得电 子(阴得还)
导线 负极――→阴极→ 电子 导线 流向 负极――→正极 导线 阳极――→正极
同电解池
电流 方向
导线 正极――→负 极→电解质溶 液→正极
导线 正极――→阳极→电解质溶 导线 液→阴极――→电源负极→ 电源正极
同电 解池
电解质导电的过程实质上就是电解过程; 电解是在外 对比 电源的作用下被迫发生氧化还原的过程, 把电能转化 为化学能,而在原电池中正好相反,是自发的氧化还 原反应的过程,把化学能转化为电能
化学:专题5课题1《原电池实验的探究》课件苏教版选修.ppt

2019年11月20日5时51 分
6
提出课题——用更有说服力的实验来证实 具有实际价值的电池
探究电池效率的因素,
放大电池的电流密度,
延长电池的工作时间,
。。。。。。。
2019年11月20日5时51 分
7
二、实验基本原理
2019年11月20日5时51 分
8
电池反应 Zn + Cu2+ = Zn2+ + Cu
20
2019年11月20日5时51 分
21
四、实验注意事项
2019年11月2固体氢氧化钠立即加水配制成溶 液,由于它们溶解放热,形成热的介质,加快了电 极反应。
2.如要灯泡持续发亮,不断振荡是关键。可以用电极 搅拌溶液。海绵比两极板稍长,以防碰破烧杯底。
一是电流微弱, 用灵敏检流计检测;
二是供电时间短暂, 电池的放电效率低;
三是锌极板有大量气泡, 干扰铜极板现象的观察。
2019年11月20日5时51 分
5
(三)从实验视角看
选修3第12页“原电池的工作原理活动与探究”
克服了锌极板有大量气泡的现象 盐桥能说明内电路中离子的迁移
电流密度依然较小,不足以使小灯泡发亮
2019年11月20日5时51 分
13
2.去极化剂的选择
向三个装置中分别加入 10ml 的稀硫酸,编号为甲 乙、丙,观察小灯泡是否发光。 向甲装置中加入 5ml 3% 的双氧水,振荡溶液, 记录小灯泡发光的时间和亮度。
向乙装置中加入 0.5 g 的重铬酸钾晶体,振荡溶液, 记录小灯泡发光的时间和亮度。
《实验化学》 专题5 电化学问题研究
课题1 原电池实验的探究
浙江省上虞中学 林炯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课题 2 制作氢氧燃料电池 课题1 原电池 课题 3 金属的电化学腐蚀
拓展课题 干电池的模拟 实验
教材资料:锌-铜-稀硫酸为材料的原电池。
专题作业:从理论上分析用铝-铜-氢氧化钠为材料,
能否形成原电池。 完整版课件ppt
14
(二)从学科指导看
基本要求: 通过原电池实验,加深对原电池工作原理的认识。
一是电流微弱,
用灵敏检流计检测;
二是供电时间短暂,
电池的放电效率低;
三是锌极板有大量气泡,
干扰铜极板现象的观察。
完整版课件ppt
16
(三)从实验视角看
选修3第12页“原电池的工作原理活动与探究”
克服了锌极板有大量气泡的现象 盐桥能说明内电路中离子的迁移
电流密度依然较小,不足以使小灯泡发亮
完整版课件ppt
同的电极和电解质溶液对产生电流的
影响的差异,从中认识到电极和电解
质溶液和去极化剂种类的选择、电极
的表面积、极板之间的距离等对实验
效果的影响,同时通过对实验现象的
观察、对比和分析,加深学生对化学
反应条件控制的重要性的认识。
完整版课件ppt
12
一、背景材料分析
完整版课件ppt
13
(一)从现行教材看
课题 1 原电池实验
1、通过实验探究活动,掌握基本的 化学实验技能和方法 。
2、体验实验探究的基本过程,认识 实验在化学科学研究和化学学习中 的重要作用,提高化学实验能力
3、为了帮助学生学习一些重要的科
学方法,形成严谨的科学态度
完整版课件ppt
10
课题1:原电池
完整版课件ppt
11
本研究课题的实验方法:
“原电池实验的探究”是通过不
负极 Zn - 2e- = Zn2+
CuSO4溶液 ZnSO4溶液
K+迁入 Cl- 迁入
20
实验表明: 电池的电流密度的大小与电极的表面积、极板 之间的距离和介质等因素有关;无论何种材料 制作的原电池,电池的极化作用都是很强的, 极化作用会使电极的放电反应变得迟钝,影响 电池的工作时间,而去极化剂(如高锰酸钾、 重铬酸钾和过氧化氢等氧化剂)由于有效降低 了电极的极化作用,提高了电池的放电效率。 为此设计了如下图的实验装置。
完整版课件ppt
21
铜锌原电池
完整版课件ppt
2、掌握基本的化学实验方法和技能,了解现代 仪器在物质的组成、结构和性质研究中的应用;
知识与技能:
了解化学实验研究的一般过程,初步形成运
用化学实验解决问题完的整版能课件力ppt ;
4
通过本模块的学习,学生应主要在以下几个方面 得到发展:
1、认识化学实验是学习化学知识、解决生产和 生活中的实际问题的重要途径和方法;
17
提出课题——用更有说服力的实验 来证实具有实际价值的电池
探究电池效率的因素, 放大
电池的电流密度,延长电池的
工作时间。
完整版课件ppt
18
二、实验基本原理
完整版课件ppt
19
电池反应 Zn + Cu2+ = Zn2+ + Cu
外电路 检流计 内电路 盐 桥
电子迁移
离子迁移
完整版课件ppt
正极 Cu2+ + 2e- = Cu
发展要求: 能根据已知的电池总反应式,判断电池的正负极, 书写电极反应式。
说 明: 电极的极化作用对原电池产生电流的影响只作一 般了解。
课时安排:
1 课时,(总 2 课时,制作氢氧燃料电池和析氢
腐蚀、吸氧腐蚀拟放在第二课时)
完整版课件ppt
15
(三)从实验视角看
必修2第38页“化学能转变为电能的活动与探究”
8
本专题研究时要考虑的问题:
1、了解原电池的工作原理,认识几种常 见电池的化学原理。
2、了解电解和电镀中包含的化学知识, 加深对化学与生活的联系。
3、通过原电池、电解和电镀实验,培养 观察能力、操作能力和思维能力。
4、化学实验的本质就是在有条件控制下
发生的化学变化。完整版课件ppt
9
实验探究活动的目的:
通过化学实验探究,要求学生能达 到以下几方面要求:
①能发现学习和生产、生活中的意义的化学
问题,并进行实验探究。②能根据具体情况
设计解决化学问题的实验方案,并予以评价
和优化。③能通过化学实验收集有关数据,
并科学地加以处理。④能对实验现象做出合
理的解释,运用比较、归纳、分析、综合等
方法初步揭示化学变完化整版课的件p规pt 律。
2、实验已非纯粹的实验,而是一个内涵丰富 的课题,通过对课题的学习,学生将会在化学 知识、实验技能、实验方法、科学态度、创新 精神与实践能力等方面得到全面的发展。
3、充分利用各种教学时机,对学生进行绿色
化学、科学态度等方面的教育,同时注意和现
代实验技术发展联系起来,开拓学生的视野,
培养学生的情操。 完整版课件ppt
完整版课件ppt
2
化学实验是化学科学赖以产生和 发展的基础,以实验为基础是化学学 科重要特征之一,为充分体现化学实 验的功能,高中化学新课程专门设置 了“实验化学”这个选修模块。
完整版课件ppt
3
通过本模块的学习,学生应主要在以下几个方面 得到发展:
过程与方法:
1、认识化学实验是学习化学知识、解决生产 和生活中的实际问题的重要途径和方法;
2、掌握基本的化学实验方法和技能,了解现代 仪器在物质的组成、结构和性质研究中的应用;
3、了解化学实验研究的一般过程,初步形成运 用化学实验解决问题的能力;
4、形成实事求是、严谨细致的科学态度,具有 批判精神和创新意识;
5、形成绿色化学的观完整念版课,件pp强t 化实验安全意识。5
该模块又分成二个主题,分别为 “化学实验基础”和“化学实验探究”。
《实验化学》 专题5 电化学问题研究
完整版课件ppt
1
一、课程标准相关要求
《实验化学》模块是6个选修模块其中 之一,是普通高中化学课程的重要组成部 分。设置该课程模块有助于学生更深刻地 认识实验在化学科学中的地位,掌握基本 的化学实验方法和技能,培养学生的创新 精神和实践能力。
实验化学模块教材十分注重引导学生 运用化学原理理解化学实验技术的内涵与 操作要求,理论与实践相结合。
6
二、本实验基本原理及其在实验化学 中的地位
传统教材 :
实验目的→实验原理→实验用品→ 实验步骤→实验记录→问题与讨论
新教材:
知识预备→课题方案设计→记录
与结论→交流讨论
完整版课件ppt
7
功能:
1、将各知识性栏目穿插在课题的各部分内容中, 使学生的知识目标和实验技能目标有机地整合 在每一个课题中 。
