乙醛的分子结构
乙醛

乙醛一、醛1.定义;由烃基与醛基的连而形成的化合物且醛基只能在端C 上形成的化合物。
CH 3—C —H二、乙醛 1.分子式及结构O分子式:C 2H 4O 结构式 H —C — C —H 结构简式:CH 3CHO 或 CH 3 —C —H 氢谱3:1O官能值:—C —H (醛基) 电子式:O 红外光谱:C —H 、C=O 振动 RCHO 或R —C —H O 注:①乙醛耗氧 x+y/4-z/2 C C 2H 4O →C 2H 2·H 2O H —C H H H O②有醛基不一定是醛,但醛一定有醛基 H —C —O —H 甲酸2.物性乙醛无色有刺激性气味的液体,密度比水小,能溶于水和有机溶剂,易燃烧,易挥发,注意防火。
3.化性①加成反应(还原反应) O催化剂CH 3—C —H +H 2 CH 3CH 2OH △②氧化反应1) 被O ₂氧化(催化氧化)催化剂2CH 3一 C 一 H + O 2 → 2CH 3 一 C 一 OH 2) 可燃性 △O CO HOH HO O催化剂2CH 3一 C 一 H + 5O 2 → 4CO 2 + 4H 2O △ 3)弱氧化剂氧化①银镜反应配银氨溶液方法:向AgNO 3溶液中加入稀氨水,边加边摇动试管至最初产生的沉淀刚好溶解为止,就配成了银氨溶液。
(1)AgNO 3 + NH 3.H 2O =AgOH ↓+ NH 4NO 3(2)AgOH + 2NH 3.H 2O =[Ag(NH 3) 2]OH +2H 2O氢氧化二氨和银是络合物(配合物)。
中括号里的叫内界,中括号外的叫外界.离子式: AgOH + 2NH 3.H 2O =[Ag(NH 3) 2]+ +OH - +2H 2O 银氨络离子强碱性(1)(2)加和离子式:Ag + + 2NH 3.H 2O =[Ag(NH 3) 2]+ + 2H 2O注意:①乙醛与[Ag(NH 3) 2]OH 反应条件为水浴加热(温度不能太高,受热均匀) ②反应现象:试管内壁覆着着一层光亮的银镜。
乙醛

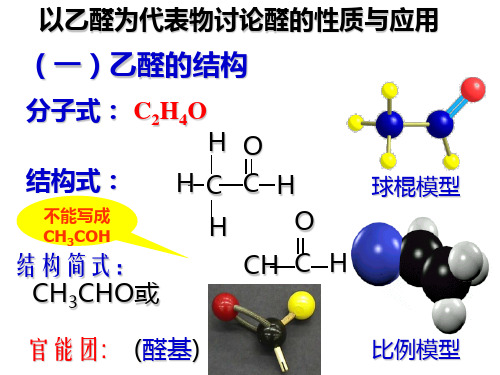
乙醛【知识要点】1.乙醛的分子组成与结构乙醛的分子式是O H C 42,结构式是,简写为CHO CH 3。
注意 对乙醛的结构简式,醛基要写为—CHO 而不能写成—COH 。
2.乙醛的物理性质乙醛是无色、具有刺激性气味的液体,密度小于水,沸点为C 8.20。
乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。
注意 因为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
3.乙醛的化学性质从结构上乙醛可以看成是甲基与醛基()相连而构成的化合物。
由于醛基比较活泼,乙醛的化学性质主要由醛基决定。
例如,乙醛的加成反应(碳氧双键)和氧化反应(醛基氢),都发生在醛基上。
(1)乙醛的加成反应乙醛分子中的碳氧双键能够发生加成反应。
例如,使乙醛蒸气和氢气的混合气体通过热的镍催化剂,乙醛与氢气发生加成反应:说明:①在有机化学反应中,常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应。
乙醛与氢气的加成反应就属于还原反应。
②从乙醛与氢气的加成反应也属于还原反应的实例可知,还原反应的概念的外延应当扩大了。
(2)乙醛的氧化反应在有机化学反应中,通常把有机物分子中加入氧原子或失去氢原子的反应叫氧化反应。
乙醛易被氧化,如在一定温度和催化剂存在的条件下,乙醛能被空气中的氧气氧化成乙酸:注意 ①工业上就是利用这个反应制取乙酸。
②在点燃的条件下,乙醛能在空气或氧气中燃烧。
乙醛完全燃烧的化学方程式为: O H CO O CHO CH 22234452+−−→−+点燃乙醛不仅能被2O 氧化,还能被弱氧化剂(如银氨溶液和新制备氢氧化铜悬浊液)氧化。
银氨溶液的制备: 在洁净的试管里加入1 mL 2%的3AgNO 溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止(此时得到的溶液叫做银氨溶液)。
再滴入3滴乙醛,振荡后把试管放在热水中温热。
实验现象 不久可以看到,试管内壁上附着一层光亮如镜的金属银。
乙醛的结构
(2)与新制氢氧化铜反应
CH3CHO +2Cu(OH)2 CH3COOH + Cu2O+ 2H2O
(3)与氧气的反应
2CH3CHO + 催化剂 2CH3COO
O2
H
(4)与酸性KMnO4溶液及Br2水反应
酸性KMnO4溶液及Br2水都褪 色
加成
一、做银镜反应的注意几个事项
1.试管内壁应洁净 2.必须用水浴加热,不能用酒精灯加热。 3.加热时不能振荡试管和摇动试管。 4.配制银氨溶液时,氨水不能过多或过少(只能
乙醛脱氢酶的作用下将乙醛氧化为乙酸,并进
一步转化为CO2和H2O。如果人体内这两种脱 氢酶的含量都很大的话,酒精的代谢速度就很
快。但如果人体内这两种脱氢酶的含量不够大,
例如缺少乙醛脱氢酶,饮酒后就会 引起体内乙醛积累,导致血管扩张 而脸红。
原来如 此啊!
五、课堂检测
1.写出下列反应的化学方程式,并注明反应类型
课堂小结:
1、乙醛和氢气发生加成反应生成乙醇,
说明了醛基有氧化性。
2、氧气、Ag(NH3)2OH、Cu(OH)2、溴水、酸 性 高锰酸钾都溶液在一定条件下都能使乙醛氧
化
3、说由明以醛上基两具点有得较出强反的应还规原律性:
氧化
氧化
乙醇
乙醛
乙酸
还原
4、醛基的检验方法:
(1)与新制的银氨溶液反应有光亮的银镜生成
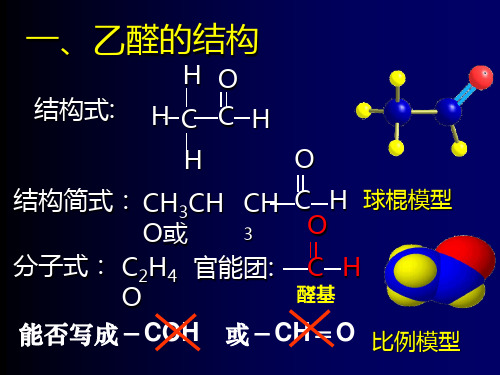
一、乙醛的结构
HO 结构式: H C C H
H
O
结构简式: CH3CH 型
分子式: C2H4 官能团: C H
O
醛基
能否写成-COH 或-CH=O 比例模型
选修5 第三章 第二节 乙醛

4、乙醛与氢气在一定条件下反应生成乙醇, 此反应属于: AC A、还原反应 B、氧化反应 C、加成反应 D、消去反应 5、下列有机物在反应中被氧化的是 BD A、CH2=CH2转化成CH3CH3 B、CH3CH2OH转化成CH3CHO C、CH3CHO转化成CH3CH2OH D、CH3CHO转化成CH3COOH
H
O
R-CH-C-H
R-CH-C-H
△ -H2O
O R-CH2-CH=C-C-H R O
以乙烯合成1-丁醇 资料36页 15题 现有一化合物A,是由B、C两物质通 过上述原理的反应生成的。试根据A的结 构式写出B、C的结构式 CH3 CH3CHO A:CH3 C CH2CHO O OH CH3 C CH3
聚甲醛, 假象牙,是一 种很好的有机塑料 nHC≡CH
一定条件
— [ CH=CH— ]n 聚乙炔,导电塑料
苯酚与甲醛的缩聚反应
OH
n
O + n HCH
OH
]n -CH2-
缩聚反应——单体间相互反应生成高分子 化合物的同时还生成小分子的反应 条件: 每一种单体必须有能够形成两条 半键的原子或原子团
-
1mol 甲醛~
2
mol Cu2O
若分子中有1个醛基: 若1个分子中有 1mol该醛 —— 2mol Ag 多个醛基,依 若分子中有2个醛基: 次类推 1mol该醛 —— 4mol Ag 所以可根据醛的物质的量和生成的Ag 的物质的量的关系,可知醛分子中所含醛 基的个数 但需注意:甲醛(HCHO)是一元醛,分子中 只有1个醛基,但在发生氧化反应时,相当 于二元醛,如与银氨溶液反应时: 1mol HCHO —— 4mol Ag
了解 2、乙醛也可和HX、HCN加成 O OH CH3CH + HX
乙醛讲课

又有还原性能被O 又有还原性能被 2氧化
(2)乙醛的还原性 ) ①乙醛在点燃条件下与氧气的反应
点燃 4CO +4H O 2 2
2CH3CHO+5O2 CHO+
被氧气氧化
醛基中碳氢键较活泼,能被氧化成相 醛基中碳氢键较活泼,能被氧化成相 应羧基
②乙醛的催化氧化
2CH3CHO+O2 催化剂 2CH3C、乙醇催化氧化法 、
2CH3CH2OH + O2
Cu或Ag 或 △
2CH3CHO + 2H2O
2、乙炔水化法 、
CH CH + H2O
催化剂
CH3CHO
3、 3、乙烯氧化法
2CH2 CH2 + O2
催化剂
加热 加压
2CH3CHO
一、甲醛结构 : 分子式:CH2O 分子式: 结构简式: 结构简式:HCHO
三、甲醛的化学性质 甲醛中有2个活泼氢可被氧化 甲醛中有 个活泼氢可被氧化
①、HCHO+H2 + ②、HCHO+O2 +
催化剂 催化剂
CH3OH CO2 ↑ +H2O CO2 ↑
③、HCHO+4Ag(NH3)OH +
+8NH3 ↑ +4Ag ↓ +3H2O ④、HCHO+4Cu(OH)2 + CO2 ↑ +2Cu2O ↓ +5H2O
此外,醛类都可以发生银镜反应, 此外,醛类都可以发生银镜反应,也 可以和新制Cu(OH)2反应 可以和新制
②、加成反应(还原反应) 加成反应(还原反应)
O || R-C-H+H2 - - +
催化剂
R-CH2-OH -
③、醛既有氧化性,又有还原性 醛既有氧化性,
醇
氧化 还原
醛
氧化
羧酸
三、醛基的检验 哪些有机物中含有—CHO? 1、*哪些有机物中含有 、 哪些有机物中含有 ? 醛、HCOOH、HCOOR、 、 、 葡萄糖、 葡萄糖、麦芽糖
醛、酮、乙醛的性质

2Cu(OH)2+CH3CH O Cu2O↓+CH3COOH+2H2O
注意:氢氧化铜溶液一定要新制 碱一定要过量
银镜反应:检验醛基的存在,测定醛基的数目, 工业上用来制瓶胆和镜子 与新制氢氧化铜悬浊液反应:检验醛基的存 在,医学上检验病人是否患糖尿病 乙醛能否使溴水或酸性KMnO4溶液褪色? 能 使酸性KMnO4溶液和溴水褪色
加热 加热
HCOONH4+2Ag+3NH3+H2O (NH4)2CO3+2Ag+3NH3+H2O
加热
(NH4)2CO3+4Ag+6NH3+2H2O
HCHO+4Cu(OH)2
加热
2Cu2O↓+CO2+5H2O
科学视野
O
丙酮
CH3-C-CH3
酮:羰基碳原子与两个烃基相连的化合物。 >C=O称羰基,是酮的官能团,丙酮 是最简单的酮。在常温下,丙酮是无色透 明的液体,易挥发,具有令人愉快的气味, 能与水、乙醇等混溶,是一种重要的有机 溶剂和化工原料。 丙酮不能被银氨溶液、新制的氢氧化 铜等弱氧化剂氧化,但可催化加氢生成醇。
H
O C H
【思考】结合乙醛的结构,说明乙醛 H 的氧化反应和还原反应有什么特点?
C H
乙醛能发生氧化反应是由于醛基上的H原子 受C=O的影响,活性增强,能被氧化剂所氧化; 能发生还原反应是由于醛基上的C=O与C=C类似, 可以与H2发生加成反应。 氧化 氧化 总结:CH3CH2OH CH3CHO CH3COOH 还原
OH OHCH3CH=O+H-CH2CHO CH3CH-CH2CHO OH △ CH3CH=CHCHO+H2O CH3CH-CH2CHO
乙醛和醛类

穿越马路时,印地安人对纽约朋友说:"你听到蟋蟀的叫声了吗?" 纽约朋友笑着说:"您大概坐飞机太久了,这机场的引道连接到高速公路,怎么可能有蟋蟀的叫声呢?" 又走了几步路,印地安人又说:"真的有蟋蟀!我清楚地听到了它们的声音。" 纽约朋友笑得更大声了:"您瞧!
那边正在施工打洞,机械的噪音那么大,怎么会听得到蟋蟀叫声呢?" 印地安人二话不说,走到斑马线旁安全岛的草地上,翻开一段干枯的树干,招呼纽约朋友观看那两只正在高歌的蟋蟀! 纽约朋友当场露出了不可置信的表情,直呼不可能:"你的听力真是太好了,能在如此吵闹的环
有时她睡在床上,双眼无神地看着天花板,嘴里就喊着外公的名字。可她却不认得外公的人,就算外公站在她身边,她还会用拐杖打外公。但我们知道外婆的心里还是有外公的,毕竟外公是她这辈子最爱的人。 后来,外婆的病情变得更不乐观了,需要住院。一开始,外婆死也不肯去医院,
最后我们和她说外公在医院里等她,她这才妥协了。一路上她还不住地问我们,医院到了没,她要见外公。其实那时外公就坐在她的旁边。 到医院后,外婆渐渐喜欢上了吃橙子,并且只要外公喂她。我们还以为她认识外公了。谁知她说,"我就要他喂,他喂的样子像老头子。" 外婆得
如果我们能够清楚地知道与了解,再加上专注地倾听,就可以清晰地听到: 自己生命心灵深处的愿望、责任、自由与博爱。 自然循环进化跃升中的变异、无待、齐物与大道。 下雨 ? 小时候听过一个笑话,一直记着,但是
一直也没弄明白那其中的玄妙。说是有一个傻子,低着头在雨中走,慢腾腾地,就那么在雨中走。路人头上顶着各式各样的雨具或者权充雨具的东西急急忙忙地从他身边跑过,一边跑一边还喊:嗨,傻子,快点往前跑啊,下雨呢!傻子不紧不慢地回答说:前面不是也在下雨吗?因为天性愚钝,
乙醛和丙醛的结构-概述说明以及解释

乙醛和丙醛的结构-概述说明以及解释1.引言1.1 概述概述乙醛和丙醛是两种常见的有机化合物,它们都属于醛类化合物。
醛类化合物是含有醛基(-CHO)的有机化合物,它们在许多化学和生物过程中具有重要的作用。
乙醛的结构简单而紧凑,由一个碳原子与一个醛基(-CHO)组成。
乙醛的分子式为C2H4O,它是一种无色液体,具有特殊的刺激性气味。
乙醛广泛应用于化学工业中,用于制备各种化学品,如有机合成中的中间体和溶剂。
此外,乙醛还可用作某些食品添加剂,例如味精的原料。
丙醛与乙醛相比稍复杂一些,它的结构由一个碳原子和一个醛基(-CHO)组成,加上一个甲基基团(-CH3)。
丙醛的分子式为C3H6O,它也是一种无色液体,具有特殊的气味。
丙醛在医药和农药工业中广泛应用,也可用于有机合成和溶剂。
乙醛和丙醛具有一些相似的物理性质和化学性质,但它们也存在一些差异。
通过比较它们的结构、物理性质和化学性质,我们可以更好地了解它们各自的特点和应用领域。
本文将从乙醛和丙醛的结构描述、物理性质、化学性质以及两者之间的区别等方面进行详细介绍和分析。
最后,我们将总结乙醛和丙醛的结构特点,并展望它们在未来的应用前景。
通过这篇文章,读者将能够更全面地了解乙醛和丙醛的结构和性质,以及它们在化学和工业领域的重要性。
1.2 文章结构文章结构部分的内容可以包括以下内容:文章结构部分是对整篇文章的组织和安排进行说明,主要是为读者提供一个清晰的导引,使读者能够更好地理解和把握文章的内容和逻辑结构。
本文采用以下结构:引言部分包括文章的概述、文章结构、文章的目的和总结。
在概述部分,将简要介绍乙醛和丙醛的结构以及它们在化学领域中的重要性和应用。
在文章结构部分,将详细介绍每个章节的内容和组织方式,以便读者能够清楚地了解整篇文章的结构。
在目的部分,说明文章撰写的目的是为了深入探讨乙醛和丙醛的结构,并对其进行比较分析。
最后,在总结部分,将简要总结乙醛和丙醛的结构特点和应用前景,以及本文的主要观点和结论。
乙醛的分子结构

△
CH3COONH4
解释: 银被还原,乙醛被氧化成乙酸, 解释: 银被还原,乙醛被氧化成乙酸,乙酸又和氨 反应生成乙酸铵。 反应生成乙酸铵。
银镜反应注意事项
(1)试管内壁必须洁净; )试管内壁必须洁净; (2)60℃水浴加热,不能用酒精灯直接 ) ℃水浴加热, 加热; 加热; (3)加热时不可振荡和摇动试管; )加热时不可振荡和摇动试管; (4)须用新配制的银氨溶液,氨水不能 )须用新配制的银氨溶液, 过量(防此生成易爆炸的物质); 过量(防此生成易爆炸的物质); (5)乙醛用量不可太多; )乙醛用量不可太多; (6)实验后,银镜用 浸泡, )实验后,银镜用HNO3浸泡,再用水 洗。
燃烧 催化氧化 被弱氧化剂氧化 Cu(OH)2 能使高锰酸钾、 能使高锰酸钾、溴水褪色
CO2、H2O
银镜反应
羧 酸
作业
P113~114 一、二、三、四(三、四做在 作业本上)
能被还原成醇 甲醛的化学性质 与乙醛相似 能被氧化成羧酸 能起银镜反应, 能起银镜反应,能与新制的 氢氧化铜反应
用途:浸制标本,制药,香料,燃料。 用途:醛类:含有醛基 的有机物
饱和一元醛的通式: 饱和一元醛的通式: CnH2n+1CHO 或者: 或者: CnH2nO 醛类具有和乙醛类似的化学性质: 醛类具有和乙醛类似的化学性质: 加成反应 氧化反应
三、乙醛的化学性质
2、乙醛的氧化反应 c 被弱氧化剂氧化 Ⅱ 和Cu(OH)2反应
现象:试管内有红色沉淀产生 红色沉淀产生 现象:试管内有红色沉淀 注意: 注意:a 氢氧化铜必须 新制; 新制;b 直接加热
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 CH3CHO + 2Cu(OH)2 2Cu(OH) + 2H2O
乙醛的结构

乙醛的结构
乙醛(乙醛)是由两个氢原子和一个氧原子组成的有机化学物质,符号为CH3CHO或HCHO。
它在常温常压下是无色无味的液体。
它的分子结构如下
H–C–O–H
/
H H
这种结构形式是分子中的氢原子和氧原子通过单键双键形成的
单一碳原子,碳原子上有三个氢原子,一个氧原子,这种结构形式也称为碳氧式有机物。
它有一个氢原子的IUPAC名称是甲醛,分子式为CH3-CHO。
乙醛具有一个碳-氧双键(C=O),因此它也被称为一种碳氧双键化合物,并且乙醛在水溶液中具有极佳的溶解性,同时它也具有易挥发性。
- 1 -。
醛类甲醛乙醛化学性质

醛类(甲醛、乙醛)化学性质一、甲醛、乙醛一、乙醛、醛类分子组成及结构式乙醛的分子组成C2H4O,结构式官能团试探:1)乙醛的结构简式可否写成CH3CHO 。
2)醛类的通式:CnH2nO (饱和一元醛) R─CHO(结构通式)1·分子结构2、乙醛物理性质:无色、有刺激性气味的液体,密度比水小,能与水、乙醇、乙醚、氯仿等互溶,沸点:℃,易挥发,易燃3·化学性质—CHO是乙醛的官能团,对乙醛的化学性质起着决定性的作用。
分析:醛基的结构,初步得出乙醛可能具有的化学性质——氧化性和还原性。
介绍氧化(加氧去氢)和还原(加氢去氧)的概念。
(1)加成反映:CH3CHO+H2CH3CH2OH(2)氧化反映:【6-7】银镜反映【6-8】与新制的Cu(OH)2反映①银镜反映—查验醛基Ag+ + NH3·H2O = AgOH↓ + NH4+AgOH + 2NH3·H2O = Ag (NH3)2OH + 2H2O氢氧化二氨合银②与新制的Cu(OH)2反映—查验醛基写出以下反映方程式:①CH3CH2CHO 与 H2反映②RCHO 与银氨溶液反映像如此由烃基和醛基组成的化合物叫醛。
二、醛类1·概念: R-CHO2·=饱和一元醛通式:CNH2N=1-CHO或CNH2NO3·甲醛(又名蚁醛):无色、刺激性气味、气体、易溶于水,水溶液又叫福尔马林,用于制酚醛树脂和杀毒、防腐①乙醛的化学性质加成反映——还原氧化反映——氧化②银镜反映的应用查验醛基并测定醛基的个数(-CHO~2Ag),制镜或水瓶胆(用含醛基的葡萄糖)三、醛、酮与水及醇的加成教学目标:把握羰基化合物与水、醇进行亲核加成反映的规律及对反映活性阻碍因素把握酸催化下生成缩醛的反映机理教学重点:缩醛、缩酮的生成及在有机合成中的应用教学内容:醛、酮的羰基是个极性的不饱和基团,它的碳原子是高度缺电子的,亲核试剂与之发生的亲核加成反映是醛、酮化合物的重要化学特性。
醛知识梳理

醛
【知识梳理】
一、乙醛 1.结构 分子式:C2H4O,结构式: 结构简式: CH3CHO。 2.物理性质 乙醛是一种无色、有刺激性气味的液体,密度比水小,沸点 20.8 ℃,易挥发,易燃烧,能跟水、乙醇互溶。 3.化学性质 (1)氧化反应 ①燃烧:2CH3CHO+5O2 4CO2+4H2O
②被弱氧化剂氧化 银镜反应:
Ⅱ.(1)某物质中可能有甲酸、乙酸、甲醇和甲酸乙酯 4 种物质中的 1 种或几种,在鉴定时有下列现象:①有银镜反 应;②加入新制 Cu(OH)2 悬浊液沉淀不溶解;③与含酚酞 的 NaOH 溶液共热发现溶液中红色溶液逐渐消失以至无色, 下列叙述正确的有________。 A.几种物质都有 B.有甲酸乙酯、甲酸 C.有甲酸乙酯和甲醇 D.有甲酸乙酯,可能有甲醇
(2)一种有机物的结构简式如下, 关于它的性质不正确的 说法是________。
A.有酸性,可与 NaOH 反应 B.可以水解生成两种有机物 C.可以发生取代反应 D.可与 H2 发生加成反应 E.可与溴水发生取代反应
例1 (2)3
Ⅰ.(1)2 3,6-二甲基-1-庚醇
(3)先将柠檬醛与足量新制Cu(OH)2反应,向反应后的
③催化氧化:
二、醛 1.概念:醛是由烃基与醛基相连而构成的化合物,简 写为RCHO。甲醛是最简单的醛,饱和一元醛的通式为 CnH2nO(n≥1)。 2.性质:随着相对分子质量的增大,醛的熔、沸点逐 渐升高。化学通性主要为强还原性,可与弱氧化剂银氨溶液、 新制Cu(OH)2悬浊液反应生成羧酸铵、羧酸,其氧化性一般 仅限于与氢加成生成醇。醛基比较活泼,也能发生加成和缩 聚反应。
(一)乙醛的结构
知识运用
1、判断下列哪些能使酸性KMnO4溶液褪色? 判断下列哪些能使酸性KMnO 溶液褪色? 乙烯、甲烷、 甲苯、乙醛、 乙烯、甲烷、苯、 甲苯、乙醛、葡萄 苯酚、 糖、SO2、H2S、苯酚、裂化汽油 乙烯、 甲苯、乙醛、葡萄糖、 乙烯、 甲苯、乙醛、葡萄糖、SO2、 苯酚、 H2S、苯酚、裂化汽油
(4)乙醛与 乙醛与Cu(OH)2的反应 乙醛与
Cu2++2OH- = Cu(OH)2(新制蓝色絮状) 新制蓝色絮状 2Cu(OH)2+CH3CHO NaOH CH3COOH+Cu2O↓+2H2O
△
该实验可用于检验醛基的存在. 该实验可用于检验醛基的存在
注意
问题
1.Cu(OH)2应现配现用; 应现配现用; 2.成功条件:碱性环境、加热. 2.成功条件:碱性环境、加热. 成功条件
O
H O C O H
H2CO3
甲醛的化学性质
O=
从 结构: 氧化反应
H—C—H
分析
(注意:相当于含有两个醛基的特殊结构) 注意:相当于含有两个醛基的特殊结构) 含有两个醛基的特殊结构
+ H—C—H + 4[ Ag(NH3)]+ 4OH2
O= O=
△
2NH4+ + CO3 2- + 6NH3 + 4Ag↓+ 2H2O
肉桂醛
CH2=CH—CHO
苯甲醛
CHO
3、甲醛 、
结构 性质 :
O 1mol甲醛最多可以还原 1mol甲醛最多可以还原 H C H molAg? 得到多少molAg? 得到多少
与乙醛相似 甲醛的氧化产物是什么? 甲醛的氧化产物是什么?
乙醛的化学性质

结构分析
O CH3 C H
O C H
发生在
O C H
上的氧化反应
醛基
O
发生在
C H上的加成反应
三、乙醛的化学性质
1.氧化反应 (1)乙醛的完全燃烧:
2CH 3CHO 5O2 4CO2 4H 2O
点燃
下一页
三、乙醛的化学性质
1.氧化反应 (1)乙醛的完全燃烧: (2)催化氧化:
O - C- H
O
催化剂
O -C-O-H
2CH3CHO+O2
2CH3COOH
三、乙醛的化学性质
(3)被弱氧化剂氧化
Ag(NH3)2OH (银氨溶液)
CH3CHO + 2Ag(NH3)2OH
△
H2O + 2Ag↓+ 3NH3 + CH3COONH4
银镜反应的应用: a、 检验醛基存在,确定醛基数目
-
注意: 醛基不能写成-COH
下一页
H O H C C H H
吸 收 强 度
10
8
6
4
2
0
乙醛的核磁共振氢谱图
醛基上的氢
甲基上的氢
二、乙醛的物理性质
乙醛是( 无 )色,具有(刺激性 ) 气味的( 液 )体,密度比水 ( 小 ),沸点(20.8℃)低,( 易 ) 挥发,易燃烧,能跟水、乙醇等 互溶。
红色
沉淀
CH3COONa + Cu2O↓+ 3H2O
应用:(1)检验醛基的存在 (2)在医疗上检测尿糖
乙醛能否使酸性KMnO4溶液褪色?
能
三、乙醛的化学性质
2. 与H2加成反应(又属 还原 反应) CH3CHO+H2
第2节 乙醛
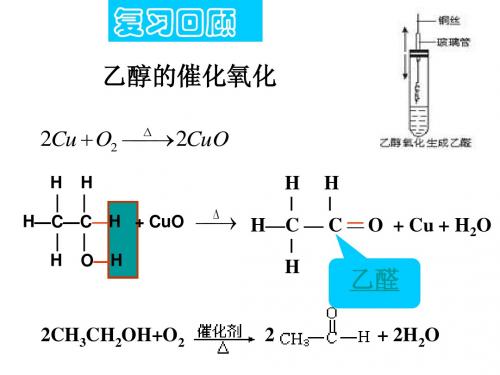
三、乙醛的化学性质
1.加成反应 加成反应
O CH3 C H +H2
O H
Ni △,通常情况下, 注意:C=O和C=C双键不同,通常情况下,乙醛不 发生加成反应。 能和HX 能和HX、X2、H2O发生加成反应。 HX、 OH O
C H H
去2H 得2H 氧化反应
沉淀恰好溶解为止,这时得到的溶液通常叫做银氨溶液。 这时得到的溶液通常叫做银氨溶液。
再滴入三滴乙醛, ② 再滴入三滴乙醛,振荡后把试管放在热水中温热 观察其现象。 观察其现象。
(4)乙醛与新制氢氧化铜反应 (4)乙醛与新制氢氧化铜反应
①在试管里加入10%的NaOH溶液2mL 在试管里加入10%的NaOH溶液2mL 10% 溶液 滴入2% 2%的 4~6滴 振荡(氢氧化钠要过量) ②滴入2%的CuSO4溶液 4~6滴,振荡(氢氧化钠要过量) 加入乙醛溶液0.5mL 加热至沸腾 0.5mL, ③加入乙醛溶液0.5mL,加热至沸腾
O CH3 C H + 2 Ag(NH3)2OH O CH3 C ONH4
-1 -1 + 1 CH3CHO + 2[Ag(NH3)2 ] + + 2OH0 0
+ 3NH3 + 2Ag + H2O
0
→
CH3COO- + NH4+ + 3NH3 + 2Ag↓+ H2O
说明: 说明: 应用: 应用:
a、生成物,一水、二银、三氨、乙酸铵 生成物,一水、二银、三氨、 b、1mol醛基 ~ 2mol Ag 1mol醛基 检验醛基存在, a、 检验醛基存在,确定醛基数目
课堂练习
4、某学生做乙醛的还原实验:量取 、某学生做乙醛的还原实验: 5mL1mol/L的CuSO4溶液 加入到盛 的 0.5mol/LNaOH溶液 溶液4mL的试管中混合, 的试管中混合, 溶液 的试管中混合 然后滴加0.5mL4%乙醛溶液,加热至沸, 乙醛溶液, 然后滴加 乙醛溶液 加热至沸, 未观察到红色沉淀, 未观察到红色沉淀,分析原因可能是 ( )
(一)乙醛的物理性质

A 10个 B 100个
C 20个 D 200个
6、 简解
M(Cu2O)=144g/mol
n(Cu2O)=14.4g÷144g/mol=0.1mol
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
——CHO ~ Cu2O
1 :1
x=0.1mol 0.1mol
CH3CHO+2Ag(NH3)2OH ——CHO ~ 2Ag
CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O
实验注意事项: (1)试管内壁应洁净。 (2)银氨溶液必须新配制,不可久置,用稀氨水且 不能过量. (防止生成易爆物质) (3)加热时不能振荡试管和摇动试管。 (4)必须用水浴加热,不能用酒精灯直接加热。
(三)乙醛的化学性质:
[ CH3COOH ]
氧化反应(加氧去氢)
3、醛基的定量分析
—CHO~2Ag n : 2n
-CHO~2Cu(OH)2~Cu2O n : 2n : n
板书设计 第五节 乙醛 醛类
一乙醛的化学性质
1、与H2加成反应(还原反应) CH3CHO+H2催化剂 CH3CH2OH
乙醛 醛类
一、乙醛:
(一)乙醛的物理性质: 无色,有刺激性气味的液体,密度比水小, 沸点20.8℃,易挥发,能和水、乙醇、 乙醚、氯仿等互溶。
(二)乙醛的结构: 结构式:
官能团醛基本身 有一个C原子, 命名时包含在主 链内。
O
H
官能团:-CHO 或-C-H 或-C=O
╳ ╳ 不能写成-COH 或-CH=O
酸性溶液或溴水
乙醛,醛类

3、制法: 、制法: ①乙烯氧化法: 乙烯氧化法:
催化剂
2CH2=CH2 + O2
加热加压
2CH3CHO
②乙炔水合法: 乙炔水合法: CH≡CH + H2O ≡
催化剂
CH3CHO
醛 类
一、醛 1、定义:烃基和醛基相连而构成的化合物。 定义:烃基和醛基相连而构成的化合物。 2、通式:RCHO(醛基碳一定在第一个位置) 通式: (醛基碳一定在第一个位置) 饱和一元醛通式: 饱和一元醛通式:CnH2n+1CHO 或 CnH2nO 饱和一元醇通式: 饱和一元醇通式:CnH2n+1OH 或 CnH2n+2O 练习:判断下列物质的类别? 练习:判断下列物质的类别? C 2H 4O
催化剂 CH3CHO + H2 → CH3CH2OH (加成反应) 加成反应) △ 催化剂 RCHO + H2 → RCH2OH △
O 催化剂 ‖ → △ CH3-C-CH3 + H2 H - H 醛和酮都能与H 醛和酮都能与 2加成生成醇
CH3-CH-CH3 H H H OH
2、氧化反应(醛基中C—H键断开,再加氧) 、氧化反应(醛基中 键断开, 键断开 再加氧) O O 被氧化 ‖ ‖ 氧化剂 羧酸 醛 R—C—H → R—C—O—H
催化剂 + n HCHO → △
OH
[
CH2— + nH2O ]n
酚醛树脂 反应机理: 甲醛断 亮键) 反应机理:①甲醛断C=O双键 (亮键) 双键 苯酚断羟基相邻的苯环上的C—H键 ②苯酚断羟基相邻的苯环上的 键 缩聚反应有小分子生成,加聚反应没有。 缩聚反应有小分子生成,加聚反应没有。 3、甲醛应用:合成酚醛塑料 电木 、防腐剂杀菌剂 电木)、 、甲醛应用:合成酚醛塑料(电木
醛的性质与应用

2%CuSO4
乙醛
5%NaOH
现象:生成砖红色沉淀
加热
NaOH+ CH3CHO + 2Cu(OH)2
CH3COONa
+ Cu2O↓+3H2O
注意: 此反应必须在碱性条件下进行
应用:
此反应也用于醛基的检验和测定
(1)检验柠檬醛中的醛基的方法是
。
(2)检验柠檬醛中的C=C的方法是
。
(3)实验操作中哪一个官能团应先检验?
(1)加入银氨溶液后,水浴加热有银镜生成,可证明醛基存在; (2)在加银氨溶液氧化-CHO后,调PH至中性再加入溴水,看是否褪色; (3)由于Br2也以能氧化-CHO,所以必须先用银氨溶液氧化-CHO,又 因为氧化后溶液为碱性,可能还有过量的银氨溶液,它也能使溴水褪色且形 成淡黄色浑浊,不利于现象的观察,所以应先酸化后再加溴水检验双键。
水浴
CH3CHO + 2Ag(NH3)2OH → CH3COONH4 + 2Ag↓+ 3NH3 + H2O
1.试管要洁净
2.水浴加热时不可振荡和摇动试管 3.银氨溶液现用现制,不能久置 试管内壁银镜的处理:稀硝酸清洗
应用:用于醛基的定性和定量检测,工业上用来制瓶胆和镜子
c.与新制氢氧化铜的反应
新制Cu(OH)2的配制方法: 操作:在试管里加入2mL 5%NaOH溶液,滴 入3~4滴2%CuSO4溶液,振荡后加入0.5mL 乙醛溶液,加热。
(1)还原 (2)氧化
a甲醛发生银镜反应
HCHOபைடு நூலகம்
4Ag
b甲醛与新制的氢氧化铜反应
乙醛

巩固练习:
1、在HCHO﹢NaOH(浓) CH3OH﹢HCOONa反应中,甲醇发生的反应是 (C ) A仅被氧化 B 仅被还原 C 既被氧化又被还原 D 即未氧化又未还原 2、乙醛与H2反应生成乙醇,此反应是( AC ) A 还原反应 B 氧化反应 C 加成反应 D 消去反应 3、可用来区分乙醛溶液和乙醇溶液的方法是( B) A 与新制CuSO4共热 B 与银氨溶液相混水浴加热 C 与新制Cu(OH)2相混 D 加入钠,生成气体的是乙醇 4、某学生用2ml 1mol/L CuSO4溶液与4ml 0.5mol/LNaOH溶液混合,再加入 0.5ml 4﹪的甲醛溶液,加热至沸腾,未见红色沉淀,失败的主要原因是 (C ) A甲醛量太少 B CuSO4 量太少 C NaOH量太少 D 加热时间短 5、对于有机物CH=C(CH3)CHO的相关叙述错误的是(CD ) A能被银氨溶液氧化 B能使溴水褪色,也能使酸性高锰酸钾溶液褪色 C适宜的条件下该有机物最多只可与1mol H2加成 D是乙醛的同系物 6、已知生成一个瓶胆需要0.108克Ag,现有一瓶醛溶液,与足量新制的 Cu(OH)2共热,可生成14.4克砖红色沉淀,若用此醛溶液制瓶胆,最多可 制得( D ) A 10个 B 100个 C 20个 D 200个
[ CH COOH ]
3
氧化反应(加氧去氢)
3、醛基的定量分析
—CHO~2Ag n : 2n -CHO~2Cu(OH) ~Cu O
2 2
n :
2n
:
n
板书设计
第五节 乙醛 醛类
一、乙醛的物理性质 二、乙醛的组成和结构 三、乙醛的化学性质 1、与H2加成反应(还原反应) CH3CHO+H2 催化剂 CH3CH2OH 2、氧化反应 催化剂 催化氧化 2CH3CHO+O2 2CH3COOH 银镜反应 CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O 与Cu(OH)2悬浊液反应CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O 氧化反应:加氧去氢 氧化:元素化合价升高 有机 无机 还原反应:加氢去氧 还原:元素化合价降低 四、乙醛的用途:有机合成材料,主要用于制取乙酸、乙醇、乙酸乙酯等
乙醛PPT课件(上课用)4

109.每个人皆有连自己都不清楚的 潜在能 力。无 论是谁 ,在千 钧一发 之际, 往往能 轻易解 决从前 认为极 不可能 解决的 事。― ―[戴尔·卡内基 ]
(2)化学性质 (与乙醛相似)
①还原反应
催化剂
R-CHO +H2 △
R-CH2 OH
②氧化反应
燃烧:
CnH2nO+
3
n 2
1
O2
点燃
nCO2+nH2O
催化氧化得羧酸:
催化剂
氧 化
镜2银R-反C应H:OR-+OCH2O△+2A2g(RN-H3C)2OOOH H△
反
R-COONH4+2Ag+3NH3+H2O
现有一化合物A,是由B、C两物质通过上述
物质的反应生成的。试根据A的结构式写出
B、C的结构式?
OH H
A:CH3-C-CH2-C=O
CH3
3、醛基的定量分析
—CHO~2Ag n : 2n
-CHO~2Cu(OH)2~Cu2O n : 2n : n
思考题
1、向乙醛溶液中滴入酸性KMnO4溶液,可观察到的现象是
104.我们最容易不吝惜的是时间, 而我们 应该最 担心的 也是时 间;因 为没有 时间的 话,我 们在世 界上什 么也不 能做。 ――[威 廉·彭]
105.人类的悲剧,就是想延长自己 的寿命 。我们 往往只 憧憬地 平线那 端的神 奇【违 禁词, 被屏蔽 】,而 忘了去 欣赏今 天窗外 正在盛 开的玫 瑰花。 ――[戴 尔·卡内 基]
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
应用: a、检验醛基的存在
b、医院里,利用这一反应原理检查尿糖
是否正常(检查葡萄糖的醛基)
讨论:如何检验醛基? 乙醛能否使酸性KMnO4、溴水褪色
6.乙醛工业制法:
(1)乙炔水化法:
催化剂
CH≡CH+H2O
CH3CHO
特点:纯度较高,但生产中易中毒,生产中耗电量大。
(2)乙烯氧化法:
催化剂
2CH2=CH2+O2
• 发生甲醛急性经口中毒后,可直接损伤人的口腔、咽喉、 食道和胃黏膜;同时产生中毒反应。轻者头晕、咳嗽、呕 吐、上腹疼痛,重者会出现昏迷、休克、肺水肿、肝肾功 能障碍,导致出血、肾衰竭和呼吸衰竭而死亡。
• 长期接触低浓度的甲醛,可引起神经系统、免疫系统、呼 吸系统和肝脏的损害,出现头晕、头痛、乏力、嗜睡、食 欲减退、视力下降等中毒症状。甲醛还容易与细胞内亲核 物质发生化学反应,形成加合物,导致DNA损伤。因此,国 际癌症机构已将甲醛列为致癌物之一。
1、物理性质:甲醛又叫蚁醛, -无色、具有强烈刺激性气味的气体 -密度比水小,与水以任意比互溶,易溶于有机物 -35%—40%的甲醛溶液,叫福尔马林,具有防腐能力。
2、分子结构 甲醛是平面分子
CH2O
O HCH
官能团是醛基
HCHO
O
可加成,易氧化
HCH
可看成有两个醛基
3、化学性质
⑴银镜反应 HCHO + 4[Ag(NH3)2]OH 水→浴 4Ag↓+ (NH4)2CO3 +
– 亚急性和慢性毒性:类似酒精中毒。表现有体重减轻、贫血、谵妄、视听 幻觉、智力丧失和精神障碍。
– 代谢:乙醛主要经呼吸道和胃肠道进人机体。 – 致畸性:高等动物致畸性实验结果阴性,但可引起植物及低等动物染色体
畸变。 – 生殖毒性:对胚胎有毒性。 – 环境危害:对环境有危害,对水体可造成污染。 – 燃爆危险:本品极度易燃,具刺激性,具致敏性。
2、银氨溶液应随配随用。 3、必须用水浴加热,不能在酒精灯上加热 4、加热时不宜震荡试管
O
O
+ CH3 C H 2 Ag(NH3)2OH
CH3 C ONH4 + 3 NH3 + 2 Ag + H2O
说明: a、银镜反应方程式的书写 :
生成物:一水、二银、三氨、乙酸铵
b、定量关系1mol醛基 ~ 2mol Ag
饱和醛、不饱和醛
醛 脂肪醛
芳香醛
一元醛 二元醛 多元醛
4、饱和一元醛的同分异构现象
除本身的碳架异构外,饱和一元醛与饱
和酮、烯醇、环醇互为同分异构体
《酮》
O R与R'均为烃基可以相同也可不同
R C R'
碳原子数相同的醛和酮是同分异构体,但是由于 酮分子中不含有醛基,所以不能发生银镜反应,也 不能和新制氢氧化铜反应。但可催化加氢成醇。
OH
H[
H
HH
H
H
]n C
H
OH
n + n HCHO
单体 单体
催化剂 水浴
OH
CH2 n+ n H2O
酚醛树脂
缩聚反应
4、应用:
(1)甲醛的水溶液叫福尔马林,具有防腐和杀菌 能力。 (2)能合成酚醛树脂 (3)在农业上制缓效肥料 (4)制氯霉素、香料、染料的原料。
三.醛: 1.醛的定义:分子里由烃基跟醛基相连而构成的 化合物。 2.醛的分类 饱和一元醛的通式:CnH2nO
6NH3 + 2H2O
1mol甲醛最多可以还原得到4molAg。
⑵与碱性的新制氢氧化铜(菲林试剂)反应 HCHO + 4Cu(OH)2 + 2NaOH 水→浴 2Cu2O↓+ Na2CO3
+ 6H2O
1mol甲醛最多可以还原得到2molCu2O。
⑶还原反应
HCHO
+
H2
Ni
加热加压
CH3OH
(4)制备酚醛树脂 酚失邻位两个氢,醛失氧成亚甲基
醛基中的碳氧双键打开,碳和氧上各加一个氢原子
HH
• 2)氧化反应
① 燃烧
点燃
CH3CHO+2.5O2
2CO2+2H2O
O
②、乙醛的催化氧化
CH3C H
O
+ 2CH3 C H O2
O 催化剂 2CH3 C OH
碳氢之间加氧,醛基变羧基
OO
2)氧化反应Ⅱ——与弱氧化剂反应
①银镜反应
实验
银氨溶液是氢氧化 二氨合银,具有弱
氧化性
沉淀恰好 消失
银氨 溶液
静置加热
银镜
AgNO3+NH3·H2O→AgOH +NH4NO3
AgOH+2NH3·H2O=[Ag(NH3)2]+ + OH-+2H2O
O
O
+ CH3 C H 2 Ag(NH3)2OH
CH3 C ONH4 + 3 NH3 + 2 Ag + H2O
实验注意事项
1、试管内壁要洁净(如有油污,得不到光亮的银, 而是黑色沉淀)
练习:写出C3H6O的所有可能同分异构体。
5.醛的化学性质
(1)加成反应
(2)氧化反应(发生银镜反应,与 新制的氢氧化铜反应…)
2CH3CHO
特点:生产流程简单,原料丰富,成本低,产率高。
。
二、甲醛
• 甲醛的毒性主要表现:低浓度的甲醛对眼、鼻和呼吸道有 刺激作用,主要症状为流泪、打喷嚏、咳嗽、结膜炎、咽 喉和支气管痉挛等;可导致皮肤过敏,出现急性皮炎,表 现为粟粒至米粒大小红色丘疹,周围皮肤潮红或轻度红肿。
• 按毒性分级,甲醛属中等毒性物质,人一次误服10~20 mL甲醛溶液即可导致死亡。
12.3家庭装潢说甲醛
一、乙醛 二、甲醛 三、醛类
一、乙醛
• 1、物理性质 –无色、有刺激性气味的液体 –密度比水小,与水以任意比互溶 –“三易”:易挥发、易燃、易溶于有机溶剂
• 2、用途 • 乙醛是有机合成工业中的重要原料,主要用来生产乙酸、
丁醇等 • 3、毒性
– 急性毒性:使动物出现明显的兴奋症状、麻醉,主要发现为肺水肿。严重 时因呼吸麻痹而死亡。
思考题:银镜反应有什么用途? 怎样清洗做过银镜反应的试管?
2)氧化反应Ⅱ——弱氧化剂氧化
②与新制Cu(OH)2(菲林试剂)反应
+ 2+
Cu
2 OH -
O
Cu(OH)2
O
弱氧化剂
+ CH3 C H 2 Cu(OH)2
+ CH3 C OH Cu2O + 2 H2O
砖红色
说明: 定量关系1mol醛基 ~ 1mol Cu2O
4、乙醛的分子结构
分子式: C2H4O
H HC
H
O CH
结构简式: CH3CHO
O
O
发生在 C H
CH3—C—H 官能团是醛
O
基
上的加成反应
CH
醛基
O 发生在 C H
上的氧化反应,在 C-H之间插入O
5、乙醛的化学性质
• 1)与氢气的加成反应
O
+ CH3 C H
H2Biblioteka 催化剂CH3 C O H
CH3CH2OH
