《第一节 元素周期表》PPT课件
合集下载
人教版高中化学必修二课件:1.1《元素周期表》(共37张PPT)

2KI+Br2 = I2+2KBr 静置后,液体分层, 氧化性: Br2 > I2
上层 无色 ,
下层 紫色 。
结论
氧化性:Cl2 > Br2 > I2 还原性:I - > Br - > Cl 小结: 氧化性:F2> Cl2> Br2>I2 还原性:F-> Cl- > Br- > I-
氧化性:F2> Cl2> Br2>I2。 Cl2可从溴、碘的盐 溶液中置换出相应的卤素单质,F2与氯、溴、 碘的盐溶液可以置换出相应的卤素单质吗?
H2+F2 = 2HF H2+Cl2 = 2HCl 暗处剧烈反应并爆炸;HF很稳定 光照或点燃反应;HCl较稳定
H2+Br2 = 2HBr
H2+I2
加热500℃ ,HBr不稳定
2HI 需不断加热,HI同时分解
■都能跟氢气反应,体现相似性 反应通式:H2 + X2 = 2HX (X= F、Cl、Br、I) ■单质氧化性减弱,体现递变性
① 除9、10、18纵行(列序)外,族序数=列序个位数。(记忆方法) ②18个纵行,只16个族;0族和第VIII族不属主族,也不属副族。
一、碱金属元素结构和化学性质的相似性和递变性
Li Na K Rb Cs
1.相似性:
最外层上都只 有一个电子 2.递变性: 核电荷数↑ 电子层数↑ 原子半径↑ 失电子能力↑ 化学性 质相似
3.请在下面的线框中用色笔画出周期表的轮廓。并标出族序数,写
出七个主族元素(可参考课本)和 0族元素的元素符号。
周期 ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB VIIB
IB IIB ⅢA ⅣA ⅤA Ⅵ AⅦA 0 种类
第一节元素周期表(共40张PPT)
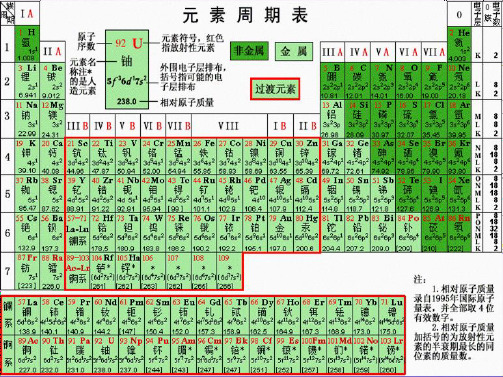
第ⅦA 族
与水缓慢反应
(2)原子结构特点 Cl2+H2O=HCl+HClO
静置后,液体分为两层。
通一过个以 12上C相质比量较同×,1点/思12考:钠和钾最的外性质层有 7个电子
静置后,液体分为两层。
和递变性。 (氧化性:Cl2 >I2)
核电荷数依次增多
不同点: 电子层数依次增多 上层无色,下层分别呈橙红色、紫红色
第一章 物质结构、元素周期律
第一节 元素周期表 一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种
编号叫原子序数。
原子序数=核电荷数=质子数=核外电子数 (一)元素周期表的编排原则
1、横行: 把电子层数相同的各种元素按原子序数递增顺序
从左到右排列。
2、纵行: 把最外层电子数相同的各种元素按电子层数递增顺序 从上而下排成。
性逐渐增强,非金属性逐渐减弱。
2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性 和递变性。
1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( B)
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
应越来越
,剧生烈成的氧化物越来越
。
最高复价杂氧化物对应水化物的碱性越来越 。
强
讨论1:Li与K 应如何保存? Li封存于固体石蜡中, 少量K保存于煤油中。
讨论2:碱金属与盐酸: 2R+2H+= 2R++H2 ↑ 讨论3:碱金属与盐溶液: 先与水反应
讨论4:Li+、Na+、K+、Rb+、Cs+也具有强还原性吗? 没有。 有较弱的氧化性。 氧化性: Li+ > Na+ > K+ > Rb+ > Cs+
人教版高中化学必修二第一章第一节 《元素周期表 》课件(共15张PPT)

B.原子的核外电子数
C.原子核内的质子数
√D.原子的中子数
1.原子序数为 x 的元素位于第IA族,那么原子序 数为 x+2 的元素肯定不会在( )
√ A.第 IA 族 B.第ⅢB族 C.第ⅢA族 D.0族
【提示】若x为氢元素,则A正确;若x为锂或钠, 则C正确;若x在第4、5、6、7周期,则B项正确。 故答案为D。
3.第ⅠA族和0族元素的原子序数
4.每周期元素的种数
一、元素周期表的结构 “三短”“四长”;“七主”“七副”“0族和Ⅷ族” 二、元素原子结构与其在周期表中位置的关系.
周期序数=电子层数 主族序数=最外层电子数
原子序数
核外电子排布
周期表中位置
1.不能作为元素周期表中元素排列顺序的依据是
A.原子的核电荷数
螺旋式元素周期表
金字塔式元素周期表
1869年,俄国化学家门捷列夫将 元素按照相对原子质量由小到大 依次排列,制出了第一张元素周 期表,这就是现代元素周期表的 雏形。
第一章 物质结构 元素周期律
第一节 元素周期表
【思考与交流】
周期表的结构
阅读教材P4、5页并结合周期表,讨论以下问题
1.元素周期表的编排原则是什么?周期表有多 少横行,多少纵行,多少族?
A.若X是氢,则Y是氦
√C.若X是氟,则W是硫
B.若Y是氦,则Z是钠 D.若Y是氟,则Z是铝
例.已知某主族元素的原子结构示意图如下,判断 其位于第几周期,第几族?
【提示】X为第4周期,第ⅠA族;Y为第5周期,第 ⅦA族。
【记一记】
周期表的结构
1.原子序数=核电荷数=质子数=核外电子数
2.周期序数=电子层数 主族序数=最外层电子数
人教版高一化学必修一第一章第一节元素周期表 课件(共20张ppt)

A.原子核内质子数 B.原子核内中子 C.原子核外电子数
3.现行元素周期表中已经列出了112种元素,其中元素种类最多的周
期是?
C
A.第4周期
B.第5周期
C.第6周期
D.第7周期
2024/1/20
16
判断下列说法是否正确
1、短周期元素全是主族元素 错,还有0族元素
2、短周期元素共有20种元素 错,短周期包括1、2、3周期,共18种元素
——32 种
主族 共 7 个主族,包括短周期和长周期元素
副族 共 7 个副族,只包括在长周期中
族
(16个) 第VIII族 包括第8、9、10 纵行
0族
稀有气体元素
2024/1/20
18
练习
推算原子序数为6,13,34,53,88,82的元素在周期表中的位置。
第6号元素: 6-2=4
第二周期第ⅣA 族。
2023最新整理收集 do something
第一节 元素周期表
化学 必修2
第一课时
元素周期表
2
1
2019年被联合国批准为“国际化学元素周 期表年”。2019年是国际纯粹与应用化学联合 会IUPAC成立100周年,同时也是化学元素周期 表发明150周年。
俄国科学家门捷列夫
2024/1/20
2
一、元素周期表的发展史
3、过渡元素全是长周期元素 正确,过渡元素还全是金属元素
4、过渡元素全是副族元素
错,还有第VIII族元素
2024/1/20
17
课堂小结:
短周期
周期
(7个) 长周期
第 1周期 第 2周期
第 3周期 第 4周期
第 5周期 第 6周期 第 7周期
3.现行元素周期表中已经列出了112种元素,其中元素种类最多的周
期是?
C
A.第4周期
B.第5周期
C.第6周期
D.第7周期
2024/1/20
16
判断下列说法是否正确
1、短周期元素全是主族元素 错,还有0族元素
2、短周期元素共有20种元素 错,短周期包括1、2、3周期,共18种元素
——32 种
主族 共 7 个主族,包括短周期和长周期元素
副族 共 7 个副族,只包括在长周期中
族
(16个) 第VIII族 包括第8、9、10 纵行
0族
稀有气体元素
2024/1/20
18
练习
推算原子序数为6,13,34,53,88,82的元素在周期表中的位置。
第6号元素: 6-2=4
第二周期第ⅣA 族。
2023最新整理收集 do something
第一节 元素周期表
化学 必修2
第一课时
元素周期表
2
1
2019年被联合国批准为“国际化学元素周 期表年”。2019年是国际纯粹与应用化学联合 会IUPAC成立100周年,同时也是化学元素周期 表发明150周年。
俄国科学家门捷列夫
2024/1/20
2
一、元素周期表的发展史
3、过渡元素全是长周期元素 正确,过渡元素还全是金属元素
4、过渡元素全是副族元素
错,还有第VIII族元素
2024/1/20
17
课堂小结:
短周期
周期
(7个) 长周期
第 1周期 第 2周期
第 3周期 第 4周期
第 5周期 第 6周期 第 7周期
《元素周期表》课件ppt课件

观察,可得 A是氮元素
B是 氧元素
C是
二、元素的性质与原子结构
1.碱金属元素
元素 元素 名称 符号
核电 荷数
最外层电子 电子
数
层数
原子结构
相同点
递变性
锂
碱
金 属
钠
元
素钾
铷
Li
3
Na
11
K
19
Rb
37
1
2
最
1
3
1
外 层 都 有
核电 原 电子 子 荷层 半 数数 径
1
4
个
逐逐 逐
电
渐渐 渐
子
增增 增
1
原子 序数
6
13 34 53 88
周期 2 3 4 5 7
族 IVA IIIA VIA VIIA IIA
课 堂 练
4.下列各表为周期表的一部分(表中为 原子序数),其中正确的是(D )
习 (A)
(B)
234
2
11
10 11
19
(C) 6
18 19
(D) 67
11 12 13
14
24
31 32
课 堂 5、元素X的原子获得3个电子或元素Y的原 练 子失去2个电子后,它们的电子层结构与 习 氖原子的电子层结构相同。X、Y两种元
H、Be 、 Al
。
族序数等于周期序数2倍的元素
有: C S
。
周期序数=族序数2倍的有: Li、Ca
。
课 堂 7. A、B、C是周期表中相邻的三种元素, 练 其中A、B是同周期,B、C是同主族。此三 习 种元素原子最外层电子数之和为17,质子数
元素周期表完整(33张)ppt课件

短周期元素中,族序数等于周期序数的元素有 ___H__、__B_e_、__A_l__,族序数等于周期序数2倍的元素有 ___C__、__S_,周期序数等于族序数2倍的元素有__L_i___。
ppt精选版
28
4.判断正误
× (1)最外层电子数为2的元素一定在第ⅡA族。( )
2He
如:氦
10Ne
√ (2)若发现了115号元素,则该元素肯定位于第7周期第ⅤA族。( 18Ar)
6个横行 6个周期
第Ⅷ族
18个纵行,16个族 ppt精选版
金属与 非金属 分界线
26
2.下列各图为元素周期表的一部分,表中的数字为原子序数, 其中M为37的是( C )
35 36
35
×
×
37 38
√
ppt精选版
27 45
×
27
3.第3周期第ⅣA族的元素是__S_i_____;Na元素的原子 序数为11,其相邻的同族元素的原子序数是__3_、__1_9__;
6
ppt精选版
螺
旋
时
钟
式
元
素
周
期
表
7
ppt精选版
塔 式 元 素 周 期 表
8
棱
台
型
元
素
周
期
ppt精选版
表
9
ppt精选版
层 式 元 素 周 期 表
10
ppt精选版
螺 旋 式 元 素 周 期 表
11
ppt精选版
透 视 式 元 素 周 期 表
12
ppt精选版
螺 旋 式 元 素 周 期 表
13
Mn= 55 Rh=104.4 Pt= 197.4
ppt精选版
28
4.判断正误
× (1)最外层电子数为2的元素一定在第ⅡA族。( )
2He
如:氦
10Ne
√ (2)若发现了115号元素,则该元素肯定位于第7周期第ⅤA族。( 18Ar)
6个横行 6个周期
第Ⅷ族
18个纵行,16个族 ppt精选版
金属与 非金属 分界线
26
2.下列各图为元素周期表的一部分,表中的数字为原子序数, 其中M为37的是( C )
35 36
35
×
×
37 38
√
ppt精选版
27 45
×
27
3.第3周期第ⅣA族的元素是__S_i_____;Na元素的原子 序数为11,其相邻的同族元素的原子序数是__3_、__1_9__;
6
ppt精选版
螺
旋
时
钟
式
元
素
周
期
表
7
ppt精选版
塔 式 元 素 周 期 表
8
棱
台
型
元
素
周
期
ppt精选版
表
9
ppt精选版
层 式 元 素 周 期 表
10
ppt精选版
螺 旋 式 元 素 周 期 表
11
ppt精选版
透 视 式 元 素 周 期 表
12
ppt精选版
螺 旋 式 元 素 周 期 表
13
Mn= 55 Rh=104.4 Pt= 197.4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2 、根据金属单质与水或者与酸反 应置换出氢的难易程度判断。 3、可以根据最高价氧化物对应的 水化物碱性的强弱判断。
我们要的最终结果是?
碱金属元素的原子的最外层都是1个电 子,性质相似,都是强还原剂 随着核电荷数的增加,碱金属元素原子 的电子层数逐渐 增多 ,原子半径逐 渐 增大,原子核对最外层电子的引力逐 渐 减弱 。失去最外层电子的能力逐渐-增强 ----,金属性(还原性)逐渐--------- 更剧烈, 轻微的 生成H2 生成H2 爆炸, 生成H2
遇水立 遇水立 即燃烧,即燃烧, 爆炸 爆炸
碱金属与水反应的通式:
2R + 2H2O
C)最高价氧化物对应的水化物都是强碱 最高价氧化物 对应的水化物的碱性?
LiOH < NaOH < KOH< RbOH< CsOH
D)元素都具有强的金属性 单质都具有强的还原性 何谓金属性? 金属性是指元素的原子失去
主族序数 = ? = ?= ?
过渡元素:
元素周期表中从
______ ⅢB 到______ ⅡB 共10个纵行,包括了 第Ⅷ族和全部副族元素,共60多种元
素,全部为金属元素,统称为过渡元
素。
注 意
注意:金属与非金属的分界线
注意:纵行的排列顺序
注意:同周期的第IIA与第IIIA元 素的原子序数的差值
锂 碱 金 属 元 素
Li
Na K
3
11 19
+3
2
1
1
1
1
2
3 4
0.152
钠
钾 铷 铯
+11
2
8
1
0.186
0.227
+19
2
8
8
1
Rb 37
Cs 55
+37
2
8
18 8
1
1 1
5 6
0.248
+55
2
8
18 18 8
1
0.265
(1)碱金属的原子结构
Li Cs
①相似性 最外层电子数都为? ②递变性(从上往下) 核电荷数逐渐? 电子层数逐渐? 原子半径依次? 原子核对最外层电子的引力?
①单质与H2化合
请阅读教材第8页中的“表格”,回答下列问题? 化合的条件、难易程度? 反应的剧烈程度? 形成的氢化物的稳定性?
②单质间的置换反应
请阅读教材第8页中的“实验1-1”,并填写第9 页的表?
写出Cl2 + NaBr(aq) Cl2 + Kl (aq) Br2 + Kl (aq) 的离子方程式? 书上咋的没说F2呢?为什么?
18 19
(C)
6 11 12 13 24
(D)
6 14 31 32
7
4.在短周期元素中,原子最外电子层只 有1个或2个电子的元素是 ( ) A.金属元素 B.稀有气体元素 C.非金属元素 D.无法确定为哪一类元素
D
5.(2013· 青岛高一检测)下列原子 结构示意图中表示的 元素与 表示的元素同主族的是( )
1、单质与氢气化合的难易以及剧烈 程度 2 、单质与氢气化合形成的气态氢 化物的稳定性 3、单质间的置换反应 4、最高价氧化物对应的水化物的 酸性强弱判断。
最后结论(元素周期表) 同主族(从上至下):最外层电子数相同 (1)核电荷数↑
(2)电子层数↑ (3)原子半径↑ (4)失电子能力↑ 得电子能力↓ (5)元素的金属性↑ 元素的非金属性↓ (6 )单质的还原性↑ 单质的氧化性↓ (7)最高价氧化物对应的水合物的碱性↑ 酸性↓ (8)与氢气化合难易程度 ↓ 生成的氢化物稳定性↓
原子结构 有何异同?
(2)碱金属元素的物理性质 ①相似性
除铯外,其余都是银白色,柔软,有延展 性,密度小,熔点低,导电、导热性强
②递变性(从锂往铯)
密度呈什么趋势?(谁反常?) 熔点逐渐? 沸点逐渐?
③个性
Cs的颜色?Li的密度?不能保存在煤油中
(3)碱金属元素的化学性质 ①相似性 ②递变性(从锂往铯)
主族
ⅠA,ⅡA等
副族
ⅠB,ⅡB等
0族
Ⅷ族
0
Ⅷ
2、族:(18个纵行16个族)
1)主族: 由短周期元素和长周期元素共同构成的族。
表示方法:在罗马数字表示的族序数后面标 “A”字。 ⅠA、ⅡA、ⅢA、…
完全由长周期元素构成的族。 2)副族:
表示方法:在罗马数字表示的族序数后面标 “B”字。 如ⅠB、ⅡB、ⅢB、…
• 按原子序数递增的顺序从左至右 排列; • 把具有相同电子层数的元素按照 原子序数递增的顺序从左至右排 列成一个横行; • 把最外层电子数相同的元素按照 电子层数的递增的顺序从上至下 排成一个纵行.
三.元素周期表的结构
1、周期:(每一横行称为一周期)。 周期序数 = ? 电子层数
它们分别位于第几周期?为什么?
周期的结构『周期』
周期的结构『周期』
周期的结构『周期』
元素周期表的结构『周期』
周期 元素 种数 分类
一
二
三
四
五
六
七 ……
2
8
8
18
18
32
短周期
长周期
不完全周期
元素周期表的结构『族』
主 族 : A
元素周期表的结构『族』
副族:B
元素周期表的结构『族』
Ⅷ族 0族
元素周期表的结构『族』
族的 分类 表示 个数
元素周期表中典型的非 金属(0族除外)是哪 一族?从上至下它们的 原子结构与性质又有何 关系呢?
二、元素的性质与原子的结构
包括哪几种元素?它们的名称与符号? 原子序数各为多少?属于第几族?
2.卤族元素(典型的非金属元素)
(1)卤素的原子结构
①相似性
最外层电子数都为? ②递变性(从上往下)
核电荷数逐渐? 电子层数逐渐? 原子半径依次? 原子核对最外层电子的引力?
的4倍,则A、B、C分别( )
O、P、Cl
大家一起画周期表
IA 0 IIA IIIA IVA VA VIA VIIA
1 H
He
2 Li Be 3 Na Mg 4 K Ca 5 6 7
IIIB IVB VB VIB VIIB VIII IB IIB
B C N O F Ne
Al Si P S Cl Ar Br Kr I Xe Rn
甲、乙是周期表中同主族的相
邻元素,若甲的原子序数为x,则乙的原
子序数不可能是(
A.x+2 C.x+8
B.x+4 D.x+18
B
)
同主族相邻元素原子序数之差可能为 2、8、18、32,
3、下列各表为周期表的一部分(表中为原 子序数),其中正确的是( ) (A )
2 3 11 19 4
(B)
D
2
10 11
电子难易程度的性质,即元素的原子越易失电
子,元素的金属性就越强。
元素的金属性?为何?
Li < Na < K < Rb < Cs
单质的还原性?
Li < Na < K < Rb < Cs
离子的氧化性?
Cs+ < Rb+< K+ < Na+ < Li+
元素金属性强弱的判断:
1、根据金属活动顺序表判断。
ⅢA~ⅦA族
0族
要求: 熟记1----20号元素的名称、 符号
应用思考:1.短周期元素中族序数与
周期数相同的元素有哪些? 2.主族序数=最高正价数,这一关 系有例外吗?请举例。
3.现在的元素周期表中,哪一列元素的 种类最多?哪一族元素形成的化合物最 多? 例1、分别指出下列元素在周期表中的位置 Be Al N Si F S Ne Ar
Li=7
?=180 Ti=50 Zr=90 V=51 Nb=94 Ta=182 W=186 Cr=52 Mo=96 Mn=55 Rh=104.4 Pt=197.44 Fe=56 Ir=198 Ru=104.4 Ni=Co=59 Pd=106.6 Os=199 Cu=63.4 Ag=108 Hg=200 Zn=65.2 Cd=112 ?=68 Ur=116 Au=197? ?=70 Sn=118 As=75 Sb=122 Bi=210 Se=79.4 Te=128? Br=80 I=127 Rb=85.4 Cs=133 Tl=204 Sr=87.6 Ba=137 Pb=207 Ce=92 La=94 Di=95 Th=118?
最后问题?
如果同主族中既有金属元素又 有非金属元素,那么,上面是 金属元素还是非金属元素呢? 性质又如何变化呢?
应用思考:1.结合同主族元素性质的
递变规律,判断H3PO4和H3AsO4酸性的 强弱;H2O和H2S的稳定性。 2.请写出两个离子反应以证明氧化性 强弱为:Cl2>Br2>I2。
第一节
1871门捷列夫(俄)的第二张周期表
拓展视野:丰富多彩的周期表
地球仪形元素周期表
八角形元素周期表
一.原子序数
排列原则 : 人们按核电荷数由小 到大的顺序给元素编号,这种序号叫 做原子序数. 原子序数与组成原子的各种微粒 间的关系:
核电荷数=核内质子数 =核外电子数=原子序数
二.元素周期表的编排原则
B
6.X、Y、Z是短周期三种元素, 它们在周期表中的位置如右图所示,
试回答:(1)X元素单质的化学式是
________。
(2)Z元素的原子结构示意图为
________。 (3)Y在元素周期表中的位置是
________________。
