GUS荧光定量分析方法
GUS报告基因

报告基因●定义报告基因 (reporter gene)是一种编码可被检测的蛋白质或酶的基因,也就是说,是一个其表达产物非常容易被鉴定的基因。
把它的编码序列和基因表达调节序列相融合形成嵌合基因,或与其它目的基因相融合,在调控序列控制下进行表达,从而利用它的表达产物来标定目的基因的表达调控,筛选得到转化体。
特征作为报告基因,在遗传选择和筛选检测方面必须具有以下几个条件:(1)已被克隆和全序列已测定;(2)表达产物在受体细胞中本不存在,即无背景,在被转染的细胞中无相似的内源性表达产物;(3)其表达产物能进行定量测定。
●应用在植物基因工程研究领域,已使用的报告基因有以下几种:胭脂碱合成酶基因(nos)、章鱼碱合成酶基因(ocs)、新霉素磷酸转移酶基因(nptⅡ)、氯霉素乙酰转移酶基因(cat)、庆大霉素转移酶基因、葡萄糖苷酶基因、荧光酶基因等。
nos、ocs这两个基因是致瘤土壤农杆菌(Agrobacterium tumfaciens)的Ti质粒特有的,对Ti质粒进行改造,用相应的致瘤农杆菌转化植物体时,如果外源基因转入植物体中,则这两种报告基因在植物根茎叶中均能表达,不受发育调控,检测时直接用转化体提取液进行纸电泳,染色后在紫外光下观察荧光即可。
nptⅡ、cat及庆大霉素转移酶基因,均为抗生素筛选基因,相关的酶可以对底物进行修饰(磷酸化、乙酰化等),从而使这些抗生素失去对植物生长的抑制作用,使得含有这些抗性基因的转化体能在含这些抗生素的筛选培养基上正常生长,也可以用转化体提取液体,外用同位素标记,放射自显影筛选转化体。
目前常用的一种报告基因是β-D-葡萄糖苷酶基因,该酶催化底物形成β-D-葡萄糖苷酸,它在植物体中几乎无背景,组织化学检测很稳定,可用分光光谱、荧光等进行检测。
荧光酶基因(luc)是1985年从北美荧火虫和叩头虫cDNA 文库中克隆出来的,该酶在有ATP、Mg2+、O2和荧光素存在下发出荧光,这样就可用转基因植物整株或部分直接用X-光片或专门仪器进行检测。
GUS活性检测实际操作步骤

2.6 GUS瞬时表达2.6.1GUS组织化学染色底物X-Gluc (5-bromo-4-chloro-3-indoly glucuronide)在GUS活性作用下水解产生无色的吲哚衍生物,此无色衍生物发生氧化二聚作用形成一种蓝色的不溶性的5,5’-二溴-4,4’-二氯靛蓝染料,使表达GUS的细胞被染成蓝色。
通过肉眼或者显微镜可明显观察到染色情况,并由此检测GUS的表达情况。
将除菌后的材料转移至微量离心管中,加适量的X-Gluc工作液,置于37 ℃黑暗条件下12 h,观察蓝色斑点的形成情况。
于显微镜下观察染色情况并拍照。
2.6.2实验统计和分析均匀取少量待检测的材料于200 μL的离心管中,每次取10 管,以每管中的蓝色比率进行计算,根据观察可分为四个计数基数分别为0、1/3、2/3、1,求平均值。
2.7 荧光分光光度法测定GUS活性原理:以4-甲基伞形酮-β-D-葡萄糖醛酸苷(4-methylumbelliferyl-β-D-glucuronide)简写为(4-MUG)为底物,Gus催化其水解为4-甲基伞形酮(4-MU)(4-methylumbelliferone)及β-D葡萄糖醛酸。
4-MU分子中的羟基解离后被365nm的光激发,产生455nm的荧光,可用荧光分光光度计定量。
2.7.1药品试剂:(1)GUS提取缓冲液(100mL):50mmol/L 磷酸钠缓冲液(pH 7.0):96 mL10mmol/L β-巯基乙醇:100 uL0.5mol/L EDTA(pH 8.0): 2 mL0.1%(V/V)Triton X-100:100 uL10% Sarcosyl (十二烷基肌氨酸钠) :0.1g(溶于上述溶液中)ddH2O up to 100mL①50mmol/L 磷酸钠缓冲液(PBS)(pH 7.0):(定容至500 mL)NaH2PO4·2H2O :1.5215 gNa2HPO4·12H2O :5.462 g②0.5mol/L EDTA(pH 8.0):在800 mL水中加入186.1 g二水乙二胺四乙酸二钠(EDTA-Na2·2H2O),在磁力搅拌器上剧烈搅拌,用NaOH调节溶解至pH值至约8.0(约需20 g NaOH颗粒),然后定容到1 L。
GUS酶活检测方法

荧光光度计定量分析转化植株GUS基因稳定表达活性试剂准备:1.GUS提取缓冲液:50mmol 磷酸钠(PH7.0)10mmol EDTAO.1% Triton X-1000.1% Sarcosyl10mmol/l β-巯基乙醇2.1mmol/1 4-MU(4-甲基伞形酮):称取19.82mg4-MU钠盐,用1ml乙醇溶解,dH2O定容至100ml。
4℃暗处可以贮存一个月。
贮存中有可能发生结晶。
3.反应缓冲液:GUS提取缓冲液中加入1mmol/l MUG(100ml 加入35.23mg),4℃可以保存2周。
4.考马新亮旒G250溶液:lOOmg考马斯亮蓝G250溶于50m1 95%乙醇中,加lOOml磷酸,dH2O定容至1L过滤后于4℃贮存。
操作步骤:新鲜的植物组织6US蛋白的提取:1.取0.1g叶片样品,用液氮研磨成粉。
2.加入3倍体积的提取缓冲液,研成匀浆。
3.4000rpm离心lOmin,收集上清液,于-20℃冰箱中保存备用。
GUS蛋白提取液蛋白含量测定:1.制作标准曲线:BSA母液(ml)H2O(ml)BSA浓度(ug/ml)0.25 4.75 1.250.5 4.5 2.51.0 4.0 5.01.5 3.5 7.52.03.0 10.02.5 2.5 12.55.0 0.0 25.0配制25ug/ml BSA母液:称取2.5mgBSA,加入0.5ml提取缓冲液,用H2O定容至lOOml。
按上表制作BSA梯度液。
从中取4ml加入lml考马斯亮蓝G-250溶液,混匀,室温下放置2min,测定595nm 的吸收值。
吸收值对蛋白浓度作图绘制标准曲线。
取植物材料GUS蛋白提取液20ul,加H2O至4ml,加入lml考马斯亮蓝,混匀,室温下放置2min。
测定595nm光吸收值根据标准曲线计算蛋白质含量。
GUS酶活反应:1. 将反应缓冲液于37℃预热。
2.取6支1.5ml离心管,各加入900ul反应终止液,编号。
实验五、GUS染色检测基因瞬时表达

问题解决能力
实验态度转变
在实验过程中遇到问题时,我学会了独立 思考和团队协作,积极寻找解决方案。
通过认真对待每一个细节,ቤተ መጻሕፍቲ ባይዱ培养了严谨 的实验态度和科学精神。
gus染色检测基因瞬时表达的未来发展方向
应用拓展
除了基础研究,gus染色检测基因瞬时表 达在医学诊断和治疗等领域也有广阔的应
用前景。
A 技术优化
01
02
03
研究基因功能
通过瞬时表达技术可以快 速检测特定基因的功能, 了解其在细胞中的作用。
药物筛选
利用瞬时表达技术筛选对 特定基因有调控作用的候 选药物。
基因治疗
瞬时表达技术可用于基因 治疗的研究,为疾病治疗 提供新思路。
02 实验原理
gus染色检测基因瞬时表达的生物学基础
基因瞬时表达
基因瞬时表达是指通过转录和翻译在 短时间内产生大量蛋白质的过程。在 植物和某些微生物中,瞬时表达常用 于研究基因的功能和表达调控。
学习gus染色检测基因瞬时表达的方法
准备实验材料
X-Gluc、缓冲液、DNA转染试 剂、细胞培养板等。
GUS染色
将转染后的细胞用X-Gluc染色 ,观察蓝色产物。
转染DNA
将目的DNA与转染试剂混合, 加入细胞培养板中,使DNA瞬 时表达。
结果分析
根据蓝色产物的多少判断GUS 基因的瞬时表达量。
掌握gus染色检测基因瞬时表达的应用
显色反应
在适宜的温度和pH条件下,GUS酶 催化底物水解,产生蓝色产物。
结果观察
通过观察蓝色产物的生成情况,判断 目的基因是否成功瞬时表达。
03 实验步骤
准备实验材料和试剂
准备所需的gus基因瞬时表 达载体。
烟草转基因及gus染色的方法

转基因烟草的方法 1.接种单菌落于加有KAN,RIF和STR的3ML液体YEB培养基中,28度培养2天,转接与20ML YEB液体培养基中,28度继续培养至OD600=0.6-0.8。
2.菌液经4000RPM离心10分钟,倒掉上清液,用MS液体培养基重悬菌体,调OD600=0.6-0.8 3.取无菌烟草叶片,去除边缘,主叶脉,剪成大小约1CM*1CM的小块,浸泡在菌体悬浮液中,2-3分钟,期间不断轻轻摇晃。
4.取出叶片,用灭菌滤纸吸取表面菌液,将叶片至于共培养培养基上(MS+6-BA 1MG/L,NAA 0.1MG/L)28度黑暗共培养2-3天。
5.将共培养后的叶片在无菌水和加入羧苄青霉素的无菌水中清洗一遍,灭菌滤纸吸取多余水分,然后转到分化选择培养基上(MS+6-BA 1MG/L,NAA 0.1MG/L,潮霉素10-60MG/L,CARB 500MG/L)25度光照培养,每两周更换一次培养基,直至分化出愈伤组织,进而分化出不定芽。
6.将长至2CM以上的不定芽切下并转移到生根培养基上(1/2MS+NAA 0.1MG/L,潮霉素20-100MG/L,CARB 500MG/L)诱导生根。
7.将一次生根的再生苗切取根尖,接种到新的生根培养基上,诱导生根,不能生根的芽丢掉。
叶盘法转基因烟草技术一.实验目的:学习并了解叶盘法转基因烟草的技术流程。
二. 实验原理:土壤中的农杆菌是一种革兰氏阴性菌,能够感染植物的受伤部位。
农杆菌中有一种环形的Ti质粒,Ti质粒最重要的两个区域为T-DNA区和毒性区,T-DNA是Ti质粒上唯一能够整合到植物染色体上的序列,而毒性区上一系列则帮助T-DNA区整合到植物的染色体上。
土壤农杆菌转化植物的常用方法是叶盘法。
这种转基因方法十分简单,一般是将植物的叶片切成小圆片,用农杆菌感染后共培养2-4天,而后转移到加有选择压的分化培养基上分化出芽,在MS培养基上生根后,再生出完整的植株。
实验转基因生物的GUS检测

编辑课件
8
gus基因简介
• gus基因是目前常用的一种报告基因,是β-D- 葡 萄糖苷酸酶(gus)基因,其表达产物β-葡萄糖苷酸酶
(GUS)能催化裂解一系列的β-葡萄糖苷酸 ,它可以 将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(X-Gluc) 分解为蓝色的物质,也可以将4-甲基-伞形花酮-β-D葡萄糖苷酯(4-MUG)分解为蓝色物质。 其检测方法简 单、快速、灵敏、稳定,且背景活性低。
• gus基因的最大优点是它能测定外源基因表达的具体
细胞和组织部位,这是其它报告基因所不能及的。
编辑课件
9
药品配方
• 1)X-Gluc母液:X-Gluc,用N-N-二甲基酰胺 (DMF)配成20mM的贮存液,分装成每管100µL,保 存于-20℃。
• 2)X-Gluc基液(50mM PBS, pH7.0)。 • 配制方法:50mM NaH2PO4·0.78g/100ml;50mM
• 37℃培养箱中温育1小时至过夜; • 将浸染过的试材转入70%或95%乙醇中脱
色2-3次(除去叶绿素),至阴性对照材料 呈白色为止。 • 观察结果。
编辑课件
12
编辑课件
13
编辑课件
14
编辑课件
1
材料: 转化的植物组织、器官、原生质体、 种子的胚及萌发的幼苗等。 非转化的相同材料(阴性对照)。
试剂: 5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯 (X-Gluc) ;N-N-二甲基甲酰胺(DMF) ; NaH2PO4; Na2HPO4 ; Na2EDTA ;Triton100; K3 [Fe(CN) 6] (铁氰化钾);K4 [Fe(CN) 6] (亚铁氰化钾)
protein)等.
GUS活性的定量检测

GUS活性的定量检测目的:定量检测转基因植株中报告基因GUS的表达水平用途:比较某个启动子在不同组织中的表达强度,比较不同启动子在同一组织中的表达强度。
试剂:①磷酸缓冲液母液:0.2M Na2HPO4:71.64g/L Na2HPO4·12H2O0.2M NaH2PO4:31.21g/L NaH2PO4·2H2O②GUS抽提液(1L):PH=7.00.2M Na2HPO4152.5mL0.2M NaH2PO497.5mL14.3M β-ME 700uLNa2-EDTA·2H2O 3.72gTriton-X 100 1mL③10mM 4-MUG(10×):105.6mg 4-MUG溶于30mL GUS抽提液中,4℃避光保存。
(注意:存放时间越久本底信号越强,尽量现配现用)。
④0.2M Na2CO3反应终止液(1L):21.2g Na2CO3溶于1000mL ddH2O。
⑤BSA母液(4ug/ul):40mgBSA溶于10mL ddH2O⑥4-MU母液(10mM):17.6mg 4-MU溶于10mL 0.2M Na2CO3中,4℃避光保存。
⑦Protein Assay Buffer(5×,Bio-Rad cat.no.500-0006):使用前要用ddH2O稀释成1×工作液仪器及用品:酶标仪TECAN Infinite M200酶标板(Nunclon 96 Flat Transparent和Greiner 96 Flat Black)操作步骤与注意事项:1.材料于液氮中研磨成粉末,取适量粉末加入3倍体积的GUS抽提液,充分混匀,置冰上。
(注意,尽量保证每个样品所取的粉末量都比较一致,这样抽提出来的总蛋白浓度比较接近,方便后续操作。
)2.10000g 4℃离心10min,上清液转移到新的1.5mL离心管,则得到总蛋白粗提液(可于4度短期保存或于-70℃长期保存;但不要存于-20℃,该温度下GUS不稳定)。
荧光光度计定量分析转化植株GUS基因稳定表达活性

荧光光度计定量分析转化植株GUS基因稳定表达活性一、试剂准备:1.GUS提取缓冲液:●50mmol 磷酸钠(PH7.0)●10mmol EDTA●0.1% Triton X-100●0.1% Sarcosyl●10mmol/l β-巯基乙醇2.1mmol/L 4-MU(4-甲基伞形酮):称取19.82mg4-MU钠盐,用1ml乙醇溶解,dH2O定容至100ml。
4℃暗处可以贮存一个月。
贮存中有可能发生结晶。
3.反应缓冲液:GUS提取缓冲液中加入1mmol/l MUG(100ml 加入35.23mg),4℃可以保存2周。
4.考马新亮旒G250溶液:lOOmg考马斯亮蓝G250溶于50m1 95%乙醇中,加lOOml磷酸,dH2O定容至1L过滤后于4℃贮存。
二、操作步骤:新鲜的植物组织6US蛋白的提取:A.取0.1g叶片样品,用液氮研磨成粉。
B.2.加入3倍体积的提取缓冲液,研成匀浆。
C.3.4000rpm离心lOmin,收集上清液,于-20℃冰箱中保存备用。
GUS蛋白提取液蛋白含量测定:1.制作标准曲线:BSA母液(ml)H2O(ml)BSA浓度(ug/ml)0.25 4.75 1.250.5 4.5 2.51.0 4.0 5.01.5 3.5 7.52.03.0 10.02.5 2.5 12.55.0 0.0 25.0配制25ug/ml BSA母液:称取2.5mgBSA,加入0.5ml提取缓冲液,用H2O定容至lOOml。
按上表制作BSA梯度液。
从中取4ml加入lml考马斯亮蓝G-250溶液,混匀,室温下放置2min,测定595nm 的吸收值。
吸收值对蛋白浓度作图绘制标准曲线。
取植物材料GUS蛋白提取液20ul,加H2O至4ml,加入lml考马斯亮蓝,混匀,室温下放置2min。
测定595nm光吸收值根据标准曲线计算蛋白质含量。
GUS酶活反应:1. 将反应缓冲液于37℃预热。
2.取6支1.5ml离心管,各加入900ul反应终止液,编号。
GUS酶活性定量检测——Glomax检测仪
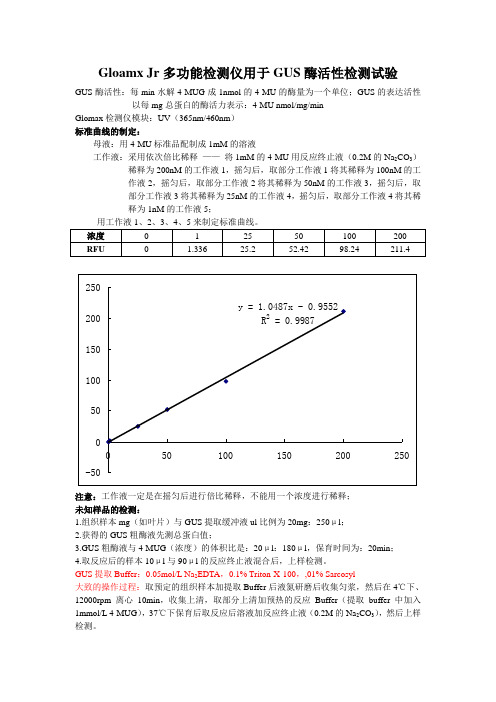
Gloamx Jr多功能检测仪用于GUS酶活性检测试验
GUS酶活性:每min水解4-MUG成1nmol的4-MU的酶量为一个单位;GUS的表达活性以每mg总蛋白的酶活力表示:4-MU nmol/mg/min
Glomax检测仪模块:UV(365nm/460nm)
标准曲线的制定:
母液:用4-MU标准品配制成1mM的溶液
工作液:采用依次倍比稀释——将1mM的4-MU用反应终止液(0.2M的Na2CO3)稀释为200nM的工作液1,摇匀后,取部分工作液1将其稀释为100nM的工
作液2,摇匀后,取部分工作液2将其稀释为50nM的工作液3,摇匀后,取
部分工作液3将其稀释为25nM的工作液4,摇匀后,取部分工作液4将其稀
释为1nM的工作液5;
注意:工作液一定是在摇匀后进行倍比稀释,不能用一个浓度进行稀释;
未知样品的检测:
1.组织样本mg(如叶片)与GUS提取缓冲液ul比例为20mg:250μl;
2.获得的GUS粗酶液先测总蛋白值;
3.GUS粗酶液与4-MUG(浓度)的体积比是:20μl:180μl,保育时间为:20min;
4.取反应后的样本10μl与90μl的反应终止液混合后,上样检测。
GUS提取Buffer:0.05mol/L Na2EDTA,0.1% Triton-X-100,,01% Sarcosyl
大致的操作过程:取预定的组织样本加提取Buffer后液氮研磨后收集匀浆,然后在4℃下、12000rpm离心10min,收集上清,取部分上清加预热的反应Buffer(提取buffer中加入1mmol/L 4-MUG),37℃下保育后取反应后溶液加反应终止液(0.2M的Na2CO3),然后上样检测。
GUS活力检测

GUS活性的荧光检测(protocal)(2007-12-12 11:52:05)转载分类:核酸技术3.4.25.2 GUS活性的荧光检测3.4.25.2.1蛋白的提取及浓度测定(1)取100mg植物样品在液氮中研磨成粉末,加入3倍体积的GUS提取缓冲液,再研磨2min,将粉末装入1.5m1离心管,摇动5min, 12,000rpm, 40C离心10min,取上清4℃保存备用。
(2)蛋白标准曲线的制作取配制的25ugfmIBSA母液,按下表进行BSA梯度稀释:从中取4ml加入lml考马斯亮蓝染液,混匀,室温放置2min,测定595nm的光吸收值,制作标准曲线。
(3)样品蛋白含量测定取蛋白上清Sul,加水至4ml,加入I ml考马斯亮蓝染液,混匀,室温放置2min,测定595nm的光吸收值,根据蛋白标准曲线计算样品蛋白含量。
3.4.25.2.2 GUS荧光检测(1)制作4-MU标准:配制4-MU梯度浓度液(由反应终止液配制)l0umol/I,2.5umol/I, lumol/I,500nmol/I, 100nmol/l, 10nmol/I:在激发光365nm,发射光455nm,狭缝3nm条件下,测定各样品的荧光值,绘制标准曲线。
(2)酶反应:取40u1蛋白上清,加入400ul反应缓冲液里(37℃预热),立即取100u1加入到900u1反应终止液(0时的空白对照),37'C温浴,严格定时,10min, 30min和60min 各取100ul,加入900u1反应终止液。
测定荧光值。
根据标准曲线,计算各样品酶活。
GUS提取缓冲液:50mM磷酸钠缓冲液(PH7.0), lOmMEDTA, 0.1% Triton X-100, O.I%SDS,l Ommp一疏基乙醇,4℃保存。
反应缓冲液:GUS提取缓冲液,加入1MM MUG, 40C避光保存,可保存2周。
反应终止液:0.2M Na2CO3,考马斯亮蓝G250溶液:考马斯亮蓝G250 10mg, 95%乙醇5m1, H3PO4IOml,定容至l00ml,过滤后4℃保存。
GUS荧光定量分析方法
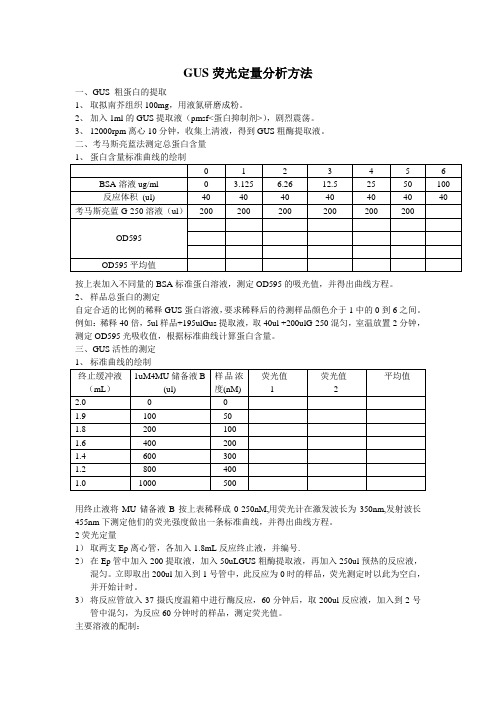
GUS荧光定量分析方法一、GUS 粗蛋白的提取1、取拟南芥组织100mg,用液氮研磨成粉。
2、加入1ml的GUS提取液(pmsf<蛋白抑制剂>),剧烈震荡。
3、12000rpm离心10分钟,收集上清液,得到GUS粗酶提取液。
二、考马斯亮蓝法测定总蛋白含量按上表加入不同量的BSA标准蛋白溶液,测定OD595的吸光值,并得出曲线方程。
2、样品总蛋白的测定自定合适的比例的稀释GUS蛋白溶液,要求稀释后的待测样品颜色介于1中的0到6之间。
例如:稀释40倍,5ul样品+195ulGus提取液,取40ul +200ulG-250混匀,室温放置2分钟,测定OD595光吸收值,根据标准曲线计算蛋白含量。
三、GUS活性的测定用终止液将MU储备液B按上表稀释成0-250nM,用荧光计在激发波长为350nm,发射波长455nm下测定他们的荧光强度做出一条标准曲线,并得出曲线方程。
2荧光定量1)取两支Ep离心管,各加入1.8mL反应终止液,并编号.2)在Ep管中加入200提取液,加入50uLGUS粗酶提取液,再加入250ul预热的反应液,混匀。
立即取出200ul加入到1号管中,此反应为0时的样品,荧光测定时以此为空白,并开始计时。
3)将反应管放入37摄氏度温箱中进行酶反应,60分钟后,取200ul反应液,加入到2号管中混匀,为反应60分钟时的样品,测定荧光值。
主要溶液的配制:1、GUS提取缓冲液:1)0.1M磷酸钠缓冲液(pH7.0)50mL:0.1M磷酸钠缓冲液(pH7.0):557mL0.1mol/LNa2HPO4+42.3mL1mol/L NaH2PO4定容到1000mL(35.814gNaHPO4.12H2O(358.14)定容到1000mL;15.6g NaH2PO4.2H2O(156.01)定容到100Ml)2) 0.5M Na2EDTA (pH8.0) 2.00mL:9.31gEDTA加水剧烈搅拌,加入约1g NaOH, 定容到50 mL.3) 30% 十二烷基肌氨酸钠0.33 mL:1.5g加水定容到504)10% Triton X-100 1 mL:1 mL Triton X-100 加9 mL水混匀5)β-巯基乙醇0.07-0.10 mL(马琳论文里面有)6)甲醇 20ml(网上有的文献里有)蒸馏水定容至100mL。
GUS 活性检测(总)
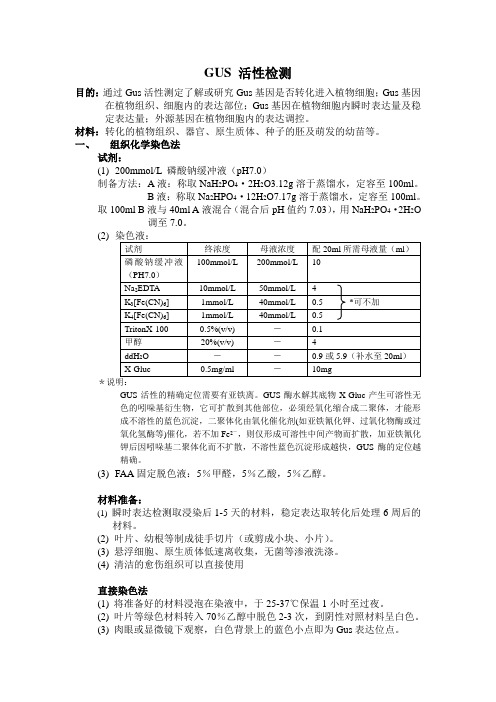
GUS 活性检测目的:通过Gus活性测定了解或研究Gus基因是否转化进入植物细胞;Gus基因在植物组织、细胞内的表达部位;Gus基因在植物细胞内瞬时表达量及稳定表达量;外源基因在植物细胞内的表达调控。
材料:转化的植物组织、器官、原生质体、种子的胚及萌发的幼苗等。
一、组织化学染色法试剂:(1)200mmol/L 磷酸钠缓冲液(pH7.0)制备方法:A液:称取NaH2PO4·2H2O3.12g溶于蒸馏水,定容至100ml。
B液:称取Na2HPO4·12H2O7.17g溶于蒸馏水,定容至100ml。
取100ml B液与40ml A液混合(混合后pH值约7.03),用NaH2PO4·2H2O 调至7.0。
(2)*说明:GUS活性的精确定位需要有亚铁离。
GUS酶水解其底物X-Gluc产生可溶性无色的吲哚基衍生物,它可扩散到其他部位,必须经氧化缩合成二聚体,才能形成不溶性的蓝色沉淀,二聚体化由氧化催化剂(如亚铁氰化钾、过氧化物酶或过氧化氢酶等)催化,若不加Fe2-,则仅形成可溶性中间产物而扩散,加亚铁氰化钾后因吲哚基二聚体化而不扩散,不溶性蓝色沉淀形成越快,GUS酶的定位越精确。
(3)FAA固定脱色液:5%甲醛,5%乙酸,5%乙醇。
材料准备:(1) 瞬时表达检测取浸染后1-5天的材料,稳定表达取转化后处理6周后的材料。
(2) 叶片、幼根等制成徒手切片(或剪成小块、小片)。
(3) 悬浮细胞、原生质体低速离收集,无菌等渗液洗涤。
(4) 清洁的愈伤组织可以直接使用直接染色法(1)将准备好的材料浸泡在染液中,于25-37℃保温1小时至过夜。
(2)叶片等绿色材料转入70%乙醇中脱色2-3次,到阴性对照材料呈白色。
(3)肉眼或显微镜下观察,白色背景上的蓝色小点即为Gus表达位点。
固定染色法(1)将材料浸入固定液中,必要时可抽真空1分钟,室温下轻摇30-60分钟。
(2)取出材料,用磷酸钠缓冲液漂洗3-4次。
GUS活性的定量检测

GUS活性的定量检测目的:定量检测转基因植株中报告基因GUS的表达水平用途:比较某个启动子在不同组织中的表达强度,比较不同启动子在同一组织中的表达强度。
试剂:①磷酸缓冲液母液:0.2M Na2HPO4:71.64g/L Na2HPO4·12H2O0.2M NaH2PO4:31.21g/L NaH2PO4·2H2O②GUS抽提液(1L):PH=7.00.2M Na2HPO4152.5mL0.2M NaH2PO497.5mL14.3M β-ME 700uLNa2-EDTA·2H2O 3.72gTriton-X 100 1mL③10mM 4-MUG(10×):105.6mg 4-MUG溶于30mL GUS抽提液中,4℃避光保存。
(注意:存放时间越久本底信号越强,尽量现配现用)。
④0.2M Na2CO3反应终止液(1L):21.2g Na2CO3溶于1000mL ddH2O。
⑤BSA母液(4ug/ul):40mgBSA溶于10mL ddH2O⑥4-MU母液(10mM):17.6mg 4-MU溶于10mL 0.2M Na2CO3中,4℃避光保存。
⑦Protein Assay Buffer(5×,Bio-Rad cat.no.500-0006):使用前要用ddH2O稀释成1×工作液仪器及用品:酶标仪TECAN Infinite M200酶标板(Nunclon 96 Flat Transparent和Greiner 96 Flat Black)操作步骤与注意事项:1.材料于液氮中研磨成粉末,取适量粉末加入3倍体积的GUS抽提液,充分混匀,置冰上。
(注意,尽量保证每个样品所取的粉末量都比较一致,这样抽提出来的总蛋白浓度比较接近,方便后续操作。
)2.10000g 4℃离心10min,上清液转移到新的1.5mL离心管,则得到总蛋白粗提液(可于4度短期保存或于-70℃长期保存;但不要存于-20℃,该温度下GUS不稳定)。
GUS酶活性测定

实验注意事项: 4-MU梯度浓度液的配置时需要根据预估样品的浓度范围来确定,要求 是4-MU的浓度梯度要跨过样品的浓度范围。 预估时可以参考一下数据: 0.05nmol的MU的荧光强度是843; 0.1nmol是1968; 1.5nmol是56247
实验中涉及到的溶液的配置
1、Extraction buffer :
0.1M 磷酸缓冲液(PH7.0) 10% SDS 0.5M EDTA(PH8.0) Triton X-100 β-巯基乙醇 ddH2O 50ml 1ml 2ml 100ul 100ul up to 100ml coomassie blue G250 95% 乙醇 磷酸 ddH2O 20mg 10ml 20ml up to 200ml
蛋白标准曲线的制作
• BSA母液(100ug/ml),分别吸取:0ul, 10ul, 20ul, 30ul, 40ul, 50ul, 60ul, 70ul, 80ul, 90ul, 100ul,150ul, 200ul, 300ul, 400ul.用水补到1ml,加入3ml的G250.反 应半小时后比色.(BSA的质量分别为0 ug,1 ug ,2 ug ,…….15 ug,20 ug ,30 ug ,40ug) • 以吸光度-蛋白含量做标准曲线图。
2、GUS assay buffer :
称取22mg 4-MUG于50ml的 GUS extraction buffer中,4℃ 保存。
GUS 基因定量试剂盒使用说明

GUS 报告基因定量检测试剂盒GUS定量试剂盒储存:-20℃保存,一年有效。
华越洋GUS定量试剂盒组成:提取液50 mL 100 mL4-MU(1mM) 1 mL 1 mLx24-MUG 底物液10 mL 10 mLx2终止液100 mLx2 100 mLx4GUS定量试剂盒说明:GUS 能与4-MUG 反应产生荧光物质4-MU。
4-MU 的激发波长为365 nm,发射波长为456nm。
其含量可由荧光分光光度计测出。
因此,我们可以根据单位质量的植物总蛋自在单位时间内产生的荧光物质的多少来定量的检测GUS 的含量。
荧光分光光度计测定的是相对值,因此用荧光分光光度计测定时必须用标准物4-MU 进行校准。
GUS定量试剂盒使用方法:一、植物总蛋白提取1.取新鲜的植物组织100 mg 左右,用液氮将材料急速冷冻,然后采用液氮研磨的方式在研钵里磨碎组织。
如果无法立即研磨,可以先将液氮冷冻处理的植物组织储存于-80 ℃冰箱。
2.将研磨破碎的组织转到EP 管里,并竟即加入1mL的提取演,充分混匀。
3. 12 000 rpm,4 ℃离心10 min。
4.将上清转至另一洁净的EP 管,12,000 rpm,4℃离心10 min.5.所得上清即为蛋白提取物,可以置于冰上待用,或者-80 ℃保存。
二、蛋白浓度的测定(Bradford 法)参照本公司产品Bradford 蛋白浓度测定试剂盒(华越洋右手)使用说明书。
三、标准溶液配制用终止液稀释4-MU,建议稀释至浓度1-10uM,即为标准液(避光放置)。
用于标准曲线绘制。
四、GUS 表达水平的定量测定1.在3个1mL的离心管中分别加入900 uL 的终止液,置于37 ℃温浴。
2. 取150 uL 蛋白提取物,加入150 uL 4-MUG 底物液,37 ℃温浴,即为反应液。
3.分别在10 min,20 min,30 min 时,从上述反应体系中,取100uL加入步骤1中温浴的900 uL终止液中,避光放置直至测量结束。
GUS组织化学染色

GUS组织化学染⾊试剂:GUS染⾊液(200ml):X-Gluc 100mg; 50mM k4[Fe(CN)6] 2 ml; 50 mM k3[Fe(CN)6] 2 ml;0.5 mol/L EDTA (pH 8.0) 4 ml; 甲醇 5ml;Triton X-100 0.2ml; 加⼊50mM 磷酸缓冲液(pH 7.0)补⾜200ml;⽆菌膜过滤。
X-Gluc:100mg溶于1ml DMF,保存于4℃50 mM k3[Fe(CN)6]: 0.824g溶于50ml ddH2O,避光保存于4℃50 mM k4[Fe(CN)6]: 1.056g溶于50ml ddH2O,避光保存于4℃50mM 磷酸缓冲液(pH 7.0):先配:0.2M Na2HPO4:称取71.632g Na2HPO4-12H2O,溶于1000ml ⽔中,0.2 M NaH2PO4:称取31.2g NaH2PO4-2H2O,溶于1000ml ⽔中,然后:62ml的0.2M Na2HPO4与38ml的0.2 M NaH2PO4混合,加蒸馏⽔稀释⾄400ml。
⼆、实验步骤:1. 取新鲜烟草叶⽚组织于90%丙酮中固定20 min;2. 弃丙酮,加⼊适量GUS染⾊液(不含X-Gluc)润洗⼀遍;3. 加⼊GUS染⾊液,真空处理20 min;4. 37℃孵育24h;5. ⽆⽔⼄醇浸泡24h,除去叶绿素;6. 观察结果并照相。
烟草叶⽚GUS活性的荧光定量测定MrBAS基因启动⼦转基因烟草叶⽚组织器官的GUS活性定量分析以GUS蛋⽩荧光测定完成,表2 GUS蛋⽩提取缓冲液TabIe.2 GUS protein extraction buffer组分母液体积50 mmol/L 磷酸缓冲液(pH 7.0) 0.1 mol/L 磷酸缓冲液 (pH 7.0) 50 mL10 mmol/L Na2-EDTA 0.5 mol/L EDTA (pH 8.0) 2 mL10 mmol/L β-巯基⼄醇β-巯基⼄醇 100µl0.1% TritonX-100 Triton X-100 100µl0.1% SDS 10% SDS 1 mLddH20 补⾜ 100 mL烟草叶⽚总蛋⽩的提取1) 取超低温冰箱保存的样品材料并⽤液氮充分研磨成粉末,分别称取1.2g样品组织于离⼼管中;2) 向离⼼管中分别加⼊1mL GUS蛋⽩提取缓冲液,涡旋混匀,冰上放置2h⾄沉淀;3) 4℃ 6000 r/min 离⼼ 20min,收集上清液;4) 滤纸过滤,去除植物组织残渣;5)吸取200µl上清液,保存在4℃冰箱中待⽤ (考虑到GUS蛋⽩的活性,时间以⼀周内为宜)。
最新整理GUS染色整理版知识讲解

1.GUS报告基因的定性检测GUS(β- 葡萄糖苷酸酶)能与显色底物X-gluc 反应,显现蓝色,因而可以通过组织化学染色定性研究GUS的表达水平和表达模式。
GUS 染色的稳定性好,组织定位精确,成为在植物中运用很广的报道基因。
gus基因是目前常用的一种报告基因,是β-D-葡萄糖苷酸酶(gus)基因,其表达产物β-葡萄糖苷酸酶(GUS)能催化裂解一系列的β-葡萄糖苷酸,它可以将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(X-Gluc)分解为蓝色的物质,也可以将4-甲基-伞形花酮-β-D-葡萄糖苷酯(4-MUG)分解为蓝色物质。
其检测方法简单、快速、灵敏、稳定,且背景活性低。
1.1 GUS染色底物的配制配制方法:将7.800g NaH2PO4溶于水,定容至100ml。
实验步骤:1.将准备好的拟南芥植株放入小EP管中,加入染色液浸没试材,封好盖子;可用抽真空,5min,200mbr。
2.37℃培养箱中温育12h,或有蓝色出现,水中洗涤一次;3.将浸染过的试材转入70%(或95%乙醇)中脱色2-3次(除去叶绿素),每隔1小时更换一次脱色液,至阴性对照材料呈白色为止。
(漂洗:先后用50%,70%,100%的乙醇漂洗样品,每次浸泡5分钟。
脱色:加入100%乙醇浸泡直至完全脱色。
)4.立体显微镜观察拍照。
2.GUS报导基因的定量检测GUS 能与底物MUG(分子量352.3,4-甲基伞型酮-β-葡萄糖醛酸苷,4-methylumbelliferylβ-D-glucuronide)反应产生荧光物质MU(分子量198.2,4-甲基伞型酮,4-methylumbelliferone)。
MU的激发波长为365nm,发射波长为456nm,其含量可由荧光分光光度计测出。
因此,我们可以根据单位质量的植物总蛋白在单位时间内产生的荧光物质的多少来定量的检测GUS含量。
2.1 试剂配制1) 1mol/L Na2HPO4溶液:35.814g Na2HPO4溶于100ml水。
gus基因检测

gus基因检测gus基因检测gus基因就是转β-葡糖醛酸酶基因该基因产物为GUS 蛋白质,相当稳定而不易降解,并为一水解酵素,有简易的测定方法;且可使用市售的基质(substrate) 在原位(in situ) 显现出酵素的活性,以肉眼即可检测其产物,非常方便。
gus基因存在于E.coli等一些细菌基因组内,编码β-葡萄糖苷酸酶。
β-葡萄糖苷酸酶是一个水解酶,以β-葡萄糖苷酸酯类物质为底物,其反应产物可用多种方法检测出来。
由于绝大多数植物没有检测到葡萄糖苷酸酶的背景活性,因此这个基因被广泛应用于基因调控的研究中。
根据地gus基因检测所用的底物不同,可以选择三种检测方法:组织化学法、分光光度法和荧光法(灵感度为分光光度检测法最高),其中最为常用的是组织化学法。
组织化学法检测以5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(X-Gluc)作为反应底物。
将被检材料用含有底物的缓冲液浸泡,若组织细胞发生了解gus基因的转化,并表达出Gus,在适宜的条件下,该酶就可将X-Gluc水解生成蓝色产物,这是由其初始产物经氧化二聚作用于形成的靛蓝染料,它使具Gus活性的部位或位点呈现蓝色,用肉眼或在显微镜下可看到,且在一定程度下根据染色深浅可反映出Gus活性。
因此利用该方法可观察到外源基因在特定器官、组织,甚至单个细胞内的表达情况。
作用原理:gus基因表达出GUS,在适宜条件下该酶可将X-Gluc 水解生成蓝色物质,初始产物并不带颜色,为无色的吲哚衍生物,后经氧化二聚作用形成5,5’-二溴-4,4’-二氯靛蓝染料,此靛蓝染料使具有Gus活性的部位或位点呈现蓝色,可用肉眼或在显微镜下观察到。
GusA(uidA)基因编码β一葡糖苷酸酶基因。
它是一种催化葡糖苷酸糖苷键水解的水解酶,其中很多水解产物具有发色团或形成荧光物质,因此可以用分光光度计、荧光剂和组织化学法对其活性进行定性或空间定位分析。
GusA基因由于具有明显区别于受体细胞遗传背景的选择标记基因,因此可以用来检测组装的嵌合基因在导人细胞后是否具有功能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
GUS荧光定量分析方法
一、GUS 粗蛋白的提取
1、取拟南芥组织100mg,用液氮研磨成粉。
2、加入1ml的GUS提取液(pmsf<蛋白抑制剂>),剧烈震荡。
3、12000rpm离心10分钟,收集上清液,得到GUS粗酶提取液。
二、考马斯亮蓝法测定总蛋白含量
按上表加入不同量的BSA标准蛋白溶液,测定OD595的吸光值,并得出曲线方程。
2、样品总蛋白的测定
自定合适的比例的稀释GUS蛋白溶液,要求稀释后的待测样品颜色介于1中的0到6之间。
例如:稀释40倍,5ul样品+195ulGus提取液,取40ul +200ulG-250混匀,室温放置2分钟,测定OD595光吸收值,根据标准曲线计算蛋白含量。
三、GUS活性的测定
用终止液将MU储备液B按上表稀释成0-250nM,用荧光计在激发波长为350nm,发射波长455nm下测定他们的荧光强度做出一条标准曲线,并得出曲线方程。
2荧光定量
1)取两支Ep离心管,各加入1.8mL反应终止液,并编号.
2)在Ep管中加入200提取液,加入50uLGUS粗酶提取液,再加入250ul预热的反应液,混匀。
立即取出200ul加入到1号管中,此反应为0时的样品,荧光测定时以此为空白,并开始计时。
3)将反应管放入37摄氏度温箱中进行酶反应,60分钟后,取200ul反应液,加入到2号管中混匀,为反应60分钟时的样品,测定荧光值。
主要溶液的配制:
1、GUS提取缓冲液:
1)0.1M磷酸钠缓冲液(pH7.0)50mL:
0.1M磷酸钠缓冲液(pH7.0):557mL0.1mol/LNa2HPO4+42.3mL1mol/L NaH2PO4定容到1000mL
(35.814gNaHPO4.12H2O(358.14)定容到1000mL;15.6g NaH2PO4.2H2O(156.01)定容到100Ml)
2) 0.5M Na2EDTA (pH8.0) 2.00mL:
9.31gEDTA加水剧烈搅拌,加入约1g NaOH, 定容到50 mL.
3) 30% 十二烷基肌氨酸钠0.33 mL:1.5g加水定容到50
4)10% Triton X-100 1 mL:
1 mL Triton X-100 加9 mL水混匀
5)β-巯基乙醇0.07-0.10 mL(马琳论文里面有)
6)甲醇 20ml(网上有的文献里有)
蒸馏水定容至100mL。
2、考马斯亮蓝溶液G-250的配制:
100mg考马斯亮蓝溶液G-250 溶于50 mL95%中,加100 mL85%磷酸,定容到1 mL,过滤后保存于4°C,最终试剂0.01%考马斯亮蓝溶液G-250,4.7%(w/v)乙醇,8.5%(w/v)磷酸.
3、标准蛋白溶液:
50mg牛血清白蛋白(BSA),溶于50 mL0.15M的氯化钠中。
配制成1 mg/mL的标准蛋白溶液。
4、0.15M的氯化钠溶液
0.876g氯化钠定容到100 mL
5、4-MU储备液A(4-MU 1 mM):19.8mg4-MU溶于避光保存
4-MU储备液B(4-MU 1 μM):10μL4-MU储备液A定容到10 mL
6、终止缓冲液(0.2M Na2CO3)
10.6g Na2CO3 溶于500 mL水。
7、GUS反应缓冲液:
25mg4-MUG溶于25 mL提取缓冲液中
1) 1mol/L Na2HPO4溶液:35.814g Na2HPO4溶于100ml水。
2) 1mol/L NaH2PO4 溶液:15.601g NaH2PO4 溶于100ml水。
3) 0.1M 磷酸缓冲液(PH7.0):1mol/L Na2HPO4取5.77ml,1mol/L NaH2PO4取4.23ml,定容至100ml。
4) 10%SDS溶液:将90ml水稍微加热,加10g SDS,搅拌溶解,加入几滴浓盐酸调节PH至7.2,然后加水定容至100ml。
5) 0.5 M EDTA (PH8.0):在80ml水中加入18.61g Na2EDTA•2H2O,用NaOH调PH至8.0(约需2g左右的固体NaOH),溶解后定容至100ml。
6) GUS酶提取液:0.1M 磷酸缓冲液(PH7.0)取50ml;10% SDS取1ml;0.5M EDTA(PH8.0)取2ml;Triton X-100取100ul;β-巯基乙醇100ul;用水定容至100ml。
7) MUG底物:称8.8mg MUG,溶于10ml GUS酶提取液中,配制成2mmol/L的工作浓度。
8) 反应终止液(0.2 mol/L Na2CO3 ):称2.12Na2CO3 ,用水定容到100ml。
9) 考马斯亮蓝G250溶液:考马斯亮蓝G250 10mg, 95%乙醇5m1, H3PO4 10ml,定容至l00ml,过滤后4℃保存。
10) 1mg/ml BSA:20mg BSA,用GUS提取缓冲液定容至20ml。
