05章 血红素蛋白
生物无机化学6第五章 血红素蛋白

小 结: 细胞色素a、细胞色素b、细胞色素c是 包含血红素辅基的一类金属蛋白,它们依靠 血红素铁的价态变化来进行电子传递。 在线粒体内膜上电子传递的顺序为: 细胞色素b 细胞色素c1 细胞色素c 细胞色素氧化酶(细胞色素a 细胞色素a3) 氧分子
第二节 细胞色素 P-450
细胞色素P-450是于1958年在鼠肝微粒 体中发现的一种以血红素b为辅基的蛋白, 它也是b类细胞色素中的一种。与细胞色素c、 细胞色素b5等不同的是,细胞色素P-450在 生物体系中不是电子传递蛋白,而是一种金 属酶,它催化某些有机底物分子的加氧反应。
4feiicyt4feiiicytc2h细胞色素c氧化酶存在于细胞的线粒体膜上该酶在催化氧化还原反应的同时还伴随着质子通过膜的转移即细胞色素c氧化酶同时具有电子转移和质子泵的双重功细胞色素c氧化酶是由多个亚基组成的复合蛋白催化反应活性中心集中在iii和iii三个亚基中活性中心由低氧化还原电位的细胞色素a和高氧化还原电位的细胞色素a3组成
自然界存在两种加氧酶:一种是单加氧 酶,即将氧分子中两个氧原子中的一个氧原 子催化加合到底物分子中,而另一个氧原子 被转换为水分子;另一种是双加氧酶,即将 氧分子中的两个氧原子都加合到底物分子中。
细胞色素P-450属于单加氧酶,催化单 加氧反应。反应式为: SH + O2 + 2H+ + 2e SOH + H2O 其中SH为底物分子。 细胞色素P-450催化的反应是在底物分 子中引入一个羟基 羟基,即底物分子进行羟基化 羟基 反应,这种羟基化反应对各种有机分子在生 物体系中的代谢具有重要作用。
血红素a3中的铁在还原态时为高自旋 的五配位构型,除了血红素平面四个氮原 子与铁配位外,一个轴向配体是组氨酸的 咪唑氮原子,另一个轴向位置为空,因此 很容易与CO、CN-等配体结合。谱学及晶 体结构研究推测,CuB中心的配位环境中有 组氨酸的咪唑氮原子参与配位,在还原态 时可能也有一个空位。
血红蛋白的结构与功能

血红蛋白的结构与功能蛋白质功能的多样性蛋白质的而生物化学功能1.催化:酶酶的催化效率远远高于合成的催化剂2.调节:激素:胰岛素——调节血糖,糖代谢生长激素——促进人的生长,且能调节体内的物质代谢促甲状腺激素——刺激甲状腺激素的合成和甲状腺素的释放3.转运:血红蛋白——通过血液循环转运物质,运输氧气,存在与红细胞肌红蛋白——贮存和分送氧的蛋白质,存在于肌肉细胞4.贮存:铁蛋白——贮存Fe,用于含铁蛋白质如血红蛋白的合成5.运动:前面学过的肌动蛋白和肌球蛋白,微丝微管。
6.结构成分:纤维状蛋白质——α-角蛋白,胶原蛋白、7.支架作用:支架蛋白——在细胞应答激素和生长因子的复杂途径中起作用的8.防御和进攻:抗体等血红蛋白的结构血红蛋白(HB)分子由4个多肽亚基组成,一般成人血红蛋白主要是HbA,其亚基组成为α2β2,每个亚基都有一个辅基,称为血红素。
血红素是原卟啉IX与还原型铁Fe(II)的络合物。
原卟啉IX是由4个吡咯环组成,与之相连的有四个甲基,2个乙烯基和2个丙酸基。
亚铁离子有六个配位键,4个与吡咯环的N原子结合,另外两个与卟啉环面垂直,配体的4个N原子有助于抑制血红素铁原子转变为三价态,如果铁二价态变为三价态,血红蛋白就变成高铁血红蛋白,无载氧功能。
血红蛋白的三维结构近似球形,4个亚基占据相当于四面体的4个顶角,整个分子形成C2点群对称。
4个血红素基分别位于每个多肽链的E和F螺旋之间的裂隙处,并暴露在分子表面。
4个氧结合部位彼此保持一定距离,两个最近的铁离子(α1和β2血红素或α2和β1血红素Fe)之间的距离为2.5nm。
两个不同链之间的亚基相互作用最大,而两个α链之间或两个β链之间的相互作用很小。
两个不同类型的亚基是为了获得协同性氧结合必需的。
珠蛋白的三级结构肌红蛋白的脱辅基蛋白质称为珠蛋白。
血红蛋白α(α-珠蛋白)、β(β-珠蛋白)链的结构与肌红蛋白的结构很相似,尽管这三种氨基酸仅有27个是相同的,比较了多种不同的血红蛋白的氨基酸序列,证明残基是可以调换的,但有9个位置的残基是所有研究过的血红蛋白所共有的。
人教版教学课件08 第05章 血液

Ⅸ
Ⅹ
肝合成蛋白,参与外源性凝血和内源 性凝血机制
肝合成血浆蛋白,缺乏将引起血友病 C。参与内源性凝血机制
Ⅺ
Ⅻ
蛋白水解酶,参与内源性凝血,激活 纤维蛋白溶解酶
血浆和血小板中的酶,加强纤维蛋白 间的结合和维持血凝块稳定
纤维蛋白稳定因子 XIII (fibrin-stabilizing factor,FSF)
血浆凝血激酶(plasma 肝合成血浆蛋白,缺乏时引起血友病 thromboplastin B。参与内源性凝血机制 component,PTC) Stuart-Prower因子 血浆凝血激酶前质 (plasma thromboplastin antecedent,PTA) 接触因子 (contact factor)
2.密度:1.050~1.060,与所含的血细胞数量及 血浆成分有关。 3.粘滞性:即血液流动阻力的大小。通常是水的 3.5~5.5倍。 4.红细胞沉降率(ESR):健康男性为2~8mm/h; 女性为2~10mm/h。
血液的组成
第二节
一、血浆的化学成分
水分:91~92%
血浆
血浆蛋白 白蛋白、球蛋白、纤维蛋白 (6.2~7.9%): 尿素、尿酸、肌酸、 非蛋白含氮化合物 肌酐、氨基酸、多肽、 (NPN):(0.1%) 氨、胆红素等 不含氮化合 葡萄糖、磷脂、胆固醇等 物(0.75%):
(二)凝血因子(coagulation factor):
血浆与组织中直接参与血液凝固的物质,称 为~。根据发现的先后顺序,以罗马数字编号命 名,共有12种,编号为凝血因子Ⅰ~ⅩⅢ(其中 有两个因子后来发现是一种因子的不同活动形式)。
除Ca2+(因子IV )外,其余已知的凝血因子 都是蛋白质,绝大多数是蛋白酶。它们在血液中 都以无活性的酶原形式存在,必须通过其他酶的 水解作用才具有酶的活性,习惯上,某因子被活 化后,在该因子代号的右下角标上“a”,如 Inactive Ⅺ(FⅪ)被激活为Active Ⅺa( FⅪa)。
第五六章铁硫蛋白和其他非血红素铁蛋白
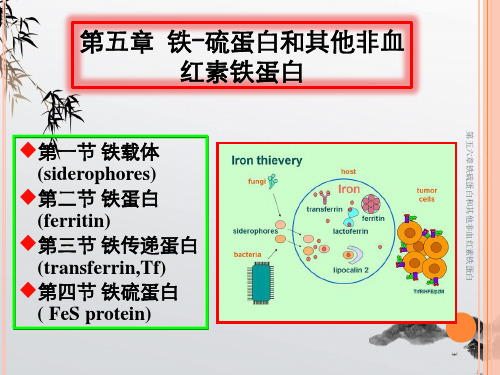
第五章 铁-硫蛋白和其他非血 红素铁蛋白
第一节 铁载体 (siderophores)
第二节 铁蛋白 (ferritin)
第三节 铁传递蛋白 (transferrin,Tf)
第四节 铁硫蛋白 ( FeS protein)
血红素蛋白(heme)和非血红素蛋白(nonheme)
✓ 它由24个亚基组装而成; ✓ 沿三,四重轴方向的通道使蛋白质壳与外部联系,其中
8个三重轴通道由亲水氨基酸残基(Asp,Glu,His,Tyr)排列 而成,即亲水性通道;而6个四重轴通道排列有多个亲脂 性残基,即疏水性通道。
✓ 无论是储铁蛋白还是脱铁储铁蛋白,其外壳的大小和亚
基的排列方式基本不变。蛋白质壳内是一个无机物复合 体的铁核,铁就聚积在铁核内,其铁含量为~4500个Fe3+ 不等, 主要成分为 [(FeOOH)8(FeOPO3H2)],铁的碱式磷 酸盐微晶排列而成。
Siderophores are small molecular weight, high-affinity iron-binding compounds that can scavenge the iron away from the high-affinity iron-binding proteins.
第五六章铁硫蛋白和其他非血红素铁蛋白
铁载体 (siderophores)
➢植物、微生物的生存,要求环境中铁浓度足够高,方能满
足其DNA合成血红素所需的铁。
➢为了能与氢氧根等有效地竞争铁(III),细菌,真菌和植物
种子等会分泌一些对铁(III)具有高度亲和力的复杂有机物, 使难溶的铁活化,这些有机物可与铁形成非常稳定的八面体 配合物。
高中生物酶和血红蛋白教案

高中生物酶和血红蛋白教案
教学内容:本节课主要介绍酶和血红蛋白的概念以及其在生物体内的重要作用。
教学目标:
1. 了解酶的定义、结构和功能;
2. 理解血红蛋白的结构和功能;
3. 应用所学知识,分析酶和血红蛋白的作用及其意义。
教学重点和难点:
1. 酶的结构和功能;
2. 血红蛋白的结构和功能。
教学准备:
1. 教学PPT;
2. 实验器材:试管、显微镜等;
3. 相关资料和教学辅助材料。
教学流程:
一、导入
通过展示一幅生物体内酶和血红蛋白的图片,引导学生讨论它们的作用和重要性。
二、介绍酶
1. 定义:酶是生物体内的一种蛋白质,具有催化化学反应的作用;
2. 结构:酶分子由氨基酸组成,具有特定的空间构象;
3. 功能:酶可以加速生物体内的化学反应,降低活化能,促进生物体正常代谢。
三、介绍血红蛋白
1. 结构:血红蛋白是一种含铁的蛋白质,主要存在于红细胞中;
2. 功能:血红蛋白可以结合氧气,在体内输送氧气至组织细胞,并将二氧化碳带回到肺部排出。
四、实验展示
展示一些酶和血红蛋白的实验,让学生通过观察实验结果来理解它们的作用和功能。
五、小结
总结本节课的内容,强调酶和血红蛋白在生物体内的重要性,以及它们的作用和功能。
六、作业布置
布置相关作业,让学生巩固所学知识,如撰写酶和血红蛋白的作用及意义。
*以上教案范本仅供参考,具体内容和安排可根据实际情况进行调整。
05章-血红素蛋白

发现的一种以血红素b为辅基的蛋白,它也是b 类细胞色素中的一种。与细胞色素c、细胞色 素b5等不同的是,细胞色素P-450在生物体 系中不是电子传递蛋白,而是一种金属酶, 它催化某些有机底物分子的加氧反应。
第39页,共77页。
这种b类细胞色素之所以被称之为细胞色 素P-450,或简称P-450,是因为其在还原 态下的一氧化碳(CO)加合物的Soret特征 吸收带出现在450 nm处,其中P代表色素。
第43页,共77页。
细胞色素P-450显示出非常广泛的底物分 子特异性,底物分子可以包括脂肪环、脂肪链
类碳氢化合物以及它们的衍生物、芳香族碳氢 化合物及其衍生物等。
第44页,共77页。
细胞色素P-450催化的主要反应类型
第45页,共77页。
某些有机化合物由于不溶于水,使其在体内 难以代谢,而在细胞色素P-450单加氧酶作用下,
第27页,共77页。
CuA中心的结构由EXAFS、ESR以及利用同
位素标记的氨基酸研究结果,并最终根据X射线
衍射晶体结构结果确定为双核结构。双核铜通 过蛋白链中两个半胱氨酸侧链上的硫原子桥 连,一个铜离子还与一个组氨酸和一个蛋氨 酸配位,另一个铜离子还与一个组氨酸和一 个主链上的羰基氧原子配位。
第28页,共77页。
第23页,共77页。
进一步研究发现细胞色素a和细胞色素a3都 含有两个金属离子。细胞色素a不仅含有一个以
血红素a为辅基的铁血红素中心,还含有一个铜 中心(CuA);而细胞色素a3不仅含有一个以
血红素a3为辅基的铁血红素中心,还含有一个
铜中心(CuB)。通过各种化学方法的研究, 表征了细胞色素c氧化酶活性中心的结构, 尤其是金属离子周围的结构。
血红蛋白的名词解释

血红蛋白的名词解释
血红蛋白(Hb)是存在于红细胞内的一种主要结合蛋白质,它占红细胞中总蛋白量的90%,由珠蛋白肽链与亚铁血红蛋白(血红素)组成。
血红蛋白在体内有两种作用:一、是和氧气和二氧化碳结合,将氧气运输到全身,同时将二氧化碳带走进行气体的交换,保证全身的供养维持正常的代谢。
二、是运输营养组织,体内的吸收营养组织会以特殊的方式和血红蛋白结合,通过血液循环运输到全身为人体的活动功能。
女性血红蛋白正常在110g/L到150g/L之间,男性血红蛋白在120g/L到165g/L之间正常。
儿童血红蛋白正常值在120g/L到140g/L。
【生物化学】第五章-生物氧化-第二节-电子传递链

② 铁硫蛋白(Fe-S) (非血红素蛋白)
与电子传递有关
与其他递氢体或电 子传递体结合成复 合物存在
②铁硫蛋白(Iron-sulfur protein, Fe-S)
又叫铁硫中心或铁硫簇。 含有等量铁原子和硫原子。 铁除与硫连接外,还与肽链中Cys残基的巯 基连接。 铁原子可进行Fe2+ Fe3++e 反应传递电子, 为单电子传递体。
Cyt-Fe2+
2e-21 O2
b
c1
c
a
a3
Fe -S
CoQH2 2e- Cyt-Fe3+
Cyt-Fe2+ 2e- Cyt-Fe3+ Cyt-Fe2+ 2e- Cyt-Fe3+ O2- H2O
2H+
复合物III (泛醌-细胞色素 c还原酶)
复合物IV (细胞色素 c氧化酶)
-
2.电子传递链的成员组成
细胞色素a、b、c的区别
Cytb
辅基
原卟啉Ⅸ (血红素)
颜色 α带波长 与酶蛋白连接 红色 560nm 非共价结合
Cytc
原卟啉Ⅸ (血红素)
红色
550nm
与多肽链中 Cys 的 –SH相连
Cyta 血红素A 绿色 600nm 非共价结合
Cytochrome bc1 complex (complex III)
Reduced
The end of Chap1 !
电子传递的方向为:琥珀酸→FAD→Fe-S→Q。
复合体Ⅱ
琥珀酸→ Fe-S1; b560; FAD; Fe-S2 ; Fe-S3 →CoQ
琥珀酸
FAD
2Fe2+-S Q
血红蛋白的结构与性质ppt课件

血红蛋白氧合过程中α , β二聚体之间的变化
12
1 血红蛋白与CO的亲和力比与O2的亲和力 大得多的原因?
2 高铁(Fe3+)血红素后即不能载氧的原因?
13 血红蛋白与C ຫໍສະໝຸດ 的亲和力要比氧的亲和力大210 倍。
C O 分子中由于氧提供孤电子对填充到碳的2 p 空 轨道上形π配键, 造成氧原子上的电子云向碳方向 的转移, 使碳原子上的电子云密度增大, 供给电子 对的性能大大增强, 使C O 成为比O2具有更强的强 场配位体, 极易与血红蛋白中的血红素配位, 组成 低自旋鳌合物,特别稳定。
14
在正常生理的p H 范围内, 大部分高铁血红蛋白的第六个配位体是 OH -, 由于OH -是较弱的配位场., 此时中心离子F e 3+处于高自旋 态, 它所形成的鳌合物必然比Fe 2+所形成的鳌合物的热学力稳定性 要强;
同时由于Fe 3+使整个血红素基团带上一个单位的正电荷, 其第六个 配位数就容易与带一个单位负电荷的离子如OH-, CN -等相结合, 这样高铁血红素就不可能与氧结合而失去载氧能力。
四吡咯环的N原子;另外2个沿着垂直于卟 啉环面的轴分布在环的上下的配位原子, 其中一个为02/H2O,另外一个为HisF8残基 (即组氨酸Histidine残基)。 第六个配位体,脱氧血红蛋白为H2O分子 或瞬间空缺, 氧合血红蛋白则为氧分子。
7
从结构化学的角度分析血红蛋白载氧功能本质可分为两方 面
1. 血红素结构特征:中心离子Fe2+和配位体络合键的本质 2. 血红蛋白分子在载氧中的变构作用
8
3.1 F e 2+与配位体之间络合键的本质
中心离子Fe2+是一个d6离子,价层电子排布如下:
血红素

含血红素蛋白的代谢在哺乳动物中需要:
①对卟啉环剪切产生的疏水性产物进行处理;
②所含铁的保留和动用,使其重新被利用。红细胞的生存周期大约为120天,衰老细胞通过膜的改变被识别, 并被血管外的状内皮系统吞噬。珠蛋白链变性后,将血红素释放于细胞质中;珠蛋白被降解为其组成的氨基酸, 重新被利用以满足一般代谢的需要。
(2)分离红细胞取抗凝猪血10mL于离心管中,以3000r/min离心15min,倾出上清液(血浆),收集红细胞, 用0.9% NaCl洗涤2次。洗涤方法为:用适量生理盐水悬浮红细胞,搅拌均匀,离心,收集红细胞沉淀,测定红细 胞体积(mL)。
(3)溶血加入相当于红细胞体积1倍的去离子水、0.25倍95%乙醇,搅拌30min,红细胞吸水胀裂,血红蛋白 释放出来。
除了运载氧,血红素还可以与二氧化碳、一氧化碳、氰离子结合,结合的方式也与氧完全一样,所不同的只 是结合的牢固程度,一氧化碳、氰离子一旦和血红素结合就很难离开,这就是煤气中毒和氰化物中毒的原理,遇 到这种情况可以使用其他与这些物质结合能力更强的物质来解毒,比如一氧化碳中毒可以用静脉注射亚甲基蓝的 方法来救治。
提取测定
试剂器材
提取原理
操作步骤
血红蛋白在pH低于3.0时,血红素与珠蛋白的结合最为疏松,此时加入有机溶剂丙酮,使珠蛋白变性凝固, 血红素则溶于丙酮中,在丙酮中加入适量的鞣酸或乙酸钠,可得到较纯的血红素结晶,然后用乙醇一乙醚洗涤, 可得到精制血红素。血红素在波长385处有最大吸收,可直接进行比色测定。
血红素分子结构由于协同效应,血红素与氧气的结合曲线呈S形,在特定范围内随着环境中氧含量的变化,血 红素与氧分子的结合率有一个剧烈变化的过程,生物体内组织中的氧浓度和肺组织中的氧浓度恰好位于这一突变 的两侧,因而在肺组织,血红素可以充分地与氧结合,在体内其他部分则可以充分地释放所携带的氧分子。可是 当环境中的氧气含量很高或者很低的时候,血红素的氧结合曲线非常平缓,氧气浓度巨大的波动也很难使血红素 与氧气的结合率发生显著变化,因此健康人即使呼吸纯氧,血液运载氧的能力也不会有显著的提高,从这个角度 讲,对健康人而言吸氧的所产生心理暗示要远远大于其生理作用。当血液内红细胞破坏过多,肝脏负荷增加肝细 胞内运送、结合和排泄障碍,或肝外胆道阻塞,都可引起血内胆红素浓度增高而出现黄疸。
第五六章铁-硫蛋白和其他非血红素铁蛋白

铁载体的结构类型
铁载体与铁形成非常稳定的低电荷配合物,有利于高电荷 铁(III)离子跨过亲脂性膜,实现铁(III)的吸收,运输过程。
氧肟酸盐型 (hydroxamate type); 邻苯二酚型(catechol type)
氧肟酸盐型 (hydroxamate type)
铁色素
Crystal structure of ferri普遍的看法是:在细胞 内,首先 Fe3+被还原为Fe2+,之后通过质子化作用将结合 不牢固的Fe2+从载体上置换下来。
第二节 铁蛋白(ferritin)
高等植物,微生物,哺乳动物的各种细胞中都含有储铁 蛋白。细胞类型不同储铁功能也有所不同。哺乳动物体内 主要储存铁的蛋白质,主要分布在动物的脾脏(spleen),肝 脏 (liver)和骨髓(bone marrow)中,植物的叶绿体和某些 细菌中也发现有铁蛋白。
铁传递蛋白的分类与结构
铁传递蛋白是一类金属键合蛋白,对于维持生命体
中铁的含量以及铁的新陈代谢起着重要作用。根据来源 不同可将其分为四类:血清运铁蛋白(serum transferrin), 伴清运铁蛋白 (ovotransferrin), 乳运铁蛋白 (lactoferrin), 黑素运铁蛋白(melanotransferrin)。
邻苯二酚型 (catechol type)
肠杆菌素, Enterobactin
Enterobactin + Fe
铁载体的性质
根据软硬酸碱规则,铁载体中属于硬碱的配位原子(氧) 可与属于硬酸的Fe3+配位,形成稳定的配合物。研究表明, 含有三个双齿配体的铁载体与 Fe3+ 的结合常数大于 1030 。 虽然铁载体也可与Ga3+及人造錒元素结合,但是与Al3+及所 有二价金属离子的结合能力是相当弱的,因此自然界出现 的金属离子中, 铁载体仅对Fe3+选择性性结合。 所结合的 Fe3+处于高自旋态 (HS), 动力学性质是活泼的,使铁载体 结合的Fe3+能向细胞内其它配体或蛋白质释放铁。
5第五章血红素蛋白

SOH + H2O
细胞色素P-450催化的反应是在底物分
子中引入一个羟基,即底物分子进行羟基化
反应,这种羟基化反应对各种有机分子在生
物体系中的代谢具有重要作用。
细胞色素P-450显示出非常广泛的底 物分子特异性,底物分子可以包括脂肪环、 脂肪链类碳氢化合物以及它们的衍生物、 芳香族碳氢化合物及其衍生物等。
原为两分子水,反应式为:
4Fe(II)-cyt c+ O2+4H+
4Fe(III)-cyt c+2H2O
细胞色素c氧化酶存在于细胞的线粒体 膜上,该酶在催化氧化还原反应的同时还 伴随着质子通过膜的转移,即细胞色素c氧 化酶同时具有电子转移和质子泵的双重功 能。
细胞色素c氧化酶是由多个亚基组成的 复合蛋白,催化反应活性中心集中在I、II和 III三个亚基中,活性中心由低氧化还原电位 的细胞色素a和高氧化还原电位的细胞色素 a3组成。其中细胞色素a是接受还原态细胞 色素c提供电子的部位,而细胞色素a3则是 还原氧分子到水分子的部位。此外,细胞色 素c氧化酶中还含有锌离子和镁离子。
在黄素蛋白、铁硫蛋白和细胞色素P- 450的共同作用下,由烟酰胺腺嘌呤二核苷 酸(NADH)作为氢供体,在樟脑(2-茨酮) 分子的5-位上进行立体选择性羟基化反应, 催化该反应的细胞色素P-450简称为P- 450cam。
《血红素蛋白》ppt课件

图5.7 未结合底物分子的细胞色素P-450 血红素活性中心的构造
图5.7 结合樟脑底物分子的细胞色素P-450 血红素活性中心的构造
小 结:
细胞色素P-450是以血红素b为辅基的 一类金属蛋白,它是一种金属单加氧酶,可 以催化某些有机底物分子的加氧反响,使有 机底物分子发生羟基化反响。该酶对于生物 体系的代谢具有重要作用。
X射线衍射晶体构造证明,血红素铁的 轴向第五个配体来自于蛋白链上半胱氨酸残 基侧链的硫原子。氧化型细胞色素P-450中 在没有底物分子存在的条件下,第六配体为 水分子,而且在配位水分子附近聚集了数个 水分子构成一个水分子簇和物。当有底物分 子进入之后,水分子簇和物即被破坏,血红 素上方的空间被底物分子所占据。
目前知的电子传送蛋白主要有三类:
1、铁硫蛋白,该蛋白活性中心含有非血红 素的铁硫簇合物; 2、活性中心含有铁血红素辅基的蛋白,即 细胞色素类; 3、活性中心含有铜的蓝铜蛋白。
和血红蛋白、肌红蛋白一样,细胞色素 类蛋白的活性中心也含有血红素铁,细胞色 素类蛋白就是依托血红素铁中铁的价态变化 来进展电子传送,包括电子从一种蛋白质到 另一种蛋白质的转移。
细胞色素b5的蛋白链由133个氨基酸残 基组成,分子质量约16000 Da。细胞色素 b5与血红蛋白、肌红蛋白有一定的类似之 处,也有明显的不同。
在细胞色素b5中,谱学测试、晶体构 造、溶液构造研讨证明铁离子为配位饱和 的六配位构型,因此细胞色素b5难以自动 氧化,不易与CO、CN-、N3-等外来配 体结合。细胞色素b5中铁无论是氧化态还 是复原态都处于低自旋态。
图5.1 金枪鱼细胞色素c 〔第一个测定构造的细胞色素c〕
用核磁共振〔NMR〕和X射线衍射单 晶构造分析对细胞色素c的研讨阐明,血红 素c中的铁离子具有六配位的八面体构型。 铁离子分别和卟啉环中的四个吡咯氮原子 以及一个蛋氨酸80的硫原子、一个组氨酸 18的咪唑氮原子配位。
血红素结合蛋白

血红素结合蛋白血红素结合蛋白介绍:HPx是肝细胞合成的一种多分子形式的蛋白质,分子量57000,对血红蛋白及高铁血红素具有高亲和力,1mg HPx可与按1. 11g比例的血红素或高铁血红素结合,形成复合物,后经血循环至肝脏被清除。
血红素结合蛋白正常值:免疫扩散法血清成人 0.50~1.15g/L,均值为0.75g/L足月胎儿>成人浓度30%,或>母体18%,母体高于非孕妇女的1.5倍尿液均值为2.0mg/24h血红素结合蛋白临床意义:(1)血清水平升高:HPx为一种反应较轻的急性时相反应蛋白,在急性应激反应时,HPx浓度升高不超过正常静止时的2倍。
某些肿瘤也可升高尤其是黑素瘤。
(2)血清含量下降:见于严重溶血性贫血、严重恶性营养不良、出血性胰腺炎、主动脉换瓣膜后、革登出血热、严重肾病综合征、红细胞生成原卟啉症以及肝病(如亚急性肝坏死、肝硬变、慢性活动性肝炎、原发性肝癌等)。
其中肝病时HPx的降低程度与肝损害相平行。
血红素结合蛋白注意事项:HPx可配合结合珠蛋白(Hp)处理血红蛋白(Hb)。
当广泛溶血时Hp耗竭,游离的Hb可降解为珠蛋白和血红素,而血红素不溶于水,可和HPx结合成复合物。
通过血流至肝脏分解,铁可被机体重新利用,有效地防止了铁的丢失。
血红素降解的卟啉环进一步代谢为胆红素由胆汁排出,而HPx又在血循环中反复利用。
连续动态观察血清HPx的变化以了解血管内溶血状况,其临床价值优于Hp,因为在溶血情况下,血清Hp水平可下降至零。
例如在体外循环手术后。
HPx水平持续下降表明红细胞继续破坏。
血红素结合蛋白检查过程:暂无相关信息。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
处,也有明显的不同。
在细胞色素b5中,谱学测试、晶体结
构、溶液结构研究证实铁离子为配位饱和
的六配位构型,因此细胞色素b5难以自动
氧化,不易与CO、CN-、N3-等外来配体 结合。细胞色素b5中铁无论是氧化态还是 还原态都处于低自旋态。
细胞色素b5 中铁离子除了与 卟啉环平面的四 个氮原子配位之 外,轴向位置被 两个组氨酸侧链 上的咪唑氮原子 占据。
电子传递的顺序为:
细胞色素b 细胞色素c1 细胞色素c
细胞色素氧化酶(细胞色素a
细胞色素a3) 氧分子
一、细胞色素c
细胞色素c是相对分子质量比较小且
相对比较容易结晶的蛋白,它的分布非常 广,存在于从细菌、酵母、植物、无脊椎 动物、脊椎动物到高等动物和人等所有的 原核生物和真核生物中。
细胞色素c是少数几个被详细研究的含
反应中,研究最多、了解最清楚的是茨酮-5-
单氧酶,反应式为:
在黄素蛋白、铁硫蛋白和细胞色素P-
450的共同作用下,由烟酰胺腺嘌呤二核苷
酸(NADH)作为氢供体,在樟脑(2-茨酮)
分子的5-位上进行立体选择性羟基化反应,
催化该反应的细胞色素P-450简称为P-
450cam。
通过ESR、EXAFS等谱学表征,细胞色
半胱氨酸
组氨酸
蛋氨酸
细胞色素c氧化酶中CuA中心的配位结构
2、细胞色素a3
磁性、ESR等研究发现氧化型细胞色素
a3中的Fe和Cu之间存在较强的相互作用,
推测Fe和Cu之间可能有某种桥连基团存在。
这两个非常接近的Fe和Cu氧化还原中心对
氧分子的四电子还原过程的顺利完成非常
有利。
血红素a3中的铁在还原态时为高自旋 的五配位构型,除了血红素平面四个氮原 子与铁配位外,一个轴向配体是组氨酸的 咪唑氮原子,另一个轴向位置为空,因此 很容易与CO、CN-等配体结合。谱学及晶 体结构研究推测,CuB中心的配位环境中有 组氨酸的咪唑氮原子参与配位,在还原态 时可能也有一个空位。
细胞色素广泛存在于动物和植物组织
中。在动物中细胞色素的含量,以心脏和
其它活跃的运动肌(如鸟类和昆虫类的飞翔
肌)较高,肝、脑和非横纹肌次之,皮肤和
肺最低。故一般多从动物(如猪、牛)的心脏
提取。
1961年,国际生物化学学会把细胞色
素定义为“一种血红素蛋白,它的基本生 物功能是通过分子中血红素铁的价态的可 逆变化在生物体中起电子及氢的传递作 用”。目前已知的细胞色素有50种以上。
二、细胞色素c氧化酶--
细胞色素a和细胞色素a3 细胞色素c氧化酶是细胞色素c的氧化剂, 它是需氧生物呼吸链中的最后一步氧化还 原反应,它将还原态的细胞色素c催化氧化 到氧化态的细胞色素c,同时将一分子氧还 原为两分子水,反应式为:
4Fe(II)-cyt c+ O2+4H+ 4Fe(III)-cyt c+2H2O
在生物体内,根据所含血红素辅基结
构的不同,将细胞色素分为:细胞色素a (包含血红素a辅基)、细胞色素b(包含 血红素b辅基)、细胞色素c(包含血红素 c辅基)等。
不同的生物体采用了不同的细胞色素
系列来适应它们自身的需要。细胞色素参
与线粒体内膜上一整套电子传递链(生物
氧化呼吸链)的最后几步氧化还原反应, 将电子最终传递给氧分子,使氧分子还原 成水分子。
外,这一代谢过程对哺乳动物十分重要。
例如,在肝微粒体中已经发现多种细 胞色素P-450,可将外来有毒化合物、污 染物等催化氧化成水溶性物种排出体外, 从而起到保护机体不受伤害的作用。但是, 也有一些本来没有毒性或毒性较小的化合 物经过细胞色素P-450催化引入羟基之后 反而变成毒性更大的化合物。
生物体系中,在许多重要的代谢和生物 合成中,细胞色素P-450起了非常重要的作 用。例如,在肾上腺皮质中,细胞色素P- 450参与脂的代谢、胆甾醇的氧化等重要过 程。这些反应中的氢供体主要有还原型烟酰 胺腺嘌呤二核苷酸(NADH)、还原型烟酰 胺腺嘌呤核苷酸磷酸盐(NADPH)、还原
金属的生物大分子之一,现在已经确定了
几十种不同来源的细胞色素c的氨基酸序列,
每个细胞色素c分子含有一条蛋白链 和一
个血红素c辅基。马心的细胞色素c的分子
质量为12400 Da,它由104个氨基酸残基组
成。
图5.1 金枪鱼细胞色素c (第一个测定结构的细胞色素c)
用核磁共振(NMR)和X射线衍射单
型黄素蛋白、维生素C等。
根据来源的不同,可将细胞色素P-450 分为三类:
1、细菌单加氧酶,代表性的是茨酮-5-单氧 酶; 2、肾上腺皮质线粒体单加氧酶,催化的底 物分子主要有孕甾酮和11-脱氧皮质甾酮;
3、肝线粒体单加氧酶,催化的底物分子种 类较多,包括脂肪族化合物、药物分子的 羟化等。
在细胞色素P-450参与的各种催化羟化
第三节
甲烷单加氧酶、双加氧酶
自然界存在两种加氧酶:一种是单加氧
酶,即将氧分子中两个氧原子中的一个氧原 子催化加合到底物分子中,而另一个氧原子 被转换为水分子;另一种是双加氧酶,即将 氧分子中的两个氧原子都加合到底物分子中。
一、甲烷单加氧酶
细胞色素P-450能够高效、特异性地
催化许多有机化合物的羟基化反应,但是 不能催化最简单的碳氢化合物--甲烷到 甲醇的反应。催化氧化甲烷到甲醇的酶称 为甲烷单加氧酶。
第五章
血红素蛋白及催化体系
在生物体内,除了含铁蛋白的氧载 体之外,还有多种含铁蛋白,在生物体 内起着传递电子、参与各种酶催化体系
以及铁自身的吸收、储存、运送等。
第一节 细胞色素:电子传递 第二节 细胞色素 P-450 第三节 甲烷单加氧酶、双加氧酶 第四节 过氧化物酶及过氧化氢酶
第一节
细胞色素:电子传递
血红素铁的价态变化来进行电子传递。
在线粒体内膜上电子传递的顺序为: 细胞色素b 细胞色素c1 细胞色素c 细胞色素氧化酶(细胞色素a 细胞色素a3) 氧分子
第二节 细胞色素 P-450
细胞色素P-450是于1958年在鼠肝微粒 体中发现的一种以血红素b为辅基的蛋白,
它也是b类细胞色素中的一种。与细胞色素c、
1、细胞色素a 拉曼光谱、ESR等谱学研究表明,血
红素a中的铁无论是氧化态还是还原态都处
于六配位低自旋状态。铁离子除了与血红
素平面的四个氮原子配位之外,轴向两个 位置分别被来自于蛋白链中组氨酸侧链上 的咪唑氮原子占据。
细胞色素c氧化酶中血红素a铁的配位结构
CuA中心的结构由EXAFS、ESR以及利 用同位素标记的氨基酸研究结果,并最终根 据X射线衍射晶体结构结果确定为双核结构。 双核铜通过蛋白链中两个半胱氨酸侧链上的 硫原子桥连,一个铜离子还与一个组氨酸和 一个蛋氨酸配位,另一个铜离子还与一个组 氨酸和一个主链上的羰基氧原子配位。
晶结构分析对细胞色素c的研究表明,血红
素c中的铁离子具有六配位的八面体构型。
铁离子分别和卟啉环中的四个吡咯氮原子
以及一个蛋氨酸80的硫原子、一个组氨酸
18的咪唑氮原子配位。
蛋白链 蛋白链
血红素c辅基除 了由两个轴向 配体与蛋白链 连接外,卟啉 环2,4-位以共价 键形式与蛋白 链中的两个半 胱氨酸连接。
进一步研究发现细胞色素a和细胞色素 a3都含有两个金属离子。细胞色素a不仅含 有一个以血红素a为辅基的铁血红素中心, 还含有一个铜中心(CuA);而细胞色素a3 不仅含有一个以血红素a3为辅基的铁血红 素中心,还含有一个铜中心(CuB)。通过 各种化学方法的研究,表征了细胞色素c氧 化酶活性中心的结构,尤其是金属离子周 围的结构。
素P-450的活性中心含有铁和原卟啉,还 原型的细胞色素P-450中铁为高自旋,易 与O2、CO、CN-等分子或离子结合,并转 变为低自旋,这一现象与肌红蛋白类似。
X射线衍射晶体结构证明,血红素铁的 轴向第五个配体来自于蛋白链上半胱氨酸残 基侧链的硫原子。氧化型细胞色素P-450中 在没有底物分子存在的条件下,第六配体为 水分子,而且在配位水分子附近聚集了数个
在生物体系中,氧分子在酶的催化作 用下氧化加合到有机底物分子中去的反应 叫做加氧反应,催化该类反应的酶称为加 氧酶。
自然界存在两种加氧酶:一种是单加氧
酶,即将氧分子中两个氧原子中的一个氧原
子催化加合到底物分子中,而另一个氧原子
被转换为水分子;另一种是双加氧酶,即将
氧分子中的两个氧原子都加合到底物分子中。
X射线衍射晶体结构表明,细胞色素b5
中的血红素位于疏水袋中,原卟啉的两个丙
酸基指向蛋白表面,处在与水可接触的区域。
血红素周围有四个α螺旋链存在,其底部有β
折叠片存在,这样就构成了一个桶状疏水空
腔,血红素辅基正好位于其中。
小 结:
细胞色素a、细胞色素b、细胞色素c是
包含血红素辅基的一类金属蛋白,它们依靠
细胞色素b5等不同的是,细胞色素P-450在
生物体系中不是电子传递蛋白,而是一种金
属酶,它催化某些有机底物分子的加氧反应。
这种b类细胞色素之所以被称之为细
胞色素P-450,或简称P-450,是因为其
在还原态下的一氧化碳(CO)加合物的
Soret特征吸收带出现在450 nm处,其中P 代表色素。
细胞色素P-450的作用(功能)、 结构和作用机理
在生物体系中,电子传递反应是一系列 重要生物过程的基本反应,所有的氧化还原 反应都会涉及电子的转移。由于铁、铜等过 渡金属离子有可变的化合价,通过其价态之 间的变化,如Fe(III)/Fe(II)、Cu(II)/Cu(I)等, 可以有效地进行电子传递。所以在生物体内 形成了一些含有铁、铜等过渡金属离子的蛋 白分子作为生物过程中的电子传递体。
物分子特异性,底物分子可以包括脂肪环、 脂肪链类碳氢化合物以及它们的衍生物、
