3.2醛-天津市第一中学人教版高中化学选修五课件(PDF版 )
合集下载
人教版高中化学选修五3.2 醛 (1) (共25张PPT)教育课件

CH3COONa + Cu2O + 3H2O
应用:检验醛基;医疗上检验糖尿病
注意事项:a.反应必须在碱性环境下进行(NaOH过量); b.热必须至沸腾;
思考:乙醛能否使酸性KMnO4溶液或溴水褪色?
能
(4)、被酸性高锰酸钾溶液、溴水氧化
2、加成反应(还原反应)
O
OH
CH3—C—H + H2 催化剂 CH3—C—H
c、应用:检验醛基;工业上制镜或保温瓶胆.
注意事项:
1.试管内壁应洁净; 2.必须用水浴加热,不能用酒精灯直接加热; 3.加热时不能振荡试管; 4.实验后银镜先用稀HNO3清洗,再用水洗。
II、与新制Cu(OH)2悬浊液的反应
[探究实验3-6]
现象:生成砖红色沉淀
CH3CHO + 2Cu(OH)2 + NaOH △
•
•
•
•
之前有个网友说自己现在紧张得不得了 ,获得 了一个 大公司 的面试 机会, 很不想 失去这 个机会 ,一天 只吃一 顿饭在 恶补基 础知识 。不禁 要问, 之前做 什么去 了?机 会当真 就那么 少?在 我看来 到处都 是机会 ,关键 看你是 否能抓 住。运 气并非 偶然, 运气都 是留给 那些时 刻准备 着的人 的。只 有不断 的积累 知识, 不断的 进步。 当机会 真的到 来的时 候,一 把抓住 。相信 学习真 的可以 改变一 个人的 运气。
•
•
•
有些人经常做一些计划,有的计划几乎 不去做 或者做 了坚持 不了多 久。其 实成功 的关键 是做很 坚持。 上帝没 有在我 们出生 的时候 给我们 什么额 外的装 备,也 许你对 未来充 满迷惑 ,也许 你觉得 是在雾 里看花 ,但是 只要我 们不停 的去做 ,去实 践,总 是可以 走到一 个鲜花 盛开的 地方, 也许在 那个时 候,你 就能感 受到什 么叫柳 暗花明 。走向 成功的 过程就 好像你 的起点 是南极 ,而成 功路径 的重点 在北极 。那么 无论你 往哪个 方向走 ,只要 中途的 方向不 变,最 终都会 到达北 极,那 就在于 坚持。
应用:检验醛基;医疗上检验糖尿病
注意事项:a.反应必须在碱性环境下进行(NaOH过量); b.热必须至沸腾;
思考:乙醛能否使酸性KMnO4溶液或溴水褪色?
能
(4)、被酸性高锰酸钾溶液、溴水氧化
2、加成反应(还原反应)
O
OH
CH3—C—H + H2 催化剂 CH3—C—H
c、应用:检验醛基;工业上制镜或保温瓶胆.
注意事项:
1.试管内壁应洁净; 2.必须用水浴加热,不能用酒精灯直接加热; 3.加热时不能振荡试管; 4.实验后银镜先用稀HNO3清洗,再用水洗。
II、与新制Cu(OH)2悬浊液的反应
[探究实验3-6]
现象:生成砖红色沉淀
CH3CHO + 2Cu(OH)2 + NaOH △
•
•
•
•
之前有个网友说自己现在紧张得不得了 ,获得 了一个 大公司 的面试 机会, 很不想 失去这 个机会 ,一天 只吃一 顿饭在 恶补基 础知识 。不禁 要问, 之前做 什么去 了?机 会当真 就那么 少?在 我看来 到处都 是机会 ,关键 看你是 否能抓 住。运 气并非 偶然, 运气都 是留给 那些时 刻准备 着的人 的。只 有不断 的积累 知识, 不断的 进步。 当机会 真的到 来的时 候,一 把抓住 。相信 学习真 的可以 改变一 个人的 运气。
•
•
•
有些人经常做一些计划,有的计划几乎 不去做 或者做 了坚持 不了多 久。其 实成功 的关键 是做很 坚持。 上帝没 有在我 们出生 的时候 给我们 什么额 外的装 备,也 许你对 未来充 满迷惑 ,也许 你觉得 是在雾 里看花 ,但是 只要我 们不停 的去做 ,去实 践,总 是可以 走到一 个鲜花 盛开的 地方, 也许在 那个时 候,你 就能感 受到什 么叫柳 暗花明 。走向 成功的 过程就 好像你 的起点 是南极 ,而成 功路径 的重点 在北极 。那么 无论你 往哪个 方向走 ,只要 中途的 方向不 变,最 终都会 到达北 极,那 就在于 坚持。
人教版化学选修5第三章第二节醛(共31张PPT)

小
O=
结 ⑴ —C—H 氧化(得氧) ,断C—H键:
2CH3CHO + O2
Cu △
2CH3COOH
O= O=
⑵ —C—H 醛还原(加氢) ,断C=O键:
R—C—H + H2
Ni △
R—CH2—OH
一、乙醛
⒋乙醛的用途
乙醛是有机合成工业中的重要原料, 主要用来生产乙酸、丁醇、乙酸乙酯等。 如:
催化剂
⑵ 氧化反应
②与银氨溶液的反应
• 在 逐洁滴净滴A的入g2试%+管+的N里稀H加氨3入·水H1,2mO至L2=最%初A的g产AgO生NHO的3溶沉↓液+淀,N恰然H好后4溶+一解边为摇止动(试这管时,得一到边的 溶液叫A做gO银H氨+溶2液N)H。3再·H滴2O入=3滴[乙A醛g(,N振H荡3)后2]把++试O管H放-+在2热H水2O中温热。
⑴ 加成反应:
催化剂
CH3—C—H + H—H △ CH3CH2OH
有机物得氢或去氧, 发生还原反应 有机物得氧或去氢, 发生氧化反应
注意:和C=C双键不同的是,通常情况下,乙醛 不能和HX、X2、H2O发生加成反应
一、乙醛
⑵ 氧化反应
①催化氧化
O= O=
2CH3-C-H
+ O2
催化剂 △
2CH3-C-OH 乙酸
• 或不:A久g可O以H看+2到N,H试3管·H内2壁O上=附[着A一g(层N光H亮3)2如] 镜O的H金+2属H银2。O
⑵ 氧化反应
②Байду номын сангаас银镜反应---与银氨溶液的反应
CH3CHO + 2 [Ag(NH3)]2 ++ 2OH-
人教化学选修5第三章第二节 醛第1课时(共15张PPT)

4.关于乙醛的下列反应中,乙醛被还原的 ( B )
A.乙醛的银镜反应
B.乙醛制乙醇
C.乙醛与新制氢氧化铜的反 D.乙醛的燃烧反应
的乙醛溶液加热至沸腾,无红色沉淀,实验失败的原因
是( B )
A.乙醛溶液太少 C.硫酸铜不够用
B.氢氧化钠不够用 D.加热时间不够
2.甲醛、乙醛、丙醛组成的混合物里,氢元素的质量分数
是9%,则氧元素的质量分数是( B )
A.16%
B.37%
C.48%
D.无法计算
3.下列配制银氨溶液的操作中,正确的是 ( D )
(2)被强氧化剂氧化:
乙醛能使酸性KMnO4溶液褪色,酸性K2Cr2O7 溶液变色。
ቤተ መጻሕፍቲ ባይዱ
(3) 催化氧化:
催化剂
2CH3CHO+O2 △
2CH3COOH
乙醇
氧化
氧化 乙醛
乙酸
还原
思考交流
1.葡萄糖的特征反应有哪些? A.银镜反应 B.与新制的氢氧化铜悬浊液反应
2.葡萄糖含有哪些官能团? 羟基、醛基
(4) 被弱氧化剂氧化
3.情感态度与价值观: 通过乙醇、乙醛的对比学习,提高自我归纳总结能 力;通过实验,提高自我的观察能力和思维能力。
【自主学习】 阅读课本56页完成下列问题:
一、乙醛的物理性质
乙醛是 无色 、有 刺激性 气味的 液体 ,密度比水小,沸点是 20.8℃,易挥 发,易 燃烧 ,能跟 水 、乙醇等互溶。
二、乙醛的结构
【实验3-5】 乙醛的银镜反应
①配制银氨溶液:取一洁净试管,加入1 mL 2% 的AgNO3溶液,再逐滴滴入2%的稀氨水,至生 成的沉淀恰好溶解。 ②水浴加热生成银镜:在配好的上述银氨溶液中滴 入三滴乙醛溶液,然后把试管放在热水浴中静置。
人教版高中化学选修五 《醛》课件(新人教版选修5) PPT课件

乙醛
一、醛: 从结构上看,由烃基(或氢原子)跟醛基相连 而成的化合物叫醛。
1、饱和一元醛的通式: CnH2n+1CHO 或CnH2nO
肉桂醛
苯甲醛 CH2=CH— CHO 兰花含香草醛
CHO
【学与问】
通过乙醛的核磁共振氢谱,你能获取什么信息? 请你指出两个吸收峰的归属。
吸 收 强 度
10
8
6
4
2
与新制的氢氧化铜反应
d.使酸性KMnO4溶液和溴水褪色
【练习2】
1、用化学方法鉴别下列各组物质 (1)溴乙烷 、乙醇 、乙醛
溴乙烷 乙醇 乙醛 红色沉淀
新制Cu (OH)溶液
重铬酸甲酸性溶液
变绿
【练习2】
1、用化学方法鉴别下列各组物质 (2)苯、甲苯、乙醇、1-己烯、甲醛、苯酚
苯 溴水 甲苯 乙醇 1-己 烯 甲醛 苯酚
碳氧键
O C
碳氢键
H
与H2加成
二、乙醛的化学性质
1、加成反应
根据加成反应的机理写出CH3CHO 和H2 加成反应的方程式。
CH3CHO + H2
Ni
CH3CH2OH
思考:这个反应属于氧化反应还是还原反应? 为什么?
思考:分析醛基的结构,判断醛基有哪些性质?
H
H
O C
碳氢键
C
H
H
能被氧化剂氧化
2、氧化反应 1>与氧气反应
作业本:P59 5题
其余写到课本上。
【练习】
分别写出丙醛与下列物质反应的化学方程式: (1)与银氨溶液反应: (2)与新制的氢氧化铜反应: (3)与氢气反应:
小结:醛类化学性质
(1) 和H2加成被还原成醇 (2)氧化反应 a.燃烧 b.催化氧化成羧酸 c.被弱氧化剂氧ຫໍສະໝຸດ Ⅰ 银镜反应OR
一、醛: 从结构上看,由烃基(或氢原子)跟醛基相连 而成的化合物叫醛。
1、饱和一元醛的通式: CnH2n+1CHO 或CnH2nO
肉桂醛
苯甲醛 CH2=CH— CHO 兰花含香草醛
CHO
【学与问】
通过乙醛的核磁共振氢谱,你能获取什么信息? 请你指出两个吸收峰的归属。
吸 收 强 度
10
8
6
4
2
与新制的氢氧化铜反应
d.使酸性KMnO4溶液和溴水褪色
【练习2】
1、用化学方法鉴别下列各组物质 (1)溴乙烷 、乙醇 、乙醛
溴乙烷 乙醇 乙醛 红色沉淀
新制Cu (OH)溶液
重铬酸甲酸性溶液
变绿
【练习2】
1、用化学方法鉴别下列各组物质 (2)苯、甲苯、乙醇、1-己烯、甲醛、苯酚
苯 溴水 甲苯 乙醇 1-己 烯 甲醛 苯酚
碳氧键
O C
碳氢键
H
与H2加成
二、乙醛的化学性质
1、加成反应
根据加成反应的机理写出CH3CHO 和H2 加成反应的方程式。
CH3CHO + H2
Ni
CH3CH2OH
思考:这个反应属于氧化反应还是还原反应? 为什么?
思考:分析醛基的结构,判断醛基有哪些性质?
H
H
O C
碳氢键
C
H
H
能被氧化剂氧化
2、氧化反应 1>与氧气反应
作业本:P59 5题
其余写到课本上。
【练习】
分别写出丙醛与下列物质反应的化学方程式: (1)与银氨溶液反应: (2)与新制的氢氧化铜反应: (3)与氢气反应:
小结:醛类化学性质
(1) 和H2加成被还原成醇 (2)氧化反应 a.燃烧 b.催化氧化成羧酸 c.被弱氧化剂氧ຫໍສະໝຸດ Ⅰ 银镜反应OR
人教版高中化学选修五课件3.2醛(人教).pptx

点击此图片进入 课堂10分钟练习
(1)醛类既有氧化性又有还原性,被H2还原生成相应的醇, 被氧化剂氧化生成相应的羧酸。 (2)检验醛基的试剂是银氨溶液和新制Cu(OH)2悬浊液,且均 需在碱性条件下进行。 (3)有关醛计算的常用关系:
①R—CHO~2Ag,②R—CHO~2Cu(OH)2~Cu2O, ③HCHO~4Ag,④HCHO~4Cu(OH)2~Cu2O。
1molHCHO~4molAg, 1molHCHO~4molCu(OH)2~2molCu2O。 (3)二元醛发生银镜反应或与新制Cu(OH)2悬浊液反应时有 如下量的关系 1mol二元醛~4molAg; 1mol二元醛~4molCu(OH)2~2molCu2O。
[例3] 两种饱和一元脂肪醛的混合物,其平均相对分子质量 为51。取4.08g混合物与足量银氨溶液共热,生成银21.6g。试 通过计算判断这两种醛是什么醛,并求它们各自的物质的量。 [解析] 混合醛的物质的量=4.08g÷51g·mol-1=0.08mol,生 成银的物质的量=21.6g÷108g·mol-1=0.2mol>0.08mol×2, 由此可知:混合物中必含有甲醛。 设甲醛的物质的量为x,另一种醛A的物质的量为y。
制羟Cu基(O、H醛)2悬基浊液产生色沉淀;②在碱性加热条件下,能与
银氨溶液反应析出。
砖红
银
(2)①乙醇催化氧化反应的化学方程式为: 2CH3CH2OH+O2催―△化 ―→剂2CH3CHO+2H2O。
②催化氧化反应的化学方程式为:
(3)以下四种有机物的分子式都是C4H10O:
其中能被氧化成含相同数目碳原子的醛的是;能被②氧③化成酮
(2)能和新制Cu(OH)2反应产生红色沉淀。 实验中注意事项: ①Cu(OH)2要新制; ②制备Cu(OH)2是在NaOH溶液中滴加少量CuSO4溶液,应 保持碱过量; ③反应条件是加热煮沸。
《醛》人教版高二化学选修五PPT课件(第3.2课时)

二、乙醛的化学性质
2. 氧化反应 (4)银镜反应(教材 P57 实验3-5)
实验操作
实验现象
(a)中滴加氨水,产生白沉后又变澄清; (c)中水浴加热后,试管内壁出现光亮的银镜。
➢银氨溶液的配制:向硝酸银溶液中逐滴加氨水至最初产生的沉淀恰好溶解为止
二、乙醛的化学性质
工业上用来制瓶胆和镜子
二、乙醛的化学性质
课堂练习
3.某同学探究乙醛的还原性时 ,取1mol/LCuSO4溶液和0.5mol/L NaOH溶液各 1ml,在一支洁将的试管内混合后,向其中又加入5ml 40%的乙醛,结果无红色
沉淀出现。实验失败原因可能是( A C )
A、未充分加热 B、加入乙醛太少 C、加入NaOH溶液的量不够 D、加入CuSO4溶液的量不够
O CH3-C_ OH 被氧化 ?
二、乙醛的化学性质
2. 氧化反应
(1)燃烧 2CH3CHO + 5O2 点燃 4CO2 + 4H2O
(2)催化氧化(醛基的C-H中加O成羧基)
O
O
催化剂
2 CH3−C−H + O2 ∆ 2 CH3−C−OH
(3)强氧化剂 RCH2OH CH3CHO
[O] RCHO [O] RCOOH
➢新制氢氧化铜的配制:向2mlNaOH溶液中滴加4~6滴CuSO4溶液
二、乙醛的化学性质
2. 氧化反应 (5)与新制Cu(OH)2悬浊液反应 Cu2+ + 2OH- ══ Cu(OH)2↓、
CH3CHO + 2Cu(OH)2 + NaOH △
O H−C−H [O]
O HO−C−OH (H2CO3)
重力的大小跟什么因素有关系? 重力的大小跟物体的形状有关? 重力的大小跟物体的质量有关? 重力的大小跟物体的位置有关?
2020版高中化学人教版选修5课件1:3.2 醛

编后语
听课不仅要动脑,还要动口。这样,上课就能够主动接受和吸收知识,把被动的听课变成了一种积极、互动的活动。这对提高我们的学习积极性和口头 表达能力,以及考试时回答主观题很有帮助的。实践证明,凡积极举手发言的学生,学习进步特别快。上课的动口,主要有以下几个方式:
第一,复述。 课本上和老师讲的内容,有些往往非常专业和生硬,不好理解和记忆,我们听课时要试着用自己的话把这些知识说一说。有时用自己的话可能要啰嗦
第二节 醛
装修完的新房往往甲醛超标,甲醛对孕妇儿童的危害尤 其严重,那么新装修的住宅中如何避免和减少甲醛的危 害?
学习目标
• 1.掌握乙醛的组成、结构、性质和用途,了解甲醛、苯甲醛的性质 和用途。
• 2.了解醛的结构特点,能理解醛的性质。 • 3.通过实验进一步训练操作技能、体会实验对认识和研究物质性
联系?”,并先在头脑中理一理思路,想好回答时,先答什么,后答什么。老师对你的回答做出点评和讲解,指出大家都应该注意的问题和标准答案时 你一定要仔细听讲,从中发现哪些是应当记住和掌握的。
2019/9/24
最新中小学教学课件
17
谢谢欣赏!
2019/9/24
最新中小学教学课件
18
无色
物 气味
有刺激性气味
有刺激性气味
理 状态
___气__体_____
___液__体_____
性 质
易溶于水,35%~ 溶解性 40%的甲醛水溶液又
能跟水、乙醇等互溶
称_福__尔__马__林___
• 2.醛的化学性质(以乙醛为例) • (1)氧化反应。 • 醛基是一种还原性基团,可被多种氧化剂氧化。 • ①银镜反应。
一些,那不要紧,只要明白即可。 第二,朗读。 老师要求大家朗读课文、单词时一定要出声地读出来。 第三,提问。 听课时,对经过自己思考过但未听懂的问题可以及时举手请教,对老师的讲解,同学的回答,有不同看法的,也可以提出疑问。这种方法也可以保证
人教版高中化学选修五课件: 醛 (1) (25页)

H
【注意】:醛基的加成,主要指醛基和H2的加 成 ,通常情况下,不能和HX、X2、H2O发生 加成反应。
OO C H C 3 H CH
醛基
O
CH 易断裂,易发生 加氧氧化
O CH易断裂,易发生
加氢还原
醛类性质小结
醛类具有和乙醛类似的化学性质:
加成反应
燃烧
CO2、H2O
醛
银镜反应
被弱氧化剂氧化
氧化反应
O 官能团:—C—H 或 –CHO
不能写成-COH
饱和一元醛的通式为: CnH2nO n≥1
【自主探究1】
乙醛的物理性质
乙醛是一种 无、色有_____刺__激性 气味的 液体,密度比水 小,沸点 是 20.8℃,易挥发,易燃烧,能
与 水、 乙等醇互溶。
【自主探究2】
乙醛的分子结构 HO
结构式: H C C H
•
7.圣诗的溯研究实际上必然属于宗教 文化的 范畴。 俗诗的 根则在 于世俗 文化, 尤其是 民间的 文化。 随着从 原始到 文明的 演进, 许多本 作为宗 教信仰 对象的 圣诗逐 渐向世 俗化方 向转变 ,也就 是从固 定于仪 式场合 演唱的 歌诗向 非信仰 的、文 学性的 说唱诗 转变。
•
8.有时,面对芸芸众生的世界,我常 为那些 美好的 生命和 思想, 浅吟低 唱、瑟 瑟和弦 地奉上 一曲; 而身临 那丑陋 的人生 和污浊 的灵魂 ,我只 能进行 一种自 我的人 生挣扎 和灵魂 的清洗 。
是( B)
A.橙花醛不可以与溴发生加成反应
B.橙花醛可以发生银镜反应
C.1mol橙花醛最多可以与2mol氢气发生加成反应
D.橙花醛是乙烯的同系物
4、糖尿病患者的尿样中含有葡萄糖,在与新制的氢氧化
人教版高二化学选修五教学课件_3.2_醛(共29张ppt)

一分耕耘一分收获
儿童房甲醛超标易诱发儿童白血病
一分耕耘一分收获
第二节 醛
一分耕耘一分收获
一、醛
1、醛的定义:
从结构上看,由烃基(或氢原子)跟醛基 (-CHO)相连而成的化合物叫醛。
R
一分耕耘一分收获
2、醛的分类:
R 饱和醛、不饱和醛
脂肪醛 芳香醛
醛
一元醛 二元醛 多元醛
一分耕耘一分收获
3、讨论:饱和一元醛的通式?
注:“√”代表能,“×”代表不能。
注意:直馏汽油、苯、CCl4、己烷等分别与溴水混合,则能通 过萃取作用使溴水中的溴进入非极性有机溶剂而被萃取,使溴水褪
色,但属于物理变化。
一分耕耘一分收获
巩固练习
1、哪些有机物中含有—CHO?
醛、HCOOH、HCOOR、 葡萄糖、麦芽糖
2、下列哪些不能使酸性KMnO4溶液褪色? 乙烯、甲烷、苯、 乙酸、甲苯、乙醛
3.可用稀HNO3清洗试管内壁的银镜。 4.银氨溶液必须随配随用,不可久置,否则会产生易爆炸的物
质。
一分耕耘一分收获
银镜反应的应用 (1)检验醛基的存在 (2)测定醛基的数目 (3)工业上用来制瓶胆和镜子
一分耕耘一分收获
Ⅱ、与新制的氢氧化铜反应(实验3—6) 1、配制新制的Cu(OH)2悬浊液: 在2ml 10% NaOH溶液中滴入2%CuSO4溶液
b、催化氧化
催化剂
2CH3CHO+O2 △ 2CH3COOH
乙醇
氧化 乙醛
氧化 乙酸
还原
一分耕耘一分收获
银镜反应 c. 被弱氧化剂氧化 与新制的氢氧化铜反应
Ⅰ、银镜反应(实验3—5)
1、配制银氨溶液 取一洁净试管,加入2ml2%的AgNO3溶液,再逐 滴滴入2%的稀氨水,至生成的沉淀恰好溶解 AgNO3+NH3·H2O → AgOH↓+NH4NO3 AgOH+NH3·H2O →[Ag(NH3)2]OH +2H2O
儿童房甲醛超标易诱发儿童白血病
一分耕耘一分收获
第二节 醛
一分耕耘一分收获
一、醛
1、醛的定义:
从结构上看,由烃基(或氢原子)跟醛基 (-CHO)相连而成的化合物叫醛。
R
一分耕耘一分收获
2、醛的分类:
R 饱和醛、不饱和醛
脂肪醛 芳香醛
醛
一元醛 二元醛 多元醛
一分耕耘一分收获
3、讨论:饱和一元醛的通式?
注:“√”代表能,“×”代表不能。
注意:直馏汽油、苯、CCl4、己烷等分别与溴水混合,则能通 过萃取作用使溴水中的溴进入非极性有机溶剂而被萃取,使溴水褪
色,但属于物理变化。
一分耕耘一分收获
巩固练习
1、哪些有机物中含有—CHO?
醛、HCOOH、HCOOR、 葡萄糖、麦芽糖
2、下列哪些不能使酸性KMnO4溶液褪色? 乙烯、甲烷、苯、 乙酸、甲苯、乙醛
3.可用稀HNO3清洗试管内壁的银镜。 4.银氨溶液必须随配随用,不可久置,否则会产生易爆炸的物
质。
一分耕耘一分收获
银镜反应的应用 (1)检验醛基的存在 (2)测定醛基的数目 (3)工业上用来制瓶胆和镜子
一分耕耘一分收获
Ⅱ、与新制的氢氧化铜反应(实验3—6) 1、配制新制的Cu(OH)2悬浊液: 在2ml 10% NaOH溶液中滴入2%CuSO4溶液
b、催化氧化
催化剂
2CH3CHO+O2 △ 2CH3COOH
乙醇
氧化 乙醛
氧化 乙酸
还原
一分耕耘一分收获
银镜反应 c. 被弱氧化剂氧化 与新制的氢氧化铜反应
Ⅰ、银镜反应(实验3—5)
1、配制银氨溶液 取一洁净试管,加入2ml2%的AgNO3溶液,再逐 滴滴入2%的稀氨水,至生成的沉淀恰好溶解 AgNO3+NH3·H2O → AgOH↓+NH4NO3 AgOH+NH3·H2O →[Ag(NH3)2]OH +2H2O
3.2醛-天津市第一中学人教版高中化学选修五课件
c.强氧化剂 ①催化氧化: 写出乙醛催化氧化的方程式(用于制备乙酸)
2CH3CHO + O2
2CH3COOH
写出乙二醛催化氧化的方程式
OHC—CHO + O2
HOOC—COOH
注意:属于氧化反应
②使 酸性高锰酸钾溶液 和 溴水 褪色 (丌能使溴的CCl4溶液褪色,区别于烯和炔)
[小结]
醛(RCHO)
还原
(仲醇)
[练习]
丙酮和氢气加成:
+ H2
写出乙二醛不氢气加成反应的方程式:OHC—CHO + H2
6.甲醛的化学性质:
(丌能収生氧化反应) HO—CH2—CH2—OH
(1)还原反应:HCHO + H2 (2)氧化反应:
CH3OH (甲酸)
CO2↑+H2O (H2CO3)
a.不新制Cu(OH)2反应: HCHO + 2Cu(OH)2 + NaOH
Ⅱ.不新制Cu(OH)2反应: 【实验2】被新制氢氧化铜氧化 ①新制氢氧化铜的配制:在试管里加入10%的NaOH溶液2mL,滴入2%的CuSO4溶液4—6滴。
离子方程式:Cu2+ + 2OH- = Cu(OH)2 ②加入0.5mL乙醛溶液并加热
现象:生成红色沉淀
方程式:CH3CHO + 2Cu(OH)2+ NaOH
说明: Ⅰ.氢氧化二氨合银是弱氧化剂,说明乙醛还原性强。 Ⅱ.检验醛基的方法。 Ⅲ.定量测定醛基个数:1—CHO → 2Ag↓ Ⅳ.工业制镜或保温瓶胆
[练习]写出乙二醛银镜反应的方程式: OHC—CHO + 4[Ag(NH3)2]OH
NH4OOC—COONH4 + 6NH3+ 4Ag↓+ 2H2O
人教版高中化学选修五课件3.2《醛》(5).pptx

质。
醛类物质都含有醛基,所以都能够发生上述两个反应。
化学方程式可表示为: RCHO+2Ag(NH3)2OHR―C―△O→ONH4+2Ag↓+3NH3+H2O R这C两H个O+反2应Cu是(O醛H类)2+的N特aO征H反―R―△C应→O。ONa+Cu2O↓+3H2O
二、能使溴水和酸性KMnO4溶液褪色的有机物
解析 根据混合液与银氨溶液反应可得混合醛的平均相
对分子质量:
RCHO
~ 2Ag 2×108
1.0× 50 626.1%6 50 29% 100
得=M47.5 此值比甲醛、乙醛的相对分子质量均大而排除为此两种
醛 的 混 合 物 。 M( 乙 醛 ) < < M( 丙 醛 ) , 且 两 者 相 差 1 个 碳 原 子,因此,A为乙醛:CH3CHO;B为丙醛:CH3CH2CHO。
答案 A为CH3CHO;B为CH3CH2CHO。
跟踪练习2 某饱和一元醛发生银镜反应时,生成21.6g 银,再将等质量的醛完全燃烧生成4.48L(标准状况下)CO2, 则该醛为( )
A.乙醛B.丙醛 C.丁醛D.己醛 答案 A
A.该物质中有甲酸和甲酸乙酯 B.该物质中有乙酸和甲酸乙酯 C.该物质中可能有甲醇,一定有甲酸乙酯 D.该物质中几种物质都有 答案 C
知识点2:关于醛的银镜反应的定量计算
例2 A、B是两种一元醛,B比A分子多1个碳原子。现 有50g含A66%的溶液与50g含B29%的溶液混合成A、B的混 合水溶液。取1.0g此溶液与足量的银氨溶液反应,可析出银 2.16g。求A、B的结构简式。
(2)由于溴水能氧化—CHO,因此需要先检验—CHO
跟踪练习1 某物质中可能有甲酸、乙酸、甲醇和甲酸 乙酯4种物质中的一种或几种,在鉴定时有下列现象:①可 发生银镜反应;②加入新制Cu(OH)2悬浊液,沉淀不溶解; ③与含酚酞的NaOH溶液共热,发现溶液中红色逐渐消失至 无色。下列叙述中正确的是( )
醛类物质都含有醛基,所以都能够发生上述两个反应。
化学方程式可表示为: RCHO+2Ag(NH3)2OHR―C―△O→ONH4+2Ag↓+3NH3+H2O R这C两H个O+反2应Cu是(O醛H类)2+的N特aO征H反―R―△C应→O。ONa+Cu2O↓+3H2O
二、能使溴水和酸性KMnO4溶液褪色的有机物
解析 根据混合液与银氨溶液反应可得混合醛的平均相
对分子质量:
RCHO
~ 2Ag 2×108
1.0× 50 626.1%6 50 29% 100
得=M47.5 此值比甲醛、乙醛的相对分子质量均大而排除为此两种
醛 的 混 合 物 。 M( 乙 醛 ) < < M( 丙 醛 ) , 且 两 者 相 差 1 个 碳 原 子,因此,A为乙醛:CH3CHO;B为丙醛:CH3CH2CHO。
答案 A为CH3CHO;B为CH3CH2CHO。
跟踪练习2 某饱和一元醛发生银镜反应时,生成21.6g 银,再将等质量的醛完全燃烧生成4.48L(标准状况下)CO2, 则该醛为( )
A.乙醛B.丙醛 C.丁醛D.己醛 答案 A
A.该物质中有甲酸和甲酸乙酯 B.该物质中有乙酸和甲酸乙酯 C.该物质中可能有甲醇,一定有甲酸乙酯 D.该物质中几种物质都有 答案 C
知识点2:关于醛的银镜反应的定量计算
例2 A、B是两种一元醛,B比A分子多1个碳原子。现 有50g含A66%的溶液与50g含B29%的溶液混合成A、B的混 合水溶液。取1.0g此溶液与足量的银氨溶液反应,可析出银 2.16g。求A、B的结构简式。
(2)由于溴水能氧化—CHO,因此需要先检验—CHO
跟踪练习1 某物质中可能有甲酸、乙酸、甲醇和甲酸 乙酯4种物质中的一种或几种,在鉴定时有下列现象:①可 发生银镜反应;②加入新制Cu(OH)2悬浊液,沉淀不溶解; ③与含酚酞的NaOH溶液共热,发现溶液中红色逐渐消失至 无色。下列叙述中正确的是( )
人教版化学选修五3.2醛(共12张PPT)

CH3CH2COONa+Cu2O ↓ +3H2O
• 《学与问》课本58页:
• 甲醛和银氨溶液反应:
• HCHO+2Ag(NH3)2OH
△
• HCOONH4+2Ag↓+3NH3+H2O
• HCHO+4Ag(NH3)2OH
△
• (NH4)2CO3+4Ag↓+6NH3+2H2O
• 甲醛和新制的Cu(OH)2反应:
H
H C
O C
H+H2
催化剂 △
H
C2H5OH
乙醛的加成反应,也叫还原反应, 因为:加入氢原子。
练习:丙醛被银氨溶液氧化的方程式
CH3CH2CHO+2Ag(NH3)2OH △ CH3CH2COONH4+2Ag↓+3NH3+H2O
练习2:丙醛被新制的Cu(OH)2氧化:
CH3CH2CHO+2Cu(OH)2+NaOH △
易溶于水。分子中有两个醛基。
• 质量分数为35%-40%的甲醛水溶液俗称福尔马 林,杀菌、防腐。
• 甲醛还是重要的有机合成原料。3、乙醛的物理性质和用途
• (1)、无色; • (2)、有刺激性气味; • (3)、液体; • (4)、有毒; • (5)、易挥发;易燃烧。 • (6)、与水、乙醇等互溶; • (7)、沸点:20.8℃。 • (8)、密度小于水。 • 有机合成的重要原料;制乙酸、乙酸乙酯等。
第二节 醛
前言
我们已知:
2CH3CH2OH+O2
催化剂 △
2CH3CHO+2H2O
乙醛
• 1、醛的定义:烃基与醛基相连而构成的化合物。 • 简写成:RCHO。 • 最简单的醛:甲醛 HCHO; • 常见的醛:CH3CHO。 • 饱和一元醛的通式:CnH2nO • 2、甲醛的物理性质与用途 • 甲醛俗称蚁醛,无色具有强烈刺激性气味的气体,
• 《学与问》课本58页:
• 甲醛和银氨溶液反应:
• HCHO+2Ag(NH3)2OH
△
• HCOONH4+2Ag↓+3NH3+H2O
• HCHO+4Ag(NH3)2OH
△
• (NH4)2CO3+4Ag↓+6NH3+2H2O
• 甲醛和新制的Cu(OH)2反应:
H
H C
O C
H+H2
催化剂 △
H
C2H5OH
乙醛的加成反应,也叫还原反应, 因为:加入氢原子。
练习:丙醛被银氨溶液氧化的方程式
CH3CH2CHO+2Ag(NH3)2OH △ CH3CH2COONH4+2Ag↓+3NH3+H2O
练习2:丙醛被新制的Cu(OH)2氧化:
CH3CH2CHO+2Cu(OH)2+NaOH △
易溶于水。分子中有两个醛基。
• 质量分数为35%-40%的甲醛水溶液俗称福尔马 林,杀菌、防腐。
• 甲醛还是重要的有机合成原料。3、乙醛的物理性质和用途
• (1)、无色; • (2)、有刺激性气味; • (3)、液体; • (4)、有毒; • (5)、易挥发;易燃烧。 • (6)、与水、乙醇等互溶; • (7)、沸点:20.8℃。 • (8)、密度小于水。 • 有机合成的重要原料;制乙酸、乙酸乙酯等。
第二节 醛
前言
我们已知:
2CH3CH2OH+O2
催化剂 △
2CH3CHO+2H2O
乙醛
• 1、醛的定义:烃基与醛基相连而构成的化合物。 • 简写成:RCHO。 • 最简单的醛:甲醛 HCHO; • 常见的醛:CH3CHO。 • 饱和一元醛的通式:CnH2nO • 2、甲醛的物理性质与用途 • 甲醛俗称蚁醛,无色具有强烈刺激性气味的气体,
人教版高中化学选修五课件:3.2 醛 (1) (共22张PPT)

明朝未及,我只有过好每一个今天,唯一的今天。
昨日的明天是今天。明天的昨日是今天。为什么要计较于过去呢(先别急着纠正我的错误,你确实可以在评判过去中学到许多)。但是我发现有的人过分地瞻前顾后了。为 何不想想“现在”呢?为何不及时行乐呢?如果你的回答是“不”,那么是时候该重新考虑一下了。成功的最大障碍是惧怕失败。这些句子都教育我们:不要惧怕失败。如 果你失败了他不会坐下来说:“靠,我真失败,我放弃。”并且不是一个婴儿会如此做,他们都会反反复复,一次一次地尝试。如果一条路走不通,那就走走其他途径,不 断尝试。惧怕失败仅仅是社会导致的一种品质,没有人生来害怕失败,记住这一点。宁愿做事而犯错,也不要为了不犯错而什么都不做。不一定要等到时机完全成熟才动手。 开头也许艰难,但是随着时间的流逝,你会渐渐熟悉你的事业。世上往往没有完美的时机,所以当你觉得做某事还不是时候,先做起来再说吧。喜欢追梦的人,切记不要被 梦想主宰;善于谋划的人,切记空想达不到目标;拥有实干精神的人,切记选对方向比努力做事重要。太阳不会因为你的失意,明天不再升起;月亮不会因为你的抱怨,今 晚不再降落。蒙住自己的眼睛,不等于世界就漆黑一团;蒙住别人的眼睛,不等于光明就属于自己!鱼搅不浑大海,雾压不倒高山,雷声叫不倒山岗,扇子驱不散大雾。鹿 的脖子再长,总高不过它的脑袋。人的脚指头再长,也长不过他的脚板。人的行动再快也快不过思想!以前认为水不可能倒流,那是还没有找到发明抽水机的方法;现在认 为太阳不可能从西边出来,这是还没住到太阳从西边出来的星球上。这个世界只有想不到的,没有做不到的!不是井里没有水,而是挖的不够深;不是成功来的慢,而是放 弃速度快。得到一件东西需要智慧,放弃一样东西则需要勇气!终而复始,日月是也。死而复生,四时是也。奇正相生,循环无端,涨跌相生,循环无端,涨跌相生,循环 无穷。机遇孕育着挑战,挑战中孕育着机遇,这是千古验证了的定律!种子放在水泥地板上会被晒死,种子放在水里会被淹死,种子放到肥沃的土壤里就生根发芽结果。选
昨日的明天是今天。明天的昨日是今天。为什么要计较于过去呢(先别急着纠正我的错误,你确实可以在评判过去中学到许多)。但是我发现有的人过分地瞻前顾后了。为 何不想想“现在”呢?为何不及时行乐呢?如果你的回答是“不”,那么是时候该重新考虑一下了。成功的最大障碍是惧怕失败。这些句子都教育我们:不要惧怕失败。如 果你失败了他不会坐下来说:“靠,我真失败,我放弃。”并且不是一个婴儿会如此做,他们都会反反复复,一次一次地尝试。如果一条路走不通,那就走走其他途径,不 断尝试。惧怕失败仅仅是社会导致的一种品质,没有人生来害怕失败,记住这一点。宁愿做事而犯错,也不要为了不犯错而什么都不做。不一定要等到时机完全成熟才动手。 开头也许艰难,但是随着时间的流逝,你会渐渐熟悉你的事业。世上往往没有完美的时机,所以当你觉得做某事还不是时候,先做起来再说吧。喜欢追梦的人,切记不要被 梦想主宰;善于谋划的人,切记空想达不到目标;拥有实干精神的人,切记选对方向比努力做事重要。太阳不会因为你的失意,明天不再升起;月亮不会因为你的抱怨,今 晚不再降落。蒙住自己的眼睛,不等于世界就漆黑一团;蒙住别人的眼睛,不等于光明就属于自己!鱼搅不浑大海,雾压不倒高山,雷声叫不倒山岗,扇子驱不散大雾。鹿 的脖子再长,总高不过它的脑袋。人的脚指头再长,也长不过他的脚板。人的行动再快也快不过思想!以前认为水不可能倒流,那是还没有找到发明抽水机的方法;现在认 为太阳不可能从西边出来,这是还没住到太阳从西边出来的星球上。这个世界只有想不到的,没有做不到的!不是井里没有水,而是挖的不够深;不是成功来的慢,而是放 弃速度快。得到一件东西需要智慧,放弃一样东西则需要勇气!终而复始,日月是也。死而复生,四时是也。奇正相生,循环无端,涨跌相生,循环无端,涨跌相生,循环 无穷。机遇孕育着挑战,挑战中孕育着机遇,这是千古验证了的定律!种子放在水泥地板上会被晒死,种子放在水里会被淹死,种子放到肥沃的土壤里就生根发芽结果。选
人教版高二化学选修五:3.2《醛》课件

在日常生活中我们都会有 这样的疑问,为什么有的人喝酒“千杯万杯 都不醉”,而有的人一点喝酒就面红耳赤,
情绪激动?酒量的大小到底与什么有关呢?
首先在乙醇脱氢酶的作用下氧化为乙醛
接着生成的乙醛又在酶的作用下被氧化为乙酸 最后乙酸转化为CO2和H2O
如果人体内这两种酶的含量不够大, 特别是缺少将 乙醛氧化成乙酸的酶,饮酒后就会引起体内乙醛积累,
实验注意事项:
(1)实验成功的关键是制备氢氧化铜时氢氧化钠过量 保证制得的氢氧化铜是悬浊液; (2)加热至沸腾,但温度不能过高
人教版高二化学选修五:3.2《醛》课 件
人教版高二化学选修五:3.2《醛》课 件
二、乙醛 3、乙醛的化学性质
(2)氧化反应
乙醛能被弱氧化剂银氨 溶液、氢氧化铜氧化,那么能否被 KMnO4/H+氧化吗?
导致血管扩张而脸红,同时作用于人的神经系统因此 人就会醉
人教版高二化学选修五:3.2《醛》课 件
人教版高二化学选修五:3.2《醛》课 件
根据结构分析及解酒原理推测乙醛化性
O
C OH CH3 C
O CH
H加H还原成醇 H
H
O 加O氧化成羧酸
人教版高二化学选修五:3.2《醛》课 件
人教版高二化学选修五:3.2《醛》课 件
二、乙醛
3、乙醛的化学性质
(1)加成反应 (加氢还原反应)
O
CH3-C-H +H-H
Ni △
CH3CH2OH
注意:加成时只能与H2、HCN不能与Br2水加成
(2)氧化反应
①燃烧 2CH3CHO + 5O2 点燃
人教版高二化学选修五:3.2《醛》课 件
4CO2 + 4H2O
情绪激动?酒量的大小到底与什么有关呢?
首先在乙醇脱氢酶的作用下氧化为乙醛
接着生成的乙醛又在酶的作用下被氧化为乙酸 最后乙酸转化为CO2和H2O
如果人体内这两种酶的含量不够大, 特别是缺少将 乙醛氧化成乙酸的酶,饮酒后就会引起体内乙醛积累,
实验注意事项:
(1)实验成功的关键是制备氢氧化铜时氢氧化钠过量 保证制得的氢氧化铜是悬浊液; (2)加热至沸腾,但温度不能过高
人教版高二化学选修五:3.2《醛》课 件
人教版高二化学选修五:3.2《醛》课 件
二、乙醛 3、乙醛的化学性质
(2)氧化反应
乙醛能被弱氧化剂银氨 溶液、氢氧化铜氧化,那么能否被 KMnO4/H+氧化吗?
导致血管扩张而脸红,同时作用于人的神经系统因此 人就会醉
人教版高二化学选修五:3.2《醛》课 件
人教版高二化学选修五:3.2《醛》课 件
根据结构分析及解酒原理推测乙醛化性
O
C OH CH3 C
O CH
H加H还原成醇 H
H
O 加O氧化成羧酸
人教版高二化学选修五:3.2《醛》课 件
人教版高二化学选修五:3.2《醛》课 件
二、乙醛
3、乙醛的化学性质
(1)加成反应 (加氢还原反应)
O
CH3-C-H +H-H
Ni △
CH3CH2OH
注意:加成时只能与H2、HCN不能与Br2水加成
(2)氧化反应
①燃烧 2CH3CHO + 5O2 点燃
人教版高二化学选修五:3.2《醛》课 件
4CO2 + 4H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
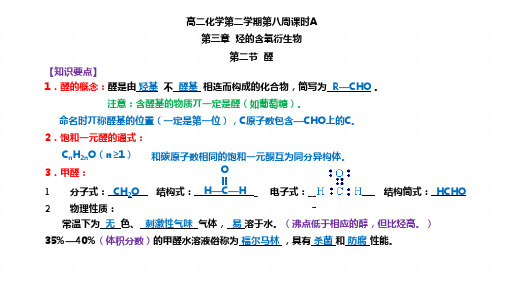
高二化学第二学期第八周课时A
第三章 烃的含氧衍生物
第二节 醛
【知识要点】
1.醛的概念:醛是由 烃基 与 醛基 相连而构成的化合物,简写为 R —CHO 。
注意:含醛基的物质不一定是醛(如葡萄糖)。
命名时不称醛基的位置(一定是第一位),C 原子数包含—CHO 上的C 。
2.饱和一元醛的通式:
C n H 2n O (n≥1) 和碳原子数相同的饱和一元酮互为同分异构体。
3.甲醛: (1)分子式: CH 2O 结构式:_______________ 电子式:_______________ 结构简式: HCHO
(2)物理性质:
常温下为 无 色、 刺激性气味 气体, 易 溶于水。
(沸点低于相应的醇,但比烃高。
) 35%—40%(体积分数)的甲醛水溶液俗称为 福尔马林 ,具有 杀菌 和 防腐 性能。
O H —C —H
4.乙醛:
(1)分子式:C2H4O结构式:_______________ 电子式:_______________ 结构简式:CH3CHO (2)物理性质:
乙醛是一种无色、有刺激性气味的液体。
密度小于水,沸点较低(20.8℃),易挥发,能与水、乙醇、氯仿等互溶。
5.化学性质:
(1)氧化反应
a.燃烧。
