最新化学热力学基础
热力学全套课件pptx2024新版

辐射传热定律
基尔霍夫定律、普朗克定律、斯特藩-玻尔兹曼定 律等,描述了辐射传热的基本规律和特性。
辐射传热的应用
在太阳能利用、红外测温、激光技术等领域广泛 应用。
综合传热问题解决方法探讨
综合传热问题
涉及热传导、对流和辐射传热的复杂问题,需要考虑多种 传热机制的相互作用和影响。
03
开放系统
与外界既有能量交换,又有物 质交换的系统。
状态参量与平衡态
01
状态参量
描述系统状态的物理量,如体 积、压强、温度等。
系统在没有外界影响的条件下, 各部分的宏观性质不随时间变化
的状态。
02
平衡态
热力学第零定律与温度概念
热力学第零定律
如果两个系统与第三个系统各自 处于热平衡,则它们之间也必定 处于热平衡。
热力学全套课件pptx
目录
• 热力学基本概念与定律 • 热力学过程与循环 • 热力学第二定律与熵增原理 • 理想气体性质与应用 • 相变与化学反应热力学 • 热传导、对流和辐射传热机制剖析
01
热力学基本概念与定律
热力学系统及其分类
01
孤立系统
与外界没有物质和能量交换的 系统。
02
封闭系统
与外界只有能量交换,没有物 质交换的系统。
范德华方程的适用范围
适用于中低压、中低温条件下的真实气体行为描述。在高压或低温条件下,需要考虑更复 杂的分子间相互作用和量子效应。
05
相变与化学反应热力学
相平衡条件及相变潜热计算
相平衡条件
在相变过程中,物质各相之间达到平衡 状态的条件。包括温度、热计算
化学热力学基础

Qp = ΔU +Δ (pV) = (U2 - U1) +p(V2 -V1) = (U2 + p2V2) - (U1 + p1V1)
ΔH 称为焓变。ΔH > 0,表明体系从环境吸热; ΔH < 0, 表明体系向环境放热。
4பைடு நூலகம்
1、“焓”不是系统所含的热量。QP与ΔH只是数值上相等, QP不是状态函数,而ΔH是状态函数 。 特别提醒
恒压过程、恒容过程,绝热过程和循环过程。
2
途径
完成这一过程的具体步骤。
4、热与功
体系与环境之间因为温度差而进行的能量交换形式。 热(Q) 体系从环境吸热:Q > 0 ;体系向环境放热:Q < 0 特点:不是状态函数 体系与环境之间除热以外的其它能量交换形式。
功(W)
环境对体系做功:W > 0 ;体系对环境做功:W < 0
7
对于任意的化学反应:aA + bB = gG + dD 标准摩尔反应焓变 rHm = H = g fHm(G)+ d fHm(D)- a fHm(A)- b fHm(B)
标准摩尔燃烧焓变 C H m
Θ
1mol纯物质在标准状态和指定温度下完全燃烧时的标准焓变。 完全燃烧是指C、H、N、S等分别被氧化为CO2(g)、H2O(l)、N2(g)、SO2(g) 。 规定:完全燃烧产物的 CHm= 0 。即: CHm(CO2,g) = CHm(H2O,l) = CHm(N2,g)= CHm(SO2,g) = CHm(O2,g) = 0 对于任意的化学反应:aA + bB = gG + dD rHm = H = a CHm(A)+ b CHm(B)- g CHm(G)- d CHm(D)
最新第六章化学热力学初步化学ppt课件

系统吸热 Q 状态Ⅰ,U1
系统对外作功 W
状态Ⅱ,U2
数学表达式:U2 = U1+QW
△U=U2-U1=Q-W
即 △U=Q-W
(注意Q、W符号的规定)
2024/7/3 10
例题1:某过程中系统从环境吸热100J,
对环境做体积功20J。求过程中系统热力 学能的改变量和环境热力学能的改变量。 解:△U系 =Q-W
△fHθm(H2O,l)=-285.83kJ·mol-1
2024/7/3 33
化学热力学中的标准状态:
是指在温度T和标准压力Pθ=100kPa下的该 物质的状态,简称标准态。
若计量方程写成: 1/2N2+3/2H2→NH3,则一单元反应是 指消耗了1/2molN2和3/2molH2 ,生成了 1molNH3 。
所以,在谈到反应进度时,必须指明相 应的计量方程式。
2024/7/3 23
(2)QV与QP的关系
反应物 T P1 V1 (始态)
等压
(1)
生成物 T P1 V2
若1mol C6H6(l)参加反应,QV=- 3.268×103kJ; 1mol O2参加反应,QV=-3.268×103/7.5kJ。 为了对参与反应的各物质从数量上统一表达化学 反应进行的程度,引进反应进度ξ。
2024/7/3 20
(1)反应进度ξ(extent of reaction) 设有反应: νAA + νBB →νGG +νHH
= H2-H1
(enthalpy)
QP=△H(焓变)
[条件①等压过程②变化过程中系统只作体积功]
意义:等压反应过程中,系统吸收的热量
全部用于改变体系的焓。
化学热力学基础知识点汇总

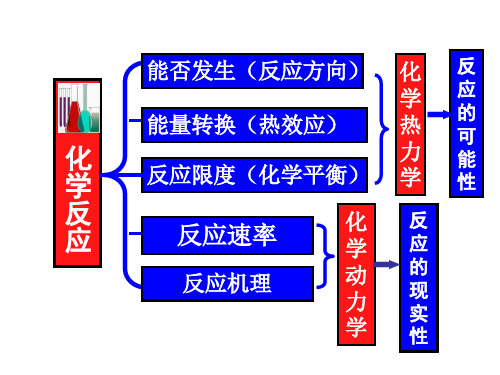
化学热力学基础知识点汇总化学热力学是研究化学反应过程中能量转化规律的科学,它对于理解化学反应的可能性、方向和限度具有重要意义。
以下是对化学热力学基础知识点的详细汇总。
一、热力学的基本概念1、体系与环境体系是我们研究的对象,根据体系与环境之间物质和能量的交换情况,可分为敞开体系、封闭体系和孤立体系。
敞开体系:与环境既有物质交换,又有能量交换。
封闭体系:只有能量交换,没有物质交换。
孤立体系:既无物质交换,也无能量交换。
2、状态函数状态函数是用于描述体系状态的物理量,其值只取决于体系的状态,而与变化的途径无关。
常见的状态函数有温度(T)、压力(P)、体积(V)、内能(U)、焓(H)和熵(S)等。
3、过程与途径过程是指体系状态发生变化的经过,而途径则是完成这个过程的具体方式。
例如,从状态 A 到状态 B 可以通过不同的途径实现,但状态函数的变化量只与始态和终态有关,与途径无关。
二、热力学第一定律热力学第一定律也称为能量守恒定律,其表达式为:ΔU = Q + W 。
其中,ΔU 表示体系内能的变化,Q 表示体系从环境吸收的热量,W 表示环境对体系所做的功。
当体系膨胀时,体系对环境做功,W 为负值;当体系被压缩时,环境对体系做功,W 为正值。
如果是恒容过程,体积不变,W = 0,此时ΔU = Qv ,Qv 表示恒容热。
如果是恒压过程,压力恒定,ΔU =Qp PΔV ,Qp 表示恒压热,此时 H = U + PV ,ΔH = Qp 。
三、热化学1、化学反应的热效应化学反应在一定条件下发生时,所吸收或放出的热量称为化学反应的热效应。
热效应分为等容热效应和等压热效应。
2、热化学方程式热化学方程式是表示化学反应与热效应关系的方程式。
需要注明反应物和生成物的状态、反应的温度和压力以及反应热。
3、标准摩尔生成焓在标准状态下,由最稳定单质生成 1mol 化合物时的焓变称为该化合物的标准摩尔生成焓。
利用标准摩尔生成焓可以计算化学反应的标准摩尔反应焓变:ΔrHmθ =ΣνBΔfHmθ(B) 。
化学热力学基础
Q 和W 都不是状态函数
体积功
体积功是体系在反抗外压发生体积变 化时而引起的体系与环境间能量的传递。 W体= p外ΔV
p内 P内 ΔV
P外 p外
第二节 热力学第一定律和热化学
热力学第一定律
能量只能从一种形式转化为另一种形式,从一个 物体传递给另一个物体,但在转化和传递过程中,能 量的总数量不变。 它的另一种表达形式就是:不供给能量而连续不 断的对外做功的第一类永动机是不可能造成的。
CaCO3 (方解石)
CaO(s)+ CO2(g)
△ rH m
CaO(s)+ CO2(g)
Ca(s)+ C (石墨)+ O2
标准生成焓
温度T下,由标准态的各元素的稳定单质生成 标准态下1mol某纯物质的热效应称为该物质的标 准摩尔生成焓(standard molar enthalpy of formation)简称标准生成焓。
example
例:2H2(g)+O2(g)=2H2O(g)
△rHm(298.15K)=-483.6 kJ· -1 mol H2(g)+1/2O2(g)=H2O(g)
△rHm(298.15K)=-241.8 kJ· -1 mol
标准摩尔生成焓和标准摩尔燃烧焓
CaCO3 (方解石) Qp =△rH=H2 - H1 =∑H(生成物) - ∑H(反应物)
练习题 求H2O(l)→H2O(g) ΔrHm
ΔfHm
1 查表: H2(g) + O2(g) = H2O(l) 2
H2O(l) = -285.8 kJ· -1 mol
1 H2(g) + O2(g) = H2O(g) 2
ΔfHm H2O(g) = -241.8 kJ· -1 mol ΔrHm = ΔfHm H2O(g)-ΔfHm H2O(l) ΔrHm = -241.8+285.8 = 44.0 kJ· -1 mol
2024版大学化学热力学基础课件

大学化学热力学基础课件contents •热力学基本概念与定律•热力学基本量与计算•热力学过程与循环•热力学在化学中的应用•热力学在物理化学中的应用•热力学在材料科学中的应用目录01热力学基本概念与定律孤立系统与外界既没有物质交换也没有能量交换的系统。
开放系统与外界既有能量交换又有物质交换的系统。
封闭系统与外界有能量交换但没有物质交换的系统。
热力学系统及其分类状态函数与过程函数状态函数描述系统状态的物理量,如内能、焓、熵等。
状态函数的变化只与系统的初、终态有关,与过程无关。
过程函数描述系统变化过程的物理量,如热量、功等。
过程函数的变化与具体的路径有关。
能量守恒定律能量既不能被创造也不能被消灭,只能从一种形式转化为另一种形式,或者从一个物体转移到另一个物体。
热力学第一定律表达式ΔU = Q + W,其中ΔU表示系统内能的变化,Q表示系统与外界交换的热量,W表示外界对系统所做的功。
热力学第二定律的表述不可能从单一热源吸热并全部转化为有用功而不引起其他变化。
熵增原理在孤立系统中,一切不可逆过程必然朝着熵增加的方向进行。
熵是描述系统无序度的物理量,熵增加意味着系统无序度增加。
02热力学基本量与计算温度是表示物体冷热程度的物理量,是热力学中最重要的基本量之一。
温度的概念温标的定义温度的测量温标是用来衡量温度高低的标准,常见的有摄氏温标、华氏温标和开氏温标等。
温度的测量通常使用温度计,其原理是利用物质的热胀冷缩性质或其他物理效应来测量温度。
030201温度与温标压力的概念压力是单位面积上受到的垂直作用力,是描述气体状态的重要物理量。
体积的概念体积是物体所占空间的大小,对于气体而言,体积通常是指气体所充满的容器的容积。
压力与体积的关系在温度不变的情况下,气体的压力与体积成反比关系,即波义耳定律。
压力与体积030201热量的概念热量是物体之间由于温差而传递的能量,是热力学中重要的基本概念之一。
功的概念功是力在力的方向上移动的距离的乘积,是描述系统能量转化或传递的物理量。
化学热力学基础

化学热力学基础热力学是研究能量变化和转化的科学,而化学热力学则专注于研究化学反应中的能量变化和转化。
在化学反应中,物质的能量发生了变化,这种变化可以通过热力学原理和方程来描述和计算。
本文将介绍化学热力学的基本概念、方程和应用。
一、热力学基本概念1. 系统和周围:热力学研究的对象称为系统,而系统以外的一切称为周围。
系统和周围可以通过物质和能量的交换而发生相互作用。
2. 状态函数:热力学的基本量不依赖于路径,只与初始状态和终态有关,被称为状态函数。
例如温度、压力、体积、内能等都是状态函数。
3. 第一法则:能量守恒定律,即能量既不能创造也不能消失,只能从一种形式转化为另一种形式。
对于化学反应,能量的变化可以表示为热量和功的转化。
4. 第二法则:熵增原理,即自然界趋向于无序与熵增加的状态。
化学反应中,反应通常会使系统的熵增加。
5. 第三法则:绝对零度,即温度低于绝对零度(0K)时,系统的熵趋于零。
这个法则揭示了温度对于熵的影响。
二、熵变与自由能1. 熵变:熵变(ΔS)是描述系统熵增或减的度量,根据熵变可以判断反应的方向性和自发性。
当ΔS大于零时,反应向有序的方向进行,反之向无序的方向进行。
2. 熵变的计算:对于化学反应,熵变可以根据摩尔熵变的差值计算得到。
摩尔熵变可以通过标准摩尔熵的差异计算得到。
3. 自由能:自由能(G)是描述系统可用能量的函数,用于预测反应的可能性。
自由能与熵变和焓变有关,可以通过关联熵变、焓变和温度的方程计算得到。
三、焓变与反应热量1. 焓变:焓变(ΔH)是化学反应中吸热或放热的度量,可以用于判断反应的放热性质和温度变化。
当ΔH小于零时,反应放热;当ΔH 大于零时,反应吸热。
2. 焓变的计算:焓变可以通过化学反应的热化学方程式和反应热量的测定来计算得到。
3. 反应热量:反应热量是化学反应中产生或吸收的热量,可以通过实验测量得到。
反应热量可以用于判断反应的热效应及其在工业和实验室中的应用。
大学化学化学热力学基础

真实气体状态方程在科研和工程中的应用举例
石油工业
利用真实气体状态方程预测天然气在地下的分布和储量,指导油气 田的开发和生产。
化学工程
在化工过程中涉及气体的压缩、膨胀、冷却和加热等操作,需要利 用真实气体状态方程进行精确计算和控制。
航空航天工程
在飞机和火箭的发动机设计中,需要考虑高温高压下气体的性质和行 为,真实气体状态方程为相关计算提供了重要依据。
压条件。
混合气体中各组分性质变化规律探讨
道尔顿分压定律
混合气体的总压力等于各组分气 体分压之和,分压与各组分的摩 尔分数成正比。
阿马格分体积定律
混合气体的总体积等于各组分气 体分体积之和,分体积与各组分 的摩尔分数成正比。
亨利定律
在一定温度和平衡状态下,气体 在液体中的溶解度与液面上该气 体的平衡压力成正比。
04
相平衡与相图分析
相平衡条件及相律应用
相平衡条件
在恒温恒压下,当多相系统中各相的性质和数量均不随时间变化时,称系统处于相平衡状态。此时, 各相中的组元成分和物性均保持恒定,且各相间的宏观物质交换达到动态平衡。
相律应用
相律是描述相平衡系统中相数、组元数和自由度之间关系的定律。对于简单系统,相律可表示为F=CP+2,其中F为自由度,C为组元数,P为相数。利用相律可以判断系统可能存在的相数及自由度,进 而分析系统的相平衡状态。
大学化学化学热力学基础
目 录
• 热力学基本概念与定律 • 热力学在化学反应中的应用 • 热化学方程式及计算 • 相平衡与相图分析 • 化学平衡移动原理及影响因素探讨 • 非理想气体状态方程及混合气体性质研究
01
热力学基本概念与定律
热力学系统及其分类
1章 化学热力学基础

第一章化学热力学基础第一节热力学第一定律一、基本概念和常用术语1、体系和环境体系:被选作研究对象的部分。
环境:体系之外并与体系密切相关的部分。
敞开体系:与环境有物质交换、有能量交换。
封闭体系:与环境无物质交换、有能量交换。
孤立体系:与环境无物质交换、无能量交换。
2、状态和状态函数状态:体系的宏观性质的综合表现。
状态函数:确定体系状态的物理量。
(p, V, T, U, H, S, G)状态函数特征:状态函数的改变量只与体系的始态、终态有关,而与变化途径无关。
分类:广度性质(具有加和性)强度性质(不具有加和性T, p )3、过程和途径过程:当体系的状态发生变化时,发生变化的经过。
途径:完成状态变化过程的具体步骤。
等容过程等温过程等压过程绝热过程二、热力学第一定律1、热和功(体系与环境能量交换的两种形式)规定:体系吸热:Q >0体系放热:Q <0环境对体系做功:W >0体系对环境做功:W <0特 点: 热和功不是状态函数其数值与具体途径有关2、热力学能U特 点: 是状态函数,广度性质,其绝对值未知。
3、热力学第一定律该定律的实质是能量守恒与转化定律。
第二节 化学反应的热效应一、反应热在封闭体系、非体积功=0的前提下,当反应物和生成物温度相同时,化学反应过程中吸收或放出的热量。
1. 恒容反应热(QV)W =0+(- p e x V )=0U= QV + W= QVQV 全部用于改变系统的热力学能2.恒压反应热 U Q V ∆=Vp Q U p ∆-=∆ex()12ex 12V V p Q U U p --=- 定义焓: ()111222)(V p U V p U Q p +-+=状态函数,广度性质焓变:Qp = H pV U H +=3. 反应进度ξ(读作“克赛”)a A + d D = g G + h H0= – a A – d D + g G + h H写成通式式中符号B 表示反应中的物质,而νB 为数字或简分数,称为物质B 的化学计量数。
化学热力学基础

ΔfHmӨ(O2, g) = 0 ΔfHmӨ(H2, l)= 0
ΔfHmӨ(Ag, s)= 0
2
应用及意义
ΔrHm 反应物 生成物
Σν反ΔfHm
Σν产ΔfHm
同样数量和种类的 指定状态单质
ΔrHm =Σν产ΔfHm -Σν反ΔfHm 根据此式,可以计算任一在标准状态下的反应的反 应热。
弹式量热计
1 温度计 2 引燃线 3 氧弹 4 搅拌器 5 水 6 绝热套
2
恒压反应热 在恒压过程中完成的化学反应称为恒压反应,其热效
应称为恒压反应热,用Qp表示 ΔU=Qp-W W = pΔV Qp=U2-U1+p(V2-V1) Qp =ΔU+W Qp=ΔU+pΔV
由于恒压过程 Δp=0 即 p2=p1=p
符号 ξ,单位为 mol 对于任意一个反应 νA A+νB B = νG G+νH H Δξ = ΔnB/νB
对于指定的化学计量方程,当ΔnB等于νB时,反应进
度为 1,表示各物质按计量方程进行的完全反应
4
Qp 和QV 的关系
生成物 I T1 p2 V1 n2 (II)恒容过程
H3 (III)
生成物 Ⅱ T1 p1 V2 n2
状态函数的特性 ① 定值性—— 状态确定,状态函数确定。 系统的变化,用状态函数的改变来描述。 ② 状态函数的改变,只与过程有关,而与途径无关。
在计算有关状态函数变化的问题时,只需明确系统的
始态和终态即可,而不需考虑具体的变化途径。
③ 同一体系,状态函数之间相关。
状态函数的分类
(1) 容量性质: 即广度性质,如 V, m, U,H 等, 具有加和性。 (2) 强度性质:如 T, p, c,ρ 等,不具有加和性。
2024版大学化学热力学基础ppt课件

在化学反应中,反应前后物质的焓的差值称为 焓变,用ΔH表示;反应前后物质的熵的差值 称为熵变,用ΔS表示。
11
热力学性质图表
01
温度-熵图(T-S图)
以温度为纵坐标、熵为横坐标的 图示方法,用于表示物质在不同 温度下的熵值变化。
02
压力-体积图(p-V 图)
以压力为纵坐标、体积为横坐标 的图示方法,用于表示物质在不 同压力下的体积变化。
28
非平衡态热力学基本概念
非平衡态定义
系统内部存在不均匀性,导致物 理量(如温度、压力、浓度等) 在空间或时间上呈现不均匀分布 的状态。
热力学流与力
描述非平衡态系统中,各种物理 量的流动(如热流、粒子流、信 息流等)及其驱动力(如温度梯 度、浓度梯度等)。
局域平衡假设
在非平衡态系统中,可以将其划 分为若干小区域,每个小区域内 达到局部平衡状态,从而可以应 用平衡态热力学的理论。
内容
热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值 保持不变。
数学表达式
ΔU = Q - W,其中ΔU为系统内能的变化,Q为系统吸收的热量,W为系统对外所做的功。
2024/1/25
6
热力学第二定律
内容
不可能把热从低温物体传到高温物体而不产生其他影响,或不可能从单一热源 取热使之完全转换为有用的功而不产生其他影响,或不可逆热力过程中熵的微 增量总是大于零。
热力学第三定律 在热力学温度零度(即T=0开)时,一切完美晶体的熵值等于零。
10
热力学性质的计算
热容
系统在某一过程中,温度升高(或降低)1K 所吸收(或放出)的热量,称为该系统在该过 程中的“热容”,用C表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
l
10
非体积功
功不是状态函数
3 . 热力学能
热力学能(U): 系统内所有微观粒子的全部
能量之和,也称内能。
U是状态函数。
U 2 U1 U
热力学能变化只与始态、终态有关, 与变化途径无关。
jjjkk 11
4. 热力学第一定律
热力学定律的实质是能量守恒与转化定律。 U1 Q U 2 W
U2 = U1 + Q + W U2 - U1 = Q + W 对于封闭系统热力学第一定律为:
化学热力学基础
§5.1 热力学术语和基本概念 §5.2 化学热力学的四个重要状态函数
§5.3 化学热力学的应用
jjjkk
1
§5.1 热力学术语和基本概念
5.1.1 系统和环境 5.1.2 状态和状态函数 5.1.3 过程
5.1.4 相
5.1.5 化学反应计量式和反应进度
jjjkk 2
5.1.1 系统和环境
△ rHm不同。 • 聚集状态不同时, 2H2(g)+O2(g) 2H2O(l)
mol-1 △ rHm (298.15K) = -571.66kJ·
△ rHm 不同。 • 化学计量数不同时,
H2(g) + 1/2 O2(g)
H2O
17
jjjkk
mol-1 △ rHm (298.15K) = -241.82kJ·
≈ △ rHm
18
4. 标准摩尔生成焓
在温度T下,由参考状态单质生成物质 B(νB=+1)的标准摩尔焓变,称为物质B的 标准摩尔生成焓。 mol-1 △ fHm (B,相态,T) ,单位是kJ·
H2(g) + 1/2 O2(g)
H2O
mol-1 △ fHm (H2O ,g,298.15K) = -241.82kJ·
均相系统(或单相系统)
非均相系统(或多相系统)
jjjkk 6
5.1.5 化学反应计量式和反应进度
化学反应计量式: aA bB yY zZ
0 BB
B
B —物质B的化学计量数 νA=-a, νB=-b, νY=y, νZ=z 。
反应进度:
jjjkk
nB
B
nB ( ) nB (0)
B
单位是mol
7
反应进度必须对应具体的反应方程式。
§5.2 化学热力学的四个重要状态函数
5.2.1 热力学能(内能)
5.2.2 焓
5.2.3 熵
5.2.4 自由能
jjjkk
8
5.2.1 热力学能
1.热( Q ) 系统与环境之间由于存在温差而传递 的能量。 热不是状态函数。 规定:系统吸热:Q >0; 系统放热: Q <0。
3. rUm与rHm 的关系
U Q W U H pexV
对于无气体参加的反应,W = –pex V=0 △ rHm = △ rUm 有气体参加的反应:
△ rUm =△ rHm –pex V =△ rHm – n(g)RT
=△ rHm –RT∑νB(g)
jjjkk
jjjkk
U Q W
12
5.2.2 焓
1.焓和焓变 对于封闭系统,在定容过程中, V = 0,W = 0
QV U QV为定容反应热。
jjjkk 13
在定压过程中,
U 2 U1 Qp pex V2 V1
U Qp pexV
U 2 U1 Qp p2V2 p1V1
△ fHm (参考态单质,T)=0
jjjkk 19
5. 标准摩尔燃烧焓
在温度T下, 物质B (νB= -1)完全氧化成指 定产物时的标准摩尔焓变,称为物质 B 的标 准摩尔燃烧焓。
mol-1 △ cHm (B,相态,T) ,单位是kJ·
C
CH 3OH(l)
H2O H CO2 3 2H 2O(l) O (g) CO (g) 2 2 2
(Ⅰ)
终态
4
始态
jjjkk
(Ⅱ)
5.1.3 过程
定温过程:始态、终态温度相等,并且过 程中始终保持这个温度。T1=T2 定压过程:始态、终态压力相等,并且过 程中始终保持这个压力。p1=p2 定容过程:始态、终态容积相等,并且过 程中始终保持这个容积。V1=V2
jjjkk 5
5.1.4 相
系统中物理性质和 化学性质完全相同的且 与其他部分有明确界面 分隔开来的任何均匀部 分,叫做相。
系统:被研究对象。 环境:系统外与其密切相关的部分。
敞开系统:与环境有物质交换也有能量交换。 封闭系统:与环境无物质交换有能量交换。 隔离系统:与环境无物质、能量交换。
jjjkk
3
5.1.2 状态和状态函数
状态:系统的宏观性质的综合表现。 状态函数:描述系统性质的物理量。(p,V,T) 特点:①状态一定,状态函数一定。 ② 状态变化,状态函数也随之而变,且 状态函数的变化值只与始态、终态 有关,而与变化途径无关。
Qp (U 2 p2V2 ) U1 p1V1
状态函数 Qp = H
焓: H U pV 焓变: H H 2 H1
jjjkk
吸热反应 H 0, 放热反应 H 0
14
2.热化学方程式
在一定条件下,化学反应 0 BB
B
反应的摩尔热力学能变rUm
jjjkk 9
2.功( W ) 系统与环境之间除热之外以其它形式 传递的能量 。 规定:系统对环境做功,W<0(失功) 环境对系统做功,W>0(得功) 体积功: W Fex l
pex A l pex V2 V1 pex V
jj ξ n
反应的摩尔焓变 rHm
H B H r H m ξ n
jjjkk 15
热化学方程式: 表示化学反应及其反应热(标准摩尔焓 变)关系的化学反应方程式。 2H2(g)+O2(g) 2H2O(g) mol-1 △ rHm (298.15K) = -483.64kJ·
△ rHm 称为反应的标准摩尔焓变。
标准状态: 气体:T,p = p =100kPa 液、固体:T,p 下,纯物质 溶液:溶质B,bB=b =1mol· kg-1
jjjkk
c B= c
16 -1 =1mol· L
2H2(g)+O2(g) 2H2O(g)
mol-1 △ rHm (298.15K) = -483.64kJ·
