两种传代方法影响人胚胎干细胞转染效率的比较
细胞转染技术原理及应用(瞬时转染和稳定转染)

细胞转染技术原理及应用(瞬时转染和稳定转染)常规转染技术可分为两大类,一类是瞬时转染,一类是稳定转染(永久转染)。
前者外源DNA/RNA 不整合到宿主染色体中,因此一个宿主细胞中可存在多个拷贝数,产生高水平的表达,但通常只持续几天,多用于启动子和其它调控元件的分析。
一般来说,超螺旋质粒DNA 转染效率较高,在转染后24-72 小时内(依赖于各种不同的构建)分析结果,常常用到一些报告系统如荧光蛋白,β 半乳糖苷酶等来帮助检测。
后者也称稳定转染,外源DNA 既可以整合到宿主染色体中,也可能作为一种游离体(episome)存在。
尽管线性DNA 比超螺旋DNA 转入量低但整合率高。
外源DNA 整合到染色体中概率很小,大约1/104 转染细胞能整合,通常需要通过一些选择性标记,如来氨丙基转移酶(APH;新霉素抗性基因),潮霉素B 磷酸转移酶(HPH),胸苷激酶(TK)等反复筛选,得到稳定转染的同源细胞系。
转染技术的选择对转染结果影响也很大,许多转染方法需要优化DNA 与转染试剂比例,细胞数量,培养及检测时间等。
一些传统的转染技术,如DEAE 右旋糖苷法,磷酸钙法,电穿孔法,脂质体法各有利弊,其主要原理及应用特点见下表:(各种转染方法的比较)除上述传统方法外,近年来国际上推出了一些阳离子聚合物基因转染技术,以其适用宿主范围广,操作简便对细胞毒性小,转染效率高受到研究者们的青睐。
其中树枝状聚合物(Dendrimers)和聚乙烯亚胺(Polyethylenimine,PEI)的转染性能最佳,但树枝状聚合物的结构不易于进一步改性,且其合成工艺复杂。
聚乙烯亚胺是一种具有较高的阳离子电荷密度的有机大分子,每相隔二个碳个原子,即每“第三个原子都是质子化的氨基氮原子,使得聚合物网络在任何pH 下都能充当有效的“质子海绵”(proton sponge)体。
这种聚阳离子能将各种报告基因转入各种种属细胞,其效果好于脂质聚酰胺,经进一步的改性后,其转染性能好于树枝状聚合物,而且它的细胞毒性低。
胰酶和Ⅳ型胶原酶在人胚胎干细胞传代中的作用特点

a e a s gn n r o r s r ain,a d t e k r oy e p o l at r mo e t a 1 a s g s Re u t W e fu d ta , p sa e y 'trp s a i g a d c y p e e v to f n h a y tp rf e f r h n p s a e . i e 0 sl s o n h t asg d b t p i ,t e c l c l n a n fr y r sn h el oo y w s u i m,t ec ln , o n t n r t sh g e n o a c l n mb r ic e s d f s rt a h to ol g n s o h o o ) fn ai ae wa ih ra d ttl el u e n r a e a t h n ta f l e a e o e c a
消化组少 , 传代 时细胞存活率和复苏后细胞存 活率 和低浓度胰 酶组相似 。分别用两种 酶处 理传代十余代 , 核型均无 异常。结论 两种酶消化均适用于 h S E C培 养 , 二者作用特点不完 全相 同 , 分别适 用于不同的实验需要 。
【 关键词】 人胚 胎干细胞 ;细胞培养 ; 胰酶 ;I型胶原酶 V 【 中图分类号】 R34 2 9 .
Co p r s n be we n Tr psni a i n a d Co l g n s e t e t i m a io t e y i z t0 n l e a e Tr a m n n a
Pa s gng o u a sa i fH m n Em b y n c S e ls r o i t m Cel
维普资讯
20 8 正 0
两种转染试剂转染 C2C12 细胞效率比较分

两种转染试剂转染 C2C12 细胞效率比较分精品论文两种转染试剂转染 C2C12 细胞效率比较分析韦伟,赵元元,张维娅,赵书红,李新云5 ,农业动物遗传育种与繁殖教育部重点实验室~华中农业大学~武汉 430070, 摘要:C2C12 细胞是鼠的骨骼肌成肌细胞~常用于体外研究肌细胞成肌分化~研究表明 C2C12 细胞的转染效率较低~为了提高 C2C12 细胞的转染效率~建立理想的转染条件~本研究对比分析了 FuGENE HD 和 Lipofectamine 2000 两种常用转染试剂的转染效率。
研究结果表明10 FuGENE HD 转染寡核苷酸的效率比 Lipofectamine 2000 高~而转染质粒的效率比Lipofectamine 2000 低。
另外我们还发现培养基中的血清会降低细胞的转染效率。
本研究结果为提高 C2C12 细胞的转染效率提供了新的信息。
关键词:转染效率,寡核苷酸,质粒,C2C12 细胞中图分类号:Q-3315Compare analysis of the transfection efficiency of twotransfection regents in C2C12 CellsWei Wei, Zhao Yuanyuan, Zhang Weiya, Zhao Shuhong, Li Xinyun(Key Lab of Agricultural Animal Genetics, Breeding and Reproduction of Ministry of Education,20 Huazhong Agricultural University, WuHan 430070)Abstract: C2C12 cells are the myoblast of mice, which are used asthe model for investigating the differentiation of myoblast in vitro. The transfection efficiency of the C2C12 cells was not good in many studies. In order to improve the transfection efficiency of C2C12 cells and contribute an ideal condition of transfection. The transfection efficiency of two transfection reagents, FuGENE25 HD and Lipofectamine 2000, was analyzed in this study. According the results, the transfection efficiency of FuGENE HD was higher than that of Lipofectamine 2000 when oligo nucleic acids was transfected, but it was lower than Lipofectamine 2000 when plasmid was transfected in the C2C12 cells. Also, we found that serum in cultured medium could inhibit the transfection efficiency. These results offered useful informationfor improving the transfection efficiency of30 C2C12 cells.Key words: transfection efficiency; oligo nucleic acids; plasmid;C2C12 cells0 引言简转染是指将外源遗传物质转入到真核细胞内的过程。
各种转染方法比较

各种转染方法比较不同的实验室转染方法选择会依赖于多个相关因素,如目标细胞类型、转染效率、细胞毒性、需求的表达时间、实验的规模和预算等。
以下是一些常见的转染方法的比较:1. 离子交换法(Calcium phosphate transfection)离子交换法是最早开发和使用的转染方法之一、它使用磷酸钙和DNA或RNA的复合物在细胞表面形成凝析沉淀物。
该方法简单、经济且较为普遍,适用于许多细胞类型。
然而,它的转染效率较低,存在较多的细胞毒性。
2. 迷走转染法(Lipofection)迷走转染法是当前最常用的转染技术之一,通过磷脂体(例如Lipofectamine)与质粒DNA形成复合物。
该方法转染效率高,而且适用于许多类型的细胞,包括哺乳动物和非哺乳动物。
然而,迷走转染法存在一些限制,如细胞毒性、稳定性较差,和细胞特异性。
3. 电穿孔法(Electroporation)电穿孔法是通过应用电场使细胞膜暂时性孔化来实现转染效果。
它可以用于转染各种类型的细胞,包括哺乳动物、鸟类和植物。
电穿孔法的转染效率高,但存在一定的细胞毒性和细胞损伤风险。
此外,电穿孔设备的成本较高,需要专门训练的技术人员来操作。
4. 病毒载体转染法(Viral vector transfection)病毒载体转染法使用经修饰的病毒作为转染载体,可实现高效的基因传递和表达。
常用的病毒载体包括腺病毒、衣壳病毒和逆转录病毒。
这些病毒对于不同类型的细胞具有不同的亲和力和转染效率。
然而,病毒载体转染法的主要限制是细胞对病毒的感染能力,以及在临床应用中可能引发的安全性问题。
5. 直接注射法(Direct microinjection)直接注射法是一种机械刺伤细胞膜直接将DNA注入细胞的方法。
这种方法对于特定的细胞类型具有高效转染的能力,如哺乳动物受精卵和干细胞。
它可以实现精确控制和单细胞水平的转染,但需要昂贵的设备和专业技能。
总结起来,转染方法的选择应根据实验的具体需求来进行。
细胞转染的各种方法比较

细胞转染的各种方法比较梭华-Sofast TM基因转染试剂(高效率和细胞毒性低的聚阳离子转染试剂)梭华-Sofast TM是新一代的阳离子聚合物基因转染试剂,梭华-Sofast TM具有高效率转染所必备特征,如浓缩DNA,将DNA运送到细胞内,并使其在细胞核内释放等;梭华-Sofast TM 的细胞毒性很低,这是它的另一个重要特点;而且与其它转染试剂相比,梭华-Sofast TM很稳定,不被血清清除。
以上优点使得基因转染的操作简便易行,重复性好。
梭华-Sofast TM 已被成功应用于很多原代培养细胞和转化细胞株的基因转染。
一. 特点★转染效率高且稳定,比目前常用产品高10%。
★细胞培养基中的血清存在与否,均能获得高效率转染。
★细胞毒性低。
★转染程序简单,转染前后无需更换培养基转染实验可以在半小时内完成。
★价格比进口产品便宜60%。
★完善的技术支持,保证质量,无效退货。
二. 效果比较将梭华转染试剂与其它公司的聚阳离子转染试剂和常用的脂质体转染试剂分别在常用的报告基因如GFP、荧光素酶基因和LacZ基因的转染效率方面作了对比。
实验表明:1. 梭华-Sofast TM具有很高和稳定的转染率,是一种很好的基因转染试剂。
对某些常用的细胞株梭华-Sofast TM 转染率高于某常用阳离子脂质体,对其他多数细胞株的转染效率相近。
2. 需特别指出梭华-Sofast TM在原代培养细胞HUV-EC中有较高的转染效率,而大多数阳离子脂质体对此细胞的转染效率很低。
3. 通过检测转染细胞荧光素酶基因的活性,测定其转染效率。
实验表明梭华转染试剂具有最高的转染率。
4. 通过检测转染GFP基因的细胞所发出的荧光强度来测试转染效率,实验发现梭华转染试剂的转染率比常用的脂质体转染试剂转染率高达5-10%。
三. 适用范围☉适应于众多原代培养细胞和转化细胞株的基因转染。
☉适用于瞬时转染和稳定转染。
☉适应于贴壁细胞和悬浮细胞转染。
四. 各种转染方法的比较(在目前使用的方法中, 阳离子聚合物转染法是最好的转染试剂。
各种细胞转染方法比较

各种细胞转染方法比较细胞转染方法包括DEAE-葡聚糖法,磷酸钙法,阳离子脂质体法,阳离子聚合物,病毒介导法,Biolistic 颗粒传递法(基因枪粒子轰击法),显微注射法,电穿孔法等,对各种方法的原理,应用,特点,厂家产品等信息的比较结果如下表:转染方法原理主要应用特点厂家及产品DEAE-葡聚糖法带正电的DEAE-葡聚糖与核酸带负电的磷酸骨架相互作用形成的复合物被细胞内吞瞬时转染相对简便、重复比磷酸钙好,但对细胞有一定的毒副作用,转染时需除血清且一般只用于BSC-1,CV-1,COS细胞系Sigma-Aldrich(DEAE-DextranTransfectionKit)磷酸钙法磷酸钙DNA复合物吸附细胞膜被细胞内吞稳定转染,染瞬转染不适用于原代细胞(所需的DNA浓度较高),操作简便但重复性差,有些细胞不适用细胞建议用CSCL梯度离心,转染是拷贝数较多GIBCO BRL ,Promega阳离子脂质体法带正电的脂质体与核酸带负电的磷酸基团形成复合物,然后脂质体上剩余的电核与细胞膜上的唾液酸残基的负电核结合;另一种解释是通过细胞是内吞作用而被进入细胞。
(若DNA浓度过高,中和脂质体表面电核,而降低了与细胞的结合能力)稳定转染,瞬时转染,所有细胞使用方法简单,可携带大片段DNA,通用于各种类型的裸露DNA或RNA,能转染各种类型的细胞,没有免疫原性。
虽在体外基因转染中有很高的效率,但在体内,能被血清清除,并在肺组织内累积,诱发强烈的抗炎反应,导致高水平的毒性,这在很大程度上限制了其应用Invitrogen(Lipofectamine 2000,Lipofectamine,Lipofectin,LipofectaminePlus,Cellfectin)Roche(Dosper,DOTAP,FuGENE6)CPG Biotech Co(GeneLimoPlus,GeneLimoSuper)Promega(Transfast,Tfx,Transfectam)阳离子聚合物带正电的聚合物与核酸带负电的磷酸基团形成带正电的复合物后与细胞表面带负电的蛋白多稳定转染,瞬时转染,所有细胞除了具有阳离子脂质体的转染效率高,操作简单,适用范围广,重复性好等特点外,还具有在体内,转染效率高,细胞毒性低等特点,是新一代的转染试剂。
各种转染方法比较

各种转染方法比较转染是将外源DNA或RNA导入体细胞的一种常用技术,用于研究基因功能、疾病机制、基因治疗等领域。
常用的转染方法包括化学法、电穿孔法、病毒载体介导转染和生物矢量直接注射法等。
下面将对这些转染方法进行详细比较。
1.化学法:化学法是最简单、最常用的转染方法之一,主要通过化学试剂与DNA或RNA形成复合物,进而被细胞摄取。
常用的化学试剂有钙磷酸盐、聚乙烯亚胺(PEI)、脂质体、高分子聚合物等。
化学法的优势在于易操作、适用于不同细胞类型,且无需特殊设备。
但其转染效率相对较低,引起细胞毒性的风险较高。
2.电穿孔法:电穿孔法又称为电转染法,通过利用电场作用使细胞膜发生瞬时通透性,使外源DNA或RNA进入细胞。
这种方法可使用电脉冲仪或特殊转染设备进行操作,适用于多种细胞类型。
相比于化学法,电穿孔法的转染效率更高,但对细胞的毒性稍高。
3.病毒载体介导转染:病毒载体介导转染是一种高效的转染方法,常用的病毒载体有腺病毒(Adenovirus)、腺相关病毒(Adeno-associated virus,AAV)、逆转录病毒(Retrovirus)和慢病毒(Lentivirus)等。
这些病毒载体不仅能将外源DNA或RNA导入细胞,还能使其在细胞内稳定表达。
病毒载体介导转染的优势在于高转染效率、稳定表达,适用于许多细胞类型。
然而,为了避免潜在的致病性和免疫反应,需要选择无毒性、无致病性的病毒载体。
4.生物矢量直接注射法:生物矢量直接注射法是将外源DNA或RNA直接注射到体内,让其进入目标细胞。
这种方法适用于许多动物模型研究,如小鼠、斑马鱼等。
生物矢量直接注射法的优势在于转染效率高、实验操作简单,但对于人体病理研究等实验要求较高的场景,其应用范围较窄。
根据以上比较,选择适合自己研究需求和细胞类型的转染方法非常重要。
需要考虑的因素包括转染效率、细胞毒性、操作难度、成本等。
在实际应用中,有时也可结合多种方法,例如将化学法与电穿孔法相结合,能够提高转染效率。
三种脂质体介导的花鲈胚胎干细胞转化效率的比较.pdf

! !
水! 产! 学! 报
"#$%&’( #) )*+,-%*-+ #) .,*&’
! ! ! ! ! !
! ! ! ! !
/012 !" ,&02 #& 3452 , $""#&
文章编号: %""" ’ "#%( ( $""# ) "( ’ ")$% ’ "#
!"#$%&’(") "* +**’,’+),- "* ./&++ 0’$("#+( #+1’%.+1 .&%)(*"&#%.’") ." +#2&-")’, (.+# ,+00( 1+&’3+1 *&"# !"#$%&"’(") *"+%,-./0
$ ! H- ,8A6<9AC%, ,.,-& +0AC619A$, ,+,’ I;4A6J98$
= = 胚胎干细胞具有发育上的多能性, 能够在体 外长期培养、 扩增、 转化和筛选, 具有正常的二倍 体核型, 通过细胞移植和核移植技术能使其与受 体胚胎嵌合, 生产包括生殖系在内的各种组织的 嵌合体个体。利用胚胎干细胞的多能性, 将细胞 水平上的突变转变为个体水平上的突变, 从而缩 短改良品种的周期和时间。 脂质体法目前广泛应用于真核细胞的转化, 其介导细胞转化方法简单、 转化效率高, 不需要昂
干货:细胞转染的常用方法
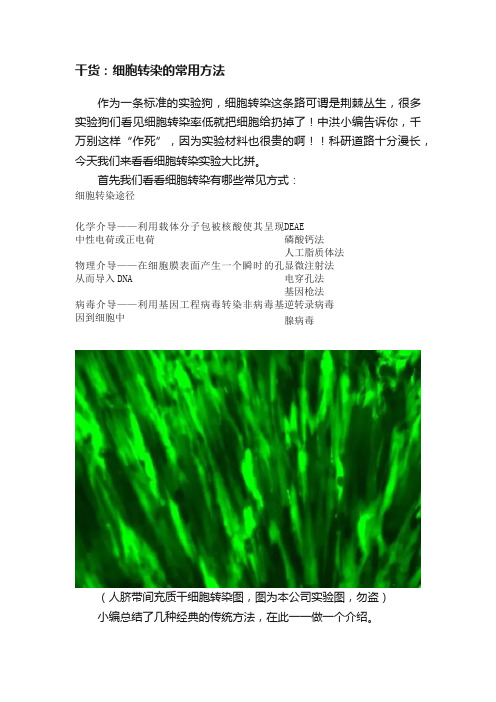
干货:细胞转染的常用方法作为一条标准的实验狗,细胞转染这条路可谓是荆棘丛生,很多实验狗们看见细胞转染率低就把细胞给扔掉了!中洪小编告诉你,千万别这样“作死”,因为实验材料也很贵的啊!!科研道路十分漫长,今天我们来看看细胞转染实验大比拼。
首先我们看看细胞转染有哪些常见方式:细胞转染途径化学介导——利用载体分子包被核酸使其呈现中性电荷或正电荷DEAE磷酸钙法人工脂质体法物理介导——在细胞膜表面产生一个瞬时的孔从而导入DNA 显微注射法电穿孔法基因枪法病毒介导——利用基因工程病毒转染非病毒基因到细胞中逆转录病毒腺病毒(人脐带间充质干细胞转染图,图为本公司实验图,勿盗)小编总结了几种经典的传统方法,在此一一做一个介绍。
1磷酸钙共沉淀原理:该法可用于瞬时或稳定转染。
然而因其对pH、温度和缓冲液盐浓度的微小变化十分敏感,所得结果容易出现差异,且对许多类型的细胞培养物(尤其是原代细胞)具有细胞毒性,转染效率较差。
实验步骤:将核酸与氯化钙在磷酸盐缓冲液中混合,同时控制好pH、温度等条件→ 室温孵育,生成浓缩DNA的极小不溶性颗粒沉淀→ 将颗粒型沉淀分散到细胞中,促进DNA粘附在细胞表面→ 共沉淀通过内吞作用进入胞浆→ 分析细胞瞬时基因表达或者选择稳定性传染。
2人工脂质体法原理:带正电的脂质体与核酸带负电的磷酸基团形成复合物,进而可被细胞内吞稳定转染/瞬时性转染。
这种方法几乎适用于所有细胞,转染效率高、重复型好,但转染时需要去除血清,转染效果随细胞类型变化大。
实验步骤:在单独试管中分别稀释核酸及转染试剂→ 脂质体与核酸的磷酸骨架结合,形成复合物→ 脂质体上的正电荷有助于复合物与细胞膜结合→ 复合物通过内吞作用进入胞浆→ 分析细胞瞬时基因表达或沉默情况。
3病毒转染原理:对于用脂质体不能实现转染的细胞,可以采用病毒转染。
可用于蛋白质过表达或抑制,是临床研究中最常用的方法。
它通过侵染宿主细胞将外源基因整合到染色体中,可用于难转染细胞、原代细胞的稳定性转染。
细胞瞬时转染 稳定转染

细胞转染摘要:真核蛋白表达细胞转染方式有两种:瞬时转染和稳定转染,本文的主要介绍了两者的定义和适用性及细胞转染一般步骤,影响转染效率的因素,帮助我们提高实验的成功率。
在哺乳动物细胞蛋白表达实验,根据不同的实验目的,将质粒导入细胞有两种方法:瞬时转染和稳定转染。
细胞转染是将外源基因导入真核细胞的过程。
质粒、DNA、RNA将这些外源基因导入到真核细胞内并不容易,要跨越细胞膜的屏障进入细胞质。
瞬时转染瞬时转染是指外源基因导入到细胞后得以表达,但是基因不整合到细胞的基因组上,因此不会随着细胞的生长复制。
因此,瞬时转染的时间有限,通常只持续几天,直到外源基因在细胞生长分裂过程中因各种因素消失为止。
判断细胞是否转染成功,在构建质粒上含有报告基团,以指示目标基因是否存在,一般在转染两天后即能被检测到。
稳定转染稳定转染是在瞬时转染的基础上,瞬时转染时有一小部分的基因会整合到细胞基因组上,并随着细胞的生长分裂,质粒会随机分配到子细胞中从而稀释直至最终丢失,所以稳定转染要进行稳定细胞系的筛选,经过筛选出来的细胞株,此时的质粒已经完全整合到细胞基因组中,随着细胞的生长复制并稳定的遗传给后代。
瞬转稳转适用性瞬时转染表达和稳定转染表达最显著的区别就是在时间上。
瞬时转染在转染后四天即能收获细胞,瞬时转染一般用于基因产物的短期表达、基因敲除、蛋白质的小规模合成。
相对于瞬时转染,稳定转染表达适用于长期的药理学研究遗传调控机制研究及大规模的蛋白质合成,需要大量的周期,因此更费力成本投入高。
目前,在进行哺乳动物细胞蛋白表达蛋白时,因为细胞培养技术的进步和人们对瞬时转染的不断探索,人们已经可以对一些常用细胞进行悬浮培养,实现了瞬时转染对重组蛋白的大规模合成,节省了时间和成本。
细胞转染一般步骤以24孔板进行细胞瞬时转染表达为例,全程操作均为无菌状态,以免造成细胞污染转染前准备,细胞株或者直接培养后的细胞用胰蛋白酶消化后计数,铺板,培养基为含有1ml血清,不含抗性的正常培养基。
转染效率低的原因

转染效率低的原因1.细胞类型:不同细胞株在基因转染上的敏感性和响应性各不相同。
一些细胞株对基因转染过程中用的化学试剂和转染载体的特异性反应较弱,从而导致转染效率低。
2.细胞状态:在基因转染前,细胞的状态也会对转染效率产生影响。
例如,细胞过度密集化时,细胞的生理状态可能会发生改变,从而降低了细胞对外源基因的摄取和表达能力。
3.细胞数量:正确选择合适的细胞数量进行转染也是一个重要因素。
如果细胞数量太少,可能会使细胞的可见表达效应降低。
4.转染试剂和载体的选择:不同的细胞株可能对不同的试剂和载体具有不同的敏感性。
因此,在选择试剂和载体时应根据细胞类型进行优化选择,以提高转染效率。
5.转染方法:转染方法不正确或不合适也是转染效率低的原因之一、例如,电穿孔法可能会导致细胞膜破裂,细胞死亡,从而影响转染效率。
6.微环境:转染过程中,细胞所处的微环境也会影响转染效率。
细胞培养温度、pH值、离子浓度、细胞培养液成分等都可能对细胞的生长和基因表达产生影响。
7.DNA质量:外源基因的质量也是影响转染效率的一个重要因素。
如果外源基因的质量不好,可能会导致转染效率低。
8.转染时间:转染的时间可能会影响转染效率。
如果转染时间太短,细胞未能充分与外源基因接触;而如果转染时间太长,则可能导致细胞受损或死亡。
9.细胞状态:细胞生长阶段也会影响转染效率。
例如,细胞处于分裂期或静止期时,可能不容易转染成功。
10.细胞培养条件:培养基的成分、温度、CO2浓度等因素都会影响细胞生长和基因表达,从而影响转染效率。
综上所述,基因转染效率低的原因有很多,包括细胞类型、细胞状态、细胞数量、转染试剂和载体的选择、转染方法、微环境、DNA质量、转染时间、细胞状态以及细胞培养条件等。
为了提高转染效率,需要对这些因素进行优化和调整,以满足实验要求。
实验小站细胞转染操作方法及各方法比较

实验小站细胞转染操作方法及各方法比较转染,是将外源性基因导入细胞内的一种专门技术。
随着基因与蛋白功能研究的深入,转染目前已成为实验室工作中经常涉及的基本方法。
转染大致可分为物理介导、化学介导和生物介导三类途径。
电穿孔法、显微注射和基因枪属于通过物理方法将基因导入细胞的范例;化学介导方法很多,如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法,有较为原始的原生质体转染,和现在比较多见的各种病毒介导的转染技术。
理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。
病毒介导的转染技术,是目前转染效率最高的方法,同时具有细胞毒性很低的优势。
但是,病毒转染方法的准备程序复杂,常常对细胞类型有很强的选择性,在一般实验室中很难普及。
其它物理和化学介导的转染方法,则各有其特点。
需要指出的一点,无论采用哪种转染技术,要获得最优的转染结果,可能都需要对转染条件进行优化。
影响转染效率的因素很多,从细胞类型、细胞培养条件和细胞生长状态,到转染方法的操作细节,都需要考虑。
一、细胞传代1. 试验准备:200ul/1mlTip 头各一盒(以上物品均需高压灭菌),酒精棉球,废液缸,试管架,微量移液器,记号笔,培养皿,离心管。
2. 弃掉培养皿中的培养基,用 1ml 的 PBS 溶液洗涤两次。
3. 用 Tip 头加入 1ml Trypsin 液,消化 1 分钟(37℃,5%CO2 )。
用手轻拍培养瓶壁,观察到细胞完全从壁上脱落下来为止。
4. 加入 1ml 的含血清培养基终止反应。
5. 用 Tip 头多次吹吸,使细胞完全分散开。
6. 将培养液装入离心管中,1000rpm 离心 5min。
7. 用培养液重悬细胞,细胞计数后选择0.8X106 个细胞加入一个35mm 培养皿。
8. 将合适体积完全培养液加入离心管中,混匀细胞后轻轻加入培养皿中,使其均匀分布。
9. 将培养皿转入 CO2培养箱中培养,第二天转染。
人胚胎干细胞传代培养及细胞化学染色特性

[ 图分 类 号] R3 9 中 2 [ 献 标 识 码] A 文 DOI 1 . 8 0 z z h . 0 2 O . 1 :0 3 7 / gc lu e a d c t c e i a t i n h r c e itc f h m a m b y ni tm el b u t r n y o h m c lsa ni g c a a t rs is o u ne r o c s e c ls
第 2 卷 第 2期 l
21 O 2年 4月
化 中 国 组 织 化 学 与 细 胞 学 杂 志
CHI NES OURNAL S EJ OF HI TOCHEM I TRY S AN D CY TOC H EM I T RY S
V o1 .21 .N O .2
A Dr 2O1 . 2
c 1s usng m o e e e 1 i us mbr n c fhr bl s s a he f e r1 ye yo i i o a t s t e de a r,a xp or d t y o he ia t i i ha a nd e l e he c t c m c ls a n ng c r c t r s is o m a e br o c t m c ls p t n o l if r nta e ol nis a d e e i tc f hu n m y ni s e e l ,s on a e usy d f e e i t d c o e n mbr i b di s Re yo d o e . - s t uma m b yo cs e c ls wh e m o ph o i t i e o it nc r u t e or h n 3 uis H ne r ni t m e l os r ol gy ma n a n d c nss a y we e c lur d m et a 0 D s a e n mou e e br o c fb ob a t . The y o he ia t i i hu n e b y i t m e l ( a s g so s m y ni i r l s s c t c m c ls a n ng of ma m r on c s e c Is f) r ALP.PAS a c AE r l ostve,whie he d fe e ta e o o e b c m e o i us y we ke . I nd 0 N — we e a 1 p ii l t if r n i t d c l nis e a bv o l a r n
干细胞的培养与传代方法

干细胞的培养与传代方法干细胞是一类能够自我更新并具有潜能分化成多种细胞类型的特殊细胞。
它们具有许多潜在的应用价值,例如再生医学、疾病治疗和药物筛选等。
干细胞的培养和传代方法是研究者在实验室中进行干细胞研究所必需的技术。
本文将介绍干细胞的培养和传代方法,以帮助读者更好地理解和掌握这一领域的关键技术。
一、干细胞培养条件的优化干细胞培养的基本条件包括培养基、培养器具和培养环境等。
为了获得稳定和高质量的干细胞培养,研究者需要优化这些条件。
1.培养基的选择:干细胞培养基的选择是干细胞培养的基础。
目前常用的培养基包括无血清培养基和有血清培养基。
无血清培养基可以避免血清来源的不稳定性和免疫原的潜在风险,但其成本较高,且需要较复杂的配方和条件。
有血清培养基通常使用胎牛血清,成本较低且易于获取,但由于血清来源的不稳定性,存在一定的批次差异和细胞应激的风险。
对于特定类型的干细胞,研究者可以选择不同的培养基,以满足其特定的培养需求。
2.培养器具的选择:培养器具也是干细胞培养的重要因素。
常用的培养器具包括细胞培养瓶、培养皿和多孔膜培养器。
对于干细胞的培养,培养器具的表面要求较为特殊,以提供良好的附着和增殖环境。
通常,干细胞培养中常使用带有特殊表面修饰的培养器具,如胶原被修饰的培养瓶。
此外,可使用特制的细胞培养器具,如培养皿的凹槽和凹槽,以便更好地控制干细胞的分裂和传代。
3.培养环境的优化:干细胞对培养环境的要求较高,包括适当的温度、湿度和气氛等。
通常,干细胞培养需要在37摄氏度的恒温培养箱中进行,保持水分通常通过加入适当量的培养基或者使用水合舱实现。
对于某些特定类型的干细胞,如神经干细胞,还需要提供一定的气氛,如增加二氧化碳和氧气浓度等。
二、干细胞传代的方法干细胞在进行长期培养时需要进行传代,以维持其生长状态和增殖能力。
干细胞传代是一种将干细胞从初始培养器中移至新的培养器中的过程。
1.胶原酶消化法:胶原酶消化法是一种常用的干细胞传代方法。
无饲养层人胚胎干细胞系的培养及传代

无饲养层人胚胎干细胞系的培养及传代
人胚胎干细胞(hES)在医学界中具有重要的基础研究价值和巨大的临床应用前景。
目前,大部分胚胎干细胞培养都使用饲养层细胞,但这个方法制备繁琐,因此以无饲养层培养体系替代饲养层培养体系,是近年来hES细胞基础研究的重点和热点。
如何进行无饲养层人胚胎干细胞系的培养及传代?
1. 在培养瓶中加入适量matrigel(覆盖瓶底即可)放入培养箱孵育 1小时左右。
2. 吸去matrigel,将饲养层培养的人胚胎干细胞传代洗涤后,最后细胞转移到此培养瓶中,加CM培养。
3. 在人胚胎干细胞克隆生长5天左右传代。
吸去培养液,加dispase 5%CO培养箱2消化至克隆大部分脱壁。
4. 加适量培养液,用移液管轻轻吹打使克隆脱壁。
5. 将细胞悬液转移到15ml离心管中,用移液管吹打几次使细胞克隆至适当大小。
6. 吸取适量混匀的悬液至小离心管中,离心沉淀,用胰酶消化成单细胞,加培养液中和,细胞计数。
7. 以1000rpm的速度离心5分钟。
8. 吸去上清,加CM培养液重悬细胞。
9. 按照_90,000–170,000 cells/cm2将细胞接种到已铺好matrigel的培养瓶中,补加适量CM。
轻轻晃动培养瓶,使克隆均匀分布在瓶底,放入5%CO培养箱2培养。
虽然无饲养层培养体系比饲养层培养体系更具优势,但是大多数hES细胞无饲养层培养体系中仍含有动物源蛋白或人源性蛋白,而且在限定性培养基中添加的各种生长因子非常昂贵。
所以这个方法还有待改进。
细胞转染方法比较

细胞转染方法比较
细胞转染方法是指将外源基因转入细胞中的一种技术,是细胞基因学
研究的基础。
它具有非常重要的研究意义,可以将DNA、RNA或蛋白质引
入细胞,从而提高研究的准确性,发展基因治疗技术,还可以实现重组技术,在生物医药方面已经发挥了巨大的作用。
常用的细胞转染方法有电穿孔、热穿孔、化学转染、动力转染、质粒
载体转染等,下面就具体介绍这些方法的优缺点及适用条件。
一、电穿孔
电穿孔是将外源DNA用电压转染到细胞表面的一种方法,采用电穿孔
转染时,首先将目的基因与含有盐的溶液混合,然后在细胞上施加脉冲电压,使基因可以透过电穿孔进入细胞。
优点是转染效率高,可以较快地将
基因转染到细胞中,而不会造成细胞的死亡和损伤,并且不需要昂贵的设备。
缺点是转染的时间短,极易受环境条件的影响,转染率往往显著降低,另外,由于电压的作用,细胞表面可能受到副作用,效果不一定很理想。
二、热穿孔
热穿孔是通过改变细胞温度以及外源基因的溶液温度,使膜的稳定性
得到改变,有助于外源基因进入细胞。
优点是转染效率较高,能够获得比
较好的转染效果,且操作简单,易于掌握。
胚胎干细胞介导法

细胞工程胚胎干细胞介导法胚胎干细胞(embryonic stem cell,ES)是从胚泡内细胞团分离得到的多潜能细胞。
一、胚胎干细胞介导将外源基因导入体外培养的ES细胞,经筛选后获得整合稳定和表现良好的细胞,将这些细胞注射到胚泡腔中,部分ES细胞可与内细胞团融合并参与其分化,形成嵌合体。
在嵌合过程中,带有外源基因的ES细胞可能进入生殖系,再经杂交育种得到纯合体,这种纯合体即为所需的转基因动物。
此方法在小鼠上应用比较成熟,大家畜比较困难。
二、胚胎干细胞介导法的过程◆获取发育至一定时期的胚胎,经培养后,剥离和分散内细胞团,再培养,最后分离、扩散、鉴定ES细胞。
◆通过基因打靶技术,将外源基因经逆转录病毒感染、电脉冲法等方法导入ES细胞,体外培养和筛选有外源基因表达者。
◆获取囊胚期胚胎,作为ES细胞的移植受体。
◆通过显微操作将ES细胞注入到囊胚期胚胎的腔内,使之与内细胞团紧靠在一起,成为嵌合体。
◆将注射过的胚胎,经培养后筛选无发育缺损的囊胚,移植到交配第3天的假孕受体动物子宫内,培育出转基因动物。
胚胎干细胞介导的转基因技术三、胚胎干细胞介导法的优势◆打破了物种的界限,突破了亲缘关系的限制,加快了动物群体遗传变异程度;◆可以进行定向变异和育种,利用同源重组技术对ES细胞进行遗传操作,通过细胞核移植生产遗传修饰性动物,有可能创造新的物种;◆利用ES细胞技术,可在细胞水平对胚胎进行早期选择,这样可以提高选择的准确性,缩短育种时间。
近年来的研究表明,利用ES细胞生产转基因动物在动物生产中发挥着极为重要的作用。
3种转基因方法及其与受精卵不同发育阶段的关系 DNA 显微注射DNAGastrula 胚胎干细胞 DNA 显微注射 反转录病毒感染反转录病毒感染或DNA 转染或电转移胚胎干细胞介导法外源基因整合率高,植入囊胚前筛选合适的转化的ES细胞,克服了以前只能在子代选择的缺点,并能充分利用分子生物学发展起来的各种先进方法,是很有前途的技术。
两种体系下诱导多潜能干细胞定向分化为运动神经元前体细胞的差异

两种体系下诱导多潜能干细胞定向分化为运动神经元前体细胞的差异李哲;方明珠;陈红;郭钢花;范家宏;毛志娟【摘要】目的将人诱导多潜能干细胞(iPSCs)定向分化为脊髓运动神经元前体细胞(MNP),并比较在有无饲养层两种体系下的分化效率.方法分别在鼠胚胎成纤维细胞饲养层和无饲养层体系中培养人iPSCs.诱导6 d获得神经上皮前体细胞(NEP),诱导12 d获得MNP细胞.倒置显微镜下观察细胞形态变化,免疫荧光染色鉴定iPSCs、NEP、MNP标记物,实时定量聚合酶链反应检测NEP相关基因SOX1、HOXA3,MNP相关基因OLIG2、PAX6,及多能性基因SOX2、OCT4的转录水平.结果两种体系中iPSCs均表达多能性标记物,NEP及MNP均高表达神经相关标记物,低表达多能性标记物,有饲养层体系中NEP细胞SOX1、HOXA3,MNP细胞OLIG2、OCT4基因表达明显高于无饲养层,PAX6和SOX2表达无显著性差异.结论 iPSCs在两种培养体系均可有效分化为MNP细胞,在有饲养层体系中分化效率较高.%Objective To induce human-induced pluripotent stem cells(iPSCs)to differentiate into spinal motor neuron precursor (MNP)and compare the induction efficiency in systems of feeder and feeder-free. Methods iPSCs cultured on mouse feeder cells or in feeder-free condition were induced into neuroepithelial progenitors (NEP) on the sixth day and MNP on the twelveth day.Their morphology was observed under inverted micro-scope,and the markers of iPSCs,NEP,MNP were detected with immunofluorescence.NEP-related genes SOX1 and HOXA3,MNP-related genes OLIG2 and PAX6,and pluripotency genes SOX2 and OCT4 were detected with real-time quantitative polymerase chain reaction. ResultsiPSCs expressed pluripotency markers,while NEP and MNP expressed high levels of neural related markers and low levels of pluripotency markers in two systems. The expression of the genes SOX1, HOXA3, OLIG2 and OCT4 was higher in the feeder system,and there was no significant difference in the expression of genes SOX2 and PA X 6. Conclusion iPSCs can differentiate into MNP in culture systems of feeder and feeder-free,and the induction efficiency is higher in the feeder system.【期刊名称】《中国康复理论与实践》【年(卷),期】2018(024)003【总页数】8页(P269-276)【关键词】人诱导多潜能干细胞;运动神经元;神经分化【作者】李哲;方明珠;陈红;郭钢花;范家宏;毛志娟【作者单位】郑州大学第五附属医院,河南郑州市450052;郑州大学第五附属医院,河南郑州市450052;华中科技大学同济医院,湖北武汉市430030;郑州大学第五附属医院,河南郑州市450052;郑州大学第五附属医院,河南郑州市450052;华中科技大学同济医院,湖北武汉市430030【正文语种】中文【中图分类】R741.05人诱导多潜能干细胞(human-induced pluripotent stem cells,iPSCs)是将特定的多能遗传基因导入体细胞获得的一种类似胚胎干细胞的多能干细胞。
ww小鼠胚胎干细胞移植后两种示踪方法的比较

4
H e a l t hC e n t e r o f t h eT h i r dC o m m u n i c a t i o nD e v i c eR e p a i r S h o po f A i r F o r c e ,B e i j i n g 1 0 0 0 7 5 ,C h i n a
C o r r e s p o n d i n ga u t h o r :C H E NL i n g T e l :0 1 0 8 3 1 9 8 8 5 2 ,E m a i l :c h l y z 3 4 @1 6 3 c o m
A B S T R A C T : Ob j e c t i v e T ot r a c et h ee m b r y o n i cs t e m( E S )c e l l s t r a n s p l a n t e di n t or a t b r a i nb yl a b e l i n gt h ec e l l s w i t hg r e e nf l u o r e s c e n t p r o t e i n( G F P )a n db ym o u s en e u r o n a l s p e c i f i ca n t i b o d yT h y 1a n dc o m p a r et h e i r f e a t u r e s Me t h o d s F o r G F Pl a b e l i n g ,t r a n s f e c t p E G F P N 1p l a s m i dc o n t a i n i n gG F Pa n da n t i n e o m y c i ns e q u e n c e si n t oe m b r y o n i cs t e mc e l l a n da d dn e o m y c i nf o rm o r et h a n1 0p a s s a g e s T ot e s tt h eG F P e x p r e s s i o ni nv i v o ,t h eG F P E Sw a st r a n s p l a n t e di n t oh e a l t h yr a t b r a i n ,a n dt h ef r o z e ns e c t i o n e ds l i d e sw e r e
四种胞外基质支持人胚胎干细胞的生长:效果有差异吗?

四种胞外基质支持人胚胎干细胞的生长:效果有差异吗?胡智兴;罗敏;周轶平;梁道明【摘要】背景:胞外基质在维持人胚胎干细胞的自我更新和未分化状态方面具有重要作用,建立无血清无饲养层、成分明确的人胚胎干细胞培养系统是人胚胎干细胞运用于临床移植研究的前提.目的:比较4种胞外基质对于维持人胚胎干细胞生长的效果差异.方法:常规复苏人胚胎干细胞株BG02,设立4组,分别将人胚胎干细胞转至预铺有纤粘连蛋白、Ⅳ型胶原、Matrigel、层粘连蛋白的培养板上,均在含bFGF,TGFβ及ITS无血清培养基中培养.测定细胞集落贴壁率及分化率,流式细胞仪检测人胚胎干细胞特异性分子标志Oct-4及Nanog的表达,RT-PCR检测胞外基质受体的表达.结果与结论:与纤粘连蛋白组、Ⅳ型胶原组比较,Matrigel组和层粘连蛋白组人胚胎干细胞集落的贴壁率均明显增加(P < 0.05),分化率均明显降低(P < 0.05),Oct-4,Nanog阳性率均明显升高(P < 0.05),后2组各项指标比较无明显差异(P > 0.05).Matrigel组、层粘连蛋白组人胚胎干细胞高表达整合素受体integrinα5,integrinα6和integrinβ1;而纤粘连蛋白组、Ⅳ型胶原组3种整合素受体的表达均明显降低.提示Matrigel和层粘连蛋白可以较好支持人胚胎干细胞在无饲养层体系生长,而纤粘连蛋白和Ⅳ型胶原无法维持人胚胎干细胞的未分化状态;人胚胎干细胞integrin受体家族激活状态的不同,可能是不同胞外基质对于维持人胚胎干细胞自我更新产生差异的原因之一.【期刊名称】《中国组织工程研究》【年(卷),期】2010(014)006【总页数】4页(P1027-1030)【关键词】胞外基质;自我更新;生长;整合素;人胚胎干细胞【作者】胡智兴;罗敏;周轶平;梁道明【作者单位】昆明医学院药理学教研室,云南省昆明市,650031;昆明医学院云南省生物医学工程中心,云南省昆明市650031;昆明医学院云南省生物医学工程中心,云南省昆明市650031;昆明医学院云南省天然药物药理重点实验室,云南省昆明市,650031;昆明医学院云南省生物医学工程中心,云南省昆明市650031;昆明医学院云南省天然药物药理重点实验室,云南省昆明市,650031;昆明医学院第二附属医院,云南省昆明市,650031【正文语种】中文【中图分类】R394.20 引言现已明确胞外基质在维持人胚胎干细胞的自我更新和未分化状态方面具有重要作用,其中Matrigel、层粘连蛋白、纤粘连蛋白、胶原等已运用于人胚胎干细胞的无饲养层无血清培养[1-3]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《中国组织工程研究》 Chinese Journal of Tissue Engineering Research72 ·研究原著·孙莉,女,1990年生,江苏省靖江市人,汉族,在读硕士,主要从事细胞生物学和分子生物学方面的研究。
通讯作者:魏建峰,博士,副教授,江苏省脑病生物信息重点实验室,江苏省徐州市 221004;徐州医科大学基础医学院组织胚胎学教研室,江苏省徐州市 221004文献标识码:A来稿日期:2019-03-19 送审日期:2019-03-27 采用日期:2019-05-31 在线日期:2019-09-26Sun Li, Master candidate, Jiangsu Key Laboratory of Brain DiseaseBioinformation, Xuzhou Medical University, Xuzhou 221004, Jiangsu Province, China; School of Nursing, Xuzhou Medical University, Xuzhou 221004, Jiangsu Province, ChinaCorresponding author: Wei Jianfeng, MD, Associate professor, Jiangsu Key Laboratory of Brain Disease Bioinformation, Xuzhou Medical University, Xuzhou 221004, Jiangsu Province, China; Department of Histology and Embryology, School of Basic Medical Sciences, Xuzhou Medical University, Xuzhou 221004, Jiangsu Province, China两种传代方法影响人胚胎干细胞转染效率的比较孙 莉1,2,纵艳艳1,魏建峰1,3 (1江苏省脑病生物信息重点实验室,江苏省徐州市 221004;徐州医科大学,2护理学院, 3基础医学院组织胚胎学教研室,江苏省徐州市 221004)DOI:10.3969/j.issn.2095-4344.1870 ORCID: 0000-0002-1800-8057(孙莉)文章快速阅读:文题释义:胚胎干细胞:是一类起源于胚胎发育早期囊胚内细胞群中未分化的细胞,具有自我更新、无限增殖和多向分化的潜能。
转染:是真核细胞主动或被动导入外源DNA 片段而获得新的表型的过程。
摘要背景:现有方法将外源分子如DNA 导入到人胚胎干细胞用于科学研究的效率普遍较低,如何优化现有条件,提高转染效率显得尤为重要。
目的:比较两种不同的传代方法对人胚胎干细胞系H9转染效率的影响,优化胚胎干细胞转染条件。
方法:人胚胎干细胞系H9分别采用小克隆传代法和单细胞传代法进行传代,传代后继续培养细胞48 h ,用Lipofectamine 3000转染pAdTrack-AKT1荧光质粒2 d 后,荧光显微镜下观察荧光质粒的表达,流式细胞仪检测人胚胎干细胞的转染效率;RT-qPCR 和Western blot 分别检测转染后AKT1在mRNA 和蛋白质水平的表达。
结果与结论:①荧光显微镜下观察发现单细胞传代组表达荧光质粒的细胞数量更多,流式细胞仪检测单细胞传代法的转染效率[(47.18±2.00)%]高于小克隆传代法的转染效率[(19.52±0.86)%],差异有显著性意义 (P < 0.01);②单细胞传代组转染后AKT1 mRNA 和蛋白的表达均高于小克隆传代组,差异有显著性意义 (P < 0.01);③结果表明,采用单细胞传代法,增加细胞与转染试剂脂质体的接触面积可提高人胚胎干细胞的转染效率。
关键词:人胚胎干细胞;小克隆传代法;单细胞传代法;脂质体转染;转染效率 中图分类号:R459.9;R394.2;R318 基金资助:江苏省高校自然科学基金(14KJB310021),项目负责人:魏建峰;江苏省脑病生物信息重点实验室开放课题(JSBl1403),项目负责人:魏建峰Comparison of two passage methods affecting the transfection efficiency of human embryonic stem cellsSun Li 1, 2, Zong Yanyan 1, Wei Jianfeng 1, 3 (1Jiangsu Key Laboratory of Brain Disease Bioinformation, Xuzhou Medical University, Xuzhou 221004, Jiangsu Province, China; 2School of Nursing, Xuzhou Medical University, Xuzhou 221004, Jiangsu Province, China; 3Department of Histology and Embryology, School of Basic Medical Sciences, Xuzhou Medical University, Xuzhou 221004, Jiangsu Province, China)AbstractBACKGROUND: In the research of human embryonic stem cells, introducing exogenous molecules such as DNA into cells is a common research method, but the transfection efficiency is relatively low. It is crucial to answer the question of how to optimize the existing conditions to improve the transfection efficiency.OBJECTIVE: To compare the effects of two different passaging methods on H9 transfection efficiency, in order to人胚胎干细胞 单细胞传代法SUN L, ZONG YY, WEI JF. Comparison of two passage methods affecting the transfection efficiency of human embryonic stem cells.Zhongguo Zuzhi Gongcheng Yanjiu. 2020;24(1):72-76. DOI:10.3969/j.issn.2095-4344.187073optimize the conditions required for embryonic stem cell transfection.METHODS: Human embryonic stem cell lines H9 were cultured for 48 hours after small clone passaging or single-cell passaging.Lipofectamine 3000 was used to transfect pAdTrack-AKT1 fluorescent plasmid into human embryonic stem cells. After 2 days of transfection, the expression of fluorescent plasmids was observed by fluorescence microscope and the transfection efficiency was detected by flow cytometry. RT-qPCR and western blot were used to detect the mRNA and protein expression levels of AKT1 respectively.RESULTS AND CONCLUSION: Under the fluorescence microscopy, the number of cells expressing fluorescent plasmids in the single-cell passaging group was more than that in the small clone passaging group, and the flow cytometry analysis showed that the transfectionefficiency of cells in the single-cell passaging group was (47.18±2.00)%, which was significantly higher than (19.52±0.86)% in the small clone passaging group (P < 0.01). RT-qPCR and western blot analysis showed that the expression levels of AKT1 mRNA and protein in thesingle-cell passaging group were significantly higher than those in the small clone passaging group (P < 0.01). These findings indicate that single-cell passaging can increase the contact area between cells and transfection reagent liposomes, and improve the transfection efficiency of human embryonic stem cells.Key words: human embryonic stem cells; small clone passaging; single-cell passaging; liposome transfection; transfection efficiencyFunding: the Natural Science Foundation of Colleges in Jiangsu Province, No. 14KJB310021 (to WJF); the Foundation of Jiangsu Province Key Laboratory of Encephalopathy Bioinformatics, No. JSBl1403 (to WJF)0 引言 Introduction胚胎干细胞是一类起源于胚胎发育早期囊胚内细胞群中未分化的细胞,具有自我更新、无限增殖和多向分化的潜能[1],故其在医学上具有非常重要的研究价值与应用前景[2-5]。
