甘氨酸含量测定和甲硫氨酸含量测定
食品营养强化剂氨基酸使用的有关要求
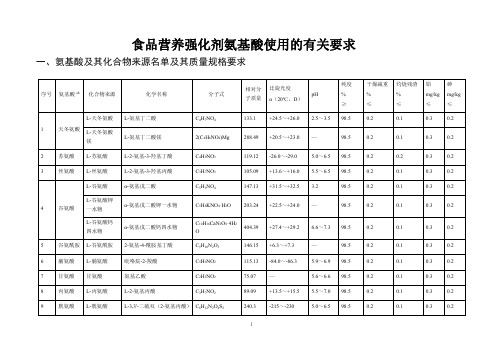
食品营养强化剂氨基酸使用的有关要求一、氨基酸及其化合物来源名单及其质量规格要求L-半胱氨酸L-α-氨基-β-巯基丙酸C3H7NO2S121.16+8.3~+9.5 4.5~5.598.50.50.10.30.2L-半胱氨酸盐酸盐一水物L-2-氨基-3-巯基丙酸盐酸盐一水物C3H7NO2S·HCl·H2O175.64+5.5~+7.0 1.5~2.098.58.0~120.10.30.2N-乙酰基-L-半胱氨酸N-乙酰基-L-α-氨基-β-巯基丙酸C5H9NO3S163.20+21~+27 2.0~2.898.00.20.1——10半胱氨酸L-胱氨酸L-3,3'-二硫双(2-氨基丙酸)C6H12N2O4S2240.3-215~-230 5.0~6.598.50.20.10.30.2 L-半胱氨酸L-α-氨基-β-巯基丙酸C3H7NO2S121.16+8.3~+9.5 4.5~5.598.50.50.10.30.2L-半胱氨酸盐酸盐一水物L-2-氨基-3-巯基丙酸盐酸盐一水物C3H7NO2S·HCl·H2O175.64+5.5~+7.0 1.5~2.098.58.0~120.10.30.2L-半胱氨酸盐酸盐L-2-氨基-3-巯基丙酸盐酸盐C3H7NO2S·HCl157.62+5.6~+8.9 1.5~2.098.5 2.00.10.30.211缬氨酸L-缬氨酸L-2-氨基-3-甲基丁酸C5H11NO2117.15+26.6~+28.8 5.5~6.598.50.20.10.30.212蛋氨酸L-蛋氨酸2-氨基-4-甲巯基丁酸C5H11NO2S149.21+21.0~+25.0 5.6~6.198.50.20.20.30.2N-乙酰基-L-甲硫氨酸N-乙酰-2-氨基-4-甲巯基丁酸C7H13NO3S191.25-18.0~-22.0—98.50.50.10.30.213亮氨酸L-亮氨酸L-2-氨基-4-甲基戊酸C6H13NO2131.17+14.9~+16.0 5.5~6.598.50.20.20.30.2 14异亮氨酸L-异亮氨酸L-2-氨基-3-甲基戊酸C6H13NO2131.17+38.9~+41.8 5.5~6.598.50.20.20.30.215酪氨酸L-酪氨酸S-氨基-3(4-羟基苯基)-丙酸C9H11NO3181.19-11.3~-12.1 5.0~6.598.50.20.20.30.216苯丙氨酸L-苯丙氨酸L-2-氨基-3-苯丙酸C9H11NO2165.19-33.0~-35.0 5.4~6.098.50.20.10.30.217赖氨酸L-盐酸赖氨酸L-2,6-二氨基己酸盐酸盐C6H14N2O2·HCl182.65+20.4~+21.5 5.0~6.098.50.40.10.30.2L-赖氨酸醋酸盐L-2,6-二氨基己酸醋酸盐C6H14N2O2·C2H4O2206.24+8.5~+10.0 6.5~7.598.50.30.20.30.2L-赖氨酸L-2,6-二氨基己酸C6H14N2O2·H2O164.2+25.5~+27.09.0~10.598.50.20.10.30.2L-赖氨酸-L-谷氨酸二水物L-2,6-二氨基己酸α-氨基戊二酸盐二水物C11H23N3O6·2H2O329.35+27.5~+29.5 6.0~7.598.00.20.10.30.2L-赖氨酸-天冬氨酸L-2,6-二氨基己酸L-氨基丁二酸盐C10H21N3O6279.30+24.0~+26.5 5.0~7.098.00.20.10.30.218精氨酸L-精氨酸L-2-氨基-5-胍基戊酸C6H14N4O2174.2+26.0~+27.910.5~12.098.50.20.10.30.2 L-盐酸精氨酸L-2-氨基-5-胍基戊酸盐酸盐C6H14N4O2·HCl210.66+21.3~+23.5—98.50.20.10.30.2 L-精氨酸-天冬氨酸L-2-氨基-5-胍基戊酸-L-氨基丁二酸C10H21N5O6307.31+25.0~+27.0 6.0~7.098.50.20.10.30.219组氨酸L-组氨酸α-氨基-β-咪唑基丙酸C6H9N3O2155.15+12.0~+12.87.0~8.598.50.20.20.30.2L-盐酸组氨酸一水物L-2-氨基-3-咪唑基丙酸盐酸盐一水物C6H9N3O2·HCl·H2O209.63+8.5~+10.5 3.5~4.598.50.20.10.30.220色氨酸L-色氨酸L-2-氨基-3-吲哚基-1-丙酸C11H12N2O2204.23-30.0~-32.5 5.4~6.498.50.20.10.30.2 21瓜氨酸L-瓜氨酸L-2-氨基-5-脲戊酸C6H13N3O3175.19+24.5~+26.5 5.7~6.798.50.20.10.30.222鸟氨酸L-盐酸鸟氨酸2,5-二氨基戊酸单盐酸盐C5H12N2O2·HCl168.62+23.0~+25.0 5.0~6.098.50.20.10.30.2a不得使用非食用的动植物原料作为单体氨基酸的来源。
非酒精性脂肪肝患者血清同型半胱氨酸水平的研究

非酒精性脂肪肝患者血清同型半胱氨酸水平的研究姚少芳;刘琳【摘要】目的探讨非酒精性脂肪肝(NAFLD)患者血清同型半胱氨酸(HCY)水平的变化及其临床意义.方法选取经过肝脏穿刺活检确诊为NAFLD患者31例(试验组),其中单纯性非酒精性脂肪肝(NAFL)患者15例,非酒精性脂肪性肝炎(NASH)患者16例,同时选取22名健康人作为对照组,记录2组性别、年龄、体质量指数(BMI)等基本资料,分别测定2组对象血清中HCY、叶酸、维生素B12、胰岛素水平,并计算稳态模型胰岛素抵抗指数(HOMA-IR).结果试验组与对照组血清HCY水平无显著性差异[(13.5±2.7 )mmol· L-1vs( 12.8±4.6)mmol·L-1,P=0.533),同样,2组对象血清叶酸、维生素B12水平也无显著性差异.虽然NAFL与NASH患者的平均年龄,BMI,血清叶酸、维生素B12等指标差异不明显,但NASH患者血清HCY水平显著低于NAFL患者[(11.3±2.6)mmol·L-1 vs( 15.7±3.1 )mmol ·L-1,P=0.013).血清中HCY水平随肝脏纤维化程度、脂肪变区域以及汇管区炎症程度的增加而呈现降低趋势(P值分别为0.005、0.021和0.029).在Logistic回归分析中,将年龄、性别、BMI、天冬氨酸转移酶(AST)、血糖以及HOMA-IR等变量进行校正后,发现HCY是NASH的独立预测因素(P=0.045).结论 NASH患者血清HCY水平较NAFL患者低,且HCY是NASH的独立预测指标.血清HCY或许可以成为NAFLD 的非侵入性诊断指标之一.【期刊名称】《实用临床医学》【年(卷),期】2012(013)004【总页数】5页(P11-15)【关键词】非酒精性脂肪肝;同型半胱氨酸;胰岛素抵抗;叶酸;维生素B12【作者】姚少芳;刘琳【作者单位】陕西能源职业技术学院临床医学系,陕西咸阳712000;甘肃省中医院白银分院内科,甘肃白银730900【正文语种】中文【中图分类】R575.2非酒精性脂肪肝(NAFLD)是一种与胰岛素拮抗IR和遗传易感密切相关的代谢应激性肝脏损伤,其疾病谱包括单纯性非酒精性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)、脂肪性肝纤维化和脂肪性肝硬化4个从轻到重的病理阶段[1]。
20氨基酸)

氨基酸1.甲硫氨酸Methionine2.甘氨酸Glycine3.苯丙氨酸Phenylalanine4.蛋氨酸Methionine5.亮氨酸Leucine6.精氨酸Argnine7.脯氨酸Proline8.赖氨酸Lysine9.谷氨酰胺Glutamine10.谷氨酸Glutamic acid11.天冬酰胺Asparagine12.异亮氨酸Isoleucine13.缬氨酸Viline14.组氨酸Hlstidine15.丝氨酸Serine16.丙氨酸Alanine17.苏氨酸Threonine18.半胱氨酸Cysteine19.色氨酸Tryptophane20.天冬氨酸Aspartic acid氨基酸氨基酸(Amino acid)是构成蛋白质的基本单位,赋予蛋白质特定的分子结构形态,使他的分子具有生化活性。
蛋白质是生物体内重要的活性分子,包括催化新陈代谢的酵素和酶。
不同的氨基酸脱水缩合形成肽(蛋白质的原始片段),是蛋白质生成的前体。
介绍氨基酸(Amino acid)是构成蛋白质的基本单位,赋予蛋白质特定的分子结构形态,使他的分子具有生化活性。
蛋白质是生物体内重要的活性分子,包括催化新陈代谢的酵素和酶。
不同的氨基酸脱水缩合形成肽(蛋白质的原始片段),是蛋白质生成的前体。
两个或两个以上的氨基酸化学聚合成肽,一个蛋白质的原始片段,是蛋白质生成的前体。
氨基酸(amino acids)广义上是指既含有一个碱性氨基又含有一个酸性羧基的有机化合物,正如它的名字所说的那样。
但一般的氨基酸,则是指构成蛋白质的结构单位。
在生物界中,构成天然蛋白质的氨基酸具有其特定的结构特点,即其氨基直接连接在α-碳原子上,这种氨基酸被称为α-氨基酸。
在自然界中共有300多种氨基酸,其中α-氨基酸21种。
α-氨基酸是肽和蛋白质的构件分子,也是构成生命大厦的基本砖石之一。
构成蛋白质的氨基酸都是一类含有羧基并在与羧基相连的碳原子下连有氨基的有机化合物,目前自然界中尚未发现蛋白质中有氨基和羧基不连在同一个碳原子上的氨基酸。
甘氨酸含量测定和甲硫氨酸含量测定

甘氨酸含量测定和甲硫氨酸含量测定甘氨酸(Glycine)和甲硫氨酸(Methionine)是人体必需的氨基酸,分别在蛋白质合成、生物降解和代谢途径中发挥重要的作用。
因此,准确测定甘氨酸和甲硫氨酸的含量对于研究生物学功能以及调控人体健康具有重要意义。
甘氨酸是最简单的氨基酸之一,其含量测定可以采用不同的分析方法。
其中,光谱法是一种常用且简单的测定方法,通过检测甘氨酸溶液在特定波长下的吸收光强度来确定其含量。
甘氨酸溶液在190-210nm波长范围内有一个特征吸收峰,根据其吸收峰的强度可以计算出甘氨酸的浓度。
除了光谱法,还可以使用高效液相色谱法(HPLC)等方法来测定甘氨酸的含量。
HPLC是一种分离和定量目标物质的高效分析方法,通过将甘氨酸溶液通过带有特定色谱柱的系统进行分离,然后通过检测器检测分离出来的甘氨酸峰的面积或峰高来计算其含量。
甲硫氨酸是一种含有硫原子的氨基酸,其含量测定相对较为复杂。
一种常用的测定方法是使用高效液相色谱法与紫外检测器结合,该方法可以通过特定的色谱条件使甲硫氨酸与其他氨基酸分离,然后利用紫外检测器检测甲硫氨酸的峰面积或峰高来进行计算。
此外,还可以使用气相色谱法或质谱法等方法来测定甲硫氨酸的含量。
总之,准确测定甘氨酸和甲硫氨酸的含量对于了解其在生物体内的功能以及人体健康状态具有重要意义。
不同的分析方法有各自的特点和适用范围,需要根据实际需求选择合适的测定方法进行分析。
同时,为了保证测定结果的准确性和可靠性,还需要注意样品的预处理、仪器的校准与标定等操作步骤,以及对结果进行统计学分析的工作。
氨基酸分析仪测定复方甘草酸苷注射液中甘氨酸的含量

相应的位置上,显相同黄色斑点”为宜。
此外,现行质量标准中,金银花和金果榄的薄层鉴别均采用三氯甲烷作为提取溶剂,而射干的展开剂也使用到了三氯甲烷,从降低试剂毒性出发,考虑将三氯甲烷更换为二氯甲烷,对薄层鉴别方法进行改进,实验结果表明可以进行替代。
TLC主要用于中药材、中药成方制剂中有效成分的快速分离与定性分析4〕。
虽然随着检验技术的发展,许多检测方法在定量和定性方面比TLC更具优势,但正是因为技术的日新月异,作为检验工作者,更应该熟知每门技术的优缺点,通过人整合技术,物尽其用4S〕。
本研究通过对小儿咽扁颗粒TLC的分析和优化,充分展现了TLC在定性鉴别中的优势,它不仅设备简单、分离速度快,而且可以同时分离多种样品且色谱图色彩鲜艳,结果直观,便于鉴别。
参考文献〔2国国家药典委员会编・中国药典(224版一部))S〕.北京:中国医药科技出版社952:541944〔2〕刘朋朋・桔梗质量标准研究〔D〕.北京:中国中医药科学院中药研究所,2027.4〕向金莲,王伟,任飞宇•薄层色谱技术在中药检验中的应用4〕.中国医药指南,224,2(4):237W38〔4〕邓哲,荆文光,刘安.薄层色谱在当前中药质量标准中的应用探讨4〕.中国实验方剂学杂志922,25(7):291A06.4〕王秀芹,林彤,江英桥.薄层色谱法标准化操作要点及实例分析〔〕•中成药92492(7):255-259.氨基酸分析仪测定复方甘草酸苷注射液中甘氨酸的含量张黎莉(福州市食品药品检验所,福建福州350007)摘要:目的探究和建立用氨基酸分析仪测定复方甘草酸苷注射液中甘氨酸的含量的方法,完善复方甘草酸苷注射液中甘氨酸含量的监测体系。
方法本实验采用氨基酸分析仪法,色谱柱:PEEK材料安玛西亚色谱填料填装色谱柱;检测波长:577am;显色剂:茚三酮缓冲液;进样量: 12jxL;流速:55mL/6;流动相:缓冲液系统。
甘氨酸经离子交换色谱和茚三酮柱后衍生化,根据外标法进行测定。
甲硫氨酸

分子结构数据
分子结构数据
摩尔折射率:38.26 摩尔体积(cm3/mol):123.7 等张比容(90.2K):329.9 表面张力(dyne/cm):50.5 极化率(10-24cm3):15.17
计算化学数据
计算化学数据
疏水参数计算参考值(XlogP):无 氢键供体数量:2 氢键受体数量:4 可旋转化学键数量:4 互变异构体数量:0 拓扑分子极性表面积:88.6 重原子数量:9 表面电荷:0 复杂度:97 同位素原子数量:0 确定原子立构中心数量:0
鉴别
1、取本品50mg。加水2mL使溶解,加氢氧化钠试液1mL,摇匀,滴加新制的亚硝基铁氰化钠试液0.6mL,边 滴边摇,40°C放置10分钟后,冰浴冷却2分钟,加稀盐酸2mL,摇匀,溶液显红色。
2、取本品与甲硫氨酸对照品各适量,分别加水溶解并稀释制成每1mL中约含10mg的供试品溶液与对照品溶 液。照其他氨基酸项下的方法试验,供试品溶液所显主斑点的位置和颜色应与对照品溶液的主斑点相同。
制剂
甲硫氨酸片。
安全信息
安全术语
风险术语
安全术语
S24/25:Avoid contact with skin and eyes. 避免皮肤和眼睛接触。
风险术语
R33:Danger of cumulative effects. 有累积作用危险。
谢谢观看
尚用于氨基酸输液,综合氨基酸制剂。
按我国GB2760-86规定可用作香料。
药典信息
基本信息 性状
鉴别 检查
含量测定 类别
贮藏 制剂
基本信息
本品为L-2-氨基-4-(甲硫基)丁酸,按干燥品计算,含C5H11NO2S不得少于98.5%。
性状
高效液相色谱法测定氨基酸

脑蛋白水解物溶液氨基酸含量分析方法研究方案1、仪器与试药1.1 仪器1525型高效液相色谱仪(美国Waters公司);Waters1525型泵,Waters2487型检测器,Waters5CH 型柱温箱,WatersBREEZE数据处理软件,水浴恒温器(精度±0.1℃),旋涡器,微量移液器,衍生专用管;CP225D型分析天平(德国);4umNora-Pak TM C18(3.9mm×150mm,5μm)色谱柱(美国)1.2 药品与试剂16种氨基酸(门冬氨酸、丝氨酸、谷氨酸、甘氨酸、组氨酸、精氨酸、苏氨酸、丙氨酸、脯氨酸、缬氨酸、甲硫氨酸、赖氨酸、异亮氨酸、亮氨酸、苯丙氨酸、色氨酸)由中国药品生物制品检定所提供。
脑蛋白水解物注射液,云南盟生药业有限公司生产,规格10ml/支。
批号:2013、2013、2013.乙腈(HPLC级);EDTA(分析纯);磷酸(分析纯);二乙胺(分析纯);三水合乙酸钠(分析纯)。
2、方法与结果2.1色谱条件流动相A为AccQTag醋酸—磷酸盐缓冲液;由AccQTagEluent A浓缩制备AccQTag洗脱液,用前稀释10倍(或按以下方法配制:称19.04g三水合乙酸钠,加1000ml纯化水,搅拌,溶解,用50%H3PO4将pH调至5.2,加入1ml 1mg/ml的EDTA溶液,加入2.37ml二乙胺,用50%H3PO4滴定至pH4.95,用水溶性过滤器过滤,超声,脱气,备用。
);流动相B为60% HPLC级乙腈,按梯度表梯度洗脱;流速1.0ml/min;检测波长为254nm;进样量5μl;柱温38℃。
2.2对照品溶液、供试品溶液的制备分别精密称取16种氨基酸标准品,用纯化水配制成浓度如下表所示的混合溶液。
取上述溶液0.1ml,加纯化水0.9ml,旋涡器混匀,作为对照品溶液;取脑蛋白水解物注射液,加水稀释成含总氮为1mg/ml的溶液,取0.1ml,加纯化水0.9ml,旋涡器混匀,作为供试品溶液。
武汉大学生科院张楚富教授--学习指导及习题解答

武汉大学生科院武汉大学生科院张楚富教授等原作!非常感谢!第二章氨基酸和蛋白质的一级结构基本内容蛋白质含有20种标准氨基酸,这些氨基酸在它们的α碳原子上分别含有一个氨基、一个羧基和一个侧链基团(或称R基团)。
除甘氨酸外,所有其它氨基酸的α碳原子都是一个不对称的碳原子,即手性碳原子。
蛋白质中的所有氨基酸都是L-型的。
20种标准氨基酸可以根据它们侧链的结构分为含脂肪烃基的氨基酸、含芳香基的氨基酸、含硫的(或含羟基的、或含酰胺基的)氨基酸。
如果根据它们的侧链极性(或在生理pH下的解离),可分为侧链非极性氨基酸、侧链不带电荷的极性氨基酸和侧链解离带正电荷或负电荷的氨基酸。
氨基酸侧链的性质对于决定蛋白质的性质、结构和功能来说是很重要的。
氨基酸的α-氨基和α-羧基都是可解离的基团,它们的解离取决于介质的pH。
在生理pH下,α-氨基解离带正电荷(–NH3+),α-羧基解离带负电荷(–CO O–);侧链可解离基团的解离取决于它们的pK值和介质的pH。
氨基酸的解离性质是建立分离和分析氨基酸的方法的基础,它们的解离也影响蛋白质的性质、结构和功能。
分离分析氨基酸的主要方法是离子交换法以及电泳法。
蛋白质是由氨基酸借肽键连接而成多聚物。
在蛋白质多肽链中,肽键是唯一的共价键,由一个氨基酸的α-羧基和相邻氨基酸的α-氨基脱水缩合而成。
在多肽链中,氨基酸残基的顺序称为蛋白质的一级结构。
蛋白质是生物大分子,虽然它们具有与氨基酸相似的解离性质,但这一性质却比氨基酸复杂。
蛋白质的许多重要的性质,例如,溶解性、极性、带电性质、分子大小以及配体亲和性等,是构成分离分析它们的方法的基础。
离子交换法、凝胶过滤法、亲和层析法、超速离心法以及各种电泳法是常用的方法。
蛋白质一级结构的测定通常采用这样的程序,即纯净样品的末端分析、氨基酸组成分析、专一性酶或化学试剂进行部分水解、Edman降解法测定肽碎片的氨基酸残基的顺序以及片段重叠。
末端分析常有丹磺酰氯法和二硝基氟苯法;肽链的部分水解一般是有胰蛋白酶法、胰凝乳蛋白酶法以及溴化氰法。
植物生理学中各项生理指标的测定方法

一.实验内容实验1 MDA(丙二醛)含量测定所需试剂:10%三氯乙酸(TCA)(纯) 0.25%硫代巴妥酸 (纯)实验2:可溶性蛋白含量测定所需试剂:考马斯亮蓝G-250 95%乙醇 85%磷酸实验3:SOD(超氧化物歧化酶)酶活性测定所需试剂:dl-甲硫氨酸(Met) NBT EDTA-Na2 核黄素实验4:CAT(过氧化氢酶)活性(过氧化氢酶)测定所需试剂:PBS(PH=7.0) 30% H2O2实验五:Apx(抗坏血酸过氧化物酶)活性(即ASA—POD活性)测定所需试剂:ASA(分子量167.12) (乙=胺四乙酸=钠)EDTA—Na2 PBS (pH7.0) 30%H2O实验6: ASA(维生素C)含量测定偏磷酸 95%乙醇磷酸 4% 2,2-二联吡啶 FeCl3(或FeCl3·6H2O)实验7:GSH(谷胱甘肽, 媚力肽GSH GSH是由谷氨酸、半胱氨酸和甘氨酸结合而成的三肽化合物)含量测定所需试剂:NaH2PO4·2H2O DTNB(二硫代硝基苯甲酸) PBS (PH6.8)实验8:脯氨酸测定所需试剂:磺基水杨酸甲苯茚三酮冰乙酸 85%磷酸试验9:叶绿素含量测定。
80%丙酮试验9:GR活性测定试验10:过氧化氢含量测定。
三氯乙酸试验11:超氧阴离子含量测定二.酶液和母液提取1. 酶液提取所需试剂:50mmol/L磷酸缓冲液(PH=7.8)(内含1% (m/v) 聚乙烯吡哆烷酮PVP),0.1mmol/L EDTANa2或EDTA),也可为(内含2% (m/v)PVP),0.2mmol/L EDTA Na2或EDTA)(先配制后用缓冲液定容)2. ASA . GSH母液提取所需试剂:5%偏磷酸1.抗氧化酶酶液提取(SOD.POD.CAT):1g(根据样品的量,少的可以适当减少)叶片加入预冷5ml. 50mmol/L磷酸缓冲液(PH=7.8)↓4℃冷冻15000g离心20分钟↓上清液即为酶液(5℃下保存一两天内备用,中短期用-20℃保存)2.ASA . GSH母液提取:0.1g叶片加入3ml预冷5%偏磷酸溶液↓4℃冷冻14000g离心10分钟↓上清液即为母液(5℃下保存备用)(偏磷酸可显著沉淀蛋白质和保护ASA)酶液提取所需试剂:PVP(聚乙烯吡哆烷酮):1%(1g溶于100ml水),1000ml需称取10g,此处用PBSEDTA-Na 2 : 0.1mmol/L (37.2mg EDTA-Na2溶于1000ml蒸馏水),此处用PBSPBS(缓冲液)配制方法:① Na2HPO4·12H2O ② NaH2PO4·2H2O取① 71.64g,蒸馏水定容至1L,取② 31.21g定容至1L,放置4℃冰箱备用PH=7.8 取① 91.5ml+② 8.5ml=100ml (浓度0.2mol/L)需要0.05mol/L→将上述溶液烯释至400ml (0.2mol/L*0.1=0.05mol/L*V)母液提取所需试剂:5%偏磷酸:称5g纯偏磷酸,定容至100 ml蒸馏水(需加热溶解,温度在50-60℃)偏磷酸有剧毒(偏磷酸难溶解,先得用研钵提前研碎,后用磁力搅拌器溶解一到两天后再定容)(现所用为38%HPO3,所以需称65.7895g,定容至500ml)三.实验步骤实验1:MDA含量测定1.1所需试剂:10%三氯乙酸(TCA)(纯)称10g定容至100ml0.25%硫代巴妥酸 (纯) 称0.25g用10%TCA定容至100ml(配制时,可一次完成,先配TCA,不要定容,再加入硫代巴比妥酸,然后定容,若难溶解,可以在磁力搅拌器上微热)1.2步骤:取0.3g叶片,加4ml磷酸缓冲液研磨,加入 4ml 0.25%的硫代巴比妥酸(溶于10%的三氯乙酸)溶液↓摇匀95℃加热15分钟↓快速冷却3000g离心15分钟↓取上清测定 OD532,OD600,OD450值↓按公式求 MDA浓度=6.45×(OD532-OD600)-0.56OD450 (μmol/L)可溶性糖浓度=11.71×OD450 (mmol/L)最后计算 MDA含量(μmol/g FW)= [4×(MDA浓度x)×10-3/0.1]同时,可测得可溶性糖含量(m mol/g FW)= 4×(可溶性糖浓度χ)×10-3/0.1(用多波长测定,在测定之前一定要矫正基线,公式中的参数可以直接在分光光度计上输入)注意:以0.25%的硫代巴妥酸溶液作空白调零MDA含量测定的改进1.可以用做酶活性时提取的酶液来直接测定MDA含量,用量可以定为1.0、1.5或2.0(较好)ml。
氨基酸的定量测定

6、三硝基苯磺酸法
原理: 三硝基苯磺酸(TNBS)是定量测定氨基酸的重要试剂之一。 TNBS 在偏碱性的条件下与氨基酸反应,先形成中间络合物。 中间络合物在光谱上有2个吸收值相近的高峰,分别位于355nm 和420nm 附近。然而溶液一旦酸化,中间络合物转化成三硝基苯 -氨 基酸(TNP-氨基酸),420nm 处的吸收值显著下降,而350nm 附近 的吸收峰则移至340nm 处。 利用 TNBS 与氨基酸反应的这一特性,可在420nm 处(偏碱性 溶液中)或在340nm(偏酸性溶液中)对氨基酸进行定量测定。在 340nm 处,各氨基酸的吸收度大致相近,而在420nm 处的吸光度因 2 氨基酸种类而异;在加入适量 SO3 时,吸收值升高。 本法允许的测定范围是 0.05~0.4μmol 氨基酸。
1、甲醛滴定法
计算结果:
氨基酸态氮含量=
(V2 V1 ) c 0.014 100 % m
式中:c——氢氧化钠标准溶液的浓度,mol/L V1——用中性红作指示剂滴定时消耗氢氧化钠标准溶液体积,mL V2——用百里酚酞作指示剂滴定时消耗氢氧化钠标准溶液体积, mL m——测定用样品溶液相当于样品的质量,g 1 0.014—— N2毫摩尔质量,g/mmol
100%
式中:VHClO ——所消耗的高氯酸标准溶液的体积 cHClO ——所消耗的高氯酸标准溶液的浓度 M——被测氨基酸的摩尔质量 m——被测氨基酸的质量
4
4、非水溶液滴定法
②回滴法(适用于不易溶解于冰醋酸而能溶解于高氯酸的氨基酸):精确称取氨 基酸样品30~40mg 左右,溶解于5mL高氯酸标准溶液中,加2滴甲基紫指示剂,剩 余的酸以醋酸钠溶液滴定,颜色变化由黄,经过绿、蓝至初次出现不褪的紫色为 终点。 氨基酸含量=
植物生理学中各项生理指标的测定方法

植物⽣理学中各项⽣理指标的测定⽅法⼀.实验内容实验1 MDA(丙⼆醛)含量测定所需试剂:10%三氯⼄酸(TCA)(纯) 0.25%硫代巴妥酸 (纯)实验2:可溶性蛋⽩含量测定所需试剂:考马斯亮蓝G-250 95%⼄醇 85%磷酸实验3:SOD(超氧化物歧化酶)酶活性测定所需试剂:dl-甲硫氨酸(Met) NBT EDTA-Na2 核黄素实验4:CAT(过氧化氢酶)活性(过氧化氢酶)测定所需试剂:PBS(PH=7.0) 30% H2O2实验五:Apx(抗坏⾎酸过氧化物酶)活性(即ASA—POD活性)测定所需试剂:ASA(分⼦量167.12) (⼄=胺四⼄酸=钠)EDTA—Na2 PBS (pH7.0) 30%H2O实验6: ASA(维⽣素C)含量测定偏磷酸 95%⼄醇磷酸 4% 2,2-⼆联吡啶 FeCl3(或FeCl3·6H2O)实验7:GSH(⾕胱⽢肽, 媚⼒肽GSH GSH是由⾕氨酸、半胱氨酸和⽢氨酸结合⽽成的三肽化合物)含量测定所需试剂:NaH2PO4·2H2O DTNB(⼆硫代硝基苯甲酸) PBS (PH6.8)实验8:脯氨酸测定所需试剂:磺基⽔杨酸甲苯茚三酮冰⼄酸 85%磷酸试验9:叶绿素含量测定。
80%丙酮试验9:GR活性测定试验10:过氧化氢含量测定。
三氯⼄酸试验11:超氧阴离⼦含量测定⼆.酶液和母液提取1. 酶液提取所需试剂:50mmol/L磷酸缓冲液(PH=7.8)(内含1% (m/v) 聚⼄烯吡哆烷酮PVP),0.1mmol/L EDTANa2或EDTA),也可为(内含2% (m/v)PVP),0.2mmol/L EDTA Na2或EDTA)(先配制后⽤缓冲液定容)2. ASA . GSH母液提取所需试剂:5%偏磷酸1.抗氧化酶酶液提取(SOD.POD.CAT):1g(根据样品的量,少的可以适当减少)叶⽚加⼊预冷5ml. 50mmol/L磷酸缓冲液(PH=7.8)↓4℃冷冻15000g离⼼20分钟↓上清液即为酶液(5℃下保存⼀两天内备⽤,中短期⽤-20℃保存)2.ASA . GSH母液提取:0.1g叶⽚加⼊3ml预冷5%偏磷酸溶液↓4℃冷冻14000g离⼼10分钟↓上清液即为母液(5℃下保存备⽤)(偏磷酸可显著沉淀蛋⽩质和保护ASA)酶液提取所需试剂:PVP(聚⼄烯吡哆烷酮):1%(1g溶于100ml⽔),1000ml需称取10g,此处⽤PBSEDTA-Na 2 : 0.1mmol/L (37.2mg EDTA-Na2溶于1000ml蒸馏⽔),此处⽤PBSPBS(缓冲液)配制⽅法:① Na2HPO4·12H2O ② NaH2PO4·2H2O取① 71.64g,蒸馏⽔定容⾄1L,取② 31.21g定容⾄1L,放置4℃冰箱备⽤PH=7.8 取① 91.5ml+② 8.5ml=100ml (浓度0.2mol/L)需要0.05mol/L→将上述溶液烯释⾄400ml (0.2mol/L*0.1=0.05mol/L*V)母液提取所需试剂:5%偏磷酸:称5g纯偏磷酸,定容⾄100 ml蒸馏⽔(需加热溶解,温度在50-60℃)偏磷酸有剧毒(偏磷酸难溶解,先得⽤研钵提前研碎,后⽤磁⼒搅拌器溶解⼀到两天后再定容)(现所⽤为38%HPO3,所以需称65.7895g,定容⾄500ml)三.实验步骤实验1:MDA含量测定1.1所需试剂:10%三氯⼄酸(TCA)(纯)称10g定容⾄100ml0.25%硫代巴妥酸 (纯) 称0.25g⽤10%TCA定容⾄100ml(配制时,可⼀次完成,先配TCA,不要定容,再加⼊硫代巴⽐妥酸,然后定容,若难溶解,可以在磁⼒搅拌器上微热)1.2步骤:取0.3g叶⽚,加4ml磷酸缓冲液研磨,加⼊ 4ml 0.25%的硫代巴⽐妥酸(溶于10%的三氯⼄酸)溶液↓摇匀95℃加热15分钟↓快速冷却3000g离⼼15分钟↓取上清测定 OD532,OD600,OD450值↓按公式求 MDA浓度=6.45×(OD532-OD600)-0.56OD450 (µmol/L)可溶性糖浓度=11.71×OD450 (mmol/L)最后计算 MDA含量(µmol/g FW)= [4×(MDA浓度x)×10-3/0.1]同时,可测得可溶性糖含量(m mol/g FW)= 4×(可溶性糖浓度χ)×10-3/0.1(⽤多波长测定,在测定之前⼀定要矫正基线,公式中的参数可以直接在分光光度计上输⼊)注意:以0.25%的硫代巴妥酸溶液作空⽩调零MDA含量测定的改进1.可以⽤做酶活性时提取的酶液来直接测定MDA含量,⽤量可以定为1.0、1.5或2.0(较好)ml。
不同晶型、旋光型氨基酸原料药的红外图谱分析

图#
不同晶型甘氨酸红外图谱
— — —白色结晶性粉末
$ $ $ $ $ 白色结晶
图%
不同晶型谷氨酸红外图谱
— — —白色结晶性粉末
$ $ $ $ $ 白色结晶
&’%
不同旋光性氨基酸原料药红外图谱的分析
除甘氨酸外, 其余氨基酸均具有旋光性, 有( 型和 ) 型, 其旋光度可按药典规定方法测定; () 型 氨基酸是其外消旋体, 其旋光度为 *+, 不同光学异构 体的红外图谱的差异依不同种类的氨基酸而不同, 在分析比较的图谱中: (#) 试验证明: (图 (),甲硫氨酸与 ),甲硫氨酸 、 &) (),胱氨酸与 ),胱氨酸、 (),色氨酸与 ),色氨酸、 (),盐酸赖氨酸与 ),盐酸赖氨酸均有显著的差异, 其中 (),甲硫氨酸与标准图谱 (---) 完全一致, ),甲 硫氨酸 与 标 准 图 谱 不 一 致; ),胱 氨 酸 与 标 准 图 谱 (-#.) 完全一致, 限于 (),胱氨酸与标准图谱不一致;
图&
不同旋光性苏氨酸红外图谱
— — — "#苏氨酸
% % % % % !#苏氨酸
$ ’ $ 市售饲料级 "#盐酸赖氨酸有黄色颗粒和浅黄 色颗粒状粉末两种性状, 分别来自不同的生产厂家, 与精制后医药级和生化试剂 "#盐酸赖氨酸 (白色结 晶) 、 !"#甲硫氨酸粗品与生化试剂红外图谱完全一 致, 说明纯度大于 () ’ *+ 的样品, 杂质含量对红外 图谱没有多大影响。 $’& 甘氨酸、 甲硫氨酸、 缬氨酸、 亮氨酸用 ,-. 和 压片, 其红外图谱均为一致, 但盐酸赖氨酸的图 ,/0
转动能级的信息, 物质分子的组成与结构的差别在 红外光谱上有极敏感的反应, 因此利用红外图谱可 对物质 (主要是有机物) 作定性分析 , 很多氨基酸 原料药采购企业都把红外图谱作为判定产品是否合 格的一项主要指标。 现行 国 家 标 准
简明氨基酸质量标准-CP2010

≤0.2% ≤0.1% ≤0.001% ≤10ppm ≤0.0001%
细菌内毒素 (供注射用 时) 含量测定 类别
贮藏
制剂
祛痰药 密封,阴凉处保存 颗粒/喷雾
氨基酸类药 密封保存
20EU/g
20EU/g
氨基酸类药 遮光,密封保存 冲洗液
氨基酸类药 密封保存
157 甲硫氨酸
240 丝氨酸
281 色氨酸
照的图谱一致
1.5~ 2.0 ≥98.0%
3.5~ 4.5 ≥98.0%
5.0~ 6.0 ≥98.0%
≥98.0%
5.0~ 6.5 ≥98.0%
19.8%-20.8%
16.7%-17.1%
19.0%-19.6%
16.5%-17.1%
≤0.02%
≤0.02% ≤0.02%
≤0.5%
≤0.02% ≤0.02%
7.0~ 8.5 ≥98.0%
5.5~ 6.5 ≥98.0%
≤0.02%
≤0.02% ≤0.02%
≤0.02%
≤0.02% ≤0.02%
≤0.02%
≤0.02% ≤0.02%
≤0.02%
≤0.02% ≤0.02%
≤0.5%
≤0.5%
≤0.5%
≤0.5%
≤0.5% ≤0.1% ≤0.0005% ≤10ppm ≤0.0001% 符合规定
≤0.2%
≤0.02% ≤0.02%
≤0.5%
≤0.02% ≤0.02% ≤0.02% 符合要求 ≤0.2%
≤0.02% ≤0.5%
8.0%-12.0% ≤0.1% ≤0.001% ≤10ppm ≤0.0001% 符合规定
≤0.2% ≤0.1% ≤0.001% ≤10ppm ≤0.0001%
氨基酸分类

氨基酸分类一、总表20种氨基酸密码子表二、分类1. 根据氨基酸分子中所含氨基和羧基数目的不同,将氨基酸分为中性氨基酸、酸性氨基酸和碱性氨基酸:类别氨基酸特点中性氨基酸甘氨酸、丙氨酸、亮氨酸、异亮氨酸、缬氨酸、胱氨酸、半胱氨酸、甲硫氨酸、苏氨酸、丝氨酸、苯丙氨酸、酪氨酸、色氨酸、脯氨酸、蛋氨酸和羟脯氨酸这类氨基酸分子中只含有一个氨基和一个羧基酸性氨基酸谷氨酸、天门冬氨酸这类氨基酸分子中含有一个氨基和二个羧基碱性氨基酸赖氨酸、精氨酸、组氨酸这类氨基酸的分子中含二氨基一羧基;组氨酸具氮环,呈弱碱性,也属碱性氨基酸。
2. 根据氨基酸的极性分类:类别氨基酸非极性氨基酸甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸极性氨基酸极性中性氨基酸色氨酸、酪氨酸、丝氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸酸性氨基酸天冬氨酸、谷氨酸碱性氨基酸赖氨酸、精氨酸、组氨酸其中,属于芳香族氨基酸的是:色氨酸、酪氨酸、苯丙氨酸属于亚氨基酸的是:脯氨酸含硫氨基酸包括:半胱氨酸、蛋氨酸3. 按其亲水性、疏水性可分为:4. 其它的分类方法天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。
另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。
1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。
共有8种其作用分别是:①赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;②色氨酸(Tryptophane):促进胃液及胰液的产生;③苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗;④蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;⑤苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能;⑥异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;⑦亮氨酸(Leucine ):作用平衡异亮氨酸;⑧缬氨酸(Viline):作用于黄体、乳腺及卵巢。
枸杞干果酒发酵过程中氨基酸组成的变化

枸杞干果酒发酵过程中氨基酸组成的变化丁学利【摘要】采用高效液相色谱法,测定了干果枸杞酒发酵过程中的游离氨基酸组成的变化.发酵前后共检测出20种氨基酸,其中均包含必须氨基酸8种,发酵前后氨基酸总量分别为4 379.61 mg·L-1、1 975.71 mg·L-1.发酵过程中,大多数氨基酸的变化趋势较为类似,均随着发酵的逐渐旺盛,氨基酸含量降低;但也检测出组氨酸和半胱氨酸含量基本保持不变,而甲硫氨酸含量从初始的8.53 mg·L-1上升到最后的10.81mg· L-1.【期刊名称】《陕西林业科技》【年(卷),期】2019(047)001【总页数】5页(P12-15,22)【关键词】干枸杞;果酒;发酵过程;高效液相色谱;氨基酸组成【作者】丁学利【作者单位】宁夏葡萄酒与防沙治沙职业技术学院,银川750199【正文语种】中文【中图分类】S枸杞子通常是人们对茄科枸杞属多年生落叶灌木—宁夏枸杞(Lycium barbaruv)果实的统称,其富含枸杞多糖、类胡萝卜素、甜菜碱、黄酮、多种维生素等多种营养成分和生物活性物质[1],具有多方药理作用和生物活性功能[2],如抗病毒、抗凝血、抗肿瘤、降低血糖、保护肾脏等[3-4]。
枸杞发酵酒是以宁夏枸杞干果为原料,在控温条件下通过酵母菌发酵制成,可以较大程度保持枸杞原料的风味和生物活性成分,使营养成分更易于吸收,而且产品风味独特、多样,酒度较低,受众更广,更符合国内外饮料向天然、健康、保健发展的趋势,具有很大的发展空间和市场潜力,是枸杞深加工的趋势之一[5-8]。
枸杞中的主要含氮化合物为氨基酸,游离氨基酸的含量对所发酵的枸杞酒有重要的影响,将直接影响枸杞酒的酒精发酵[9]。
研究表明,若发酵液中氮源缺乏或比例不合适,会对酿酒产生不良的影响,严重时会引起发酵停滞,并会产生过多的硫化氧、双乙酰,影响酒的香气物质形成,产生过多的高级醇,最终影响酒的品质[10]。
氨基酸组成分析

影响氨基酸分析结果的三大因素是:水解、衍生、色谱。 水解是第一步,水解的完全与否对结果影响很大。在实验中 通常采用一些标准蛋白质,如细胞色素c(Cyt c)、核糖核酸 酶(RNase)或胰岛素(insulin)为标样进行水解、衍生和色 谱分析来计算回收,从而考验蛋白质分析的可靠程度和评价 方法的适用性。 但由于各种蛋门质含有的氨基酸多少不同,并且每一种氨 基酸的量也不一样,有的氨基酸含量可多到十几个,有的 氨基酸含量只有1~2个,这影响到氨基酸的回收。生物应 用公司(ABI)曾设计过一种“测试肽”,即人工合成18种 不 同氨基酸的肽(除Gln、Asn外),这样每种氨基酸出现的频 率都是1,用此肽来校正回收,看来机会均等,是一种可以 采纳的方法,但在实际样品中,不太可能出现这种理想情 况。
(4)PTC-AA分析法 属柱前衍生法,源于Edman降解法测定蛋白质的一级结 构。异硫氰酸苯酯(PITC)能在碱性条件下和氨基酸反应, 生成PTC-AA,此法分析灵敏度和荧光胺、OPA的荧光法 相同,优点是能同时检出初级和次级氨基酸,在254nm检 出,缺点是操作繁琐,水和盐的副反应敏感,要求较高的操 作技术。
(1)还原烷化法 产生能抗水解的半胱氨酸衍生物。烷化试剂包括4—乙烯 吡啶和碘代乙酸。但这些方法有缺点,为了确保试剂接近巯 基,还原和氧化通常在变性剂存在下进行,多余试剂和变性 剂要用HPLC、沉淀法或透析去除,每一步都可能造成样品的 损失,特别是对于小肽和微量样品,而且烷化反应如果不仔 细控制条件,可能导致半胱氨酸以外其他残基的衍生。 (2)氧化法 氧化反应被用来转化半胱氨酸和胱氨酸成为半胱磺酸,过 甲酸氧化反应的缺点是它会影响其他氨基酸特别是甲硫氨酸 会转变成甲硫氨酸砜,酪氨酸会降解。为克服这一 缺点,必 须准备能分析两次的样品量,一次提供半胱氨酸数据,另一 次则提供其他氨基酸的组成数据。
lcms氨基酸检测报告

lcms氨基酸检测报告检测周期:2021年6月1日至2021年6月30日检测结果:样本编号:001检测日期:2021年6月5日检测人员:李华检测物质含量(单位:mg/L)参考范围(单位:mg/L)结果说明苏氨酸 38.5 20-70 正常甲硫氨酸 20.2 10-35 正常天冬氨酸 78.9 40-90 正常谷氨酰胺 52.1 20-50 正常精氨酸 15.8 5-15 正常丝氨酸 10.9 5-15 正常异亮氨酸 14.5 10-35 正常缬氨酸 37.2 20-70 正常脯氨酸 32.1 10-35 正常组氨酸 10.1 5-15 正常丙氨酸 85.6 30-80 正常谷氨酸 148.5 100-220 正常甘氨酸 43.2 20-70 正常苯丙氨酸 48.9 20-70 正常L-赖氨酸 12.5 6-20 正常L-色氨酸 8.9 4-10 正常酪氨酸 23.4 10-35 正常L-脯氨酸 9.8 4-15 正常样本编号:002检测日期:2021年6月15日检测人员:李华检测物质含量(单位:mg/L)参考范围(单位:mg/L)结果说明苏氨酸 53.2 20-70 正常甲硫氨酸 29.8 10-35 正常天冬氨酸 63.5 40-90 正常谷氨酰胺 44.1 20-50 正常精氨酸 17.6 5-15 正常丝氨酸 12.1 5-15 正常异亮氨酸 20.5 10-35 正常缬氨酸 48.9 20-70 正常脯氨酸 43.2 10-35 正常组氨酸 14.1 5-15 正常丙氨酸 96.3 30-80 正常谷氨酸 186.6 100-220 正常甘氨酸 53.5 20-70 正常苯丙氨酸 58.8 20-70 正常L-赖氨酸 14.2 6-20 正常L-色氨酸 10.6 4-10 正常酪氨酸 29.1 10-35 正常L-脯氨酸 11.9 4-15 正常结论:经过LCMS氨基酸检测,样本001和样本002的各项检测指标均在参考范围内,未发现异常情况。
甲硫氨酸氧化

甲硫氨酸氧化甲硫氨酸氧化是一种重要的生物化学反应,它在生物体内发挥着重要的作用。
本文将从以下几个方面详细介绍甲硫氨酸氧化的相关内容。
一、甲硫氨酸的结构和性质甲硫氨酸是一种含有硫原子的非极性氨基酸,其分子式为C4H9NO2S,相对分子质量为135.19。
它是由甘氨酸和蛋氨酸通过转移甲基形成的。
甲硫氨酸在水中可以自由溶解,并且可以被各种蛋白质所包含。
二、甲硫氨酸氧化反应机理甲硫氨酸在生物体内主要通过两种途径进行代谢,一种是通过转化为半胱氨酸,另一种就是通过直接被氧化成为二氧化碳和水。
其中,后者就是我们所说的甲硫氨酸氧化反应。
该反应主要由两个步骤组成:首先,在存在催化剂存在下(如铜离子等),甲硫氨酸会被加成过渡金属离子上的氧原子,形成一个硫醇中间体;其次,在氧化剂的作用下,这个硫醇中间体会被氧化为二氧化碳和水。
整个反应的方程式如下:CH3SCH2CH(NH2)COOH + 3O2 → CO2 + H2O + SO42- + NH3从反应机理来看,甲硫氨酸氧化是一种复杂的生物化学反应,需要多种催化剂和辅助因素才能完成。
三、甲硫氨酸氧化在生物体内的作用甲硫氨酸是一种重要的代谢产物,在生物体内发挥着重要的作用。
其中,甲硫氨酸代谢途径中的甲基转移反应对于蛋白质合成、DNA修复等过程都有着至关重要的作用。
而在甲硫氨酸直接被氧化成为二氧化碳和水的过程中,则可以释放出大量能量,并且产生一些有益于身体健康的物质。
例如,该反应可以产生大量ATP分子,为身体提供能量;同时还可以产生一些抗氧化剂和其他有益物质,对身体健康有着积极的影响。
四、甲硫氨酸氧化在医学和生物技术中的应用甲硫氨酸氧化反应在医学和生物技术中都有着广泛的应用。
例如,在医学领域,该反应可以用于治疗一些代谢性疾病,如糖尿病等;同时还可以作为一种重要的诊断工具,通过检测血液中甲硫氨酸的含量来判断身体健康状况。
而在生物技术领域,甲硫氨酸氧化反应则可以被用于制备一些有益物质,如抗癌药物、抗菌素等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甘氨酸含量测定
甲硫氨酸含量测定
一、方法原理
根据《中国药典》甘氨酸含量测定:取本品约70mg,精密称定,加无水甲酸1.5ml使溶解,加冰醋酸50ml,照电位滴定法,用高氯酸滴定液(0.1mol/L)滴定。
每1ml高氯酸滴定液(0.1mol/L)相当于7.507mg的甘氨酸。
甘氨酸含量:药典2010版二部86页
二、实验仪器及推荐配置
雷磁自动电位滴定仪
231-01 pH玻璃电极217-01甘汞参比电极
三、实验试剂
1、滴定液:0.1mol/L高氯酸溶液配制
取无水冰醋酸(按含水量计算,每1g水加醋酐 5.22ml)750ml,加入高氯酸(70%-72%)8.5ml,摇匀,在室温下缓缓滴加醋酐23ml,边加边摇,加完后摇匀,放冷,加无水冰醋酸适量使成1000ml,摇匀,放置24小时。
2、基准纯邻苯二甲酸氢钾:在105℃干燥至恒重
3、样品
四、样品分析及结果计算
1、标定
取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.16g,精密称定,加无水冰醋酸20ml使溶解。
在自动电位滴定仪上滴定至终点,每1ml高氯酸滴定液(0.1mol/L)相当于20.42mg的邻苯二甲酸氢钾。
按下列公式计算
C HClO4=0.1(m邻苯二甲酸氢钾/0.02042)/V HClO4
0.1 –高氯酸标准溶液理论浓度(mol/L)
C HClO4–高氯酸标准溶液浓度(mol/L)
V HClO4 - 滴定至终点时消耗高氯酸的体积(ml)
m邻苯二甲酸氢钾- 称取的邻苯二甲酸氢钾质量(g)
0.02042 - 与1.00ml高氯酸标准溶液[c(HClO4)0.1mol/L]相当的邻苯二甲酸氢钾的质量(g)2、样品分析
取样品约70mg,精密称定,加无水甲酸1.5ml使溶解,加冰醋酸50ml,在雷磁
自动电位滴定仪上,用高氯酸滴定液(0.1 mol/l )滴定。
按下列公式计算
甘氨酸含量=000
0.007507100%0.1⨯⨯c V m 0.1 – 高氯酸标准溶液理论当量浓度(mol/L )
c 0 – 高氯酸标准溶液实际标称浓度(mol/L )
V 0 - 滴定突跃点时消耗高氯酸的体积(ml )
m 0 - 样品质量(g )
0.007507 - 与1.00ml 高氯酸标准溶液[c(HClO 4)0.1mol/L]相当的甘氨酸的质量(g ) 结果(谱图)
仪器准备,参照自动电位滴定仪说明书
五、 结论与建议
参比电极内充液更换为非水溶剂的氯化钾或氯化锂饱和溶液,分析效果较好。
甲硫氨酸含量测定
一、方法原理
根据《中国药典》甲硫氨酸含量测定:取本品约0.13g,精密称定,加无水甲酸3ml使溶解后,加冰醋酸50ml,照电位滴定法,用高氯酸滴定液(0.1mol/L)滴定。
每1ml高氯酸滴定液(0.1mol/L)相当于14.92mg的甲硫氨酸。
甲硫氨酸含量:药典2010版二部157页
二、试验仪器
雷磁自动电位滴定仪
231-01 pH玻璃电极217-01甘汞参比电极
三、滴定试剂
1、滴定液:0.1mol/L高氯酸溶液配制
取无水冰醋酸(按含水量计算,每1g水加醋酐 5.22ml)750ml,加入高氯酸(70%-72%)8.5ml,摇匀,在室温下缓缓滴加醋酐23ml,边加边摇,加完后摇匀,放冷,加无水冰醋酸适量使成1000ml,摇匀,放置24小时。
2、基准纯邻苯二甲酸氢钾:在105℃干燥至恒重
3、样品
四、样品分析
1、标定
取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.16g,精密称定,加无水冰醋酸20ml使溶解。
在自动电位滴定仪上滴定至终点,每1ml高氯酸滴定液(0.1mol/L)相当于20.42mg的邻苯二甲酸氢钾。
按下列公式计算
C HClO4=0.1(m邻苯二甲酸氢钾/0.02042)/V HClO4
0.1 –高氯酸标准溶液理论浓度(mol/L)
C HClO4–高氯酸标准溶液浓度(mol/L)
V HClO4 - 滴定至终点时消耗高氯酸的体积(ml)
m邻苯二甲酸氢钾- 称取的邻苯二甲酸氢钾质量(g)
0.02042 - 与1.00ml高氯酸标准溶液[c(HClO4)0.1mol/L]相当的邻苯二甲酸氢钾的质量(g)2、样品分析
取本品约0.13g,精密称定,加无水甲酸3ml使溶解后,加冰醋酸50ml,在雷磁自动电位滴定仪上,用高氯酸滴定液(0.1mol/L)滴定。
按下列公式计算
甲硫氨酸含量=
0000.01492100%0.1⨯⨯c V m 0.1 – 高氯酸标准溶液理论当量浓度(mol/L ) c 0 – 高氯酸标准溶液实际标称浓度(mol/L ) V 0 - 滴定突跃点时消耗高氯酸的体积(ml ) m 0 - 样品质量(g )
0.01492 - 与1.00ml 高氯酸标准溶液[c(HClO 4)0.1mol/L]相当的甲硫氨酸的质量(g ) 实验结果:
仪器准备,参照自动电位滴定仪说明书
五、
结论与建议 参比电极内充液更换为非水溶剂的氯化钾或氯化锂饱和溶液,分析效果较好。
