液相分析方法进行方法学验证时各项指标的可接受标准
含量及有关物质分析方法验证的可接受标准精编版

试品溶液,分别由两个分析人员使用不同的仪器 与试剂进行测试,所得12个含量数据的相对标准 差应不大于20%。
4.专属性
含量:
可接受的标准为:空白对照应无干扰,主 成分与各有关物质应能完全分离,分离度不得 小于2.0。以二极管阵列检测器进行纯度分析 时,主峰的纯度因子应大于980。 有关物质:
可接受的标准为:空白对照应无干扰,该 杂质峰与其它峰应能完全分离,分离度不得小 于2.0。
总结及个人观点:
1. 在进行分析方法的验证时,首先还是要参 考中国药典和指导原则,文章中提到的试验方 法和可接受标准也是专家的一些经验总结,我 们在进行研究时应根据具体的项目分析参考。
2. 在耐用性试验时,文中要求每个条件下各 测试两次,且每次要平行测定6份样品?
总结及个人观点
3. 在进行溶出度测定方法的选择时,仅考 虑不同条件下单点的溶出度是不合适的,应 结合溶出曲线的测定结果来确定。 个人建议:(1)桨法和篮法均考查50、 75和100rpm。(2)将溶出曲线测定放在溶 出度测定方法验证之前进行。
该杂质峰峰面积的相对标准差应不大于2.0%, 保留时间的相对标准差应不大于1.0%。另外, 杂质峰的拖尾因子不得大于2.0,理论塔板数 应符合质量标准的规定。
9.溶液稳定性
有关物质:
按照分析方法分别配置对照品溶液与供试品 溶液,平行测定两次主成分与杂质的含量,然后 将上述溶液分别贮存在室温与冰箱冷藏室(4℃) 中,在1、2、3、5和7天时分别平行测定两次主 成分与杂质的含量。
(2)溶出介质体积的选择
溶出介质的体积需使药物符合漏槽条件, 大杯法(第一、二法)常用体积为500、900 和1000ml,小杯法(第三法)常用体积为 100~250ml。部分品种为满足在溶出量测定 时药物浓度的需要,可采用低于上述限度范围 的溶剂。
分析方法验证的接受标准

分析方法验证的接受标准鉴别测试对于HPLC,TLC或者GC等色谱鉴别法的专属性而言,接受标准应该是色谱峰与斑点的分离,至于分离度达到多少,可参考药典上HPLC 章节的内容,分离度通常应该大于1.5;至于紫外和红外的鉴别法,被测物质的特征图谱应该与标准物质响应相同,能清晰地与相似物区分,通常可采用全波长范围内的扫描,比较图谱的一致性,并且找1~2个特征吸收峰,不同物质特征吸收峰的峰值差异通常可定义为±2nm;含量测定之一溶出度方法验证接受标准溶出度的方法验证本质上属于含量测定,所以需要对精密度/重复性,中间精密度,专属性,线性,范围,准确度,稳定性等指标进行验证。
精密度通常需要采用6个以上的供试品溶液,通常仪器分析的相对标准偏差标准是不大于2.0%;专属性的要求与上述鉴别试验的要求类似,但对于溶出而言,需要考虑空白片的影响,通常空白片的影响接受标准是不大于3.0%;溶出度考察线性需要有不少于6个浓度的样品,相关系数不小于0.990,截距不大于5%,剩余标准差不大于2.5%。
这里需要说明的是截距允许正,也允许负,是指的一个绝对值,后面的两个百分数指标是指与回归线的y值对应于完全溶出(x=100%)时的浓度的比值。
范围无论是对于篮法还是桨法,建议采取的标准是低于标准的20%到标示量的120%准确度的平均值主要考察的是回收率以及回收率的相对标准偏差,回收率应该在标示量的95%~105%之间,相对标准偏差应该不大于2.5%,准确度的回收率考察往往是方法验证过程中的一个难点。
稳定性无论是对于供试溶液,还是对于标准品溶液,在规定的时间内的 变化应该不大于2.0%。
含量测定之二基于色谱|光谱法的含量测定接受标准精密度/重复性通常需要采用6个以上的供试品溶液,通常仪器分析的相对标准偏差标准是不大于2.0%;但原料药的分析有可能会有一个更高的精度度/重复性要求,相对标准偏差标准可以采用不大于1.0%或1.5%设定。
液相分析方法进行方法学验证时_各项指标的可接受标准
含量 RSD%应不大于 2.0%
进2针
S/N≈3.0
进性
空白溶剂 1 针 5+2 针对照 取在室温下放置 0h、1h、2h、4h、6h、 8h、12h 供试品溶液分别进样
RSD%应不大于 2.0%
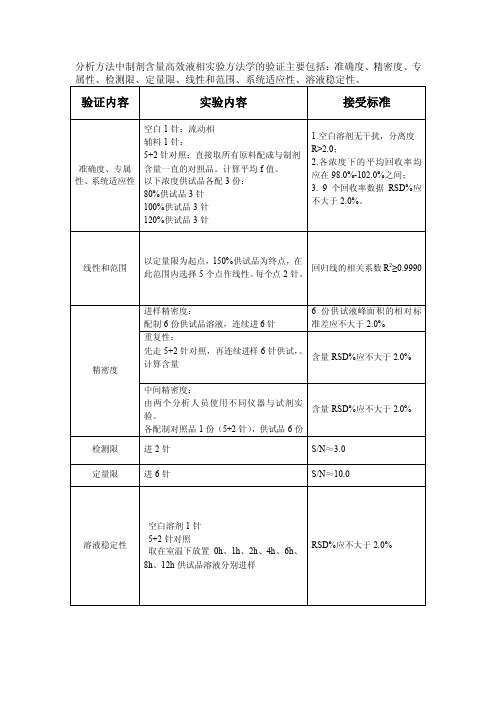
分析方法中制剂含量高效液相实验方法学的验证主要包括:准确度、精密度、专 属性、检测限、定量限、线性和范围、系统适应性、溶液稳定性。
验证内容
实验内容
接受标准
准确度、专属 性、系统适应性
空白 1 针:流动相 辅料 1 针: 5+2 针对照:直接取所有原料配成与制剂 含量一直的对照品。计算平均 f 值。 以下浓度供试品各配 3 份: 80%供试品 3 针 100%供试品 3 针 120%供试品 3 针
1.空白溶剂无干扰,分离度 R>2.0; 2. 各浓度下的平均回收率均 应在 98.0%-102.0%之间; 3. 9 个回收率数据 RSD%应 不大于 2.0%。
线性和范围
以定量限为起点,150%供试品为终点,在 此范围内选择 5 个点作线性。每个点 2 针。
回归线的相关系数 R2≥0.9990
精密度
检测限 定量限
进样精密度:
6 份供试液峰面积的相对标
配制 6 份供试品溶液,连续进 6 针
准差应不大于 2.0%
重复性:
先走 5+2 针对照,再连续进样 6 针供试,。 计算含量
含量 RSD%应不大于 2.0%
中间精密度: 由两个分析人员使用不同仪器与试剂实 验。 各配制对照品 1 份(5+2 针),供试品 6 份
液相峰谷比可接受标准-概述说明以及解释

液相峰谷比可接受标准-概述说明以及解释1.引言1.1 概述在撰写本文之前,首先需要明确液相峰谷比在化学领域中的重要性和应用。
液相峰谷比是一种用于描述在液相色谱分析中峰与谷之比的指标。
在液相色谱中,峰谷比可以反映物质的分离效果,进而评估分析方法的准确性和可靠性。
液相色谱技术在化学领域中得到广泛应用,其优点包括分析速度快、灵敏度高以及对复杂样品的适用性。
然而,由于样品中的复杂基质干扰以及仪器的噪声等因素,往往会导致峰形状变得不对称、背景噪声增加等问题,从而影响到定量分析的准确性。
因此,液相峰谷比的定义和研究对于提高液相色谱分析的准确性具有重要意义。
通过对峰和谷的区分与计算,液相峰谷比可以提供关于峰形对称性、分离度等信息,帮助分析人员判断分析结果的可靠性,并对分析方法进行优化。
在本文中,将首先介绍液相峰谷比的定义及计算方法,探索其在液相色谱分析中的应用。
同时,还将研究液相峰谷比的可接受标准,以指导实际分析中判断峰形对称性的标准。
最后,将对液相峰谷比的意义和局限性进行讨论,并对未来研究方向进行展望。
总之,本文将全面探讨液相峰谷比在液相色谱分析中的可接受标准,旨在为化学分析人员提供有关峰形对称性和分析结果可靠性的重要参考依据,并为后续的液相色谱分析方法研究提供借鉴。
1.2 文章结构本文分为引言、正文和结论三个部分。
每个部分的内容如下:1. 引言1.1 概述:介绍液相峰谷比的基本概念和背景。
1.2 文章结构:阐述本文的结构和各部分的内容安排。
1.3 目的:明确本文的研究目的和意义。
2. 正文2.1 液相峰谷比的定义:详细阐述液相峰谷比的定义和计算方法。
2.2 液相峰谷比的应用:介绍液相峰谷比在不同领域的应用案例。
2.3 液相峰谷比的可接受标准:探讨液相峰谷比的可接受范围和标准。
3. 结论3.1 总结:总结本文的主要内容和研究结果。
3.2 对液相峰谷比的意义和局限性的讨论:讨论液相峰谷比的实际意义、应用前景和相关局限性。
液相色谱方法学验证

液相色谱方法学验证
液相色谱方法学验证(Liquid chromatography method validation)是指通过一系列实验和数据分析,对液相色谱方法进行验证,以保证该方法能够获得可靠和准确的结果。
液相色谱方法学验证是药物分析、环境监测等领域中常用的分析方法验证方法。
液相色谱方法学验证通常包括以下方面:
1. 精密度(Precision):通过重复测定相同样品,计算测定结
果的变动程度,评估测定方法的精密度。
2. 准确度(Accuracy):通过添加已知浓度的标准品进行测定,与标准品浓度进行比较,评估测定方法的准确性。
3. 线性范围(Linearity):通过分析不同浓度的标准品,绘制
出样品浓度与峰面积或峰高的线性关系曲线,评估测定方法的线性范围。
4. 选定的特异性(Selectivity):检查方法中其他组分对分析
目标的干扰程度,评估测定方法的特异性。
5. 检测限(Detection limit):测定方法中能够可靠检测到目
标分析物的最低浓度。
6. 定量限(Quantitation limit):测定方法中能够定量测定目
标物质的最低浓度。
7. 精确度(Accuracy):通过测定不同样品的回收率,评估测定方法的精确度。
8. 系统适用性(System suitability):通过检查色谱柱效率、峰对称性、峰分离度等参数,评估测定方法的适用性。
液相色谱方法学验证是保证分析方法可靠性的重要步骤,验证结果需要符合相关的验证指南和标准要求。
高效液相色谱仪(HPLC)的校验与管理校验项目与技术指标(供参考)
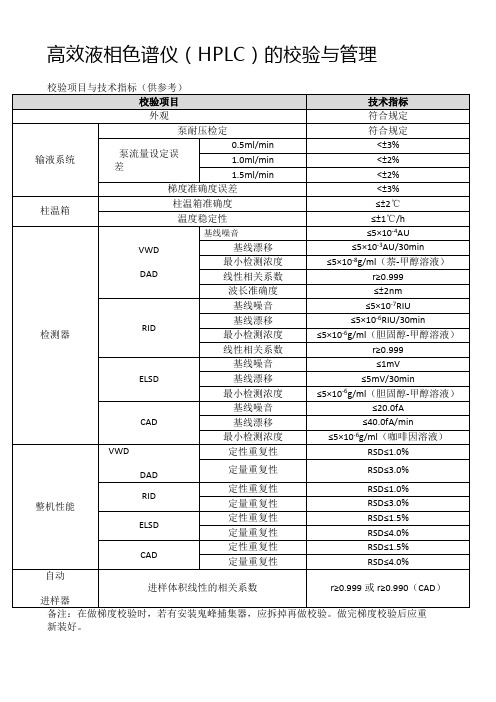
≤5×10-4AU
基线漂移
≤5×10-3AU/30min
最小检测浓度
≤5×10-8g/ml(萘-甲醇溶液)
线性相关系数
r≥0.999
波长准确度
≤±2nm
RID
基线噪音
≤5×10-7RIU
基线漂移
≤5×10-6RIU/30min
最小检测浓度
≤5×10-6g/ml(胆固醇-甲醇溶液)
线性相关系数
r≥0.999
ELSD
基线噪音
≤1mV
基线漂移
≤5mV/30min
最小检测浓度
≤5×10-6g/ml(胆固醇-甲醇溶液)
CAD
基线噪音
≤20.0fA
基线漂移
≤40.0fA/min
最小检测浓度
≤5×10-6g/ml(咖啡因溶液)
整机性能
VWD
DAD
定性重复性
RSD≤1.0%
定量重复性
RSD≤3.0%
RID
高效液相色谱仪(HPLC)的校验与管理
校验项目与技术指标(供参考)
校验项目
技术指标
外观
符合规定
输液系统
泵耐压检定
符合规定
泵流量设定误差
0.5ml/min
<±3%
1.0ml/min
<±2%
1.5ml/min<±2%梯准确度误差<±3%
柱温箱
柱温箱准确度
≤±2℃
温度稳定性
≤±1℃/h
检测器
VWD
DAD
定性重复性
RSD≤1.0%
定量重复性
RSD≤3.0%
ELSD
定性重复性
RSD≤1.5%
液相方法学验证中各项指标的深度剖析概述

有关物质、含量与自身对照三者浓度的关系
浓 度 进样量 绝对值 相对于样品测定浓度的
最大进样量 50mg/ml 以上 20μl 供试品溶液 对照溶液 最低检出量 5mg/ml 50μg/ml 1μg/ml 20μl 100μg 20μl 20μl 1μg 20ng 100%(5000 倍) 1% 0.02%
强破坏试验的目的:
验证药品在遭遇了极端的气候环境
条件下产生的杂质,在所建立的色谱
条件下是否能够分离、测定。
● 检测波长的确定 涉及到各被检测物质在该波长下的响应因子是否 相同,即所谓重量校正因子的问题。(f=A杂质/A被 测成分) 选取主成分与各杂质具有相同紫外吸收的波长 (f=1.0)。 选取各杂质紫外吸收大于主成分紫外吸收的波长 (f>1.0),这样可更加严格控制杂质的限度。 如选取各杂质紫外吸收小于主成分紫外吸收的波 长,应必须加入重量校正因子(f<1.0),否则将得 到错误的判断。
物(确认结构后人工合成)来验证与主成分
的分离。
系统适用性试验的配制方法: 在100%浓度的主成分溶液中加 入1%浓度的杂质对照品,以模拟样品 中有可能存在的状态。 介绍配制方法 —— 先配制杂质贮
备液,再用供试品溶液(或浓的对照
品溶液)来稀释,简便、易行!
专属性试验验证图谱
存在问题 —— 配制相同浓度,测定 样品时,主成分峰骤然加大,将杂质 峰覆盖。
积分参数的设定
●
积分参数的设定是非常重要的。由斜率(Slope)、 峰宽(Width)、最小峰面积(Min Area)组成。
●
采用自身对照法时,对照溶液与供试品溶液必须 在同一斜率、峰宽下进行积分计算。
供试品溶液最小峰面积的设定将直接导致测定结 果。设定得太小,会导致很多小峰甚至是基线漂 移的小峰均被积分出作为杂质峰,从而导致杂质 峰面积增加,易判断为不合格;如设定得过大, 又将反映不出杂质情况。
有关物质可接受标准

有关物质分析方法验证的可接受标准简介摘要:本文介绍了在对有关物质检查所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。
关键词:有关物质检查分析方法验证可接收标准药品中的有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。
由于这些有关物质的存在会影响到药品的纯度,进而可能会产生毒副作用,所以有关物质的控制是药品研发的一个重要方面,也是我们在药品审评中一直重点关注的要点之一。
而要对有关物质进行严格的控制,就离不开专属性强、灵敏度高的分析方法,这就涉及到分析方法的筛选与验证。
从现有的申报资料看,药品研发单位已基本上意识到分析方法验证的重要性,但是对验证时各具体指标是否可行尚没有一个明确的可接受标准,从而难以对验证结果进行评判。
为解决这一问题,本文结合国外一些大型药品研发企业在此方面的要求,提出了在对有关物质检查方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
1.准确度该指标主要是通过回收率来反映。
验证时一般要求根据有关物质的定量限与质量标准中该杂质的限度分别配制三个浓度的供试品溶液各三份(例如某杂质的限度为0.2%,则可分别配制该杂质浓度为0.1%、0.2%和0.3%的杂质溶液),分别测定其含量,将实测值与理论值比较,计算回收率,并计算9个回收率数据的相对标准差(RSD)。
该项目的可接受的标准为:各浓度下的平均回收率均应在80%-120%之间,如杂质的浓度为定量限,则该浓度下的平均回收率可放宽至70%-130%,相对标准差应不大于10%。
2.线性线性一般通过线性回归方程的形式来表示。
具体的验证方法为:在定量限至一定的浓度范围内配制6份浓度不同的供试液,分别测定该杂质峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于0.990,Y轴截距应在100%响应值的25%以内,响应因子的相对标准差应不大于10%。
液相分析方法进行方法学验证时各项指标的可接受标准

液相分析方法进行方法学验证时各项指标的可接受标准This model paper was revised by the Standardization Office on December 10, 2020液相分析方法进行方法学验证时,各项指标的可接受标准审评四部黄晓龙1、有关物质药品中的有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。
由于这些有关物质的存在会影响到药品的纯度,进而可能会产生毒副作用,所以有关物质的控制是药品研发的一个重要方面,也是我们在药品审评中一直重点关注的要点之一。
而要对有关物质进行严格的控制,就离不开专属性强、灵敏度高的分析方法,这就涉及到分析方法的筛选与验证。
从现有的申报资料看,药品研发单位已基本上意识到分析方法验证的重要性,但是对验证时各具体指标是否可行尚没有一个明确的可接受标准,从而难以对验证结果进行评判。
为解决这一问题,本文结合国外一些大型药品研发企业在此方面的要求,提出了在对有关物质检查方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
1.准确度该指标主要是通过回收率来反映。
验证时一般要求根据有关物质的定量限与质量标准中该杂质的限度分别配制三个浓度的供试品溶液各三份(例如某杂质的限度为%,则可分别配制该杂质浓度为%、%和%的杂质溶液),分别测定其含量,将实测值与理论值比较,计算回收率,并计算9个回收率数据的相对标准差(RSD)。
该项目的可接受的标准为:各浓度下的平均回收率均应在80%-120%之间,如杂质的浓度为定量限,则该浓度下的平均回收率可放宽至70%-130%,相对标准差应不大于10%。
2.线性线性一般通过线性回归方程的形式来表示。
具体的验证方法为:在定量限至一定的浓度范围内配制6份浓度不同的供试液,分别测定该杂质峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于,Y轴截距应在100%响应值的25%以内,响应因子的相对标准差应不大于10%。
含量测定分析方法验证的可接受标准简介

含量测定分析方法验证的可接受标准简介摘要:本文介绍了在对含量测定所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。
关键词:含量测定分析方法验证可接收标准为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。
该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。
但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。
1.准确度该指标主要是通过回收率来反映。
验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。
可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。
2.线性线性一般通过线性回归方程的形式来表示。
具体的验证方法为:在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。
3.精密度1)重复性配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。
2)中间精密度配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。
4.专属性可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。
以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。
5.检测限主峰与噪音峰信号的强度比应不得小于3。
6.定量限主峰与噪音峰信号的强度比应不得小于10。
另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于2.0%。
质量标准中含量测定分析方法验证的可接受标准简介

含量测定分析方法验证的可接受标准简介摘要:本文介绍了在对含量测定所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。
关键词:含量测定分析方法验证可接收标准在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。
为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。
该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。
但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。
另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。
本文结合国外一些大型药品研发企业在此方面的要求,提出了在对含量测定方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
1.准确度该指标主要是通过回收率来反映。
验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。
可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。
2.线性线性一般通过线性回归方程的形式来表示。
具体的验证方法为:在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。
3.精密度1)重复性配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。
高效液相分析方法验证

Isocratic vs. Gradient 等度 VS. 梯度
Method Development 方法开发 – Initial Chromatographic Conditions Initial 色谱条件
C18 Column: first choice C18柱:首选
Short length: 10 cm or 15 cm 短柱: 10 cm or 15 cm
Small diameter: 3.5 µ m or 5 µ m 小的粒径: 3.5 µ m or 5 µ m
End-capped
封尾
Method Development 方法开发
Pore size, Surface area, End capping 孔径,表面积,封尾
Method Development 方法开发 – HPLC Column色谱柱:考考你 ???
Particle Size 粒径Length长度 Expected N 要求
3.5 µm
5 cm
4200
3.5 µm
Method Development – HPLC Mobile Phase: Buffer 流动相:缓冲液
Buffer Selection Principle:
缓冲液选择原则
The pH of the mobile phase buffer should NOT be within ±2 pH units of the pKa values of the
Ion-Exchange: Dionex column 离子交换: Dionex column
含量及有关物质分析方法验证的可接受标准

溶出介质体积的选择
漏槽条件即做溶出的最佳条件,是指药物 所处释放介质的浓度远小于其饱和浓度,生理 学解释为药物在体内被迅速吸收,制剂的体外 包括释放度等测定需要模仿体内生理条件的, 满足药物溶解-吸收的过程,漏槽条件起到了 修正作用,一般释放介质的体积为药物饱和溶 液所需介质体积的3~5倍。
(3)转篮法与桨法的选择
含量及有关物质 分析方法验证的可接受标准
文章来源:药审中心 审评二部 黄晓龙
本文介绍了在对含量及有关物质测定所用的 分析方法进行方法学验证时,各项指标的可接 受标准,以利于判断该分析方法的可行性。
内容包括:准确度、线性、精密度、专属性、 检测限、定量限、耐用性和系统适应性 。
1.准确度
含量: 该指标主要是通过回收率来反映。验证时一般 要求分别配制浓度为80%、100%和120%的供 试品溶液各三份,分别测定其含量,将实测值 与理论值比较,计算回收率。 可接受的标准为:各浓度下的平均回收率均 应在98.0%-102.0%之间,9个回收率数据的相 对标准差(RSD)应不大于2.0%。
3.精密度
含量: 1)重复性 配制6份相同浓度的供试品溶液,由一个分析 人员在尽可能相同的条件下进行测试,所得6份供 试液含量的相对标准差应不大于2.0%。 2)中间精密度 配制6份相同浓度的供试品溶液,分别由两个 分析人员使用不同的仪器与试剂进行测试,所得 12个含量数据的相对标准差应不大于2.0%。
化学药品溶出度方法研究
文章来源:审评二部 唐素芳
化学药品普通口服固体制剂 溶出度方法验证易忽视的几个问题
文章来源:审评四部审评八室 郑国钢
溶出度研究试验主要包括以下内容:
(1)溶出介质的选择 (2)溶出介质体积的选择 (3)溶出方法(转篮法与桨法)的选择 (4)转速的选择 (5)溶出度测定方法的验证 (6)溶出度均一性试验(批内) (7)重现性试验(批间)
有关物质分析方法验证的可接受标准简介

有关物质分析方法验证的可接受标准简介(CDE网站2006年2月8号发表的电子刊物)摘要:本文介绍了在对有关物质检查所用的分析方法进行方法学验证时,各项指标的可接受标准,以利于判断该分析方法的可行性。
关键词:有关物质检查分析方法验证可接收标准药品中的有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。
由于这些有关物质的存在会影响到药品的纯度,进而可能会产生毒副作用,所以有关物质的控制是药品研发的一个重要方面,也是我们在药品审评中一直重点关注的要点之一。
而要对有关物质进行严格的控制,就离不开专属性强、灵敏度高的分析方法,这就涉及到分析方法的筛选与验证。
从现有的申报资料看,药品研发单位已基本上意识到分析方法验证的重要性,但是对验证时各具体指标是否可行尚没有一个明确的可接受标准,从而难以对验证结果进行评判。
为解决这一问题,本文结合国外一些大型药品研发企业在此方面的要求,提出了在对有关物质检查方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
1.准确度该指标主要是通过回收率来反映。
验证时一般要求根据有关物质的定量限与质量标准中该杂质的限度分别配制三个浓度的供试品溶液各三份(例如某杂质的限度为0.2%,则可分别配制该杂质浓度为0.1%、0.2%和0.3%的杂质溶液),分别测定其含量,将实测值与理论值比较,计算回收率,并计算9个回收率数据的相对标准差(RSD)。
该项目的可接受的标准为:各浓度下的平均回收率均应在80%-120%之间,如杂质的浓度为定量限,则该浓度下的平均回收率可放宽至70%-130%,相对标准差应不大于10%。
2.线性线性一般通过线性回归方程的形式来表示。
具体的验证方法为:在定量限至一定的浓度范围内配制6份浓度不同的供试液,分别测定该杂质峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于0.990,Y轴截距应在100%响应值的25%以内,响应因子的相对标准差应不大于10%。
【药物分析方法学验证】分析方法的方法学验证

【药物分析方法学验证】分析方法的方法学验证分析方法的方法学验证一、方法验证1.准确度该指标主要是通过回收率来反映。
验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。
可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSd)应不大于2.0%。
2.线性线性一般通过线性回归方程的形式来表示。
具体的验证方法为:在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。
3.精密度1)重复性配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。
2)中间精密度配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。
4.专属性可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。
以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。
5.检测限主峰与噪音峰信号的强度比应不得小于3。
6.定量限主峰与噪音峰信号的强度比应不得小于10。
另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于2.0%。
7.耐用性分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、流速相对值变化±20%时,仪器色谱行为的变化,每个条件下各测试两次。
可接受的标准为:主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离;各条件下的含量数据(n=6)的相对标准差应不大于2.0%。
hplc 的可接受标准

hplc 的可接受标准一、概述HPLC(高效液相色谱法)是一种常用的分析方法,广泛应用于药物分析、食品安全、环境监测等领域。
为了保证HPLC分析结果的准确性和可靠性,制定本可接受标准,用于评估和规范HPLC实验操作。
二、实验设备与试剂1.高效液相色谱仪应满足制造商提供的技术指标,并定期进行校准和验证。
2.实验试剂应符合相关质量标准,并经过适当的纯化和处理。
3.实验用水应符合分析要求,可使用去离子水或符合相关标准的纯水。
4.注射器、管道接头等实验用具应清洗干净,避免引入杂质和污染。
三、样品处理1.样品应预先处理,确保其均匀性和稳定性。
2.样品量应准确,并符合相关规定。
3.样品处理过程中应避免污染和损失。
4.样品标识应清晰,避免混淆和误用。
四、流动相配制1.流动相的配制应准确、合理,并经过充分的混合和过滤。
2.流动相的配制环境应符合规定,避免污染和杂质引入。
3.定期对流动相进行监测和评估,确保其质量和稳定性。
五、色谱条件设置1.色谱柱的选择应考虑样品性质和检测要求,并定期进行评估和维护。
2.检测器的选择和应用应符合相关规定,并定期进行校准和验证。
3.实验条件(如流速、柱温、检测波长等)应根据样品性质和检测要求进行设置和调整。
4.色谱图应清晰、稳定,无明显干扰峰。
六、可接受标准范围1.定量限:检测结果应达到规定的定量限要求,以确保能够准确测定样品中目标成分的浓度。
2.线性范围:检测结果应呈线性关系,以评估分析方法的可靠性。
一般要求相关系数(r)值大于0.99。
3.精密度与准确度:分析结果应在可接受的范围内,包括日内精密度、日间精密度以及回收率等指标。
根据不同应用领域和检测目的,可适当调整标准。
4.稳定性:样品及检测结果应在规定的时间内保持稳定,以确保分析结果的可靠性。
5.报告结果:报告结果应包括待测成分的保留时间、峰高或峰面积、浓度等信息,并与标准品进行比对确认。
七、实验过程控制与记录1.实验过程中应严格遵守操作规程,避免人为误差和干扰因素。
液相分析方法进行方法学验证时,各项指标的可接受标准

液相分析方法进行方法学验证时,各项指标的可接受标准(总3页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除液相分析方法进行方法学验证时,各项指标的可接受标准审评四部黄晓龙1、有关物质药品中的有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。
由于这些有关物质的存在会影响到药品的纯度,进而可能会产生毒副作用,所以有关物质的控制是药品研发的一个重要方面,也是我们在药品审评中一直重点关注的要点之一。
而要对有关物质进行严格的控制,就离不开专属性强、灵敏度高的分析方法,这就涉及到分析方法的筛选与验证。
从现有的申报资料看,药品研发单位已基本上意识到分析方法验证的重要性,但是对验证时各具体指标是否可行尚没有一个明确的可接受标准,从而难以对验证结果进行评判。
为解决这一问题,本文结合国外一些大型药品研发企业在此方面的要求,提出了在对有关物质检查方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
1.准确度该指标主要是通过回收率来反映。
验证时一般要求根据有关物质的定量限与质量标准中该杂质的限度分别配制三个浓度的供试品溶液各三份(例如某杂质的限度为%,则可分别配制该杂质浓度为%、%和%的杂质溶液),分别测定其含量,将实测值与理论值比较,计算回收率,并计算9个回收率数据的相对标准差(RSD)。
该项目的可接受的标准为:各浓度下的平均回收率均应在80%-120%之间,如杂质的浓度为定量限,则该浓度下的平均回收率可放宽至70%-130%,相对标准差应不大于10%。
2.线性线性一般通过线性回归方程的形式来表示。
具体的验证方法为:在定量限至一定的浓度范围内配制6份浓度不同的供试液,分别测定该杂质峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于,Y轴截距应在100%响应值的25%以内,响应因子的相对标准差应不大于10%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
液相分析方法进行方法学验证时,各项指标的可接受标准
审评四部黄晓龙
1、有关物质
药品中的有关物质泛指在药品的生产与储存过程中产生的工艺杂质或降解产物。
由于这些有关物质的存在会影响到药品的纯度,进而可能会产生毒副作用,所以有关物质的控制是药品研发的一个重要方面,也是我们在药品审评中一直重点关注的要点之一。
而要对有关物质进行严格的控制,就离不开专属性强、灵敏度高的分析方法,这就涉及到分析方法的筛选与验证。
从现有的申报资料看,药品研发单位已基本上意识到分析方法验证的重要性,但是对验证时各具体指标是否可行尚没有一个明确的可接受标准,从而难以对验证结果进行评判。
为解决这一问题,本文结合国外一些大型药品研发企业在此方面的要求,提出了在对有关物质检查方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
1.准确度
该指标主要是通过回收率来反映。
验证时一般要求根据有关物质的定量限与质量标准中该杂质的限度分别配制三个浓度的供试品溶液各三份(例如某杂质的限度为%,则可分别配制该杂质浓度为%、%和%的杂质溶液),分别测定其含量,将实测值与理论值比较,计算回收率,并计算9个回收率数据的相对标准差(RSD)。
该项目的可接受的标准为:各浓度下的平均回收率均应在80%-120%之间,如杂质的浓度为定量限,则该浓度下的平均回收率可放宽至70%-130%,相对标准差应不大于10%。
2.线性
线性一般通过线性回归方程的形式来表示。
具体的验证方法为:
在定量限至一定的浓度范围内配制6份浓度不同的供试液,分别测定该杂质峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于,Y轴截距应在100%响应值的25%以
内,响应因子的相对标准差应不大于10%。
3.精密度
1)重复性
配制6份杂质浓度(一般为%)相同的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于15%。
2)中间精密度
配制6份杂质浓度(一般为%)相同的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于20%。
4.专属性
可接受的标准为:空白对照应无干扰,该杂质峰与其它峰应能完全分离,分离度不得小于。
5.检测限
杂质峰与噪音峰信号的强度比应不得小于3。
6.定量限
杂质峰与噪音峰信号的强度比应不得小于10。
另外,配制6份最低定量限浓度的溶液,所测6份溶液杂质峰保留时间的相对标准差应不大于%,峰面积的相对标准差应不大于%。
7.耐用性
分别考察流动相比例变化±5%、流动相pH值变化±、柱温变化±5℃、检测波长变化±5nm、流速相对值变化±20%以及采用三根不同批号的色谱柱进行测定时,仪器色谱行为的变化,每个条件下各测试两次。
可接受的标准为:各杂质峰的拖尾因子不得大于,杂质峰与其他成分峰必须达到基线分离;各条件下的杂质含量数据(n=6)的相对标准差应不大于%,杂质含量的绝对值在±%以内。
8、系统适应性
配制6份相同浓度的杂质溶液进行分析,该杂质峰峰面积的相对标准差应不大于%,保
留时间的相对标准差应不大于%。
另外,杂质峰的拖尾因子不得大于,理论塔板数应符合质量标准的规定。
9.溶液稳定性
按照分析方法分别配置对照品溶液与供试品溶液,平行测定两次主成分与杂质的含量,然后将上述溶液分别贮存在室温与冰箱冷藏室(4℃)中,在1、2、3、5和7天时分别平行测定两次主成分与杂质的含量。
可接受的标准为:主成分的含量变化的绝对值应不大于%,杂质含量的绝对值在±%以内,并不得出现新的大于报告限度的杂质。
2、含量
在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。
为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。
该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述,但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。
另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。
本文结合国外一些大型药品研发企业在此方面的要求,提出了在对含量测定方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
1.准确度
该指标主要是通过回收率来反映。
验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。
可接受的标准为:各浓度下的平均回收率均应在%%之间,9个回收率数据的相对标准差(RSD)应不大于%。
2.线性
线性一般通过线性回归方程的形式来表示。
具体的验证方法为:在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于%。
3.精密度
1)重复性
配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于%。
2)中间精密度
配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于%。
4.专属性
可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于。
以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。
5.检测限
主峰与噪音峰信号的强度比应不得小于3。
6.定量限
主峰与噪音峰信号的强度比应不得小于10。
另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于%。
7.耐用性
分别考察流动相比例变化±5%、流动相pH值变化±、柱温变化±5℃、流速相对值变化±20%时,仪器色谱行为的变化,每个条件下各测试两次。
可接受的标准为:主峰的拖尾因子不得大于,主峰与杂质峰必须达到基线分离;各条件下的含量数据(n=6)的相对标准差应不大于%。
8、系统适应性
配制6份相同浓度的供试品溶液进行分析,主峰峰面积的相对标准差应不大于%,主峰保留时间的相对标准差应不大于%。
另外,主峰的拖尾因子不得大于,主峰与杂质峰必须达到基线分离,主峰的理论塔板数应符合质量标准的规定。
