有机化学之胺类化合物(精选)
有机化学-胺与杂环化合物
第十章:含氮有机化合物
前 言
胺和杂环化合物是两类极其重要的有机含氮化合物:
A:蛋白质的基础物质——氨基酸
B:治疗和控制精神病患者情绪的药物——胺的衍生物
C:储存和传递遗传信息、控制蛋白质合成功能的核酸
D:抗菌消炎的磺胺药物
第十四章:胺和杂环化合物
一、胺的分类和结构
第一节: 胺 类
第一节: 胺 类
四、胺的化学性质
碱性与成盐
B:成 盐:
由于胺具有碱性,不管是否易溶于水,均能定量 地与无机酸反应形成盐。
+ HCI
R — NH3CI
+
R — NH2
:
-
NaOH
R — NH2
:
利用胺的碱性与成盐的性质,可以分离、纯化胺与非碱性化合物的混合物。
NH3
..
H
H
H
112.9°
CH3NH2
..
H
CH3
H
N原子采用sp3不等性杂化成键
NH3 结 构
CH3—NH2 结 构
二、胺的命名
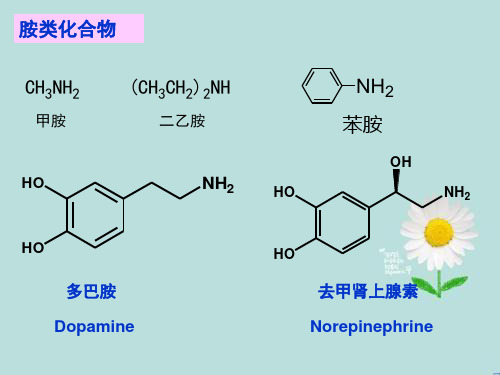
(1)烃基较简单,以胺为母体,烃基作为取代基
二乙胺
N,N-二甲基苯胺
对苯二胺
(2)复杂的胺以烃为母体,氨基作为取代基
2,4-二甲基-2-氨基-3-甲氨基戊烷
四、胺的化学性质
碱性与成盐
A:碱 性:
季铵碱 > 脂肪胺 > NH3 > 芳香胺
H
H
N
H
H
:
R — NH2
+ H2O
R — NH3
+
+ OH—
:
p -π共轭体系的形成,使胺基上的N的电子云向苯环离域化,电子云的密度降低,接受H + 的能力下降 .碱性降低。
有机化学之胺类化合物教学案例

CH3
N+ ph C2H5 CH2=CHCH2
• 芳香胺
NH H
N原子在SP3与SP2杂化之间,为不等 性的sp3杂化。其弧对电子与大π键 可以达到某种程度上的共轭,C-N键 具有部分双键的性质。
2. 胺的化学性质 1) 碱性 胺和氨相似,具有碱性,能与大多数酸作用成盐。
RN2 H+H C l RN2 H+H O SO 3H
•气态时,仅有烷基的供电子效应,烷基越多,供电子效应越大。 •在水溶液中,碱性的强弱决定于电子效应、溶剂化效应等。 溶剂化效应——铵正离子与水的溶剂化作用(胺的氮原子上的氢与水形成氢 键的作用)。胺的氮原子上的氢越多,溶剂化作用越大,铵正离子越稳定, 胺的碱性越强。
HO H 2
C H 3
C H 3
C H 3N +HO H 2>C H 3 N +HO H 2>C H 3N +HO H 2
3) 烷基化 氨或胺与卤代烃作用
1 胺分子中的氮原子上有弧对电子,可作为亲核试剂与卤 代烃发生SN2反应。
C H 3 C H 2 IN H 3 C H 3 C H 2 N H 3 + I C H 3 C H 2 N H 3 + I - N H 3 C H 3 C H 2 N H 2N H 4 I
C H 3 C H 2 N H 2C H 3 C H 2 I( C H 3 C H 2 ) 2 N H 2 + I - ( C H 3 C H 2 ) 2 N H N H 4 I
HO H 2
HO H 2
C H 3
C、芳香胺的碱性比氨弱,不能用石蕊试纸检验,强弱与芳环上取代基的性 质有关。苯环上连供电子基时,碱性略有增强;连有吸电子基时,碱性则降
药用有机化学试题(第九章:含氮化合物(胺类)附答案 )

第九章:含氮化合物(胺类)223.下列化合物中,低温下能生成稳定重氮盐的是?[1分]A苄胺B苯胺CN-甲基苯胺DN-甲基苄胺参考答案:B224.下列化合物中,沸点最高的是?[1分]A乙酸B乙胺C二乙胺D乙醇参考答案:A225.下列化合物中碱性最强的是?[1分]A NH3B CH3NH2C C 6H5CH2NH2D CH3NHCH3参考答案:D226.的正确名称为?[1分] A苯乙胺B乙苯胺CN-苯基乙胺DN-乙基苯胺参考答案:D227.下列化合物属于芳香胺的是?[1分]ABCD参考答案:B228.能与乙酰氯发生酰化反应的胺是?[1分]A异丙胺B二乙丙胺CN,N-二甲基苯胺D甲乙丙胺参考答案:A229.下列化合物中,沸点最高的是?[1分]A CH3NH2B CH3CH2CH2NH2 C(CH3)3N D CH3NHCH2CH3参考答案:B230.关于苯胺性质的叙述错误的是?[1分]A易被空气中氧气氧化B能与盐酸所用生成季铵盐C能与羧酸反应生成酰胺D 能与溴水反应生成白色沉淀参考答案:B231.与亚硝酸反应可放出氮气的是?[1分]ACH3NH2BCH3NHCH3C(CH3)3NDCH3NHCH2CH3参考答案:A232.与NaNO2和盐酸反应,能生成黄色油状物的是?[1分]AC6H5NH2BCH3CH2NH2CCH3NHCH2CH3D(CH3)3N参考答案:C233.芳香胺的碱性一般较脂肪胺弱。
[1分]参考答案:T234.在实验室合成乙酰苯胺时,可采用苯胺和乙酸进行制备。
[1分]参考答案:T235.所有的胺及其衍生物均呈碱性。
[1分]参考答案:F236.胺的碱性取决于氮原子上电子云密度,电子云密度越大,碱性越强。
[1分]参考答案:T237.胺的盐类属于离子型化合物,具有强酸性。
[1分]参考答案:T238.利用伯、仲、叔胺与HNO2的不同反应性能,可以鉴别伯、仲、叔胺。
[1分]参考答案:T239.胺可与不溶于水的中性或酸性物质分离,是由于胺具有碱性。
有机化学11胺与酰胺

RNH2 R’X RNHR’ R’X RR’2N R’X RR’3N+X-
伯胺
仲胺
叔胺
季铵盐
胺作为亲核试剂与卤代烃发生取代反应,生 成仲胺、叔胺和季铵盐。此反应可用于工业上 生产胺类。但往往得到的是混合物。
烷基化后,碱性增强,再次烷基化容易。
3、酰化、Hinsberg反应
伯胺、仲胺易与酰氯或酸酐等酰基化剂作用生
3、酰胺的化学性质
1)酰胺的酸碱性; 2)与亚硝酸反应; 3)还原反应; 4)霍夫曼降级反应。
本章思考题和作业
一、习题:10.1,10.4; 二、习题:10.3; 作业:习题: 10.2,10.5,10.6,10.7。
季铵碱为强碱,其碱性与氢氧化钠或 氢氧化钾相当。卤化季铵盐的水溶液用氧 化银处理时则生成季铵碱。
R 4 N + C l+A g 2 OH 2 OR 4 N + O H+ A g C l
比较碱性(给电子能力):
(1)芳胺 < NH3 < 脂肪胺 (2)脂肪胺:
气态:NH3<CH3NH2<(CH3)2NH<(CH3)3N 水溶液: NH3< (CH3)3N < CH3NH2
2、胺的命名
❖简单的胺:用“胺”作官能团,把它所含烃基 的名称和数目写在前面,按简单到复杂先后列出, 后面加上“胺”字。
CH3 N
CH2CH3
甲(基)乙(基)环丙胺
❖复杂的胺:作为烃类的衍生物来命名
❖季铵化合物:作为铵的衍生物来命名
氢氧化四甲铵
溴化四乙铵
§1.3 胺的物理性质
低级脂胺是气体或易挥发的液体,具有难闻的臭 味。高级胺为固体。胺的沸点比分子量相近的烃类 高,但比醇或羧酸的沸点低。叔胺氮原子上无氢原 子,分子间不能形成氢键,因此沸点比其异构体的 伯、仲胺低。伯、仲、叔胺都能与水分子形成氢键, 低级的胺易溶于水。胺的溶解度随分子量的增加而 迅速降低,从6个碳原子的胺开始就难溶于水。一 般胺能溶于醚、醇、苯等有机溶剂。
大学有机化学 第13章_胺及其衍生物

3.29
3.36
4.4
N H
pKb 2.88
(CH3CH2)2NH
(CH3CH2)3N
CH3CH2NH2
3.06
RNH2 + H2O
3.25
RNH3+ + OH-
3.36
13 .3 胺类化合物的化学性质
芳香胺的碱性强弱与芳环上取代基的性质有关。
CH3 NH2 > NH2 > O2N NH2
RNH2 —————> N2
重氮化反应
CH3CH2CH2NH2 1o胺 NaNO2 HCl
NaNO2+HCl
+ H2O + 混合物
CH3CH2CH2N+ NCl重氮盐
CH3CH2CH2++Cl- + N2 醇、烯、卤代烃等
13 .3 胺类化合物的化学性质
NH2
氯化重氮苯 (重氮盐)
NaNO2 , HCl
季 铵 碱 (R4N+OH - ) 为 离 子 化 合 物 , 其 碱 性 与 NaOH相当,是强碱。季铵碱与酸作用生成季铵盐。 综合多种因素,各类胺碱性强弱的大致排列顺序为: 季铵碱(强碱) >>脂肪胺 ( 2o >1o >3o ) > NH3 >> 芳香胺
13 .3 胺类化合物的化学性质
13.3.2
CH3 N H
NaNO2 HCl
CH3 N NO
N-甲基-N-亚硝基苯胺
H2O
芳香胺的 N- 亚硝基化合物 在酸性条件下会立即发生重 排,生成对亚硝基化合物。
ON
H+ CH3 N H
胺类化合物第一组-精选文档43页

RNH2 (Ar)
R'COCl or (R'CO)2O
RNHCOR'
R2NH
R'COCl
R2NCOR'
NHCH3 CH3COCl
R3N (Ar)3N
R'COCl2 or (R'CO)2O
NCOCH3 CH3
芳胺的特性反应 • 氧化反应
芳胺很容易氧化,例如,新的纯苯胺是无色的,但暴 露在空气中很快就变成黄色然后变成红棕色。用氧化剂 处理苯胺时,生成复杂的混合物。在一定的条件下,苯 胺的氧化产物主要是对苯
广泛。它在农业上用作高效固体氮肥,也是有机合成的 重要原料。用于合成药物、塑料等。尿素本身也是药物, 对降低脑颅内压和眼内压有显著疗效。 尿素具有酰胺的
结构,有酰胺的一般化学性质。但因两个氨基连在一个 羰基上,所以它又表现出某些特殊的性质。
(2)丙二酰脲 尿素与酰氯、酸酐或酯作用,则生成相应的酰脲。例如, 尿素与丙二酰氯反应生成丙二酰脲。 丙二酰脲是无色晶体,
上述重氮基被其他基团取代的反应,可用来制备一 般不能用直接方法来制取的化合物。
例1, 从甲苯制间溴甲苯,即不能用甲苯直接溴化 ,也不能用溴苯直接甲基化,只能用见解方法制取。
例2,制备1,3,5-三溴苯。 例3,由硝基苯制备2,6-二溴苯甲酸
NO2 Fe
NH2 (CH3CO)2O
NHCOCH3 HNO3
• 从形溶成剂氢效键应少和,空与间H+位结阻合效形应成看铵:离N子上后取,代溶基剂多化,稳与定H作2O 用弱,碱性减弱。
• N上的取代基多了,空间障碍就不利于N接受H+——碱 性减弱。
• 具体的胺的碱性是这两种相反因素协同作用的结果, 一级胺与三级胺哪个碱性强,要看是什么烃基,不同 的烃基得出的次序可能不同。
有机化学之胺类化合物-文档资料

+
C H 3
+ N p h C H 2 5 C H = C H C H 2 2
p h C H C H = C H 2 2
芳香胺
N
H H
N原子在SP3与SP2杂化之间,为不等 性的sp3杂化。其弧对电子与大π键 可以达到某种程度上的共轭,C-N键 具有部分双键的性质。
+ R N H + O H 3
胺的碱性较弱,其盐与氢氧化钠溶液作用时,释放出游离胺。
R NH Cl + N a O H 3
R N H + C l+ H O 2 2
胺的碱性强弱
A、碱性强度:脂肪胺 > 氨 > 芳香胺
C H N H 3 2
PKb
(C H )2 N H 3 3 .2 7 N H 2 1 3 .0
C H C H O C H C H C H C H ) N HC H C H C H C H O H 3 2 2 3 ( 3 2 2 3 2 2 2
o 3 4 . 5 C o 5 6 C o 1 1 7 C
4 炭原子数目相同,沸点 伯胺>仲胺>叔胺.
5 溶解度:低级胺(C6~C7)能溶于水,溶解度略大于相应 的醇。随分子量的增加,溶解度降低,高级胺不溶于水。
C H C H C H C H C H C H C H 3 2 2 2 2 3 N H C H C H 2 3
3-(N-乙氨基)庚烷
ON H C H C C H C C H 3 2 3
3-甲基-2-(N-甲氨基)戊烷
O H N 2 C O C H 2 5
4-亚氨基-2-戊酮
对氨基苯甲酸乙酯
有机化学15章-胺类化合物

+ KOH
nd
Cl NO2 + OHCl
若硝基的邻位,对位 有吸电子基时,亲核 取代反应易发生
N2O
NO2 Cl
NO2
NO2
一、芳香族硝基化合物
(4) 硝基对其邻、对位取代基的影响
硝基吸电子的共轭和诱导效应对其邻、对位存在的取代基产生显著 的影响,对间位上的取代基影响较小。
OH OH NO2 NO2 OH NO2 O2N NO2 OH NO2
二、胺
(2) 烃基化反应
胺是一种亲核试剂,能与卤代烷(伯卤代烷)或具有活泼卤原子
的芳卤化合物发生亲核取代反应,在胺的氮原子上引入烃基,称 为烃基化反应
NH2 +
CH2Cl
NaHCO3
CH2NH
NH2 +
OH
ZnCl2
NH
二、胺
(3) 酰基化
伯胺、仲胺氮原子上含有可被取代的氢原子,当与酰基化剂
(酰氯、酸酐)反应时,则发生酰化反应,分别得到 N—
CH3 N H5C2 Ph CH2CH CH2 Ph H2C CHCH2
CH3 N C2H5
S-
R-
二、胺
芳胺
具有较多p成份 140pm .. N H 142.5O H N介于sp2~sp3杂化之间
芳胺中存在P, π 共轭
电子云向环上共轭转移
N原子的碱性和亲核性都大大降低 芳环上的亲电取代活性增强(特别是o、p-位)
O
Br NO 2
NO 2 浓 发烟 HNO 3 , H2SO4
95
O
C NO 2
NO2
发烟 H2SO4
110
O
C
SO3H
有机化学有机化学胺以及生物碱
H3C H3C
三
47nm
01nm
.9。 .9。
键长:C-N 0.147nm
H3C N H3C
CH3 键角: C-N-C 108。
三甲胺
N
❖苯胺分子中,苯环上所有未参与杂化的p轨道所形成 的大π键可以和氮原子的未参与成键的 sp3杂化轨道形 成部分共轭体系
胺的物理性质
❖ 物态: 低级胺为无色气体或者易挥发的液体,有氨味或鱼腥
HO-N=O + NaCl
亚硝酸
❖脂肪伯胺与HNO2反应生成极不稳定的脂肪重氮盐。
R-NH2
NaNO2 HCl
R
+
N
N Cl-
脂肪重氮盐
N2 ↑ + R+ + Cl-
醇、烯、卤烃等混合物
➢ 该重氮盐即使在低温下也会立即分解放出氮气,并有醇、烯 及卤代烃等混合物的形成。
❖ 芳香伯胺与 HNO2 在低温(一般<5℃)及过量强 酸水溶液中反应生成芳香重氮盐,这个反应称为
从电性效应看,碱性顺序应为: R3N > R2NH > RNH2
2.水的溶剂化效应
H
H
OH
OH
H
+
R NH
H
H O
H
OH H
R+H N
RH
R+ R NH R OH H
H O
H
溶剂化效应越强,氨离子越稳定。
碱性强弱顺序为:伯胺>仲胺>叔胺
3. 空间效应
❖ N 原子上连接的基团越多越大,对 N 上孤对电子的屏蔽作 用越大, N 上孤对电子与 H+ 结合就越难, 碱性就越弱。从空间 效应看碱性顺序为伯胺>仲胺>叔胺
有机化学 第十七章 胺

邻苯二甲酰亚胺氮上的氢受到两个拉电子基团
影响呈现酸性(pKa8. 3),用K0H处理很容易生成相 应的钾盐。
该法除合成伯胺外,还用于合成α-氨基酸(参
阅第二十一章)。
三、硝基化合物还原 通过硝基化合物还原制备胺类是极为重要的方
法,因芳香硝基化合物很容易由芳烃硝化得到,因 此该法主要用于合成芳香伯胺。还原主要有催化氢 化和化学还原两种方式。
二、盖布瑞尔(Gabriel)合成 由卤代烃直接氨解制备伯胺时常会有仲、叔胺
生成,盖布瑞尔[S. Gabriel(1851—1924)出生于 德国,在Berlin大学获博士学位,而后在该校任化 学教授,主要在胺及氨基酸合成方面作出了贡献。] 提供了一个由卤代烃制备纯伯胺的好方法。邻苯二 甲酰亚胺的钾盐与卤代烃发生亲核取代反应,生成 N-取代亚胺后水解或肼解可获得高产率伯胺。
ቤተ መጻሕፍቲ ባይዱ
工业上由油脂水解得到高级脂肪酸(14.4节), 把该酸转化为酰胺,进而脱水生成腈,催化氢化可 得到长链伯胺(参看15. 3节)
2.酰胺还原
酰胺在醚中用LiAlH4处理可把羰基还原为亚甲 基获得较高产率的胺。氮上无取代基的酰胺可得到
伯胺,N-取代酰胺可得到仲、叔胺。
3.肟的还原 醛、酮与羟氨反应生成肟,肟是不饱和含氮化
17.4 胺的化学反应 由于胺中氮上具有孤对电子,使得它能在化学反
应中提供电子,体现了胺的一系列化学性质,如碱性、 亲核反应及氨基致活芳环上的亲电取代反应等。 一、碱性与成盐
1.碱性 按路易斯(Lewis)酸碱概念讲,反应中接受质子 或提供电子对的化合物为碱。由于胺中孤对电子的存 在,能从水中接受质子,故呈碱性。
七、曼尼希(Mannich)反应 具有α氢的酮与甲醛(或其他简单脂肪醛)及
第十章 胺类化合物

溶剂化效应
RN
OH2 OH2 OH2
溶剂化程度高, 碱性
空间效应
R R N R
N连接烃基多,体 积大,碱性
芳香胺由于N原子的孤对电子与苯环形 成共轭体系,使N上的电子云密度降低,因 此其碱性比NH3和脂肪胺要弱得多。
NH2
共轭效应, 碱性
各类胺的碱性强弱顺序:
季铵碱>脂肪仲胺>脂肪伯胺和叔胺>NH3>芳香胺
麻 黄 素
(二)1.酰化反应 可看作是胺分子中氢原子被酰基(酰氯, 酸酐等)取代,产物是N-取代酰胺。由于 叔胺氮上没有氢,不能被酰化。
H ( C H C O ) O 3 2 N H 2 o r C H C O C l 3
O l C H C C 3
N C O C H 3
O
H N ( C H ) 2 5 2 +
O C H 3 C H O H 3 C H 3
乙酰胆碱
C H 3
N H C H C OC 2 2
乙酰胆碱是神经传导介质,具有重要的生理作用。
+
P210
酰胺
(三)与亚硝酸反应 伯胺
R N H 2
N H 2
H N O ( N a N O + H C l ) 2 2
+ N 2(醇、烯、卤代烃 )
混合产物
N a N O + H C l 2
0 ~ 5 ℃
+ N l 2C
常 温
△
O H
N + 2
重氮盐
(三)与亚硝酸反应 仲胺 + HNO2
N-亚硝基胺
( CH CH ) N NO + 3 2 2 N 亚 硝 基 二 乙 胺 NHCH 3+ HNO 2 NCH + 3 NO N 甲 基 N 亚 硝 基 苯 胺
萘胺结构式

萘胺(也叫萘胺醚)是一种有机化学的分子,化学式为C8H11N。
它是一种有机胺类化合物,是一种具有醚基氢的氮甲烷胺,也是一种有机含氮元素的醚甲醇。
萘胺可以被绘制为一个四角形,右边和左边各有一个醚基氢,上面一个氮原子,底部一个碳原子,上面还有两个氢原子。
萘胺的分子结构可以用分子式表示为:O-C-H2-C-H2-C-H-C-H-C-H-C-H-N 萘胺的分子量为121.182 g/mol,其熔点为25 ℃,沸点为169.5 °C。
萘胺是一种沸点较高的碳氢化合物,这使它具有一定的分子稳定性。
它的摩尔折射率为1.5087,它的密度为0.969 g/mL,它的折射率为1.4884。
这些物理性质使它可用于制备各种有机染料、染料衍生物和有机电解质晶体。
萘胺分子是非常脆弱的,它们很容易被强氧元素,比如过氧化物、自由基、氧化还原剂和光照,所分解以获得一系列有机产物,特别是氧化类有机物,它们可以用于制备有机分子材料,拓宽材料应用范围。
咪鲜胺2篇

咪鲜胺2篇咪鲜胺(M-amine),是一种重要的有机化学化合物,属于胺类化合物的一种。
它的化学式为H2N(CH2)3NH2,结构式为NH2(CH2)3NH2,它是胺类化合物中的重要代表之一。
咪鲜胺具有很多重要的物理和化学性质。
首先,它是一种无色、透明、具有强烈氨味的液体。
咪鲜胺具有较高的沸点和相对较低的冰点,常温下为液体状态。
它能溶于水、醇类和醚类溶剂,与大部分有机溶剂也能互溶。
此外,咪鲜胺的水溶液呈碱性。
咪鲜胺是一种重要的有机合成原料。
它作为一种二胺化合物,常用于将其它化合物还原成相应的胺。
咪鲜胺还可以用于制备其他胺类化合物,例如通过与酸反应生成相应的盐类。
此外,咪鲜胺还可以用作银盐制备光敏材料的重要原料。
另外,咪鲜胺也具有一定的生物活性。
研究表明,咪鲜胺对某些细菌、真菌和病毒具有一定的抑制作用。
它在农业上也被广泛应用,例如用于防治农作物病虫害,促进农作物生长等。
咪鲜胺的合成方法有多种途径。
其中一种常用的方法是通过醇胺反应得到咪鲜胺。
具体步骤是首先将醇和胺在催化剂存在下反应,生成相应的醇胺盐,然后通过酸化再生到咪鲜胺。
另外,咪鲜胺也可以通过酰胺的氨解反应得到。
总的来说,咪鲜胺作为一种重要的有机化合物,在化学合成和生物活性研究中发挥着至关重要的作用。
它具有多种物理化学性质和化学反应途径,并且具有一定的生物活性。
随着科学技术的不断进步,咪鲜胺的应用也将会越来越广泛。
在未来,咪鲜胺有可能在医药、农业和材料科学等领域发挥更大的作用。
下面是第二篇:咪鲜胺(M-amine)是一种重要的胺类化合物。
它由两个氨基(NH2)基团通过碳链连接而成。
咪鲜胺呈无色透明液体,具有强烈的氨味。
在常温下,咪鲜胺为液体状态,其沸点较高,冰点较低。
咪鲜胺能溶于水、醇类和醚类溶剂,也能互溶于大部分有机溶剂。
其水溶液呈碱性。
咪鲜胺是一种重要的有机合成原料。
它可用于还原其他化合物成相应的胺。
此外,咪鲜胺还可用于合成其他胺类化合物,通过与酸反应形成相应的盐类。
【有机化学】胺

分子结构中含有碳氮键(C-N)的一类化合物。 广泛分布于自然界中,与日常生活及生命过程密 切相关,在生命科学中占有及其重要的地位 。
1
含氮有机物
硝基化合物 腈
肟 酰胺
胺 Amines 重氮和偶氮化合物 Diazonium Salts & Azo compounds
2
第一节 胺
一、胺的结构、分类和命名 NH3分子中的氢原子被烃基所取代的衍生物。
17
3.与苯磺酰氯反应(兴斯堡反应 Hinsberg )
苯磺酰氯如同酰氯一样能与伯胺、仲胺反应,生 成难溶于水的苯磺酰胺。 苯磺酰氯可用来鉴别伯、仲、叔三种胺。
伯胺所生成的苯磺酰胺
因氮原子上还连一个活 泼的氢原子,它在碱性溶 液中能生成可溶性的盐
叔胺因分子中氮原子 上不连氢原子,所以 与苯磺酰氯不反应
1.5
423.0
3.0
2
329.0
9.0
3
357.0
5.0
5
304.0
3.0
8
286.0
197.0
15
239.0
1842.0
24
286.0
2820.0
24
贮存蔬菜中亚硝酸盐含量的变化(mg/Kg)
贮存时间
亚硝酸盐含量
新鲜
0.00
2天
0.42
4天
1.10
6 天(开始腐烂) 6.70
8 天(完全腐烂) 146.0
H+
R NH2 + HNO2
R OH + H2O + N2
用于伯胺的定量分析 产物复杂,无制备意义
低温条件下,芳香伯胺在强酸性溶液中与亚硝酸 反应,生成芳香重氮盐,该反应称为重氮化反应
第11章 胺

3、Hofmann降解反应(不作要求)
9.2.7 碳酸衍生物(p234) 1.碳酰氯(不作要求) 2.碳酰胺(尿素,脲 ) H2N
O C NH2
有机化学
(1)弱碱性
O H2N C
O R C NH2
药学院化学教研室
尿素具有弱碱性,与硝酸作用生成硝酸脲白色沉淀。
白 白
R R R
(苯磺酰氯) R N SO2
N
Na R N SO2
不反应(可溶于酸) 沉淀溶解
NaOH
不反应(沉淀不溶解)
常用于分离鉴别胺类化合物
有机化学
药学院化学教研室 11. 3. 3 与亚硝酸反应
伯、仲、叔胺与亚硝酸反应的产物不同,可鉴别三种胺。 亚硝酸很不稳定,临用时配制NaNO2+HCl →HNO2+NaCl
重氮盐的结构
药学院化学教研室
芳香族重氮盐具有π-π共轭体系,在低温、强酸 介质中能稳定存在。(比脂肪族重氮盐稳定)
芳香族重氮盐是重要的合成中间体,它的性质活 泼,可以发生取代反应和偶联反应
有机化学
药学院化学教研室 重氮化反应(复习) 芳香族伯胺在低温(0~5℃)和强酸(盐酸或硫酸) 溶液中与亚硝酸钠作用,生成重氮盐的反应称为重 氮化反应 。
O NH2
+
HNO3
O C NH
H2N
O C
C
NH2 . HNO3
白↓
O H2N C NH2
近中性
酸性
碱性
有机化学
(2)水解反应(了解)
药学院化学教研室
尿素在酸、碱、酶的作用下,可以发生水解,生 成氨或二氧化碳。 + + H NH4 + C O 2
有机化学-第十一章考点

(CH3)4N+Cl– 氯化四甲铵
(CH3)3N+CH2CH3Cl– 氯化三甲基乙基铵
三、胺的化学性质
能接受质子,显碱性
1、胺的碱性
N
R
R'' R'
接受H+
R-NH2 + HCl RN+H3Cl- + NaOH
RN+H3Cl- (胺的鉴定) R-NH2 + NaCl+ H 2O(胺的提纯)
综合烷基的给电子诱导效应和空间位阻效应: 脂肪胺碱性排序:仲胺>伯胺>叔胺
7、写出由苯为原料制备氯化重氮苯的各步反应试剂、反应条件及产物;以及氯化重氮苯 中重氮基分别被-Cl、-CN、-OH、-H取代的反应试剂、反应条件及产物。根据这些总
8、写出氯化重氮苯发生偶联反应的反应试剂、反应条件及产物;偶联产物如何命名?根 据这些总结完成课后习题2(8);3(10);7(6); 第二节 酰胺
Br
NH 2
NH 2
Br
Br
N2Cl
Br
Br
Br
Br
Br2/CCl4
NaNO2/HCl
<5℃
Br
H3PO2
Br
H2O
Br
白色
苯胺 的鉴定
重氮盐的偶联反应
N2Cl +
有机化学第十七章_胺

NO2 NH4SH
NO2 (还原一个硝基)
选择性还原
NO2
NO2 Zn 2 NaOH 氢化偶氮苯 NH NH
NH2
碱性还原:双分 碱性还原: 子偶联
•联苯胺重排: 联苯胺重排: 联苯胺重排 氢化偶氮苯在酸催化下, 二氨基联苯的反应。 氢化偶氮苯在酸催化下 生成 4,4-二氨基联苯的反应。 二氨基联苯的反应
N(CH3)2 Br
NCH3
HBr OH-
CrO3-
TM
用苯及不超过三个碳的有机物合成: 例:用苯及不超过三个碳的有机物合成: 用苯及不超过三个碳的有机物合成
3-(N-乙氨基 庚烷 乙氨基)庚烷 乙氨基
O NH
3-甲基 甲基-2-(N-甲氨基 戊烷 甲氨基)戊烷 甲基 甲氨基
O H2N COC2H5
CH3CCH2CCH3
4-亚氨基 戊酮 亚氨基-2-戊酮 亚氨基 [季铵化合物 季铵化合物] 季铵化合物
对氨基苯甲酸乙酯
将负离子和取代基的名称放在“ 将负离子和取代基的名称放在“铵”字前
第十七章 胺
本章目录
分类、 第一节 分类、结构和命名 第二节 物理性质和波谱性质 第三节 胺的制备 第四节 胺的化学反应 第五节 重氮化反应和重氮盐
分类、 第一节 分类、结构与命名
一、分类
NH3 氨 RNH2 1o胺 R2NH 2o胺 R3N 3o胺 R4N+X季铵盐 R4N+OH季铵碱
季铵化合物: 季铵化合物:氮原子上连有四个烃基的衍生物 氨基: 氨基:-NH2 ; 亚氨基: 亚氨基:-NH-
肟的还原(催化氢化、LiAlH4,Zn/HCl等) 肟的还原(催化氢化、 等
NOH Na, C2H5OH or LiAlH4 NH2
有机化学--胺及其衍生物

H R-+N-H
H
H OH
H OH
H OH
综合上述各种因素, 在水溶液中,胺的碱性强弱次序为:
脂肪胺(2°&的碱性强弱次序为: 3°> 2°> 1°
(4)芳香胺碱性强弱的分析
首先考虑N上的孤电子对,能不能与苯环 共轭,能共轭,碱性弱,不能共轭,碱性强。
HH ON O
2 胺的碱性
(1)产生碱性的原因: N上的孤对电子
(2)判别碱性的方法: 碱的pKb;其共轭酸的pKa; 形成铵正离子的稳定性。
(3)影响碱性强弱的因素: 电子效应:3o胺 > 2o胺 > 1o胺 空间效应:1o胺 > 2o胺 > 3o胺 溶剂化效应:NH3 > 1o胺 > 2o胺 > 3o胺
溶剂化效应是给电子的,N上的H越多, 溶剂化效应越大,形成的铵正离子就越稳定。 不同溶剂的溶剂化效应是不同的。
利用邻苯二甲酰亚胺的烷基化来制备一级胺,称为盖 布瑞尔合成法。(空阻大的RX不能发生此反应)
O O NH3
O
O
KOH
NH C2H5OH O
O R-X
N-K+
THF orDMF
O
O NR
O
H+ or OHH2O or ROH
NH2-NH2 C2H5OH
COOH
+ RNH2
COOH
O
NH NH
+ RNH2
O CH2N(CH3)2
85% Mannich碱
OH
+ CH2 O + HN(CH3)2
1. HCl, EtOH 2. OH-
CH3
OH CH2N(CH3)2 (CH3)2NCH2 +
有机化学中的胺与胺衍生物

有机化学中的胺与胺衍生物胺和胺衍生物在有机化学中扮演着重要的角色。
胺是指含有一个或多个氨基(-NH2)官能团的有机物,而胺衍生物则是由胺基官能团和其他官能团组成的化合物。
1. 胺的分类胺可以分为三类:一级胺、二级胺和三级胺。
一级胺是指含有一个氨基和两个有机基团的化合物;二级胺含有两个氨基和一个有机基团;三级胺含有三个氨基和没有氢原子的有机基团。
2. 胺的制备胺的制备方法主要有两种:一是通过氨和卤代烷类发生取代反应制备;二是通过亲核取代反应合成。
此外,还可以通过胺的重排反应或通过还原醛、酮和酸的亲核加成来制备胺。
3. 胺的物化性质胺具有氨的性质,可形成氮氢键,以及独特的碱性。
一级胺和二级胺可形成氮氢键,而三级胺则不具有此性质。
胺还可与酸反应生成相应的盐。
4. 胺的化学反应胺在有机化学反应中表现出多种多样的特性。
例如,胺能够与醛、酮等羰基化合物进行亲核加成反应,生成相应的胺衍生物。
此外,胺还可参与亲电取代、烃化等反应。
5. 胺衍生物的应用胺衍生物在药物合成、染料制备、农药研发等领域具有重要的应用价值。
许多药物中都含有胺基结构,例如氨基酸、生物碱等。
胺衍生物还用于合成有机染料,其中许多染料颜料的颜色来源于胺基基团。
农药中也存在许多胺衍生物,用于控制害虫和病虫害。
6. 胺的重要性胺及其衍生物在有机化学中具有重要的地位。
它们不仅可以作为反应底物,还可以作为反应催化剂或配体参与各种重要有机合成反应。
胺也是许多重要化学品和生物分子的构建块,对于我们理解生命的基本单位和化学反应机理至关重要。
综上所述,胺及其衍生物在有机化学中扮演着不可忽视的角色。
它们的分类、制备方法、物化性质、化学反应和应用都具有一定的特点和重要性。
深入了解和研究胺的性质和反应机理对于推动有机化学的发展和应用具有重要意义。
