PCR产物胶回收实验
1.4 胶回收PCR产物(纯化)

一、目的基因的扩增
(四)、PCR产物的提纯
实验目的:
回收得到纯的目的DNA,去除影响DNA连接酶活性的物质及其它DNA片段。
纯化产物用于酶切和连接反应。
主要实验仪器:
冰箱,为试剂、样品或菌种提供冷冻、冷藏的保存环境制冰机,用于制备碎冰块
微量移液器,用于吸取微量试剂及样品
超净工作台,提供无菌工作台面
常温离心机,用于样品的常温离心分离
核酸电泳仪,用于核酸的电泳分离分析
主要实验室剂:
酚/氯仿/异戊醇、无水乙醇、70%乙醇、TE。
实验步骤:
将PCR反应液转入1.5ml离心管中,加入50ulTE和100ul 酚/氯仿/异戊醇,盖好离心管盖子,上下颠倒混匀。
将管置于离心机中,12000rpm离心5min。
取上清,加入1/10体积3mol醋酸钠和2.5倍体积预冷的无水乙醇,上下颠倒混匀,室温放置20min沉淀DNA。
将管置于离心机中,12000rpm离心10min。
离心后现象:(图片)。
弃上清,加入1ml70%乙醇,12000rpm离心5min。
离心后现象:(图片)。
弃上清。
将管口打开,倒置于纸巾上数秒,使液体尽可能流尽,再平放于纸巾上室温干燥10min。
加30ulTE溶解沉淀,取5ul样品跑电泳。
电泳图谱为:(图片)。
确认回收到PCR产物后,剩余样品置于-20℃冰箱中备用,用于酶切。
END。
PCR-RFLP实验设计经典方案(1)

【思考题】 1、如何有效提高凝胶纯化PCR产物的效率?
实验六 PCR产物的胶回收分离纯化
满朝来
哈尔滨师范大学生命科学与技术学院 生化与分子生物学教研室
一、实验目的
1、了解分离纯化DNA片段中的污染物方法和原理。
2、掌握PCБайду номын сангаас产物纯化的实验技术,为后续的连接 反应和转化反应打下良好的基础。
二、实验原理
首先利用低熔点琼脂糖凝胶电泳DNA片段, 分离目的条带DNA,然后紫外光下切割含目 的DNA条带的胶块,利用胶回收试剂盒回收 纯化DNA片段。试剂盒的胶回收柱采用特殊 硅基质材料在一定的高盐缓冲系统下高效、 专一地吸附DNA、RNA的原理,配备设计独 特的离心吸附柱式结构,使用常规台式高速 离心机,在几分钟之内即可以高效回收核酸 片段。
【仪器与试剂】 一、实验仪器 1、琼脂糖凝胶电泳系统 2、紫外观察分析仪 3、离心机 4、单面刀片 5、恒温水浴锅
二、试剂
1、 DNA回收试剂盒 2、50×TAE 3、ddH2O
三、实验步骤
1)在紫外灯下切分含DNA的琼脂糖块,尽可能除去多余的琼脂糖.放入1.5ml 离心管中。 2) 按每100mg琼脂糖加入300—600μl 溶胶液的比例加入溶胶液(本实验加 500ul),置55℃水浴10分钟,使琼脂糖块完全溶化,期间每2分钟颠例混匀一 次促溶。 3)将溶化后的琼脂糖液移入吸附柱,12000rpm 室温离心1分钟,倒掉收集管 中的液体.再将吸附柱放入同一个收集管中。 4)在吸附杜中加入500uI漂洗液,室温静置1分钟后, 12000rpm 室温离心30 秒,倒掉收集管中的液体,将吸附柱放入同一个收集管中。 5)再在吸附柱中加入500uI漂洗液, 12000rpm 室温离心15秒,倒掉收集管中 的液体,将吸附柱放入同一个收集管中。 6) 12000rpm 室温空离心1分钟。 7)将吸附柱放入一个干净的1.5ml的离心管中,在吸附膜中央加入30ul洗脱缓 冲液,室温静置2分钟后, 12000rpm 室温离心1分钟(为提高回收效率可再洗 脱一次),将1.5ml离心管(DNA)贮存于-20℃。 8)琼脂糖凝胶电泳检测回收产物。
胶回收

1. 使用TAE缓冲液或TBE缓冲液制作琼脂糖凝胶,然后对目的DNA进行琼脂糖凝胶电泳。
2. 在紫外灯下切出含有目的DNA的琼脂糖凝胶,用纸巾吸尽凝胶表面的液体。
此时应注意尽量切除不含目的DNA部分的凝胶,尽量减小凝胶体积,提高DNA回收率。
注)切胶时请注意不要将DNA长时间暴露于紫外灯下,以防止DNA损伤。
3. 切碎胶块。
胶块切碎后可以加快操作步骤6的胶块融化时间,提高DNA的回收率。
4. 称量胶块重量,计算胶块体积。
计算胶块体积时,以1 mg=1 ul进行计算。
5. 向胶块中加入胶块融化液DR-I Buffer。
DR-I Buffer的加量如下表: 6. 均匀混合后75℃加热融化胶块(低熔点琼脂糖凝胶只需在45℃加热)。
此时应间断振荡混合,使胶块充分融化(约6~10分钟)。
注)胶块一定要充分融化,否则将会严重影响DNA的回收率。
7. 向上述胶块融化液中加入DR-I Buffer量的1/2体积量的DR-II Buffer,均匀混合。
当分离小于400 bp的DNA片段时,应在此溶液中再加入终浓度为20%的异丙醇。
8. 将试剂盒中的Spin Column安置于Collection Tube上。
9. 将上述操作7的溶液转移至Spin Column中,12,000 rpm离心1分钟,弃滤液。
注)如将滤液再加入Spin Column中离心一次,可以提高DNA的回收率。
10. 将500 ul的Rinse A加入Spin Column中,12,000 rpm离心30秒,弃滤液。
11. 将700 ul的Rinse B加入Spin Column中,12,000 rpm离心30秒,弃滤液。
12. 重复操作步骤11。
13. 将Spin Column安置于新的1.5 ml的离心管上,在Spin Column 膜的中央处加入25 ul 的灭菌蒸馏水或Elution Buffer,室温静置1分钟。
注)把灭菌蒸馏水或Elution Buffer加热至60℃使用时有利于提高洗脱效率。
PCR产物的克隆(DNA的胶回收和连接)技术方案及实验原理

PCR产物的克隆(DNA的胶回收和连接)技术方案及实验原理【实验原理】1.DNA片段回收方法:DNA片段在适当浓度的琼脂糖凝胶中,通上一定电压进行电泳,不同大小的DNA分子由于迁移率的不同而分离开。
切下带有所需DNA 片段的凝胶,用冻融法、玻璃奶回收法或商品化胶回收试剂盒将目的片段回收纯化。
2.利用Taq酶能够在PCR产物的3’末端加上一个非模板依赖的A,而T载体是一种带有3’T突出端的载体,在连接酶作用下,可以把PCR产物插入到质粒载体的多克隆位点,可用于PCR产物的克隆和测序。
商品化的T载体有很多。
本实验采用TaKaRa公司的pMDTM18-T Simple Vector。
这个载体以pUC19载体为基础,消除了pUC18载体上的多克隆酶切位点,经EcoRⅤ酶切后在两侧的3'端添上“T”制备而成(见附录1)。
由于本载体上消除了多克隆酶切位点,克隆后的PCR产物将无法使用载体上的限制酶切下,需要在PCR扩增引物上导入合适的酶切位点。
【试剂与器材】(一)试剂1.pMDTM18-T Simple Vector Kit(Takara公司)。
2.TAE电泳缓冲液3.琼脂糖(Agarose)4.6×电泳加样缓冲液:0.25%溴粉蓝,40%(w/v) 蔗糖水溶液,贮存于4℃。
2 / 95.溴化乙锭(EB)溶液母液:配制成10mg/mL,用铝箔或黑纸包裹容器,储于室温即可。
6.70%乙醇7.胶回收试剂盒(Omega公司)(二)器材水平式电泳装置,电泳仪,台式高速离心机, 恒温水浴锅, 微量移液枪, 微波炉或电炉,紫外透射仪, 凝胶成像系统或其它照相设备。
【操作方法】(一)胶回收试剂盒回收PCR产物(以Omega公司Gel Extraction Kit为例)1.当目的片段DNA完全分离时,转移凝胶至紫外灯上尽可能快地切下目的片段。
2.凝胶块转移至1.5ml离心管(离心管已经称重了)中,称重得出凝胶块的重量。
pcr切胶回收的步骤

pcr切胶回收的步骤
PCR切胶回收呀,这可是个很有趣的小实验呢。
先说说准备工作吧。
你得有已经跑过PCR并且经过琼脂糖凝胶电泳的胶块哦。
然后呢,把要用的工具都准备好,像干净的刀片啦,还有专门的切胶回收试剂盒。
开始切胶啦。
在紫外灯下看胶块的时候,就像寻宝一样呢。
找到你要的那条DNA 条带,然后用刀片小心翼翼地把它周围的胶切下来。
可别切太大块啦,不然会有好多杂质的。
切的时候就像在给小宝贝做精细的手术一样,要很小心哦。
切好胶之后,就按照试剂盒的说明来操作啦。
一般是把切下来的胶放到一个离心管里,然后加入一些溶液,让胶融化。
这时候你就看着胶慢慢变成液体,感觉就像魔法一样呢。
接着呢,要把融化后的液体加到吸附柱里。
这个吸附柱就像一个小卫士,专门把DNA吸附住,而那些杂质就被留在外面啦。
把液体加进去之后,离心一下,就像坐小过山车一样,让液体在离心力的作用下快速通过吸附柱。
然后呢,要清洗一下吸附柱。
这一步就像是给小卫士洗个澡,把它身上可能残留的杂质都洗干净。
再离心一下,把清洗的液体甩掉。
最后就是把我们想要的DNA从吸附柱上洗脱下来啦。
加入洗脱液,再离心,这个时候我们的DNA就乖乖地跑到洗脱液里啦。
就像把小宝贝从保护它的小房子里接出来一样。
这样,PCR切胶回收就完成啦。
虽然过程有点小复杂,但是只要按照步骤来,就可以得到我们想要的纯净的DNA啦。
每次做这个实验都感觉像是在和小小的DNA分子玩一场有趣的游戏呢。
PCR产物的TA克隆(DNA的胶回收和连接) PCR实验技术

PCR产物的TA克隆(DNA的胶回收和连接)
【实验原理】
1.DNA片段回收方法:DNA片段在适当浓度的琼脂糖凝胶中,通上一定电压进行电泳,不同大小的DNA分子由于迁移率的不同而分离开。
切下带有所需DNA片段的凝胶,用冻融法、玻璃奶回收法或商品化胶回收试剂盒将目的片段回收纯化。
2.利用Taq酶能够在PCR产物的3’末端加上一个非模板依赖的A,而T载体是一种带有3’T突出端的载体,在连接酶作用下,可以把PCR产物插入到质粒载体的多克隆位点,可用于PCR产物的克隆和测序。
商品化的T载体有很多。
本实验采用TaKaRa公司的pMDTM18-T Simple Vector。
这个载体以pUC19载体为基础,消除了pUC18载体上的多克隆酶切位点,经EcoRⅤ酶切后在两侧的3'端添上“T”制备而成(见附录1)。
由于本载体上消除了多克隆酶切位点,克隆后的PCR产物将无法使用载体上的限制酶切下,需要在PCR扩增引物上导入合适的酶切位点。
【试剂与器材】
(一)试剂
1.pMDTM18-T Simple Vector Kit(Takara公司)。
2.TAE电泳缓冲液
3.琼脂糖(Agarose)
4.6×电泳加样缓冲液:0.25%溴粉蓝,40%(w/v) 蔗糖水溶液,贮存于4℃。
1 / 9。
胶回收攻略

胶回收攻略一、这个回收小片断,我还比较在行,我以前的片断只有100bp市售的试剂盒常常有小片断回收效率很低的问题。
PCR产物经过酶切、回收等步骤后,损失太大。
进入连接反应的PCR片断量太小常常是试验失败的原因。
我的做法是,简化步骤、减少核酸在处理过程中的损失,让较多量的PCR产物和质粒片断进入酶连反应——以量取胜。
我的做法是很粗放型的,但是成功率很高。
如果愿意,你可以试试。
大致的做法是:制作100微升PCR产物;酒精沉淀回收PCR产物;PCR产物及载体酶切;跑回收胶;将回收胶上的PCR产物和载体片断切下,回收到一个试管中;冰冻、碎胶,酚、氯仿抽提,酒精沉淀;加入8微升水、1微升连接酶和1微升连接buffer,4度过夜;转化涂板。
具体的操作:PCR产物回收1. 制备100μL PCR产物。
2. 将100μL PCR产物加入一1.5mL离心管中,再加入400μL双蒸水,颠倒混匀。
加入 900μL 预冷无水乙醇、20μL 3M的醋酸钠。
颠倒数次混匀。
(提示本方法使用的醋酸钠量较小,但足够沉淀核酸,并且无需洗盐。
)3. 4℃静置30分钟,以利于核酸沉淀。
4. 12000rpm 4℃离心15分钟,沉淀核酸。
5. 弃上清,将离心管倒置于干净吸水纸巾上5分钟。
室温下吹风干燥。
(提示可将试管至于超净台吹风干燥。
如果管底有较多液体聚集,可盖好管盖后,轻弹管底数次,将液体分散挂在管壁上,再打开管盖吹风。
)酶切直接在回收PCR产物的试管中配置酶切体系:PCR产物酶切-制作插入片断10×Buffer 6μLSal I 5μLPCR产物——双蒸水 49μL合计 60μL要将PCR产物接入的质粒载体A,取A质粒(小提的质粒即可)3μL进行酶切。
A质粒酶切-制作载体片断10×Buffer 3μLSal I 1μL质粒 3μL双蒸水 23μL合计 30μL混匀。
37℃,酶切3小时。
1%琼脂糖回收胶回收(碎胶、酚氯仿抽提法)1. 酶切产物加入10%量的上样Buffer,混匀。
PCR产物胶回收实验
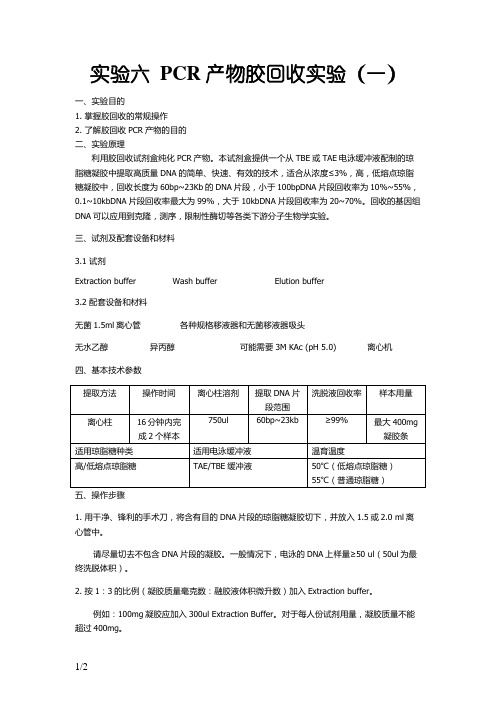
实验六 PCR产物胶回收实验(一)一、实验目的1. 掌握胶回收的常规操作2. 了解胶回收PCR产物的目的二、实验原理利用胶回收试剂盒纯化PCR产物。
本试剂盒提供一个从TBE或TAE电泳缓冲液配制的琼脂糖凝胶中提取高质量DNA的简单、快速、有效的技术,适合从浓度≤3%,高,低熔点琼脂糖凝胶中,回收长度为60bp~23Kb的DNA片段,小于100bpDNA片段回收率为10%~55%,0.1~10kbDNA片段回收率最大为99%,大于10kbDNA片段回收率为20~70%。
回收的基因组DNA可以应用到克隆,测序,限制性酶切等各类下游分子生物学实验。
三、试剂及配套设备和材料3.1 试剂Extraction buffer Wash buffer Elution buffer3.2 配套设备和材料无菌1.5ml离心管各种规格移液器和无菌移液器吸头无水乙醇异丙醇可能需要3M KAc (pH 5.0) 离心机四、基本技术参数1. 用干净、锋利的手术刀,将含有目的DNA片段的琼脂糖凝胶切下,并放入1.5或2.0 ml离心管中。
请尽量切去不包含DNA片段的凝胶。
一般情况下,电泳的DNA上样量≥50 ul(50ul为最终洗脱体积)。
2. 按1:3的比例(凝胶质量毫克数:融胶液体积微升数)加入Extraction buffer。
例如:100mg凝胶应加入300ul Extraction Buffer。
对于每人份试剂用量,凝胶质量不能超过400mg。
3. 于恒温水浴或金属浴中50℃温育,直到凝胶融化。
一般温育时间为10分钟,温育过程中没隔23分钟混匀一次。
如果温育后,混合液体颜色变紫,请加入10 ul 3M KAc (pH 5.0),使混合液颜色变回黄色。
4. 可选:按1:1的比例(凝胶质量毫克数:异丙醇体积微升数)加入异丙醇,并混合均匀。
如DNA片段大于500bp/小于4kb,不需要加异丙醇。
5. 将混合液全部转移到Spin column内,于6,000g离心1分钟,并弃去接液管内液体。
质粒或PCR酶切产物切胶回收

质粒或PCR酶切产物切胶回收实验材料实验耗材:枪头(10μl、200μl、1ml)、EP管(200μl、1ml)试剂:普通琼脂糖凝胶DNA回收试剂盒(天根)、ddH2O准备工作:50˚C加热块、质粒或PCR酶切产物、PCR产物实验操作步骤:使用前请先在漂洗液PW中加入无水乙醇。
1. 柱平衡步骤:向吸附柱CA2中(吸附柱放入收集管中)加入500 μl平衡液BL,12,000 rpm (~13,400×g )离心1 min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
(请使用当天处理过的柱子)2. 将单一的目的DNA条带从琼脂糖凝胶中切下(尽量切除多余部分)放入干净的离心管中,称取重量。
3. 向胶块中加入等倍体积溶液PN(如果凝胶重为0.1 g,其体积可视为100 µl,则加入100 µl PN溶液),50℃水浴放置,其间不断温和地上下翻转离心管,以确保胶块充分溶解。
如果还有未溶的胶块,可继续放置几分钟或再补加一些溶胶液,直至胶块完全溶解(若胶块的体积过大,可事先将胶块切成碎块)。
注意:对于回收<300bp的小片段可在加入PN完全溶胶后再加入1/2胶块体积的异丙醇以提高回收率;胶块完全溶解后最好将溶液温度降至室温再上柱,因为吸附柱在室温时结合DNA的能力较强。
4. 将上一步所得溶液加入一个吸附柱CA2中(吸附柱放入收集管中),室温放置2 min,12,000 rpm (~13,400×g )离心30-60 sec,倒掉收集管中的废液,将吸附柱CA2放入收集管中。
注意:吸附柱容积为800 μl,若样品体积大于800 μl可分批加入。
5. 向吸附柱CA2中加入600 μl漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000 rpm (~13,400×g )离心30-60 sec,倒掉收集管中的废液,将吸附柱CA2放入收集管中。
注意:如果回收的DNA是用于盐敏感的实验,例如平末端连接实验或直接测序,建议PW 加入后静置2-5 min再离心。
实验三PCR产物回收检测

实验三PCR产物电泳回收检测(D2500-01型号)1..琼脂糖凝胶电泳分离DNA片段,推荐使用新鲜的TAE/TBE Buffer和新配制的胶。
2.片段完全分离后,在紫外灯下迅速切取所需条带,DNA在紫外灯下爆光时间不超过30s。
3.称取凝胶块的重量,按照每1g凝胶加入1ml Binding Buffer对应量,加入适量体积的Binding Buffer,55-60℃水浴至凝胶完全溶解(约7-10min)。
每隔2-3min振荡一次。
注意:当Binding Buffer完全溶解凝胶后,请注意溶液颜色的变化。
如果溶液颜色已经变成紫色或红色,必须加入5ul 5M NaAc, pH 5.2至溶液中调整pH值。
4.把HiBind DNA 柱子套在2ml收集管。
5.将DNA/凝胶混合液转移至套在2ml收集管的HiBind DNA柱子中,10,000xg离心1min。
6.倒去滤液,把柱子装回收集管中。
HiBind柱一次能装700ul溶液,若混合液超过700ul,每次转移700ul至柱子中,然后重复5-6步骤。
7.把柱子重新装回收集管,加入300ul Binding Buffer,按上述条件离心,弃去滤液。
8.把柱子重新装回收集管,加入700ul SPW Wash Buffer,按上述条件离心,弃去滤液。
注意:使用前SPW Wash Buffer必须用无水乙醇稀释。
9.(可选)重复步骤8一次。
10.弃去滤液,把柱子重新装回收集管,13,000xg离心空柱2min以甩干柱子基质。
11.把柱子装在干净的1.5ml离心管上,加入30ul 65℃预热的Elution Buffer到柱子基质上,室温静置2min。
≥13,000xg离心2 min洗脱出DNA。
PCR产物胶回收实验

PCR产物胶回收实验引言:PCR(聚合酶链式反应)是一种用于扩增DNA片段的常用技术。
在PCR实验中,扩增产物通常需要从琼脂糖凝胶上回收和纯化,以便进一步的分析和应用。
本文将介绍一种PCR产物胶回收的实验方法。
实验材料:1. 扩增产物:经过PCR扩增得到的DNA片段。
2. 琼脂糖凝胶:用于扩增产物分离和纯化。
3. 胶回收缓冲液:用于胶回收的缓冲液。
4. 真空浓缩仪:用于回收DNA片段。
5. 无菌纯水:用于制备实验溶液。
6. DNA电泳仪:用于检测和分析PCR产物。
实验步骤:1. 准备琼脂糖凝胶:a. 根据实验需要,制备适合的琼脂糖凝胶。
b. 加入适量的琼脂糖凝胶染料(如安全染料)。
2. 进行PCR扩增:a. 根据所需扩增片段的序列,设计引物,并合成引物。
b. 准备PCR反应体系,包括DNA模板、引物、Taq DNA聚合酶等。
c. 进行PCR扩增反应。
3. 分析PCR产物:a. 用电泳法将PCR产物与DNA标准品一同进行电泳。
b. 根据需要,记录PCR产物的迁移距离和片段大小。
4. 准备胶回收缓冲液:a. 根据实验所需,制备合适的胶回收缓冲液。
5. 胶回收:a. 使用刮胶刀将PCR产物切下,放入离心管中。
b. 添加足够的胶回收缓冲液,使产物完全浸没其中。
c. 低温热激活离心管以使产物与缓冲液充分混合。
d. 放入离心机中离心,以使产物完全沉积到离心管底部。
6. 剔除上清:a. 使用吸走器小心地吸取上清,避免吸取产物。
b. 检查离心管底部是否完全干燥,如有残余液体则继续吸取。
7. 回收DNA片段:a. 加入适量的无菌纯水,以溶解和洗涤DNA片段。
b. 用手轻轻摇晃离心管,使DNA片段溶于水中。
c. 使用真空浓缩仪,将溶解的DNA片段浓缩至所需浓度。
8. 分析纯化后的PCR产物:a. 用电泳法将纯化后的PCR产物与DNA标准品一同进行电泳。
b. 检查PCR产物的迁移距离并与之前的分析结果进行比较。
结论:通过PCR产物胶回收实验,我们成功地从琼脂糖凝胶中回收和纯化了PCR扩增的DNA片段。
pcr产物纯化回收跑胶试验结果分析

pcr产物纯化回收跑胶试验结果分析PCR产物的回收(玻璃奶吸附法)SYBR会使DNA部分显出绿色荧光,在紫外灯下辨认绿色荧光,可将胶切下。
实验结果及分析本次试验中,在最后一步检测中看到了荧光,说明了DNA的存在,证明回收到了PCR的产物PCR产物的直接纯化:一、原理PCR产物一般都含有过量的引物、Taq DNA酶及dNTP,这些成分的存在将直接影响到后续的酶切、双脱氧PCR测序反应等过程,因此有必要除去。
目前核酸纯化的方法有很多,商用化试剂盒的出现使得DNA的纯化过程变得更加简便快捷。
本实验中, Buffer PCR-A促使大于100bp 的DNA片段选择性地吸附到 silica膜上。
经 Buffer W. BufferW2洗涤去除残留在sica膜上的小于50-mer的引物、酶蛋白、单核苷酸、荧光染料或放射性同位素标记的单核苷酸后,吸附到sica膜上的DNA片段经微量水或 Eluent洗脱下来,即可用于各种分子生物学的操作。
二、材料与方法1、材料PCR产物2、仪器、用具恒温孵育器(65C)、离心机、移液器、1.5ml离心管3、试剂Buffer_PCR -A Buffer w1;已加无水乙醇的 Buffer V2 Eluent或去离子水4、方法(1)在PCR反应液中加入3倍体积的Buffer PCR-A若需加入的BufferPCR-A不足100ul,则加入100ul。
(2)将DNA --prep Tube置于2 -ml Microfuge Tube中,将步骤(1)中的混合液移入DNA -prep Tube I中,5500rpm离心1min。
(3)弃滤液,将DNA -prep Tube置回到原2 -ml Microfuge Tube 中,加入500 ul Bufer W1,5500rpm离心1min。
(4)弃滤液,将DNA -prep Tube置回到原2 -ml Microfuge Tube 中,加入700山已加无水乙醇的 Buffer V2,5500rpm离心1min,以同样的方法再用700山己加无水乙醇的 Buffer\2洗涤一次。
PCR产物的胶回收分离纯化

PCR产物的胶回收分离纯化一、实验仪器1、琼脂糖凝胶电泳系统2、紫外观察分析仪3、离心机4、单面刀片5、恒温水浴锅二、试剂1、DNA回收试剂盒2、50×TAE3、ddH2O三、步骤1 在紫外灯下切分含DNA的琼脂糖块,尽可能除去多余的琼脂糖.放入1.5ml离心管中。
4. 称量胶块重量,计算胶块体积。
计算胶块体积时,以1 mg=1 μl 进行计算。
5. 向胶块中加入胶块融化液DR-I Buffer,DR-I Buffer 的加量如下表:凝胶浓度DR-I Buffer 使用量1.0% 3 个凝胶体积量1.0%~1.5% 4 个凝胶体积量1.5%~2.0% 5 个凝胶体积量6. 均匀混合后75℃加热融化胶块(低熔点琼脂糖凝胶只需在45℃加热)。
此时应间断振荡混合,使胶块充分融化(约6~10 分钟)。
注)胶块一定要充分融化,否则将会严重影响DNA 的回收率。
7. 向上述胶块融化液中加入DR-I Buffer量的1/2体积量的DR-II Buffer,均匀混合。
当分离小于400 bp 的DNA 片段时,应在此溶液中再加入终浓度为20% 的异丙醇。
8. 将试剂盒中的Spin Column 安置于Collection Tube 上。
9. 将上述操作7 的溶液转移至Spin Column 中,12,000 rpm 离心 1 分钟,弃滤液。
注)如将滤液再加入Spin Column 中离心一次,可以提高DNA 的回收率。
10. 将500 μl的漂洗液Rinse A加入Spin Column中,12,000 rpm 离心30 秒钟,弃滤液。
11. 将700 μl的Rinse B加入Spin Column中,12,000 rpm 离心30 秒钟,弃滤液。
注)请确认Rinse B中已经加入了指定体积的100%乙醇。
12. 重复操作步骤11。
13. 将Spin Column 安置于新的1.5 ml 的离心管上,在Spin Column 膜的中央处加入25 μl 的灭菌蒸馏水或Elution Buffer,室温静置 1 分钟。
pcr产物回收原理

pcr产物回收原理PCR产物回收原理。
PCR(聚合酶链式反应)是一种用于扩增DNA片段的技术,它是分子生物学领域中非常重要的工具。
在PCR过程中,产生了大量的PCR产物,而回收这些产物对于后续的实验和分析非常重要。
本文将介绍PCR产物回收的原理及方法。
PCR产物回收的原理主要包括DNA片段的寡聚物纯化和DNA片段的凝胶回收两个方面。
首先,DNA片段的寡聚物纯化是指通过将PCR产物与寡聚物结合,然后利用寡聚物的亲和性将DNA片段纯化出来。
这种方法可以有效地去除PCR反应体系中的盐离子、引物和聚合酶等杂质,从而得到纯净的DNA片段。
其次,DNA片段的凝胶回收是指将PCR产物通过琼脂糖凝胶电泳分离出来,然后通过切割凝胶并使用凝胶回收试剂盒将DNA片段从凝胶中提取出来。
这种方法可以根据DNA片段的大小选择性地回收目标片段,从而得到所需的DNA片段。
在实际操作中,可以根据实验需求选择合适的回收方法。
下面将介绍两种常用的PCR产物回收方法。
首先是寡聚物纯化法。
这种方法通常使用商业化的DNA寡聚物纯化试剂盒,通过将PCR产物与寡聚物结合,然后通过洗涤步骤将DNA片段从其他杂质中分离出来。
这种方法操作简单,纯化效果好,适用于小规模的PCR产物回收。
其次是凝胶回收法。
这种方法通常需要进行琼脂糖凝胶电泳,将PCR产物按照大小分离出来,然后通过切割凝胶并使用凝胶回收试剂盒将DNA片段从凝胶中提取出来。
这种方法适用于需要回收多个目标片段或者需要大量PCR产物的情况。
总的来说,PCR产物回收是PCR技术中非常重要的一步,它直接影响到后续实验的结果和分析。
选择合适的回收方法并严格按照操作步骤进行操作,可以有效地得到纯净的DNA片段,为后续的实验和分析奠定基础。
在实际操作中,需要注意操作规范,避免污染和损失,保证回收的PCR产物质量和数量。
同时,根据实验需求选择合适的回收方法,并结合实际情况进行操作,可以提高PCR产物回收的效率和质量。
DNA片段的胶回收

DNA片段的胶回收
PCR或酶切产物经1%琼脂糖凝胶电泳,用胶回收试剂盒回收目的片段。
操作步骤:
(1)向吸附柱CB2加入500μL平衡液BL,12000rmp离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中;
(2)将目的DNA条带从琼脂糖凝胶中切下放入干净的离心管中,称取重量;
(3)向胶块中加入等倍体积溶液PC(如果凝胶重0.1g,其体积可视为100μL,则能加入100μLPC溶液),50℃水浴放置10min左右,确保胶块充分溶解;
(4)将上一步所得溶液加入吸附柱CB2中,12000rmp离心1min,倒掉收集管中的废液,将吸附柱CB2放入收集管中;
(5)向吸附柱CB2中加入600μL漂洗液PW,12000rmp离心1min,倒掉收集管中的废液,将吸附柱CB2放入收集管中;
(6)向吸附柱CB2中加入600μl漂洗液PW,12000rmp离心1min,倒掉收集管中的废液;
(7)将吸附柱CB2放入收集管中,12000rmp离心2min,尽量除去漂洗液,吸附柱置于室温放置数分钟,彻底晾干;
(8)将吸附柱CB2放入干净的离心管中,向吸附膜中间位置悬空滴加适量的洗脱缓冲液EB,室温放置2min,12000rmp离心2min,收集DNA溶液。
PCR反应及PCR产物的鉴定、回收与载体连接

分子生物学实验报告实验名称:PCR反应及PCR产物的鉴定、回收与载体连接班级:生工xx姓名:xxx学号:xxxx日期:xxxPCR反应及PCR产物的鉴定、回收与载体连接1 引言聚合酶链式反应(polymerase chain reaction,PCR)是体外酶促合成特异DNA片断的一种技术。
由于这种方法高效、敏感、特异性高[1],因而在分子生物学、基因工程研究以及对遗传病、传染病和恶性肿瘤等基因诊断和研究中得到广泛应用。
通过本次实验来学习PCR反应的基本原理与实验技术,了解引物设计的一般要求,同时学习PCR产物的回收及其与载体连接的原理和方法。
2 材料和方法2.1 实验原理2.1.1 PCR反应的基本原理聚合酶链式反应(PCR)是体外酶促合成特异DNA片段的一种方法,由高温变性、低温退火(复性)及适温延伸等几步反应组成一个周期,循环进行,使目的DNA得以迅速扩增,具有特异性强、灵敏度高、操作简便、省时等特点[2]。
PCR进行的基本条件是:以DNA为模板(在RT-PCR中模板是RNA);以寡聚核苷酸为引物;需要4种dNTP作为底物;有耐高温的Taq DNA聚合酶。
PCR每一个循环由三个步骤组成:①变性:加热模板DNA,使其解离成单链;②退火:降低温度,使人工合成的寡聚核苷酸引物在低温条件下与模板DNA所需扩增序列结合;③延伸:在适宜温度下,DNA聚合酶利用dNTP使引物3’端向前延伸,合成与模板碱基序列完全互补的DNA链。
每一个循环产物可作为下一个循环的模板,因此通过35-45个循环后,目标片段的扩增可达106-107倍。
由于DNA的琼脂糖凝胶电泳已于实验一详细阐述与实验,此次不再赘述。
2.1.2 PCR产物的回收与载体连接原理DNA片段回收方法:DNA片段在适当浓度的琼脂糖凝胶中通上一定电压进行电泳,不同大小的DNA分子由于迁移率的不同而分离开。
切下带有所需DNA片段的凝胶,用冻融法、玻璃奶回收法或商品化胶回收试剂盒将目的片段回收纯化。
PCR产物纯化

PCR产物纯化和切胶回收一、pcr产物纯化PCR扩增完成后需要进行琼脂糖凝胶电泳检测,在条带单一无其他杂带的情况下,可以直接对产物进行纯化,常见的纯化方法有:1、硅胶层析柱法原理:大多数离心柱中吸附DNA的是一层硅胶膜,实际上就是一层玻璃纤维,其表面有大量修饰的硅羟基(Si-OH),硅羟基在溶液中解离后带负电,然后与带正电盐离子、带负电DNA形成电桥,从而吸附住DNA,使得DNA双链变单链,不会被生物大分子溶剂洗脱,但能经水溶性缓冲液水化后,被定量回收,从而实现纯化分离。
2、磁珠法(abs60151)原理:磁珠是有磁性的能吸附DNA的物质,其内部核心是铁离子,在磁场作用下可以吸附在磁体上。
在核心外,经过羧化,带有羧基基团,在特定的离子条件下,可以与DNA结合。
结合后,在外磁场的作用下,磁珠与DNA结合体移动到磁体周围,可以很方便去除其他多余的液体,这时,不能与磁珠结合的所有杂质都随水溶液一并去除。
然后,在洗脱条件下,DNA与磁珠分离,溶解在水中,将溶解有DNA的溶液转移,就得到了纯化后的DNA样本。
3、其他纯化方法①渗透液结合醇沉纯化原理:利用分子大小不同,小分子的物质能够通过渗透膜溶解到大量的溶液中去,而大分子的物质不能通过渗透膜,所以继续留存在透析袋中,通过乙醇沉淀最后达到去除小分子物质,得到纯化的有机大分子的效果。
②直接沉淀纯化原理:DNA分子在高盐离子醇溶液中会被沉淀出来,而其他物质继续溶液在溶液中,沉淀出来的DNA分子经过离心与溶液成分分开,达到纯化的目的。
二、凝胶回收纯化如电泳检测结果存在非特异性条带,则需要将目的条带切出来,再用胶回收试剂盒(abs60098)对凝胶进行回收纯化,相较于直接纯化,只是多了一步溶胶的过程,相应的产物纯度提高,回收率则下降。
附:在PCR扩增完成后,反应体系中除了DNA片段,还存在离子、dNTP、引物及聚合酶等物质,这些物质会影响后续克隆测序等实验,因此对其产物进行纯化是必不可缺的步骤,不同的纯化手段各有自己的优缺点。
实验总结

3,1月22 回去前组培苗的处理
将之前已经做到芽伸长处理的苗扩增繁殖,种子预培 养的花生切出胚芽,转到芽伸长培养基培养,扩增繁殖和 预处理后转培养基的苗共118瓶。 4,2月25 统计污染率
返校后,检查存活的苗,发现已污染 79 瓶,剩余 39 瓶, 污染率为67%
5,跟潘师姐做过氧化物酶的活性测定
配制反应液: 19 微升愈创木酚用磷酸缓冲液定容至 50 毫升,再加入30%过氧化氢28微升。
用紫外分光光度计测吸光度:空白对照为 3毫升反应液 加 100 微升磷酸缓冲液,测量为 3 毫升反应液加 100 微升酶 液,每隔30秒读一次数据,共3分钟。重复2次。
2,1月20 载体连接
测定胶回收产物的浓度
取一支PCR小管置于冰上,加入1微升DMP 19 vector、 3 微升胶回收产物、1 微升超纯水、 5 微升 Solution Ⅰ,放 置于 PCR 仪上 16℃反应 30 分钟。将 PCR 小管中体系转入 DH 5α管中,冰上放置30分钟。42℃水浴45秒,冰中1分钟。 加入 SOC 890 微升,摇床 37℃ 1 小时。准备 10 个平板,在 含有Amp的LB固体平板上加入7微升IPTG和40微升X-gal,涂 布至晾干。每个平板涂 微升连接好的感受态细胞,封 口,37℃倒置黑暗培养12-16小时。 1月21 挑蓝白斑
周末总结
熊伟姣
一,学习
二,报账
三,实验
1,1月19 跟潘师姐做胶回收
目的基因的扩增,跑电泳,切胶,以 3 倍体积的 GM 溶 解,待胶完全融化后离心(若想提高胶回收浓度,可将废 液重新倒回吸附柱再离心一次),加入 700 微升 WB 离心, 重复一次,空离心后静置10分钟,加30微升超纯水于吸附 膜上静置 1 分钟,换离心管离心,将超纯水吸回吸附膜再 离心一次。
pcr产物回收原理

pcr产物回收原理PCR产物回收原理。
PCR(Polymerase Chain Reaction)是一种常用的分子生物学技术,它可以在体外扩增DNA片段,是分子生物学领域中不可或缺的技术手段之一。
在PCR实验中,产物回收是非常重要的一步,它可以影响到后续实验的成功与否。
本文将介绍PCR产物回收的原理和方法。
首先,我们需要了解PCR反应产物的性质。
在PCR反应中,DNA 聚合酶通过反复的扩增,使得目标DNA片段得到大量复制。
这些产物通常是双链DNA,其中包括了我们需要的目标序列。
但是,PCR反应中还会产生一些非特异性产物,比如引物二聚体和引物延伸产物等。
因此,在进行产物回收时,需要将目标DNA片段从这些非特异性产物中分离出来。
产物回收的原理主要是利用DNA的亲和性分离。
在实验中,我们通常会使用凝胶电泳将PCR反应产物分离开来。
凝胶电泳是一种常用的DNA分离技术,通过电场作用使得DNA片段在凝胶中移动,从而实现分离。
在凝胶电泳后,我们可以通过紫外光照射或染色方法将目标DNA片段可视化,然后将其切割出来。
另外,产物回收的方法还包括了使用商业化的PCR纯化试剂盒。
这些试剂盒通常包括了DNA结合柱和缓冲液等,可以通过离心等步骤将目标DNA片段从反应混合物中纯化出来。
这种方法操作简单,且可以高效地将目标DNA片段回收下来。
除了上述方法,还有一些其他的产物回收方法,比如磁珠分离法、溶液抽提法等。
这些方法都是根据DNA的性质和特点来设计的,可以根据实验需要选择合适的方法进行产物回收。
在进行PCR产物回收时,需要注意一些问题。
首先,要严格控制实验条件,避免外源DNA的污染。
其次,在产物回收过程中要避免DNA的降解,可以使用RNase等酶来去除RNA的污染。
最后,要对回收的DNA片段进行定量和质量检测,确保其适用于后续实验。
总之,PCR产物回收是PCR实验中至关重要的一步,它直接影响到后续实验的成功与否。
通过合理选择回收方法,并严格控制实验条件,可以高效地将目标DNA片段从PCR反应产物中回收出来,为后续实验提供可靠的DNA样品。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验六 PCR产物胶回收实验
一、实验目的
1. 掌握胶回收的常规操作
2. 了解胶回收PCR产物的目的
二、实验原理
利用胶回收试剂盒纯化PCR产物。
本试剂盒提供一个从TBE或TAE电泳缓冲液配制的琼脂糖凝胶中提取高质量DNA的简单、快速、有效的技术,适合从浓度≤3%,高,低熔点琼脂糖凝胶中,回收长度为60bp~23Kb的DNA片段,小于100bpDNA片段回收率为10%~55%,0.1~10kbDNA片段回收率最大为99%,大于10kbDNA片段回收率为
20~70%。
回收的基因组DNA可以应用到克隆,测序,限制性酶切等各类下游分子生物学实验。
三、试剂及配套设备和材料
3.1 试剂
Extraction buffer Wash buffer Elution buffer
3.2 配套设备和材料
无菌1.5ml离心管各种规格移液器和无菌移液器吸头
无水乙醇异丙醇可能需要3M KAc (pH 5.0) 离心机
四、基本技术参数
五、操作步骤
1. 用干净、锋利的手术刀,将含有目的DNA片段的琼脂糖凝胶切下,并放入1.5或
2.0 ml离心管中。
请尽量切去不包含DNA片段的凝胶。
一般情况下,电泳的DNA上样量≥50 ul (50ul为最终洗脱体积)。
2. 按1:3的比例(凝胶质量毫克数:融胶液体积微升数)加入Extraction buffer。
例如:100mg凝胶应加入300ul Extraction Buffer。
对于每人份试剂用量,凝胶
质量不能超过400mg。
3. 于恒温水浴或金属浴中50℃温育,直到凝胶融化。
一般温育时间为10分钟,温育过程中没隔2-3分钟混匀一次。
如果温育后,混合液体颜色变紫,请加入10 ul 3M KAc (pH 5.0),使混合液颜色变回黄色。
4. 可选:按1:1的比例(凝胶质量毫克数:异丙醇体积微升数)加入异丙醇,并混
合均匀。
如DNA片段大于500bp/小于4kb,不需要加异丙醇。
5. 将混合液全部转移到Spin column内,于6,000g离心1分钟,并弃去接液管内
液体。
如混合液体积大于750ul可先转移750ul,其余的液体待离心弃液后,再转移。
6. 向Spin column内加500ul Extraction Buffer,于12,000g离心30~60秒,并弃去接液管内液体。
7. 向Spin column内加750ul Wash Buffer,于12,000g离心30~60秒,并弃去接液管内液体。
如果回收的DNA片段将用于盐浓度敏感的实验,请在加入Wash buffer后静置
2~5分钟,再离心。
8. 再次于12,000 rpm离心1分钟,然后将spin column转移到无菌的1.5ml离心管中。
如不进行该步离心,则无法保证离心柱内残液被彻底清除。
9. 向Spin column内加50ul Elution Buffer、水或TE溶液,并于室温静置1分钟。
可根据实验的实际需要决定Elution Buffer用量。
但不要低于20ul。
10. 于12,000g离心1分钟,微量离心管内溶液中含有目的DNA片段。
回收的DNA可直接用于各类下游分子生物学实验,如果不立即使用,请保存于-20℃。
六、注意事项
1. 为了保证没有外源DNA的污染,电泳的buffer和gel都是新制的,切胶的台子清理干净,刀片最好洗净灭菌。
2. 为了减少胶的体积,我们可以用相对比较薄的胶来跑电泳,这样可以减少回收试剂引起的一些后续麻烦。
2. 在洗脱前,将洗脱液于30~60℃温浴,可提高提取效率。
七、思考题
1. 简述影响DNA在琼脂糖凝胶中迁移速率的因素。
2. 简述PCR上样缓冲液(loading buffer)的成分及其作用。
