琼脂糖凝胶电泳常见问题
琼脂糖凝胶电泳常见问题解答

琼脂糖凝胶电泳常见问题解答核酸分子是两性解离分子,在高于其等电点的电泳缓冲液中,其碱基不解离,而磷酸基团全部解离,核酸分子因而带负电荷,电泳时向正极迁移。
琼脂糖主要从海洋植物琼脂中提取而来并经糖基化修饰,为一种聚合链线性分子,使用琼脂糖凝胶作为电泳支持介质,发挥分子筛功能,使得大小和构象不同的核酸分子的迁移率出现较大差异,从而达到分离的目的。
琼脂糖凝胶电泳操作简单、快速,通过调整其使用浓度,使得分辨率达到大多数实验的要求,因此成为分离、鉴定、纯化核酸分子的常用方法。
但操作过程中仍有不少要注意的问题。
1 凝胶制作1.1 凝胶浓度配制凝胶的浓度据实验需要而变,一般在0.8%~2.0%之间,如果一次配制凝胶100 ml,没用完的凝胶可以再次融化,但随着融化次数的增加,水分丢失也越多,凝胶浓度则会越来越高,导致实验结果不稳定,补水办法:一是在容器上标记煮胶前的刻度,煮胶后补充相应的水分至原刻度;二是在煮胶前称重,煮胶后补充水至原重量。
粗略一点的方法是通过多次较恒定的煮胶条件得出一个经验补水值。
以保证凝胶浓度基本维持在原浓度。
核酸染色剂溴化乙锭(ethidium bromide)可加在融化的琼脂糖中,终浓度为0.5 t*g /ml;也可在电泳结束后染色。
1、2 梳板的选用一般每个制胶模具均配有多个齿型不同的梳板,梳齿宽厚,形成的点样孑L容积较大,用于DNA 片段回收实验等;相反,梳齿窄而薄,形成的点样孑L容积就较小,用于PCR产物、酶切产物鉴定等。
梳板的选择主要是看上样量的多少而定,一般来说,上样量小时尽量选择薄的梳板制胶,此时电泳条带致密清晰,便于结果分析。
另外,每次制胶时都要注意梳齿与底板的距离至少要1 mm,否则,拔梳板时易损坏凝胶孑L底层,导致点样后样品渗漏。
当然,点样孑L的破坏还与拔梳板的时间和方法有关,一般凝胶需冷却30 min以上方可拔梳板,应急的情况下可以将成型的凝胶块放4℃冰箱中冷却15 min 左右,拔梳板的方法是将制胶槽放置在电泳槽中的电泳缓冲液中,然后垂直向上慢慢用力,因为有液体的润滑作用,梳板易拔出且不易损坏点样孑L。
琼脂糖凝胶电泳条带不清晰的原因

琼脂糖凝胶电泳条带不清晰的原因
琼脂糖凝胶电泳是一种常用的分离和检测DNA分子的方法,但有时候会出现电泳条带不清晰的情况。
这种情况可能由以下几个原因引起。
琼脂糖凝胶的制备和使用过程中可能存在问题。
如果琼脂糖凝胶的浓度不够或者制备过程中出现了气泡,就会导致电泳条带不清晰。
此外,如果琼脂糖凝胶的pH值不正确,也会影响电泳结果。
DNA样品的质量可能不够好。
如果DNA样品的浓度过低或者存在杂质,就会导致电泳条带不清晰。
此外,如果DNA样品没有经过充分的纯化和处理,也会影响电泳结果。
第三,电泳条件可能不够合适。
如果电泳时间过短或者电压过高,就会导致电泳条带不清晰。
此外,如果电泳缓冲液的浓度或pH值不正确,也会影响电泳结果。
操作者的技术水平也会影响电泳结果。
如果操作者没有经过充分的培训和实践,就可能出现操作不当的情况,比如样品加载不均匀、电泳仪设置不正确等,都会导致电泳条带不清晰。
为了避免电泳条带不清晰的情况,我们可以采取以下措施。
首先,制备琼脂糖凝胶时要注意浓度、pH值和气泡等问题。
其次,对DNA样品进行充分的纯化和处理,确保样品质量。
第三,调整电泳条件,包括时间、电压和缓冲液浓度和pH值等。
最后,操作者要
经过充分的培训和实践,确保操作技术水平。
电泳条带不清晰可能由多种原因引起,我们需要仔细分析和排除这些原因,才能得到准确的电泳结果。
琼脂糖凝胶电泳注意事项

琼脂糖凝胶电泳常见错误及注意事项琼脂糖凝胶电泳是一种常用的分子生物学实验技术。
在实验过程中,为避免常见错误和提高实验效果,需要注意以下几点:1. 样品制备:在样品制备过程中,需要严格控制样品的来源、处理和质量。
避免污染和杂质的污染,以免影响实验结果。
2. 凝胶制备:在凝胶制备过程中,需要严格按照实验方案的要求制备凝胶。
应避免在制备过程中产生气泡和缺陷,保证凝胶质量的均一性和完整性。
3. 负载样品:样品的负载量也是影响实验结果的一个重要因素。
负载量过多或者过少,都会影响实验结果的准确性。
因此,需要根据实验要求和样品特点调整合适的负载量。
4. 配置电解液:电解液是凝胶电泳实验中的重要组成部分。
配置电解液应按照实验方案的要求进行,不能进行随意变更。
5. 进行电泳实验:在进行电泳实验时需要注意以下几点:(1)电泳时间:电泳时间应根据实验要求和实验人员的经验来调整,以保证样品可以在凝胶中分离出来。
(2)使用电源:电源是电泳实验中的重要设备,需要使用与实验要求相符的电源,避免因电源不适应或使用不当引起实验故障。
(3)电极夹:电极夹应牢固可靠,避免在实验过程中出现松动或断电等情况。
6. 结果解读:琼脂糖凝胶电泳实验结果的解读需要根据实验要求和实验人员的经验进行。
在进行实验结果的解读时需要注意以下几点:(1)确定分离带:分离带越清晰越好,可以通过显微镜来观察分离带是否正常。
(2)确定目标DNA:确定目标DNA时需要考虑实验目的和分离带的特点来确定是否符合要求。
(3)保留样品:需要在实验结果出来后保留样品,以备后续实验需要。
总之,在进行琼脂糖凝胶电泳实验时需要注意以上几点,以达到实验目的并减少实验错误的发生。
琼脂糖凝胶电泳实验注意事项

琼脂糖凝胶电泳实验注意事项以琼脂糖凝胶电泳实验注意事项为标题,写一篇文章。
琼脂糖凝胶电泳是一种常用的分离和分析生物大分子(如核酸和蛋白质)的技术。
在进行琼脂糖凝胶电泳实验时,需要注意以下几个方面:一、琼脂糖凝胶的制备1. 选择适当的琼脂糖浓度:根据需要分离的目标生物大分子的大小,选择合适的琼脂糖浓度。
一般来说,较大分子需要较低浓度的琼脂糖。
2. 充分溶解琼脂糖:将琼脂糖加入缓冲液中,充分搅拌或加热至完全溶解。
避免出现结块或沉淀现象。
3. 均匀注入琼脂糖凝胶模板:将溶解的琼脂糖缓冲液均匀注入琼脂糖凝胶模板中,避免产生气泡或不均匀的凝胶层厚度。
二、样品处理1. 样品预处理:根据需要,进行样品的提取、纯化和浓缩等处理,以获得较纯净的样品。
2. 样品加载量:根据样品的浓度和凝胶孔径的大小,确定合适的样品加载量。
过多的样品会导致分离效果不佳,过少的样品则可能无法检测到目标分子。
3. 加载缓冲液:为了保持样品的稳定性,在加载样品时,可以加入适量的加载缓冲液。
缓冲液的选择应根据实验需要来确定,常用的缓冲液包括TAE缓冲液和TBE缓冲液等。
三、电泳条件1. 电泳缓冲液的选择:根据实验需要,选择适当的电泳缓冲液。
常用的电泳缓冲液包括TAE缓冲液和TBE缓冲液。
缓冲液的选择应考虑到其离子浓度和pH值的影响。
2. 电泳时间和电压:根据样品的大小和需要分离的目标,确定合适的电泳时间和电压。
较小的分子需要较长时间的电泳,较大的分子则需要较高的电压。
3. 温度控制:在进行琼脂糖凝胶电泳时,应控制好实验温度,避免温度过高引起样品的变性或凝胶的溶解。
四、染色和可视化1. 染色剂的选择:根据需要染色的生物大分子,选择合适的染色剂。
DNA常用的染色剂包括溴化乙锭和SYBR Green等,蛋白质常用的染色剂包括银染剂和共染剂等。
2. 染色时间和浓度:根据染色剂的特性,确定合适的染色时间和浓度。
过长的染色时间可能导致背景信号过强,过高的染色浓度则可能掩盖目标信号。
电泳常见问题

Marker参考见解:marker有时会出现这样的问题,应该是时间久了。
新买时跑胶在点样孔没有,过一段时间就会在点样孔出现亮点。
也可能是蛋白,有时DNA提的不纯含有蛋白时就会出现上样孔有条带的现象琼脂糖凝胶电泳检测DNA时,跑出的带后面出现拖尾现象,什么原因造成的?参考见解:DNA带模糊??:1、DNA降解??避免核酸酶污染。
2、DNA上样量过多??减少凝胶中DNA上样量。
3、所用电泳条件不合适??电泳时电压不应超过20V/cm,温度<30℃,巨大DNA链,温度应<15℃,核查所用电泳缓冲液是否有足够的缓冲能力。
4、DNA样含盐过高??电泳前通过乙醇沉淀去除过多的盐。
5、有蛋白污染??电泳前酚抽提去除蛋白。
6、DNA变性,?电泳前勿加热,用20mM NaCl缓冲液稀释DNA。
将从组织提取的DNA进琼行脂糖凝胶电泳,用的1.5%的胶加了EB,80V跑1小时,溴酚蓝已经跑到头了,在紫外灯观察什么带也没有,只见孔里面有橘红色的亮光。
好象没跑出来,是怎么回事?参考见解:1、根据目的条带长度来调整凝胶浓度,一般1.5%左右,也不一定。
2、紫外灯下没见带,不一定没有出孔,而是量少看不到,可以测一下浓度看一下,或直接试跑一下PCR。
3、最好加一个marker孔,尤其你第一次跑胶时。
4、电泳时间可能过长,一般75v×30min左右,但是具体看溴酚蓝的离孔距离和目的条带离孔距离。
怎样根据目测条带亮度来判断DNA浓度?参考见解:1、跑胶时候marker 可以加成定量marker,如1kb、100bp等marker,按说明书的量上样电泳,如加500ng量的DNA marker,电泳完毕后,就可将目的DNA条带和MARKER 条带的亮度做个大致的比较,找出两者最接近亮度的条带。
因为marker的各条带都已知所含的DNA浓度(说明书中详细注明),因此根据条带的亮度、大小大致就可推测目的DNA的浓度。
2、在通过目测DNA浓度的时候,最好要把加样量设一个梯度,比如从0。
琼脂糖凝胶电泳条带不清晰的原因

琼脂糖凝胶电泳条带不清晰的原因琼脂糖凝胶电泳是一种常用的分析和分离生物大分子的方法。
然而,有时候在进行琼脂糖凝胶电泳实验时,我们可能会遇到条带不清晰的问题,这给结果的解读和分析带来了困扰。
下面我将介绍一些可能导致琼脂糖凝胶电泳条带不清晰的原因。
1. DNA样品质量不佳琼脂糖凝胶电泳的前提是获得高质量的DNA样品。
如果DNA样品质量不佳,比如存在脏带、降解或者污染,都会导致条带不清晰。
因此,在进行实验之前,我们需要对DNA样品进行质控,确保其质量符合要求。
2. 样品预处理不当在进行琼脂糖凝胶电泳之前,我们通常需要对DNA样品进行一些预处理,比如酶切、PCR扩增或者纯化等。
如果预处理过程中存在问题,比如酶切反应时间过长、PCR扩增过程中出现非特异性扩增等,都会导致条带不清晰。
3. 聚丙烯酰胺凝胶浓度选择不当琼脂糖凝胶电泳中,聚丙烯酰胺凝胶的浓度是影响条带清晰度的重要因素之一。
一般来说,较低浓度的凝胶适用于较大的DNA片段分离,而较高浓度的凝胶适用于较小的DNA片段分离。
如果选择的凝胶浓度不合适,就会导致条带模糊不清。
4. 电泳条件设置不当电泳条件的设置也是影响琼脂糖凝胶电泳结果的重要因素。
比如,电泳电压、电泳时间和电泳缓冲液的配制等都会影响条带的清晰度。
如果电压过高或者电泳时间过长,都会导致条带模糊不清。
此外,如果电泳缓冲液的配制不正确,比如pH值不稳定或者离子浓度不合适,也会影响条带的清晰度。
5. 负载样品量过多或过少在进行琼脂糖凝胶电泳时,负载样品量的选择也是非常关键的。
如果负载样品量过多,会导致条带扩散,模糊不清;如果负载样品量过少,条带可能会变得非常弱或者根本看不到。
因此,在进行负载样品时,需要根据实验的需要选择适当的样品量。
琼脂糖凝胶电泳条带不清晰的原因可能是多方面的,包括DNA样品质量不佳、样品预处理不当、聚丙烯酰胺凝胶浓度选择不当、电泳条件设置不当以及负载样品量过多或过少等。
在进行琼脂糖凝胶电泳实验时,我们需要仔细检查每一个步骤,确保实验条件的准确性和合理性,从而获得清晰可靠的结果。
琼脂糖凝胶电泳实验报告思考题

琼脂糖凝胶电泳实验报告思考题
当涉及琼脂糖凝胶电泳实验时,有许多思考题可以涉及。
以下是一些可能的思考题:
1. 实验目的是什么?为什么要使用琼脂糖凝胶电泳?
2. 实验中使用的琼脂糖凝胶是什么成分?它是如何制备的?
3. 实验中使用的样品是什么?为什么选择这些样品进行电泳分析?
4. 实验中使用的电泳条件是什么?包括电场强度、电泳时间等参数。
5. 在实验中观察到的电泳结果是什么?是否有预期的结果?有无异常结果?
6. 实验中的控制组是什么?它们的作用是什么?
7. 实验中可能存在的误差来源是什么?如何减少这些误差?
8. 实验结果与预期结果是否一致?如果不一致,可能的原因是什么?
9. 实验结果对理论或实际应用有何意义?是否可以推广到其他领域?
10. 未来实验中可以改进的地方是什么?有无可能的进一步研究方向?
以上思考题可以帮助读者更深入地理解琼脂糖凝胶电泳实验,并引发更多的讨论和思考。
琼脂糖凝胶电泳常见问题
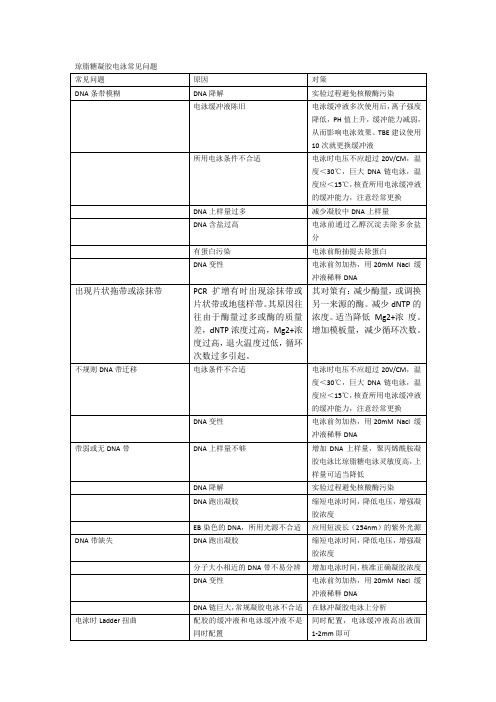
DNA上样量不够
增加DNA上样量,聚丙烯酰胺凝胶电泳比琼脂糖电泳灵敏度高,上样量可适当降低
DNA降解
实验过程避免核酸酶污染
DNA跑出凝胶
缩短电泳时间,降低电压,增强凝胶浓度
EB染色的DNA,所用光源不合适
应用短波长(254nm)的紫外光源
DNA带缺失
DNA跑出凝胶
缩短电泳时间,降低电压,增强凝胶浓度
琼脂糖凝胶电泳常见问题
常见问题
原因
对策
DNA条带模糊
DNA降解
实验过程避免核酸酶污染
电泳缓冲液陈旧
电泳缓冲液多次使用后,离子强度降低,PH值上升,缓冲能力减弱,从而影响电泳效果。TBE建议使用10次就更换缓冲液
所用电泳条件不合适
电泳时电压不应超过20V/CM,温度<30℃,巨大DNA链电泳,温度应<15℃,核查所用电泳缓冲液的缓冲能力,注意经常更换
分子大小相近的DNA带不易分辨
增加电泳时间,核准正确凝胶浓度
DNA变性
电泳前勿加热,用20mM Nacl缓冲液稀释DNA
DNA链巨大,常规凝胶电泳不合适
在脉冲凝胶电泳上分析
电泳时Ladder扭曲
配胶的缓冲液和电泳缓冲液不是同时配置
同时配置,电泳缓冲液高出液面1-2mm即可
电泳时电压过高
电泳时电压不应超过20V/CM
其对策有:减少酶量,或调换另一来源的酶。减少dNTP的浓度。适当降低Mg2+浓度。增加模板量,减少循环次数。
不规则DNA带迁移
电泳条件不合适
电泳时电压不应超过20V/CM,温度<30℃,巨大DNA链电泳,温度应<15℃,核查所用电泳缓冲液的缓冲能力,注意经常更换
DNA变性
琼脂糖凝胶电泳实验

琼脂糖凝胶电泳实验⼀、实验原理:琼脂糖凝胶电泳是分离和纯化DNA ⽚段的常⽤技术。
把DNA样品加⼊到⼀块包含电解质的多孔⽀持介质(琼脂糖凝胶)的样品孔中,并置于静电场上。
由于DNA分⼦的双螺旋⾻架两侧带有含负电荷的磷酸根残基,因此在电场中向正极移动。
在⼀定的电场强度下,DNA分⼦的迁移速度取决于分⼦筛效应。
具有不同的相对分⼦质量的DNA⽚段泳动速度不⼀样,因⽽可依据DNA分⼦的⼤⼩来使其分离。
凝胶电泳不仅可分离不同分⼦质量的DNA,也可以分离相对分⼦质量相同,⽽构型不同的DNA分⼦。
在电泳过程中可以通过⽰踪染料或相对分⼦质量标准参照物和样品⼀起进⾏电泳⽽得到检测。
相对分⼦质量标准参照物相对可以提供⼀个⽤于确定DNA⽚段⼤⼩的标准。
在凝胶中加⼊少量溴化⼄锭(ethidium bromide, EB)或者EB类似物,其分⼦可插⼊DNA的碱基之间,形成⼀种络合物,在254~365nm波长紫外光照射下,呈桔红⾊荧光,因此也可对分离的DNA进⾏检测。
⼀般琼脂糖凝胶电泳适⽤于⼤⼩在0.2kb~50kb范围内的DNA⽚段。
三种不同构型分⼦进⾏电泳时的迁移速度⼤⼩顺序为:超螺旋DNA>线性DNA>开环DNA正确选择凝胶浓度对于琼脂糖凝胶电泳,浓度通常在0.5~2%之间,低浓度的⽤来进⾏⼤⽚段核酸的电泳,⾼浓度的⽤来进⾏⼩⽚段分析。
低浓度胶易碎,⼩⼼操作和使⽤质量好的琼脂糖是解决办法。
注意⾼浓度的胶可能使分⼦⼤⼩相近的DNA带不易分辨,造成条带缺失现象。
适合的电泳缓冲液常⽤的缓冲液有TAE和TBE,⽽TBE⽐TAE有着更好的缓冲能⼒。
电泳时使⽤新制的缓冲液可以明显提⾼电泳效果。
注意电泳缓冲液多次使⽤后,离⼦强度降低,PH 值上升,缓冲性能下降,可能使DNA电泳产⽣条带模糊和不规则的DNA带迁移的现象。
Marker的选择DNA电泳⼀定要使⽤DNA Marker或已知⼤⼩的正对照DNA来估计DNA⽚段⼤⼩。
琼脂糖凝胶电泳条带不清晰的原因

琼脂糖凝胶电泳条带不清晰的原因
琼脂糖凝胶电泳是一种常见的分离DNA、RNA和蛋白质的方法,但有时会出现条带不清晰的情况,这可能由以下原因造成:
1. 样品制备不当:样品制备是影响琼脂糖凝胶电泳结果的关键因素之一。
如果样品处理不当,如DNA或RNA未能完全溶解或含有杂质,会导致条带模糊或消失。
因此,在进行琼脂糖凝胶电泳前,应该仔细处理样品。
2. 带电物质浓度过高:如果DNA、RNA或蛋白质的浓度过高,会导致它们在凝胶中聚集在一起形成模糊的条带。
因此,在进行琼脂糖凝胶电泳时应该注意调整样品浓度。
3. 凝胶制备不当:凝胶制备也是影响结果的重要因素之一。
如果凝胶制备不当,如pH值、离子强度或聚合物浓度等参数没有正确控制,会导致凝胶结构不稳定或缺陷,并且影响分离效果。
4. 电泳条件设置错误:电泳条件也是影响结果的关键因素之一。
如果电场强度过高或时间过长,会导致条带扩散或聚集在一起,从而影响分离效果。
因此,在进行琼脂糖凝胶电泳时应该注意设置合适的电泳条件。
5. 染色不充分:染色是观察条带的关键步骤之一。
如果染色不充分或时间过短,会导致条带颜色暗淡或消失,从而难以观察。
综上所述,琼脂糖凝胶电泳条带不清晰可能由样品制备不当、带电物质浓度过高、凝胶制备不当、电泳条件设置错误或染色不充分等多种原因造成。
为了得到清晰的结果,需要仔细处理样品、调整浓度、正确制备凝胶、设置合适的电泳条件和充分染色。
琼脂糖凝胶电泳条带不清晰的原因

琼脂糖凝胶电泳条带不清晰的原因介绍琼脂糖凝胶电泳是一种常用的分离和鉴定DNA、RNA和蛋白质的技术。
然而,在执行琼脂糖凝胶电泳实验时,有时会发现条带不清晰的情况。
本文将深入探讨琼脂糖凝胶电泳条带不清晰的原因,并提出相应的解决方案。
二级标题1:样品质量差在分离和凝胶电泳之前,合理选择、处理和保存样品是确保条带清晰的关键之一。
三级标题1.1:DNA/RNA质量差1.确保使用高质量的DNA/RNA提取试剂盒,遵循厂家提供的操作指南。
2.在提取DNA/RNA的过程中,注意样品的污染问题,如DNA污染、RNA降解等。
3.波长为260 nm和280 nm的比值是衡量DNA/RNA纯度的指标,确保该比值在1.8至2.0之间。
4.使用凝胶电泳仪器前,对DNA/RNA样品进行定量,确保加载足够的样品。
三级标题1.2:蛋白质质量差1.使用高纯度的蛋白质提取试剂盒提取样品。
2.注意蛋白质样品的保存温度和时间,避免蛋白质降解。
3.使用SDS-PAGE等技术进行蛋白质分离,确保负载均衡。
二级标题2:电泳条件不当电泳条件的设置对于琼脂糖凝胶电泳的条带清晰度具有重要影响。
三级标题2.1:电泳缓冲液配制问题1.确保电泳缓冲液的pH值和离子浓度符合实验要求。
2.避免电泳缓冲液的变质和二次污染。
三级标题2.2:凝胶浓度和孔隙度不合适1.根据DNA/RNA或蛋白质的分子大小选择适当的琼脂糖凝胶浓度,以充分分离目标分子。
2.考虑使用不同孔隙度的琼脂糖凝胶,以适应不同大小的DNA/RNA或蛋白质。
三级标题2.3:电泳电压和时间错误1.根据实验要求,设置合适的电泳电压和时间。
2.避免电泳时间过长,以免造成DNA/RNA或蛋白质的扩散和模糊化。
三级标题2.4:电泳缓冲液温度过高1.调整电泳室的冷却系统,控制电泳缓冲液温度在合适的范围内。
2.避免电泳缓冲液温度过高导致琼脂糖溶解和扩散。
二级标题3:样品加载问题样品的加载方式和负载量也会影响琼脂糖凝胶电泳的结果。
琼脂糖凝胶电泳常见问题分析
琼脂糖凝胶电泳常见问题分析DNA凝胶电泳简介一、实验原理DNA电泳是基因工程中最基本的技术,DNA制备及浓度测定、目的DNA片段的分离,重组子的酶切鉴定等均需要电泳完成。
根据分离的DNA大小及类型的不同,DNA电泳主要分两类:1、聚丙烯酰胺凝胶电泳适合分离1kb以下的片段,最高分辨率可达1bp,也用于分离寡核苷酸,在引物的纯化中也常用此中凝胶进行纯化,也称PAGE纯化。
2、琼脂糖凝胶电泳可分离的DNA片段大小因胶浓度的不同而异,胶浓度为0.5~0.6%的凝胶可以分离的DNA片段范围为20bp~50kb。
电泳结果用溴化乙锭(EB)染色后可直接在紫外下观察,并且可观察的DNA条带浓度为纳克级,而且整个过程一般1小时即可完成。
由于该方法操作的简便和快速,在基因工程中较常用。
二、琼脂糖凝胶琼脂糖是从琼脂中分离得到,由1,3连接的吡喃型b-D-半乳糖和1,4连接的3,6脱水吡喃型阿a-L-半乳糖组成,形成相对分子量为104~105的长链。
琼脂糖加热溶解后分子呈随机线团状分布,当温度降低时链间糖分子上的羟基通过氢键作用相连接,形成孔径结构,而随着琼脂糖浓度不同形成不同大小的孔径。
表1给出了不同浓度凝胶对DNA片段的线性分离范围。
表1不同类型琼脂糖分离DNA片段大小的范围由于琼脂糖凝胶是通过氢键的作用,因此过酸或过碱等破坏氢键形成的方法常用于凝胶的再溶化,象NaClO4能用于凝胶的裂解,一般的凝胶回收试剂盒利用的也是这一原理。
随着实验技术的发展,也针对不同用途开发了各种类型的琼脂糖凝胶:(1)低熔点琼脂糖凝胶,用于DNA片段的回收,且由于该种凝胶中无抑制酶,可在胶中进行酶切、连接等;(2)高熔点凝胶,可分离小于1kb的DNA片段,专用于PCR产物的分析;(3)快速凝胶,电泳速度比普通凝胶中快一倍,可节省实验时间;(4)适用于DNA大片段的分离。
(5)其它类型。
各生产商还开发很多类型的凝胶,可根据实验要求选择不同类型的,选择原则是考虑合适的机械强度和熔点。
琼脂糖凝胶电泳失败的原因

琼脂糖凝胶电泳失败的三大原因及解决方法琼脂糖凝胶电泳是常用分离DNA或RNA等生物大分子的方法之一。
但是,在进行琼脂糖凝胶电泳时,经常会出现失败的情况,影响实验
结果。
下面介绍三种常见的琼脂糖凝胶电泳失败原因及解决方法。
一、凝胶制备不当
凝胶制备不当是琼脂糖凝胶电泳失败的常见原因之一。
凝胶的浓
度和 pH 值的不准确,会导致样品在凝胶上的迁移速度不同,分离效
果差。
解决方法:
1、准确称量琼脂糖的用量,按标准比例配制凝胶;
2、保持 pH 值适当,通常为 7.5-8.0;
3、使用新鲜的试剂,防止污染。
二、电泳条件不正确
电泳条件对于琼脂糖凝胶电泳的成功与否有很大的影响,如果电
泳时间不够或者电场强度不够,样品可能没有分离开来。
解决方法:
1、选择正确的电泳缓冲液;
2、根据样品的大小和特性来制定合适的电泳时间和电场强度;
3、定期更换电泳缓冲液,防止污染。
三、样品制备不当
样品制备不良,也是琼脂糖凝胶电泳失败的原因之一。
不同的组织、细胞、DNA或RNA等样品,对样品的制备条件有不同的要求。
解决方法:
1、严格按照标准或常规操作制备样品;
2、根据样品的大小和性质,选择合适的溶解方法;
3、尽可能地去除污染物或者其他干扰物。
综上所述,准备好琼脂糖凝胶,选择合适的电泳条件,以及正确地制备样品,是避免琼脂糖凝胶电泳失败的关键。
琼脂糖凝胶电泳

DNA琼脂糖凝胶电泳一、基本原理当把一个带净电荷(q)的颗粒放入电场,便有一个电场力(F)作用于其上。
F的大小取决于颗粒静电荷量及其所处的电场强度(E),它们之间的关系可以表示成:F=E×q。
由于F的作用,使带电颗粒在电场中向一定方向泳动。
此颗粒在泳动的过程中还受到一个相反方向的摩擦力(f*v)阻挡。
当这两种力相等时,颗粒则以速度(v)向前泳动:v=F/f,其中f为摩擦系数。
根据Stoke公式,阻力大小取决于带电颗粒的大小、形状以及所处介质的粘度,即f=6πγη, γ为颗粒半径,η为介质粘度。
该公式指球形颗粒所受的阻力。
代入F=E×q得到: v=E×q/6πγη.从这个公式可以看出,带电颗粒在电场中泳动的速度与电场强度和带电颗粒的净电荷量成正比,与颗粒半径和介质粘度成反比。
带电颗粒在电场中泳动的速度常用泳动度(m)或者迁移率以下列公式表示:m=μ/E=d*l/V*td为带电颗粒泳动的距离(cm),l为支持物的有效长度(cm),t为通电时间(s),V为加在支持物两端的电压。
在一定条件下,任何带电颗粒都具有自己特定的泳动度。
它是胶体颗粒的一个物理常数,可用其鉴定蛋白质、核酸等物质的纯度,还可以用其来研究蛋白质、核酸等物质的一些理化性质。
影响泳动度的因子有颗粒的性质、电场强度、溶液的性质等。
二、琼脂糖凝胶电泳通常情况下,核酸类物质的分离、鉴定是采用琼脂糖凝胶(做支持物)电泳法进行的。
用琼脂糖分离线性DNA时,其迁移率与该物质分子质量的关系密切,而与结构和碱基组成无关。
这也是采用凝胶电泳法测定核酸分子质量的依据所在。
此方法除了可以分离线性DNA外,还可以分离、分析细菌质粒的闭环DNA和开环DNA,以及分子质量不等的RNA片段。
一般实验室采用的琼脂糖凝胶的浓度为0.3%——2%。
不同的凝胶浓度,可以分离不同长度的DNA片段。
具体见表格:琼脂糖凝胶 /% m/V 分离线性DNA片段的范围 /kb0.3 50---600.6 1----200.7 0.8---100.9 0.5---7.01.2 0.4----6.01.5 0.3---3.02.0 0.1---2.0琼脂糖凝胶电泳常用的缓冲液:缓冲液pH1.50mmol/L Tris-NaH2PO4-1--5mmol/L EDTA 7.5---8.02.50mmol/L NaH2PO4- Na2HPO4-1--5mmol/L EDTA 7.5---8.03.50mmol/L Tris-乙酸-1--5mmol/L EDTA 7.5---8.04.50mmol/L 乙酸钠-乙酸-1--5mmol/L EDTA 7.5---8.033琼脂糖凝胶电泳常用的样品缓冲液(示踪染料):0.25%溴酚蓝-0.25%二甲苯青FF-30%甘油水溶液,并且这两种指示剂在琼脂糖凝胶中的迁移率不同,可以指示一定片段长度的DNA迁移率(具体见下表)。
琼脂糖凝胶电泳

一、实验原理琼脂糖凝胶电泳是分离和纯化DNA 片段的常用技术。
把DNA样品加入到一块包含电解质的多孔支持介质(琼脂糖凝胶)的样品孔中,并置于静电场上。
由于DNA分子的双螺旋骨架两侧带有含负电荷的磷酸根残基,因此在电场中向正极移动。
在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应。
具有不同的相对分子质量的DNA片段泳动速度不一样,因而可依据DNA分子的大小来使其分离。
凝胶电泳不仅可分离不同分子质量的DNA,也可以分离相对分子质量相同,而构型不同的DNA分子。
在电泳过程中可以通过示踪染料或相对分子质量标准参照物和样品一起进行电泳而得到检测。
相对分子质量标准参照物相对可以提供一个用于确定DNA片段大小的标准。
在凝胶中加入少量溴化乙锭(ethidium bromide, EB),其分子可插入DNA的碱基之间,形成一种络合物,在254~365nm 波长紫外光照射下,呈桔红色荧光,因此也可对分离的DNA进行检测。
一般琼脂糖凝胶电泳适用于大小在0.2kb~50kb范围内的DNA片段。
本实验介绍琼脂糖凝胶的制备以及琼脂糖凝胶电泳在DNA片段分离中的应用方法。
二、仪器及试剂1.仪器及耗材:水平电泳槽、电泳仪、凝胶成像分析系统、微波炉、微量移液器、透明胶带、点样板或parafilm、100 ml或250 ml锥形瓶、量筒、吸头等。
2.试剂及配制:50×TAE缓冲液的配制:2 mol/L Tris-乙酸,0.05 mol/L EDTA(pH 8.0)配制1000 mlTris 242 g冰乙酸 57.1 ml0.5 mol/L EDTA 100 ml加入600 ml去离子水后搅拌溶解,将溶液定容至1 L后。
高温高压灭菌,室温保存。
1×TAE缓冲液的配制:称量20 ml的50×TAE缓冲液,再加入980 ml的去离子水。
溴化乙啶贮存液:10 mg/ml 溴化乙啶配制:100 ml称取1 g溴化乙啶,置于100 ml烧杯中,加入80 ml去离子水后搅拌溶解。
常见琼脂糖凝胶电泳错误

部分:向DNA样本说再见——常见琼脂糖凝胶电泳错误1. 使用水代替凝胶缓冲液或电泳缓冲液琼脂糖凝胶配制和电泳通常使用TAE或TBE缓冲液进行。
如果您使用水进行凝胶配制和跑电泳,您的凝胶将在电泳时很快融化。
TAE、TBE和水都是透明的溶液;因此,在配制时请检查容器的标签。
2. 使用了错误浓度的琼脂糖DNA凝胶电泳所需的标准琼脂糖浓度为1.0%。
浓度越高,小条带的分辨率越高;反之,琼脂糖浓度越低,大分子量条带的分辨率和分离程度越高。
如果使用了错误浓度的琼脂糖凝胶,就很难确定DNA 条带的可靠性。
当使用低百分比浓度琼脂糖凝胶时要小心;它们往往较软,更容易破损。
3. 颠倒了电泳槽与电源连接线的方向这是很容易犯的错误,但是如果你不小心颠倒了电泳槽与电源连接线的方向,结果将会非常令人沮丧。
因为样本会向相反方向移动,而且由于上样孔与凝胶的末端很近,您会丢失所有的样本。
开始您的电泳后确保DNA样本以正确的方向进入凝胶;如果您看到您的条带向错误的方向移动,请颠倒电源线的方向。
II部分:琼脂糖凝胶中实现更高分辨率的5种方法1. 什么是适合于您的琼脂糖凝胶电泳的正确缓冲液?进行DNA琼脂糖凝胶电泳所需的缓冲液类型,主要取决于DNA片段大小和电泳后的应用。
进行琼脂糖凝胶电泳最常见的两种缓冲液是Tris-乙酸EDTA缓冲液(TAE)和Tris-硼酸EDTA缓冲液(TBE)。
因为两种缓冲液的pH值都接近中性,所以缓冲液中的DNA都带净负电荷并向凝胶装置正极(+)方向移动。
对于小片段DNA (<1000 bp),如果没有计划从凝胶中回收DNA,那么推荐使用1x TBE缓冲液。
TBE 溶液具有高离子强度和缓冲能力。
TAE缓冲液,结合低电场强度(1–2 V/cm),最适于分离大DNA (12–15 kb)。
TAE缓冲液与琼脂糖相互作用,相比较TBE缓冲液中的琼脂糖凝胶,会产生更低的电渗透,更大的表面孔经,和更低的电场强度,可降低大DNA的smear现象。
琼脂糖凝胶电泳注意事项及操作流程

琼脂糖凝胶电泳注意事项及操作流程琼脂糖凝胶电泳操作注意事项及流程在进行凝胶电泳操作时,需要注意以下事项:1.缓冲液的使用:缓冲液的离子强度会影响DNA的迁移速度,因此应选择合适的缓冲液,并定期更换或循环使用,避免电泳过程中出现DNA变性的情况。
2.琼脂糖的选择:不同品牌和批次的琼脂糖杂质含量不同,会影响DNA的迁移和荧光背景的强度,因此应有选择地使用。
3.凝胶的制备:凝胶中所加缓冲液应与电泳槽中的相一致,避免出现凝固结块和气泡等影响电泳结果的情况。
4.样品加入量:加样量的多少应根据加样孔的大小和DNA中片段的数量和大小而定,过多的量会导致超载,从而影响电泳结果。
5.DNA标准参照物的使用:电泳系统的变化会影响DNA的迁移,因此需要加入DNA标准参照物进行判定。
6.盐浓度的影响:DNA样品中盐浓度会影响DNA的迁移率,因此应使用同样的缓冲条件进行平行对照样品以消除这种影响。
7.凝胶浓度的选择:不同浓度的凝胶有可能分辨范围广泛的DNA分子,应根据DNA分子的范围来选择凝胶的浓度。
小片段的DNA电泳应采用聚丙烯酰胺凝胶电泳以提高分辨率。
在加样时,需要注意以下事项:1.使用移液抢将样品加至点样孔,每孔点样的体积一般少于25ul,操作要稳当且细心。
2.加入适量的蔗糖来增加样品的浓度,以使每个样品停留在各自的点样孔中。
3.加入水溶性的阴离子追踪染料,用以观察样品移动的距离。
4.加入标准分子质量样品进行标准曲线的制作。
5.在追踪染料泳动到胶的80%部位时停止电泳,注意电泳期间要安全盖好电泳槽盖,以防止液体蒸发和电击的可能性。
6、在电泳结束后,将凝胶浸泡在浓度为1mg/L的溴化乙锭(EB)中,经过5分钟后,可以看到DNA带的出现。
这是因为EB分子能够插入到DNA的双链核苷酸之间,从而与DNA结合。
另外一种方法是在电泳时向凝胶中加入EB。
7、通过在紫外灯下观察,由于EB分子会发出强烈的橘红色荧光,因此可以很明显地观察到DNA带的存在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
琼脂糖凝胶电泳常见问题
缓冲液稀释DNA出现片状拖带或涂抹带PCR扩增有时出现涂抹带或片状带或地毯样带。
其原因往往由于酶量过多或酶的质量差,dNTP浓度过高,Mg2+浓度过高,退火温度过低,循环次数过多引起。
其对策有:减少酶量,或调换另一来源的酶。
减少dNTP 的浓度。
适当降低 Mg2+浓度。
增加模板量,减少循环次数。
不规则DNA带迁移电泳条件不合适电泳时电压不应超过20V/CM,温度<30℃,巨大DNA链电泳,温度应<15℃,核查所用电泳缓冲液的缓冲能力,注意经常更换DNA变性电泳前勿加热,用20mM Nacl 缓冲液稀释DNA带弱或无DNA带DNA上样量不够增加DNA上样量,聚丙烯酰胺凝胶电泳比琼脂糖电泳灵敏度高,上样量可适当降低DNA降解实验过程避免核酸酶污染DNA跑出凝胶缩短电泳时间,降低电压,增强凝胶浓度EB染色的DNA,所用光源不合适应用短波长(254nm)的紫外光源DNA带缺失DNA跑出凝胶缩短电泳时间,降低电压,增强凝胶浓度分子大小相近的DNA带不易分辨增加电泳时间,核准正确凝胶浓度DNA变性电泳前勿加热,用20mM Nacl 缓冲液稀释DNADNA链巨大,常规凝胶电泳不合适在脉冲凝胶电泳上分析电泳时Ladder扭曲配胶的缓冲液和电泳缓冲液不是同时配置同时配置,电泳缓冲液高出液面1-2mm即可电泳时电压过高电泳时电压不应超过20V/CM
第 1 页共 1 页。
