对甲苯磺酸的制备及应用_王刚
正确版对甲苯磺酸的合成及表征

方程式:
优:操作简便、产品纯、副产氯化氢可用水吸收制盐酸。 缺:氯磺酸价格高,产品生产成本高,缺乏市场竞争力。
03
Part Three 实验设计
3.1反应原理
确定合成路线如下: (100℃)
CH3 CH3
+
主反应:
+
H2SO4
H2O
(79%)
SO3H
副反应:
(8%)
CH3 CH3
+
SO3H
+
H2SO4
-
-
-
-
甲苯
清澈的无 色液体
92.14
−94 .99 67. 5
110.6
1.4967
0.866
邻甲苯 磺酸
无色晶体
170.2 0
128.8
-
-
02
Part Two 合成方法
2.1硫酸磺化
方程式:
优:由于硫酸价格低而具有一定的市场竞争力,且生产工艺简单、设备投资低 易操作,适用于小规模生产。 缺:此工艺的反应收率低、产品纯度低,反应进行时随着水的生成,硫酸浓度 下降,当浓度过低时,反应停止,产生大量的废酸,严重污染环境。
3.3.2硫酸浓度的影响
硫酸的浓度
98%
95%
90%
85%
(第二大组)
(四个数据点) 注: 1、5.5ml浓硫酸+0ml水 2、5.5ml浓硫酸+0.5ml水 3、5.5ml浓硫酸+1.1ml水 4、5.5ml浓硫酸+1.8ml水
3.3.3其他因素
☼ 回流时间的影响 回流时间 0.5h 1h 2h 3h
【2】:虞文良,袁琴,邓传芸,甲苯磺化反应工艺条件的实验研【J】。上 海应用工程技术学院学报,2002(3),192-194
项目五 对甲苯磺酸的生产解析

对甲苯磺酰氯水解过程必须严格控制水解温度,以防止冲料。采 用此方法的得到的对甲苯磺酸产品纯度高,但由于生产工艺的原因而 明显缺乏市场竞争力适用高品质、小批量生产。
2、各方法的质量产率、原料消耗量、生产成本比较 级估算(完成者:王海平)
二、三氧化硫 • 健康危害: 其毒性表现与硫酸同。对皮肤、粘膜等组织有强烈的刺激和腐蚀作用。可引起结膜炎、 水肿。角膜混浊,以致失明;引起呼吸道刺激症状,重者发生呼吸困难和肺水肿;高浓度引起喉 痉挛或声门水肿而死亡。口服后引起消化道的烧伤以至溃疡形成。严重者可能有胃穿孔、腹膜炎、 喉痉挛和声门水肿、肾损害、休克等。慢性影响有牙齿酸蚀症、慢性支气管炎、肺气肿和肝硬变 等。 • 环境危害: 对环境有危害,对大气可造成污染。 • 燃爆危险: 本品不燃,具强腐蚀性、强刺激性,可致人体灼伤。 • 急救措施 • 皮肤接触: 立即脱去污染的衣着并迅速擦净接触部分,之后用大量流动清水冲洗至少15分钟。 • 眼睛接触: 立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。 • 吸入: 迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即 进行人工呼吸。就医。 • 食入: 用水漱口,给饮牛奶或蛋清。就医。 • 消防措施 • 危险特性: 与水发生爆炸性剧烈反应。与氧气、氟、氧化铅、次亚氯酸、过氯酸、磷、四氟乙烯 等接触剧烈反应。与有机材料如木、棉花或草接触,会着火。吸湿性极强,在空气中产生有毒的 白烟。遇潮时对大多数金属有强腐蚀性。 • 有害燃烧产物: 氧化硫。 • 灭火方法: 本品不燃。消防人员必须佩戴过滤式防毒面具(全面罩)或隔离式呼吸器、穿全身防火 防毒服,在上风向灭火。尽可能将容器从火场移至空旷处。喷水保持火场容器冷却,直至灭火结 束。灭火时尽量切断泄漏源,然后根据着火原因选择适当灭火剂灭火。禁止用水和泡沫灭火。 泄漏应急处理 • 应急处理: 迅速撤离泄漏污染区人员至安全区,并立即隔离150m,严格限制出入。建议应急处 理人员戴自给正压式呼吸器,穿防酸碱工作服。尽可能切断泄漏源。若是液体。小量泄漏:用砂 土、蛭石或其它惰性材料吸收。大量泄漏:构筑围堤或挖坑收容。用泵转移至槽车或专用收集器 内,回收或运至废物处理场所处置。若是固体,用洁净的铲子收集于干燥、洁净、有盖的容器中。 若大量泄漏,收集回收或运至废物处理场所处置。
对甲苯磺酸性质及制作工艺

对甲苯磺酸一、对甲苯磺酸的主要性质对甲苯磺酸(英文名:Toluene-p-sulfonic acid) 是白色针状或粉末状结晶,易溶于水、醇和醚,极易潮解,易使棉织物、木材、纸张等碳水化合物脱水而碳化,难溶于苯、甲苯和二甲苯等苯系溶剂。
碱熔时生成对甲酚。
表1-1对甲苯磺酸的主要物理性质二、对甲苯磺酸的应用对甲苯磺酸是一种很强的有机酸,其酸性比苯甲酸强百万倍。
这种酸的独特之处是,它在通常情况下为固体,方便称用。
它的另一个优势是,与一些无机强酸相比没有氧化性,可以在一些情况下替代无机强酸。
1、催化剂在范围很广的反应中,包括醇化、生成缩醛、脱水、烷基化、脱烷基、贝克曼重排、聚合和解聚反应,它像硫酸一样有效,但效果比硫酸好因为它不会引起氧化或结炭等副反应,所以得到的产物纯度高,颜色浅。
2、有机合成常用对甲苯磺酸制造对甲苯磺酰胺、糖精、氯胺T、对甲苯磺酰氯和对砜二氯酰胺等。
对甲苯磺酸的最大用途是用于生产对甲酚。
3、稳定剂在工业上,常用对甲苯磺酸和氧化锌制备对甲苯磺酸锌。
在丙烯腈和丙烯酸甲酯或丙烯腈和偏二氯乙烯共聚过程中,可使用对甲苯磺酸锌作为稳定剂,其用量可达0.2%。
对甲苯磺酸还可用于酚醛、环氧和氨基塑料、家具滑漆、染料、粘合剂、合成抗糖尿病医药及电镀槽的防应力添加剂等方面,随着以二甲基甲酰胺为溶剂的一步法腈氯纶和腈纶装置的引进,作为稳定的高质量对甲苯磺酸的需求量,正在迅速增长。
三、对甲苯磺酸的主要合成方法磺化反应中使用的磺化剂主要有:发烟硫酸、硫酸、三氧化硫、二氧化硫、氯磺酸、硫酰氯、亚硫酸盐等。
甲苯磺化成对甲苯磺酸采用的磺化剂主要有硫酸、三氧化硫、氯磺酸三种。
合成对甲苯磺酸的主要方法有:硫酸磺化法、三氧化硫磺化法、氯磺酸磺化法、对甲苯磺酰氨水解法,它们各有自己的特点。
1、硫酸磺化法用硫酸磺化甲苯,是采用最多且历史最长的工艺。
磺化反应过程如下:磺化反应速度与甲苯浓度成正比,与硫酸含水量的平方成反比,所以需使用含水少的硫酸和纯度高的甲苯,但磺化反应是可逆反应,每消耗lmol的硫酸就生成lmol的水,水的浓度随反应的进行而逐渐升高,最后达到平衡,产生大量的废酸。
一种废硫酸制备对甲苯磺酸钠的环保生产方法[发明专利]
![一种废硫酸制备对甲苯磺酸钠的环保生产方法[发明专利]](https://img.taocdn.com/s3/m/5687320e856a561253d36f82.png)
专利名称:一种废硫酸制备对甲苯磺酸钠的环保生产方法专利类型:发明专利
发明人:王力立,刁正坤,刘萍,徐晓江
申请号:CN201710085014.1
申请日:20170217
公开号:CN106748900A
公开日:
20170531
专利内容由知识产权出版社提供
摘要:本发明公开了一种废硫酸制备对甲苯磺酸钠的环保生产方法,包括以下步骤:(1)将废硫酸浓缩至硫酸重量百分浓度大于70%,然后按照甲苯与硫酸的重量比为1.2‑2.0:1的比例加入甲苯,加热到100‑160℃反应,得到对甲苯磺酸;(2)将含对甲苯磺酸的溶液与氢氧化钠水溶液进行中和反应,得到对甲苯磺酸钠;(3)将含对甲苯磺酸钠的溶液经过活性炭脱色、结晶分离、干燥后得到对甲苯磺酸钠产品。
本发明不仅解决了废硫酸难以处理的问题,更为对甲苯磺酸钠制备工艺提供了新思路,对对甲苯磺酸钠的制备工艺具有极大的革新性和普遍应用性。
申请人:四川省中明环境治理有限公司
地址:620036 四川省眉山市东坡区复盛乡中塘村七组
国籍:CN
代理机构:成都弘毅天承知识产权代理有限公司
代理人:杨保刚
更多信息请下载全文后查看。
对甲苯磺酸的制备与应用

摘要本文主要对对甲苯磺酸的制备工艺和应用前景进行了研究,分别采用了传统工艺和两种改进工艺制备对甲苯磺酸,并对此进行了比较。
改进工艺克服了传统工艺的弊端。
第一种改进方案是运用了部分结晶选择性原理制备对甲苯磺酸。
甲苯与浓硫酸在甲苯沸腾回流(110℃)的条件下反应5h后,在80℃下加一定量的水使对甲苯磺酸结晶水合物从磺化混合液中析出,而间位和邻位两种异构物留在体系中,补充原料后继续反应,体系重新达到化学平衡状态,再析出产品。
如此循环反应-结晶过程,即抑制了新的间位和邻位异构物进一步产生,又使较纯的对位产物分离出体系。
优化了工艺条件,结果表明,该生产工艺路线为硫酸定量反应,无废酸或甲苯排放,产品纯度大于85%,对于高选择性生产对甲苯磺酸和清洁磺化过程具有重要的意义。
第二种改进工艺是将甲苯缓慢滴加到热的浓硫酸中,此工艺减短了实验时间,使操作时间为平时的四分之一,不但节省了反应物的用量,而且还大大提高了产量,改进的方法制备收率高,反应操作简单。
本文以对甲苯磺酸做催化剂催化合成了邻苯二甲酸二丁酯,其产率为84.0%,用浓硫酸作催化剂的产率为82.8%,尽管两者间的产率相近,但对甲苯磺酸没有腐蚀性,且在反应过程中不能产生废酸,对环境无污染。
关键词:对甲苯磺酸;磺化;结晶;催化剂AbstractThis paper focuses on the p-toluene sulfonic acid preparation process and application prospects were studied, respectively using traditional technology and two kinds of improved preparation process of p-toluene sulfonic acid, and make a comparison. Improved technology overcomes the defects of the traditional process. The first improvement plan is the use of partially crystalline selective preparation principle of p-toluene sulfonic acid. Refluxing toluene with concentrated sulfuric acid in toluene (110 ℃) 5h reaction conditions, adding a certain quantity of water at 80 ℃for crystalline hydrate precipitated from the sulfonated toluene sulfonic acid in the mixture, and meta - and ortho two isomers in the system, supplementary materials after reaction, system to achieve chemical equilibrium, then precipitation products. So the cycle reaction crystallization process, which inhibits the new meta - and ortho isomer to produce, and the para product is pure isolated system. Process conditions, the optimization results show that, the production process for sulfuric acid quantitative reaction, no waste acid or toluene emissions, the purity of product is more than 85%, high selectivity for the production has the vital significance to the toluene sulfonic acid and clean the sulfonation process. Process improvement of second is concentrated sulfuric acid to toluene is slowly added into hot, this process to shorten the experimental period, the operation time is usually 1/4, not only to save the amount of reactants, but also greatly improve the yield, high yield improved method of operation is simple, reactiThe catalyst p-toluene sulfonic acid dibutyl phthalate was synthesized, its yield is 84%, with concentrated sulfuric acid as catalyst. The yield is 82.8%, although similar between the yield, but no corrosive p-toluene sulfonic acid, and can not waste acid produced in the reaction process, no pollution to the environment.Keywords: catalyst p-toluene sulfonic acid sulfonation crystallization目录第1章文献综述 (1)1.1 对甲苯磺酸的性质 (6)1.2对甲苯磺酸的制备方法 (6)1.2.1硫酸磺化法 (6)1.2.2三氧化硫磺化法 (7)1.2.3 氯磺酸磺化法 (8)1.3对甲苯磺酸的精制 (8)1.3.1真空精馏法 (8)1.3.2水稀释法 (8)1.3.3苯—乙醇法 (9)1.4对甲苯磺酸的应用 (9)1.4.1催化剂 (9)1.4.2有机合成 (9)1.4.3稳定剂 (9)1.5选题意义 (9)第2章实验部分 (11)表2.1实验药品 (11)表2.2实验仪器 (11)2.3制备对甲苯磺酸的传统工艺 (12)2.3.1原理 (12)2.3.2实验步骤 (12)2.3.3传统工艺存在的问题 (12)2.4工艺改进一 (13)2.4.1改进原理 (13)2.4.2 实验过程 (14)2.5工艺改进二 (14)2.5.1改进原理 (14)2.5.2实验步骤 (14)2.6实验改进的结果讨论 (14)表2.6.1工艺一实验结果讨论 (15)表2.6.2工艺二 (15)第3章对甲苯磺酸的应用 (16)3.1对甲苯磺酸的应用 (16)3.1.l催化剂 (16)3.1.2有机合成 (16)3.1.3稳定剂 (16)3.2对甲苯磺酸合成酯 (16)3.2.1对甲苯磺酸催化合成邻苯二甲酸二丁酯 (16)3.2.2 酯的合成 (17)3.3 结果与讨论 (17)第4章结论 (19)致谢 (21)第1章文献综述对甲苯磺酸是贾沃斯基(Jaworsky)于1865年用硫酸磺化而首先制得的,该产品是无色或白色片状或柱状结晶,易溶于醇,难溶于苯,对皮肤、眼睛、黏膜有刺激性。
对甲苯磺酸制备和乙酰水杨酸的合成

对甲苯磺酸制备
一.实验原理
原先教材实验方法存在如下弊端:
1.分水器的容积约有15~25mL,而加入的甲苯仅有25mL,大部分的甲苯在反应初期就被蒸发到分水器中。
留在反应器中的甲苯量少。
2.由于反应器中的甲苯量少,反应温度高,反应物料易炭化变黑。
3.原实验方案是反应物料预先一次性混合在一起的,慢慢加热的操作方式生成较多的邻位异构体,所形成的物料粘稠,抽滤困难所以对实验进行改进:
温度高有利于对甲苯磺酸的生成以及对甲苯磺酸一水化合物能从稀硫酸中结晶出来的原理,采用浓硫酸过量,把甲苯滴加到90~100摄氏度的浓硫酸中反应
二.改进实验药品用量和实验仪器
甲苯15ml 、浓硫酸20ml、水5ml
三口烧瓶一侧连接温度计,一侧接恒压漏斗,中间接分水器,分水器上再接冷凝管
三.实验步骤
四.实验结果
产物性状:呈为微粉红色的晶体产量11.2g 产率=11.2/24.2=46.3%
乙酰水杨酸的合成一.实验原理
M=138.12 M=102.09 M=180.15
二.实验试剂
水杨酸3g、Na2CO3 0.15g、醋酸酐 3.2 ml 三.实验步骤
四.实验结果
产物性状:白色颗粒状晶体产量:2.3 g 产率=2.3/3.9=58%。
对甲苯磺酸的制备
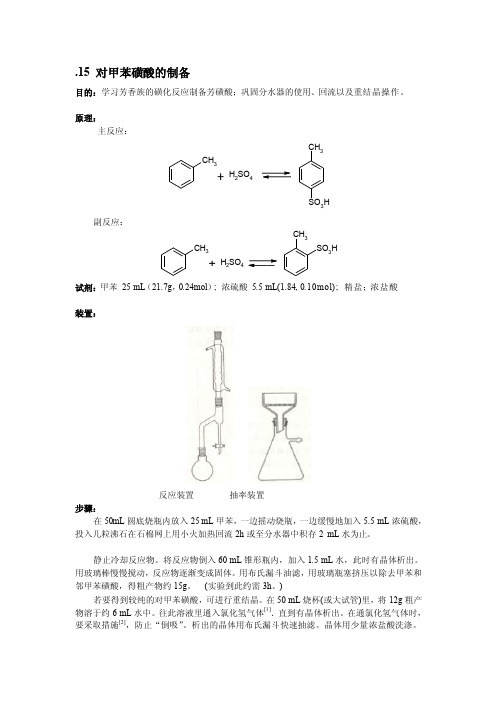
.15 对甲苯磺酸的制备目的:学习芳香族的磺化反应制备芳磺酸;巩固分水器的使用、回流以及重结晶操作。
原理:主反应:CHH 2SO 4CH 3SO 3H副反应:CHH 2SO 4CH 3SO 3H试剂:甲苯 25 mL (21.7g ,0.24mol ); 浓硫酸 5.5 mL(1.84, 0.10mol); 精盐;浓盐酸装置:反应装置 抽率装置步骤:在50mL 圆底烧瓶内放入25 mL 甲苯,一边摇动烧瓶,一边缓慢地加入5.5 mL 浓硫酸,投入几粒沸石在石棉网上用小火加热回流2h 或至分水器中积存2 mL 水为止。
静止冷却反应物。
将反应物倒入60 mL 锥形瓶内,加入1.5 mL 水,此时有晶体析出。
用玻璃棒慢慢搅动,反应物逐渐变成固体。
用布氏漏斗油滤,用玻璃瓶塞挤压以除去甲苯和邻甲苯磺酸,得粗产物约15g 。
(实验到此约需3h 。
)若要得到较纯的对甲苯磺酸,可进行重结晶。
在50 mL 烧杯(或大试管)里,将12g 粗产物溶于约6 mL 水中。
往此溶液里通入氯化氢气体[1].直到有晶体析出。
在通氯化氢气体时,要采取措施[2],防止“倒吸”。
析出的晶体用布氏漏斗快速抽滤。
晶体用少量浓盐酸洗涤。
用玻璃瓶塞挤压去水分,取出后保存在干燥器里。
纯对甲苯磺酸一水合物为无色单斜晶体,熔点96℃;对甲苯磺酸熔点104-105℃。
注释:[1] 此操作必须在通风橱内进行。
产生氯化氢气体最常用的方法是:在广口圆底烧瓶里放入精放,加入浓盐酸至浓盐酸的液面盖住食盐表面。
配一橡皮塞,钻三孔,一孔插滴液漏斗,一孔插压力平衡管,一孔插氯化氢气体导山管.滴液漏斗上口与玻璃平衡管通过橡皮塞紧密连接(不能漏气)。
在滴液漏斗中放入浓硫酸。
滴加浓硫酸,就产生氯化氢气体。
[2] 为防止“倒吸”,可不用插入溶液中的玻璃管来引入氯化氢气体,而是使气体通过一略微倾斜的倒悬漏斗让溶液吸收,漏斗的边缘有一半浸入溶液中,另一半在液面之上。
问题:1)利用什么性质除去对甲苯磺酸中的邻位衍生物?2)在本实验条件下,会不会生成相当量的甲苯二磺酸?为什么?。
一种通过甲苯磺化制备对甲苯磺酸的方法[发明专利]
![一种通过甲苯磺化制备对甲苯磺酸的方法[发明专利]](https://img.taocdn.com/s3/m/59065e78ce84b9d528ea81c758f5f61fb7362803.png)
(10)申请公布号 CN 101845004 A(43)申请公布日 2010.09.29C N 101845004 A*CN101845004A*(21)申请号 201010151255.X(22)申请日 2010.04.16C07C 309/30(2006.01)C07C 303/08(2006.01)C07C 303/06(2006.01)(71)申请人苏州市兴业化工有限公司地址215151 江苏省苏州市新区浒墅关工业园浒华路8号(72)发明人王进兴 王文浩 朱文英(74)专利代理机构苏州创元专利商标事务所有限公司 32103代理人范晴(54)发明名称一种通过甲苯磺化制备对甲苯磺酸的方法(57)摘要本发明公开了一种制备对甲苯磺酸的方法,其特征在于所述方法包括将甲苯与磺化剂产生磺化反应后加入复配剂结晶而成;所述复配剂由至少两种不同的对甲苯磺酸溶剂构成。
该工艺制备的对甲苯磺酸成品含量高、成品中对甲苯磺酸的纯度高;经检测成品含量≥98.5%,对甲苯磺酸的纯度≥99.5%,而且放置后不易结块。
该工艺是集合成与精制于同一反应体系中完成,流程短,操作方便,提高了生产效率,降低了劳动强度。
(51)Int.Cl.(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书 1 页 说明书 4 页权 利 要 求 书CN 101845004 A1/1页1.一种制备对甲苯磺酸的方法,其特征在于所述方法包括将甲苯与磺化剂产生磺化反应后加入复配剂结晶而成;所述复配剂由至少两种不同的对甲苯磺酸溶剂构成。
2.根据权利要求1所述的方法,其特征在于所述方法中所述磺化反应为采用气相磺化法或液相磺化法将甲苯与磺化剂进行反应;所述磺化剂选自硫酸、三氧化硫、氯磺酸。
3.根据权利要求1所述的方法,其特征在于所述方法中所述对甲苯磺酸溶剂选自水、甲醇、乙醇、苯甲醇、乙醚。
4.根据权利要求1所述的方法,其特征在于所述方法中复配剂为水和乙醇的混合物,水与乙醇的质量比在1∶1~5∶1范围内。
论甲苯

甲苯分子比例模型甲苯的性质:甲苯是最简单,最重要的芳烃化合物之一。
在空气中,甲苯只能不完全燃烧,火焰呈黄色。
甲苯的熔点为-95 ℃,沸点为111 ℃。
甲苯带有一种特殊的芳香味(与苯的气味类似),在常温常压下是一种无色透明,清澈如水的液体,对光有很强的折射作用(折射率:1,4961)。
甲苯几乎不溶于水(0,52 g/l),但可以和二硫化碳,酒精,乙醚以任意比例混溶。
在氯仿,丙酮和大多数其他常用有机溶剂中也有很好的溶解性。
甲苯的粘性为0,6 mPa s ,也就是说它的粘稠性弱于水。
甲苯的热值为40.940 kJ/kg ,闪点为4 ℃,燃点为535 ℃。
甲苯的用途:甲苯大量用作溶剂和高辛烷值汽油添加剂,也是有机化工的重要原料,但与同时从煤和石油得到的苯和二甲苯相比,目前的产量相对过剩,因此相当数量的甲苯用于脱烷基制苯或岐化制二甲苯。
甲苯进行侧链氯化得到的一氯苄、二氯苄和三氯苄,包括它们的衍生物苯甲醇、苯甲醛和苯甲酰氯(一般也从苯甲酸光气化得到),在医药、农药、染料,特别是香料合成中应用广泛。
甲苯的环氯化产物是农药、医药、染料的中间体。
甲苯氧化得到苯甲酸,是重要的食品防腐剂(主要使用其钠盐),也用作有机合成的中间体。
甲苯及苯衍生物经磺化制得的中间体,包括对甲苯磺酸及其钠盐、CLT 酸、甲苯-2,4-二磺酸、苯甲醛-2,4-二磺酸、甲苯磺酰氯等,用于洗涤剂添加剂,化肥防结块添加剂、有机颜料、医药、染料的生产。
甲苯硝化制得大量的中间体。
可衍生得到很多最终产品,其中在聚氨酯制品、染料和有机颜料、橡胶助剂、医药、炸药等方面最为重要。
甲苯的制取:在工业生产中主要以石油为原料。
我国石油级甲苯的生产主要有两种生产路线:1、由炼厂抽提,原料是催化重整汽油;2、由石化厂抽提,原料是加氢裂解汽油(PY GAS )。
在第二次世界大战期间,由于石油供应的匮乏,德国也尝试过用苯或甲醇为原料的制备法。
在制备过程中主要的副产品是乙烯和丙烯。
对甲苯磺酸制备实验报告

对甲苯磺酸制备实验报告甲苯磺酸制备实验报告引言甲苯磺酸是一种重要的有机合成中间体,广泛应用于医药、染料、涂料等领域。
本实验旨在通过对甲苯磺酸的制备过程进行研究,探索最优的制备条件和方法。
实验原理甲苯磺酸的制备方法主要有两种:一种是通过甲苯与浓硫酸反应得到甲苯磺酸;另一种是通过甲苯与亚硝酸钠反应生成对甲基苯磺酸,再通过酸化反应得到甲苯磺酸。
实验步骤1. 实验前准备准备好所需的实验器材和试剂,包括甲苯、浓硫酸、亚硝酸钠等。
2. 反应条件选择根据实验要求和已有文献资料,选择适宜的反应条件。
如温度、反应时间、反应物的摩尔比等。
3. 反应操作将甲苯和浓硫酸按一定比例加入反应瓶中,加热搅拌,控制反应温度在适宜的范围内。
反应结束后,将反应混合物进行冷却。
4. 结晶分离将反应混合物转移到漏斗中,加入适量的冷水进行结晶分离。
通过过滤或离心等方式将结晶物分离出来。
5. 洗涤和干燥用冷水洗涤分离得到的结晶物,去除杂质。
然后将洗净的结晶物晾干或用低温烘干。
6. 验收对制备得到的甲苯磺酸进行质量验收,包括外观、纯度、溶解性等方面。
实验结果与讨论通过实验操作,成功合成了甲苯磺酸。
经过结晶分离、洗涤和干燥等步骤,得到了白色结晶状的甲苯磺酸产物。
对产物进行质量验收,外观无明显杂质,纯度较高,溶解性良好。
在实验过程中,我们发现反应温度对甲苯磺酸的产率和纯度有重要影响。
过高的温度可能导致副反应的发生,降低产率和纯度。
因此,在实验中应控制好反应温度,保证反应的高效进行。
此外,亚硝酸钠的用量也是影响甲苯磺酸产率的关键因素。
过量的亚硝酸钠可能导致副反应的发生,降低产率。
因此,在实验中应根据实际需要合理控制亚硝酸钠的用量。
结论通过本次甲苯磺酸制备实验,我们成功合成了高纯度的甲苯磺酸。
实验结果表明,反应温度和亚硝酸钠的用量是影响甲苯磺酸产率和纯度的重要因素。
在实际应用中,可以根据需要对反应条件进行调整,以获得更好的制备效果。
总结甲苯磺酸作为一种重要的有机合成中间体,在医药、染料、涂料等领域具有广泛的应用前景。
对甲苯磺酸的制备

CH3 + H2O SO3H
甲苯80.84%, 水19.16%, 共沸物:b.p. 84.1℃
+ H2SO4
副反应:
CH3
mp 67.5℃, bp128.8 ℃, 微溶于甲苯
CH3 SO3H + H2O
+ H2SO4
有机化学实验
Chem is try !
二、实 验 原 理:
实验设பைடு நூலகம்:
本实验反应可逆,通过加大反应物甲苯的浓度和 除去生成物水(与甲苯形成共沸物)来促使平衡移动。 本实验用过量的甲苯来除去邻位副产物。
化学化工学院
实验二十七
对甲苯磺酸的制备
(4学时) 主讲教师:林东恩
有机化学实验
Chem is try !
有机化学实验
Chem is try !
一、实 验 目 的:
了解芳烃的磺化反应过程; 掌握分水器的使用方法;
理解邻甲苯磺酸和对甲苯磺酸的性质区别
有机化学实验
Chem is try !
二、实 验 原 理:
实验步骤及现象记录格式:
时间
00:00
实验步骤
分布按顺序详细列出
现象
每位同学现象不尽相同,需仔细记 录,每步骤现象与左边步骤对齐。
备注
化学化工学院
请同学们先凭实验卡领取仪器, 然后各自进行实验操作! 请同学们下次实验前预习 “己二酸的制备” !
有机化学实验
Chem is try !
磺化反应:
SO3H + H2SO4 + H2O
CH3
43% 4%
CH3
32% 6%
CH3
13% 8%
正确版对甲苯磺酸的合成及表征

(第一大组)
3.3.2硫酸浓度的影响
注: 1、5.5ml浓硫酸+0ml水 2、5.5ml浓硫酸+0.5ml水 3、5.5ml浓硫酸+1.1ml水 4、5.5ml浓硫酸+1.8ml水
(第二大组) (四个数据点)
3.3.3其他因素
• 回流时间的影响
(第三大组)
(四个数据点)
• 提纯过程中硫酸浓度(取决于加水量)的影响
• 在有机合成中,常用于生产对甲苯磺酰氯、对甲苯磺酰胺和对甲酚等。另外 对甲苯磺酸还可用做酚醛、环氧、氨基塑料、家具清漆、染料和粘合剂等方 面的添加剂。
2.2对甲苯磺酸
• 分子式:C7H8O3S
结构式:
• 分子量:172.20
• 性状:白色针状或粉末状结晶,易溶于 水 、 醇和醚,极易潮解,易使棉织物 、木材、纸张等碳水化合物脱水而碳化,难溶于苯、甲苯和二甲苯等苯系溶 剂。碱熔时生成对甲酚,它是不具氧化性的有机强酸,常见的是对甲苯磺酸 一水合物(TsOH·H2O)或四水合物(TsOH·4H2O)。
SO3H
+
H2O (13%)
3.1反应原理
我们选择用硫酸做磺化剂,理由是:硫酸价格低、易操作,适合实验室合成。 该反应为可逆反应,在过量且沸腾的甲苯中滴加浓硫酸,甲苯蒸气通过冷凝分水器装
置将反应生成的水分离,这样一方面能保持较高的硫酸浓度,维持一定的反应速度; 另一方面还能抑制逆向的水解反应。 甲苯过量的好处在于甲苯的沸点相对较低(甲苯110℃、对甲苯磺酸140℃),并且容 易处理。 磺化反应速度与甲苯浓度成正比,与硫酸含水量的平方成反比,所以需要使用纯度高 的甲苯和含水量少的硫酸。
2.3原料与产物的物理常数
2.3原料与产物的物理常数
一种高纯对甲苯磺酸铁制备方法[发明专利]
![一种高纯对甲苯磺酸铁制备方法[发明专利]](https://img.taocdn.com/s3/m/1ab8507468eae009581b6bd97f1922791688beb9.png)
(10)申请公布号 (43)申请公布日 2014.12.31C N 104250220A (21)申请号 201310262260.1(22)申请日 2013.06.27C07C 309/30(2006.01)C07C 303/32(2006.01)(71)申请人张雪琴地址231507 安徽省合肥市庐江县冶父山镇幸福村玉坟村民组(72)发明人张雪琴(74)专利代理机构苏州华博知识产权代理有限公司 32232代理人孟宏伟(54)发明名称一种高纯对甲苯磺酸铁制备方法(57)摘要本发明提供一种高纯对甲苯磺酸铁制备方法,其特征在于,所述制备方法以氢氧化铁为铁源与对甲苯磺酸进行反应,产物经过滤后,再经喷雾干燥得到合格对甲苯磺酸铁;所述氢氧化铁与对甲苯磺酸的摩尔比为1:1~3.5。
本发明方法能够制得水分低、各种阴离子含量低、颗粒细、溶解性高、符合电子产品要求的高纯对甲苯磺酸铁,并且更适合工业化生产。
(51)Int.Cl.权利要求书1页 说明书3页(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书1页 说明书3页(10)申请公布号CN 104250220 A1/1页1.一种高纯对甲苯磺酸铁制备方法,其特征在于,所述制备方法以氢氧化铁为铁源与对甲苯磺酸进行反应,产物经过滤后,再经喷雾干燥得到高纯对甲苯磺酸铁;所述氢氧化铁与对甲苯磺酸的摩尔比为1:1~3.5。
2.如权利要求1所述的高纯对甲苯磺酸铁制备方法,其特征在于,所述氢氧化铁与对甲苯磺酸的摩尔比1:1.8~2.5。
3.如权利要求1或2所述的高纯对甲苯磺酸铁制备方法,其特征在于,所述反应温度为60~120℃。
4.如权利要求3所述的高纯对甲苯磺酸铁制备方法,其特征在于,所述反应温度为85~110℃。
5.如权利要求1或2所述的高纯对甲苯磺酸铁制备方法,其特征在于,所述反应时间为1~7h 。
6.如权利要求5所述的高纯对甲苯磺酸铁制备方法,其特征在于,所述反应时间为3.5~5.5h 。
对甲苯磺酸的合成

对甲苯磺酸的合成
沈国平;孙根新
【期刊名称】《精细化工原料及中间体》
【年(卷),期】2004(000)007
【摘要】本文论述了合成对甲苯磺酸的四种方法,分别采用硫酸、三氧化硫、氯磺酸等三种不同的磺化剂,并对这四种方法进行了比较,认为采用三氧化硫磺化法生产对甲苯磺酸具有一定的优势。
同时简述了对甲苯磺酸的精制和分析方法。
【总页数】2页(P24-25)
【作者】沈国平;孙根新
【作者单位】浙江嘉化实业股份有限公司,浙江嘉兴314021
【正文语种】中文
【中图分类】TQ247.51
【相关文献】
1.对甲苯磺酸改性SBA-15的合成及催化合成乙酸正丁酯 [J], 田志茗;邓启刚;孙慧;赵德丰
2.超声波辐射对甲苯磺酸催化合成类辣椒素的工艺研究 [J], 岳金方;侯海超;呙茗婕;罗志臣;袁书婷
3.超声辅助对甲苯磺酸催化合成阿司匹林的研究 [J], 何凯君;吴叶群;张泽蓉;谢广洋;刘杰润;廖清怡;林泽鸿;赖吉敏;李艳萍
4.硅胶负载对甲苯磺酸催化合成环己烯 [J], 刘天宝;彭娜;徐震;王攀攀;彭艳芬
5.对甲苯磺酸催化合成油酸油酯 [J], 王胜利
因版权原因,仅展示原文概要,查看原文内容请购买。
液碱法合成对甲基苯酚工艺研究

液碱法合成对甲基苯酚工艺研究
陈贵军;岳涛
【期刊名称】《山东化工》
【年(卷),期】2022(51)16
【摘要】对甲基苯磺酸钠与液碱在高温下发生碱解反应得到对甲基苯酚(目标化合物),反应条件为:n(对甲苯磺酸钠)∶n(氢氧化钠)=1∶4、液碱浓度为50%,280℃搅拌4 h反应收率95%。
反应结束后以二氧化硫酸化分层后精馏得到对甲基苯酚,水溶液减压浓缩得到亚硫酸钠固体。
该方法为工业生产提供了参考。
【总页数】3页(P49-51)
【作者】陈贵军;岳涛
【作者单位】青岛科技大学山东化工研究院山东省水相有机合成及高效清洁分离工程技术研究中心
【正文语种】中文
【中图分类】O625.312
【相关文献】
1.固体超强酸SO2-4/Fe2O3催化甲基叔丁基醚与苯酚合成对叔丁基苯酚的研究
2.一种液相加氢合成对氨基苯酚的生产工艺
3.苯酚亚硝化——硫碱还原法合成对氨基苯酚工艺的研究
4.4-叔丁基-2-(α-甲基苄基)苯酚萃取分离碱液中的钾和钠
5.4-叔丁基-2-(α-甲基苄基)苯酚萃取分离碱液中的钾和钠
因版权原因,仅展示原文概要,查看原文内容请购买。
