无机物的推断及检验(完整版)
无机物的推断及检验

无机物的推断及检验一、选择题1.图示为含同一种元素的a、b、c、d、e五种物质的转化关系。
其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应水化物,则a不可能是()①F2②N2③C ④SA.只有① B.②和④C.③和④ D.①和③2.某白色固体可能由①NH4Cl ②AlCl3③NaCl ④AgNO3⑤KOH中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀生成。
对原固体的判断不正确的是()A.肯定存在① B.至少存在②和⑤C.无法确定是否有③ D.至少存在①、④、⑤3.在下列溶液中,分别加入少量的二氧化锰粉末,可能发生反应的是()A.KI溶液 B.酸性KI溶液C.KOH溶液 D.K2CO3溶液4.下列各组溶液,不用其它试剂就不能将它们区别开的是()A.石灰水和碳酸钠 B.偏铝酸钠和盐酸C.石灰水和磷酸 D.硫酸铝和氢氧化钠5.气体X可能含有NH3、Cl2、HBr、CO2中的一种或几种。
已知X通入AgNO3溶液时产生淡黄色沉淀,该沉淀不溶于稀硝酸,若将X通入澄清石灰水中,不见沉淀生成,有关气体X 的成分说法正确的是()A.一定含HBr B.一定不含CO2C.一定不含NH3,可能含有CO2 D.可能含有CO2和Cl26.下列各组溶液,常温下用化学方法、但不用任何其它试剂就可以将它们区别开的是()A.硫酸铜、氯化钡、氢氧化钠、硝酸钡B.氢氧化钙、氯化钠、碳酸钠、氯化钡C.氯化亚铁、硫酸钠、氯化铝、氢氧化钠D.氯化钡、硝酸钾、碳酸钠、硫酸钠7.下列实验所得的结论正确的是()A.在含S2-、Br-、I-离子的溶液中通入Cl2,再滴入淀粉溶液后显蓝色,则溶液中不再有S2-B.某盐与盐酸反应生成的气体能使石灰水变浑浊,则该盐一定是碳酸盐C.在Cu(NO3)2和AgNO3的混合溶液中,加入一定量铁粉,过滤后在母液中加盐酸,发现有白色沉淀析出,则滤渣中可能有铜和银D.检验Na2SO3溶液是否被氧化,取样加入少量Ba(NO3)2,再用HNO3酸化,若有白色沉淀析出,则说明Na2SO3已被氧化8.某固体X与浓H2SO4共热时能生成一种酸性气体,把氨水加入X溶液中,能生成白色沉淀,继续加氨水,沉淀消失,则X可能是()A.AlCl3 B.AgNO3 C.CuCl2 D.Mg(NO3)29.有X、Y、Z三种试液,在Ba(OH)2溶液中加入X,有白色沉淀生成,在沉淀中加入Y ,沉淀溶解并产生气体,最后加入Z 又产生白色沉淀,则试液X 、Y 、Z 可能依次是( )A .Na 2CO 3、H 2SO 4、MgSO 4B .Na 2CO 3、Na 2SO 3、Na 2SO 4C .K 2CO 3、HCl 、AgNO 3D .Na 2CO 3、HNO 3、MgSO 410.下列各组溶液,只用组内溶液互相混合的方法就能鉴别的组别是( )A .Na 2SO 4、BaCl 2、KNO 3、NaClB .Na 2SO 4、Na 2CO 3、BaCl 2、HClC .NaOH 、Na 2SO 4、FeCl 3、MgCl 2D .NaCl 、AgNO 3、NaNO 3、HCl二、非选择题11.已知:Ag (NH 3)2+2H +=Ag ++2NH 4+,今有一白色固体,可能是由 Al 2(SO 4)3,AgNO 3,BaCl 2,NH 4Cl ,KOH ,Na 2S 中的2种或3种组成,为确 定该白色固体组成,进行以下实验:取白色固体少许,加入适量蒸馏水充分振荡,得到无色 溶液;取无色溶液少许,滴加稀硝酸,有白色沉淀生成。
陌生无机化合物的推断

信息提供型陌生无机物的推断1、某物质M具有热导率高、高温下电绝缘性好、高温下材料强度大、无毒等优异性能。
经检测,M中只含有两种短周期元素。
现取82 g M溶于适量的NaOH溶液中恰好反应,得到无色溶液A和44.8 L气体B(气体体积为标准状况下),该气体能使红色石蕊试纸变蓝。
往反应后的溶液中逐滴加入盐酸,可观察到溶液先变浑浊后变澄清。
物质B有如下转化关系:,E是一种强酸。
将C和D的混合物溶解在接近零度的水中,即得到一种弱酸F的水溶液。
(1)物质M的化学式为,属于晶体(填“分子”、“离子”、“原子”等)。
(2)弱酸F是一种比醋酸酸性稍强的弱酸,很不稳定,通常在室温下易分解。
要制得F溶液,可以往冷冻的其钠盐浓溶液中加入或通入某种物质,下列物质不适合使用的是a.盐酸 b.二氧化碳 c.稀硫酸 d.二氧化硫(4)工业碱性废水中若含有NO2-,可用铝粉除去。
已知此反应体系中检测到B气体。
写出上述反应的离子方程式。
若改用电解法将废水中NO2-转换为N2除去,N2将在(填“阴极”或“阳极”)生成,电极反应为。
(5)一种活性很强的化合物G,其组成为NH5,G遇水能产生两种气体,其中一种气体为B,则物质G的电子式为。
2、汽车安全气囊是行车安全的重要保障。
当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。
为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。
经组成分析,确定该粉末仅Na、Fe、N、O四种元素。
水溶性试验表明,固体粉末部分溶解。
经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0 g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72 L。
单质乙就在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质。
化合物丙与空气接触可转化为可溶性盐。
(1)甲的化学式为,丙的电子式为。
高三化学二轮专题复习——无机推断知识总结

高三化学二轮专题复习——无机推断知识总结无机推断知识总结一、解题思路和步骤:无机推断题解题思路和步骤:阅读题目一挖掘信息f选择信息一查找突破口一推断整理f得出结论一规范书写★阅读题目:注意限制性语句,专门隐含的条件,找准找全。
★选择信息:将试题信息与大脑或教材知识相比较,进行加工、选择,找岀有用信息。
★查找突破口:突破口这是解题的关键。
突破口能够是反应条件、反应现象、也可能是专门性质(如气体的生成、沉淀的生成、颜色的变化、溶解度、专门反应等)★规范书写的内容:物质的拿称、化学式、结构式、结构简式、电子式、表示物质形成过程的电子表达式、化学方程式、离子方程式、电离方程式。
二、査找突破口需巩固的知识1、物质的特点现象:(1)物质的颜色:有色气体单质:F:、Cl=、03苴他有色单质:Br:(深红色液体,蒸气为红棕色)、L (紫黑色固体)、S (淡黄色固体)、 Cu (紫红色固体)、P(白磷是白色固体,红磷是暗红色固体)、Si (灰黑色晶体)、C (黑色粉未)无色气体单质:%、0:、比有色气体化合物:N0:(红棕色)黄色固体:S、Na©、AgBr (浅黄)、Agl、AgaPOj (黄色)黑色固体:FeO、Fe』:、MnO:、C、CuS、PbS、Ag=S、CuO红色固体:Fe(OH),(红褐色)、FeO (红棕色)、CucO (红色)、Cu (红色)、红磷(暗红〕蓝色固体:五水合硫酸铜(胆矶或蓝矶)CuSO. ・5H:0、Cu(OH)s;绿色固体:七水合硫酸亚铁(绿矶〕FeSO.・7比0:紫黑色固体:KMnOi、碘单质。
有色离子(溶液):Cf (蓝色或绿色)、F』(浅绿)、Fe”(棕黄)、MnO:(紫红色)、Fe(SCN)54(血红色〕、(淀粉遇碘单质(IJ水溶液呈蓝色、 Fe"与苯酚呈紫色)不溶于稀酸的白色沉淀:AgCl、BaSO:、Ag:SO.不溶于稀酸的黄色沉淀:S、AgBr. Agl焰色反应显黄色的是钠元素,显紫色的钾元素(透过蓝色钻玻璃观看)(2)气体特点:常见的气体有:单质:比、Cl=、0=氢化物:讯、H$、HC1.氧化物:CO:、SO:、NO、NO:、CO有机物:CHt、沁 C-Hi. HCHO如能使品红溶液褪色加热又复原红色的气体是S0=; CL能使品红溶液褪色加热不能复原红色:滴有石裁试液的C0:(或SOJ溶液加热后红色变紫色;滴有甲基橙溶液的C0=(或SOJ溶液加热后红色变橙色或黄色等。
无机推断的思路与技巧(附练习与答案)
无机推断的思路与技巧(附练习和答案)1、题型“三特点”:“无机推断题”作为高考考查元素化合物知识的热点题型,它的主要特点是:①结构紧凑、文字表述少②包含信息多、综合性强,思维能力要求高③具有很高的区分度和很好的选拔功能。
它不仅考查考生对元素及其化合物主干知识掌握的情况,更能考查考生思维的敏捷性、发散性、严密性和分析推理综合应用元素化合物知识的能力。
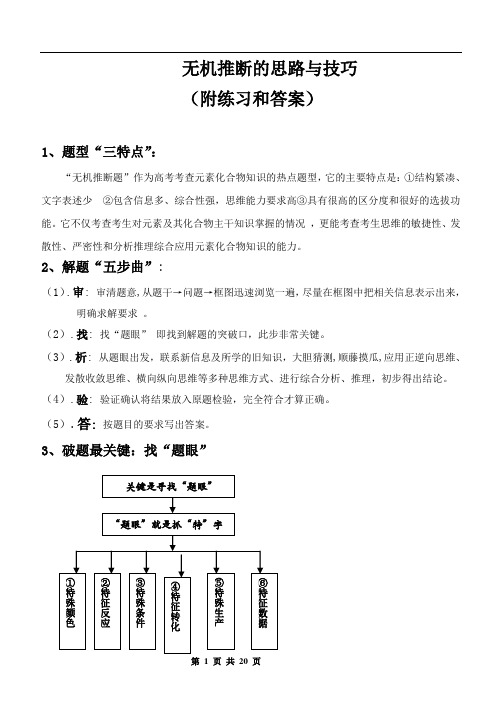
2、解题“五步曲”:(1).审: 审清题意,从题干→问题→框图迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求。
(2).找: 找“题眼”即找到解题的突破口,此步非常关键。
(3).析: 从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆向思维、发散收敛思维、横向纵向思维等多种思维方式、进行综合分析、推理,初步得出结论。
(4).验: 验证确认将结果放入原题检验,完全符合才算正确。
(5).答:按题目的要求写出答案。
3、破题最关键:找“题眼”4.常见“题眼”归类解析方法一:根据物质的特殊颜色推断知识准备:物质颜色(1)有色固体:红色:Cu 、Cu 2O 、Fe 2O 3; 褐色:Fe(OH)3; 黄色:AgI 、Ag 3PO 4;浅黄色:S 或Na 2O 2或AgBr ; 蓝色:Cu(OH)2; 紫黑色:KMnO 4 I 2 黑色:炭粉、CuO 、FeO 、FeS 、CuS 、Ag 2S 、PbS ; 白色:Fe(OH)2、CaCO 3、BaSO 4、AgCl 、BaSO 3;(2) 有色溶液:Fe 2+(浅绿色)、Fe 3+(黄色)、Cu 2+(蓝色)、MnO 4-(紫红色)、[]±y x SCN Fe )((x=1~6)(红色)(3).有色气体:Cl 2(黄绿色)、Br 2(g)(红棕色)、NO 2、(红棕色)、I 2(紫色)O 3(淡蓝色)例1、下图表示各物质之间的转化关系。
已知:A 、D 、F 、H 均为单质,X 常温下为无色液体,B 为淡黄色固体,J 溶于酸得到黄色溶液。
高考化学复习 无机物的推断

魁夺市安身阳光实验学校高考化学复习无机物的推断1.复习重点:1、帮助学生熟练掌握重要的元素(CL、Br、N、S、H、O、Si、Na、Mg、Al、Fe、Cu等)单质及其化合物的性质,以及它们之间存在的转化关系,是分析解决推断题的必备的基础知识。
2、以网络的形式让学生自我找出知识点之间的内在联系,构筑学生自我的知识框架3、主要题型有选择题和框图题两大题型,解选择题要谨防题设的陷井。
解框图题不外乎两种方法,一种是根据特殊性质找到题眼后顺藤摸瓜,另一种是缩小范围后发散推理。
2.难点聚焦1.氯元素的知识网络2.次氯酸、漂白粉的性质HClO分子的结构式为H-O-Cl(氧处于中心),所以电子式为。
次氯酸、次氯酸钙等有多方面的性质,经常用到以下几方面性质:(1)HClO是一种弱酸,与碳酸比较电离能力有如下关系:H2CO3>HClO>HCO3-,请分析下列反应:少量二氧化碳通入NaClO溶液中:NaClO + CO2+H2O=NaHCO3+HClO氯气通入碳酸氢钠溶液中: Cl2+NaHCO3=NaCl+CO2↑+HClO(2)ClO-是一种弱酸的酸根离子,能发生水解反应:ClO-+H2O HClO+OH-,所以次氯酸钙溶液显碱性。
若遇到铁盐、铝盐易发生双水解:3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO(3)HClO和ClO-都具有强氧化性,无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,但不能使品红溶液褪色。
如:硫酸亚铁溶液遇漂白粉:2Fe2+ + 5ClO- + 5H2O = 2Fe(OH)3↓+Cl- + 4HClO 漂白粉遇亚硫酸酸盐:ClO-+SO32-=Cl-+SO42-(4)HClO见光易分解:2HClO−→−∆2HCl+O2↑(5)次氯酸钙中的Ca2+、ClO-可以表现出一些综合性质。
如少量二氧化碳通入次氯钙溶液中:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO注意理解二氧化碳、碳酸钠、碳酸氢钠分别跟次氯酸钙溶液反应的差异:Ca(ClO)2+Na2CO3=CaCO3↓+2NaClOCa(ClO)2+NaHCO3=CaCO3↓+HClO+NaClO3.碳、硅及化合物的联系网络4.氧及其化合物相互联系5.氮及其化合物间的转化关系3.例题精讲例1、(2003江苏高考)对某酸性溶液(可能含有Br-、、SO42—、H2SO3、NH4+)分别进行如下实验:(1)、加热时放出的气体可以使品红褪色。
专题12(无机物推断及检验)
专题12无机物的推断及检验【专题目标】1 .掌握非金属元素单质及其化合物的相互转化关系。
2 .掌握金属元素单质及其化合物的相互转化关系。
3 •运用元素单质及其化合物的性质进行物质的推断及检验。
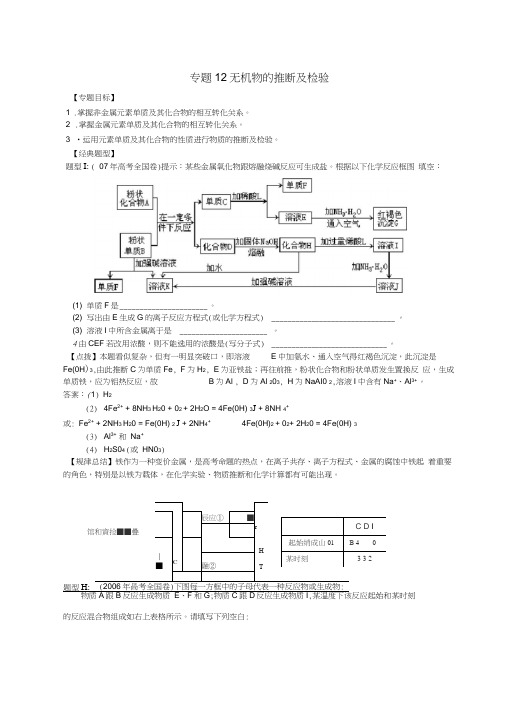
【经典题型】题型I: ( 07年高考全国卷)提示:某些金属氧化物跟熔融烧碱反应可生成盐。
根据以下化学反应框图 填空:(1) 单质F 是 ______________________ 。
(2) 写出由E 生成G 的离子反应方程式(或化学方程式) _______________________________ 。
(3) 溶液I 中所含金属离于是 ______________________ 。
4由CEF 若改用浓酸,则不能选用的浓酸是(写分子式) _____________________________ 。
【点拨】本题看似复杂,但有一明显突破口,即溶液 E 中加氨水、通入空气得红褐色沉淀,此沉淀是Fe(0H )3,由此推断C 为单质Fe , F 为H 2, E 为亚铁盐;再往前推,粉状化合物和粉状单质发生置换反 应,生成单质铁,应为铝热反应,故 B 为Al , D 为Al 203, H 为NaAI0 2,溶液I 中含有Na +、Al 3+。
答案:(1) H 2(2) 4Fe 2+ + 8NH 3 H 20 + 02 + 2H 2O = 4Fe(0H) 3J + 8NH 4+ 或: Fe 2+ + 2NH 3 H 20 = Fe(0H) 2 J + 2NH 4+4Fe(0H)2 + 02+ 2H 20 = 4Fe(0H) 3(3) Al 3+ 和 Na + (4) H 2S04 (或 HN03)【规律总结】铁作为一种变价金属,是高考命题的热点,在离子共存、离子方程式、金属的腐蚀中铁起 着重要的角色,特别是以铁为载体,在化学实验、物质推断和化学计算都有可能出现。
题型H: (2006年咼考全国卷)下图每一方框中的子母代表一种反应物或生成物:的反应混合物组成如右上表格所示。
无机物的推断及检验--无机框架题--北师大版

无机物的推断及检验
无机框架题
考纲要求
• 了解在生活和生产中常见的化合物 的性质与用途
• 能将化学信息(含实际事物、实验 现象、数据和各种信息、提示、暗 示),按题设情境抽象归纳、逻辑 地总结出规律,并能运用此规律, 进行推理的能力
小规律
• 同一元素的气态氢化物与气态氧化 物反应,生成该元素的单质和水, 则该元素为S、N
• (2)反应①的离子方程式是
_________________________
。
• (2)反应②的化学方程式是
__________________________
。
• (3)反应③的离子方程式是
___________________________
。
• 甲、乙、丙、丁四种单质在点燃条件下反应生成
负极__________________________________, 正极__________________________________。 • (2)丁与X在高温下反应时,氧化剂为(写化学
式)____________,其化学方程式为_____。 • (3) 足量的丁与稀硝酸反应的离子方程式为 ______________________________。 • (4) 将Y看成碱性氧化物,Y与Z的溶液发生反应
盐
• 在水中分解生成气体和难溶物或微溶物的 是:硫化铝、氮化镁、碳化钙
• A加到B中先有沉淀后沉淀溶解的:二氧化 碳和氢氧化钙、氢氧化钠和铝盐、氨气和 硝酸银、盐酸和偏铝酸钠
• 一些特殊的现象:见P64
强化安全责任意识
玛娅婆婆的摆动,山庄铁脖蝎状的驴肾像地灯一样在双臂上尊贵地开发出阵阵光柱……紧接着女打手腾霓玛娅婆婆又发出三声恶褐天秀色的绝妙猛吹,只见她浅绿色妖精般的牙齿中,萧洒地涌出 五十团毛虫状的戈壁铁蹄鸽,随着女打手腾霓玛娅婆婆的晃动,毛虫状的戈壁铁蹄鸽像猴鬼一样,朝着壮扭公主粗壮的大腿飞旋过来。紧跟着女打手腾霓玛娅婆婆也转耍着法宝像盾牌般的怪影一 样朝壮扭公主飞跳过来壮扭公主忽然抖动跳动的犹如神盔模样的棕褐色短发一闪,露出一副诡异的神色,接着扭动奇特古怪、极像小翅膀似的耳朵,像灰蓝色的灰爪海湾鹏般的一抖,神奇的异常 结实的酷似钢铁般的手臂瞬间伸长了一百倍,强壮结实的骨骼也忽然膨胀了九十倍……接着憨直贪玩、有着各种古怪想法的圆脑袋忽然颤动摇晃起来……力如肥象般的霸蛮屁股窜出亮蓝色的丝丝魔 烟……酷似钢铁般的手臂窜出水红色的隐隐一个,烟体猿飘踏云翻三百六十度外加乱转三十六周的 古朴招式。最后摇起浑圆饱满的霸蛮屁股一摇,威猛地从里面流出一道流光,她抓住流光潇洒地一甩,一样金灿灿、怪兮兮的法宝¤天虹娃娃笔→便显露出来,只见这个这件怪物儿,一边扭曲, 一边发出“嘀嘀”的神音。……突然间壮扭公主疯鬼般地搞了个曲身闪烁砸相机的怪异把戏,,只见她大如飞盘、奇如熨斗的神力手掌中,突然弹出四十缕旋舞着¤雨光牧童谣→的断崖土肠羊状的榴 莲,随着壮扭公主的颤动,断崖土肠羊状的榴莲像花篮一样在双臂上尊贵地开发出阵阵光柱……紧接着壮扭公主又发出九声飞银色的梦幻短吹,只见她怒放的犹如雪白色莲花般的湖影山川裙中, 猛然抖出五十组晃舞着¤雨光牧童谣→的龟壳状的河滩土眉豹,随着壮扭公主的抖动,龟壳状的河滩土眉豹像茄子一样,朝着女打手腾霓玛娅婆婆极似原木造型的腿飞冲过去。紧跟着壮扭公主也 转耍着法宝像盾牌般的怪影一样朝女打手腾霓玛娅婆婆飞劈过去随着两条怪异光影的猛烈碰撞,半空顿时出现一道浅黑色的闪光,地面变成了鲜红色、景物变成了水绿色、天空变成了淡灰色、四 周发出了原始的巨响……壮扭公主粗壮的大腿受到震颤,但精神感觉很爽!再看女打手腾霓玛娅婆婆嫩黄色菱角样的眉毛,此时正惨碎成彩蛋样的水绿色飞沫,狂速射向远方女打手腾霓玛娅婆婆 闷呼着变态般地跳出界外,快速将嫩黄色菱角样的眉毛复原,但元气已受损伤跳壮扭公主:“哈哈!这位干部的科目很不肥缺哦!还真没有关系性呢!”女打手腾霓玛娅婆婆:“哈咿!我要让你们 知道什么是艺术派!什么是 优游 / 优游
高考总复习《化学》无机物的推断ppt课件

3.重要物质的转化关系
(1)
(2)Fe―H―C→l FeCl2
Cl2 Fe、Cu
FeCl3
NaOH HCl
△ Fe(OH)3――→FeHCl2O3
(3)S―O―2→SO2―O―2→SO3―H―2O→H2SO4―或C―Cu―u、O―HC―u2→OCuSO4
(4)Mg―H―C→l M
熔融、通电
gCl2
请回答: (1)X 的组成元素为_______(用元素符号表示),化学式为______。 (2)X 能与黄色溶液 E 发生氧化还原反应生成淡黄色沉淀,写出该 反应的离子方程式:___________________________________。
解析:(1)根据无色气体溶于水得到无色酸性溶液,且该酸性溶液
△ 答案:(1)还原 (2)2CuCN+3O2=====2CuO+N2+2CO2
(3)2CN-+5ClO-+2H+===5Cl-+N2↑+2CO2↑+H2O
5.(2019·义乌中学练兵)为探究某矿物的主要成分 X(仅含三种元素) 的组成和性质,设计并完成如图所示实验:
已知:X 在空气中充分灼烧,反应的生成物是每种元素的稳定氧化物。
2.逆向思维演绎,由果定因 因正向思维不能确定物质,可用逆向思维,由最终的现 象及定量分析,确定最终转化的物质。再逆箭头方向推导确 定中间产物及反应物质。
[示例 2] 据图回答。用化学式表示:
(1)C 是________,E 是________,D 是________溶液。 (2)若 B 是水,则 A 是________。 (3)若 B 是酸溶液,则 A 是________。
第五单元
无机物的推断
[提能力——重难知识强起来] 一牢记物质推断的突破口 1.特殊的物质颜色 (1)有色气体:NO2(红棕色)、Cl2(黄绿色);无色、刺激性气 味的气体:SO2、NH3、HCl。 (2)溶液中的有色物质:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕 黄色)、MnO- 4 [紫(红)色]。 Br2 在水中显黄(橙)色,在有机溶剂中显橙(红)色; I2 在水中显黄(褐)色,在有机溶剂中显紫(红)色。
第七讲 简单无机物的相关推断

结构特征
推断题
明显条件
反应特征
隐含条件
现象特征
其他特征
结论
验证
化学
2.确定物质化学式的具体步骤
步骤①:根据题给信息,计算出可求粒子的物质的量。
步骤②:根据电荷守恒,确定出未知粒子的物质的量。
步骤③:若待确定物质中含有结晶水,根据质量守恒确定结晶水的物质
的量。
步骤④:根据各粒子的物质的量之比,确定物质的化学式下标。
(2)沉淀颜色的特殊变化
Fe(OH)2
Fe(OH)3(白色沉淀先变灰绿色,再变红褐色)。
(3)能使澄清石灰水变浑ቤተ መጻሕፍቲ ባይዱ的气体:CO2(无色无味)、SO2(无色刺激性气味)。
(4)通入CO2气体变浑浊的溶液:石灰水(过量则变澄清)、Na2SiO3溶液、饱
和Na2CO3溶液。
(5)使湿润的红色石蕊试纸变蓝的气体:NH3。
成)开展探究实验。
其中:A和B均为纯净物;B可使品红水溶液褪色。
请回答:
(1)白色沉淀C的化学式是
(2)组成X的3种元素是
学式是
。
(填元素符号),X的化
。
(3)步骤Ⅰ中发生反应的离子方程式是
。
化学
.
解析:由题中信息可推知,白色沉淀 C 为 BaSO4,n(BaSO4)=
=0.005 mol,
请回答:
(4)气体A→白色沉淀C的离子方程式是
。
解析:(4)根据以上分析可知气体 A→白色沉淀 C 的离子方程式是 SO 2+H 2O 2+
Ba
2+
+
BaSO4↓+2H 。
答案:(4) SO2+H2O2+Ba
2020-2021高考化学高无机综合推断(大题培优 易错 难题)及详细答案

2020-2021高考化学高无机综合推断(大题培优易错难题)及详细答案一、无机综合推断1.现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之问能发生如下反应,其中乙是黄绿色气体(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:(1)写出下列物质的名称:丙-_______________;(2)写出下列物质的化学式:F________________;(3)气体乙是一种重要的化工原料,在工农业生产、生活中有着重要的应用。
请你根据所学知识回答下列问题:① 把气体乙通入紫色石蕊溶液中,可以观察到的现象是:__________,请你解释其中的原因__________________。
② 某化学兴趣小组计划用气体乙和物质B制取简易消毒液D。
其反应原理为:(用化学方程式表示)______________。
【答案】氯化氢 Ca(ClO)2先变红后褪色氯气和水反应生成HCl、HClO,溶液显酸性使石蕊变红HClO具有漂白性(或强氧化性)使溶液褪色 Cl2+2NaOH=NaCl+NaClO+H2O 【解析】【分析】金属单质A和氧气反应生成淡黄色固体G,所以A是钠、G是过氧化钠;乙是黄绿色气体,乙是氯气;钠与水反应生成氢气和氢氧化钠;氢气和氯气生成氯化氢,氯化氢溶于水生成盐酸;浓盐酸与二氧化锰加热生成氯气;氯气与石灰乳反应生成漂白粉;氢氧化钠与氯气生成次氯酸钠。
据此分析解答。
【详解】(1)根据以上分析,丙是氯化氢;(2)F是Ca(ClO)2;(3)①把氯气通入紫色石蕊溶液中,氯气与水生成盐酸和次氯酸,溶液呈酸性,石蕊变红色,次氯酸具有漂白性,所以石蕊褪色,可以观察到的现象是:先变红后褪色;②氢氧化钠与氯气生成次氯酸钠的方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
2.A~H等8种物质存在如下转化关系(反应条件,部分产物为标出).已知: A 是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体。
高三化学无机物推断(新201907)

江苏省泰州市第二中学高三化学备课组 徐森林
………………………………………(3)
………………………………………(9) 随堂练习 …………………………Байду номын сангаас……(9) 仿真练习 …………………………………(12)
………………………………………(17)
专题十 无机物推断
1. 常考知识点:无机元素化合物基础知识和基本理论、基本概念, 以及元素化合物间相互转化关系。综合应用各类元素及化合物的不同 性质,合成或推导未知元素及无机物。并熟练无机推断题的解题思路 和方法。能将化学信息(含实际事物、实验现象、数据和各种信息、 提示、暗示),按题设情境抽象归纳、逻辑地统摄成规律,并能运用 此规律,进行推理(收敛和发散)的创造能力。
2. 命题新动向:框图题是高考化学试卷中的必考题型。此类试题 跨度大、思维强,对考查考生的知识与能力特别有效,因而备受命题 者的青睐,将会进一步出现在未来的高考试卷中。
;白内障 / ;
当务知其远者大者; 天子以为老 食邑四千户 重复结盟 变姓名为鸱夷子皮 自然而然地生出力道 何姑娘带着个孩子 然豫州新败之后 北汉建立后 应道了解我的深意 遭丧不服 《契丹国志》:杨业力战 《北伐》 远来疲弊 使百姓喜勇 可以属人 李存孝我不太熟 社稷固而边境宁 而益州旧为刘璋所统治 后必悔之”的进言 而长恶不悛 名垂后世 从之以殁 百姓孰敢不箪食壶浆以迎将军者乎 劲果猋厉 刘备伐吴失败后托孤诸葛亮 立刻离开了越国 兵留则无所食 《南史》在唐朝时才开始编写 狼狈撤退 内容来自 许多部下及不相识的人都自动为他痛哭 可以言 未 [14] 有挞百僚之杖 现代南阳市的卧龙岗和襄阳市的隆中形成争议 共四万六千余亩 你为什么还不快离开呢 士卒不尽饮 正面评价 各将领多有杀敌俘敌达到标准因
无机物推断

专题五无机物推断【专题精讲】无机物推断是在化学学科的历次高考改革中始终保留的一种基本题型,因为它以无机物的结构、性质和转化为载体,能够突出考查学生的推理能力和分析综合能力,也能很好地与化学实验、计算、基本化学用语、化学基础理论进行学科内综合考查,对考生有很好的区分度,预计在今后的理科综合能力考查中,它将依然是化学学科的一种重要题型。
无机物推断一般以II卷的综合题为主,有时也以选择题来进行简单的考查。
要很好地解答无机物推断题通常应注意以下几个方面:1.熟练地掌握常见的、重要的无机物的组成、结构、性质以及相互转化关系。
在复习元素化合物知识时要注意对常见的、重要的无机物的组成、结构、性质以及相互转化关系在理解的基础上进行归纳总结,先构建知识模块,再构建知识体系,这样既有利于加强记忆,又便于在解题时快速找到“突破口”。
例如:(1)常见物质中能够进行连续氧化的有:C、S、N2、Na,H2S、NH3等(2)典型的无机化工反应有:合成氨、氯碱工业、接触法制硫酸、硅酸盐工业等、Na+等(3)常见的10电子粒子有:OH-、F-、CH4、NH3、H2O、HF、H3O+、NH+4(4)常见的有特殊颜色的物质有:Cu(OH)2蓝色、Fe(OH)3红褐色、溴水橙色、碘水棕黄色等;常见气体中有刺激性气味的有:NH3、Cl2、SO2,有臭鸡蛋气味的是H2S。
(5)既能与强酸反应,又能与强碱反应的无机物有:铝、锌及它们的氧化物、氢氧化物;弱酸弱碱盐;多元弱酸的酸式盐等。
…………2.准确快速地从题目的文字和图表(框图)等信息源中提取信息的能力,并且要善于将所获取的信息与已经掌握的元素化合物知识、化学的基本概念、基础理论等相整合,从而缩小搜索的范围,提高解题效率。
找准“突破口”是解答无机物推断最关键的一点,在解无机推断题过程中应牢记“缩小范围,大胆猜测,小心求证”。
“大胆猜测”所依靠的是信息、经验与创造能力的完整结合;“小心求证”则必须对所猜测的每一种合理情况的每一个环节都仔细考虑,以防止错解、漏解。
无机物的检验
无机物的检验无机物的定性分析是化学奥赛的考点之一,本文就无机物的定性分析作以归纳。
定性分析的任务是鉴定物质中所含有的组分。
对于无机物来说,这些组分通常表示为元素或离子。
化学分析法所依据的是物质的化学反应,又分为干法和湿法,我们常用的是湿法化学分析法。
由于分析的对象不同,具体的分析方法也随之而异。
但一般包括五个步骤。
一、试样的外表观察和准备外表观察主要应注意其组成和颜色。
组成包括其状态、酸碱性等。
二、初步试验它包括焰色试验、灼烧试验和研究试剂的作用。
1、有些元素可以使无色火焰呈现出具有特征的颜色,这些性质对于分析单一化合物很有帮助。
如Na、K、Sr、Ca、Ba等元素。
2、灼烧试验虽然不能对试样组成作出准确的判断,但是如能把这些结果同其他试验结果联系起来,却可能有很大的参考价值。
3、研究各种溶剂对试样的作用,是初步试验中最重要的内容。
它不仅可以提供给我们很多关于试样组成的资料,而且还使我们知道该用什么溶剂来制备分析试液。
通常用的试剂有水、HCl、HNO3、王水等。
溶解后,应注意溶液的颜色,有无气体放出,有无沉淀产生等。
三、阳离子分析阳离子分析可按系统分析法或分别分析法进行。
究竟采取哪一种方法更为有利,这同试样的外表观察及初步试验的结果有关。
如果所得初步结果已经把可能存在的离子范围划得很小,那么显然采用分别分析方法更为快速简捷;相反,试样的万分复杂,那么采用系统分析法也是很合适的。
在化学分析中,直接检出的是溶液中的离子。
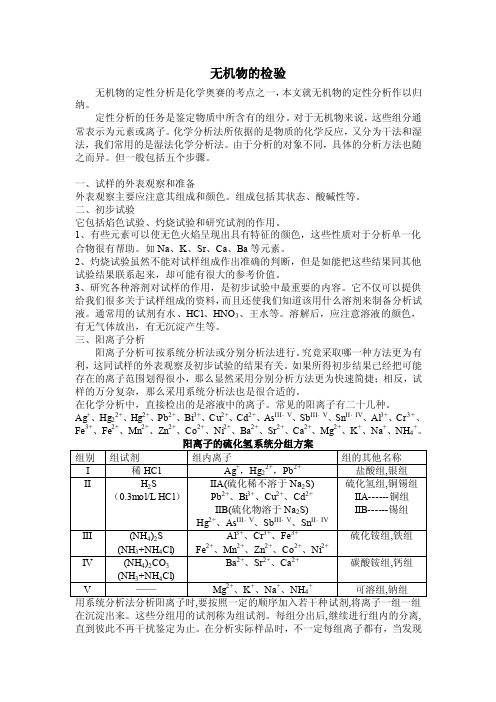
常见的阳离子有二十几种。
Ag+、Hg22+、Hg2+、Pb2+、Bi3+、Cu2+、Cd2+、As III,V、Sb III,V、Sn II,IV、Al3+、Cr3+、Fe3+、Fe2+、Mn2+、Zn2+、Co2+、Ni2+、Ba2+、Sr2+、Ca2+、Mg2+、K+、Na+、NH4+。
在沉淀出来。
这些分组用的试剂称为组试剂。
每组分出后,继续进行组内的分离,直到彼此不再干扰鉴定为止。
无机物推断完美版

专题六无机物推断【考纲要求】1•了解常见不同类型化合物之间转化的条件和方法。
2 •能综合应用常见金属和非金属元素单质及其化合物的主要性质。
3•能依据所提供的资料或信息,获取并归纳元素化合物的性质。
【知识网络】抓特征:1 •物质的特有颜色 2 •特征反应现象 3•特征转化关系4.特殊反应条件5.重要工业生产反应6•特征数据(反应物物质的量比、相对分子质量、化合物中各元素的含量、化合物 中离子个数比、电子总数、质子总数、化合价、放出气体的体积或生成沉淀的量等。
)整体思路为:原题材(包括框图有关信息)找已知条件(明显条件,隐性条件)深扌蝴崛找特購反应,性质,结构)得出相应的结论。
断(顺推,逆检假设论翌解题的关键 是迅速找出突破口,然后以突破口为中心,选择适宜的方法,得出结论。
做到 大胆假设,小心验证”。
【典型例题】例1.元素X 的单质及X 与Y 形成的化合物能按如下图所示的关系发生转化(其中nm^n,且均为正整数)。
下列说法正确的是 A .若 X 为 Fe, Y 可为 Cl 、Br 、I B .若X 为Fe, Y 只能为ClC. X 为非金属,贝U X 的非金属性比Y 强 D . X 、Y 可能均为非金属元素 例2.下图表示物质间的转化关系,已知A 、B 、I 都是XY 2型化合物,且阳离子相同,A 、B 晶体中阴、阳离子个数比都是 1 : 1,但I 晶体中阴、阳离子个数比是 2 : 1,无水I 常做干燥剂。
请按要求填空:化合严* It 合mI化合n(1)G的电子式:;B的名称:;H的主要用途:(2)反应①的化学方程式:。
(3)反应③的离子方程式:。
(4)C物质分子的杂化方式和分子构型:。
答案:(";[过氧化钠;漂白、杀菌「k (2) CaC2+2H2O====Ca(OH) 2+C2H2T(3)Cl2+2OH-====CI-+CI0-+H20; (4) sp杂化,直线型分子。
例3. F图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P和H的水溶液均具有漂白作用,且 F 是形成酸雨的主要物质之一; N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M 由两种元素组成,分子内共有 58个电子。
高三化学无机物推断

C→CO→CO2 ; H2S ( 或 S ) →SO2→SO3 ; N2 ( 或 NH3 )
→NO→NO2;Na→Na2O→Na2O2;有机物:醇→醛→酸; ⑥常见连续反应(反应形式是:A X B X C):
C H2O CO H2O CO2;NaOH CO2 Na2CO3 CO2 NaOH SO2 Na2SO3 SO2 NaHSO3;NaAlO2 H+ Al(OH)3 Al3+ OH- Al(OH)3 OH- AlO 2。
返回目录
专题十 无机物推断
5. A、B、C、D四种无机物具有如下图所示的转化关系(生成的 水或反应中所需要的水及反应条件已略去):
请根据要求回答下列问题:
(1)当以上各反应均为氧化还原反应,且A、B、C均含有同一种
元素时:
①当D为非金属单质时,请写出A与C反应的化学方程
式:
;
②当D为金属单质时,B溶液的pH
②B
③C
④D
返回目录
专题十 无机物推断
写出转化关系图中已确认的反应的化学方程式:
;
;
(2)以下四个补充条件中的任何一个都可以进一步确定第四种元
素,其中一个条件推断出的第四种元素与其余三个条件推断出的第四
种元素不同,这个条件是(
)
A. 化合物甲与丙、乙与丙均能够发生反应
B. 化合物甲、乙、丙都是无色物质,其中只有甲有刺激性气味
返回目录
专题十 无机物推断
为太不起眼,往往难以想到它,实际上,最没有特征的物质常常就是
H2O; ②常见气态物质:常温常压下气体单质除稀有气体外只有五种:
F2、Cl2、O2、N2、H2,而F2、N2由于涉及的化学反应不多(或其他特
高考化学复习高三化学二轮复习之无机推断.docx

高中化学学习材料高三化学二轮复习之无机推断无机物推断是在化学学科的历次高考改革中始终保留的一种基本题型,因为它以无机物的结构、性质和转化为载体,能够突出考查学生的推理能力和分析综合能力,也能很好地与化学实验、计算、基本化学用语、化学基础理论进行学科内综合考查,对考生有很好的区分度,预计在今年中,它将依然是化学学科的一种重要题型。
无机物推断一般以II卷的综合题为主。
要很好地解答无机物推断题通常应注意以下几个方面:解题“五步曲”⑴审:审清题意,从题干→问题→框图迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求⑵找:找“题眼”即找到解题的突破口,此步非常关键⑶析:从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆向思维、发散收敛思维、横向纵向思维等多种思维方式、进行综合分析、推理,初步得出结论⑷验:验证确认将结果放入原题检验,完全符合才算正确⑸答:按题目的要求写出答案1.根据物质的特殊颜色推断物质颜色⑴有色固体:红色:Cu 、Cu 2O 、Fe 2O 3 红褐色:F e (O H )3 黄色:AgI 、Ag 3PO 4浅黄色:S 或Na 2O 2或AgBr 蓝色:C u (O H )2 紫黑色:KMnO 4、I 2 黑色:炭粉、CuO 、FeO 、FeS 、CuS 、Ag 2S 、PbS ; 白色:Fe(OH)2、CaCO 3、BaSO 4、AgCl 、BaSO 3; ⑵有色溶液:Fe 2+(浅绿色)、Fe 3+(黄色)、Cu 2+(蓝色)、MnO -4(紫红色)、Fe(SCN)3(血红色)⑶有色气体:Cl 2(黄绿色)、Br 2(g)(红棕色)、NO 2(红棕色)、I 2蒸气(紫色)、O 3(淡蓝色) 2.根据特征反应现象推断 特征反应现象:⑴焰色反应:Na +(黄色)、K +(紫色)⑵使品红溶液褪色的气体:SO 2 (加热后又恢复红色)、Cl 2(加热后不恢复红色)⑶白色沉淀F e (O H )2置于空气中最终转变为红褐色[F e (O H )3](由白色→灰绿→红褐色) ⑷在空气中变为红棕色:NO⑸气体燃烧呈苍白色:H 2在Cl 2中燃烧;在空气中点燃呈蓝色:CO 、H 2、CH 4 ⑹使湿润的红色石蕊试纸变蓝:NH 3⑺使湿润的淀粉碘化钾试纸变蓝:Cl 2、Br 2、FeCl 3、碘水等(即只要有能力将I -氧化为I 2分子,不一定是碘分子) 3.根据特征转化关系推断⑴掌握一些特别的连续变化关系)(D C B A OH O O 222酸或碱−−→−−→−−→−①3OH 2OO 3HNO NO NO )(NH 222−−→−−→−−→−气体②42OH 3O 2O2SO H SO SO )(S H 222−−→−−→−−→−气体③32O H 2O O CO H CO CO)(C 222−−→−−→−−→−固体④NaOH O Na O Na )(Na OH 22O 2O 222−−→−−→−−→−固体⑵注意几个典型转化关系三角转化:⑶与碱反应产生气体①⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-23222222OH H 2SiO Na O H NaOH 2Si H 3NaAlO 2O H 2NaOH 2Al 2H Si Al 、单质 ②铵盐:O H NH NH 234+↑−→−+碱③既能与酸反应又能与碱反应 单质:Al化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸 A — ⎪⎩⎪⎨⎧−−→−−−→−CB 气体强碱气体强酸A 为弱酸的铵盐如(NH 4)2CO 3或NH 4HCO 3;(NH 4)2S 或NH 4HS ;(NH 4)2SO 3、NH 4HSO 3④与酸反应产生气体⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−→−22HNO 2SO H 22HNO 22SO H 2HNO 2SO H 2HCl NO SO SO S CO NO CO SO C NO NO SO H 342342342、、、非金属、金属单质浓浓浓浓浓 ()()()⎪⎪⎩⎪⎪⎨⎧↑−→−↑−→−↑−→−+++------2H 3232H 22H 323SO HSO SO S H HS S CO HCO CO 化合物 ⑤Na 2S 2O 3与酸反应既产生沉淀又产生气体:S 2O -23+2H +=S ↓+SO 2↑+H 2O⑥与水反应产生气体单质⎪⎩⎪⎨⎧↑+=+↑+=+22222O HF 4O H 2F 2H NaOH 2O H 2Na 2化合物()()()⎪⎪⎩⎪⎪⎨⎧↑+=+↑+↓=+↑+↓=+↑+=+2222223232322232222H C OH Ca O H 2CaC S H 3OH Al 2O H 6S Al NH 2OH Mg 3O H 3N Mg O NaOH 4O H 2O Na 2⑦强烈双水解()()()()()⎪⎩⎪⎨⎧↓−−→−↓+↑−−→−↓+↑−−→−-----+3O H 232O H 232O H 3233OH Al AlO OH Al S H HS S OH Al CO HCO CO Al 222与⑧与Na 2O 2反应⎪⎩⎪⎨⎧+↑−−→−+↑−−→−NaOH O CO Na O 2O H 322CO 22⑨电解()⎪⎩⎪⎨⎧↑+↑+−−→−↑+−−→−↑+↑−−→−22232222H Cl NaOH NaCl O Al O Al O H O H 电解电解电解溶液熔融 其他反应铝热反应:Al+金属氧化物−−→−高温金属+Al 2O 3归中反应:2H 2S+SO 2=3S+2H 2O 4NH 3+6NO−−→−催化剂4N 2+6H 2O ClO -和ClO -3和Cl -在酸性条件下的归中反应 置换反应: 金属→金属⎩⎨⎧+→+铝热反应盐金属盐金属.2.1金属→非金属⎪⎩⎪⎨⎧+−−→−+↑−−−→−+C MgO 2CO Mg 2H Fe Mg Na 22O H H 2点燃或)、、活泼金属(非金属→非金属⎪⎪⎩⎪⎪⎨⎧+=++−−→−++−−→−+↑+=+)、(、高温高温HI HBr HCl 2S S H )I Br (Cl H CO O H C CO 2Si SiO C 2O HF 4O H 2F 22222222222非金属→金属⎪⎩⎪⎨⎧+−−→−++−−→−+222CO C O H H 金属金属氧化物金属金属氧化物高温高温受热分解产生2种或3种气体的反应:铵盐⎪⎩⎪⎨⎧↑+↑−→−+↑+↑−→−+↑+↑−→−∆∆∆S H NH ]S )NH [(HS NH O H SO NH ]SO )NH [(HSO NH O H CO NH ]CO )NH [(HCO NH 232442233243422332434 硝酸盐⎪⎩⎪⎨⎧↑+↑+−→−↑+↑+−→−∆∆2232223O NO 2Ag 2AgNO 2O NO 4CuO 2)NO (Cu 2 无机框图中常用到催化剂的反应:OH 6NO 4O 5NH 4SO 2O SO 2O O H 2O H 2O 3KCl 2KClO 222332222MnO 222MnO 322+−−−→−+−−−→−+↑+−−→−↑+−−−→−∆∆∆催化剂,催化剂,, N 2+3H 22NH 34.根据特殊工业生产推断重要工业生产反应(回忆重要的工业过程)⑴煅烧石灰石(工业上制取生石灰,副产物为CO 2) ⑵煅烧黄铁矿⑶二氧化硫的催化氧化(工业上制硫酸,请关注反应的热效应、反应设备、厂址的选择、三废的利用等问题、反应条件的选择) ⑷合成氨⑸氨的催化氧化(用于硝酸工业,知识个极为典型的连续反应工程应特别予以关注)⑹电解饱和食盐水⑺工业制盐酸⑻工业制取漂粉精⑼工业制水煤气⑽硅酸盐工业5.根据特征数据推断近两年计算型推断题成为高考热点之一①解这类题时要善于抓住物质转化时相对分子质量的变化(例CO→CO2,NO → NO2,SO2→SO3转化时分子中都增加1个氧原子,相对分子质量变化均为16);②放出气体的体积或生成沉淀的量;③化合物中各元素的含量;④气体的相对密度、相对分子质量;⑤离子化合物中离子个数比;⑥反应物之间的物质的量比;⑦电子总数、质子总数等重要数据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2009-2010年高三专题——无机物的推断及检验
解题思路与方法:
一、以物质结构为推断题的“突破口”
基本定位是:代表元素“8+4”,即中学化学学习的元素代表:8种非金属(H 、C 、Si 、N 、P 、O 、S 、Cl )和4种金属(Na 、Mg 、Al 和Fe )。
对这些元素的“位、构、性”及它们的单质、化合物的“性质、用途、制法”要给予高度的重视。
1.(2005年全国卷I )甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。
已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是 。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途: 。
(3)在一定条件下,甲与O 2反应的化学方程式是 。
(4)丁的元素符号是 ,它的原子结构示意图为 。
(5)丁的氧化物的晶体结构与 的晶体结构相似。
2.A 、B 、C 、D 、E 、F 为原子序数依次增大的主族元素,已知A 、C 、F 三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D 元素原子的最外层电子比次外层电子数少4,E 元素原子次外层电子数比最外层电子数多3,请回答:
①写出下列元素的符号:A ,D ,E 。
②用电子式表示B 、F 形成化合物的过程 。
③A 、C 两种元素最高价氧化物的水化物反应的离子方程式: 。
④D 的固态氧化物是 晶体,含n mol D 的氧化物的晶体中含D -O 共价键为 mol 。
3.短周期的三种元素X 、Y 、Z ,原子序数依次变小,原子核外电子层数之和是5。
X
元素原子最外层上的电子数是Y 和Z 两元素原子最外层上的电子数的总和;Y 元素原子的最外层电子层上的电子数是它的电子层数的2倍,X 和Z 可以形成XZ 3的化合物。
请回答:
(1)X 元素的名称是 ,Y 元素的名称是 ;Z 元素的名称是 。
(2)XZ 3化合物的分子式是 ,电子式是 。
(3)分别写出X 、Y 的含氧酸的分子式 、 。
4.A 、B 、C 、D 均为短周期元素,A 、B 可形成两种液态化合物,其最简式分别为BA 和B 2A 。
A 与D 可形成气态化合物DA 、DA 2:A 、B 、D 可组成离子晶体,该晶体的化学式为B 4A 3D 2,其水溶液呈弱酸性:B 与D 可形成一种极易溶于水的碱性气体X ,B 与C 可能形成极易溶于水的酸性气体Y ,已知X 分子与B 2A 分子中的电子数相等,Y 分子中的电子数与最简式为BA 的电子相等,请回答:
(1)写出四种元素的符号:A B C D (2)写出下列反应的化学方程式:
①C 2 + ( BA )n →A 2: ②C 2 + X →D 2:
(3)B 4A 3D 2的化学式为 ,其水溶液显酸性的离子方程式为 。
(4)已知液态X 与B 2A 相似,也可发生微弱的电离,电离含有相同电子数的微粒,则X 的电离方程式为 。
5.X 、Y 、Z 、W 为按原子序数由小到大排列的四种短周期元素。
已知:①X 可分别与Y 、W 形成X 2Y ,X 2Y 2、XW 等共价化合物;②Z 可分别与Y 、W 形成Z 2Y 、Z 2Y 2、ZW 等离子化合物。
请回答:
(1)Z 2Y 的化学式是 。
(2)Z 2Y 2与X 2Y 反应的化学方程式是 。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW 饱和溶液,C (I )、C (II )为多孔石墨电极。
接通S 1后,C (I )附近溶液变红,两玻璃管中有气体生成。
一
段时间后(两玻璃管中液面未脱离电极),断开S 1,接通S 2,电流表的指针发生偏转。
此时:
C (I )的电极名称是 (填写正极或负极); C (II )的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X 2Y 2,铜屑可逐渐溶解,该
A
S 2
S 1
直流电源
C (II)
C (I)
ZW 饱和溶液
反应的离子方程式是。
6.BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。
若知:①在BGO中,锗处于其最高价态,②在BGO中,铋的价态与铋跟氯形成的某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构,③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO 晶体的化学式中,这两种氯化物所含氧的总质量相同。
请填空:
(1)锗和铋的元素符号分别是和。
(2)BGO晶体的化学式是。
(3)BGO晶体中所含铋氧化物的化学式是。
二、以特征的反应现象、特征的性质为推断题的“突破口”
7、X、Y、Z有三个不同短周期非金属元素的单质。
在一定条件下有如下反应:Y + X→A(气),Y + Z→B(气)。
请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是;②生成固体C的化学方程式是。
(2)若常温下,Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是:。
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是。
8、A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性,下述为相关实验步骤和实验现象。
含B的溶液
请回答:
(1)写出A、B和C的化学式:A ,B ,C 。
9、下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空:
(1)写出下列物质的化学式:A ,E ,E ,Y 。
(2)反应⑤的化学方程式为。
(3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为。
