《卤化反应》PPT课件
合集下载
《卤化反应 》课件

卤化反应
目 录
• 卤化反应概述 • 卤化反应机理 • 卤化反应的条件与影响因素 • 卤化反应的工业应用 • 卤化反应的安全与环保 • 卤化反应的前沿进展与展望
01
卤化反应概述
定义与分类
定义
卤化反应是指将其他元素或基团替换 为卤素(氟、氯、溴、碘)的反应。
分类
根据卤化反应中卤素的不同,可以分 为氟化、氯化、溴化和碘化等。
详细描述
亲核取代卤化反应中,亲核试剂(如醇、胺等)进攻卤代烃的碳原子,卤素原子被取代基取代。这个反应过程中 ,亲核试剂首先与卤代烃形成络合物,然后发生取代反应,生成新的碳-碳键和卤化物。
消除反应卤化
总结词
不饱和烃在加热条件下发生消除反应,同时生成碳-卤键。
详细描述
消除反应卤化中,不饱和烃在加热条件下发生消除反应,同 时生成碳-卤键。这个过程中,不饱和烃首先形成不稳定的消 除中间体,然后发生消除反应,生成新的碳-卤键和烯烃。
氟代烃的合成工艺难度较大, 且氟气具有剧毒和强腐蚀性, 因此研究和应用相对较少。
05
卤化反应的安全与环 保
卤化反应的危险性
卤化反应通常涉及高温、高压和有毒有害物质,操作不当可能导致火灾、爆炸等安 全事故。
卤化反应过程中产生的废气、废水和废渣等废弃物,如未经妥善处理,可能对环境 造成严重污染。
卤化反应过程中使用的原料和催化剂等物质,如对人体有害,可能对操作人员的健 康造成危害。
高选择性卤化反应的研究
研究高选择性卤化反应,以实现特定位置或特定结构的卤化,提高产物的纯度和 收率。
开发高选择性卤化反应的机理和动力学模型,为优化反应条件和提高产物选择性 提供理论支持。
卤化反应在绿色化学领域的应用
探索卤化反应在绿色合成中的实际应用,如药物合成、材料 制备和生物活性分子合成等。
目 录
• 卤化反应概述 • 卤化反应机理 • 卤化反应的条件与影响因素 • 卤化反应的工业应用 • 卤化反应的安全与环保 • 卤化反应的前沿进展与展望
01
卤化反应概述
定义与分类
定义
卤化反应是指将其他元素或基团替换 为卤素(氟、氯、溴、碘)的反应。
分类
根据卤化反应中卤素的不同,可以分 为氟化、氯化、溴化和碘化等。
详细描述
亲核取代卤化反应中,亲核试剂(如醇、胺等)进攻卤代烃的碳原子,卤素原子被取代基取代。这个反应过程中 ,亲核试剂首先与卤代烃形成络合物,然后发生取代反应,生成新的碳-碳键和卤化物。
消除反应卤化
总结词
不饱和烃在加热条件下发生消除反应,同时生成碳-卤键。
详细描述
消除反应卤化中,不饱和烃在加热条件下发生消除反应,同 时生成碳-卤键。这个过程中,不饱和烃首先形成不稳定的消 除中间体,然后发生消除反应,生成新的碳-卤键和烯烃。
氟代烃的合成工艺难度较大, 且氟气具有剧毒和强腐蚀性, 因此研究和应用相对较少。
05
卤化反应的安全与环 保
卤化反应的危险性
卤化反应通常涉及高温、高压和有毒有害物质,操作不当可能导致火灾、爆炸等安 全事故。
卤化反应过程中产生的废气、废水和废渣等废弃物,如未经妥善处理,可能对环境 造成严重污染。
卤化反应过程中使用的原料和催化剂等物质,如对人体有害,可能对操作人员的健 康造成危害。
高选择性卤化反应的研究
研究高选择性卤化反应,以实现特定位置或特定结构的卤化,提高产物的纯度和 收率。
开发高选择性卤化反应的机理和动力学模型,为优化反应条件和提高产物选择性 提供理论支持。
卤化反应在绿色化学领域的应用
探索卤化反应在绿色合成中的实际应用,如药物合成、材料 制备和生物活性分子合成等。
《药物合成反应》第一章卤化反应课件

特点
亲核卤化反应是一种常见的有机合成方法,具有操作简便、产物纯度高、产率 较高等优点。
常见的亲核卤化试剂
氯化氢(HCl)、溴 化氢(HBr)、碘化 氢(HI)等氢卤酸。
氯化亚砜(SOCl₂) 、溴化钠(NaBr) 、碘化钾(KI)等卤 化物。
氯气(Cl₂)、溴( Br₂)、碘(I₂)等卤 素单质。
03
亲电卤化反应
定义与特点
总结词
亲电卤化反应是指卤素与带有部分正电荷的碳原子相 连的反应,其特点是卤素取代碳上的氢原子或取代基 。
详细描述
亲电卤化反应是一种常见的有机合成反应,其特点是 卤素(如氯、溴、碘)与有机分子中的碳原子相连, 形成新的碳-卤键。这种反应通常发生在带有部分正电 荷的碳原子上,因此被称为亲电卤化反应。在反应过 程中,卤素原子取代了碳上的氢原子或取代基,生成 新的有机化合物。亲电卤化反应是一种重要的有机合 成手段,在药物合成和其他化学领域中广泛应用。
卤化反应在药物合成中的应用
1 2
引入卤素官能团
在药物合成中,卤化反应常用于引入卤素官能团 ,如氟代、氯代等,以改变药物的理化性质和药 效。
增加药物稳定性
卤化反应可以增加药物的稳定性,如将烯醇式结 构转化为卤代烃,提高药物的化学稳定性。
3
调节药物的代谢和排泄
通过卤化反应可以调节药物的代谢和排泄,如将 羟基或氨基等代谢敏感基团替换为卤素,降低药 物的代谢速度和排泄速度。
实例
以苯酚的溴化为例,苯酚与溴在光照条件下发生自由基溴化反应,生成2-溴苯酚。在这个反应中,溴原子取代了 苯酚中的羟基氢原子,形成了一个新的碳-溴键,同时生成了一个苯氧自由基。
05
卤化反应的选择性与控制
选择性卤化反应的条件与影响因素
亲核卤化反应是一种常见的有机合成方法,具有操作简便、产物纯度高、产率 较高等优点。
常见的亲核卤化试剂
氯化氢(HCl)、溴 化氢(HBr)、碘化 氢(HI)等氢卤酸。
氯化亚砜(SOCl₂) 、溴化钠(NaBr) 、碘化钾(KI)等卤 化物。
氯气(Cl₂)、溴( Br₂)、碘(I₂)等卤 素单质。
03
亲电卤化反应
定义与特点
总结词
亲电卤化反应是指卤素与带有部分正电荷的碳原子相 连的反应,其特点是卤素取代碳上的氢原子或取代基 。
详细描述
亲电卤化反应是一种常见的有机合成反应,其特点是 卤素(如氯、溴、碘)与有机分子中的碳原子相连, 形成新的碳-卤键。这种反应通常发生在带有部分正电 荷的碳原子上,因此被称为亲电卤化反应。在反应过 程中,卤素原子取代了碳上的氢原子或取代基,生成 新的有机化合物。亲电卤化反应是一种重要的有机合 成手段,在药物合成和其他化学领域中广泛应用。
卤化反应在药物合成中的应用
1 2
引入卤素官能团
在药物合成中,卤化反应常用于引入卤素官能团 ,如氟代、氯代等,以改变药物的理化性质和药 效。
增加药物稳定性
卤化反应可以增加药物的稳定性,如将烯醇式结 构转化为卤代烃,提高药物的化学稳定性。
3
调节药物的代谢和排泄
通过卤化反应可以调节药物的代谢和排泄,如将 羟基或氨基等代谢敏感基团替换为卤素,降低药 物的代谢速度和排泄速度。
实例
以苯酚的溴化为例,苯酚与溴在光照条件下发生自由基溴化反应,生成2-溴苯酚。在这个反应中,溴原子取代了 苯酚中的羟基氢原子,形成了一个新的碳-溴键,同时生成了一个苯氧自由基。
05
卤化反应的选择性与控制
选择性卤化反应的条件与影响因素
药物合成反应课件 中国药科大学

醋酸去氢 表雄酮
炔雌醇合成 的第一步
卤素外 的基团 来自溶剂
注意 区域 选择 性?
N-卤代酰胺
Nu=H2O, ROH, DMSO, DMF
选择性???
Dalton 反应
a-溴酮
高选择性对
向加成产物
不影响其它官能团
不饱和烃的硼氢化-卤解反应
首先将烯烃进行硼氢化,然后用卤解反应转
化成卤代烃,具立体和区域选择性的。定位 属反马氏规则。 烯烃的硼氢化常用的试剂为二硼烷(B2H6), BH3/THF和BH3/Me2S(DMS)。 炔烃的硼氢化试剂常用儿茶酚硼烷。 属顺式硼氢化加成机理,硼原子优先处于位 阻较小的位置。 若硼原子连接的碳原子为手性中心,在置换 过程中发生构型反转现象。
3-羰基甾体
Py的作 用??
酮的选择性 ketoselectivity
减少双键加成
取代,快,可逆 加成,慢,不可逆
四溴环己二烯酮
特点:亲电活性大,无需催化剂,只得到单取代产物, 反应中不生成卤化氢,适用于对酸、碱敏感的酮。 区域选择性高,取代反应主要在烷基取代较多的α位。 对αβ不饱和酮也较好,还可用于醛的α-溴代反应。
还有什 么方 法??
与前页比较
芳环上有吸电子取代基时,卤取代反应一
般需用lewis酸催化,反应温度也较高。
含吸电 子基团
二溴异氰尿酸
98%
含多余π-电子的芳杂环:吡咯﹥呋喃﹥ 噻吩﹥>苯,且2位比3位活泼。
对于缺π-电子的芳杂环如吡啶,卤 取代反应相当困难,条件苛刻。
20~50℃
氟和碘取代反应
第二节 卤加成反应
一、不饱和烃的卤加成反应
卤素的活性次序为F>Cl>Br>I
卤化反应

Cl2 k1
Cl
HCl
Cl
Cl2
k2
Cl
Cl
HCl
k3
Cl
Cl2
Cl
HCl
Cl
Cl2
苯在硝化、磺化、氯化中k1/k2值的比较
反应类型 硝化
磺化
氯化
k1︰k2
105~107 103~104
~101
❖ 卤化反应中,随着反应生成物浓度的不断变化, 使各级反应的反应速率也相应发生较大的变化。
❖ 苯氯化的动力学方程式看用下式表示:
ICl)等。
❖ 用于置换卤化的卤化剂有HF,KF,NaF,SbF3, HCl,PCl3,HBr等。
第二节 芳环上的取代卤化反应
一 反应历程 芳环上取代卤化的反应通式为:
ArH + X2 = ArX + HX 反应类型:典型的亲电取代反应。 进攻芳环的活泼质点:卤正离子(X+),
1. 以金属卤化物为催化剂的反应历程
1 K-1
CA CA0
CA k CA0
CD CA0
=
K 1-K
CA CA0
1 K
CA CA0
k 1-K + K
K= k2/k1≠1
例:设苯氯化的转化率是50%,则
K=0.1/1=0.1 一氯苯的生成量
CC CA0
=
1 0.1 - 1
0.5
0.50.1 = 0.4811mol
二氯苯的生成量
CD CA0
亚铜进行氯化;目前采用分子筛分离得到纯 净的邻氯甲苯或者对氯甲苯。
(3)催化剂不同,邻、对位异构体比例不同。
催化剂
邻位/对位
二氯甲苯 含量(%)
药物合成反应课件(闻韧)第二版

O BH
O
70℃,2h
C6H13 C
H
H
CO
B O
H2O 25℃,2h
C6H13 C
H
H
I2/NaOH/H2O
C
Et2O/0℃
B(OH)2
C6H13
H
CC
90%
H
I
第一节 不饱和烃的卤加成反应 四、硼氢化-卤解反应
BH3.THF 25。
I2/MeONa
(
)3B MeOH/0。
H I
78% (endo/exo=80/20)
R1 C C R2 NBS/DMSO
H
H
R1
Br CC
R2
H
H
Me OS
Me
Br R2 H
R1 C C
H
O SMe2
第一节 不饱和烃的卤加成反应
三、不饱和烃和次卤酸(酯),N-卤代酰胺的反应
NBS 英文名称:N-Bromosuccinimide 别名:N-溴代琥珀酰亚胺。 结构式:
NCS NBA NCA
Ph--C-CH3
Br
HBr
Ph-CH2CH2Br 反 马 氏 规 则
H2O2或 光 照
第一节 不饱和烃的卤加成反应
二、卤化氢对不饱和烃的反应
机理
R1 C
R2
R3 H+
C
R4
Nu
R1
R2
CC
R4
R3 Nu H
Nu R1
C
R4
R2
C
反向
H R3
反马氏规则机理
光
HBr
H
+ Br
R1 C
R4 Nu
卤化反应及其工艺概述课件

KHSO4 H2O
2020/10/9
13
酰卤化合物
• 光气
O
O
+ C-H Cl C Cl
• 硫酰氯(二氯硫酰)
O
+ Cl S Cl O
CH3 SbCl3
• 次卤酸盐
CHCl2
+ CO2
CH3 Cl
Cl
OH NaClO/NaBrO NaOH
Cl (Br) OH
2020/10/9
14
§3.2 氯化反应
2ቤተ መጻሕፍቲ ባይዱ20/10/9
6
加成卤化
2020/10/9
7
取代卤化
+ Cl2 FeCl3
CH3
+ Cl2
Cl CH2Cl
2020/10/9
8
置换法
+ CH3CH2OH HCl ZnCl2 C2H5Cl
O
O Cl
+ Cl2
O
O
2020/10/9
9
四、常用的卤化剂
1 卤单质 2 卤化物 3 酰卤化合物
2020/10/9
• 有资料表明,最有效的催化剂可能是三 氯 的 常分数化子为铁的比最大一(Fe水值C。合l3︰大物H于(F2Oe1C时)为l3,·lH时反2O,应)反。速应当度速二常度者数 减小。因此,在氯化反应中,原料含有 微 以生量成水复份合(必催须化保剂持,Fe能C加l3︰速H反2应O≥的1)进,行可 。
3
阻燃卤化物
Br HO
Br
Br
Br
CH3 C
CH3
Br OH
Br
H
CO
N Br
CC
N H
第四章-卤化反应讲解课件

·
(3)电子转移法
33
n 链的传递
RH + X · → R ·+
R ·+ X2 → RX + X · 或 RH + X · → RX + H ·
H ·+ X2 → HX + X ·
n 链的终止
器壁或填料
2X ·
X2
R ·+ X · → RX
X ·+ O2 → O2X · X→· O2 + X2
R ·+ O2 → RO2 · →X · RX + O2
n 氯化深度
19
n 混合作用
在连续反应时,由于反应器型式选择不当、传质不 均匀,使反应生成的产物未能及时离开,又返回反应区 域促进连串反应的进行,这种现象叫做反混作用。
图 氯苯的生产工艺
20
n 氯化温度
表 苯氯化反应温度与k2/k1的关系
T, ℃
18
25
k2/ k1
0.107
0.118
30 0.123
C-C,C-H,H-H :330~418.6KJ/mol(500~650℃) Cl-Cl,Br-Br,I-I,O-O,N-N,C-N=N-C:<250KJ/mol(50~100 ℃)
60~100C 32
(2)光离解法
E=hν=h
Cl2 ,Br2 ,I2
400~
500nm hν
Cl ·,Br ·,I
7
转化为其它化合物
亲核置换
δ+
n -X(-Cl)
-NH2 ,-OH,-F,-OR,-OAr
8
4.1.3 卤化试剂
n 卤素单质: Cl2 ,Br2 ,I2 n 卤化氢+氧化剂:
卤化反应药物合成反应课件

卤化反应的历程与机理
历程
卤化反应通常包括三个步骤:亲核试剂或亲电试剂接近底物、形成碳卤键、离 去基团离去。
机理
根据不同的卤化反应类型,其机理也有所不同。例如,亲核卤化反应通常是通 过SN2(双分子亲核取代)机理进行的,而亲电卤化反应则通常是通过SE2(单 分子亲电取代)机理进行的。
02 卤化反应在药物合成中的 应用
过渡金属催化的卤化
研究过渡金属催化剂在卤化反应中的作用机制和应用 范围。
新型卤化剂的开发
探索新型、高效的卤化剂,以替代传统卤化剂,降低 环境影响。
THANKS FOR WATCHING
感谢您的观看
杂环化合物的卤化
杂环化合物的卤化是指将杂环化合物中的氢原子被卤素取代的反应。在药物合成 中,杂环化合物的卤化常用于制备杂环族卤代烃,作为合成其他复杂化合物的中 间体。
杂环化合物的卤化通常采用强酸或强氧化剂作为催化剂,例如硫酸、硝酸等。在 卤化反应中,杂环化合物可以与卤素发生亲电取代反应,生成杂环族卤代烃。
03 卤化反应的工业应用
卤化反应的工业化过程
原料准备
选择合适的原料,确保 原料的纯度和供应稳定
性。
反应条件控制
调节温度、压力、浓度 等反应条件,确保反应
顺利进行。
产物分离与纯化
采用蒸馏、萃取、结晶 等方法对产物进行分离 和纯化,得到高纯度的
卤化物。
废物处理与环保
对产生的废物进行妥善 处理,确保符合环保要
卤化反应的未来发展方向
开发高效催化剂
通过研究新的催化体系, 提高卤化反应的活性和选 择性。
绿色化学方向
探索环境友好的反应条件 和替代品,降低卤化反应 的环境影响。
计算机辅助设计
药物合成反应 第二章 卤化反应

醇羟基、羧 羟基的置换 宜制备不饱 和酸的酰氯衍生 物
醇羟基的置 换反应
一、卤素对不饱烃的加成反应
烯烃和炔烃中的双键和叁键,存在有不稳定的π键, 它们容易被亲电试剂进攻而发生断裂,进而发生加成反应 。药物原料分子中大多含有双键,利用药物原料分子中的 双键与亲电型卤化剂的加成是药物原料分子卤化的常用方 法,加成后得到相应的邻二卤化物。炔烃类含叁键的化合 物,在与卤素的加成中,叁键的反应活性比双键小得多, 应用远没有烯烃广泛。在药物合成技术中主要学习双键的 有关反应。
(三)常用卤化试剂
类别
分子式 Cl2
特
点
应用范围
常 见 卤 化 试 剂
Br2 HCl HBr HClO HBrO
活性高,易进行 ,但需注意反应的特 殊条件。
与不饱和键加成 • 在芳环上、芳环侧链上和羰 基α 位上取代
价廉易得,应用 广泛,反应条件要控 制。
不稳定,需新制 ;条件温和,但有副 产物。
CH2
CH2 + Cl2 + H2O
60
ClCH2CH2OH + HCl
用次溴酸合成氯霉素中间体(9):
H CH CH CH2OH
Br2/H2O
Br C CH2OH
C
OH H (9)
又如用N-卤化酰胺合成α–卤代醇:
O H C C + RC N Br
H2O
Br C C OH
三、卤素与芳香烃的反应பைடு நூலகம்
CCl4 60
杂环中的五员环(呋喃、吡咯、噻吩等),环中碳的 电子密度比苯大,均为多电子杂环,亲电取代活性大于苯 ,卤代要容易进行些; 六员杂环(吡啶、吡喃、吡嗪等),环中碳的电子密 度比苯小,均为缺电子杂环,使位碳上的电子密度减小, 亲电取代活性小于苯,卤代要难进行些。
醇羟基的置 换反应
一、卤素对不饱烃的加成反应
烯烃和炔烃中的双键和叁键,存在有不稳定的π键, 它们容易被亲电试剂进攻而发生断裂,进而发生加成反应 。药物原料分子中大多含有双键,利用药物原料分子中的 双键与亲电型卤化剂的加成是药物原料分子卤化的常用方 法,加成后得到相应的邻二卤化物。炔烃类含叁键的化合 物,在与卤素的加成中,叁键的反应活性比双键小得多, 应用远没有烯烃广泛。在药物合成技术中主要学习双键的 有关反应。
(三)常用卤化试剂
类别
分子式 Cl2
特
点
应用范围
常 见 卤 化 试 剂
Br2 HCl HBr HClO HBrO
活性高,易进行 ,但需注意反应的特 殊条件。
与不饱和键加成 • 在芳环上、芳环侧链上和羰 基α 位上取代
价廉易得,应用 广泛,反应条件要控 制。
不稳定,需新制 ;条件温和,但有副 产物。
CH2
CH2 + Cl2 + H2O
60
ClCH2CH2OH + HCl
用次溴酸合成氯霉素中间体(9):
H CH CH CH2OH
Br2/H2O
Br C CH2OH
C
OH H (9)
又如用N-卤化酰胺合成α–卤代醇:
O H C C + RC N Br
H2O
Br C C OH
三、卤素与芳香烃的反应பைடு நூலகம்
CCl4 60
杂环中的五员环(呋喃、吡咯、噻吩等),环中碳的 电子密度比苯大,均为多电子杂环,亲电取代活性大于苯 ,卤代要容易进行些; 六员杂环(吡啶、吡喃、吡嗪等),环中碳的电子密 度比苯小,均为缺电子杂环,使位碳上的电子密度减小, 亲电取代活性小于苯,卤代要难进行些。
卤代反应 ppt课件

卤化剂活性: CF3COOBr>>CH3COOBr>CF3COOI>>
CH3COOI>Cl2>BrCl>Br2>ICl>I2>HOX
ppt课件
21
溶剂:
烃类的卤取代07
极性溶剂(常用):稀醋酸、稀盐酸、氯仿或其他 卤代烃。
非极性溶剂:反应缓慢。四氯化碳
定位规律:
邻对位定位基团:反应快,形成三卤代物
羰酸衍生物的α卤取代反应
ppt课件
25
羰基的卤取代02
醛和酮的α-卤取代反应
酮的α-卤取代反应
• 含α -H的酮,其α -H原子可在一定条件下被卤代。 • 常用卤化剂:卤素、N-卤代酰胺、次卤酸酯、硫酰卤化 物等。 • 常用溶剂:卤代烃、醚和乙酸。
ppt课件
26
羰基的卤取代03
反应机理:卤化剂对烯醇式双键的亲电取代反应。
• 次卤酸酯:常用次卤酸叔丁酯
• N-卤代酰胺:NBA, NCA, NBS, NCS
ppt课件
11
不饱和烃加成08
加成产物符合马氏定位法则,卤素加成在双键的取代 较少的一端。
ppt课件
12
不饱和烃加成09
• NBS在含水的DMSO中与烯烃的反应,得高收率、高立体 选择性的对向加成产物(Dalton Reaction)。
反应温度 视活性而定,提高温度有利于均裂成自由基
ppt课件
18
CH3
Cl2/PCl5/hv 105-110
Cl2/(PhCOO)2/hv 200
CH2Cl
烃类的卤取代04
CCl3
90% 93%
1molNBS
Br 80%
药物合成反应习题 第一章 卤化反应ppt课件

O H
C r O /P y /C H C l 3 2 2
L i A l H / E t O 4 2
O H O H
C l C H C H C H ( C H ) C H O H 2 2 2 4 2 C l C H C H C H ( C H ) C O O C H 2 2 2 4 2 5
N a B H / E t O H 4
N R X N N+ N N X N NR N
环 六 亚 甲 基 四 胺 ( 乌 洛 托 品 )
四、药物合成反应课程的学习方法
3. 了解一些新试剂,新反应的特点、应用 范围,并与类似反应进行比较. 4.课后要做练习; 5.重视《药物合成实验》提高自己的动手 能力。
五.药物合成反应授课的要求和安排
H O 2
N H 2
B r
B r
(3)阻断基
• 阻断基的引入使反应物分子中某一活性部位被 封闭,让分子中其他活性低的部位发生反应并 顺利引入所需的基团,等目的达到后再除去阻 断基。
N H 2
( C H C O ) O 3 2
N H C O C H 3
H S O 9 8 % 2 4
N H C O C H 3
• 课堂讲授为主、自学为辅。课堂上的重 点突出,讲解主要内容及难点,因课时 有限,有部分内容要求同学自学。 • 课前要预习.
讨论与练习
1.学好本课程对从事药物及其中间体合 成工作有何意义? 2.药物合成反应有哪些特点?应如何学 习和掌握? 3.什么是导向基?具体包括哪些类型? 举例说明。 4.查阅报道药物合成领域的新技术及发 展动态资料?
药物合成反应习 题 第一章 卤化 反应
绪论
一、药物合成课程的目的 二、药物合成的发展趋势与新技术 三、药物合成反应课程教授内容 四、药物合成反应课程的学习方法 五、药物合成反应授课的要求和安排
C r O /P y /C H C l 3 2 2
L i A l H / E t O 4 2
O H O H
C l C H C H C H ( C H ) C H O H 2 2 2 4 2 C l C H C H C H ( C H ) C O O C H 2 2 2 4 2 5
N a B H / E t O H 4
N R X N N+ N N X N NR N
环 六 亚 甲 基 四 胺 ( 乌 洛 托 品 )
四、药物合成反应课程的学习方法
3. 了解一些新试剂,新反应的特点、应用 范围,并与类似反应进行比较. 4.课后要做练习; 5.重视《药物合成实验》提高自己的动手 能力。
五.药物合成反应授课的要求和安排
H O 2
N H 2
B r
B r
(3)阻断基
• 阻断基的引入使反应物分子中某一活性部位被 封闭,让分子中其他活性低的部位发生反应并 顺利引入所需的基团,等目的达到后再除去阻 断基。
N H 2
( C H C O ) O 3 2
N H C O C H 3
H S O 9 8 % 2 4
N H C O C H 3
• 课堂讲授为主、自学为辅。课堂上的重 点突出,讲解主要内容及难点,因课时 有限,有部分内容要求同学自学。 • 课前要预习.
讨论与练习
1.学好本课程对从事药物及其中间体合 成工作有何意义? 2.药物合成反应有哪些特点?应如何学 习和掌握? 3.什么是导向基?具体包括哪些类型? 举例说明。 4.查阅报道药物合成领域的新技术及发 展动态资料?
药物合成反应习 题 第一章 卤化 反应
绪论
一、药物合成课程的目的 二、药物合成的发展趋势与新技术 三、药物合成反应课程教授内容 四、药物合成反应课程的学习方法 五、药物合成反应授课的要求和安排
药物合成反应第1章卤化反应课件

a.当芳环上边有推电子基时,使反应容易进行, 且产物为邻、对位定位。如:
b.当芳环上边有吸电子基时,不利于反应,且产 物为间位定位。如:
②催化剂
NO 2
Br2, Fe
120-135℃, 3h
NO 2 Br
常用的有: AlCl3、SbCl5、FeCl3、FeBr3等。
③溶剂 (多为稀醋酸、稀盐酸等极性溶剂)
成时,可加入少量的路易斯(Lewis)酸进行催化。
ⅲ)温度
不宜太高,否则可能引起二卤化物脱卤化氢。
⑤光照或自由基引发:自由基加成
2. 卤素对炔烃的加成: 与烯烃加成机理类似 得到反式二卤烯烃
与SOCl2和BBr3的卤代:
二、 不饱和羧酸(酯)的卤内酯化反应
——不饱和羧酸的C=C双键上形成三元环卤正离子
②连有供电子基时,则自由基的稳定性增加。 ③对于开链烯烃,烯键α位亚甲基一般比α位甲基 容易卤代。如:
α位亚甲基
α位甲基
④NBS、NCS对烯丙位及苄位卤取代的选择性高。
应用:
CH3 COOH
Br2, PhCl 微微回流
CH 3 Br,hλ
Br 160-180℃
CH2Br
防晒药对氨苯甲酸的中间体
COOH
3. 应用 ①氟取代 ②氯取代 ③溴取代 ④碘取代
第三节 羰基化合物的卤取代反应
一、 醛和酮的α-卤取代反应
1. 酮的α-卤取代反应
亲电取代反应历程 常用卤化剂:卤素分子、N-卤代酰胺、次卤酸酯、 硫酰卤化物等 常用溶剂: 四氯化碳、氯仿、乙醚、醋酸等
①酸催化下的α-卤取代反应 反应机理:
主要影响因素:
对于无α-氢的芳醛,用卤素可直接取代醛基C上 的氢。如:
3. 羧酸及其衍生物的α-卤取代反应 羧酸α-氢不如醛、酮α-氢活泼,需在硫、磷等
b.当芳环上边有吸电子基时,不利于反应,且产 物为间位定位。如:
②催化剂
NO 2
Br2, Fe
120-135℃, 3h
NO 2 Br
常用的有: AlCl3、SbCl5、FeCl3、FeBr3等。
③溶剂 (多为稀醋酸、稀盐酸等极性溶剂)
成时,可加入少量的路易斯(Lewis)酸进行催化。
ⅲ)温度
不宜太高,否则可能引起二卤化物脱卤化氢。
⑤光照或自由基引发:自由基加成
2. 卤素对炔烃的加成: 与烯烃加成机理类似 得到反式二卤烯烃
与SOCl2和BBr3的卤代:
二、 不饱和羧酸(酯)的卤内酯化反应
——不饱和羧酸的C=C双键上形成三元环卤正离子
②连有供电子基时,则自由基的稳定性增加。 ③对于开链烯烃,烯键α位亚甲基一般比α位甲基 容易卤代。如:
α位亚甲基
α位甲基
④NBS、NCS对烯丙位及苄位卤取代的选择性高。
应用:
CH3 COOH
Br2, PhCl 微微回流
CH 3 Br,hλ
Br 160-180℃
CH2Br
防晒药对氨苯甲酸的中间体
COOH
3. 应用 ①氟取代 ②氯取代 ③溴取代 ④碘取代
第三节 羰基化合物的卤取代反应
一、 醛和酮的α-卤取代反应
1. 酮的α-卤取代反应
亲电取代反应历程 常用卤化剂:卤素分子、N-卤代酰胺、次卤酸酯、 硫酰卤化物等 常用溶剂: 四氯化碳、氯仿、乙醚、醋酸等
①酸催化下的α-卤取代反应 反应机理:
主要影响因素:
对于无α-氢的芳醛,用卤素可直接取代醛基C上 的氢。如:
3. 羧酸及其衍生物的α-卤取代反应 羧酸α-氢不如醛、酮α-氢活泼,需在硫、磷等
药物合成反应第一章卤化反应-PPT课件

反应机理
在亲电取代卤化反应中,卤 素离子首先与芳香环上的电 子云密度较高的区域结合, 形成正碳离子中间体。随后 ,正碳离子中间体发生重排 和消除质子,最终形成卤代 芳香烃。
影响因素
亲电取代卤化的反应速度和 选择性受多种因素的影响, 包括底物结构、反应条件( 如温度、催化剂、溶剂等) 、卤素原子的性质等。
药物合成反应第一章卤化反应ppt课件
目录
• 卤化反应简介 • 亲电取代卤化 • 亲核取代卤化 • 自由基卤化 • 其他卤化方式
01
卤化反应简介
卤化反应的定义
卤化反应
在有机化学中,卤化反应通常指 的是将氢原子替换为卤素(如氟 、氯、溴、碘)的反应。
卤化反应的分类
根据卤素和氢原子的取代位置, 卤化反应可以分为芳香族取代、 脂肪族取代和乙烯基取代等类型 。
非芳香族化合物的亲电取代卤化
01
非芳香族化合物的亲电取代卤化
对于非芳香族化合物,亲电取代卤化反应通常发生在具有电子富集基团
的碳-氢键上。这些基团可以是醇、醚、硫醇等。
02 03
反应机理
在非芳香族化合物的亲电取代卤化反应中,卤素离子首先与具有电子富 集基团的碳-氢键结合,形成正碳离子中间体。随后,正碳离子中间体 发生重排和消除质子,最终形成卤代烃。
HI>HBr>HCl。
溶剂和酸碱度
选择合适的溶剂和调整酸碱度 可以促进或抑制亲核取代卤化
的反应。
温度和压力
温度和压力也是影响亲核取代 卤化反应的重要因素。
04
自由基卤化
芳香族化合物的自由基卤化
总结词
芳香族化合物的自由基卤化是卤化反应的一种重要类型,主 要通过卤素与芳香族化合物发生自由基取代反应来实现。
卤化反应二.ppt
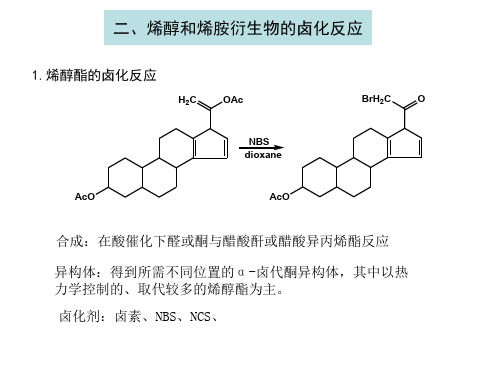
二、烯醇和烯胺衍生物的卤化反应
1.烯醇酯的卤化反应
H2C
OAc
NBS dioxane
BrH2C
O
AcO
AcO
合成:在酸催化下醛或酮与醋酸酐或醋酸异丙烯酯反应
异构体:得到所需不同位置的α-卤代酮异构体,其中以热 力学控制的、取代较多的烯醇酯为主。 卤化剂:卤素、NBS、NCS、
CH3(CH2)4CCH3 1) AcOC3H3/H2SO4
HX活性:HI>HBr>HCl>HF
• 碘代、溴代机理
R OH
X ( X = Br, I)
H R OH2
(SN2)
R X + H2O
(SN1) -H2O
好离去基
X
R
RX
• 氯代(Lucas试剂反应)机理
ZnCl2
- Cl
R OH
R O ZnCl
H Cl
好离去基
Cl R O ZnCl H
(SN1)
Cl
Me
H
N
Me
3.醇和卤化磷的反应
H3C
C CH CH2
PBr3
H3C OH
PE/r.t., 12h
H3C CC H
H3C
CH2Br
反应中仍有重排和异构副产物,这种方法只局限于对酸稳定的分 子,一个普遍的、重要的方法是将它们转化成烷氧磷酸酯,以活 化醇进行亲核取代反应
PCl3反应产率低
4.醇和有机磷卤化物的反应
OH Ph3PBr2
CH3CN 60-70°, 0.5h
Br 75%
HI或KI/H3PO4, HBr BF3, BCl3, BBr3
HO
三、醚的卤置换反应
1.烯醇酯的卤化反应
H2C
OAc
NBS dioxane
BrH2C
O
AcO
AcO
合成:在酸催化下醛或酮与醋酸酐或醋酸异丙烯酯反应
异构体:得到所需不同位置的α-卤代酮异构体,其中以热 力学控制的、取代较多的烯醇酯为主。 卤化剂:卤素、NBS、NCS、
CH3(CH2)4CCH3 1) AcOC3H3/H2SO4
HX活性:HI>HBr>HCl>HF
• 碘代、溴代机理
R OH
X ( X = Br, I)
H R OH2
(SN2)
R X + H2O
(SN1) -H2O
好离去基
X
R
RX
• 氯代(Lucas试剂反应)机理
ZnCl2
- Cl
R OH
R O ZnCl
H Cl
好离去基
Cl R O ZnCl H
(SN1)
Cl
Me
H
N
Me
3.醇和卤化磷的反应
H3C
C CH CH2
PBr3
H3C OH
PE/r.t., 12h
H3C CC H
H3C
CH2Br
反应中仍有重排和异构副产物,这种方法只局限于对酸稳定的分 子,一个普遍的、重要的方法是将它们转化成烷氧磷酸酯,以活 化醇进行亲核取代反应
PCl3反应产率低
4.醇和有机磷卤化物的反应
OH Ph3PBr2
CH3CN 60-70°, 0.5h
Br 75%
HI或KI/H3PO4, HBr BF3, BCl3, BBr3
HO
三、醚的卤置换反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
⑴ 烃类:以X2为卤化剂 氟化是高放热反应;氯化是放热反应;
溴化为中等放热,所有温度下,均有利于 向右方进行。
碘化则是吸热可逆反应。 但用ICl为碘化剂精选pp,t 则是放热反应。31
⑵ 乙烷:用 F2 进行取代氟化,发生C-C键 的断裂和聚合等副反应。 Why
精选ppt
32
• 加成卤化:
有机单元合成反应 ——
第四章
精选ppt
1
内容提要
• 取代卤化反应 • 加成卤化反应 • 置换卤化反应
小结
精选ppt
讨论
作业
2
主要内容(共14学时):
❖ 卤化反应的定义、目的、重要性
❖ 卤化剂,卤化反应的类型
❖ 芳环上的取代氯化(重点)
⑴ 亲电质点、反应历程及动力学(重 点:催化剂存在下Cl2的氯化)
• 氯化
应用最广泛、制备最经济的卤化反应。 大批氯化产品,如…具有广泛的工业用途。
精选ppt
9
Cl2价格低廉,供应量大,因此,氯化 产物品种多,产量大,是最重要的卤化反 应,也是本章讨论的重点。
• Cl2 ?
电 解
2 N a C l+ 2 H 2 O 2 N a O H + C l2 + H 2
精选ppt
CH3
X X
X X
环上加成
X
• 卤化中除加入特定卤化剂,常需加入催化剂
或活化剂,如光能、热能或游离基引发剂。
精选ppt
29
4.2 卤化热力学
• •
性碳
卤
和卤 加 取 化
反键 成 代 反
应的 卤 卤 应
活稳 化 化 热
性定
精选ppt
30
4.2.1 卤化反应热
某些卤化反应的反应热见表3-2
• 取代卤化:
Cl
OC2H5
乙氧基化
NO2
NO2
精选ppt
16
4.1.3 卤化剂
• 分子态卤素:Cl2、Br2 、I2 ; • 卤素的酸 + 氧化剂:
HCl(HBr)+ O2、NaClO、NaBrO、NaClO3、 NaBrO3、H2O2 等;
• 金属或非金属卤化物:FeCl3、PCl3、PCl5;
• 其他:SOCl2、SO2Cl2、HOCl、COCl2、 SCl2、 ICl、 RNHCl、 RSO2NHCl
C 6 H 6 + C l 2F e C l 3 C 6 H 5 C l+ H C l C 6 H 5 C H 3 + C l 2h vC 6 H 5 C H 2 C l+ H C l
h v C H 4 + C l2精选ppt C H 3 C l+ H C l 27
⑵ 加成卤化:
C 6 H 6 + 3 C l 2 h vC 6 H 6 C l 6 ( 六 六 六 ) H C C H + 2 C l 2F e C l 3C l 2 C H C H C l 2
精选ppt
19
• 实例精选ppt20Fra bibliotek精选ppt
21
精选ppt
22
4.1.3.2 溴化剂
• 分类 • 实例
精选ppt
23
4.1.3.3 碘化剂
精选ppt
24
4.1.3.4 氟化剂
精选ppt
25
精选ppt
26
4.1.4 卤化反应的类型
• 引入卤素的方法? 取代卤化、置换卤化、加成卤化
⑴ 取代卤化:包括芳烃环上取代、侧链取代 和脂肪烃的取代卤化。
• 卤化反应 ? 向有机化合物分子中的C原子上引入卤
原子的反应。 • 根据引入卤原子的不同,分为:
氟化
卤
氯化
化
溴化
碘化 精选ppt
7
• 根据引入卤原子的方式,分为:
取代卤化
卤
加成卤化
化
置换卤化
精选ppt
8
氟、氯、溴、碘虽同属卤素,但其性 质存在较大差异,因而其合成方法有很大 区别。
原料性质以及制备产物的结构对卤化 方法的选择有密切关系。
SO2Cl2是引入Cl的高活性反应剂,SO2Cl2、 SCl2、AlCl3 相混合为高氯化剂。
精选ppt
17
• 置换卤化剂? HF、KF、NaF、SbF5、HCl、HBr、NaBr
4.1.3.1 氯化剂 4.1.3.2 溴化剂 4.1.3.3 碘化剂 4.1.3.4 氟化剂
精选ppt
18
4.1.3.1 氯化剂(氯化剂的分类)
精选ppt
12
• 碘化
碘价格昂贵,资源比其他几种卤素少 得多,应用范围也小得多,仅用于少数医 药、农药及染料。
精选ppt
13
• 总之: 卤化是精细有机合成最重要反应之一。
大规模生产 ?
氯和氟有机单体(氯乙烯、四氟乙烯)
有机溶剂 (四氯化碳、二氯乙烷、氯苯等)
制冷剂(氟里昂)
还广泛用来制取农药、医药、增塑剂、
Schiemann反应(重点)
精选ppt
4
❖ 加成卤化:卤素和卤化氢对双键的加成 ❖ 置换卤化
卤素置换羟基、硝基、磺酸基; 重点:卤素置换重氮基
Sandmeyer反应
精选ppt
5
4.1 概述
•
•
• •
型卤 卤 的卤 义卤
化 化 化 及化
反 剂 反 重反
应
应 要应
的
的 性的
类
目定
精选ppt
6
4.1.1 卤化反应的定义及重要性
润滑剂、阻燃剂、染料、颜料及橡胶防老
剂等的中间体。 精选ppt
14
4.1.2 卤化反应的目的
• 赋予有机化合物一些新的性能,得到 性能优异的最终产品。
• 卤素衍生物→卤基转换→一系列含有 其他基团的中间体产品。
精选ppt
15
C l
N H 2
N O 2+N H 3 氨 解
N O 2+N H 4C l
⑶ 置换卤化:卤素置换硝基、磺酸基、羟 基、重氮基
C 2 H 5 O H + H C lZ n C l 2C 2 H 5 C l+ H 2 O
• 甲苯的卤化?
精选ppt
28
CH3
CH3
CH3 + X2
催化剂:FeCl3 △
光照hv或过氧化物 △
光照hv 冷却
X+
环上取代
CH2X
X CHX2
同前步
侧链取代
10
• 溴化
溴的资源相对较少,溴化物常具有某 些功能性用途。如……
溴化物中的Br原子较活泼,易为其他 基团置换,常被应用于精细化工产品的有 机合成。
精选ppt
11
• 氟化
氟的自然资源较广,许多氟化物具有 突出的优点,如……
氟化还可用于润滑油、烹饪用具涂料、 火箭燃料、染料等的合成。
近年来对氟化物的合成十分重视,但 氟活性太高,一般要用间接方法制备。
⑵ 影响因素:被卤化物性质、氯化深 度、操作方式、混合作用、反应介质、原
料纯度、反应温度 精选ppt
3
⑶ 实例
❖ 羰基α-氢的取代卤化
❖ 芳烃的侧链取代卤化(重点)
反应理论及实例,氯甲基化反应
❖ 饱和烃的取代卤化(自学)
❖ 烯键α-氢的取代卤化(自学)
❖ 氟化、溴化、碘化
Finkelstein卤素交换反应
溴化为中等放热,所有温度下,均有利于 向右方进行。
碘化则是吸热可逆反应。 但用ICl为碘化剂精选pp,t 则是放热反应。31
⑵ 乙烷:用 F2 进行取代氟化,发生C-C键 的断裂和聚合等副反应。 Why
精选ppt
32
• 加成卤化:
有机单元合成反应 ——
第四章
精选ppt
1
内容提要
• 取代卤化反应 • 加成卤化反应 • 置换卤化反应
小结
精选ppt
讨论
作业
2
主要内容(共14学时):
❖ 卤化反应的定义、目的、重要性
❖ 卤化剂,卤化反应的类型
❖ 芳环上的取代氯化(重点)
⑴ 亲电质点、反应历程及动力学(重 点:催化剂存在下Cl2的氯化)
• 氯化
应用最广泛、制备最经济的卤化反应。 大批氯化产品,如…具有广泛的工业用途。
精选ppt
9
Cl2价格低廉,供应量大,因此,氯化 产物品种多,产量大,是最重要的卤化反 应,也是本章讨论的重点。
• Cl2 ?
电 解
2 N a C l+ 2 H 2 O 2 N a O H + C l2 + H 2
精选ppt
CH3
X X
X X
环上加成
X
• 卤化中除加入特定卤化剂,常需加入催化剂
或活化剂,如光能、热能或游离基引发剂。
精选ppt
29
4.2 卤化热力学
• •
性碳
卤
和卤 加 取 化
反键 成 代 反
应的 卤 卤 应
活稳 化 化 热
性定
精选ppt
30
4.2.1 卤化反应热
某些卤化反应的反应热见表3-2
• 取代卤化:
Cl
OC2H5
乙氧基化
NO2
NO2
精选ppt
16
4.1.3 卤化剂
• 分子态卤素:Cl2、Br2 、I2 ; • 卤素的酸 + 氧化剂:
HCl(HBr)+ O2、NaClO、NaBrO、NaClO3、 NaBrO3、H2O2 等;
• 金属或非金属卤化物:FeCl3、PCl3、PCl5;
• 其他:SOCl2、SO2Cl2、HOCl、COCl2、 SCl2、 ICl、 RNHCl、 RSO2NHCl
C 6 H 6 + C l 2F e C l 3 C 6 H 5 C l+ H C l C 6 H 5 C H 3 + C l 2h vC 6 H 5 C H 2 C l+ H C l
h v C H 4 + C l2精选ppt C H 3 C l+ H C l 27
⑵ 加成卤化:
C 6 H 6 + 3 C l 2 h vC 6 H 6 C l 6 ( 六 六 六 ) H C C H + 2 C l 2F e C l 3C l 2 C H C H C l 2
精选ppt
19
• 实例精选ppt20Fra bibliotek精选ppt
21
精选ppt
22
4.1.3.2 溴化剂
• 分类 • 实例
精选ppt
23
4.1.3.3 碘化剂
精选ppt
24
4.1.3.4 氟化剂
精选ppt
25
精选ppt
26
4.1.4 卤化反应的类型
• 引入卤素的方法? 取代卤化、置换卤化、加成卤化
⑴ 取代卤化:包括芳烃环上取代、侧链取代 和脂肪烃的取代卤化。
• 卤化反应 ? 向有机化合物分子中的C原子上引入卤
原子的反应。 • 根据引入卤原子的不同,分为:
氟化
卤
氯化
化
溴化
碘化 精选ppt
7
• 根据引入卤原子的方式,分为:
取代卤化
卤
加成卤化
化
置换卤化
精选ppt
8
氟、氯、溴、碘虽同属卤素,但其性 质存在较大差异,因而其合成方法有很大 区别。
原料性质以及制备产物的结构对卤化 方法的选择有密切关系。
SO2Cl2是引入Cl的高活性反应剂,SO2Cl2、 SCl2、AlCl3 相混合为高氯化剂。
精选ppt
17
• 置换卤化剂? HF、KF、NaF、SbF5、HCl、HBr、NaBr
4.1.3.1 氯化剂 4.1.3.2 溴化剂 4.1.3.3 碘化剂 4.1.3.4 氟化剂
精选ppt
18
4.1.3.1 氯化剂(氯化剂的分类)
精选ppt
12
• 碘化
碘价格昂贵,资源比其他几种卤素少 得多,应用范围也小得多,仅用于少数医 药、农药及染料。
精选ppt
13
• 总之: 卤化是精细有机合成最重要反应之一。
大规模生产 ?
氯和氟有机单体(氯乙烯、四氟乙烯)
有机溶剂 (四氯化碳、二氯乙烷、氯苯等)
制冷剂(氟里昂)
还广泛用来制取农药、医药、增塑剂、
Schiemann反应(重点)
精选ppt
4
❖ 加成卤化:卤素和卤化氢对双键的加成 ❖ 置换卤化
卤素置换羟基、硝基、磺酸基; 重点:卤素置换重氮基
Sandmeyer反应
精选ppt
5
4.1 概述
•
•
• •
型卤 卤 的卤 义卤
化 化 化 及化
反 剂 反 重反
应
应 要应
的
的 性的
类
目定
精选ppt
6
4.1.1 卤化反应的定义及重要性
润滑剂、阻燃剂、染料、颜料及橡胶防老
剂等的中间体。 精选ppt
14
4.1.2 卤化反应的目的
• 赋予有机化合物一些新的性能,得到 性能优异的最终产品。
• 卤素衍生物→卤基转换→一系列含有 其他基团的中间体产品。
精选ppt
15
C l
N H 2
N O 2+N H 3 氨 解
N O 2+N H 4C l
⑶ 置换卤化:卤素置换硝基、磺酸基、羟 基、重氮基
C 2 H 5 O H + H C lZ n C l 2C 2 H 5 C l+ H 2 O
• 甲苯的卤化?
精选ppt
28
CH3
CH3
CH3 + X2
催化剂:FeCl3 △
光照hv或过氧化物 △
光照hv 冷却
X+
环上取代
CH2X
X CHX2
同前步
侧链取代
10
• 溴化
溴的资源相对较少,溴化物常具有某 些功能性用途。如……
溴化物中的Br原子较活泼,易为其他 基团置换,常被应用于精细化工产品的有 机合成。
精选ppt
11
• 氟化
氟的自然资源较广,许多氟化物具有 突出的优点,如……
氟化还可用于润滑油、烹饪用具涂料、 火箭燃料、染料等的合成。
近年来对氟化物的合成十分重视,但 氟活性太高,一般要用间接方法制备。
⑵ 影响因素:被卤化物性质、氯化深 度、操作方式、混合作用、反应介质、原
料纯度、反应温度 精选ppt
3
⑶ 实例
❖ 羰基α-氢的取代卤化
❖ 芳烃的侧链取代卤化(重点)
反应理论及实例,氯甲基化反应
❖ 饱和烃的取代卤化(自学)
❖ 烯键α-氢的取代卤化(自学)
❖ 氟化、溴化、碘化
Finkelstein卤素交换反应
