电化学习题课[1]
电化学习题课

ln(1.00×0.809/1.00) 4
ΔrGm=-zFE=-2×(96485 C· -1)×(1.3692V) mol =-264.2kJ· -1<0 mol ②负极: 正极: Zn(s) Zn2+(0.00500 mol· -1)+2e kg 2Ag(s)+2Cl-(0.0100 mol· -1) kg Zn2+(0.00500 mol· -1) + kg
ห้องสมุดไป่ตู้
解:
负极:H2(py) 正极:Hg2Cl2(s)+2e
2H+(0.100 mol· -1)+2e kg 2Hg(l)+2Cl-(0.100 mol· -1) kg 2Hg(l)+2HCl(0.100 mol· -1) kg
电池反应:H2(py)+Hg2Cl2(s) 25℃时,
E=[0.0694+1.881×10-3(T/K)-2.9×10-6(T/K)2]V =[0.0694+1.881×10-3×298.15-2.9×10-6×298.152]V =0.3724V
解:(l/A)=(KCl)/G=(KCl)R=(0.141S/m)×( 525Ω) =74.025 m-1
(NH4OH) =(l/A) G=(l/A) / R=(74.025 m-1)÷(2030Ω)
=0.03647Ω-1· -1 m
m(NH4OH) =( NH4OH)/c=(0.03647Ω-1· -1)÷( 1.00×102mol· -3) m m
(E/T)p=[1.881×10-3-2×2.9×10-6(T/K)]V· -1 K
=[1.881×10-3-2×2.9×10-6×298.15]V· -1 K
=1.5173×10-4 V· -1 K ΔrSm=zF(E/T)p =2×(96485 C· -1)×(1.5173×10-4 V· -1) mol K =29.28J· mol-1· -1 K
电化学相平衡-习题课讲解

(1)只有 (NH4 )2 CO3(s) 存在,指的是
NH3(g), H2O(g),CO2 (g)
均由 (NH4 )2 CO3(s)
分解出来的,所以有两个浓度限制条件。
f C 2 (S R R') 2 (4 1 2) 2 2 1
(2)反应前四种物质都有时:
7. 2 分 (3893) 离子迁移率的单位是___________。
8. 2 分 (3601) 如在标准状况下,阳极析出 22.4 dm3氧 气,则通过电池的电量为 ________ 。
12
9. 2 分 (3843) 已知 18℃时,Ba(OH)2,BaCl2,NH4Cl 溶液的无限稀释摩尔电导率分别为 2.88×10-2,1.203×10-2,1.298×10-2 S·m2·mol-1,那么 18℃时 NH3·H2O 的
(C) E1= E2
(D) E1≥ E2
7
8. (4333) 电池
Pt,H2(10 kPa)│HCl(1.0 molkg-1)│H2(100kPa),Pt 是否为自发电池?_____ E=________V。
9. 2 分 (4335)
将反应
Ag2SO4(s)=2 2
Ag++SO42-
设计成电池,其书面表示式为: 4 (aq)│Ag2SO4(s),Ag(s)
值 ,1/,2
(b) H+ 离子在 HCl 乙醇溶液中的迁移数 t+
(b)
H+
和
Cl-
离子的无限稀释离子摩尔电导率
H
+
Cl
已知 m(HCl) = 8.38×10-3 S·m2·mol-1
电化学原理_(李狄_著)北航出版社_课后1-7章习题参考答案

电化学原理第一章习题答案1、解:2266KCl KCl H O H O 0.001141.31.010142.31010001000c K K K K cm 11λ−−−−×=+=+=+×=×Ω溶液 2、解:E V Fi i =λ,FE V i i λ=,,, 10288.0−⋅=+s cm V H 10050.0−⋅=+s cm V K 10051.0−⋅=−s cm V Cl 3、解:,62.550121,,,,2−−⋅Ω=−+=eq cm KCl o HCl o KOH o O H o λλλλ2O c c c ,c 1.004H H +−====设故,2,811c5.510cm 1000o H O λκ−−−==×Ω4、(1)121,,Cl ,t t 1,t 76.33mol (KCl o KCl o Cl cm λλλλλ−−−−+−+−=++=∴==Ω⋅∵中)121121121,K ,Na ,Cl 73.49mol 50.14mol 76.31mol (NaCl o o o cm cm cm λλλ++−−−−−−−=Ω⋅=Ω⋅=Ω⋅同理:,,中)(2)由上述结果可知: 121Cl ,Na ,121Cl ,K ,mol 45.126mol 82.142−−−−⋅Ω=+⋅Ω=+−+−+cm cm o o o o λλλλ,在KCl 与NaCl 溶液中−Cl ,o λ相等,所以证明离子独立移动定律的正确性;(3) vs cm vs cm u vs cm u F u a o o l o l o i o /1020.5,/1062.7,/1091.7,/24N ,24K ,24C ,C ,,−−−×=×=×==++−−λλ5、解:Cu(OH)2== Cu 2++2OH -,设=y ;2Cu c +OH c −=2y 则K S =4y 3因为u=Σu i =KH 2O+10-3[y λCu 2++2y λOH -]以o λ代替λ(稀溶液)代入上式,求得y=1.36×10-4mol/dm 3所以Ks=4y 3=1.006×10-11 (mol/dm 3)36、解: ==+,令=y ,3AgIO +Ag −3IO Ag c +3IO c −=y ,则=y S K 2,K=i K ∑=+(y O H K 2310−+Ag λ+y −3IO λ)作为无限稀溶液处理,用0λ代替,=+y O H K 2310−3AgIO λ则:y=43651074.1104.68101.11030.1−−−×=××−×L mol /;∴= y S K 2=3.03810−×2)/(L mol 7、解:HAc o ,λ=HCl o ,λ+NaAc o ,λ-NaCl o ,λ=390.7,121−−⋅Ωeq cm HAc o ,λ=9.02121−−⋅Ωeq cm ∴α0/λλ==0.023,==1.69αK _2)1/(V αα−510−×8、解:由欧姆定律IR=iS KS l ⋅=K il,∵K=1000c λ,∴IR=1000il cλ⋅=V 79.05.0126101010533≈××××− 9、解:公式log ±γ=-0.5115||||+Z −Z I (设25)C °(1)±γ=0.9740,I=212i i z m ∑,I=212i i c z ∑,=()±m ++νm −−νm ν1(2)±γ=0.9101,(3)±γ=0.6487,(4)±γ=0.811410、解:=+H a ±γ+H m ,pH=-log =-log (0.209+H a 4.0×)=1.08电化学原理第二章习题答案1、 解:()+2326623Sb O H e Sb H O ++++ ,()−236H H +6e + ,电池:2322323Sb O H Sb H O ++解法一:00G E nF ∆=−83646F =0.0143V ≈,E=+0E 2.36RT F 2232323log H Sb O Sb H OP a a a ==0.0143V0E 解法二:0602.3 2.3log log 6Sb Sb H H RT RT a a F Fϕϕϕ+++=+=+; 2.3log H RTa Fϕ+−=∴000.0143Sb E E ϕϕϕ+−=−===V2解:⑴,(()+22442H O e H O +++ )−224H H +4e + ;电池:22222H O H O +2220022.3log 4H O H O P P RT E E E Fa =+= 查表:0ϕ+=1.229V ,0ϕ−=0.000V ,001.229E V ϕϕ+−∴=−= ⑵视为无限稀释溶液,以浓度代替活度计算()242Sn Sn e ++−+ ,(),电池:32222Fe e Fe ++++ 23422Sn Fe Sn Fe 2+++++ +23422022.3log 2Sn Fe Sn Fe C C RT E E F C C ++++=+=(0.771-0.15)+220.05910.001(0.01)log 20.01(0.001)××=0.6505V ⑶(),,(0.1)Ag Ag m e +−+ ()(1)Ag m e Ag +++ (1)(0.1)Ag m Ag m ++→电池:(1)0(0.1)2.3log Ag m Ag m a RT E E F a ++=+,(其中,=0) 0E 查表:1m 中3AgNO 0.4V γ±=,0.1m 中3AgNO 0.72V γ±=, 2.310.4log0.0440.10.72RT E V F×∴==× 3、 解:2222|(),()|(),Cl Hg Hg Cl s KCl m Cl P Pt ()2222Hg Cl Hg Cl e −−++ ,()222Cl e Cl −++ ,222Hg Cl Hg Cl 2+ 电池:222200002.3log 2Cl Hg Hg Cl P a RT E E E F a ϕϕ+−=+==−∵O 1.35950.2681 1.0914(25C)E V ,∴=−=设 由于E 与无关,故两种溶液中的电动势均为上值Cl a −其他解法:①E ϕϕ+=−−0,亦得出0E ϕϕ+=−−②按Cl a −计算ϕ+,查表得ϕ甘汞,则E ϕϕ+=−甘汞 4、 ⑴解法一:23,(1)|(1)()H Pt H atm HCl a AgNO m Ag +=()222H H e +−+ 222,()Ag e Ag +++ g ,2222H Ag H A ++++ 电池:有E ϕϕϕ+−=−=+,02.3log()AgAgAg RTE m Fϕγ++±∴=−。
电化学习题课-1

答案:C
课堂练习:
电池 Pt H 2 p $
H 2 SO 4 0.01m O 2 p $
Pt
在298K时,该电池的电动势为1.228V,H2O(l)的生 成焓为-286.06kJ.mol-1 (A)写出该电池的电极反应和电池反应 (B)求298K时该电池电动势的温度系数 (C)求298K时该电池可逆放电时的热效应 (D)求标准电池电动势
注意等式中物质的量的一致性,都用电子的物质的量或者 Pb2+的物质的量。
n终=n前+n电-n迁
课后习题的关键点:
20.画出下列电导滴定的示意图: (1)用NaOH滴定C6H5OH; (2)用NaOH滴定HCl; (3)用AgNO3滴定K2CrO4; (4)用BaCl2滴定TI2SO4。 知识点: 1)相同浓度下,强电解质的电导率远大于弱电解质; 2)相同条件下,H+的电迁移速率最大,其次OH-。 其次还要知道化合物的溶解性,Ag2CrO4, BaSO4, TICl均难溶或微溶于水。
TI+|
Pt 的电极电势
2
1
= 1.250 V
TI 的电极电势
= -0.336 V,则TI 3+| TI 的电
极电势 3 为( )。
(a) 0.305 V (b) 0.721 V (c) 0.914 V (d) 1.586 V
答案:b
下周习题课: 电极电势及电池电动势的计算及其应用 (1)求热力学函数的变化值 (2)判断反应趋势 (3) 求一价离子的迁移数t+,t(4)求化学反应的平衡常数 (5)求微溶盐活度积 (6)求离子平均活度系数 (7)pH值的测定 (8)E(Ox|Red)- pH图
电化学(习题)PPT课件

(H 2O) m (H 2O c )547.82×10-4 ×1.004×10-4
=5.500×10-6 S m-1
故经离子交换剂处理过的水,其电导率愈接 近此值,表明水的纯度愈高。一般能达到10-6的数 量级,即为高纯度的水。
a m m
m
m m
I
1 2
B
mB zB2
lg Azz I
(德拜—尤格尔活度 系数极限公式)
-
3
一. 电解质溶液
例题1: 通电于 Au(NO3)3 溶液,电流强度 I0.025A, 析出 Au(s)=1.20g。已知 M (A u)=197.0gm ol-1。 求:
⑴ 通入电量 Q ; ⑵ 通电时间 t ;
1.写电池的电极反应、电池反应和设计电池
例题 写出下列电池的电极反应和电池反应。 Pt,H2(pH2)|NaOH(m)|HgO(s)|Hg(l)
-
29
a (-) H2( p H 2 )+2OH –( O H )→2H2O(l)+2e -
a (+) HgO(s)+H2O(l)+2e -→2OH –( O H )+Hg(l)
cm m
=1.81×10-4×10-3/(1.383×10-2) =1.31×10-5 mol·dm-3 KSP=(cm)2=(1.31×10-5)2 =1.72×10-10mol2·dm-6
-
15
例题7
分别计算下列两个溶液的平均质量摩尔浓度 m
离子的平均活度
B
电 解 质 m/mol·kg-1
第一课时原电池习题带答案

第一课时化学能转化为电能1.下列有关原电池的叙述中正确的是()A.把电能转变为化学能的装置B.活泼金属作正极,不活泼金属或非金属作负极C.外电路中电子从负极流向正极D.正极发生氧化反应2.如下图,下列装置属于原电池的是()3.一个原电池的总反应的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池的合理组成是()选项正极负极电解质溶液A Zn Cu CuCl2B Cu Zn H2SO4C Cu Zn CuSO4D Zn Fe CuCl24.如图所示装置,电流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的()A.A是Zn,B是Cu,C为稀硫酸B.A是Cu,B是Zn,C为稀硫酸C.A是Fe,B是Ag,C为稀AgNO3溶液D.A是Ag,B是Fe,C为稀AgNO3溶液5.某学生用如图装置研究原电池原理,下列有关说法错误的是()A.图(3)中Zn片增重质量与Cu片减轻质量的比为65∶64B.图(2)中如果两极上都有气体产生,则说明Zn片不纯C.图(1)中铜片上没有气体产生D.图(2)与图(3)中正极生成物的质量比为1∶32时,Zn片减轻的质量相等6.如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,在卡片上描述合理的是()实验后的记录:①Zn为正极,Cu为负极②H+向负极移动③电子流动方向:从Zn经外电路流向Cu④Cu极上有H2产生⑤若有1 mol电子流过导线,则产生H2 0.5 mol⑥正极的电极反应式为Zn-2e-===Zn2+7.按下图装置进行实验,若x轴表示流入正极的电子的物质的量,则y轴可以表示()①c(Ag+)②c(NO-3)③a棒的质量④b棒的质量⑤溶液的质量A.①③B.②④C.①③⑤D.②④⑥8.现有M、N、P、E四种金属,已知:①M+N2+===N+M2+;②M、P 用导线连接放入硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。
习题课---电化学_动力学部分

《物理化学》习题课 (电化学、动力学部分)(中科院2009硕士入学考试)1. 某药物分解反应为一级反应,298K 时,反应速率常数k 为0.46h -1,若服用该药物0.16g ,则体内停留多长时间分解90%?A) 3h B) 5h C) 4.6h D) 6h2. 升高温度可以增加反应速率,主要原因是A) 增加分子总 B) 增加活化分子总数C) 降低反应的活化能 D) 使反应向吸热方向进行3. 浓度为0.001 mol/L 的硫酸钠溶液的电导率为0.026 S.cm 2,当该溶液饱和了硫酸钙以后,电导率上升为0.070 S.cm 2,求硫酸钙的活度积(已知Na +与1/2Ca 2+的摩尔电导率分别为5.0×10-3和6.0×10-3 S.m 2.mol -1)4. 某气相反应12()()()k k A g B g C g −−→+←−−,在298K 时,K 1=0.2s -1,K 2=5×10-6 pa ∙s -1,当温度升高到310K 时,K 1和K 2均增加1倍,求:(1)298K 的平衡常数; (2)正逆反应的表观活化能; (3)反应的r m H ∆; (4)在298K 时,A 的起始压力为101.325kpa ,总压力到151.99kpa 时,需时间多少?(中科院2007硕士入学考试)5. 某反应的速率常数与各基元反应的速率常数的关系为124()2k k k k =,则该反应的表观活化能E a 与各基元反应活化能的关系为: (A) 21412a E E E E =+- (B) 2141()2a E E E E =+- (C) 1/2214(2)a E E E E =+- (D) 214a E E E E =+-6. 在化学反应动力学中,反应级数是个宏观的概念,其值 。
(A )只能是正整数; (B )可正、可负、可为零,可以是整数,也可以是分数;(C )只能是0,1,2,3,· ; (D )无法确定。
化学电化学练习题了解电解质电池和电解过程

化学电化学练习题了解电解质电池和电解过程化学电化学是研究电和化学反应之间相互作用的科学领域。
本文将介绍电解质电池和电解过程,并通过练习题来深入了解相关概念和原理。
一、电解质电池电解质电池是将化学能转化为电能的装置。
它由电解质中的正负离子以及在电解质溶液中的电极构成。
电解质电池根据电化学反应的方向分为两类:蓄电池和燃料电池。
练习题1:什么是电解质电池?请举例说明。
解答:电解质电池是将化学能转化为电能的装置。
例如,铅酸蓄电池是常见的电解质电池之一。
它通过电化学反应将铅和过硫酸铅转化为铅二氧化物和硫酸铅,在过程中释放出电能。
二、电解过程电解过程是指通过外加电压将化学反应逆反应的过程。
在电解过程中,正极受电子流的输送而发生氧化反应,负极发生还原反应。
这些反应使离子在溶液中进行迁移,并在电极上发生反应。
练习题2:请描述电解过程的基本原理。
解答:在电解过程中,外加电压促使正极发生氧化反应,负极发生还原反应。
正极释放电子到外部电路,负极从外部电路获取电子。
同时,溶液中的离子根据各自的电荷被吸引到相应的电极上。
这样,正离子向负极迁移,负离子向正极迁移,从而在电解质溶液中形成电流。
三、练习题1. 在铜盘中放入含有硫酸铜溶液的电解质池,通过外加电压,在铜盘上生成铜金属。
请简述这一实验的电解过程。
解答:在这个实验中,外加电压促使正极(铜盘)发生还原反应,负极(电解质池)发生氧化反应。
铜盘上的铜离子被电子还原成铜原子,并在铜盘上电镀出固体铜金属。
硫酸铜溶液中的硫酸根离子被氧化成氧分子和水,释放出电子供给铜盘上的还原反应。
2. 电池A由铝电极和铁电极组成,电池B由铜电极和铁电极组成。
通过实验数据可知,电池A的电动势为2.1V,电池B的电动势为0.34V。
根据电动势的定义,判断A和B电池中的正、负极反应情况,并解释电动势的大小与正、负极反应的关系。
解答:根据电动势的定义,电动势等于正极反应的标准电极电势与负极反应的标准电极电势之差。
电化学原理习题课-资料

(+) Ag eAg
02.3F RT lo1g0 (.4)0 02.3F RT lo1g0 (.7)2
E 2 .3 R[T l1 o 0 .4 g) 0 (lo 0 .1 g 0 .7 () 2 0 .0V 44 F
设计电池时要写对电池组。
0(P|S t 2 n , S4 n)0.15 V4
E 0 0 ( P |F 3 , t F 2 e ) 0 e ( P |S 2 , t S n 4 ) n 0 . 7 0 . 1 7 0 . 5 6 1 V 4 1
所以,E E 0 2 .3 RlT o c S2 g n c F 23 e 0 .6 1 0 .0 75 lo 0 9 .0 g 1 0 (0 .0 1 )21 0 .6V 5
2 F cc 2 S4 n F 2 e
2 0 .0 ( 1 0 .0)2 01
问题:
2.3RT
① 200C时, F 0.0581 250C 时,2.3RT 0.0591
同时第6章习题F4也有类似情况。
②能斯特方程“+”“-”号, 平衡电位——氧化态、还原态 电动势——反应物、生成物
③活度计算公式
所以电极表面带正电。 ①当电极在零电荷电位时电极表面无双电层结构,界面层
中正负离子浓度相等,电位为0,如下图所示。
0
C+=C—
a 0
X
X
②电极在平衡电位时,其双电层结构示意图和双电层内离 子浓度分布与电位分布图如下图。
a
a 1
注意:①画图紧密层厚度为d; ②外电位写法为ψ1 ,而不是φ1。
子平均活度系数 0.544
高中化学必修课----《电化学》单元复习知识讲解及巩固练习题(含答案解析)

电镀池 应用电解原理在某些金属表面镀 上一层其他金属(或合金)的装 置
装置 举例
①活泼性不同的两电极(连 ①两电极接直流电源
①镀层金属接电源正极。镀件(待
接)
②两电极插入电解质溶液
形成
②电解质溶液(电极插入其 ③形成闭合回路
条件
中并与电极自发反应)
镀金属)接电源负极 ②电镀液必须含有镀层金属离子 (电镀过程浓度不变)
相对原子质量小。
附:用惰性电极电解下列电解质溶液变化情况简析
类型
电极反应特点
实例 电解物质 电解质 pH
电解质
溶液浓度
溶液复原
电解水型 阴极:2H++2e-=H2↑ 阳极:4OH--4e-=2H2O+O2↑
电解 电解质电离出的阴、阳离子分别
NaOH H2SO4 Na2SO4 HCl
水 水 水 电解质
③形成闭合回路
负极:较活泼金属(电子流 阳极:与电源正极相连的极 名称同电解池,但有限制条件
电极 出的极)
阴极:与电源负极相连的极 阳极:必须是镀层金属
名称 正极:较不活泼金属或能导
阴极:镀件
电的非金属(电子流入的极)
负极:发生氧化反应,失电 阳极:发生氧化反应,溶液 阳极:镀层金属电极失电子(溶
子
量不变,则此电极上一定有气体产生,且该气体一定是 H2。 4、溶液中,若阳离子的放电能力强于 H+,而阴离子的放电能力强于 OH-时,电解的实质是:电解电解
质本身。
5、溶液中,若阳离子的放电能力强于 H+,而阴离子的放电能力弱于 OH-时,电解的实质是:电解质的
阳离子和水电离出的 OH-放电,溶液的 pH 一定变小。如电解 CuSO4 溶液。 6、溶液中,若阳离子的放电能力弱于 H+,而阴离子的放电能力强于 OH-时,电解的实质是:电解质的
习题电化学

(B )
(B) 还原电势与其超电势之代数和愈正的粒子愈容易析出
(C) 还原电势愈负的粒子愈容易析出
(D) 还原电势与其超电势之和愈负的粒子愈容易析出
上一内容 下一内容 回主目录
返回
2019/7/21
典型例题
21.一贮水铁箱上被腐蚀了一个洞,今用一金属片焊接在
洞外面以堵漏,为了延长铁箱的寿命,选用哪种金属片
S·m2·mol-1.
解:k(HAc)/k(KCl)=R(KCl)/R(HAc) 求得: k(HAc) = 0.01623 S·m-1
m(HAc) = k(HAc)/c = 0.001623 S·m2·mol-1 = m/= 0.04154 K = (c/c )·2/1- = 1.8×10-5
返回
2019/7/21
典型例题
23.电池放电时,随电流密度增加阳极电位变 _正____,阴极 电位变 _负___,正极变 __负____ ,负极变__正___。
24.在锌电极上 ,H2的超电势为 0.75 V,电解一含Zn2+的浓 度为 1×10-5 mol·kg-1的溶液,为了不使 H2(g) 析出,问溶 液的 pH 值应控制在 __>_2_._7_2____ 。
返回
2019/7/21
主要内容
二、可逆电池的电动势及其应用
4.电动势产生的机理 5.电动势的测定及其应用
三、电解与极化作用
1.分解电压 2.极化作用 3.电解时电极上的竞争反应 4.金属的电化学腐蚀与防腐 5.化学电源
上一内容 下一内容 回主目录
返回
2019/7/21
典型例题
1. 使2000A的电流通过一个铜电解器,在1h内 得到的铜的质量是..................................( D )
大学物理化学习题课(上课)-电化学(1)

∵ KCl溶液中t+ = t- ∴ m(K+)=m(Cl-) ∴m(KCl)=m(K+)+m(Cl-)= 2 m(K+)
=m(NaCl)+ m(KNO3) m(NaNO3) = 1.510-2Sm2mol-1
m(K+)=m(Cl-)=0.7510-2Sm2mol-1 m(Na+)=m(NaCl)m(Cl-)=0.5110-2Sm2mol-1 m(NO3-)=m(KNO3)m(K+)=0.7010-2Sm2mol-1
1.360
②BHCl+大量B
0.001
1.045
③HCl(aq)
0.001
4.210
BHCl为强电解质,在溶液中全部电离为BH+和Cl-。
B为非电解质。试计算BH+ =B+H+的离解平衡常数。
解:BHCl BH++Cl- (全部电离)
BH+ c(1-)
cc B + H+
c c
K
c 2 (1 )c
度下ZnSO4的=?
解:负极:Zn(s) 2e Zn2+
正极:PbSO4 (s)+2e Pb(s)+SO42-(m-)
电池反应:PbSO4 (s)+ Zn(s)= Pb(s)+ZnSO4(m)
(1)E
E
RT 2F
ln
a(ZnSO4 )
0.5477
E
RT F
ln(
m
/
m
)
E =0.5477+0.0591lg(0.380.01)=0.4046V
大学物理化学8电化学课后习题及答案

电化学课后习题一、就是非题下列各题中的叙述就是否正确?正确的在题后括号内画“√”,错误的画“×”:1、用能斯特公式算得电池的电动势为负值,表示此电池反应的方向就是朝正向进行。
( )2、电池Zn (s)| ZnCl 2(b =0、002 mol ·kg -1,γ±=1、0) | AgCl(s) | Ag(s),其反应为:2AgCl(s)+Zn(s)===2Ag(s)+ ZnCl 2(b =0、002 mol ·kg -1,γ±=1、0) 所以,其电动势的计算公式为:E MF =E MF -RT F2ln a (ZnCl 2) =E MF -RT F 2ln(0、002×1、0) ( )。
3、标准电极电势的数据就就是每个电极双电层的电势差。
( )4、电池反应的电动势E MF 与指定电池反应计量方程式的书写无关,而电池反应的热力学函数变∆r G m 等则与指定电池反应计量方程式的书写有关。
5、锌、银两金属片同时插入HCl 水溶液中,所构成的电池就是可逆电池。
二、选择题选择正确答案的编号,填在各题之后的括号内:1、原电池在定温定压可逆的条件下放电时,其在过程中与环境交换的热量为:( )。
(A)∆r H m ; (B)零; (C)T ∆r S m ; (D) ∆r G m 。
2、 电池Hg(l) | Zn(a 1) | ZnSO 4(a 2) | Zn(a 3) | Hg(l)的电动势:( )。
(A)仅与a 1,a 3有关,与a 2无关;(B)仅与a 1,a 2有关,与a 3无关; (C)仅与a 2,a 3有关,与a 1无关;(D)与a 1,a 2,a 3均无关。
3、在25℃时,电池Pb(Hg)(a 1)|Pb(NO 3)2(aq)|Pb(Hg) (a 2)中a 1> a 2,则其电动势E :( )。
(A)>0; (B)<0; (C)=0; (D)无法确定三、填空题在以下各小题中的 处填上答案:1、Ag(s)|AgNO 3(b 1=0、01 mol ·kg -1, γ±, 1=0、90)|| AgNO 3(b 2=0、01 mol ·kg -1, γ±, 2=0、72)|Ag(s)在25℃时的电动势E MF =⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
电化学练习题及解答

荆楚理工学院 化工与药学院 化学工程与工艺《物理化学》课程建设·Li Wen-Hui
答:由于单个电极的电极电势无法测量,人们不得不采用相对的电极电势。目前国际上绝大多数采用的是氢标还 原电极电势,即规定标准氢电极的电极电势为 0 V,将待测电极作阴极(还原极) ,这样组成的电池的电动势就作为待 测电极的标准还原电极电势 EOx|Red ,即
E分解 | ER | a c IR
其实际分解电压 E分解 一定大于理论分解电压 | ER | 。
12.在电解池和原电池中,极化曲线有何异同点? 答:其相同点是:无论是在原电池还是在电解池中,随着电流密度的增加,阳极的实际析出电势不断变大,阳极 的极化曲线总是向电势增大的方向移动; 阴极的实际析出电势不断变小, 阴极的极化曲线总是向电势减小的方向移动。 所不同的是,在电解池中,由于超电势的存在使实际分解电压变大,随着电流密度的增加,实际消耗的电能也不 断增多。而在原电池中,由于超电势的存在,使电池的不可逆电动势小于可逆电动势,随着电流密度的增加,电池的 不可逆电动势不断下降,对环境作电功的能力也下降。 13.为了防止铁生锈,分别电镀上一层锌和一层锡,两者防腐的效果是否一样? 答:在镀层没有被破坏之前,两种防腐的效果是一样的,镀层都起了将铁与环境中的酸性气体和水隔离的目的, 防止微电池的形成,防止了铁被电化腐蚀。但是镀层一旦有破损,则两者的防腐效果就大不相同。 镀锡铁俗称马口铁,锡不如铁活泼。若将锡与铁组成原电池,则锡作阴极,称为阴极保护层,而铁作阳极,这 样铁被腐蚀得更快。 镀锌铁俗称白铁,锌比铁活泼,组成原电池时,锌作阳极,称为阳极保护层,锌被氧化,而铁作阴极,仍不会被 腐蚀。
荆楚理工学院 化工与药学院 化学工程与工艺《物理化学》课程建设·Li Wen-Hui
电化学相平衡-习题课

G 150 kJ Qr 80kJ
'
4
H W Q 230kJ
5. (4261) 25℃时,电池反应 Ag +1/2 Hg2Cl2= AgCl + Hg 的电池电动势为 0.0193V,反应时所对应的 rSm为 32.9 J·K-1·mol-1,则电池电动势的温 度系数 (E/T )p 为: ( ) (A) 1.70×10-4 V·K-1 (B) 1.10×10-6 V·K-1 (C) 1.01×10-1 V·K-1 (D) 3.40×10-4 V·K-1
一、选择与填空题
1. (2435) CuSO4与水可生成CuSO4ּH2O,CuSO43 H2O, CuSO45H2O三种水合物,则在一定温度下与水蒸 气平衡的含水盐最多为: ( ) (A) 3种 (B) 2种 (C) 1种 (D) 不可能有共存的含水盐 [答] (B) 因为等温下,f*=2-Φ+1 Φ最多为3 所以, 除水蒸汽相外,最多可有两种水合盐
+
已知 (HCl) = 8.38×10-3 S· m2· mol-1
m
21
7. 5 分 (4396) 将Ag(s)插入AgNO3(0.001 mol· kg-1)与 NaCl(0.01 mol· kg-1)的混合溶液中形成电极, 试求该电极的电极电势,已知:E$(Ag+|Ag) = 0.799 V,AgCl的Ksp=1.7×10-10,设活度系 数均为1。
(2422)[答] f = 3 (2432) [答] f=C-Φ+3
9
1. 2 分 (4389) 盐桥的作用是: ( ) A . 将液接电势完全消除 B.将不可逆电池变成可逆电池 C.使液接电势降低到可以忽略不计 D.相当于用一根导线将两个电解质溶液沟通
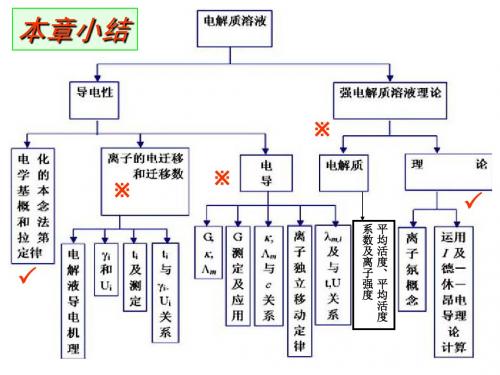
电化学习题课
D. E甲、 E乙之间没有这么简单的关系。
解答
电池甲的两电池反应为:
负极:1/2H2 (p1) → H+(0.001molkg-1) + e-
正极: H+(0.01molkg-1) + e- → 1/2H2 (p1)
实验时,只要用铜导线将插入硫酸铜溶液的两铜 片分别与微伏计的两个接线柱相连,接通电路, 指示出的正极便是经过退火处理的铜片。
6. 下面两种电池的电动势之间有何关系
(甲)H2 (p1) | HCl(0.001mol kg-1) || HCl(0.01mol kg-1) | H2 (p1) (乙) H2 (p1) | HCl(0.001mol kg-1)| Cl2(p2) -Cl2(p2) | HCl(0.01mol kg-1) | H2 (p1) A. E甲=1/2 E乙 B. E甲= E乙 C. E甲=2 E乙
电化学习题课
2.影响导电能力的因素
(1)与浓度的关系
b. 摩尔电导与浓度的关系
m
a. 电导率与浓度的关系
C
科尔劳乌斯定律:
m m (1
c)
科尔劳乌斯离子独立移动定律
电化学习题课
(2),摩尔电导率与离子运动的关系
fo r M N ; m m , m , ; t t 1
, a
m
m
m m m (
) mB
电化学习题课
2.影响活度系数的因素
lg A Z Z I 1 2 miZ i
2
【免费下载】电化学习题及答案

5.分别将 CuSO4、H2SO4、HCl、NaCl 从 0.1mol·dm-3 降低到 0.01mol·dm-3,则 Λm 变化 最大的是:
(A) CuSO4 ; (B) H2SO4 ; (C) NaCl ;
(D) HCl 。
7.科尔劳施的电解质当量电导经验公式 Λ = Λ∞ - Ac1/2,这规律适用于:
12.不能用测定电解质溶液所得的电导来计算出的物理量是:
(A) 离子迁移数 ;
(B) 难溶盐溶解度 ;
(C) 弱电解质电离度 ;
(D) 电解质溶液浓度 。
19.用界面移动法测量离子迁移数,应选用下列哪一对电解质溶液:
(A) HCl 与 CuSO4 ;
(B) HCl 与 CdCl2 ;
(C) CuCl2 与 CuSO4 ;
(A) 弱电解质溶液 ;
(B) 强电解质稀溶液 ;
(C) 无限稀溶液 ;
(D) 浓度为 1mol·dm-3 的溶液 。
9.已知 298K 时,(NH4)2SO4、NaOH、Na2SO4 的 Λ∝分别为 3.064 × 10-2、2.451 × 10-2、
2.598 × 10-2 S·m2· mol-1,则 NH4OH 的 Λ∝为:(单位 S·m2·mol-1)
7.错,强电解质也适用。
8.错,只适用于强电解质。
9.错。 (2) 错。 (3) 对。 (4) 错
10.错,适用于强电解质稀溶液。 11.a、e 正确,其余错。
12.错,a(CaF2) = a(Ca2+)·a2(F-)。
二、单选题答案: 1. B; 2. C; 3. B; 11.C; 12.A; 13.A; 21.B; 22.D; 23.D;
(A) 负极和阴极 ;
第四章 电化学 课后题

第四章习题及答案4.18℃时测得CaF 2的饱和水溶液的电导率为38.6×10-4Ω-1.m -1,水的电导率为1.5×10-4Ω-1.m -1.已知无限稀释时的摩尔电导率为∧m ∞(1/2CaCl 2)=0.01167Ω-1.m 2mol -1∧m ∞(NaCl)=0.01089Ω-1.m 2mol -1,∧m ∞(NaF)=0.00902Ω-1.m 2mol -1.求18℃时CaF 2的溶度积。
()(),00902.0,01089.0,01167.0212=Λ=Λ=⎟⎠⎞⎜⎝⎛Λ∞∞∞NaF Nacl Cacl m m m 已知:()()()()0196.00098.0201089.000902.001167.0221222=×=−+×=⎟⎟⎠⎞⎜⎜⎝⎛Λ−Λ+⎟⎠⎞⎜⎝⎛Λ=Λ∴∞∞∞∞Nacl NaF Cacl m m m CaF m ()3441893.00196.0105.1106.382−−−∞⋅=×−×=Λ−=m mol k k c CaF m 水溶液饱和()3311244234321071.20.110892.10.1101813.110893.11893.02θ2−−−−−−−⋅×=⎟⎟⎠⎞⎜⎜⎝⎛××⎟⎟⎠⎞⎜⎜⎝⎛×=⎟⎠⎞⎜⎝⎛=⋅×=⋅==+dm mol c c c c k dm mol m mol c S CaF F ca sp CaF 饱和在该温度时的溶解度所以6.根据Debye-Hückel 极限定律,计算298.15K 时0.005mol ·kg -1的CaCl 2水溶液中,求离子平均活度系数。
IZ AZ r −+−=±lg 21)(509.025mol kg A =℃水溶液015.0)101.02005.0(2121005.022212=×+×=Σ=⋅=−i i Z b I kg mol bCacl 750.0101247.0015.012509.0lg 1247.0==±⇒−=×××−=±−r r 7.写出下列电池的电极反应和电池反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分解反应 2HgO(s) 2Hg(s) O2 (g) (3)
r
Gθ m
(3)
2
r
Gθ m
(1)
r
Gθ m
(2)
116.85kJ / mol
r
Gθ m
(3)
RT
ln
PO2 Pθ
PO2 Pθ
3.2911021; PO2
3.331016 Pa
例题5:电池
(2)
电池反应的
E2θ
和
K
θ 2
的值与前者是否相同?
解:设计电池为 Pt H2 (Pθ) HI(a 1) I2 (s)Pt
298K 时 Eθ (I I2 ) 0.5362V
Eθ Eθ (I I2 ) Eθ (H H2 ) 0.5326V Kθ exp(2FEθ ) 1.381018
讨论题: 1 电池(1) Cu Cu+ Cu+ Cu2+ Pt
电池(2) Cu Cu2+ Cu+ Cu2+ Pt 电池反应均可写成 Cu + Cu2+ = 2 Cu+ 问两个反应的 rGmθ 和 有何关系
两个反应的 rGmθ 相同,但得失电子数不 同,所以 不同.
E
θ
E
θ
同一电池反应可设计成不同的电池.由于两 电池的电极不同,所以两电池的标准电池电 动势不同,同时电极反应的得失电子数也不 同.但是因电池反应是相同的,所以尽管两电
电极电势不是容量性质,不象 H, G 那样具有 简单的加和性.但电极电势和相应的电极反应的
G 有定量关系.因此可以通过已知电极的 Eθ
的加和来求未知电极反应的电极电势.
值得注意:电极电势实质上并不是电极双电层的 电势差,而是相应电极与标准氢电极组成的电池 的电动势.
6.将下列化学反应设计成电池
生失电子反应,该电解池的电极为阳极(正极)
电极反应的书写和标准电势
例:铜电极 Cu2 (aq) Cu 电极反应:(按还原方向) Cu2 2e Cu
标准电极电势: Eθ{Cu2 (aq)Cu}defEθ{H2 Cu2 (aq) 2H Cu} 书写时,电极符号总是从溶液到电极,电极反应 写还原方向.
解:由已知电池反应:
H2 (g, Pθ) HgO(s) Hg(s) H2O(l) (1) rGmθ 2EθF 178.81kJ / mol
2H2 (g) O2 (g) 2H2O(l) (2)
r
Gθ m
r
H
θ m
T
r
S
θ
m
查各物质的标准生
成焓和标准熵的值
474.47kJ / mol
• 电池电动势的应用(求电池反应热力学函 数变化,测电解质溶液离子的平均活度系 数,溶液pH值等)
• 电极过程的极化现象和超电势(原电池,电 解池的极化现象)
例题1. 298K时AgBrO3的活度积为5.7710-5, , 试用 极限公式计算AgBrO3 (1)纯水中的溶解 度
(2)在0.01mol·mol-1的KBrO3中的溶解度
Cu1 e Cu(s) , E2θ 0.521V
求: Cu 2 e Cu , E3θ ?
解: rGmθ,3 rGmθ,1 rGmθ,2 rGmθ,1 2FE1θ rGmθ,2 FE2θ rGmθ,3 F ( 2E1θ E2θ ) FE3θ E3θ 2E1θ E2θ 0.153V
(1) AgCl(s)+I-1 = AgI (s)+ Cl-1 失电子
Ag AgCl(s)+I-1 = AgI + Cl-1 Ag
得电子 左极Ag (s)+I-1 AgI + e 右极 AgCl(s)+ e Ag+ Cl-1 总反应AgCl(s)+I-1 = AgI (s)+ Cl-1
Ag, AgI(s) I- Cl- AgCl(s) , Ag,
RT
对反应(2)
Eθ相同,
K2θ
[
K1θ
1
]2
E
θ和
E
与电极上发生反应的物质的量
无关,而 Kθ, rGmθ 的值与电池反应
方程式的写法有关.
3.下列浓差电池
(1) Sn(l) SnCl2(l) Sn-Bi xsn=0.89 (2) Sn(l) SnCl2(l) Sn-Bi xsn=0.50
其电动势是否相同
弱电解质的摩尔电导率不等于离子的摩尔电 导率之和,只有在无限稀释时才相等.
电池与电解池中电极符号的表示
电池:发生失电子反应的极-----阳极(负极) 发生得电子反应的极-----阴极(正极)
电解池: 与外加电源的负极相连的电极上发生得
电子反应,该电解池的电极为阴 极(负极) 与外加电源的正极相连的电极上发
1) E Eθ RT ln 0.000625 0.04202(V )
2F 0.0165
理想液体混合物的 =1
2) 可逆放电1摩尔电荷电量
rGm 1 0.04202 96500 4055 J / mol
rHm 0
?
r Sm
rGm T
13.61J mol1 K 1
例题2:电导池用0.01mol/dm3标准KCl溶液标定 时,R1=189, 用0.01mol/dm3的氨水溶液测其电 阻R2= 2460,用下列该浓度下的m数据,计算 氨水的解离系数.
m (K ) 73.5104 S m2 mol1; m (Cl ) 76.4 104 S m2 mol1; m (NH4 ) 73.4 104 S m2 mol1; m (OH ) 196.6 104 S m2 mol1
Pt H2(P0) HCl(m1) AgCl-Ag (m2) H2(P0) Pt
Ag -AgCl HCl
解:该电池实际上是由两个电解质溶液不同 的同种电池的反向串联而成,按图示顺序,两 个电池反应分别为
左电池阳极:
1 2
H
2
(Pθ
)
H
(m1
)
e
左电池阴极: AgCl(s) e Ag(s) Cl (m1)
0.9028
m
7.596 10 3 0.9028
mθ
8.413
10 3 mol
/
kg
溶解度为 8.413103
在0.01mol·mol-1的KBrO3溶液中的 不同与纯 水中的 ,须重新计算.先假设=1 ,求出m(Ag+1), 然后再求I 和,最后求出精确的m(Ag+1),
不同
其标准电动势是否相同
相同
电池反应的标准平衡常数是否相同 相同
二个反应的 G 是否相同
不同
dE 是否相同
dT
不同
4. 电池 Tl TlCl (s) NaCl(aq) AgCl(s) Ag
E(298K)=0.779V;
E (T )P
4.7 105V / K
问(1)当温度升高时,电池反应的 K 将变大变小
F
a 2
2RT ln 2 m2 F 1 m1
其中 m m
计算题:例3
电池 Pb-Hg(x) Pb(NO3)2(aq) Pb-Hg(x’) x,x’是Pb 在汞齐中的量分数, xPb=0.0165,
x’Pb=0.000625.假设上述组成的铅汞齐可看作理想 液体混合物.求:
1)298K下该电池的电动势
2)在298K,101325Pa下可逆放电1摩尔电荷电量,求 电池反应的 rGm , r Sm , r Hm 及与环境交换的热量.
3)温度,压力同上,使电池在两极短路下放电, ,求电 池反应的rGm , r Sm , r Hm及与环境交换的热量.
解:电池总反应 Pb - Hg(x) Pb - Hg(x')
池的 Eθ不同,n也不同,但电池反应的 rGmθ 是
相同的,因此反应的 Kθ 也相同.
2.将下面的化学反应设计成电池;
H2 ( pθ) I2 (s) 2HI(a 1) (1)
求此电池反应的E1θ 及 K1θ
若反应写成
1 2
H2 ( pθ)
1 2
I2 (s)
HI(a
1)
NH3 H2O NH4 OH
c(1 ) c c
m (NH3 H2O)
m
(
NH
4
) m (OH- )
1.152103 2.70 102
0.0426
Kθ (c / cθ ) 2 0.01 0.04262 1.90105
1
1 0.0426
讨论课(电解质溶液与可逆电池)
• 电解质溶液的热力学性质(平均活度系数 和平均活度,离子强度,德拜-休格尔极限 定律)
• 电解质溶液的导电性质(电导率,摩尔电导 率,无限稀释摩尔电导率,离子的无限稀释 摩尔电导率及其应用(求弱电解质的解离 度,难溶盐的溶解度)
讨论课(电解质溶液与可逆电池)
• 可逆电池及其热力学(电极反应,电池反应 的表示和电极电势,电池电动势的计算;
0.01 mAg mθ
Kθ
2
7.622 10 5
解出
mAg 5.06 10 3 mol / kg
所以在0.01mol·mol-1的KBrO3中AgBrO3的溶 解度为5.0610-3.说明在加入同离子的盐后, 溶解度会减小.
