合成子与极性转换
逆向合成分析及其应用

常见的a3-合成子主要有b-羰基正离子,相 应的合成等价体是a, b-不饱和羰基化合物、a, b-不饱和羧基化合物和a, b-不饱和腈。 烯丙基型正离子和炔丙基正离子也可以视 为a3-合成子,它们相应的合成等价体主要为3卤代丙烯、3-卤代丙炔、2-丙烯醇的磺酸酯和2丙炔醇的磺酸酯。 此外,氧杂环丁烷有时也可以充当a3-合成 子的合成等价体。
t-Bu O
t-Bu
反合成子(retron)
反合成元是反合成分析中进行某一转换所必要的结构 单元。例: 对Diels-Alder反应,双烯烃为合成子,而加成产物环 己烯则为该转换的反合成子。 对Robinson反应,产物为反合成子
+ O O
Base O Robinson Rxn
合成树(tree)
O
O
dis
O O
O
O
O
dis +
O
O
五元环
O O
dis
EtO2C O EtO2C
+
EtO2C
CO2Et
O -
O
dis
EtO2C
+
CH2CO2Et
O
CH3CH2COCH2CO2Et
ClCH2CO2Et
dis
O CHO O
CHO
FGI
CHO
dis
-
CH2Br
六元环
CO2CH3 CO2CH3 CO2CH3 CO2CH3 OH+
杂原子的交换
RCl RCH2X RCHO RCOCl R-M (M= Li, MgCl, Cu) RCH=PPh3 S S R
RCO-Fe(CO)4
杂原子的引入
O
OM
有机化学结构与功能学习笔记第一部分

基础有机化学-----------------------------------------------------预备知识-----------------------------------------------------一. 原子结构1. 波尔理论对氢原子光谱的解释:氢原子在正常状态总是处于能量最低的基态,在受到光照射或放电等作用时,吸收能量,原子中的电子跳到能量较高的激发态。
但在激发态不稳定,回到低能量轨道时放出能量产生与能量对应的光,从而产生光谱。
hv E =∆。
2. 四个量子数:(1)主量子数n :n 为不同的电子层层数。
(2)角量子数l :同一电子层还可以分为不同的亚层,对应于n ,l =0~1-n 。
其中当0=l 时,为s 电子,1=l ,为p 电子,以此类推…(3)磁量子数m :用来描述同一亚层原子轨道和电子云的方向。
它受到l 的影响,当0=l 时,0=m ;1=l 时,1-=m 、0、1+,即p 电子有3种空间取向,分别为x p 、y p 、z p ;当2=l 时,可有五种空间取向,即2z d 、xz d 、yz d 、xy d 、22y x d -。
(4)自旋量子数s m :电子除绕核运转外,还有自旋运动。
电子自旋量子数只有2个取值,21+和21-,即电子有2个相反的自旋方向。
3. 原子轨道:我们常把电子层、电子亚层和空间取向都确定的运动状态称作原子轨道,即s 层有一个原子轨道,p 层有3个等等。
空间取向不同,并不影响电子的能量,因此同一亚层的几个原子轨道能量完全相同,这样的轨道称为等价轨道或简并轨道。
4. 原子轨道分布图描述的是解薛定谔方程得到的波函数ψ的值,函数值可以为正也可以为负。
形成共价键时要求同号重叠,即对成型匹配原则。
电子云角度分布图全为正。
5. 屏蔽效应:在多电子原子中,电子不但受到原子核的吸引,而且电子和电子之间也存在着排斥作用。
也就是说其余电子屏蔽了或削弱了原子核对该电子的吸引作用。
有机合成 逆合成分析

逆合成分析是一种 逆推法,是通过切 断(剖析)等操作, 从比较复杂的目标 分子推导出简单易 得的起始原料的过 程 LOGO
3
断裂转化和合成子 (Transforms, Synthon)
合成子
断裂转化
由产物推出起 始物的过程, 是合成反应的 逆过程
反合成分析中 进行某一转化 所必须的结构 单元或化合物
4
简化断裂分析的主要目的
1.
将TM变换成 合成上更易制 备的可替代的 目标分子 (Alternative TM) 2. 为了作逆向切 断、连接或重 排等变换,须 将TM中原来不 适用的官能团 变换成所需形 式,或暂时添 加某些必须官 能团。 3. 添加某些活化 基、保护基或 阻断基,以提 高化学区域选 择性或立体选 择性。
逆合成分析是一种逆推法是通过切断剖析等操作从比较复杂的目标分子推导出简单易得的起始原料的过断裂转化和合成子transformssynthon断裂转化由产物推出起始物的过程是合成反应的逆过程合成子反合成分析中进行某一转化所必须的结构单元或化合物添加某些活化基保护基或阻断基以提高化学区域选择性或立体选为了作逆向切断连接或重排等变换须将tm中原来不适用的官能团变换成所需形式或暂时添加某些必须官将tm变换成合成上更易制备的可替代的目标分子alternativetm1
5
合成子及其合成等效体
1.合成子 Synthon 指在逆向合成法中,通过切断化学键而拆 开TM分子后,得到的各个组成结构单元
2.合成等效体 2.合成等效体 能起合成子作用的试剂。 synthetic synthetic equivalent equivalent
6
7
设计中利用的结构因素
1 2 3 分子骨架:连接与重排 官能团:相互转化 立体化学:翻转或转移
合成子

d0: 也可能在C之前,官能团(FG)或杂原子X0有活性,就是d0合成子
相似地,也有因极性转换使碳原子有受电子能力而形成活 性中心的,受电子合成子就合成子
思考:
CH3Li
CH3- + Li+ 中, CH3-属于哪一类合成子?
CH3Li中不含有任何官能团,在反应中只起到烷基化的作 用,因此,我们把这种合成子称为烷基d合成子。 由于烷基 d合成子在反应中只起到烷基化的作用,因此, 产物不会增加官能团。
(三)d3合成子
H2C O
等效试剂制备
CH2 OSiR3
t-BuLi
H2C OSiR3
CH2
COOR
等效试剂制备
COOR
COOR
t-BuOK
COOR
COOR
HO
OR
(四)>3的dn合成子
如果参与反应的官能团和不参与反应的官能团相隔较远,大多数情 况互相不起作用,不再形成一个整体。例如:
O O
(1)KH-H2,THF (2)t-BuLi,TMEDA
R X R + Nu X R Nu MgX R E
RMgX
R
+ E
像这种,卤代烷分解时产生R+离子,而通过格式剂再分解时, 烷基就成了负离子。这就叫极性转换。 有了极性转换,同一基团既可以成为正离子也可以成负离子, 这就扩大了可能进行的有机合成的范围。
O
O
O
+
H3COC
CH3C
极性转换: 途径:
O
O
CH3C
CH3C
如何选用A和B? 选用亲核能力强的B,利于第一步的反应;选择离去能力 强的A,利于对后一步的反应。 具体合成路线:
有机合成中的合成子

例1:苯基与氧处于交叉构象的位置
位阻小
O S O
大 S
CH3
O S
S
CH3
S
CH3
S
M eLi (T H F ,-5 0 o C )
Li
中
H
小
+
H
H
H
Li
S
Ph Ph Ph
R (S , S ) 94% (R , S ) 6%
(S )-(+ )苄 基 , 甲 基 亚 砜
例2 叔丁基和苯处于对位。去质子发生在亚甲基上位阻最小 的部位。
空间位阻大的碱:
(CH3)3C OK
(CH3CH )2 NLi CH3
KOBut
特丁醇钾
(LDA)
二异丙基氨化锂
Me3Si Me3Si
N Li
双(三甲硅烷基)氨化锂
H2N
NH K
KAPA
3-氨基丙氨钠
O Li
1,1-二(三甲基硅烷基)-3-甲基丁醇锂
SiMe3 SiMe3
N M e2
CH2
CH
d
COOR
C C
2 3
COOR
H C C COOR
LDA
Li
C C COOR
1
O
ButLi
OSiR3
d
OSiR3
三、接受电子合成子及等效试剂
等效试剂
a
R
R X
(X= Cl, Br,I, OTs, OMe3 等)
烷基合成子
M e 3S X
硫鎓盐
M e3O B F4
R A lC l 4
(F rie d e l-C ra fts 烷 基 化 )
高中化学竞赛题有机合成

中学化学竞赛试题资源库——有机合成A 组1.6-羰基庚酸是合成某些高分子材料和药物的重要中间体。
某试验室以溴代甲基环己烷为原料合成6-羰基庚酸。
请用合成反应流程图表示出最合理的合成方案(注明反应条件)提示:①合成过程中无机试剂任选,②如有须要,可以利用试卷中出现过的信息,③合成反应流程图表示方法示例如下:2.已知①卤代烃(或-)可以和金属反应生成烃基金属有机化合物。
后者又能和含羰基化合物反应生成醇:+()−−−→−OH C 252−−→−OCH 22−−−→−+H O H /22 ②有机酸和3反应可以得到羧酸的衍生物酰卤:③苯在3催化下能和卤代烃作用生成烃基苯:有机物A 、B 分子式均为C H O ,和钠反应放出氢气并均可经上述反应合成,但却又不能从羰基化合物干脆加氢还原得到。
A和硫酸并热可得到C和C’,而B得到D和D’。
C、D分子中全部碳原子均可共处于同一平面上,而C’和D’却不行。
请以最基础的石油产品(乙烯、丙烯、丙烷、苯等)并任选无机试剂为原料依下列路途合成B,并给出A、C’、D 的结构简式及下述指定结构简式。
合成B的路途:3.由指定原料及其他必要的无机及有机试剂会成下列化合物:(1)由丙烯合成甘油。
(2)由丙酮合成叔丁醇。
(3)由1-戊醇合成2-戊炔。
(4)由乙炔合成3222223(5)由322合成4.已知苯磺酸在稀硫酸中可以水解而除去磺酸基:又知苯酚和浓硫酸易发生磺化反应:请用化学方程式表示苯、水、溴、铁、浓硫酸及烧碱等为原料,合成的过程。
5.以2=2和H 218O 为原料,自选必要的其他无机试剂合成3--18O -C 2H 5,用化学方程式表示实现上述合成最志向的反应步骤。
6.已知甲烷高温下裂解反应的产物随温度不同而不同。
有好用价值的是以下两个反应:4−−−−→−-C o 15001000+2H 2 24−−→−〉C o15002H 2+3H 2试以自然气为唯一有机原料合成乙酸甲酯,写出方程式。
第二章 逆合成分析

应的卤代物与活泼金属发生卤素交换反应来制备。
常见的d1合成子等价物主要有CH3NO2、CH3SOCH3、CH3SO2CH3、HCN、 磷叶立德、硫叶立德和硫代缩醛等。
常见的d2合成子合成子等价物主要有RCH2CHO、RCH2COPh、RCH2CO2Et、
CH2(CO2Et)2、CH3COCH2CO2Et和CH2(CN)2等。 常见的d3合成子合成子等价物:
有机合成
第2章
逆合成分析
常见的a3合成子主要有β-羰基正离子,其合成等价体是α,β –不饱和羰基化合物、 α,β –不饱和羧基化合物和α,β –不饱和腈。烯丙基正离子和炔丙基正离子也可以视为a3-
合成子,等价体为3-卤代丙烯、3-卤代丙炔、2-烯丙醇的磺酸酯和2-炔丙醇的磺酸酯。
常见的d合成子 常见的d0合成子主要有烷基负离子、烯基负离子和芳基负离子,它们通常由相
分析
TM
O
O
O
O
+
O O O
+
CH3I
有机合成
第2章
逆合成分析
5、逆推到适当阶段再切断
有些分子不能直接切断,或切断后得到的合成子在正向合成时,无合适 方法将其连接起来。此时,应将TM逆推到某一替代的TM后再切断。
eg. 合成
CH3CH CH2CH2OH OH FGI;Dis
CH3CH OH
+
CH2CH2OH
C-杂键不如C-C键稳定,且在合成时也易形成,合成时,C-杂键放在最后 几步完成,较为有利。一方面避免C-杂键受到早期反应的干扰,另一方面也 可在较温和的条件下连接,避免在后期反应中破坏已引进的官能团。合成中
后期形成的键,在分析时应先切断。
有机合成
有机反应中的极性转化方法

最后是还原消除过程, 钯有机物分解, 形成新的 <— < 键, 金属钯游离出来, 完成了催化过程 ! 6-— 9:— 6-= " 6-— 6-= . 9:; 采用 @’A3B*3 反应, 通过极性转换作用, 也可以得到与 [45] 0&1&23 反应类似的偶联产物 !
!!#
卤素互换
我们知道, 有机碘化物的活性比有机溴化物强, 作者曾
! ! " #, ""二噻烃的还原反应
[’] 认为, (, )"二噻烷烃经 *+,$- .& 处理, /— 0 键被 #$%%&% 这是 氢解, 按 1234526"7+5+8&,29 反应分解成亚甲基衍生物,
代替 /3$66$,92, 或 12344"7&9:;,$5 还原羰基化合物的一种好 方法 ! 反应中酮羰基碳原子由荷正电荷, 在与 (, )"二噻烃作 用后通过极性转换, 原来羰基碳原子的正电性几乎表现不出 来, 这是由于碳原子和硫原子的电负性几乎相等 ! 当 ?, E"二溴噻吩分子中与溴相连的碳原子略显正电荷, H 与 与叔丁基锂在低温下发生反应后, 溴原子异裂 ( G5 离去) 负电荷的叔丁基形成溴化物, 锂离子取代溴原子配位芳环, 反应中心的碳原子通过极性转换由正电荷变为负电荷 ! 式左 的稳定性应该大于式右的稳定性:
与三甲基硅基乙炔锂发生离子型反应, 再经三氟乙酸处理得
[(>] 到氢化衍生物 !
与碱金属作用生成 /=> 的甲苯溶液在无氧无水条件下, 通过这种极性转换的方式, /=> 负离子, /=> 负离子与一些活泼 卤代物发生亲核取代反应得到相关衍生物:
氨基化合物的极性转换在有机合成中的应用

氨基化合物的极性转换在有机合成中的应用关于氨基化合物的极性转换在有机合成中的应用,我为大家总结了一下这些内容,希望可以帮助到你:极性转换是指在有机化合物中的某个原子或原子团的反应特性(在本文中特指亲电性和亲核性)发生了暂时相互转换的过程。
在有机合成中,其中心问题就是碳碳键的构成和官能团的转换,其中碳键的构成往往又是主要矛盾。
对于有机合成分析中最为常用的切断法来说,构成碳碳键的核心就是把目标碳链切成或正或负的合成子。
从这个角度来说,碳碳链的形成实质就是正负合成子的结合。
而在合成中,如果遇到需要连上的基团的反应性不满足人们的要求时,便必须对它进行极性转换了。
如α碳由于羰基吸电子影响,可以稳定负电荷,因此可以方便地得到α碳负离子(如乙酰乙酸乙酯),可是α碳正离子与α碳负离子有相反的电性,按照常规是不容易得到的,必须通过极性转换得到。
在有机合成路线设计过程中,贯穿把碳链的合成看做是正负基团的结合,再根据需要对其进行极性转换的思想,可以大大减少设计路线的盲目性,提高效率,对合成某些难于合成的化合物有很好的效果。
1烃类化合物的极性转换在有机化合物中,烃类的结构相对简单;同时,有机合成有很大一部分工作就是简单接上一个或正或负的烷基,如果能方便地得到烷基正离子和负离子,并能把它们进行相互转化的话,就能简化合成设计。
1.1 卤代烃的极性转换卤代烃由于卤素原子的吸电子作用,使与之相连的碳呈一定的电正性,在反应中提供的是烷基正离子。
要使之成为烷基负离子,使碳上的电子云密度升高,最容易想到的方法就是在碳上直接连上一个给电子基团。
而可以提供电子最易得的物质就是活泼金属。
因此通常让卤代烃和活泼金属反应形成金属化合物,如有机锂,烷基铜锂,格氏试剂。
由于金属的电负性很小,使与之相连的碳带有部分负电荷,这样就得到一个烷基负离子,可以与化合物中电正性的部分连接。
与卤代烷可以引入烷基正离子相反,可以方便地在有机化合物中引入烷基负离子。
药物合成名词解释

药物合成名词解释 TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-名词解释1、苄位卤取代: 苄位氢原子被卤素原子取代2、烯丙位卤取代:烯丙位氢原子被卤素原子取代3、缺电子体系:含有空轨道的体系4、富电子体系:电子云密度高或含有未共用电子对的体系5、脱羧卤置换反应:羧酸脱去二氧化碳,生成比原产物少一个碳原子的卤代烃的反应6、卤交换反应:有机卤化物和无机卤化物之间进行卤素交换的反应7、S1反应:单分子亲核取代反应N2反应:双分子亲核取代反应8、SN9、NBA:N-溴代乙酰胺10、t-BuOH:叔丁醇11、t-BuOCl:次氯酸叔丁酯12、n-BuLi:正丁基锂B(p-2):在乙醇溶液中制备的硼化镍13、N i214、T sCl:对甲苯磺酰氯15、s-BuLi:仲丁基锂16、i-PrOH:异丙醇17、释电子基:能增加相邻基团电子云密度的基团18、还原胺化反应:羰基与胺加成脱水成亚胺,再还原为胺类化合物19、吸电子基:能减少相邻基团电子云密度的基团20、反应机理:反应发生的机制和道理21、邻苯二甲酰亚胺制胺法:邻苯二甲酰亚胺和卤代烃在碱性条件下反应,然后肼解得伯胺的反应22、α-羟烷基化反应:含有活性α-氢原子的醛酮,在碱或酸的催化下发生缩合,生成β-羟基醛或酮类化合物的反应23、B lanc反应:芳烃在甲醛、氯化氢和路易斯酸或质子酸的存在下,在芳环上引入卤烷基的反应24、β-羟烷基化反应:活性化合物与环氧乙烷发生反应,生成β-羟烷基化产物25、羰基烃化反应:醛、酮的羰基还原为亚甲基的反应26、β-羰烷基化反应:α,β不饱和羰基化合物在碱性催化剂存在下与亲核试剂发生缩合生成β-羰烷基化类化合物27、双烯合成:1,3-丁烯衍生物和乙烯衍生物在加热情况下生成环己烯骨架的反应28、活性亚甲基:邻位具有羰基或其他强吸电子基的亚甲基结构29、单线态:两个价电子自旋方向相反时,此种分子状态为单线态30、三线态:两个价电子自旋方向相同时,此种分子状态为三线态31、W ittig试剂:卤代物与三苯膦在碱作用下形成磷内盐32、化学氧化:利用化学试剂进行氧化O:乙酸酐33、A c234、(phCO)O:苯甲酸酐235、A cCl:乙酰氯36、B n2O2:过氧苄基醚37、A rOH:芳香酚38、S OCl2:二氯亚砜39、P E:石油醚40、E t3N:三乙胺41、C ollins氧化法:以三氧化铬吡啶复合物的二氯甲烷溶液作为氧化剂的方法42、J ones氧化法:以三氧化铬硫酸的丙酮溶液作为氧化剂的方法43、D DQ氧化法:以二氯二氰苯醌作为氧化剂的方法44、A g2CO3氧化法:以碳酸银作为氧化剂的方法45、A l(O-i-Pr)3:三异丙氧基铝46、D MSO氧化法:以二甲亚砜作为氧化剂的方法47、L AH还原法:以四氢铝锂作为还原剂的方法48、极性倒置:通过杂原子的交换、引入或添加,将某一合成子的正常极性转化成其相反的性质的过程49、C lemmensen还原法:锌汞齐盐酸反应将羰基还原成亚甲基的反应50、W olff还原法:肼在碱性条件下还原羰基成亚甲基的反应51、多相催化氢化:使用过渡金属等催化剂,使得不饱和烃加氢形成饱和烃的过程52、催化转移氢化:在催化剂的作用下,氢由氢的给体转移到有机化合物反应底物的反应53、R osenmund反应:酰卤用催化氢化或金属氢化物选择性地还原为醛的反应54、D ieckmann反应:指二元羧酸的酯类在金属钠或醇钠作用下发生分子内的克莱森缩合反应,形成环状的β-酮酯55、质子酸:水溶液中能电离出质子的酸56、脱氢芳构化:使用氧化脱氢的方法使得脂肪族化合物转变成芳香族化合物的反应57、B irch还原:芳香族化合物在液氨中用钠还原,生成非共轭二烯的反应58、亲电重排:正性取代基向富电子原子上迁移的反应59、亲核重排:负性取代基向缺电子原子上迁移的反应60、单酐:相同酸脱水得到的酸酐61、混酐:不同种酸脱水形成的酸酐62、单醚:单一醇脱水生成的醚63、混醚:不同的烃基形成的醚64、酯交换反应:不同种酸脱水形成的酸酐65、Oppenauer氧化66、Darzens缩合67、Knoevenagel反应68、羰基烯化反应(Wittig反应)69、DMSO:二甲基亚砜70、THF:四氢呋喃73、靶分子:凡是需要合成的有机分子。
09第三章形成C-C单键的反应

它们可以通过Micheal加成反应合成目标物: 化学与材料科学学院
③合成子是否一定实际存在 “合成子”是一个人为的、概念化了的名词。它区别于 实际存在的起反应的离子、自由基或分子。但在有些合成反 应中,也可能是一个实际不存在的、抽象化了的东西。如下 面的例子(这也是一个Michael反应):
化学与材料科学学院
5、a3十d2,产物是1.5双官能团。
化学与材料科学学院
第二节碳原子的烷基化和酰基化 (教材p 28)
(一)芳环上的烷基化和酰基化; Friedel-crafts反应主要特征: 在Leafts酸或质子酸的催化下,RX、RCOX与芳香族 化合物反应,在芳环上引入烷基和酰基。是制备烷基和酰基 取代的苯、萘、酚、胺芳香杂环类化合物的重要反应。
④合成子的极性转换 要理解上述所谓等价物就必须了解合成子的极性转换 (umpolung)。 例:
当卤代烷分解成R+与X-时,烷基是正离子。 但当它通过格氏试剂再分解时,烷基就成了负离子。 这就叫极性转换。有了极性转换这一技术,同一基团既可 成正离子,又可成负离子。这无疑扩大了可能进行的有机 合成的范围。 化学与材料科学学院
著名的有机合成路线设计专家、学者Corey提出了合成子 的定义:“凡是能用已知的,或合理的操作连接成分子的 结构单元均称为合成子。” ”这里用“已知的,或合理的”,就意味着合成子可能实 际存在的,也可能很不稳定,在反应过程中能瞬间存在, 也可能实际不存在,但反应中可用实际存在的等价物。
化学与材料科学学院
(二)活泼亚甲基化合物的烷基化和酰基化(教材p75) 1、活泼亚甲基化合物:在一个饱和碳原子上连有不饱和 官能团,与该碳原子相连的氢具有一定酸性, 这类化合物 被称为活泼亚甲基化合物。 A、B 为如下不饱和官能团:
第四章 有机化合物的极性转换

C3的极性转换,人们研究了很多种化合物
S S R Li H 3C H 3C S S R Li S S S Li R' S R R' S R' S Li R'=CH3 , C2H5 R R' S Li(Na) R'=CH3 , C2H5
S S
C10H21
C4H9Li
CH3 CH2 CH2 C6H5 > 95%
亚硝胺锂可以和酯肪醛酮、芳香醛酮、芳环酮发生亲核加成
NO N C6H5CHO NO N C(CH3) 3 CH SCH3 Li CH2 (CH2) 4 C O C(CH3) 3 CH SCH3 CH C6H5 OH NO N HC HO C C(CH3) 3 SCH3 (CH2)4 CH2 80% 90%
Li CH3
常用试剂: R
R
C O
N
C R
H Li
C
N C R
H Li
N3 C C 6H 5 R(ON)N
H Li
X 2P
N
CH3 CHPh Li
S C NR CH2Li
C Li
N=C C6H5 C : Li H + CO2
N=C C6H5 CHCO2Li
H2O
NH2 C6H5 CH COOH
氨基α-碳原子的极性转换试剂——亚硝胺锂 可以和卤代烷反应,生成在氨基α-碳上烷 基取代的衍生物。
CH2=CHOC2H5 R O Li
呋喃α-锂化合物可以和各种亲电试剂作用, 生成物水解得1,4-二酮
H3C O (1)C4 H9 Li (2) Br O OH O H 3C O O H
有机合成
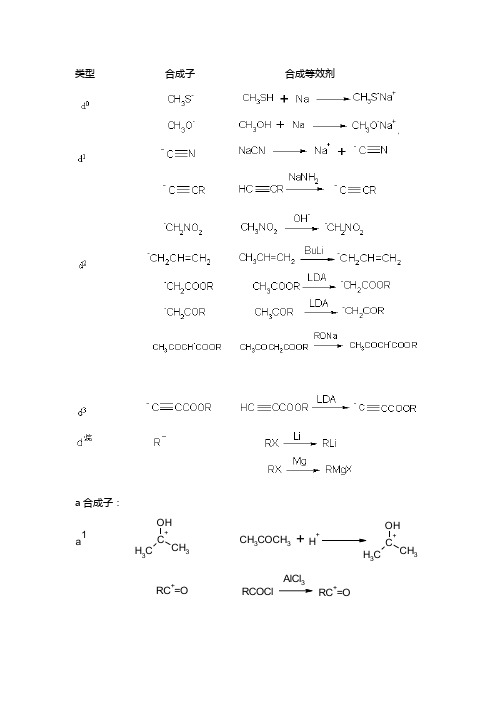
类型 合成子 合成等效剂a 合成子:C+OH CH 3CH 3CH 3COCH 3H +C+OHCH3CH 3RC+=ORCOClAlCl 3RC +=O+CH 2COCH 3BrCH 2COCH 3BrC -HCOCH 3+CH 2CHOHCH 3OCH 3H++CH 2CHOHCH3R(H)OCNXX=Cl,Br,IR+RXR 2SO 48.1.2.2合成子的作用规律一个d 合成子与一个a 合成子在适当的条件下化合,得到一个加合的C -C 键(d 0合成子除外)。
下述的一些规律,可以用来设计产物(目标分子)中的官能团的位臵。
d 烷+a 烷,反应产物是无官能团产物 a 烷+d 1,a 1+d 烷,反应产物是单官能团化合物 a 1+d 1, 反应产物是1,2-双官能团化合物 a 1+d 2,a 2+d 1,反应产物为1,3-双官能团化合物等等。
例如:烷基a +烷基d :CH 3LiCH 3Br CH 3-CH 3a 1+d 1:RC=OHHCNRCH OHCNa 1+d 2:CH 3COCH 3CH 3CHOC OHCH 2CHOCH 3C H 3a2+d2:OCOOCH3BrO COOCH3OCOOCH3O COOCH3a3+d2:OOHO注意:目标分子是合成子就必须由一个以上官能团。
如果在开链化合物分子中,含有一个电子接受体部位和一个供电子中心,则这两个原子间可进行分子内键合。
相应地生成单环化合物。
例如:O OMeO8.2供电子合成子8.2.1烷基(烃基)d合成子碳负离子是带一对电子的有机负离子,电荷主要集中在碳原子上。
烷基、烯基、炔基负离子中,非键合的电子总是定域在碳原子上,它们具有高度的反应活性。
形成碳负离子的难易程度:与碳氢键中的S成分有关,S成分增加,则越易形成碳负离子。
C CH C CH C CH当碳原子上的取代基数目不同时,饱和烷基负离子的稳定性顺序为3o<2o<1o,但他们的稳定性都很小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不饱和吸电子基团影响α-碳上碳氢键的活化
a合成子,产物无官能团。
合成子的加合——a合成子与d合成子的反应
烷基a + 烷基d:
CH3Li
+ (CH3)3SBr
(a)
CH3CH3
+
(CH3)2S +
LiBr
(d)
产物为无官能团化合物。
a1 + d1:
R H OH OH
[H]
+
HCN
R
CN
H
R
NH2
(a1)
(d1)
产物为1,2-双官能团化合物。
反应机理:
因此:
CN
HO
C
-
O
是
的等价物
Example 2:二噻烷碳负离子的形成
醛(如乙醛)可以和1,3-丙二硫醇形成二噻烷。由 于硫对碳负离子具有特殊的稳定性,故邻位的碳有
酸性,用正丁基锂在低温四氢呋喃中处理,得到相
应的亲核性碳负离子。该锂化的碳负离子作为亲核 试剂,可以和卤代烃(溴化苄)、其他羰基化合物 (环己酮)以及环氧乙烷衍生物(苯基环氧乙烷) 等合成子发生亲核取代,生成的产物水解,又得回
的等价物。
合成子极性转换的具体应用
Example 1:安息香缩合反应
安息香缩合是羰基极性转换的代表,也是人们最早知道的极性转 换的例子。反应物苯甲醛中的羰基碳原子是亲电性的。首先发生 氰离子对羰基碳的亲核加成,然后质子由碳转移到氧上,形成一 个碳负离子,其中的碳发生了极性转换,是亲核性的。然后该碳 原子亲核进攻另一分子的苯甲醛的亲电性羰基碳,质子转移,氰 离子离去,得到产物安息香。
O H 3C H O
H3 C
H
(a1)
OH O
H2O
H 3C
H
O
a2 + d2:
O COOCH3
+
Br
O CO2CH3
(d2)
(1)NaOH (2)H3+O
(a2)
O CO2H O
产物为1,4-双官能团化合物, a1 + d3 ,a3 + d1的 产物也都是1,4-双官能团化合物。
a3 + d2:
2 O
有些碎片是有效的,有些是无效的,合成子是分 子拆开后在有机合成中确实有效的碎片。
上述分子中只有下列两个碎片才是有效的:
O O
Ph
-
OCH3
和
+
O
OCH3 O
OCH3
+
H+
它们可以通过Michael加成反应合成目标物:
O Ph O
OCH3
+
O
OCH3
OCH3
EtONa
O
Ph
O O
OCH3
Br
+
2Li
THF
Li
+
LiBr
Cl
+
2Li
THF
Li
+
LiCl
请思考如何控制
二) d1合成子
(1)在C1-X0(杂原子)中,碳的电子对可
离域到杂原子上去,就形成较稳定的碳负离 子,即d1合成子。HCN(及钾盐、钠盐)以 及CH3NO2都能在水溶液中生成d1合成子。
H-C≡N
+
OH-
C≡N
又如:
R R’ C OH C2H 5 R R’ C O
+
C2H 5-
+
H+
一般说来,Et-是一个不稳定的负离子,不能直
接用于和羰基的反应,但通过格氏试剂能将它 稳定下来。
R R’
C
O
+
C2H5MgBr
H3+O
R R’
C
OH C2H 5
因此,一个稳定的合成子,可以直接起反应,
而一个不稳定的合成子,就需要用它的稳定
+CH 2COCH3(α-C原子活化)
官能团 -PMe2 -CO-CO-
a3
H2C=CHCOOR
H2+C-CH=CO-OR
-COOR,-C=C-
除了以上涉及的合成子外,还有烷基合成 子,也有供电子与受电子之分: (1)烷基d合成子:
如甲基锂分解成CH3-和Li+,前者就是烷基d合
成子,反应中起甲基化作用;
格氏试剂中得到的R-当然是烷基d合成子;
注意:它们不是d1合成子,反应中只起烷基化 作用,产物无官能团!
(2)烷基a合成子
如二甲硫醚与溴甲烷的加成物能起下列离子 化反应:
(CH3)3SBr (CH3)3S+
+
Br-
此正离子在反应中,由于甲基被活化成Me+而
起了甲基化的作用;不是a1合成子,而是烷基
三)合成子是否一定实际存在 “合成子”是一个人为的,概念化的名词,
有别于实际存在的起反应的离子、自由基或
分子。合成子可能是实际存在的,也可能是
一个实际不存在的抽象化的东西。
Example 1:
O O O
+
EtONa
O
其碎片是:
O
不稳定
-
与
O
H+
实际存在 的
Example 2:用环己烯酮合成β-乙酰基
合成子与极性转换
合成子基本理论
合成子的概念
合成子(Corey E.J.):凡是能用已知 的,或合理的操作连接成分子的结构单元均 称为合成子。
Synthons are defined as units which can be joined to (organic) molecules by known or conceivable synthetic operations. (E.J.Corey 1967)
活性,就是d0合成子;
供电子合成子就有d0,d1,d2,d3等;
相似地,也有因极性转换使碳原子有受电子
能力而形成活性中心的,受电子合成子就有
a0,a1,a2,a3…之分。
d合成子
试剂 d0 d1 CH3SH KCN 负离子 CH3S-(杂原子硫有活性) CN-(杂原子N使C1活化)
-CH2CHO(α-C原子活化)
为何不用酸
O
H
+
HCN
NaOH
OH
CH3-CH CN
A用:
OC2H5 -C-CH3 H OC2H5 OH O
C2H5OCH=CH2
+ CH3-CH
CN
CH3-CH CN
C-CH3 H
实际合成步骤:
O H
NaOH
OH CH3-CH CN
C2H5OCH=CH2
+
OC2H5
HCN
O
CH3-CH CN
+
O
H O
O
O
(a3)
(d2)
O
产物是1,5-双官能团化合物。
6.3.3 供电子合成子
一)烷基(烃基)d合成子
碳负离子的烃基可以是烷基、烯基、炔
基。它们活性大,稳定性小,形成碳负离子
的容易程度是:
CH≡C > CH2=CH > CH3CH2 -
C-H中s成分增加
试分析之!
烃基d合成子大多通过有机金属卤化物制得, 由C-Na,C-Li通过金属交换而得C-M,反应 如下:
中起反应,给出中间体或目标分子。它是合成
子的合成等价物。
6.1.2 合成子的极性转换 Example:卤代烷的取代反应
R-X Mg 醚 RMgX RR+
+
Nu
XR-Nu MgX+ R-E 亲电反应 亲核反应
+
E
极性转换(英文:Umpolung),也称极性翻
转、极性反转、极性颠倒,指有机化学中官
a + d2:
O (CH3)3SBr + H 3C
H
O
H
+
(CH3)2S + HBr
(a)
(d2)
产物是单官能团化合物。
a1 + d2:
O
O
OH H
O
H
O
H
+
(a1)
H 3C
(d2)
分析正误!
产物为α,β-不饱和醛,是1,3-双官能团 化合物
正确解:
O O C
-
O
[OH-]
+
(d2)
环己酮
O O
CH3CO
此时的合成子是CH3CO-,但这是不存在的。合成时,必 须用它的对等物,而等价物是实际存在的。
相关概念: 合成等价物:一种能起合成子作用的试剂。合 成子通常由于其本身的不太稳定而不能直接使 用。
试剂:实际使用的代表合成子的化合物。例如
MeI是合成子Me+的试剂。它能在相应的的合成
1,3-二硫环烷:
R-HC S S
+
n-BuLi
注意!
-BuH
S R S Li+
P叶立德:
Ph3P-CH2-OCH3
+
n-BuLi
Ph3P
C
H OCH3
Ph3P= C
H OCH3
Li+
三)d2合成子
(1)如α-碳原子旁有不饱和吸电子基团,
α-碳上的碳氢键就会被活化,使α-碳成为d2
羰基,因此产物是另一个羰基化合物。
这里:
S S
