各种玻璃配方知识
常见玻璃材料特性大全

常见玻璃材料特性大全1. 硅酸钠玻璃(石英玻璃)- 主要成分:二氧化硅(SiO2)- 特性:+ 高熔点:约为1710℃+ 耐高温:可在高温环境下使用+ 耐酸碱:抗腐蚀性强+ 透明度高:光线透过性好+ 机械强度高:较硬,不易破裂+ 电绝缘性:不导电+ 高压缩强度:使用于高压环境下+ 红外透明:可用于红外光学器件2. 硼硅酸盐玻璃(波尔兰玻璃)- 主要成分:硼砂(B2O3)、二氧化硅(SiO2)- 特性:+ 较低的熔点:约为820℃+ 热膨胀系数低:抗热震性好+ 耐酸碱性较强+ 光线透过性好:可制作光学器件+ 电绝缘性+ 耐高温:款型可在高温环境下使用3. 硼硅酸盐玻璃(钠钙玻璃)- 主要成分:硼砂(B2O3)、二氧化硅(SiO2)、碳酸钠(Na2CO3)- 特性:+ 透明度高:对光线有较好的透过性+ 机械强度较高+ 电绝缘性好+ 耐热震性较差+ 耐酸碱性较差:不能与酸或碱接触4. 硼硅酸盐玻璃(硼硅酸盐光纤)- 主要成分:硼砂(B2O3)、硅酸盐(SiO2)- 特性:+ 透明度高:用于传输光信号+ 低损耗:光线传输损耗小+ 大传输带宽+ 抗电磁干扰性:光纤传输不受电磁干扰影响+ 耐高温性好:可在高温环境下使用5. 碱化铝硅酸盐玻璃(玻璃陶瓷)- 主要成分:氧化铝(Al2O3)、硅酸盐(SiO2)- 特性:+ 低熔点:约为750℃+ 高硬度+ 良好的绝热性能+ 耐热性强:可在高温环境下使用+ 耐酸碱性好+ 良好的抗磨性能以上是常见玻璃材料的特性概述,每种玻璃材料都有其独特的特点和应用领域。
在使用时,请根据具体需求选择适合的玻璃材料。
玻璃制作技术配方及原料

玻璃制作技术配方及原料玻璃是一种非晶态固体材料,由硅酸盐、硼酸盐、锑酸盐、氟化物等多种物质以一定比例混合制备而成。
玻璃材料广泛应用于建筑、器皿、光学、电子等领域,因其透明、坚固、耐高温等特性而受到广泛关注。
下面将介绍玻璃制作技术配方及原料。
一、玻璃制作技术配方1.硅酸盐玻璃配方:-硅石粉:55%-石灰石:25%-纯碱:15%-萤火虫石(稀土氧化物):5%2.硼酸盐玻璃配方:-硼砂:70%-硅石粉:15%-纯碱:10%-碳酸钠:5%3.锑酸盐玻璃配方:-砷酸钾:70%-硅酸钠:20%-锑酸钠:10%4.氟化物玻璃配方:-钠氟化物:70%-氟化铝:20%-氟化镁:10%二、玻璃制作原料1.硅酸盐玻璃的原料:-硅石:主要成分为二氧化硅(SiO2),是制备硅酸盐玻璃的主要原料。
-石灰石:主要成分为氧化钙(CaO),用于调节玻璃的碱性或酸性。
-纯碱:主要成分为碳酸钠(Na2CO3),用于提高玻璃的溶解度。
-萤火虫石(稀土氧化物):用于提高玻璃的抗辐射能力。
2.硼酸盐玻璃的原料:-硼砂:主要成分为硼酸(H3BO3),是制备硼酸盐玻璃的主要原料。
-硅石:同上。
-纯碱:同上。
-碳酸钠:同上。
3.锑酸盐玻璃的原料:-砷酸钾:主要成分为砷酸盐(As2O5),是制备锑酸盐玻璃的主要原料。
-硅酸钠:主要成分为硅酸盐(SiO2),是制备锑酸盐玻璃的主要原料。
-锑酸钠:主要成分为锑酸盐(Sb2O5),是制备锑酸盐玻璃的主要原料。
4.氟化物玻璃的原料:-钠氟化物:主要成分为氟化钠(NaF),是制备氟化物玻璃的主要原料。
-氟化铝:主要成分为氟化铝(AlF3),是制备氟化物玻璃的主要原料。
-氟化镁:主要成分为氟化镁(MgF2),是制备氟化物玻璃的主要原料。
以上是几种常见的玻璃制作技术配方及原料。
由于玻璃可以根据不同的配方和原料加工出多种不同类型的玻璃,如钢化玻璃、绝缘玻璃、光学玻璃等,所以实际配方和原料的组成可能会有所不同。
在实际生产过程中,还需要根据具体需要进行调整和改良。
各种玻璃配方知识

各种玻璃配方知识玻璃是一种无定形固体,主要由硅酸盐和氧化物组成。
它的基本成分是石英砂(二氧化硅)和碳酸钠(二氧化碳),同时还添加了控制玻璃的特性和性能的其他氧化物和物质。
下面将介绍几种常见的玻璃配方知识。
1.硅酸盐玻璃配方:硅酸盐玻璃是最常见的玻璃类型之一,主要成分是二氧化硅(SiO2)。
硅酸盐玻璃的配方可以根据不同的需求和应用进行调整,常见的控制元素有氧化钠(Na2O)、氧化铝(Al2O3)和氧化钙(CaO),它们对玻璃的特性和性能有显著影响。
2.硼硅酸盐玻璃配方:硼硅酸盐玻璃是一种特殊的玻璃类型,其基本成分是二氧化硼(B2O3)和二氧化硅(SiO2)。
硼硅酸盐玻璃的配方中添加了较高比例的二氧化硼,这使得玻璃具有较低的熔点和较高的热膨胀系数,适合用于制作耐热玻璃器皿和光学器件。
3.铅玻璃配方:铅玻璃是一种含有较高比例的氧化铅(PbO)的玻璃,它的主要成分是二氧化硅(SiO2)和氧化铅(PbO)。
铅玻璃具有较高的折射率和较高的密度,因此广泛用于光学器件和水晶制品。
由于铅的毒性,近年来铅玻璃的使用逐渐受到限制。
4.硼铝硅酸盐玻璃配方:硼铝硅酸盐玻璃是一种混合了硼酸盐、铝酸盐和硅酸盐的玻璃。
它的配方可以根据不同的需求进行调整,通常包括较高比例的硼酸盐(如硼酸)和铝酸盐(如氧化铝)。
硼铝硅酸盐玻璃具有较低的熔点和良好的耐用性,适合用于制作化学仪器和耐火材料。
5.镁铝硅酸盐玻璃配方:镁铝硅酸盐玻璃是一种含有较高比例的镁酸盐(如氧化镁)和铝酸盐(如氧化铝)的玻璃。
它具有较高的抗热震性能和较低的热膨胀系数,适合用于制作热电容器、电力电子器件和太阳能电池等。
玻璃的配方可以根据不同的需求和应用进行调整,以达到所需的特性和性能。
同时,配方的调整还可以影响玻璃的制备工艺和成本。
因此,在设计和制备玻璃产品时,选择合适的配方是至关重要的。
玻璃原料主要成分

在我们的生活当中,相信朋友们对玻璃都不会陌生,玻璃在我们的生活中应用到的领域非常的广泛,比较常见的是我们的玻璃门窗,但是我们的朋友并不知道制作玻璃的原材料需要用到什么?下面小编就大家来一起了解一下吧!玻璃原料比较复杂,但按其作用可分为主要原料与辅助原料。
主要原料构成玻璃的主体并确定了玻璃的主要物理化学性质,辅助原料赋予玻璃特殊性质和给制作工艺带来方便。
一、主要原料:1、硅砂或硼砂:硅砂或硼砂引入玻璃的主要成分是氧化硅或氧化硼,它们在燃烧中能单独熔融成玻璃主体,决定了玻璃的主要性质,相应地称为硅酸盐玻璃或硼酸盐玻璃。
2、苏打或芒硝:苏打和芒硝引入玻璃的主要成分是氧化钠,它们在煅烧中能与硅砂等酸性氧化物形成易熔的复盐,起了助熔作用,使玻璃易于成型。
但如含量过多,将使玻璃热膨胀率增大,抗拉度下降。
3、石灰石、白云石、长石等:石灰石引入玻璃的主要成分是氧化钙,增强玻璃化学稳定性和机械强度,但含量过多使玻璃折晶和降低耐热性。
白云石作为引入氧化镁的原料,能提高玻璃的透明度、减少热膨胀及提高耐水性。
长石作为引入氧化铝的原料,它可以控制熔化温度,同时也可提高耐久性。
此外,长石还可提供氧化钾成分,提高玻璃的热膨胀性能。
4、碎玻璃:一般来说,制造玻璃时不是全部用新原料,而是掺入15%——30%的碎玻璃。
二、玻璃的辅助原料1、脱色剂:原料中的杂质如铁的氧化物会给玻璃带来色泽,常用纯碱、碳酸钠、氧化钴、氧化镍等作脱色剂,它们在玻璃中呈现与原来颜色的补色,使玻璃变成无色。
此外,还有与着色杂质能形成浅色化合物的减色剂,如碳酸钠能与氧化铁氧化成二氧化二铁,使玻璃由绿色变黄色。
2、着色剂:某些金属氧化物能直接溶于玻璃溶液中使玻璃着色。
如氧化铁使玻璃呈现黄色或绿色,氧化锰能呈现紫色,氧化钴能呈现蓝色,氧化镍能呈现棕色,氧化铜和氧化铬能呈现绿色3、澄清剂:澄清剂能降低玻璃熔液的粘度,使化学反应所产生的气泡,易于逸出而澄清。
常用的澄清剂有白砒、硫酸钠、硝酸钠、铵盐、二氧化锰等。
玻璃的原料及成分

玻璃的原料及成分一、引言玻璃是一种广泛应用的材料,其独特的透明性和硬度使其在建筑、制造和日常生活中都有重要的作用。
然而,许多人对玻璃的原料和成分知之甚少。
本文将深入探讨玻璃的原料及其成分,为读者提供全面、详细的了解。
二、玻璃的制备方法玻璃制备的基本过程是通过将熔融的原料急冷而形成的。
为了制备玻璃,我们需要以下四个主要原料:1.矽酸盐:主要以二氧化硅(SiO2)的形式存在,是玻璃的主要成分。
2.碳酸盐:主要以碳酸钠(Na2CO3)和碳酸钙(CaCO3)的形式存在,用于调节玻璃的溶解度和熔点。
3.碳酸氢盐:主要以碳酸氢钠(NaHCO3)的形式存在,用于增加玻璃的稳定性。
4.硅酸盐:主要以液体玻璃的形式存在,用于降低玻璃的粘度。
三、玻璃的主要成分除了上述提到的原料外,玻璃中还含有以下一些成分,它们会对玻璃的性能和特性产生重要影响:1. 氧化物氧化物是玻璃的主要成分之一,它们包括:•二氧化硅(SiO2):是玻璃的主要成分,其含量通常在60%到75%之间。
它使玻璃具有硬度和透明性。
•氧化钠(Na2O):通常用作玻璃的助熔剂,可以降低玻璃的熔点。
•氧化钙(CaO):可以提高玻璃的抗压强度和化学稳定性。
2. 碱金属氧化物碱金属氧化物也是玻璃中的重要成分,它们包括:•氧化钠(Na2O):用于降低玻璃的熔点和粘度。
•氧化钾(K2O):可以改变玻璃的光学性能,使其具有不同的折射率。
3. 碱土金属氧化物碱土金属氧化物主要用于改变玻璃的物理性质,它们包括:•氧化钙(CaO):可以提高玻璃的抗压强度和化学稳定性。
•氧化镁(MgO):可以提高玻璃的抗张强度和热稳定性。
4. 其他氧化物除了上述氧化物外,玻璃中还含有一些其他氧化物,如:•氧化铝(Al2O3):用于增加玻璃的硬度和化学稳定性。
•氧化硼(B2O3):可以改变玻璃的熔点和粘度。
四、玻璃的成分对性能的影响玻璃的成分不仅决定了其物理性质,还会对其其他性能产生影响。
以下是几种常见的玻璃成分及其影响:1.二氧化硅:影响玻璃的硬度和透明性。
玻璃产品介绍及配方2021

玻璃产品基本介绍一、玻璃类别氧化物玻璃又分为硅酸盐玻璃、硼酸盐玻璃、磷酸盐玻璃等。
硅酸盐玻璃指基本成分为SiO2的玻璃,其品种多,用途广。
通常按玻璃中SiO2以及碱金属、碱土金属氧化物的不同含量,又分为:①石英玻璃。
SiO2含量大于99.5%,热膨胀系数低,耐高温,化学稳定性好,透紫外光和红外光,熔制温度高、粘度大,成型较难。
多用于半导体、电光源、光导通信、激光等技术和光学仪器中。
②高硅氧玻璃。
SiO2含量约96%,其性质与石英玻璃相似。
③钠钙玻璃。
以SiO2含量为主,还含有15%的Na2O和16%的CaO,其成本低廉,易成型,适宜大规模生产,其产量占实用玻璃的90%。
可生产玻璃瓶罐、平板玻璃、器皿、灯泡等。
④铅硅酸盐玻璃。
主要成分有SiO2 和PbO ,具有独特的高折射率和高体积电阻,与金属有良好的浸润性,可用于制造灯泡、真空管芯柱、晶质玻璃器皿、火石光学玻璃等。
含有大量PbO的铅玻璃能阻挡X射线和γ射线。
⑤铝硅酸盐玻璃。
以SiO2和Al2O3为主要成分,软化变形温度高,用于制作放电灯泡、高温玻璃温度计、化学燃烧管和玻璃纤维等。
⑥硼硅酸盐玻璃。
以SiO2和B2O3 为主要成分,具有良好的耐热性和化学稳定性,用以制造烹饪器具、实验室仪器、金属焊封玻璃等。
硼酸盐玻璃以B2O3为主要成分,熔融温度低,可抵抗钠蒸气腐蚀。
含稀土元素的硼酸盐玻璃折射率高、色散低,是一种新型光学玻璃。
磷酸盐玻璃以P2O5为主要成分,折射率低、色散低,用于光学仪器中。
二、玻璃配方在日用玻璃中硅酸盐的用量较多,约占配合料重量的60~70%以上。
现有玻璃的组成为:SiO2 72.9%,Al2O3 1.6%,CaO 8.8%,B2O3 0.4%,BaO0.5%。
Na2O + K2O 15.6%,SO3 0.2%。
玻璃的设计成分:原料的化学成分:。
玻璃的原料组成及质量标准

玻璃的原料组成及质量标准
简介
玻璃是一种非晶态无定形固体,由多种原料组成,经过一系列
工艺加工而成。
本文将介绍玻璃的主要原料组成及其相关质量标准。
原料组成
1. 硅砂(二氧化硅):是制造玻璃的主要原料,占据了玻璃成
分的大部分比例。
2. 石灰石(氧化钙):用于调节玻璃的溶解性和粘度。
3. 硼砂(三氧化二硼):用于降低玻璃的熔点和粘度,增加玻
璃的抗热冲击性能。
4. 硼石(硼酸钠):用于调节玻璃的化学稳定性和耐火性能。
5. 纯碱(氢氧化钠):用于调节玻璃的溶解性和抗水解性。
6. 改性石墨(氧化铝):用于增加玻璃的强度和耐磨性。
7. 红铁矿(二氧化铁):用于调节玻璃的着色效果。
质量标准
玻璃的质量标准主要由以下几个方面来衡量:
1. 透明度:玻璃应具有良好的透明度,不应有明显的色差、气泡和纹理。
2. 强度:玻璃应具有足够的力学强度,能够承受一定的压力和冲击。
3. 钢化性能:钢化玻璃应具有较高的抗冲击性和耐热性。
4. 热阻性:玻璃应具有良好的隔热性能,能够有效阻止热量的传导。
5. 化学稳定性:玻璃应具有良好的耐腐蚀性能,不受潮湿、酸碱等化学物质的侵蚀。
以上是玻璃的原料组成及质量标准的简要介绍。
根据不同的应用领域和需求,对玻璃的具体要求可能会有所不同。
玻璃配料3
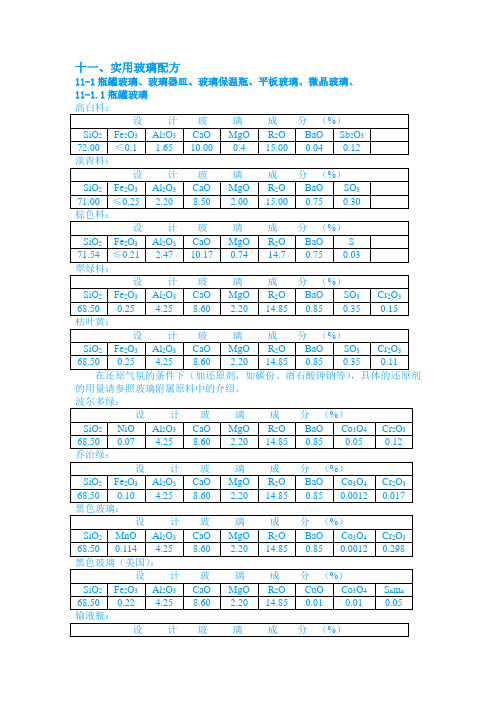
十一、实用玻璃配方11-1瓶罐玻璃、玻璃器皿、玻璃保温瓶、平板玻璃、微晶玻璃、11-1.1瓶罐玻璃的用量请参照玻璃附属原料中的介绍。
本发明介绍的是一种高红外线传递的氯化物玻璃。
该玻璃的配方为:CaF220-30%(最佳范围20-29.5%)、AlF328-34%(最佳 28-32.5%)、PbF225-35%(最佳 27.5-31.5%)、LiF 5-10%(最佳 5-9.3%)、KF 2-6%(最佳 0-6.8%)。
其中YF3+LaF3为2-8%(最佳 3-6.5%),以上均为克分子百分比,还需加上重量百分比为0.5-1.5%的氧稳定剂。
本发明的玻璃由于采用了氧稳定剂,但用量很小,从而使玻璃稳定性很好,并能做得很薄,红外线的透过率也大大提高。
11-3眼睛片用玻璃本发明的玻璃对压制尺寸精确的眼睛片来说特别适用。
该玻璃的配方为:P 2O545-55%、BaO 15-40%、PbO 5-35%、Li2O 5-15%、Al2O30-15%、以氯化物形成存在的F 0-6%。
其中,25%的BaO可以用CaO、MgO或SrO来代替,25%的Li2O可以其它的碱金属氧化物来代替,用两均相同(上述用量为克分子百分数)。
本发明介绍的玻璃是一种新型玻璃,它是无色透明的,耐侵蚀性能甚至超过了一级标准,用来压制眼睛片时,曲率公差的精确度能达到不超过+-0.5丝的精度,而表面的的粗糙度则低于0.02丝。
11-4铝玻璃本发明的铝玻璃具有一个较陡的温度-粘度曲线,一次它对于用吹制法来成型玻璃器皿的工艺是十分合适的。
该玻璃的配方为:SiO250-60%、Al2O30-3%、B2O30-8%、Lr20-3%、CaO 0-8%、Li2O 0-3%、Na2O0-15%、K2O 0-15%、PbO 20-30%。
其中SiO2+Al2O3+B2O3+ZRO2为55-65%、B2O3+CaO为5-10%、Li2O+Na2O+K2O为 9-16%(重量百分比)。
玻璃配料_精品文档

玻璃配料简介玻璃是一种常见而广泛应用的材料,它具有优良的透光性、耐热性和耐化学性。
作为一种非晶体材料,玻璃的主要成分是硅酸盐,如二氧化硅和其他金属氧化物。
除了这些主要成分外,玻璃还需要一系列的配料来提供特定的性能和质量。
本文将介绍玻璃中常见的配料及其作用。
主要配料1. 硅酸盐硅酸盐是玻璃中最主要的成分,其中最常用的是二氧化硅(SiO2)。
它占据了玻璃中的大部分成分,通常超过60%。
二氧化硅是一种硬质无色晶体,具有良好的化学稳定性和抗腐蚀性。
它能够增加玻璃的硬度、强度和耐热性。
2. 钙碱金属氧化物钙碱金属氧化物是玻璃中的另一个重要成分,通常包括氧化钠(Na2O)和氧化钙(CaO)。
它们的作用是调节玻璃的熔点,降低其粘度,使得玻璃更容易加工和制造。
此外,钙碱金属氧化物还可以增加玻璃的化学稳定性,提高其抗腐蚀性能。
3. 稀土金属氧化物稀土金属氧化物是一类稀有金属氧化物,包括氧化镧(La2O3)、氧化铈(CeO2)等。
它们在玻璃中被用作着色剂,能够赋予玻璃各种不同的颜色。
通过调节稀土金属氧化物的含量和组合,可以得到不同颜色的玻璃,如透明、蓝色、绿色、紫色等。
4. 纤维增强材料为了增加玻璃的强度和抗冲击性,通常会添加纤维增强材料,如玻璃纤维、碳纤维、石英纤维等。
这些纤维具有优异的强度和刚度,能够有效地提高玻璃的机械性能,使其更加耐用。
5. 其他配料除了上述主要配料外,玻璃还可以添加一些其他辅助配料,如氧化铁(Fe2O3)、氧化锰(MnO2)、氧化镁(MgO)等。
这些配料可以改变玻璃的化学性质、热性能和光学性能,使得玻璃具有更多的特殊用途和优良的性能。
配料的影响不同配料的含量和组合对玻璃的性能和质量具有重要影响。
下面将介绍一些常见配料对玻璃性能的影响:•硅酸盐的含量:硅酸盐的含量决定了玻璃的硬度、强度和耐热性。
较高的硅酸盐含量可以提高玻璃的硬度和强度,但过高的含量可能导致玻璃的脆性增加。
•钙碱金属氧化物的含量:钙碱金属氧化物的含量影响着玻璃的熔点和粘度。
玻璃原料及配合料制备

玻璃,X—射线防护与防辐射玻璃,人造宝石等。
2.1.1.8含硼原料
引入B2O3的原料为硼酸、硼砂和含硼矿物。 ➢ 硼酸H3BO3
硼酸加热至140~160℃后转变为四硼酸(H2B4O7),继续加热 则完全转变为熔融的B2O3。
物理脱色剂:二氧化锰、硒、氧化钴、氧化钕和氧化镍等。
2.1.2.6乳浊剂、助溶剂、氧化与还原剂
➢ 铜化合物 胶体铜的微粒使玻璃着成红色。
3、硫、硒化合物
➢ 硒与硫化镉 单体硒的胶体粒子,使玻璃着成玫瑰红色。硒与硫化镉共用 可以制成由黄色到红色的玻璃。
➢ 锑化合物 在钠—钙玻璃中加入三氧化二锑、硫和煤粉,在熔制过程 中生成硫化钠,经过加热显色,硫化钠与三氧化二锑形成 硫化锑的胶体微粒,使玻璃着成红色。
1、化学脱色剂
➢ 硝酸钠(分解温度350℃)硝酸钾(分解温度400℃)
由于它们的分解温度低,必须与白砒和三氧化二锑共用, 脱色效果才好。
➢ 白砒和三氧化二锑
氧化作用。还能消除用硒和氧化锰脱色时,因用量过多而 形成的淡红色。
➢ 二氧化铈
用作脱色剂时能保证最好的脱色,其脱色作用基于在玻璃 熔制的温度下分解放出氧,通常与硝酸盐共同使用。
时,所需芒硝的量比纯碱多34%,相对的增加了运输和加 工储备等生产费用。
➢ 纯碱缺乏时,用芒硝引入Na2O ➢ 芒硝除引入Na2O外,还有澄清作用,因而在采用纯碱引
入Na2O 的同时,也常使用部分芒硝(2~3%)。 ➢ 芒硝能吸收水分而潮解,应储放在干燥有屋顶的堆场或库内,
并 且要经常测定其水分。
玻璃制造的原材料

玻璃制造的原材料玻璃是一种常见的材料,广泛应用于建筑、家居、工艺品等领域。
它的制造过程复杂,需要使用多种原材料来达到所需的性能和质量。
下面将介绍一些常见的玻璃制造原材料。
1. 硅石:硅石是制造玻璃的主要原料之一。
它主要由二氧化硅(SiO2)组成。
硅石的质量和纯度对玻璃的质量有重要影响。
一般来说,高纯度的硅石可以制造出高质量的玻璃。
硅石经过破碎、洗涤和烘干等处理后,可以用于制造玻璃。
2. 碱金属氧化物:碱金属氧化物是另一个重要的玻璃原料。
常用的碱金属氧化物有碳酸钠(Na2CO3)和碳酸钾(K2CO3)等。
碱金属氧化物可以降低玻璃的熔点,提高玻璃的流动性和塑性,使玻璃更容易制造和加工。
3. 石灰石:石灰石中含有氧化钙(CaO),它可以调节玻璃的化学性质和物理性能。
石灰石可以增加玻璃的抗化学腐蚀性能,使玻璃更耐用。
同时,石灰石还可以减少玻璃的热膨胀系数,提高玻璃的热稳定性。
4. 砂子:砂子是制造玻璃的重要原料之一。
它主要由二氧化硅和杂质组成。
砂子的质量和纯度对玻璃的质量有很大影响。
高纯度的砂子可以制造出高质量的玻璃。
砂子经过洗涤、筛选和烘干等处理后,可以用于制造玻璃。
5. 硼砂:硼砂是一种含有硼元素的化合物,它可以增加玻璃的抗热震性能和抗冷热变形能力。
硼砂还可以降低玻璃的熔点,提高玻璃的流动性和塑性。
6. 氧化铝:氧化铝可以增加玻璃的硬度和耐磨性,使玻璃更耐用。
氧化铝还可以提高玻璃的抗化学腐蚀性能和耐高温性能。
以上是一些常见的玻璃制造原材料。
通过合理的配比和处理,这些原材料可以制造出各种性能优良的玻璃产品。
当然,在实际的玻璃制造过程中,还需要考虑其他因素,如工艺参数、加工技术等。
只有综合考虑这些因素,才能制造出质量优良的玻璃产品。
玻璃制造的原材料种类繁多,每种原材料都有其独特的作用和贡献。
在玻璃制造过程中,需要合理选择和配比这些原材料,才能制造出满足各种需求的玻璃产品。
通过不断的研究和创新,相信玻璃制造技术将会不断进步,为人们的生活和工作带来更多的便利和美好。
玻璃制作的原料和原理

玻璃制作的原料和原理
一、玻璃制作的原料:
如石英砂、硼砂、硼酸、重晶石、碳酸钡、石灰石、长石、纯碱等为主要原料,另外加入少量辅助原料制成的。
二、玻璃制作的原理:
普通的浮法玻璃的主要成分是硅酸钙和硅酸钠,主要反应如下:
Na2CO3+SiO2 =(高温)Na2SiO3+CO2
CaCO3+SiO2=(高温)CaSiO3+CO2
三、工艺:
主要包括:①原料预加工.将块状原料(石英砂、纯碱、石灰石、长石等)粉碎,使潮湿原料干燥,将含铁原料进行除铁处理,以保证玻璃质量.②配合料制备.③熔制.玻璃配合料在池窑或坩埚窑内进行高温(1550~1600度)加热,使之形成均匀、无气泡,并符合成型要求的液态玻璃.④成型.将液
态玻璃加工成所要求形状的制品,如平板、各种器皿等.⑤热处理.通过退火、淬火等工艺,清理或产生玻璃内部的应力、分相或晶化,以及改变玻璃的结构状态.。
玻璃的种类及生产工艺介绍

玻璃的种类及生产工艺介绍玻璃是指一类非晶态物质,由氧化硅、氧化硼、氧化铝等主要无机化合物组成。
根据不同的成分和工艺,玻璃可以分为多种不同的种类。
下面将对几种常见的玻璃种类及其生产工艺进行介绍。
1. 石英玻璃(Quartz glass)石英玻璃是一种无色无气孔的特种玻璃,主要由石英砂(二氧化硅)制成。
它具有优良的导热性能、耐热性和优异的透明度,可在高温下使用。
其生产工艺包括将石英砂加热至高温熔化,然后进行成型和退火等工序。
2. 硅酸钙玻璃(Calcium-silicate glass)硅酸钙玻璃是一种常见的窗户玻璃,主要由氧化硅和氧化钙组成。
它具有良好的抗腐蚀性、良好的隔热性能和较高的透明度。
其生产工艺包括将氧化硅和氧化钙混合熔融,然后快速冷却成型。
3. 硼硅酸盐玻璃(Borosilicate glass)硼硅酸盐玻璃是一种宝石般透明的玻璃,主要由氧化硼、氧化硅和氧化钠等组成。
它具有较低的热膨胀系数、优良的耐热性和耐酸碱性。
该玻璃常用于制作化学试剂瓶和实验室设备。
其生产工艺包括将氧化硼、氧化硅和氧化钠混合熔融,然后将玻璃熔液冷却成型。
4. 钠钙玻璃(Soda-lime glass)钠钙玻璃是一种常见的工业用玻璃,主要由氧化硅、氧化钠和氧化钙组成。
它具有较高的透明度和较低的制造成本,广泛用于制造瓶子、窗户和平板玻璃等产品。
其生产工艺包括将混合的原料熔融,然后将玻璃熔液流淌到液体金属上,形成带状玻璃,最后冷却成型。
5. 铅玻璃(Lead glass)铅玻璃是一种含有一定比例的氧化铅的玻璃。
它具有高折射率、较高的密度和良好的抗辐射性能,常用于制作水晶饰品和光学器材。
其生产工艺包括将氧化铅和其他原料混合熔融,然后进行成型和退火等工序。
以上是几种常见的玻璃种类及其生产工艺的简要介绍,每种玻璃都有自己独特的性质和应用领域。
随着科技的进步,越来越多的新型玻璃正在不断涌现,为我们的生活和工业带来更多的可能性。
玻璃材料的组成

玻璃材料的组成
玻璃是一种常见的无机非晶固体材料,由多种化学元素组成。
它的主要成分是二氧化硅(SiO2),也包含其他氧化物和杂质。
1. 二氧化硅(SiO2):二氧化硅是玻璃的主要成分,占据了玻璃总质量的大部分。
它是一种无色、无味的晶体,具有高熔点和抗腐蚀性。
二氧化硅的分子结构是由一个硅原子和四个氧原子组成的,这种排列方式使得玻璃具有非晶态结构。
2. 氧化钠(Na2O):氧化钠是玻璃的重要辅助成分之一,它能够降低玻璃的熔点,促进玻璃的形成。
氧化钠还可以提高玻璃的抗压强度和耐热性。
3. 氧化钙(CaO):氧化钙是另一个常见的辅助成分,它可以增加玻璃的稳定性和耐热性。
氧化钙还可以使玻璃具有一定的抗溶解性,防止玻璃在潮湿环境中被水分侵蚀。
4. 氧化铝(Al2O3):氧化铝是一种常见的玻璃辅助成分,可以提高玻璃的抗压强度和耐热性。
氧化铝还可以改变玻璃的光学性质,使其具有一定的透明度和折射率。
除了以上主要成分外,玻璃还可能含有其他氧化物和杂质,如氧化镁(MgO)、氧化铁(Fe2O3)、氧化钴(CoO)等。
这些成分的加入可以改变玻璃的特性,如颜色、硬度、导电性等。
玻璃的组成是多种化学元素的复杂组合。
不同成分的加入可以赋予玻璃不同的性质和用途。
玻璃的透明、坚硬和耐热性让它成为一种重要的建筑材料和容器材料。
同时,玻璃的特殊性质还使其在光学、电子、光纤等领域有着广泛的应用。
通过对玻璃材料组成的深入了解,我们可以更好地理解和利用这种多功能材料。
玻璃的原料按用量和用途

玻璃的原料按用量和用途玻璃是由许多不同原料组成的一种无机非金属材料,它具有透明、质地坚硬、不透水、化学稳定等特点,广泛应用于建筑、交通工具、器皿、家具、电子产品等领域。
下面我将从玻璃的用量和用途两个方面来详细回答。
一、玻璃的原料按用量:1.石英砂:石英砂是制造玻璃的主要原料,通常占整个玻璃成分的60%以上。
石英砂是一种含有高纯度二氧化硅(SiO2)的矿石,具有高熔点、高硬度和化学稳定性,是制造高质量玻璃的关键原料。
2.碳酸钠:碳酸钠是制造玻璃的主要碱性助剂,占玻璃成分的10%至20%。
碳酸钠在玻璃熔制过程中会起到熔化和改善玻璃流动性的作用,使玻璃可以更容易地进行成型。
3.石灰石:石灰石是制造玻璃的辅助原料,一般占玻璃成分的5%至15%。
石灰石主要提供氧化钙(CaO),它可以中和碳酸钠带来的碱性,并增加玻璃的化学稳定性和抗水溶解性。
4.白云石:白云石是制造玻璃的辅助原料,占玻璃成分的2%至10%。
白云石提供了含有镁的氧化物,它可以改善玻璃的耐热性和抗震性能。
5.氢氧化铝:氢氧化铝是制造玻璃的辅助原料,一般占玻璃成分的2%至10%。
氢氧化铝可以稳定玻璃的碱性,并增强其抗水溶解性和耐热性能。
二、玻璃的用途:1.建筑领域:玻璃在建筑中被广泛运用,例如用于制造窗户、门、墙壁、屋顶等。
透明的玻璃可以提供采光和视觉效果,而夹层玻璃可以提供隔音和保温功能。
2.交通工具:玻璃在汽车、火车以及飞机等交通工具的制造中扮演重要角色。
汽车前挡风玻璃和车窗都是使用特殊工艺制造的安全玻璃,以保护乘客的安全并提供良好的视觉效果。
3.器皿:玻璃器皿可以用于存储食品、饮料和药品等。
由于玻璃具有无毒、防氧化和无味的特性,它成为了制作瓶子、杯子、碗、罐等容器的理想材料。
4.家具:玻璃被广泛应用于家具制造中,例如玻璃桌面、玻璃橱窗、玻璃家居装饰品等。
透明的玻璃可以提供现代化、简约的设计风格,使家具更具美观和科技感。
5.电子产品:玻璃在电子产品制造中扮演着重要角色。
玻璃配料 (2)

玻璃配料简介玻璃是一种广泛应用于建筑、家居和工业制品的无机非金属材料。
为了制造出高质量的玻璃产品,需要精确配料各种原料。
本文将介绍玻璃制品的常见原料和配料过程。
玻璃的主要组成玻璃的主要成分是二氧化硅(SiO2)。
除了二氧化硅,玻璃还包含其他辅助成分,如氧化钠(Na2O)、氧化钙(CaO)和氧化铝(Al2O3)。
这些成分的比例和配料过程对玻璃的性质和应用起着重要的影响。
玻璃配料的常见原料1. 二氧化硅(SiO2)二氧化硅是制造玻璃的主要原料。
它可以从石英矿石、石英砂或沙石等来源中提取。
二氧化硅的纯度和颗粒大小对玻璃的质量和透明度有着重要的影响。
2. 氧化钠(Na2O)氧化钠是玻璃配料中的重要成分,可以提高玻璃的熔化温度和粘附性。
它通常通过碱性矿石,如天然碱、碱石灰和重晶石等获取。
3. 氧化钙(CaO)氧化钙是另一个常见的玻璃配料原料。
它可以降低玻璃的熔化温度,并增加玻璃的稳定性和耐久性。
氧化钙可以从石灰石或生石灰等来源中获得。
4. 氧化铝(Al2O3)氧化铝是一种常用的玻璃配料,可以改善玻璃的物理和化学性质。
它主要从含铝石灰石或者氧化铝矿石中提取。
玻璃配料过程玻璃配料过程是将上述原料按照一定比例混合,并通过一系列的加热和冷却过程制成玻璃产品的过程。
下面是一般的玻璃配料流程:1.原料准备:将二氧化硅、氧化钠、氧化钙和氧化铝等原料按照配比准备好。
2.原料称量:根据配方要求,将各种原料按照精确的比例称量。
这一步需要精确的配比控制,以确保最终产品的质量符合要求。
3.原料混合:将称量好的原料放入混合机中,进行充分的混合,以确保各种原料均匀分布。
4.加热与熔化:将混合好的原料放入玻璃窑炉中,在高温下加热熔化。
熔化过程中,原料中的化合物会发生化学反应,并将玻璃的成分和性质固定下来。
5.冷却与成型:将熔化的玻璃从窑炉中取出,放置在冷却台上,通过控制冷却速度,使玻璃逐渐变硬。
在冷却过程中,可以根据需要进行成型,例如压延、抽拉或模具成型等。
各种玻璃配方知识

各种玻璃配方知识-标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII1。
石英砂SiO2在玻璃中的含量很高,一般为50-80%,在普通瓶罐,器皿玻璃,平板玻璃中,含量在70-75%;在石英玻璃中高达98%以上。
SiO2在玻璃中构成骨架,赋予玻璃良好的化学稳定性,热稳定性,透明性,较高的软化温度,硬度和机械强度。
但含量增大时,熔融温度升高,玻璃液粘度增大。
Na2O是一种良好的助熔剂,能在较低的温度下与SiO2反应生成硅酸盐,能降低玻璃液的粘度,加快玻璃的熔制速度。
但Na2O将减弱玻璃的结构强度,增大玻璃的热膨胀系数,降低玻璃的热稳定性,化学稳定性和机械强度。
因此,玻璃组成中,Na2O,K2O的总量不能高于16%。
引入Na2O的原料有纯碱和芒硝Na2SO4。
纯碱(Na2CO3)是一种微细白色粉末,易熔于水。
所含杂质有氯化钠,硫酸钠,氧化铁等。
纯碱易潮解,结块,不利于配合料的混合,。
因此,必须贮存在通风干燥的库房内。
熔制时可能在玻璃表面形成称为‘浮渣’的泡沫。
对纯碱的质量要求是(%);Na2CO3 >98,NaCl<1, Na2SO4< 0.1,Fe2O3 <0.1。
纯碱有轻碱和重碱之分。
在国内现用轻碱,轻碱容重小(0。
61),颗粒细。
已混合好的配合料在运输过程中容易出现分层现象,入窑后,易被窑内气流带入蓄热室,造成格子砖的堵塞与熔融。
而重碱容重大(0。
94),颗粒粗。
因而使用重碱是提高配合料质量和减少碱尘的措施之一。
芒硝(Na2SO4)是比重为2。
7的白色粉未。
分无水芒硝和含水芒硝(Na2SO4.10H2O)两种。
含水芒硝在 35℃以上就开始析出结晶水而成糊状物,不便于使用。
为此,要预先进行熬制或烘烤处理。
芒硝的熔点为884℃,沸点为1430℃,它的分解温度较高,在熔制时,若有还原剂存在,则可大大降低芒硝的分解温度。
为此,在使用芒硝时必须加入煤粉。
玻璃的主要成分和原料

玻璃的主要成分和原料玻璃的主要化学成分是二氧化硅及氧化铝、氧化钙、氧化镁、氧化钠、氧化钾,其作用如下:1、二氧化硅为形成玻璃的主要组分,并使玻璃具有一系列优良性能,如透明度、机械强度、化学稳定性和热稳定性等。
缺点是其熔点高、熔液粘度大,造成熔化困难、热耗大,故生产玻璃时还需加入其他成分以改善这方面的状态。
2、玻璃原料中重新加入少量氧化铝,能减少玻璃的析晶女性主义,提升化学稳定性和机械强度,提升热稳定性,但当其含量过多时(al2o3>5%),就可以升高玻璃液的黏度,并使熔融和回应出现困难,反而减少析晶女性主义,并易并使玻璃原板上发生波筋等瑕疵。
3、加入适量氧化钙,能降低玻璃液的高温黏度,促进玻璃液的熔化和澄清。
温度降低时,能增加玻璃液黏度,有利于提高引上速度。
缺点是含量增高时,会增加玻璃的析晶倾向,减少玻璃的热稳定性,提高退火温度。
4、氧化镁其促进作用与氧化钙相似,但没氧化钙减少玻璃析晶女性主义的缺点,因此需用适度氧化镁替代氧化钙。
但过量则可以发生透辉石结晶,提升淬火温度,减少玻璃对水的稳定性。
5、氧化钠、氧化钾为良好的助溶剂,降低玻璃液的年度,促进玻璃液的熔化和澄清,还能大大降低玻璃的析晶倾向,缺点则是会降低玻璃的化学稳定性和机械强度。
由于二氧化硅、氧化铝、氧化钙、氧化镁、氧化钠、氧化钾具有以上一些特点,故在中国玻璃工业中一般大致控制在下列含量范围:sio2 70%~%,al2o3 1%~2.5%,cao 8%~10%,mgo1.5%~4.5%,(na2o+k2o)13%~15%。
此外,玻璃原料中常所含少量三氧化二铁、氧化铁、三氧化二铬等有毒成分,其促进作用如下:a、三氧化二铁能使玻璃着色,降低玻璃的透明度、透紫外线性能、透热性和机械强度,造成熔化澄清困难,并给玻璃的熔制品带来不良影响。
b、三氧化二铬能够较猛烈地并使玻璃着色,增加透明度,铬矿物颗粒能够在玻璃原板上构成黑点。
c、二氧化钛能提高玻璃的光折射和吸收紫外线性能;在三氧化二铁与二氧化钛超出一定含量比时,使玻璃组分中氧化铁的染色作用增强。
各种玻璃配方知识---精品管理资料

字体大小:大|中| 小2007-08—02 14:02 —阅读:734 —评论:0 第一节概述1.物质的玻璃态自然界中,物质存在着三种聚集状态,即气态,液态和固态。
固态物质又有两种不同的形式存在,即晶体和非晶体(无定形态).玻璃态属于无定形态,其机械性质类似于固体,是具有一定透明度的脆性材料,破碎时往往有贝壳状断面。
但从微观结构看,玻璃态物质中的质点呈近程有序,远程无序,因而又有些象液体.从状态的角度理解,玻璃是一种介于固体和液体之间的聚集状态。
对于“玻璃”的定义,二十世纪四十年代以来曾有过几种不同的表述。
1945年,美国材料试验学会将玻璃定义为“熔化后,冷却到固化状态而没有析晶的无机产物”。
也有将玻璃定义扩展为“物质(包括有机物,无机物)经过熔融,在降温冷却过程中因粘度增加而形成的具有固体机械性质的无定形物体"。
我国的技术词典中把“玻璃态”定义为;从熔体冷却,在室温下还保持熔体结构的固体物质状态。
其实,在上世纪八十年代,有人提出上述定义‘是多余的限制’.因为,无机物可以形成玻璃,有机物也可以形成玻璃,显然早期的表述并不合适.另外,经过熔融可以形成玻璃,不经过熔融也可以形成玻璃,例如,经过气相沉积,溅射可得到非晶态材料,采用溶胶—凝胶法也可以得到非晶态材料,可见后期的表述也并不妥当。
现代科学技术的发展已使玻璃的含义有了很大的扩展.因此,有人把具有下述四个通性的物质不论其化学性质如何,均称为玻璃。
这四个通性是;(1)各相同性.玻璃的物理性质,如热膨胀系数,导热系数,导电性,折射率等在各个方向都是一致的。
表明物质内部质点的随机分布和宏观的均匀状态。
(2)介稳性。
熔体冷却成玻璃体时并没有处于能量最低的状态,仍然有自发转变为晶体的倾向,因而,从热力学的观点看,处于介稳状态。
但常温下玻璃的粘度非常大,自发转变为晶体的速度非常慢,所以,从动力学的观点看,它又是非常稳定的。
(3)固态和熔融态间转化的渐变性和可逆性. 玻璃态物质由熔体转变为固体是在一定温度区间(转化温度范围)进行的,性质变化过程是连续的和可逆的,它与结晶态物质不同,没有固定的熔点.(4)性质随成分变化的连续性和渐变性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1。
石英砂SiO2在玻璃中的含量很高,一般为50-80%,在普通瓶罐,器皿玻璃,平板玻璃中,含量在70-75%;在石英玻璃中高达98%以上。
SiO2在玻璃中构成骨架,赋予玻璃良好的化学稳定性,热稳定性,透明性,较高的软化温度,硬度和机械强度。
但含量增大时,熔融温度升高,玻璃液粘度增大。
Na2O是一种良好的助熔剂,能在较低的温度下与SiO2反应生成硅酸盐,能降低玻璃液的粘度,加快玻璃的熔制速度。
但Na2O将减弱玻璃的结构强度,增大玻璃的热膨胀系数,降低玻璃的热稳定性,化学稳定性和机械强度。
因此,玻璃组成中,Na2O,K2O的总量不能高于16%。
引入Na2O的原料有纯碱和芒硝Na2SO4。
纯碱(Na2CO3)是一种微细白色粉末,易熔于水。
所含杂质有氯化钠,硫酸钠,氧化铁等。
纯碱易潮解,结块,不利于配合料的混合,。
因此,必须贮存在通风干燥的库房内。
熔制时可能在玻璃表面形成称为‘浮渣’的泡沫。
对纯碱的质量要求是(%);Na2CO3 >98,NaCl<1, Na2SO4< 0.1,Fe2O3 <0.1。
纯碱有轻碱和重碱之分。
在国内现用轻碱,轻碱容重小(0。
61),颗粒细。
已混合好的配合料在运输过程中容易出现分层现象,入窑后,易被窑内气流带入蓄热室,造成格子砖的堵塞与熔融。
而重碱容重大(0。
94),颗粒粗。
因而使用重碱是提高配合料质量和减少碱尘的措施之一。
芒硝(Na2SO4)是比重为2。
7的白色粉未。
分无水芒硝和含水芒硝(Na2SO4.10H2O)两种。
含水芒硝在35℃以上就开始析出结晶水而成糊状物,不便于使用。
为此,要预先进行熬制或烘烤处理。
芒硝的熔点为884℃,沸点为1430℃,它的分解温度较高,在熔制时,若有还原剂存在,则可大大降低芒硝的分解温度。
为此,在使用芒硝时必须加入煤粉。
煤分的理论用量为芒硝量的4%。
芒硝不仅可以代碱,而且是一种常用的澄清剂。
使用芒硝也有如下缺点;与纯碱相比,它的热耗大,这是因为石英砂和芒硝要在较高的温度下才进行反应,而且速度较慢;已熔化但未反应的芒硝浮在玻璃液表面,易产生芒硝泡;对耐火材料的侵蚀也大,尤其是当有芒水存在时;芒硝配合料的熔制必须在还原气氛下进行,但煤粉用量过多时,会使Fe2O3还原成Fe S而呈棕色。
因此,芒硝的用量有一定的限制。
对芒硝的质量要求是(%);Na2SO4 > 85,NaCl<2, CaSO4<4, Fe2O3<0.3,H2O<5.2氢氧化铝在瓶罐玻璃,器皿玻璃,平板玻璃中,Al2O3 含量为2—3%,最高为8—10%。
在含有碱金属和碱土金属氧化物的硅酸盐玻璃中,加入少量Al2O3能降低玻璃的析晶倾向,提高玻璃的化学稳定,热稳定性和机械强度,减轻玻璃对耐火材料的侵蚀,扩大玻璃成形操作范围。
引入Al2O3的原料有长石,高岭土,叶蜡石和工业氧化铝等。
氢氧化铝比焙烧氧化铝质纯,也易于熔化和澄清,但价格昂贵,容易吸水造成成分波动,熔制时易产生大量的泡沫。
为减少泡沫,可在配合料中加入适量的萤石或冰晶石。
3.1 引入Ca O的原料Ca O在玻璃中的主要作用是增加玻璃的化学稳定性和机械强度。
但含量过高时,玻璃易于析晶,因此,玻璃中Ca O含量一般不超过12.5%。
在高温时,Ca O能降低玻璃液粘度,加速玻璃的熔化和澄清,但在低温时,会使粘度快速增大,给成形操作带来困难。
引入Ca O 的原料有石灰石,方解石和白垩等。
石灰石,多呈灰色,淡黄色,淡红色,很少为白色,其颜色与氧化铁含量高低有关。
方解石它比石灰石纯度高,当玻璃成分要求严格控制时可选用方解石。
二辅助原料在玻璃生产中,起加速玻璃熔制,改善玻璃某种性能的原料,称为玻璃的辅助原料,根据它们在玻璃中的作用,可以分为助熔剂,澄清剂,氧化剂和还原剂,着色剂,脱色剂和乳浊剂。
1.助熔剂凡在玻璃配方中加入量不多,而能大大加快熔制速度的原料,称为助熔剂,如硝酸钠,硝酸钾,萤石等。
1.1硝酸钠,硝酸钾硝酸钠(NaNO3)又称智利硝,硝酸钾(KNO3)又称硝石,它们的融化温度为310-336℃,加热到400℃就分解,在较低的温度下与SiO2发生作用,从而加快了玻璃的熔制过程。
在高温下,硝酸钠,硝酸钾对耐火材料的侵蚀比较严重,所以用量不能太多,一般引入相当于玻璃中的Na2O(K2O)含量的10%-15%。
NaNO3,KNO3同时又是一种澄清剂,在熔制过程中受热分解放出氧气,并能降低玻璃液的粘度,促进了玻璃的澄清和均化。
这两种原料都是强氧化剂,受热能放出氧气,所以最好用密闭容器装,存放在干燥,阴凉之处,不要和易燃物放在一起。
2.澄清剂在玻璃熔制过程中受热分解放出气体,促进玻璃液的澄清和均化的原料,叫做澄清剂。
3.3.氧化剂和还原剂在玻璃熔制时,能释放出氧气的物质称为氧化剂。
反之,称为还原剂。
属于氧化剂的原料主要有硝酸盐(硝酸钾,硝酸钠,硝酸钡),氧化铈,五氧化二砷,五氧化二锑。
属于还原剂的有碳(煤粉,焦炭粉,木屑),酒石酸钾(KHC4H4O6),氧化锡(SnO2),二氯化锡(SnCl2.2H2O),金属锑粉,酒石酸(C4H6O6)等。
4.着色剂4.着色剂加入配合料中经过熔制后能使玻璃呈现一定颜色的物质,称为着色剂。
玻璃中的着色剂能对投射到玻璃上的白光进行选择性的吸收,从而改变了透过玻璃光线的光谱组成,使玻璃显示出各种颜色。
显色的强弱,与着色剂的种类及数量有关,也与工艺制度有关。
根据着色剂在玻璃中的状态,可把着色剂分为离子着色剂和胶体着色剂两类。
钴化合物是着色能力最强,性能最稳定的化合物,其着色不受熔制条件的影响,氧化钴的引入量为玻璃量的0.001%-0.01%。
当玻璃中含有万分之二的钴化合物时,就使玻璃呈深兰色。
常用的钴化合物有绿色的氧化亚钴,黑色的氧化钴和灰色的四氧化三钴,以及碳酸钴,硝酸钴等。
用氧化钴着色时,在配合料中同时引入适量的氧化硼,氧化钾,氧化铅时,玻璃呈色更纯正。
硒的化合物常用的原料有金属硒粉(比重为4.26的高温型红色粉末或比重为4.8的低温型黑色粉末)和白色的硒酸钠(Na2SeO3)粉。
硒使玻璃着成玫瑰色至黄红色。
熔制时,温度不能太脱色主要是指减弱铁化合物对玻璃着色的影响,以提高玻璃的透明度。
在玻璃中,Fe+2使玻璃着成蓝绿色,Fe+3使玻璃着成黄绿色。
从可见光谱范围内(400-700毫微米)单位吸收指数看,Fe+2为0.079,Fe+3为0.007,氧化亚铁的着色能力要比氧化铁高10倍左右。
实际上,在玻璃中同时存在上述两种氧化物,其着色强度与Fe+2 /Fe+3比值有关。
根据脱色机理,铁化合物的脱色可分为化学脱色和物理脱色两类。
化学脱色剂指在玻璃熔制时,能在低温或高温下放出氧气,使低价铁氧化成高价铁的物质。
常用的化学脱色剂有硝酸盐,软锰矿,氧化铈等。
最常用的是硝酸钠,但其分解温度低(380),大部分在玻璃形成前已逸出,影响了脱色效果。
较合理的方法是同时引入硝酸盐与As2O3或Sb2O3,这样低温时硝酸盐放出的氧可将它们氧化成As2O5或Sb2O5,高温时As2O5或Sb2O5将放出氧气使FeO氧化成Fe2O3.物理脱色剂化学脱色的作用是使有色离子的着色强度减弱,但不能使之消除。
物理脱色则是基于引入适当的着色剂,来中和原来的色调。
如铁离子使玻璃呈黄绿色,当引入能产生蓝,紫色的氧化亚钴,氧化亚镍,氧化锰和氧化钕时,由于蓝,紫色与黄绿色互为补色,因此能起到明显的脱色效果。
物理脱色的缺点是光吸收增大,光的总透过率下降。
因而,当玻璃中氧化铁含量较低时(通常在0.06% -0.07%以下),物理脱色的效果较好。
其实,化学和物理脱色都有一定的效果,但也都有不足之处,难以完全解决脱色问题。
所以生产中首先应注意控制原料的含铁量。
三碎玻璃碎玻璃是一种宝贵的资源,世界各国对它的回收利用都十分重视。
碎玻璃的回收,可以减少固体垃圾的数量,碎玻璃的利用,可节省资源,开发出许多新的产品,市场前景十分广阔。
1.碎玻璃的利用1.1 熔制玻璃制品将碎玻璃掺入配合料中,是碎玻璃利用的传统方法,可以节省原料,燃料,减少废气排放量,减小对熔窑的侵蚀,延长熔窑使用寿命。
.碎玻璃对玻璃熔制的影响当碎玻璃用于生产玻璃制品时,在配合料中的加入量以18%-26%为宜,碎玻璃的引入对玻璃的熔制及产品质量会产生一定影响。
2.1二次挥发在碎玻璃重熔后,易挥发组分将进行第二次挥发,因而该组分的含量将减少,例如重熔后的Na2O比重熔前平均低0.15%。
对那些更易挥发的组分,其差别就更大。
因此必须补充某些原料以调整玻璃组成。
2.2二次积累由于玻璃液对耐火材料的侵蚀,使玻璃中的Fe2O3和Al2O3含量增加,所以二次熔化就产生二次积累。
2.3对某些化学稳定性较差的玻璃,由于表面水解造成表面层成分与内层成分之间的差别,若熔制温度较低或玻璃液的对流不大时,在熔制后的玻璃液内往往会留下明显的线痕。
2.5碎玻璃中含有少量化学结合气体,重熔时产生相当于二次气泡那样的微小气泡。
因此,加入原单位玻璃多时,就难于澄清。
2.6 碎玻璃的粒度及在配合料中的比例对玻璃熔化时间有明显影响。
试验表明,碎玻璃的粒度小于0.25毫米或界于2-20毫之间时,熔化时间均较短;随碎玻璃加入量的增多,配合料的熔化时间缩短,但加入量过多时,将延长澄清时间。
在实际生产中,碎玻璃的块度要均匀,等块度的碎玻璃应占90%,因为大小不一的玻璃块,会导致条纹缺陷的产生。
另外,颗粒度过小,会增加粉碎耗用的动力。
