葡甘聚糖对魔芋软腐病病菌生长曲线的影响
菌落总数对魔芋粉凝胶粘度衰减的影响及魔芋粉灭菌浅析

菌落总数对魔芋粉凝胶粘度衰减的影响及魔芋粉灭菌浅析作者:肖瑜田阳来源:《中国食品》2024年第02期魔芋是多年生草本植物,含有大量葡甘聚糖,被广泛应用于食品、药品、农业、化工等领域。
對魔芋进行清洗、干燥、打粉、除淀粉后能够得到魔芋精粉,再采用食用乙醇对其进行洗涤提纯,即可得到纯化魔芋粉。
纯化魔芋粉的主要成分为葡甘聚糖,为非离子型水溶性高分子多糖,具有水溶性、增稠性、凝胶性、持水性等特点。
魔芋粉凝胶后并不稳定,全部溶解粘度达峰1-2h后便开始衰减,对生产应用有较大的影响。
魔芋低聚甘露糖能被微生物降解、利用,食品加工中最常用纯化魔芋粉和纯化魔芋微粉,如果找到粘度衰减的原因,就可以减缓粘度的衰减速度,进而提高魔芋粉在食品中的应用性。
本研究将两种规格的样品通过灭菌和增加菌落总数的手段得到普通菌落总数、低菌落总数和高菌落总数共6个样品,试图通过实验找出粘度降解与微生物的关系,从而找出适宜生产的微生物控制手段。
一、菌落总数与魔芋粉凝胶粘度的关系分析1.实验仪器。
NDJ-1旋转式粘度计,上海天美科学仪器有限公司;DGG-9146AD电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;WNB29恒温水浴锅,美墨尔特(上海)贸易有限公司;SPX-150生化培养箱,扬州慧科电子有限公司;LDZH-100KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;PTX-FA110电子天平,福州华志科学仪器有限公司。
2.实验材料。
纯化魔芋粉和纯化魔芋精粉(安康市),其余试剂均为分析纯。
样品参数如表1所示。
3.高菌落总数和低菌落总数样品制备。
取两种样品各500g分别置于1000mL烧杯中,再分别加入75%乙醇500mL浸泡0.5h,65℃干燥1h,室温20℃静置12h,得到低菌落总数样品。
取两种样品各500g分别置于1000mL烧杯中,再分别加入40%乙醇溶液300mL浸泡0.5h,65℃干燥1h,室温20℃静置12h,得到高菌落总数样品。
花魔芋软腐病原真菌分离鉴定

㊀Guihaia㊀Feb.2024ꎬ44(2):333-344http://www.guihaia-journal.comDOI:10.11931/guihaia.gxzw202207042李竹梅ꎬ董坤ꎬ张延安ꎬ等ꎬ2024.花魔芋软腐病原真菌分离鉴定[J].广西植物ꎬ44(2):333-344.LIZMꎬDONGKꎬZHANGYAꎬetal.ꎬ2024.IsolationandidentificationofpathogenicfungifromsoftrottissueofAmorphophalluskonjaccorm[J].Guihaiaꎬ44(2):333-344.花魔芋软腐病原真菌分离鉴定李竹梅1ꎬ董㊀坤2ꎬ张延安1ꎬ高㊀永1ꎬ陈㊀弘1ꎬ方萍萍1ꎬ雷红仙1ꎬ卢小倩1ꎬ褚洪龙1ꎬ3∗(1.曲靖师范学院生物资源与食品工程学院ꎬ云南曲靖655011ꎻ2.云南省农科院富源魔芋研究所ꎬ云南富源655500ꎻ3.曲靖师范学院云南省高校特色果酒技术创新与应用工程研究中心ꎬ云南曲靖655011)摘㊀要:魔芋软腐病是魔芋生产过程中的重要病害ꎬ也是限制魔芋产业发展的主要因素ꎮ目前ꎬ已有报道魔芋软腐病主要由细菌引起ꎬ鲜有真菌引起魔芋球茎软腐发病的报道ꎮ为明确云南曲靖市花魔芋(Amorphophalluskonjac)软腐病的病原种类和侵染特征ꎬ该研究通过组织分离法ꎬ对采集自云南曲靖市的花魔芋病样进行了真菌的分离ꎬ通过形态学结合基于ITS与LSU序列分析的分子鉴定方法对分离真菌进行鉴定ꎬ并根据柯赫氏法则进行致病性测定ꎬ并对鉴定出的病原真菌同魔芋软腐病原细菌进行了双回接试验分析ꎮ结果表明:(1)从形态学和分子水平鉴定了轮纹镰刀菌(Fusariumconcentricum)㊁尖孢镰刀菌(F.oxysporum)和F.ambrosium3种镰刀菌ꎬ1种毛霉属真菌(Mucorsp.)ꎬ1种根霉属真菌(Rhizopussp.)ꎬ1种青霉属真菌(Penicilliumsp.)和1种粉红螺旋聚孢霉属真菌(Clonostachyssp.)ꎮ(2)统计分析发现ꎬ轮纹镰刀菌的相对丰度最高ꎬ为45.45%ꎮ(3)柯赫氏法则检测发现轮纹镰刀菌具有致病性ꎮ(4)轮纹镰刀菌和病原细菌胡萝卜果胶杆菌(Pectobacteriumaroidearum)双接种魔芋球茎发现软腐病发病更快ꎬ病变组织重量显著高于单接种轮纹镰刀菌或果胶杆菌处理ꎮ综上表明ꎬ魔芋软腐病可能是由真菌和细菌复合侵染引发ꎮ该研究结果为魔芋软腐病的防治提供了理论依据ꎮ关键词:花魔芋ꎬ软腐病ꎬ病原真菌ꎬ系统发育分析ꎬ致病性中图分类号:Q949.32㊀㊀文献标识码:A㊀㊀文章编号:1000 ̄3142(2024)02 ̄0333 ̄12IsolationandidentificationofpathogenicfungifromsoftrottissueofAmorphophalluskonjaccormLIZhumei1ꎬDONGKun2ꎬZHANGYan an1ꎬGAOYong1ꎬCHENHong1ꎬFANGPingping1ꎬLEIHongxian1ꎬLUXiaoqian1ꎬCHUHonglong1ꎬ3∗(1.CollegeofBiologicalResourceandFoodEngineeringꎬQujingNormalUniversityꎬQujing655011ꎬYunnanꎬChinaꎻ2.FuyuanKonjakResearchInstituteꎬYunnanAcademyofAgriculturalSciencesꎬFuyuan655500ꎬYunnanꎬChinaꎻ3.YunnanEngineeringResearchCenterofFruitWineꎬQujingNormalUniversityꎬQujing655011ꎬYunnanꎬChina)收稿日期:2023-02-19基金项目:国家自然科学基金(31860057)ꎻ云南省基础应用研究项目(2019FD103ꎬ2019FD105)ꎻ云南省地方高校联合项目(2017FH001 ̄037)ꎮ第一作者:李竹梅(1988-)ꎬ博士ꎬ讲师ꎬ研究方向为病原微生物学ꎬ(E ̄mail)lizhume@163.comꎮ∗通信作者:褚洪龙ꎬ博士ꎬ副教授ꎬ研究方向为植物与微生物互作㊁植物抗逆ꎬ(E ̄mail)chuhonglo@163.comꎮAbstract:Konjac(Amorphophalluskonjac)isahorticulturalplantwithhighnutritionalandmedicinalvalues.Softrotisaseverediseaseinproductionofkonjacanditisalsothemainfactorrestrictingthedevelopmentofthekonjacindustry.Ithasbeenreportedthatthesoftrotofkonjacismainlycausedbypathogenicbacteria(mainlyincludingPectobacteriumaroidearumꎬP.carotovorumsubsp.carotovorumꎬP.chrysanthemiandEnterobactersp.)ꎬandthereisrarereportsonpathogenicfungithatcausekonjacsoftrot.InordertoclarifythepathogenictypesandinfectioncharacteristicsofthesoftrotinQujingCityꎬYunnanProvinceꎬthediseasedcormswerecollectedforfungalisolationbytissueisolationmethods.TheisolatedfungiwereidentifiedbymorphologicalandmolecularidentificationmethodsbasedonITSandLSUsequenceanalysesꎬandpathogenicitywasdeterminedaccordingtoKoch srule.Theinfectioncharacteristicwasanalyzedbymixedinoculationusingtheidentifiedpathogenicfungiandthepathogenicbacteriaofkonjacsoftrot.Theresultswereasfollows:(1)ThreespeciesofFusariumspp.(FusariumconcentricumꎬF.oxysporumandF.ambrosium)ꎬonespeciesofMucorsp.ꎬonespeciesofRhizopussp.ꎬonespeciesofPenicilliumsp.andonespeciesofClonostachyssp.wereidentified.(2)StatisticsanalysisfoundthatFusariumconcentricumhadthehighestrelativeabundance(45.45%).(3)KochpostulatestestsshowedthatinoculationwithF.concentricumcausedobvioussoftrotsymptomsofkonjaccormswithinthreedays.(4)InadditionꎬmixedPectobacteriumaroidearumandFusariumconcentricumtogetherinoculationpromotedthediseasedevelopmentꎬandtheweightofrottentissuewassignificantlyhigherthanthatofsingleinoculationusingF.concentricumorPectobacteriumaroidearum.Overallꎬtheseresultsindicatethatkonjacsoftrotmaybecausedbyacombinationoffungusandbacteriuminfection.Theresultsprovideatheoreticalreferenceforthepreventionandmanagementofkonjacsoftrot.Keywords:Amorphophalluskonjacꎬsoftrotꎬpathogenicfungusꎬphylogeneticanalysisꎬpathogenicity㊀㊀魔芋属(Amorphophallus)植物是天南星科(Araceae)多年生草本植物ꎬ主要生长在高海拔山区(邱凌和仇农学ꎬ1995)ꎮ全世界大约有170种ꎬ主要分布在越南㊁缅甸㊁中国㊁日本等国家ꎬ其中我国约有17种ꎬ主要集中分布在广东㊁四川㊁云南等地ꎮ魔芋球茎的蛋白质含量高于马铃薯和甘薯ꎬ并且富含膳食纤维ꎮ魔芋制品热量低ꎬ营养价值和药用价值高ꎬ食用魔芋具有减肥㊁降血压和血糖㊁改善肠道菌群结构和防癌等功效(Zhangetal.ꎬ2005ꎻChuaetal.ꎬ2010ꎻSrzednicki&Borompichaichartkulꎬ2020)ꎮ魔芋葡甘聚糖(konjacglucomannanꎬKGM)作为魔芋粉的主要成分(Lietal.ꎬ2010)ꎬ是一种水溶性多糖ꎬ在食品科学㊁营养保健㊁生物技术㊁药理学和精细化工等领域具有多种用途(Zhangetal.ꎬ2005ꎻChuaetal.ꎬ2010ꎻBehera&Rayꎬ2016ꎻZhuꎬ2018ꎻSrzednickietal.ꎬ2020)ꎮ花魔芋(Amorphophalluskonjac)作为葡甘聚糖含量最高的魔芋种类之一ꎬ是我国主要的栽培种(Gaoetal.ꎬ2022)ꎮ作为重要经济作物ꎬ魔芋已成为云㊁贵㊁川等地区农业经济发展中最具潜力与竞争优势的特色资源产业之一ꎬ也是乡村振兴重点推广种植的作物ꎮ软腐病是魔芋病害中影响最为严重的病害ꎮ由于缺乏持续有效的防控措施ꎬ被认为是对魔芋产业威胁最大的毁灭性病害ꎬ在魔芋生长期和贮藏期均可能发生ꎮ生长期魔芋软腐病的发病特征是植株的茎秆㊁球茎部位会由硬变软ꎬ叶片萎蔫ꎬ随后球茎发黑腐烂ꎬ有臭味散发出ꎬ并会出现倒苗的现象(Weietal.ꎬ2020ꎻ王敏珍等ꎬ2021)ꎮ在贮藏期及播种期ꎬ如果种芋染上软腐病ꎬ球茎在发病的初期ꎬ其表皮会出现水渍状的褐色斑纹ꎬ并不断地向内扩展ꎬ球茎的白色组织逐渐变成灰色乃至黄褐色ꎬ渗出大量浓稠的菌液ꎬ致使球茎腐烂(王敏珍等ꎬ2021)ꎮ软腐病在魔芋种植区广泛传播严重阻碍了我国魔芋产业的发展ꎮ目前ꎬ有报道魔芋软腐病主要由胡萝卜果胶杆菌(Pectobacteriumaroidearum)㊁胡萝卜果胶杆菌胡萝卜软腐亚种[P.carotovorumsubsp.carotovorum(Pcc)]㊁菊果胶杆菌(P.chrysanthemi)和肠杆菌属(Enterobactersp.)等引起的细菌性软腐病(Wuetal.ꎬ2011ꎻ徐炜ꎬ2011ꎻ黄露等ꎬ2014ꎻWuetal.ꎬ2015ꎻSunꎬ2019ꎻWeietal.ꎬ2020ꎻZhangetal.ꎬ2022)ꎬ而关于魔芋软腐病病原真菌的报道比较少ꎮ何斐等(2016)研究发现ꎬ导致魔芋病株的根区㊁根表土壤和根系腐烂的病原真菌是腐皮镰刀菌(Fusariumsolani)和尖孢镰刀菌(F.oxysporum)ꎻ李迎宾等(2017)通过用离体菌丝块接433广㊀西㊀植㊀物44卷种的方法研究表明尖孢镰刀菌对不同品种魔芋球茎致病力存在着差异ꎻ赵兴丽等(2022)分离鉴定了魔芋茎腐病的病原菌ꎬ也从病样分离鉴定出尖孢镰刀菌和腐皮镰刀菌2个种ꎬ但致病性检测发现尖孢镰刀菌菌株(xymy ̄8)无致病性ꎬ腐皮镰刀菌(xymy ̄7㊁xymy ̄9)有致病性且致病性有差异ꎮ主流观点认为魔芋软腐病病原菌为细菌(徐炜ꎬ2011ꎻWuetal.ꎬ2015ꎻWeietal.ꎬ2020ꎻZhangetal.ꎬ2022)ꎬ但研究发现云南曲靖市地区储存期魔芋球茎发病会在病组织处长出大量真菌菌丝ꎬ田间发病植株取样放置后也会在极短的时间内长出大量菌丝ꎬ甚至在田间也能发现软腐病组织处有真菌菌丝长出ꎮ魔芋软腐病原细菌侵染特征相关研究表明ꎬ病原菌不能直接通过自然孔口侵染魔芋块茎ꎬ只能通过芽鞘㊁伤口侵染致病(黄露等ꎬ2014ꎻWuetal.ꎬ2021)ꎮ田间魔芋软腐病能够短期快速传播ꎬ一方面可能由于田间病原菌累积ꎬ雨水冲刷蔓延(张红骥等ꎬ2012)ꎻ另一方面可能是由于病原真菌的侵染为病原细菌侵染提供了通道ꎮ本研究以云南省曲靖市魔芋产业种植区为研究区域ꎬ针对花魔芋软腐病球茎ꎬ采用真菌组织分离方法ꎬ通过形态学鉴定和分子生物学手段以及科赫氏法则检测ꎬ并利用所分离病原真菌与魔芋软腐病原细菌进行双回接试验ꎬ拟探讨以下问题:(1)魔芋软腐病病原物种类是真菌㊁细菌亦或复合病害ꎻ(2)魔芋软腐病病原真菌的种类㊁分类地位和病害特征如何ꎮ以期为云南地区魔芋软腐病的精准防治提供理论依据ꎮ1㊀材料与方法1.1试验材料发病花魔芋球茎采自云南省曲靖市富源县㊁沾益区和陆良县魔芋种植基地ꎬ详见表1ꎮ魔芋发病症状如图1所示ꎬ植株叶片发黄ꎬ有萎蔫症状ꎬ并会出现倒苗现象ꎬ植株的茎秆和/或球茎部位有软腐症状ꎬ挖出的球茎发黑腐烂ꎬ散发出臭味(图1:AꎬBꎬD)ꎮ所采病样在病组织处有大量白色和/或黄色真菌菌丝ꎬ有些病样采集时未发现真菌菌丝ꎬ但在温放置后会在极短的时间内长出大量真菌菌丝(图1:BꎬC)ꎮ表1㊀样地概况Table1㊀Generalsituationofsamplesites样地Samplesite采样时间Samplingtime海拔Altitude(m)纬度Latitude经度Longitude富源县FuyuanCounty2019-08-15196425ʎ43ᶄ0ᵡN104ʎ12ᶄ13ᵡE沾益区ZhanyiDistrict2019-08-16200425ʎ54ᶄ36ᵡN103ʎ48ᶄ28ᵡE陆良县LuliangCounty2019-08-16187525ʎ07ᶄ12ᵡN103ʎ47ᶄ54ᵡE1.2试验方法1.2.1菌株的分离纯化㊀(1)真菌分离:取具有软腐病状的花魔芋球茎ꎬ流水冲洗掉表面泥土ꎬ取发病与健康交界处组织切成0.3cm左右小块ꎻ75%的乙醇浸泡30s对样品组织表面消毒ꎬ无菌水冲洗3次ꎻ将3~5块消毒后的组织块转移到PDA(培养基中含3ɢ乳酸)平板ꎬ均匀排布ꎬ编号ꎬ用封口膜封口ꎻ25ħ培养箱中暗培养2~5dꎮ(2)真菌纯化:培养2~5d后ꎬ组织块周围长出不同颜色和形状真菌菌落ꎻ用接种针沿菌落边缘挑取部分菌丝ꎬ接种至新PDA平板上ꎬ编号ꎬ培养箱中25ħ暗培养ꎬ观察并记录其生长情况ꎮ重复真菌纯化培养操作2遍ꎮ1.2.2形态学鉴定㊀将分离纯化的菌株培养一周后ꎬ制作产孢菌株的临时玻片ꎬ用复合式显微镜(OlympusBX53)观察菌株的菌丝㊁产孢结构及孢子结构特征并拍照ꎬ使用ImageFrameWork软件测量其孢子大小(每个菌株选择20个孢子)ꎮ具体参考«真菌鉴定手册»(魏景超ꎬ1979)进行形态鉴定ꎮ1.2.3分子生物学鉴定㊀从纯化后的真菌培养皿中刮取菌丝ꎬ置于1.5mL离心管中ꎬ用液氮研磨ꎬCTAB法提取真菌基因组DNAꎬ用(LR0R:5ᶄ ̄GTACCCGCTGAACTTAAGC ̄3ᶄ和LR5:5ᶄ ̄ATCCTGAGGGAAACTTC ̄3ᶄ)(Vilgalys&Hesterꎬ1990)与(ITS4:5ᶄ ̄TCCTCCGCTTATTGATATGC ̄3ᶄ和ITS5:5ᶄ ̄GGAAGT5332期李竹梅等:花魔芋软腐病原真菌分离鉴定AAAAGTCGTAACAAGG ̄3ᶄ)(Whiteetal.ꎬ1990)两对引物分别扩增所分离菌株的LSU和ITS保守区段ꎬ扩增后的样品送测序ꎮ测序结果用BioEdit编辑后ꎬ在NCBI数据库中进行Blastnꎬ下载高同源性序列和相关数据ꎬ以Russulavesca菌株作为系统发育树的外群ꎬMEGA ̄X(ClustalWꎬNeighbor ̄Joiningꎬbootstrap=1000)构建系统发育树ꎮ1.2.4致病性鉴定㊀(1)柯赫氏法则检测ꎮ将鉴定出的7种真菌培养平板ꎬ用打孔器打直径为0.5cm的菌饼ꎬ菌丝面接在健康魔芋块茎片上ꎬ以无菌琼脂饼为空白对照置于28ħ温箱保湿培养ꎬ观察是否出现软腐病特征ꎮ患病组织块再次分离真菌ꎬ鉴定ꎮ(2)病原细菌和真菌接种试验ꎮ处理1(F+P):将轮纹镰刀菌的菌饼(直径0.5cm)和OD600为0.1的胡萝卜果胶杆菌菌液20μL接种到健康魔芋块茎上ꎮ处理2(F):只接种轮纹镰刀菌菌饼和20μL无菌水到健康魔芋块茎上ꎮ处理3(P):只接种OD600为0.1的胡萝卜果胶杆菌菌液20μL和无菌琼脂饼到健康魔芋块茎上ꎮ处理4(CK):接种无菌水和无菌琼脂饼ꎮ将4种处理置于28ħ保湿培养3dꎬ用硅胶勺将软腐组织挖出称重ꎬ获得的数据用SPSS(IBMSPSSStatistics19)进行单因素方差分析(one ̄wayANOVA)ꎬ用Tukey方法检验ꎬ用Excel制图ꎮ2㊀结果与分析2.1球茎软腐真菌分离纯化从发病花魔芋球茎组织中分离㊁纯化出22株真菌ꎬ编号为M1 ̄M25(M2㊁M13和M16纯化失败)ꎬ在PDA培养基25ħ培养5d后观察菌落形态㊁微观结构特征ꎮ其中ꎬ菌株M1㊁M3㊁M4㊁M5㊁M6㊁M8㊁M9㊁M11㊁M14和M25生长迅速ꎬ菌落正反面都呈砖红偏紫色或淡紫色ꎬ边缘齐整ꎬ绒毛状ꎬ菌落表面有白色棉絮状ꎬ环纹不明显ꎻ分生孢子长约7.51μmꎬ宽约3.51μmꎬ以小型分生孢子为主ꎬ呈肾形ꎬ分生大孢子稍弯㊁或有隔ꎻ菌丝有隔ꎬ可产生红色色素ꎬ菌丝中部产孢ꎮ菌株M7在PDA生长迅速ꎬ菌落中部正㊁反面都呈红偏淡紫色ꎬ边缘白色不整齐ꎻ分生孢子长约7.60μmꎬ宽约4.03μmꎬ小型分生孢子卵圆形ꎬ大型分生孢子镰刀形ꎬ有隔ꎬ会产生红色色素ꎬ菌丝有隔ꎬ从菌丝中间产孢ꎮ菌株M10和M15生长迅速ꎬ菌落正反面都呈白色ꎬ边缘整齐ꎬ绒毛状ꎬ菌落环纹不明显ꎻ分生孢子长约10.77μmꎬ宽约5.92μmꎬ小型分生孢子为主ꎬ呈卵圆形ꎬ大型分生孢子稍弯ꎬ有一个分隔或无分隔ꎬ菌丝透明ꎬ有隔ꎬ从菌丝中部产孢ꎮ菌株M12㊁M19和M22的菌落正面呈白色并带有淡黄色ꎬ菌落中心高于边缘ꎬ有或无环纹ꎻ分生孢子长约4.68μmꎬ宽约3.16μmꎬ椭圆形ꎬ表面光滑ꎬ无隔透明ꎻ菌丝白色絮状ꎬ菌丝透明有隔ꎬ顶端呈帚状分枝ꎮ菌株M17和M21生长迅速ꎬ分生孢子长约5.54μmꎬ宽约4.01μmꎬ小型分生孢子为椭圆形ꎬ大型分生孢子为球形ꎻ菌丝分枝少ꎬ透明状ꎬ菌丝的顶端有球形孢子囊产孢ꎮ菌株M18㊁M20和M23生长迅速ꎬ菌落正面靠里颜色呈深灰色ꎬ边缘呈白色ꎬ反面呈白色ꎬ质地疏松ꎬ边缘不整齐ꎬ无菌落环纹ꎬ菌落表面有黑色ꎻ分生孢子为圆形或椭圆形ꎬ分生孢子长约4.35μmꎬ宽约3.61μmꎬ孢子壁厚ꎻ有营养菌丝ꎬ大部分无隔ꎬ会产生黄色色素ꎬ顶端膨大形成孢子囊进行产孢ꎮ菌株M24生长迅速ꎬ菌落正面呈灰白色发青ꎬ反面呈灰白色ꎬ边缘不整齐ꎬ绒毛状ꎬ菌落环纹明显ꎻ分生孢子长约3.15μmꎬ宽约2.67μmꎬ分生孢子为球形或卵圆形ꎬ孢子壁厚ꎻ菌丝有隔ꎬ中部产孢或顶端的产孢结构产孢(图2ꎬ图3)ꎮ2.2球茎软腐真菌分子生物学鉴定由表2和图4可知ꎬ除M5菌株的ITS序列与轮纹镰刀菌模式菌株的相似度为96.89%以外ꎬM1㊁M3㊁M4㊁M6㊁M8㊁M9㊁M11㊁M14和M25的ITS和LSU序列与轮纹镰刀菌模式菌株的相似度均大于97.77%(表1)ꎮ系统发育分析结果表明ꎬM1㊁M3㊁M4㊁M6㊁M8㊁M9㊁M11㊁M14和M25与轮纹镰刀菌的进化地位接近ꎬ并且系统发育分析显示在同一进化分支的支持度为72%ꎬ可认为它们是同一物种ꎮM10和M15与Fusariumambrosium的进化地位接近ꎬ支持度为80%且与模式株F.ambrosium的ITS和LSU两段序列相似性在97.82%以上ꎬ可认为它们是同一物种ꎮM7与尖孢镰刀菌的进化地位接近ꎬ支持度为99%且序列相似度为98.95%ꎬ可它们认为是同一物种ꎮM12㊁M19和M22的ITS和LSU序列与粉红螺旋聚孢霉(Clonostachysroseaf.catenulata)模式菌株的相似度大于99%且支持度为84%ꎬ可认为它们是同一物种ꎮM17的ITS和LSU序列与拜尼尔毛霉(Mucorbainieri)模式菌株的相似度分别是97.22%633广㊀西㊀植㊀物44卷A.整株软腐病症状ꎻB.茎秆软腐症状ꎻC.球茎软腐早期症状ꎻD.球茎㊁茎秆基部软腐晚期症状ꎮA.SoftrotcharacterofwholeplantꎻB.SoftrotcharacterofstemꎻC.SoftrotcharacterofcormintheearlyperiodꎻD.Softrotcharacterofstemandcorminlaterperiod.图1㊀花魔芋软腐病症状图Fig.1㊀SoftrotcharacterofAmorphophalluskonjac和99.23%且支持度为100%ꎬ可认为它们是同一物种ꎻM21的ITS和LSU基因序列与拜尼尔毛霉菌株的相似度分别是91.39%和99.20%且支持度为100%ꎬ因此M21应该是毛霉属真菌ꎮM18和M23的ITS和LSU基因序列与单孢根霉(Rhizopusazygosporus)的模式菌株相似度大于98%且支持度为97%ꎬ可认为M18和M23与单孢根霉是同一菌种ꎻM20的ITS和LSU基因序列与单孢根霉菌株的相似度分别是98.89%和85.85%且支持率为100%ꎬ可认为M20是根霉属真菌ꎮM24在NCBI数据库中的ITS和LSU基因序列与氯氮卓青霉(Penicilliumsolitum)菌株的相似度是91.80%且支持率为96%ꎬ可认为M24是青霉属真菌(Penicilliumsp.)ꎮ综上所述ꎬ结合形态鉴定结果共鉴定出轮纹镰刀菌㊁尖孢镰刀菌和Fusariumambrosium3种ꎬ占总分离真菌种类的43.86%ꎻ毛霉属真菌拜尼尔毛霉㊁单孢根霉㊁青霉属真菌(Penicilliumsp.)和粉红螺旋聚孢霉各1种ꎬ各占总分离真菌种类的14.29%ꎮ根据鉴定结果ꎬ对不同种类菌株进行了分离频率的统计ꎮ从魔芋软腐病株中分离得到的轮纹镰刀菌出现的频率最高ꎬ其相对丰度为45.45%ꎻ菌株粉红螺旋聚孢霉和单孢根霉出现的频率较高ꎬ其相对丰度为13.64%ꎻ菌株Fusariumambrosium和拜尼尔毛霉出现的频率较低ꎬ其相对丰度为9.09%ꎻ菌株尖孢镰刀菌和氯氮卓青霉出现的频率最低ꎬ其相对丰度为4.55%ꎬ由此可以推断ꎬ轮纹镰刀菌是魔芋软腐病致病菌的概率最大(表3)ꎮ2.3柯赫氏法则检测将鉴定出的7个菌株直径0.5cm的菌饼接种在健康的魔芋球茎切片上ꎬ28ħ保湿培养3d后ꎬ接种轮纹镰刀菌菌饼的球茎切片可以闻到明显的臭味ꎬ并且接菌处附近均出现了明显的发黑软腐症状且面积不断扩大ꎬ此现象与魔芋软腐病的发病症状相同ꎬ而空白对照处无发病的症状ꎮ从接种发病的魔芋球茎上又可以重新分离到接种菌株ꎬ因此可以确定该菌株可能是魔芋软腐病的致病真菌(图5)ꎮ同时接种轮纹镰刀菌和胡萝卜果胶杆菌(F+P)处理软腐组织重量显著高于单接种处理(F和P)处理ꎬ说明在野外环境中魔芋软腐病可能是由真菌和细菌复合侵染引起的ꎻ病原细菌胡萝卜果胶杆菌在相同条件下致病性高于轮纹镰刀菌(图6)ꎮ3㊀讨论与结论植物病害病原种类的确定ꎬ对于防治植物病害起着关键性作用ꎮ本研究对花魔芋病样球茎进行分离㊁纯化ꎬ获得22株真菌ꎬ根据形态特征结合分子生物学手段ꎬ共鉴定出7种真菌ꎬ其中镰刀菌有轮纹镰刀菌㊁尖孢镰刀菌和F.ambrosium3种ꎬ毛霉属真菌㊁根霉属真菌单孢根霉㊁青霉属真菌(Penicilliumsp.)和粉红螺旋聚孢霉各1种ꎮ根据柯赫氏法则检测本研究发现轮纹镰刀菌具有致病性ꎬ推断轮纹镰刀菌可能是云南曲靖市地区魔芋软腐病原真菌ꎮ据报道轮纹镰刀菌也是辣椒(Capsicumannuum)果实软腐病(Wangetal.ꎬ2013)㊁玉米(Zeamays)穗腐病(Duetal.ꎬ2020)㊁罗汉松(Podocarpusmacrophyllus)萎蔫病(Qinetal.ꎬ2021)和玫瑰茄(Hibiscussabdariffa)果斑病(Rahimetal.ꎬ2020)的病原真菌ꎮ云南地区魔芋大田规模化栽培往往与玉米套种ꎬ这可能会增加魔芋真菌性软腐病和玉米穗腐病的风险ꎮ何斐等7332期李竹梅等:花魔芋软腐病原真菌分离鉴定M1㊁M3~M12㊁M14㊁M15㊁M17~M25为分离菌株编号ꎮ下同ꎮM1ꎬM3-M12ꎬM14ꎬM15andM17-M25arethenumbersofisolatedstrains.Thesamebelow.图2㊀分离菌株PDA培养菌落图Fig.2㊀IsolatedstrainsculturedonPDAmedium(2016)在魔芋根际分离出尖孢镰刀菌和腐皮镰刀菌两种镰刀菌ꎬ通过回接毒素粗提液ꎬ发现可以引发魔芋球茎腐烂ꎮ李迎宾等(2017)也报道了从具有魔芋软腐症状的球茎分离出了尖孢镰刀菌和腐皮镰刀菌两种镰刀菌ꎬ致病性检测发现尖孢镰刀菌和腐皮镰刀菌都能引起花魔芋发病ꎬ但尖孢镰刀菌不能引起珠芽黄魔芋发病ꎮ赵兴丽等(2022)也从魔芋茎腐病病样分离鉴定出尖孢镰刀菌和腐皮镰刀菌两种镰刀菌ꎬ但致病性检测发现尖孢镰刀菌(菌株xymy ̄8)无致病性ꎬ腐皮镰刀菌(菌株xymy ̄7㊁xymy ̄9)有致病性ꎬ但致病性有差异ꎮ本研究也分离出了尖孢镰刀菌ꎬ但致病性检测发现其致病性弱于轮纹镰刀菌ꎮ不同研究中ꎬ这些镰刀菌对魔芋的致病性存在差异ꎬ可能与菌株间毒力833广㊀西㊀植㊀物44卷图3 分离菌株显微观察Fig.3㊀Microscopicobservationofisolatedstrains差异和魔芋种植地域差异有关ꎮ此外ꎬ本研究利用病原细菌胡萝卜果胶杆菌和致病真菌轮纹镰刀菌进行了双接种魔芋球茎试验ꎬ发现胡萝卜果胶杆菌和轮纹镰刀菌双接种处理的软腐组织重量显著高于单接种处理ꎬ说明魔芋软腐病细菌病原菌和真菌同时侵染会加快魔芋组织软腐化速率ꎮ因此ꎬ我们推测魔芋软腐病可能是一种真菌㊁细菌复合侵染病害ꎮ病原细菌不像病原真菌能够形成附着胞等结构主动侵入宿主ꎬ病原细菌侵染通常需要侵染孔口ꎬ并在侵染处达到一定的数量才能导致宿主发病(杨珍等ꎬ2019)ꎮWu等(2021)研究魔芋软腐病侵染路径发现ꎬ软腐病病原细菌不能直接侵染完好球茎或从天然孔口侵入魔芋ꎬ而是通过伤口或根㊁鳞芽等组织的生长部位侵入魔芋ꎮ黄露等(2014)利用荧光蛋白标记病原细菌探究了不同接种(针刺㊁涂抹和灌根)方法对魔芋组培苗的侵染特性ꎬ也发现病原菌不能从自然孔口和根部侵染魔芋植株ꎬ主要是通过伤口侵染致病ꎮ田间魔芋软腐病能够短期大量传播爆发ꎬ一方面可能因田间病原菌累积而导致雨水冲刷蔓延(张红骥等ꎬ2012)ꎻ另一方面可能因为真菌侵染伤口在自然状态下为病原细菌的侵染提供了侵染通道ꎬ从而导致软腐病的快速发病ꎮ本研究还在魔芋软腐病状组织病健交界处9332期李竹梅等:花魔芋软腐病原真菌分离鉴定表2㊀花魔芋软腐病块组织分离真菌ITS和LSU序列NCBI数据库比对结果Table2㊀ComparisonresultsofisolationfungalITSandLSUsequencessoftrottissueofAmorphophalluskonjacinfromNCBIdatabase菌株编号StrainNo.序列名称Sequencename相似菌株GenBank登录号GenBankaccessionNo.ofsimilarstrain相似真菌Similarstrain相似度Identity(%)M1M3M4M6M9M11M14M5M8M25ITSNR111886.1LSUNG069847.1ITSNR111886.1LSUNG069847.1ITSNR111886.1LSUNG069847.1ITSNR111886.1LSUNG069847.1ITSNR111886.1LSUNG069847.1轮纹镰刀菌Fusariumconcentricum98.2798.8598.2498.8596.8998.6297.8898.7798.2498.77M7ITSLT841236.1尖孢镰刀菌F.oxysporum98.95LSULT841236.198.95M10M15ITSNR173405.1LSUNG076685.1ITSNR173405.1LSUNG076685.1F.ambrosium98.0198.9297.8298.92M12M19M22ITSNR165993.1LSUNG063969.1ITSNR165993.1LSUNG063969.1粉红螺旋聚孢霉Clonostachysroseaf.catenulata99.2599.6599.2599.77M17M21ITSNR103628.1LSUNG067371.1ITSNR103628.1LSUNG067371.1拜尼尔毛霉Mucorbainieri97.2299.2391.3999.20M18M20M23ITSNR103653.1LSUNG066155.1ITSNR103653.1LSUNG066155.1ITSNR103653.1LSUNG066155.1单孢根霉Rhizopusazygosporus98.8999.0098.8985.8598.7398.22M24ITS&LSUJX290030.1氯氮卓青霉Penicilliumsolitum91.80㊀注:M1㊁M3~M12㊁M14㊁M15㊁M17~M25为分离菌株编号ꎮ下同ꎮ㊀Note:M1ꎬM3-M12ꎬM14ꎬM15ꎬM17-M25arethenumbersofisolatedstrains.Thesamebelow.分离出了毛霉㊁根霉和青霉等腐生真菌ꎬ这些真菌不能引起健康魔芋球茎发病ꎬ它们在软腐病发病过程中具体有何作用ꎬ还有待进一步研究ꎮ但是ꎬ这些腐生真菌可以加速软腐组织的降解(Kavkler&Demšarꎬ2019)ꎬ在其快速繁殖的过程也会分泌各种多糖降解酶类物质(Langeetal.ꎬ2019)ꎬ从而影响魔芋球茎健康部位ꎬ加快软腐病的发病速度ꎮ此外ꎬ我们还从魔芋软腐病状组织病健交界处分离出了粉红螺旋聚孢霉属真菌ꎬ它是一种生防菌ꎬ能够捕食真菌和线虫(Seenivasagan&Babalolaꎬ043广㊀西㊀植㊀物44卷图4 菌株的系统发育树Fig.4㊀Phylogenetictreeofstrains2021)ꎬ可能是因为魔芋软腐病块组织处的次生侵染真菌和线虫能够为其提供食物ꎮ尽管对魔芋软腐病防治的研究相关报道较多(崔双等ꎬ2021ꎻ代雪凤等ꎬ2021ꎻ赵小明等ꎬ2021)ꎬ但是效果显著的防治方法并不多ꎮ本研究明确了魔芋球茎软腐病组织的真菌群落类型ꎬ首次确定了轮纹镰刀菌可以引起魔芋球茎软腐ꎬ是致病真菌ꎮ病原细菌胡萝卜果胶杆菌和轮纹镰刀菌双回接试验显示魔芋软腐病原细菌和真菌同时侵染会提高魔芋组织软腐化速率ꎬ表明魔芋软腐病可能是一种真菌和细菌复合侵染的病害ꎮ本研究明确了云南曲靖市花魔芋种植区软腐病的病原真菌种类和病害特征ꎬ对于该病害的防控具有十分重要的现实意义ꎮ1432期李竹梅等:花魔芋软腐病原真菌分离鉴定表3㊀分离菌株的相对丰度Table3㊀Relativeabundanceofisolatedstrains相似菌株Similarstrain菌株编号StrainNo.菌株数No.ofstrains相对丰度Relativeabundance(%)轮纹镰刀菌FusariumconcentricumM1M3M4M5M6M8M9M11M14M251045.45F.ambrosiumM10M1529.09尖孢镰刀菌F.oxysporumM714.55单孢根霉RhizopusazygosporusM18M20M23313.64粉红螺旋聚孢霉Clonostachysroseaf.catenulataM12M19M22313.64拜尼尔毛霉MucorbainieriM17M2129.09青霉属真菌Penicilliumsp.M2414.55总计Total22100红线框内为空白接种ꎻA.接种轮纹镰刀菌菌株ꎻB.接种尖孢镰刀菌菌株ꎻC.接种F.ambrosiumꎻD.接种粉红螺旋聚孢霉ꎻE.接种单孢梅霉ꎻF.接种拜尼尔毛霉ꎻG.接种青霉属真菌ꎮInsidetheredframearemockinoculationꎻA.InoculatedwithFusariumconcentricumꎻB.inoculatedwithF.oxysporumꎻC.InoculatedwithF.ambrosiumꎻD.InoculatedwithClonostachysroseaf.catenulateꎻE.InoculatedwithRhizopusazygosporusꎻF.InoculatedwithMucorbainieriꎻG.InoculatedwithPenicilliumsp.图5㊀柯赫氏法则检测分离真菌Fig.5㊀Kochpostulatestestofisolatedfungi参考文献:BEHERASSꎬRAYRCꎬ2016.KonjacglucomannanꎬapromisingpolysaccharideofAmorphophalluskonjacK.Kochinhealthcare[J].IntJBiolMacromolꎬ92:942-956.CHADHAJꎬHARJAIKꎬCHHIBBERSꎬ2022.RevisitingthevirulencehallmarksofPseudomonasaeruginosa:achroniclethroughtheperspectiveofquorumsensing[J].EnvironMicrobiolꎬ24(6):2630-2656.CHUAMꎬBALDWINTCꎬHOCKINGTJꎬetal.ꎬ2010.TraditionalusesandpotentialhealthbenefitsofAmorphophalluskonjacK.KochexN.E.Br[J].JEthnopharmacolꎬ128(2):26-78.CUISꎬCHENCLꎬFENGJHꎬetal.ꎬ2021.CharacterizationofPectobacteriumaroidearumcausingkonjacsoftrotandbiocontroleffectofBacillusvelezensis[J].ChinVegetꎬ(3):83-93.[崔双ꎬ陈昌龙ꎬ冯佳豪ꎬ等ꎬ2021.魔芋软腐病致病菌Pectobacteriumaroidearum的特征及贝莱斯芽孢杆菌的生防效果[J].中国蔬菜ꎬ(3):83-93.]DAIXFꎬZHULꎬZHANGSLꎬetal.ꎬ2021.Screeningof243广㊀西㊀植㊀物44卷F+P.接种轮纹镰刀菌和胡萝卜果胶杆菌ꎻF.单接种轮纹镰刀菌ꎻP.单接种胡萝卜果胶杆菌ꎻCK.对照ꎮ不同字母间表示差异显著(P<0.05)ꎮF+P.InoculatedwithFusariumconcentricumandPectobacteriumaroidearumꎻF.InoculatedwithFusariumconcentricumꎻP.InoculatedwithPectobacteriumaroidearumꎻCK.Controltreatment.Differentlettersindicatesignificantdifferences(P<0.05).图6㊀混合病原菌接种致病性检测Fig.6㊀PathogenicitytestofmixedpathogeninoculationantagonisticactinomycetesagainstAmorphophallussoftrot[J].JSWUniv(NatSciEd)ꎬ43(11):9-17.[代雪凤ꎬ朱丽ꎬ张盛林ꎬ等ꎬ2021.魔芋软腐病拮抗放线菌筛选[J].西南大学学报(自然科学版)ꎬ43(11):9-17.]DUQꎬDUANCꎬLISꎬetal.ꎬ2020.FirstreportofmaizeearrotcausedbyFusariumconcentricuminchina[J].PlantDisꎬ104(5):1539-1540.GAOYꎬZHANGYꎬCHENFꎬetal.ꎬ2022.Achromosome ̄levelgenomeassemblyofAmorphophalluskonjacprovidesinsightsintokonjacglucomannanbiosynthesis[J].ComputStructBiotechnolꎬ20:1002-1011.HEFꎬZHANGZLꎬCUIMꎬetal.ꎬ2016.IdentificationandallelopathiceffectofdominantfungiinrootzoneofAmorphophalluskonjacandscreeningofthebio ̄controlactinomycetes[J].JNWA&FUniv(NatSciEd)ꎬ44(4):157-167.[何斐ꎬ张忠良ꎬ崔鸣ꎬ等ꎬ2016.魔芋根域优势真菌鉴定和化感作用及其生防放线菌的筛选[J].西北农林科技大学学报(自然科学版)ꎬ44(4):157-167.]HUANGLꎬLIUYXꎬRENXXꎬetal.ꎬ2014.IsolationꎬidentificationandGFPmakerofsoftrotbacteriastrainsinAmorphophallusrivieri[J].GuizhouAgricSciꎬ42(12):118-121.[黄露ꎬ刘永翔ꎬ任秀秀ꎬ等ꎬ2014.魔芋软腐病菌的分离鉴定及其GFP标记[J].贵州农业科学ꎬ42(12):118-121.]KAVKLERKꎬDEMŠARAꎬ2012.Impactoffungioncontemporaryandacceleratedagedwoolfibres[J].PolymDegradStabilꎬ97(5):786-792.LANGELꎬPILGAARDBꎬHERBSTFAꎬetal.ꎬ2019.Originoffungalbiomassdegradingenzymes:Evolutionꎬdiversityandfunctionofenzymesofearlylineagefungi[J].FungalBiolRevꎬ33(1):82-97.LIHꎬZHUGꎬBOYCEPCꎬetal.ꎬ2010.FloraofChina[M].Beijing:SciencePress:23-33.LIYBꎬBAOXKꎬWANQꎬetal.ꎬ2017.Isolationandpathogenicityofkonjacrootrotpathogenicfungi[C]//ProceedingsoftheAnnualMeetingofChineseSocietyforPlantPathology.Shandong:Tai an.[李迎宾ꎬ暴晓凯ꎬ万琪ꎬ等ꎬ2017.魔芋块根腐烂病原真菌的分离及其致病性研究[C]//中国植物病理学会2017年学术年会论文集.山东:泰安.]QINCDꎬJIANGYꎬZHANGRꎬetal.ꎬ2021.FirstreportofFusariumconcentricumcausingshootblightonPodocarpusmacrophyllusinChina[J].PlantDisꎬ160(2):768.QIULꎬCHOUNXꎬ1995.KonjacResourceandItsDevelopmentandUtilizationValue[J].TerritNatResourStudyꎬ27(2):73-74.[邱凌ꎬ仇农学ꎬ1995.魔芋资源及其开发利用价值[J].国土与自然资源研究ꎬ27(2):73-74.]RAHIMHꎬKAMARUDINNSꎬMOHDMHꎬ2020.FirstreportofFusariumconcentricumcausingfruitblotchonroselle(Hibiscussabdariffa)[J].AustralPlantDisꎬ15:15.SEENIVASAGANRꎬBABALOLAOOꎬ2021.Utilizationofmicrobialconsortiaasbiofertilizersandbiopesticidesfortheproductionoffeasibleagriculturalproduct[J].Biologyꎬ10(11):1111.SRZEDNICKIGꎬBOROMPICHAICHARTKULCꎬ2020.Konjacglucomannan ̄productionꎬprocessingꎬandfunctionalapplications[M].BocaRation:CRCPress:1-300.SUNMMꎬ2019ꎬPathogenidentificationandrapiddetectionmethoddevelopmentforsoftrotofAmorphophalluskonjac[D].Wuhan:HuazhongAgriculturalUniversity.[孙苗苗ꎬ2019.魔芋软腐病病原鉴定及快速检测技术研究[D].武汉:华中农业大学.]VILGALYSRꎬHESTERMꎬ1990.RapidgeneticidentificationandmappingofenzymaticallyamplifiedribosomalDNAfromseveralCryptococcusspecies[J].JBacteriolꎬ172(8):4238-4246WANGJHꎬFENGZHꎬHANZꎬetal.ꎬ2013.FirstreportofpepperfruitrotcausedbyFusariumconcentricuminChina[J].PlantDisꎬ97(12):1657-1658.WANGZMꎬLIURNꎬDANGDZꎬetal.ꎬ2021.Symptomsꎬ3432期李竹梅等:花魔芋软腐病原真菌分离鉴定influencingfactorsandcontrolmeasuresofkonjacsoftrot[J].NWHorticꎬ(2):47-48.[王敏珍ꎬ刘润妮ꎬ党丹州ꎬ等ꎬ2021.魔芋软腐病症状㊁影响因素与防治措施[J].西北园艺(综合)ꎬ(2):47-48.]WEIHꎬYANGMꎬPEIWꎬetal.ꎬ2020.FirstreportofPectobacteriumaroidearumcausingsoftrotofAmorphophalluskonjacinChina[J].PlantDisꎬ104(3):969.WEIJCꎬ1979.Fungalidentificationmanual[M].Beijing:SciencePress.[魏景超ꎬ1979.真菌鉴定手册[M].北京:科学出版社.]WHITETJꎬBRUNSTDꎬLEESBꎬetal.ꎬ1990.AmplificationanddirectsequencingoffungalribosomalRNAgenesforphylogenetics[M]//PCRProtocols.Pittsburgh:AcademicPress:315-322.WUJꎬDIAOYꎬGUYꎬetal.ꎬ2011.MoleculardetectionofPectobacteriumspeciescausingsoftrotofAmorphophalluskonjac[J].WorldJMicrobBiotꎬ(27):613-618.WUJꎬYANGCꎬJIAOZꎬetal.ꎬ2015.GeneticrelationshipsofsoftrotbacteriaisolatedfromkonjacinChinabyAmplifiedFragmentLengthPolymorphism(AFLP)and16SrDNAgenesequences[J].AgricSciꎬ6:717-723.WUJPꎬDIAOYꎬGUYCꎬetal.ꎬ2021.InfectionpathwaysofsoftrotpathogensonAmorphophalluskonjac[J].AfrJMicrobiolRꎬ4(14):1495-1499.XUWꎬ2011.IsolationandidentificationofthesoftrotandSclerotiumrolfsiiofkonjacandstudyofbiologicalcontrolinLangaoCounty[D].Yangling:NorthwestA&FUniversity.[徐炜ꎬ2011.岚皋县魔芋软腐病和白绢病病原菌的分离鉴定和生物防控初探[D].杨凌:西北农林科技大学.]YANGZꎬDAICCꎬWANGXXꎬetal.ꎬ2019.Advanceinresearchonrhizospheremicrobialmechanismsofcropsoil ̄bornefungaldiseases[J].ActaPedolSinꎬ56(1):12-22.[杨珍ꎬ戴传超ꎬ王兴祥ꎬ等ꎬ2019.作物土传真菌病害发生的根际微生物机制研究进展[J].土壤学报ꎬ56(1):12-22.]ZHAOXMꎬLIZYꎬCUIMꎬetal.ꎬ2021.PreliminarystudyonsoftrotcontroltechnologyofkonjacinAnkang[J].ActaAgricBoreal ̄OccidentSinꎬ30(8):1263-1270.[赵小明ꎬ李增义ꎬ崔鸣ꎬ等ꎬ2021.安康魔芋软腐病防治技术初步研究[J].西北农业学报ꎬ30(8):1263-1270.]ZHANGHJꎬSHAOMꎬDUPꎬetal.ꎬ2012.Effectsofdiversitycultivationofkonjacandmaizeincontrollingkonjac ssoftrotdiseaseinYunnanProvinceꎬSouthwestChina[J].ChinJEcolꎬ31(2):332-336.[张红骥ꎬ邵梅ꎬ杜鹏ꎬ等ꎬ2012.云南省魔芋与玉米多样性栽培控制魔芋软腐病[J].生态学杂志ꎬ31(2):332-336.]ZHANGYAꎬCHUHLꎬYULQꎬetal.ꎬ2022.AnalysisofthetaxonomyꎬsyntenyꎬandvirulencefactorsforsoftrotpathogenPectobacteriumaroidearuminAmorphophalluskonjacusingcomparativegenomics[J].FrontMicrobiolꎬ12:679102.ZHANGYQꎬXIEBJꎬGANXꎬ2005.Advanceintheapplicationsofkonjacglucomannananditsderivatives[J].CarbohydPolymꎬ60:27-31.ZHAOXLꎬHESLꎬLIUSRꎬetal.ꎬ2022.Isolationandidentificationofthreestrainsofpathogencausingkonjacstemrotandstudiesonpathogenicity[J].ChinVegetꎬ(6):56-63.[赵兴丽ꎬ贺圣凌ꎬ刘思睿ꎬ等ꎬ2022.3株魔芋茎腐病病原菌的分离鉴定与致病性研究[J].中国蔬菜ꎬ(6):56-63.]ZHUFꎬ2018.Modificationsofkonjacglucomannanfordiverseapplications[J].FoodChemꎬ256(Aug.1):419-426.(责任编辑㊀李㊀莉)443广㊀西㊀植㊀物44卷。
魔芋葡甘聚糖功能研究进展

魔芋葡甘聚糖功能研究进展作者:韩端丹王格格来源:《新生代·下半月》2018年第11期【摘要】:在植物分类中魔芋是天南星科(Araceae)中魔芋属(Amorphophallus Bl.ex Decne)的草本植物,它的主要成分为魔芋的葡甘聚糖,其简称为KMG,是一种可食用植物纤维,不易被消化。
KMG具有复杂的结构,因而其具有多种生理功能,如其具有热量极低、黏度大、吸水性强、膨胀率高的特点,所以葡甘聚糖在减肥、均衡饮食、干扰癌细胞代谢、洁胃、排毒通便、造纸、瓷器上有很大功效。
因此其在食品行业、医药行业、农业、以及工业等领域中具有广泛的发展前景。
【关键词】:魔芋葡甘聚糖理化性质功能进展魔芋葡甘聚糖由于具有良好的理化性质,因此一度成为研究热点,对其功能研究较多但大多集中于其降脂降血糖以及减肥作用,对其他功能研究甚少。
国外对其大分子研究较多,基于对其一级结构较清楚的现状,现今国内外多集中于对其进行改造,研究其改造后的特性,以便适用于更多领域。
魔芋葡甘聚糖具有以下理化性质及其功能。
1.1 热量极低KGM是一种优良的高纤维膳食,与其他膳食纤维一样难以消化,但其有独特的性质即热量低,而且还是一种可发酵的能水溶性的膳食纤维。
食用魔芋后其会在胃中吸水膨胀,形成粘性较大的魔芋胶溶液,延长胃的排空时间,延缓人体产生饥饿感,使人体摄入食物量减少,减轻体重,因此其非常有利于减肥人员食用。
不光这样,KGM之所以能达到减少体内脂肪目的,是通过和胆固醇在消化道内相结合,然后有效的减少胆固醇和脂肪等在消化道的吸收,通过自身吸收胆酸,减少胆酸含量,这样就可以降低回肠粘膜的主动运转,阻断胆汁酸在肝肠中的自主循环,通过这样一系列的抑制作用,肝脂含量降低,内固醇排出量增加,体内脂肪含量也就随之降低。
KGM可用来制作魔芋葡甘聚糖胶囊而成为保健减肥产品服用,或者进一步成为降血糖辅助药物食用。
魔芋葡甘聚糖因为其特性不能被消化酶所水解,可是在腸道内因其可被大肠微生物所吸收发酵所产生的低能量被民众认为是种有益身体健康的膳食纤维。
不同遮阴度对魔芋软腐病的影响

E et o iee tS a igDere n KojcS R R t f cs fDf rn h dn geso na o o f
XU M i, E G a -a , ig n F N Xioj n HU Pn
( n h o a o a T c nc lC l g ,E s i4 5 0 ,Hu e ,C ia E si V c t n l e h ia ol e n h 4 0 0 i e b i hn )
供 试 魔 芋 品种 为 由恩 施 州农 业 科 学 院魔 芋研 究所 提供 的清 江花魔 芋
12 试 验 方 法 .
魔 芋产 业 发展 的重 点 区域 l 6
目前 . 全州魔 芋 种植
面 积 、 量 、 值 及 加 工 转 化量 均 占全 国 的 2 %以 产 产 5
上 。但是 , 着集约 化规 模栽 培 的发展 . 随 魔芋 病害 的 种 类 越来 越 多 . 目前 在生 产 上最 常 见 的病 害 是 软腐 病 , 仅在 魔 芋 田间生长 阶段 发病 , 成 叶 片 、 不 造 叶柄
关 于魔芋软 腐病 的防治研究 已有一 些报 道… 1. ~3 3
物 . 有大量 的葡甘 聚糖 …. 含有 多种 人体 不 能合 含 并 成 的 矿 物 质 . 联 合 国食 品卫 生 组 织认 定 为 “ 贵 被 宝
本试 验通 过 研 究 不 同的 遮 阴 度 对魔 芋 软 腐 病 发 生 的影 响 , 旨在 为魔 芋 的健 康 栽培提 供 理论依据
一株拮抗魔芋软腐病的苏云金芽胞杆菌研究

一株拮抗魔芋软腐病的苏云金芽胞杆菌研究李辉;李雷林;高媛;杨宇纯;刘欢;薛艳红;刘士平【摘要】魔芋软腐病严重影响着魔芋的生长,本实验室从魔芋软腐病出发,分离筛选出一株对其具有强拮抗作用的菌株16-4,并测定了其抑菌活性.经过形态观察、显微鉴定和分子鉴定确定该菌株是一株苏云金芽孢杆菌.拮抗实验结果表明16-4对魔芋软腐病具有很强的拮抗能力,平板对峙法显示该菌株对魔芋软腐病的抑菌圈达到75.4 mm,魔芋块的实验说明16-4菌悬液与病原液3:1的比例加入能很好地控制魔芋软腐病的发作,模拟田间管理的植株实验,当16-4菌悬液是病原液的3倍时就可达到较理想的防治效果.所有实验结果为魔芋软腐病的生物防治奠定了良好的基础.【期刊名称】《三峡大学学报(自然科学版)》【年(卷),期】2019(041)003【总页数】5页(P108-112)【关键词】魔芋软腐病;苏云金芽孢杆菌;内生细菌;生物防治【作者】李辉;李雷林;高媛;杨宇纯;刘欢;薛艳红;刘士平【作者单位】三峡大学生物与制药学院,湖北宜昌 443002;三峡大学生物与制药学院,湖北宜昌 443002;三峡大学生物与制药学院,湖北宜昌 443002;三峡大学生物与制药学院,湖北宜昌 443002;三峡大学生物与制药学院,湖北宜昌 443002;三峡大学生物与制药学院,湖北宜昌 443002;三峡大学生物与制药学院,湖北宜昌443002【正文语种】中文【中图分类】S436.341.1+3魔芋的有效成分是具有降血压、降血脂、降血糖、改善肠道功能和减肥等功效的一种膳食纤维——魔芋葡甘聚糖(Konjac Glucomannan, KGM),同时还能增加饱腹感,是一种广受欢迎的健康食品[1].然而,在魔芋产业进行大规模推广开发的时候,有一个关键的制约因素即魔芋软腐病,是魔芋生产中危害最严重的病害,俗称“半边疯”[2,14].每年因为魔芋软腐病都会造成魔芋种植业的巨大损失,损失可达30%~50%,严重的达到80%以上,甚至绝收[2].在中国发现的魔芋软腐病病原菌主要是属于软腐欧文氏菌属(Erwinia),胡萝卜软腐欧氏杆菌胡萝卜软腐亚种(Erwinia carotovora subsp.carotovora)[3-4],是一种革兰氏阴性细菌,其在魔芋的栽培期及贮藏期均可发病,严重影响魔芋的产量和品质[5].化学防治在植物病虫害的防治中存在环境污染、易产生抗药性等缺点[6].相比之下,生物防治具有成本低、环境友好、不易产生抗药性[7]等优点,所以近些年成为防治热点.其中植物内生真菌在生物防治中具有十分重要的地位[8],是能用来防治魔芋软腐病的生物药剂.该生物药剂由解淀粉芽孢杆菌的发酵液制成,具有一定的防治和增产作用[9].本研究从花水疏花水柏枝(myricaria laxiflora)中分离得到一株内生细菌16-4,经鉴定该内生细菌为苏云金芽孢杆菌(Bacillus thuringiensis)[10].结果表明,平板对峙和模拟田间管理的植株实验,均可达到理想的防治效果.1 材料与仪器1.1 材料疏花水柏枝的枝叶(三峡流域湖北宜昌境内胭脂坝采集),魔芋软腐病病原菌(本研究室-80 ℃保藏).1.2 培养基实验全部使用牛肉膏蛋白胨(LB)培养基:1 L的水中加入5 g牛肉膏,10 g蛋白胨,5 g氯化钠,20 g琼脂,pH 7.0~7.2.1.3 试剂与主要仪器50 μg/mL的链霉素溶液;75%乙醇;3%次氯酸钠溶液;液氮;DNA凝胶回收试剂盒(Sangon公司)、通用引物27f、1492r;dNTP、10×PCR buffer、ExTaq酶(日本、TaKaRa公司).主要试验仪器见表1.表1 主要仪器设备名称生产厂家YM30F不锈钢智能立式电热蒸汽消毒器上海三申医疗器械有限公司PH-303A干燥箱/培养箱上海一恒科学仪器有限公司SW-CJ-2FD型双人净化工作台苏州净化设备厂台式恒温振荡培养箱上海知楚仪器有限公司电热恒温水槽上海精宏实验设备有限公司PCR仪美国BIO-RAD公司凝胶成像系统美国UVP公司生物显微镜日本奥林巴斯会社水平电泳仪北京市六一仪器厂2 方法2.1 魔芋拮抗菌的分离和筛选2.1.1 魔芋拮抗菌的分离在三峡流域湖北宜昌境内胭脂坝采集疏花水柏枝的枝叶,清水洗净之后用75%乙醇和3%次氯酸钠溶液进行表面消毒,采用稀释平板法获得内生细菌.制备稀释液:无菌操作取约10 g样品枝叶,加入无菌水100 mL,将组织研磨捣碎.取1.0 mL捣碎组织液加入无菌水9.0 mL,再用无菌水稀释7个浓度梯度.培养:取各浓度梯度稀释液100 μL分别涂布于LB培养基平板中,恒温37 ℃培养.取单菌落:待平板上长出菌落后,根据形态挑取单菌落于LB培养基平板中划线培养,至长出单一菌落,用甘油保藏于-80 ℃的低温冰箱,记录并编号.2.1.2 魔芋拮抗菌的筛选1)初筛.将保藏的魔芋软腐病原菌用LB培养基的平板活化,37 ℃培养24 h,拮抗菌用同样的方法活化;然后,挑取魔芋软腐病原菌的单菌落接种于100 mL LB 液体培养基中,37 ℃、100 r/min培养24 h.之后,在无菌条件下取1 mL菌悬液加入100 mL LB固体培养基(45 ℃左右)混匀,倒入培养皿中,再用接种针挑取一环拮抗菌菌体点接在培养基表面,恒温37 ℃培养24 h.以50 μg/mL链霉素抑菌结果为对照,观察抑菌作用.2)复筛.操作步骤与初筛相同,选取初筛中效果较好的九株菌进行实验.观察抑菌作用.2.2 内生细菌16-4的分子鉴定将活化的16-4单菌落接种于装有LB液体培养基的三角瓶中,37 ℃、100 r/min 培养24 h.之后,菌悬液进行离心,收集菌体后进行液氮研磨,利用Ezup柱式真菌基因组DNA抽提试剂盒(上海生工)提取总DNA.以总DNA为模板,以27f:5′-AGAGTTTGA TCCTGGCTCAG-3′,1492r:5′-GGTTACCTTGTTTACGACTT-3′为引物扩增其16S rRNA基因[11].PCR反应在20 μL反应体系中进行,反应体系见表2.表2 反应体系 (单位:μL)反应物体积10×PCR Buffer2.0 dNTP mixture(10 mM)2.0Primer-27f(20 μM)2.0Primer-1492r(20 μM)2.0DNA模板(菌悬液)0.5ExTaq DNA(5 U/μL)0.2ddH2O11.3Total Volume20PCR进行反应,将其产物用1%的琼脂糖凝胶电泳进行检测,选取1 500 bp左右的条带进行凝胶回收,送上海生工进行测序分析,重复2次.将测得的序列提交至GenBank,并获得登录号.再将此序列在GenBank中进行Blast比对,选取同源性较高(≥97%)的菌株的序列用MEGA4.1软件构建16S rDNA系统发育树,并参照《伯杰氏细菌系统分类学手册》[12]对内生细菌进行分类,确定该菌序列属性.2.3 细菌16-4对魔芋软腐病的拮抗作用2.3.1 细菌16-4作用于魔芋块的试验取健康魔芋球茎,75%乙醇和次氯酸钠进行表面消毒,在无菌环境下切成魔芋块,在魔芋块表面切出一个大约2 cm×1 cm×0.5 cm的伤口,随后将魔芋块放入有少量无菌水的培养皿中,进行实验.其中,A组魔芋块为空白对照,不加任何物质;B组魔芋块中加1 mL无菌水;C组魔芋块中加入1 mL病原菌培养液;D、E、F组魔芋块中分别加入病原菌和16-4比例为1∶1、1∶2、1∶3的混合液;放置一周左右观察情况.2.3.2 细菌16-4作用于魔芋植株的试验相同条件下健康生长的魔芋植株均在魔芋植株靠近球茎的土壤上层部位开一个小口,便于病原菌进行侵染[13].A组为空白对照,B组植株加100 mL病原菌培养液,C组植株加入100 mL病原菌培养液和100 mL 16-4培养液,D组植株加入100 mL病原菌培养液和300 mL 16-4培养液.4组植株在自然条件下生长2周,期间适当浇水,观察实验结果.3 结果与分析3.1 魔芋拮抗菌筛选结果3.1.1 魔芋拮抗菌的初筛结果从疏花水柏枝中分离得到的86株内生细菌中共筛选到37株内生细菌对魔芋软腐病病原菌具有拮抗作用.分别为:Y2-3,J3-1,J3-2,J3-8,J4-7,J5-2,J5-4,J6-7,3-3,3-4,4-1,4-2,5-1,5-3,5-4,5-6,6-1,6-2,7-3,7-4,8-2,8-3,8-4,8-6,10-2,10-3,12-1,14-1,16-3,16-4,17-1,17-2,18-1,18-2,18-3,ML1,MS1.3.1.2 魔芋拮抗菌的复筛结果从初筛得到的37株疏花水柏枝内生细菌中共筛选到11株对魔芋软腐病病原菌具有拮抗作用.分别为:J5-4,J6-7,3-4,4-1,8-2,8-4,8-6,16-3,16-4,17-1,17-2.11株内生细菌中对魔芋软腐病效果最好的一株菌是内生细菌16-4,抑菌圈直径可达75.4 mm.实验结果如图1所示.图1 各菌株复筛结果3.2 内生细菌16-4的鉴定在牛肉膏蛋白胨培养基上菌落呈米白色,表面较干燥,单菌落较小且呈圆形(图2A 和B),菌体在液体中易分散,不产生色素.显微形态表明,菌体为直杆状,菌体体积较大,分布较紧密.经革兰氏染色后显紫色,其属革兰氏阳性细菌(图2C).提取16-4的总DNA,以其为模板进行PCR扩增,回收的产物送上海生工公司测序.将获得16S rDNA的ITS序列通过EditSeq软件拼接,把序列提交至GenBank,获得登录号KP072784.选择与GenBank收录的同源性比较高的序列与所获得序列,用Blast与进行比对和同源性行分析,再用MEGA5.0做进化树(图2D).结果表明:鉴定菌株(16-4)16S rDNA的ITS序列与一株苏云金芽孢杆菌(Bacillus thuringiensisKF687051)的同源性达97%,对照《伯杰氏细菌系统分类学手册》,比较分析该菌株和苏云金芽孢杆菌的形态特征,所以确定该菌株为苏云金芽孢杆菌,命名为16-4.A:菌落形态; B:背面形态; C:显微形态; D:系统发育树图2 16-4的菌落形态、显微形态以及分子鉴定3.3 16-4对魔芋软腐病的拮抗作用3.3.1 细菌16-4作用于魔芋块的试验实验用病原菌和16-4不同比例的混合培养液作用于魔芋块,做一组空白对照,一组无菌水作为负对照,4组实验组,得到结果如图3所示.从图3能够看出,单接无菌水的魔芋块(图3B)为出现轻微变质的迹象,单接魔芋软腐病的魔芋块(图3C)出现严重变软变黑的现象,而且伴有恶臭的味道.比较6个图片(图3)的实验结果,可以看出加了16-4培养液能够抑制魔芋软腐病,但是明显等量添加(图3D)的效果不够,需要大量添加(图3E和F)才有彻底抑制的可能.A:空白对照; B:魔芋块中加1 mL无菌水; C:魔芋块中加入1 mL病原菌培养液; D:魔芋块中加0.5 mL病原菌培养液和0.5 mL 16-4培养液的混合液; E:魔芋块中加0.33 mL病原菌培养液和0.67 mL 16-4培养液混合液; F:魔芋块加0.25 mL病原菌培养液和0.75 mL 16-4培养液的混合液图3 细菌16-4作用于魔芋块的效果3.3.2 细菌16-4作用于魔芋植株的试验实验用病原菌液和不同比例的病原菌和16-4培养液的混悬液浇灌于健康的魔芋植株,生长2周后得到结果如图4所示.A:健康植株; B:土壤里倒入100 mL病原菌培养液; C:土壤里倒入100 mL病原菌培养液和100 mL 16-4培养液的混合液; D:土壤里倒入100 mL病原菌培养液和300 mL 16-4培养液; E:魔芋植株整体比较图4 细菌16-4作用于魔芋植株的效果由于魔芋软腐病能够侵染有伤口的魔芋植株,所以实验中的魔芋植株都在接近根的茎部位开了一个小伤口,结果发现与健康植株(图4A)相比较只加了病原菌的植株就变得枯黄、打蔫(图4B),另外两组魔芋植株由于加了细菌16-4的发酵液,植株依然在生长(图4C和D),但是第2棵魔芋比第3棵长得慢.继续培养约1个星期后,将死亡植株(图4B)挖出发现球茎坏死(图4E1),特别是在伤口部位已经干枯,推测死亡原因是由于魔芋软腐病入侵导致伤口部位软烂无法传送营养物质而使植株干枯死亡.另外两组魔芋植株植株依然在生长(图4C和D),而且在伤口部位没有什么明显变化(图4E2和E3).由此可以看出,魔芋软腐病对魔芋的生长有着致命的作用,而且实验结果表明细菌16-4对于魔芋软腐病具有很强的拮抗作用,能有效抑制魔芋软腐病病原菌的生长.4 讨论实验经过分离筛选得到的86株疏花水柏枝的内生细菌,通过平板对峙法发现有37株对魔芋软腐病有抑制作用,复筛之后发现内生细菌16-4的抑制作用最好,抑菌圈可达75.4 mm.利用16-4进行魔芋块和植株的实验,也表明16-4对魔芋软腐病的确有很强的抑制作用,特别是在植株作用实验上,说明可以直接利用16-4的菌悬液来防止魔芋软腐病,降低其发病率;从生产工艺来说可以节约成本;从使用方面来说应用起来很方便.但从科研角度来说,有必要明确其拮抗机理,所以还需要进一步进行研究,分析是何种物质产生的抑制效果.参考文献:【相关文献】[1] 魏养利, 张雪芳.魔芋的保健功能及发展前景[J].中国林副特产, 2017(3):64-66.[2] 丁自立, 万中义, 矫振彪, 等.魔芋软腐病研究进展和对策[J].中国农学通报, 2014, 30(4):238-241.[3] 吴金平.魔芋软腐病病原菌及其拮抗菌的研究[D].武汉:武汉大学, 2010.[4] 黄俊斌, 邱仁胜, 赵纯森.魔芋软腐病病原菌的鉴定及生物学特性初步研究[J].华中农业大学学报, 1999, 18(5):413-415.[5] 杨发明, 张燕, 张发祥, 等.魔芋软腐病的发生特点与综合防治技术[J].长江蔬菜, 2011(5):36-38.[6] 何斐, 崔鸣.魔芋软腐病生物防治研究进展[J].陕西农业科学, 2017, 63(1):64-67.[7] 张鑫, 陈国华, 陈芳清, 等.魔芋软腐病生物防治研究[J].安徽农业科学, 2010, 38(17):9058-9059.[8] Sturz A V, Christie B R, Nowak J.Bacterial Endophytes: Potential Role in Developing Sustainable Systems of Crop Production.[J]. Critical Reviews in Plant Sciences, 2000,19(1):1-30.[9] 吴金平, 刘晓燕, 张静柏,等.一株魔芋软腐病拮抗菌的分离鉴定及其活性物质的研究[J].中国农学通报, 2011, 27(24): 302-306.[10] 刘士平,蒋维,孔玉珊,等.一种内生枯草孢杆菌及其作用. CN201510475436.O[P].2016-06-15.[11] 朱飞舟, 陈利玉, 陈汉春.16SrRNA基因序列分析法鉴定病原细菌[J].中南大学学报(医学版), 2013, 38(10):1035-1041.[12] Garrity G M, Winters M, Searles D B.Bergry's Manual of SystematicBacteriology[M].German: Springer-Verlag, 2001.[13] Wu J P, Diao Y, Gu Y C, et al.Infection Pathways of Soft Rot Pathogens on Amorphophallus konjac[J]. African Journal of Microbiology Research, 2010, 4(14):1495-1499.[14] 古洪辉, 汪正香, 蒋雄,等.魔芋软腐病及其防治研究进展[J].农学学报, 2018, 8(9): 20-24.。
魔芋葡甘聚糖的应用及研究进展

魔芋葡甘聚糖的应用及研究进展
刘雨桃;王子平
【期刊名称】《华西药学杂志》
【年(卷),期】2008(0)2
【摘要】魔芋葡甘聚糖是一种高分子量的水溶性膳食纤维,可影响糖代谢、脂质代谢,改善胃肠道功能,具有抗癌、减肥、抗细胞老化等多种功效。
文中报道了魔芋葡苷露聚糖的药理作用、临床应用及安全性的研究进展。
【总页数】2页(P188-189)
【关键词】魔芋葡苷聚糖;药理作用;临床应用
【作者】刘雨桃;王子平
【作者单位】中国医学科学院中国协和医科大学肿瘤医院
【正文语种】中文
【中图分类】R96
【相关文献】
1.魔芋葡甘聚糖静电纺丝及其在生物医学上应用研究进展 [J], 薛海波;冯瑞;庞杰
2.魔芋葡甘聚糖在果品保鲜中应用研究进展 [J], 聂小宝;潘洪民;魏雪琴;张家国;张长峰
3.魔芋葡甘聚糖的研究进展及应用现状综述 [J], 刘楠;杨芳
4.魔芋葡甘聚糖及氧化魔芋葡甘聚糖对益生菌生长及乳糖代谢作用的体外研究 [J], 芦雨佳; 毛凯雯; 钟耕
5.魔芋葡甘聚糖在酸奶中应用及其研究进展 [J], 薛海波;吴栋平;许琼;朱玉英;程初林
因版权原因,仅展示原文概要,查看原文内容请购买。
魔芋生防菌防病增产试验示范简报

魔芋生防菌防病增产试验示范简报作者:崔鸣陈和润潘鹤梅赵兴喜来源:《农业与技术》2014年第06期摘要:魔芋软腐病是魔芋生产上的主要病害,严重影响魔芋生产的发展。
通过研发魔芋生防菌及使用技术,探讨防控新途径。
研究结果表明,将生防菌与有机专用肥配合使用,对于预防魔芋软腐病的发生和促进鲜芋产量形成作用显著,不同时期病株率下降29.9%~43.7%,增产幅度达28.2%。
关键词:魔芋;生防菌;防病;增产中图分类号:S476 文献标识码:A魔芋是世界上唯一能大量提供葡甘聚糖的重要经济作物。
葡甘聚糖因其具有水溶性、可食性、粘结性、可塑性、皮膜性、保鲜性、抗菌性、凝胶性等40余种特性,使其在食品、医药、化工、纺织、造纸、钻探、环保和化妆等行业具有100余种广泛而特殊的用途,经济和开发价值很高,国内外市场潜力巨大。
我国魔芋产业兴起于20世纪80年代中后期,现已成为颇具潜质的一个新兴产业和朝阳产业。
但是,随着魔芋种植面积的扩大和种植年限的延长,过去从未引起人们重视的魔芋软腐病逐年加重,轻者减产,重则绝收,病害严重影响了魔芋生产的发展和产业的开发,并已成为制约我国魔芋产业发展的瓶颈。
针对国内当前普遍采用单一化学药剂防效不高的突出问题,与西北农林科技大学资环学院合作研发出魔芋生防菌(密旋链霉菌剂),在前期开展生防菌防病增产作用研究的基础上,通过将其与有机专用肥的配合使用,进一步研究生防菌与有机专用肥配合对魔芋软腐病的防控作用和增产效果。
1 材料与方法1.1 示范试验设计示范试验安排在陕西省旬阳县甘溪镇唐坡村四组单永锋承包地,海拔650m,土壤为扁沙土,肥力中等,前茬为冬休地。
示范设处理区和对照区(CK)。
处理区每穴种芋上均匀施用专用有机肥100g,其上施配制的密旋链霉菌剂10g(有效成分0.5g)。
配置方法为,将100g密旋链霉菌剂用有机专用肥1.9kg稀释成20倍。
CK区按常规方法播种。
示范面积533.3m2,其中处理区333.3m2,CK区200m2。
魔芋葡甘露聚糖的应用

魔芋葡甘露聚糖的开发前景摘要:魔芋的主要成分是葡甘露聚糖,属于高分子化合物,是一种天然的膳食纤维,具有独特的生理作用。
葡甘露聚糖可用于食品,医用,化工等。
关键词:葡甘露聚糖,食用,医用,化工。
Konjac Portuguese dew of chitosan development prospects Abstract: The main ingredient of Konjak is glucomannan-nan-a kind of natural food fibre and has some specially physiological functions. Portuguese dew in food, medical chitosan, chemical industry and so on.Key words: Glucomannan, edible, medical, chemical industry.1前言魔芋是一种有益的碱性食品,主要成分有葡甘露聚糖。
在魔芋的块茎中,含有魔芋葡甘露聚糖64.78%、淀粉1.46%、蛋白质2.56%,脂肪0.13%、还有还原性糖1.61%、纤维素1.43%、灰分3.76%,同时还含有多种维生素、生物碱、无机盐、草酸钙结晶、桦木酸、β- 谷甾醇、豆甾醇、羽扇醇、蜂花烷、β- 谷甾醇棕榈酸酯、葡萄糖、半乳糖、鼠李糖、木糖、胡萝卜素和抗坏血酸等。
搭配食用魔芋,可以达到食品的酸碱平衡,是一种健康食品。
现今丰富多彩的魔芋食品,具有广阔的前景。
2 魔芋葡甘露聚糖在食品中的运用魔芋作为食品原料具有相当长的历史,但是在我国的制作品种还是比较少的,仅有魔芋干、魔芋粉和魔芋豆腐等产品,而且大多数是向日本出口初级加工品近年来,随着食品加工技术的提高和人们对魔芋特殊性质和功能的不断深入研究和认识,国内外以魔芋为主要原料或辅助原料加工的食品不断出现,魔芋在食品中的用途也越来越广,如作为食品添加剂、增稠剂、乳化剂、品质改良剂、悬浮剂等。
魔芋种芋消毒方法比较研究_牟方贵

摘 要:魔芋软腐病属细菌性病害,危害极为严重。为控制其种传途径,根据病原菌不耐高温的特点,采
用恒温浸种法进行消毒,并比较与常规农用链霉素喷雾和甲醛喷雾消毒效果。结果表明:55℃水浴
10 min,足以使病原菌失活,且不影响种芋发芽。在种芋表面带菌条件下消毒,28 天后 55℃浸种 10 min
发病率仅为 12.0%,而 1%福尔马林溶液和 5×105 U/L 农用链霉素喷雾消毒发病率高达 46.7%和 56.0%,
差异达 5%显著水平,后 2 种方法发病率低于 CK 的 65.3%,但不显著。对已发病的种芋进行消毒处理,
恒温浸种法防效为 94.7%,远高于甲醛和农用链霉素的 63.2%和 59.2%,甲醛对种芋具有腐蚀作用。此
外,恒温浸种法对白绢病和蚜虫也有灭活作用。由此可见,55℃浸种 10 min,是一种高效、安全、广谱的
4 月 11 日进行消毒,消毒后种芋平放于塑料盘中, 确保种芋间不接触,放于防虫网室,每隔 7 天观测 1 次 发病情况,持续 4 次。每次调查后,隔离已发病种芋, 防止接触感染。 1.3.3 消毒处理对种芋发芽的影响观察 4 月 1 日,挑选 50 个大小均一花魔芋种芋,其中球茎 30 g 左右,根状 茎(箭 果)5 g 左 右 ,经 消 毒 处 理 后 ,平 铺 于 40 cm × 60 cm 组培塑料盘,放入网室,自然光照长度,50 天后, 随机挑选 20 个样品测量芽长。 1.3.4 统计分析处理 采用 Sigmaplot 11.0 软件进行分 析和作图,观察结果用数码相机拍照。 2 结果与分析 2.1 魔芋种芋恒温消毒临界温度
基金项目:国家科技支撑计划项目子课题“魔芋种芋生产过程中质量监控技术研究与示范”(2007BAD73B03);湖北省自然基金重点项目“魔芋资源创 新与营养系杂交新品种培育”(2010CBB04001)。 第一作者简介:牟方贵,1957 年出生,湖北利川人,农艺师,主要从事魔芋品种改良研究。通信地址:445000 湖北省恩施市施州大道 517 号 恩施州农 业科学院。 通讯作者:杨朝柱,1972 年出生,湖北恩施人,高级农艺师,博士,主要从事魔芋生物技术与品种遗传改良研究。通信地址:445000 湖北省恩施市施州 大道 517 号 恩施州农业科学院,E-mail:ychzhaau2003@。 收稿日期:2012-10-11,修回日期:2012-12-24。
魔芋葡甘聚糖对肠道微生物调控影响机制分析

72 I FOOD INDUSTRY I解读INTERPRETATION1. 魔芋葡甘聚糖结构及理化特性魔芋葡甘聚糖是天南星科植物,是魔芋中的主要成分,是天然的植物多糖,具有较高的粘度。
魔芋葡甘聚糖缩写即为KGM ,KGM 主链D-甘露糖与D-葡萄糖通过β-1,4糖苷键链接而成,甘露糖与葡萄糖分子比约为1.5:1或1.6:1(花魔芋,A.konjac )或1.69:1。
在某些糖残基C3位上存在由β-1,3糖苷键链接的支链,支链上有葡萄糖与甘露糖残基构成,数量不等,KGM 其化学结构可由图1.1表示。
KGM 的特殊结构和化学成分赋予其独特的性能,如优异的亲水性、胶凝性、流变性能、增稠性能和成膜性能。
KGM 易溶于水,但不溶于甲醇、乙醇、丙酮和氯仿等有机溶剂,难以自由移动的大分子使魔芋胶溶液成为粘稠的非牛顿流体。
KGM 具有优异的保水性,可吸收自身体积的80至100倍,形成KGM 溶胶。
同时,KGM 分子量大,吸湿性和容量性强,由于不带电而具有极好的附着力,是自然界粘度最高的多糖之一,具有极好的增稠效果,相较于其他多糖。
KGM 溶胶的脱水在一定条件下可以形成胶膜,通过调节亲水和疏水材料可以改变胶膜的透水性。
魔芋葡甘聚糖对肠道微生物调控影响机制分析文 王元KGM 吸水性强,可增加大便量,促进肠蠕动和粪便排泄,减少对有毒物质的吸收,起到肠道清道夫的作用。
KGM 到达大肠后,在肠道微生物的作用下发酵产生酸和各种短链脂肪酸,如乙酸、丙酸、丁酸等,调节肠道菌群,具有良好的肠道益生元作用。
近年来,有报道称,KGM 的肠道益生元作用是发挥减肥降脂、免疫调节、抗氧化损伤、预防大肠癌等生物学作用的重要途径。
对各种KGM 及其衍生物的肠道益生元进行了评估,性别在预测KGM 的生物活性方面非常重要。
魔芋葡甘聚糖是一种优质膳食纤维,能促进肠胃蠕动,具有“肠道清道夫”的功效,促进体内有害毒素的排出,预防和减少疾病的发生,有效保护胃黏膜,能清除胃壁并具有良好的肠道益生菌特性,但尚未报道哪种摄入形式发挥更好的作用。
六种不同生物制剂对魔芋生长的影响研究
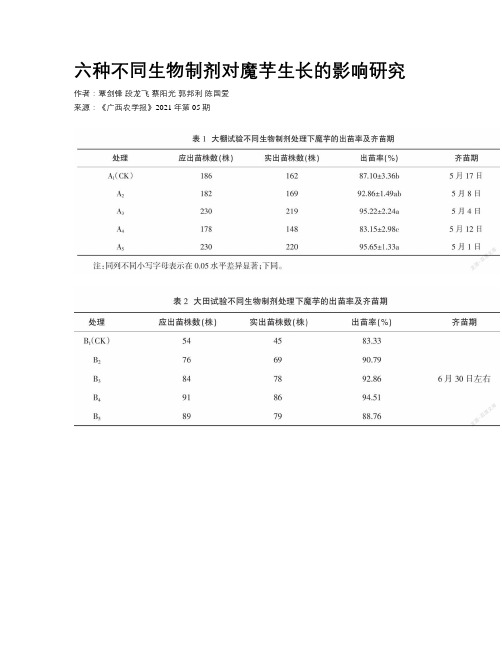
六种不同生物制剂对魔芋生长的影响研究作者:覃剑锋段龙飞蔡阳光郭邦利陈国爱来源:《广西农学报》2021年第05期摘要:【目的】為探究六种不同生物制剂对魔芋生长的影响,以期明确EM菌剂和木酷液在防控魔芋软腐病中的应用潜力。
【方法】大棚试验设置A1空白对照,A2木酷液,A3EM 菌,A4乐圣土壤修复剂,A5荧光假单胞杆菌共5个处理组,大田设置B1空白对照,B2EM菌、B3木酷液,B4大蒜素,B5亚康力诺有机多肽酶活性促进剂共5个处理组,统计两种试验不同试剂处理下魔芋的出苗率、齐苗期、软腐病发病率、葡甘聚糖含量、产量、土壤微生物数量等指标。
【结果】大蒜素、木酷液、EM菌均能在一定程度上提高魔芋出苗率,木酷液对魔芋软腐病的防治效果最好,其次是EM菌,且EM菌处理后地块的土壤微生物数量明显增多。
【结论】木酷液具有较好的防治魔芋软腐病的效果,同时在一定程度上可以调节土壤中的微生物菌群,建议使用木酷液防治魔芋软腐病。
关键词)生物制剂;EM菌;木酷液;魔芋;软腐病;生长中图分类号:s476+.9文献标识号:A文章编号:1003-4374(2021)05-0043-06Study on the Effects of Six Different Biological Agents on the Growth of Konjac0in Jian-feng. Duan Long-fei*,Cai Yang-guang,Guo Bang-li,Chen Guo-ai (Ankang Acedemy of Agricultural sciences,Ankang,shaanxi 725021,China)Abstract:【0bjective】In order to study on the effects of six different biological agents on the growth of konjac,and to define the application potential of EM bacteria and wood vinegar in the prevention and control of konjac soft rot.【Method】Greenhouse experiments were setting as follows: A1. Blank control; A2. wood vinegar; A3. EM bacteria; A4. Lesheng soil remediation agent; A5. Pseudomonas fluorescens was used in 5 treatment groups in total; Field experiments were setting as follows: B1. Blank control; B2.EM bacteria; B3. wood vinegar; B4. Allicin; B5. Aconlino organic polypeptidase activity promoter was used in 5 treatment groups in total. The index of statistics were the emergence rate,even degree of stage,incidence of soft rot,glucomannan content,yield and soil microbial number of konjac under different agents of two experiments. 【Result】The results showed that allicin,wood vinegar and EM bacteria can improve the emergence rate of konjac to a certain extent. The wood vinegar had the best control effect on konjac soft rot,followed by EM bacteria and the number of soil microorganisms in the plot treated with EM bacteria increased significantly. 【Conclusion】wood vinegar has a good control effect on konjac soft rot,and can regulate the microbial flora in the soil to a certain extent. It is suggested to use wood vinegar to control konjac soft rot.Key wor4s:biological agents,EM bacteria,wood vinegar,konjac,soft rot,growth魔芋(Amorphopha11us)属天南星科多年生草本植物,在中国、日本等地作为食物和药材广泛种植。
魔芋软腐病防治研究进展

B i n g h a i f a n g z h i就魔芋软腐病的危害、发生发展规律及国内外魔芋软腐病防治方面的研究进展、存在的问题进行了概述,并从化学防治、生物防治、农业防治几个角度论述了当前魔芋软腐病防治的有效措施与发展方向,以期为今后魔芋高产栽培提供参考。
魔芋(Amorphophallus konjac)又名魔芋或蒟蒻,属天南星科魔芋属多年生草本块茎植物。
因其球茎中含有丰富的葡甘聚糖,在农业、食品、医药保健及化工等行业被广泛利用。
近年来,随着魔芋连作种植面积的扩大,软腐病害的发生呈现逐年加重的趋势。
在魔芋软腐病发病高峰期,平均发病率为25%~50%,严重年份超过50%造成严重减产甚至绝收,从而给大田生产带来巨大风险。
魔芋软腐病频发已成为制约魔芋种植业发展的瓶颈。
近些年,不同学者从化学、生物、农业、基因工程等角度研究了魔芋软腐病的防治,并取得一些进展。
研究表明染病种芋与带菌土壤是魔芋软腐病的初侵染源,发病初期喷施波尔多液等铜制剂能有效控制病害的发展。
何斐等综述了魔芋软腐病生物防治方面的研究进展,并从复配菌剂和筛选拮抗内生菌防治魔芋软腐病、培育转基因魔芋抗病品种、加强生物农药的研发等方面对魔芋软腐病的生物防治提出了展望。
在实际生产中,由于多方因素的影响,魔芋软腐病频发且防治难度大。
传统的农业、物理手段对魔芋软腐病的防治效果正在逐年减弱。
化学药剂防治虽然速效,但其长期使用带来的抗性和残留问题直接影响魔芋产业的可持续发展。
生物防治有低成本、高效率、环境友好等优点,但依然存在微生物定殖难、稳定性低等不足。
所以生产上亟需一套有效的魔芋软腐病综合防治方法。
一、魔芋软腐病病原菌及其侵染途径相关研究认为,引起魔芋软腐病的病原菌为胡萝卜软腐欧氏杆菌胡萝卜致病变种(Erwinia carotovora pv.carotovora)及胡萝卜软腐果胶杆菌胡萝卜软腐亚种(Pectbacterium carotovorum PC1),还有尚待确定的致病菌,具有多样性。
魔芋软腐病发生规律及生物多样性防控措施

魔芋软腐病发生规律及生物多样性防控措施作者:陶慧来源:《现代农业科技》2016年第06期摘要经过3年对魔芋常规种植技术条件下,魔芋软腐病发生发展规律的调查、统计分析及玉米、魔芋、红薯高、中低层生物多样性栽培试验的统计分析,提出了魔芋软腐病生物多样性防控措施,以供参考。
关键词魔芋软腐病;发生规律;生物多样性;防控措施中图分类号 S436.32 文献标识码 B 文章编号 1007-5739(2016)06-0145-02魔芋的主要成分为葡甘露聚糖,由葡萄糖与甘露糖聚合而成。
是自然界分子量最大、黏度最高的膳食纤维,是不含糖分、脂肪、淀粉和蛋白质等具有热量的物质。
同时,还含有多酚类物质,具有降血糖、增加胰岛素敏感度、降血液胆固醇、治疗便秘、结肠保、减肥等多种营养保健功能。
但是,长期的生产实践证明,魔芋软腐病是魔芋产业发展的主要障碍,它是最易感染、传播最快、危害最大、防控最难的一种病害。
为促进魔芋产业的健康、稳定和可持续发展,2013—2015连续3年,对花魔芋软腐病的发生、发展规律和利用生物多样性防控魔芋软腐病进行探索,初步总结提出了2年免耕防控魔芋软腐病的生物多样性种植模式。
1 魔芋软腐病的发生发展规律经2013—2015连续3年,每年随机调查30个点,在常规的种植技术条件下,统计分析发现,魔芋软腐病的综合发病率为35.37%,其中:贮藏期间种芋发病率占11.63%,种植后因软腐病烂种缺塘率占11.26%,出苗后生长期发病率占12.48%。
1.1 种芋选择和贮藏方式的影响(1)花魔芋收挖。
花魔芋的收挖要植株倒苗后30 d才开始进行,这样才有利于营养回流,小球茎膨大,芋鞭自然脱落。
魔芋的种皮特别薄,易破,病原菌易从伤口侵入而引发病害,因此保持种芋种皮完整,是采挖和搬运中的重点,也是难点。
种芋采收后要就地进行遮荫,晾干失水5~7 d,让土壤自然脱落,轻拿轻放,用箩筐包装运送回家贮藏。
这个环节最根本的就是要确保种芋种皮完好无损,是预防病原菌侵入而引发病害的关键性技术。
魔芋种植业发展存在的问题与对策

魔芋种植业发展存在的问题与对策张修建N o n g j i t u i g u a n g 魔芋由于自身具有魔芋葡甘聚糖等多种成分,因此被广泛的应用在多个领域。
但是针对丹霞镇目前的魔芋种植情况来说,不仅在种植技术仍然处于较低的水平,在进行魔芋种植的过程中也存在着许多问题急需解决。
一、当前魔芋种植业发展存在的问题1、病害问题影响魔芋产量当前,在魔芋种植业内部,病虫害问题对于魔芋种植的发展造成了非常严重的制约。
如果在进行魔芋种植的过程中,没有针对病虫害问题进行有效地治理,很有可能导致魔芋的总产量受到非常严重的影响,更有可能为种植魔芋的农民带来一定的经济风险。
无论是过去的零星种植阶段,还是如今的大面积种植阶段,病害问题作为危害魔芋总产量的元凶之一一直没有得到较好地解决,且由于近年来魔芋市场增大,越来越多的人开始进行魔芋种植,魔芋病害的问题也逐渐凸显。
在魔芋种植过程中常见的病害包括了软腐病、白绢病、根腐病等病害。
其中危害程度最大,传播范围最广的根腐病一旦出现,就会在魔芋养殖区域内部飞快传播,如果在其传播阶段,农民没有针对这种病害进行足够的重视,导致根腐病感染了大部分魔芋,就很有可能导致魔芋减产约35%~47%左右,甚至可能会出现“绝收”的现象,因此病虫害问题针对魔芋种植业的发展造成了非常严重的制约。
2、种植技术较低当前,丹霞镇种植的魔芋品种包括了白魔芋、花魔芋等魔芋品种,这些品种中,白魔芋相比起其他品种而言虽然产量较低,但是其具有更高的经济价值,白魔芋的质量相对于其他品种魔芋而言也更高。
白魔芋在进行种植栽培的过程中,最适宜进行种植的环境就是中高海拔地区,并且在进行魔芋种植的过程中,对于种植地区的气候、湿度以及种植地的土壤粘性等都有着较高的要求,只有满足了这些需求,才能够保证种植出的魔芋质量较好、产量较高。
但是目前由于魔芋市场迅速扩大,导致了许多不适合进行魔芋种植的地区也开始硬着头皮进行魔芋的种植,这种行为直接导致了魔芋的质量降低,魔芋的产量也无法得到应有的提升。
魔芋软腐病及其防治

魔芋软腐病及其防治
王信保;唐发贵
【期刊名称】《西南园艺》
【年(卷),期】2005(33)1
【摘要】魔芋为天南星科魔芋属(Amorphophallus Blume)多年生宿根草本阴性植物。
主要分布于印度半岛的亚洲各国,具有奇特的保健功效,是适宜山区栽种的经济价值较高的作物。
魔芋的产品器官为块茎.内含丰富的葡甘聚糖(40%~55%),灰分3%~4%、果胶、生物碱、淀粉及17种氨基酸和多种微量元素,其淀粉膨胀力大致有80~100倍。
【总页数】2页(P45,47)
【作者】王信保;唐发贵
【作者单位】云南省元江县林业局,元江,653300;云南省元江县林业局,元
江,653300
【正文语种】中文
【中图分类】S632
【相关文献】
1.汰腐净、魔芋灵对魔芋软腐病的防治效果 [J], 陈恩发;丁海兵;尹旺;王梅;锁才邦
2.魔芋软腐病症状、影响因素与防治措施 [J], 王敏珍;刘润妮;党丹州;王珊珊;叶龙
3.魔芋软腐病症状、影响因素与防治措施 [J], 王敏珍;刘润妮;党丹州;王珊珊;叶龙
4.杀菌剂组合防治魔芋软腐病效果初报 [J], 李昕;王永久;马小玲;赵忠东
5.杀菌剂组合防治魔芋软腐病效果初报 [J], 李昕;王永久;马小玲;赵忠东
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
( u e A ae yo gi l r c ne , hn406 C ia H bi cdm f r ut a Si cs Wu a 304, h ) A c ul e n
Ab ta t y c mp r g a d a ay i g t e go t H h n e ft ep to e fs f r t ie s n A rh p a ms幻 , cu — sr c :B o a i n n zn r w h C I e c a g so ah g n o o t o s a e i mop o h l n l h V h d n d rt e s e s o i ee tc n e tain lc ma n n,t e r lt n hp b t e l c ma n n a d p t o e o o ie s a e t s fd f r n o c n r t so gu o n a h r f o f h ea i s i ewe n gu o n a n a h g n o s f r td s ae w s o f t su id h e u t s o e a : n t esa l rw h p a e o e p t o e ot o i a e h n i i r f c ) gu o n a t d e .T e rs l h w d t t i t be g o t h s t ah g n o sf r t s s .t ei h bt y ef t【 l c ma n n t s h h f h f d e o e f o te p t o e f o o i a e ga u l n r a e t h i n fgu o n a o c n rt n,b tte df r n e a n i e e t h ah g n o f r td s s d al ic e s d wi te r i g o l c ma n n c n e t i st e r y h s ao u h i e e c mo g df rn f
gu o n a o c nr to ra me t sn tsg fc nt lc ma n n c n e tain te t ns wa o ini a . i
K y w r s G u o a n n A o hp a s ojc S f rt i ae G o t Hv e o d : lcm n a ; m r oh l n ; o s s ; rw hc ie p m k a t ode
பைடு நூலகம்
间关系。结果表明 , 葡甘聚糖在魔芋软腐病病 菌生长的稳定期 , 随着浓度 的提 高抑茵能力逐渐增强 , 各浓度间差异不显著。 但
关 键 词 : 甘 聚糖 ; 芋 ; 腐病 ; 葡 魔 软 生长 曲线 中图 分 类号 :46 3 文 献标 识 码 : 文 章 编 号 :0 1 8 8 (0 1 1 0 1 0 5 3 .2 A 10 — 5 12 1 )0— 11— 2
加入葡甘聚糖的液体培养基作空 白。吸取培养液测定过 程是在无菌操作 台上完成, 但考虑到每个处理的葡甘聚 糖浓度都不一样 , 因此 , 所用枪头和移液管应在每次吸取 液体后进行更换 。同时 , 三角瓶中的液体在吸取前应适 当振荡 , 并且每次取样枪头所在位置尽量一致 每次测
l 材 料与 方 法
现在魔芋种植业面临的最 大问题 和威胁就是软腐 病, 该病害发生时产量损失 一般 在 3 % ~ 0 严重时 0 5 %, 达 8 %以上 , 0 甚至绝 收” 。针对这种情况, 魔芋 的抗病 育种显得尤为突出, 目前 中国的魔芋种质资源中只有疣 柄魔芋对该病害具有抗病性 , 但疣柄魔芋为淀粉型, 不含 葡甘聚糖 。为了解魔 芋所 含的葡甘 聚糖和软腐病病 J 菌间的关系, 本文研究了葡甘聚糖对魔芋软腐病病菌生
江西农业学报
2 1 ,3 1 ) 11~12 0 12 ( 0 :1 1
AcaAgiu ua in x t r h reJa g i e
葡 甘聚 糖对 魔芋 软 腐病 病 菌生 长 曲线 的影 响
丁 自立
( 湖北省农业科学院 , 湖北 武汉 40 6 ) 30 4
摘
要: 通过比较和分析不同葡甘聚糖浓度 下魔芋软腐病病 菌的生长曲线变化 , 究葡甘聚糖 与魔 芋软腐病病 菌两者之 研
长 曲线 的影 响 。
每个浓度做 3 , 瓶 每组重复 3 次。
15 O . D值 的测 定 和 微 生 物培 养 制 成 上述 混合 培 养
液后 即进行第 1 O 次 D值的测定 , 测定后将 5 L的三 0m
角瓶置于 2 C 8q恒温培养摇床中培养。之后 间隔 25h . 测定并记录 O D值( 8 )O 测 次 ,D值测定时以未接种且未
Efe t o uc ma na n Gr wt Cur e o t g n o o tRo f c fGl o n n o o h v fPa ho e fS f t
D saei mop o h l oj c i s A rh p amsk na e n
11 材料 . 魔芋软腐病病菌由华 中农业 大学植物科技
学院植物病理教研室提供, 葡甘聚糖为 由湖北省武汉市 强森魔芋食品有限公司提供的 K 一 O 产品规格 ) J 3( 。 12 仪器 . 分析天平 、 恒温摇床 、 分光光度计 、 无菌操作
台 、 液枪等 。 移
定完毕后 , 须用液体培养基润洗 比色杯 3次。由于分光
