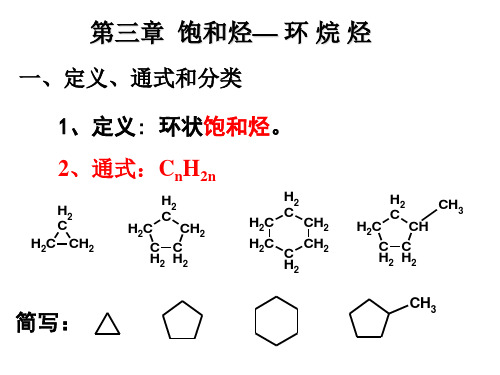
文件:第三章环烷烃
3环烷烃

环已烷及其衍生物的构象
平面结构中相邻碳形成全重叠式构象 键角为120
环己烷的椅式构象
(1) 环己烷椅式构象的画法
H 1 H H 2 H H
H
3 H H 4 H H
H 5 H 6
4 CH2 CH2 1
H H 2 3 H
H 6 H H
5
H
H
环已烷的六个碳原子都保持正常键角109°28′
a键
e键
a键转变成e键,e键转变成a键; 环上原子或基团的空间关系保持。
H3C
有二个不同取代基的环己烷衍生物
CH3 (CH3)2CH CH(CH3)2 CH3
两个规则
带有相同基团的多取代环己烷,那末在两个构象异 构体之间,总是有较多取代基取e键向位的构象为优势构 象。
带有不同基团的多取代环己烷,其优势构象总是体积 较大的基团取e键的向位。
8 7 6 5
9 10
1 2 3 4
(95%)
(5%)
4
3 5 H H 6
2 1
CH3与C3-H、C5-H有相互排斥 力,这称为1,3-二直立键作用。
CH3
(2)二取代环己烷的构象
1,2-二甲基环己烷
CH3 CH3 CH3
CH3
CH3
CH3 CH3
CH3
1,2-二甲基环己烷的平面表示法
CH3 CH3
CH3 CH3
CH3
CH3 CH3
Br
离子型 机理
+
Br2
Br
(3) 加HX:
室 温
+
HBr
CH3 CH2 CH2 Br
CH3
CH CH2 CH2
+
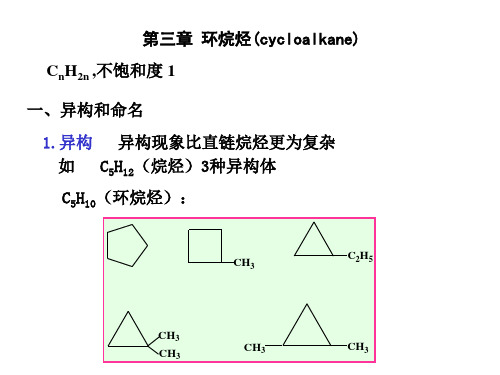
第三章 环烷烃

all hydrogens are staggered (交叉的)。 • No angle strain and no torsional strain.
讨论: 甲基环己烷分子中甲基处于e键稳定还是 处于a键稳定?
equtorial (down)
CH 3
CH3 axial (down)
*请画出叔丁基环己烷的优势构象。
构象翻转
1,3-Diaxial Interactions 1,3-二直立键
=>
Disubstituted Cyclohexanes
3
3'
环戊基环己烷 cyclopentylcyclohexane
1,1’- 联环丙基(烷) 1,1’-Bicyclopropyl 1,1’-Bicyclopropane
定义:两个或两个以上的环系各以一个碳原子用单键或 双键直接相连而成的化合物称为集合环烷烃。
第二节 单环烷烃的分类和同分异构
单环烷烃的通式:CnH2n
eg.
Br2
+HBr
CH3 (CH3)2CCHCH2Br
Br CH3
(CH3)2CCHCH3
Br
3.3 环的张力
1.拜尔张力学说(A.von Baeyer, strain theory) 环丙烷的结构
2.环烷烃的燃烧热(P45 表3.2) 3.张力能
环
产 生 张
非键相互作用(Enb):非键合的两原子或原子团距 离小于其范氏半径之和(强烈排斥)
二取代环己烷
Bulky Groups
第三章 环烷烃

1
主要内容
单环与双环的命名 小环化合物的化学性质 脂肪环的构象与稳定性因素 环己烷及其取代物的优势构象
2
§3.1 环烷烃的分类及命名
1. 环烷烃的分类
按环的大小
小环 (三元环、四元环) 常见环 (五元环、六元环) 中环 (七元环~十二元环) 大环 (十二元环以上)环烷烃
向外扩张了-5º16' 16
24º14'
9º44'
0º44'
环烷烃分子中键角与正四面体键角差值
-5º36'
角张力(angle strain):环的角度与sp3轨道夹角差别引起的张力
环的稳定性: 三元环 < 四元环 < 五元环 化学反应活性:三元环 > 四元环 > 五元环
——角张力学说的合理性 对于中等环和大环化合物,角张力学说的结论与实验 事实不符。
10
§3.2 单环脂环烃的性质
1. 自由基取代反应 : 环烷烃与烷烃相似
Br
300℃ + Br2
+ HBr
2. 加成反应
小环化合物的特殊性质-----易开环加成
11
(1) 加氢
H2 / Ni, 40oC
CH3CH2CH3
H2 / Ni, 100oC
CH3CH2CH2CH3
H2 / Pt, 300oC CH3CH2CH2CH2CH3
§3.4 脂环烃的构象
1. 环丙烷的构象
桥头碳
10 2
1
9
3
8
6
4
7
5
十氢萘
桥头间的碳原子数
(用"."隔开)
第3 环烷烃

第三章 环烷烃
• 环烷烃是环状的烷烃。环烷烃分子中碳原子相互以单键联结成闭合碳 环,其余的价全部与氢原子连接。 • 要将链状烷烃变为环状,需将链端两个碳原子上的氢原子去掉,因此 单环烷烃的通式为CnH2n。 • 多环烷烃中每成一个环,氢原子将减少两个,所以双环烷烃的通式为 CnH2n-2。 • 可想而知,环烷烃和烷烃的大多数性质相似。 • 许多有机化合物具有环状结构。
§3.4 环烷烃的稳定性和张力
环的稳定性 与环的大小 有关
环丙烷最不 稳定,环丁 烷次之,环 戊烷比较稳 定,环己烷 以上的大环 都稳定
环稳 定性
环大小
(Aldolf von Baeyer)
1885年拜尔
张力 学说
张力学说假定成环碳原子处于同一平面,并形成等边多 边形:
109.5° 49.5° 60° 109.5° 19.5° 90° 108° 1.5° 109.5°
环戊烷
甲基环丁烷
乙基环丙烷
1, 1-二甲基环丙烷 1, 2-二甲基环丙烷
1, 2-二甲基环丙烷还有顺( cis-,两个取代基在环平面同侧)、反 (trans-,取代基在环平面两侧)异构;反式-1, 2-二甲基环丙烷又有对 映异构。
顺式 bp37℃
反式 bp29℃
顺、反异 构
镜面
对映异构
顺反异构和对映异构都属于立体异构。 顺、反异构属于立体异构中的构型异构,两个顺反异构体之间要相互变 化,必须打开共价键才行,而这在常况下是不可能的。因此,二者是具有 不同物理性质的异构体。
CH3
CH3
CH3
1, 3-二甲基环戊烷
CH3
CH2CH3
反-1-甲基-4-异丙基环己烷
1,4-二甲基-1-乙基环己烷
第3章 环烷烃(武汉大学化学与分子科学学院)

饱和脂环烃— 饱和脂环烃—环烷烃 脂环烃 不饱和脂环烃—环烯烃、 不饱和脂环烃—环烯烃、环炔烃
环丙烷
环丁烷
环戊烷
环己烷
环戊二烯
环己烯
环辛炔
2
目录
3-1 3-2 3-3 3-4 3-5 小结 环烷烃的结构、分类、 环烷烃的结构、分类、异构和命名 环烷烃的稳定性与环大小的关系 环己环及其衍生物的构象 环烷烃的物理性质 环烷烃的化学性质 环烷烃的
5
环烷烃的分类 环烷烃的分类
单环 1. 按环数 二环 多环
小环( 小环(C3-C4) ) 普通环( 普通环(C5-C7) ) 中环( 中环(C8-C11) ) 大环( 大环(> C12) )
螺环:两环共用1 螺环:两环共用1个碳 2. 按环的 连接方式 螺[4.5]癸烷 癸烷 桥环: 桥环:共有两个或三个 以上的碳原子
22
环戊烷的构象:环戊烷具有信封式的构象,键角 戊烷的构象 环戊烷具有信封式的构象,
6
环烷烃的异构: 环烷烃的异构:构造异构和立体异构
构造异构: 1. 构造异构:由于环的大小及取代基位置的不同而有各 种构造异构体。 种构造异构体。 三元环最简单,无构造异构体。 ① 三元环最简单,无构造异构体。 含四个碳原子的单环烃( ),仅有 构造异构体: 仅有2个 ② 含四个碳原子的单环烃(C4H8),仅有 个构造异构体:
命名时,从桥头碳原子开始编号,从最长桥编到另一桥头碳; 命名时,从桥头碳原子开始编号,从最长桥编到另一桥头碳; 然后沿次长桥回到第一个桥头碳; 然后沿次长桥回到第一个桥头碳;再按桥渐短的次序将其余的桥 编号;按所含碳原子的总数,称为某烷。还要标明取代基的位置, 编号;按所含碳原子的总数,称为某烷。还要标明取代基的位置, 数目,名称,所含环的数目,桥的长短。 数目,名称,所含环的数目,桥的长短。
第三章 环烷烃
如何鉴别: 如何鉴别:
CH3-CH=CH2 CH3-CH2-CH3
褪褪 Br2/H2O
褪褪 KMnO4
×
褪褪
×
在强烈条件下,环烷烃也能被氧化。 在强烈条件下,环烷烃也能被氧化。 如:
OH
O
+ O2 (air)
环烷酸钴 140~180℃ ℃ 1-2.5MPa
+
氧化
HOOC
COOH
工业生产己二酸 锦纶-66单体 单体) (锦纶-66单体)
总之: 总之: 三元环的稳定性最小,最易开环; 三元环的稳定性最小,最易开环; 四元环的稳定性次之;也易开环; 四元环的稳定性次之;也易开环; 五元、六元环等,较稳定,不易开环。 五元、六元环等,较稳定,不易开环。 作业 : P73 二(4、5、6) 、 、 )
Ni + H2 200
+ 开环 加
Pt H2 300
CH3-CH2-CH2-CH2-CH3
(2)加成卤素 ) +
常温 Br2 CCl4
Br-CH2-CH2-CH2-Br
+ Br2
CCl4
Br-CH2-CH2-CH2-CH2-Br
棕红色褪去,用以鉴定环丙烷及环丁烷 鉴定环丙烷及环丁烷。 使Br2/CCl4棕红色褪去,用以鉴定环丙烷及环丁烷。
(3)加成卤化氢 )
+ HBr
CH3
CH3CH2CH2Br
+
HBr
CH3CHCH2CH3 Br
带有取代基的小环烷烃加成HX或 带有取代基的小环烷烃加成HX或Br2时,环 HX 的断裂是在取代基最多与最少的两个环碳原子 的断裂是在取代基最多与最少的两个环碳原子 加到含H多的碳上。( P67有错误 。(书 有错误!) 之间, 之间,且H加到含H多的碳上。(书P67有错误!)
第3章 环烷烃

24。44′
60。
109。28′
90。 (109。28′-90。)/ 2 = 9。44′ 108。 (109。28′-108。)/ 2 = 0。44′
24。44′
120。 ( 120。-109。28′)/ 2 = 5。16′
(109。28′-60。)/ 2 = 24。44′
成功之处:能解释大多数实验事实. 不成功之处:对五员环及六员环的推测不对. 不成功原因:把分子都看成平面,实际上除三员环外,其 它环的碳原子都不在一个平面内.
H
H
在船型构象中,有的C-H键处于重叠式。
H
H H
45
HH 3 H
HH H
6
1
HH
2
H
1
H H
6 5
CCHH22 4
2
3
H H
HH H H
第31页
3.环己烷的α键与e键
α键—竖键(或直立键) e 键—横键(或平伏键)
ee
a 5a
ae6
a e
e
ae
4
3a 2
a
1
a a
a a
a
e e
e
ee e
● 10 4__10 6 秒/次 转环
③母体:按成环碳原子总数称为 “某烷”.
第8页
7
CH1 2CH3 2 CH3
8 CHCH3 3 CH2
6
5
4
2,8-二甲基-1-乙基- 二环[3.2.1] 辛烷
定编号: 编号从一个桥头碳开始,沿最长桥到另一
桥头碳,再沿次长桥回到起始桥头碳,最后是最 短桥的碳原子.
写取代基:
将取代基位次和名称放在“二环”之前即可.
有机化学第三章环烷烃

2-甲基-4-环己基己烷 4-cyclohexyl-2-methylhexane
侧链比较简单, 以环为母体, 链为取代基,
侧链比较复杂, 以链为母体, 环为取代基。
CH3
实 例 二
CH2CH3 H3C
1,4-二甲基-2-乙基环己烷 2-ethyl -1,4-dimethylcyclohexane
CH3
螺原子
螺[2.4]庚烷
桥头碳
二环[2.2.1]庚烷
(A) 螺化合物的命名: (a) 组成环的碳原子总数命名为“某烷”,加上词头“螺”. (b) 再把连接于螺原子的两个环的碳原子数(不含螺原子),按由 小到大的次序写在“螺”和“某烷”之间的方括号里,数字 用圆点分开. 例1:
螺原子
螺[2.4]庚烷
例2:
顺反异构体
镜 面
H
CH3
H
CH3
CH3
H
H3C
CH3
H3C
CH3
顺反异构用 “顺”或“反” 注明基团相对位 置。 英文用 “cis”和“trans” 表示。
反-1,3-二甲基环戊烷(两者为对映异构体) (trans-1, 3-dimethylcyclopentane)
4
3
环丙基环己烷 cylcopropylcyclohexane
实 例 四
H3C H
CH3 H
带有二个或二 个以上取代基 时,分子有对 称性,构型用 顺、反表示(
顺-1,2-二甲基环丙烷 cis-1,2-dimethylcyclopropane
英文用 “cis”
和“trans”表 示)。
二、双环化合物的命名
其中两个碳环共用一个碳原子的叫螺环化合物. 共用两个或以上碳原子的叫桥环化合物.
有机化学课件-3-环烷烃

105.5o,H-C-H键角114º:
HH
C
H
H
CC
H
H
C-C弯曲键电子云重叠面积较链状烷烃的小,故键的稳定性
较低。
(二)环丁烷和环戊烷:
环丁烷与环丙烷相似,C-C键也是弯曲的,C-C-C键角约111.5º, 其中四个C不在同一平面。呈信封式结构。
十氢萘有两种顺反异构体:
H
顺式:
或
H
H
反式:
或
H
Bp(0C) 187.3
195.7
顺式的构象: 反式的构象:
a
H
e
H H
e
e
H
反式的十氢萘内能更低一些;
H
H
Pd
500oC
H
H
9%
91%
4
5
6
7
8
△ H[(CH2)n]
n
-697.1 -686.2 -664 -658.6 -662.4 -663.6
(kJ/mol)
从环烷烃的开环反应条件(见本章§2)及燃烧热数据可以看出: 环丙烷最不稳定,环丁烷次之,环戊烷比较稳定,环己烷以上的 大环都稳定,这反映了环的稳定性与环的结构有着密切的联系。
H
H
HH
H
HH
H
环戊烷分子中,C-C-C夹角为108°,接近sp3杂化轨道间夹角
109.5°,环张力甚微,是比较稳定的环。因此,环戊烷的化学性
质稳定。
H
H H
H
H
H H
H HH
(三)环己烷
所有键的键角都接近于理想sp3杂化的109.50,故最稳定;
第 三 章环 烷 烃(Cycloalkanes)

④. 写法:
第 三 章环 烷 烃(Cycloalkanes)
9
位次 ( 取代基位置 半
取代基名称
相
几环[a
.
b
.
c]某烷
用
字
同 的
阿
线取
除
由
桥
大
拉 )代
头
桥
伯
基
碳
到
数
合
外
小
字
并
每
桥
,
数 字
起
个
。
来 ,
桥
间
用
中
用
一
的
逗
、
碳
二 第 三 章环 烷 烃(Cycloalkanes)
10
8 H3C1 2
3
CH2
(Physical Properties,Chemical Reactions of Cycloalkanes)
1. 物理性质(自学)
2. 化学反应 1). 取代反应
+Br2 hν
Br +HBr
机理:自由基机理
取代反应一般在五、六元环上易发生。
2). 加成反应
小环易发生第加三成章环反烷 烃应(Cy。cloalkanes)
扭船式
椅式
第 三 章环 烷 烃(Cycloalkanes)
31
2. 取代环己烷的构象 1). 一取代环己烷的构象
结论:一取代环己烷最稳定构象是取代基在e键上。
例:
H HH
H H
H
H
H
H HH H
HH
95%
HH H
HH
HH
H
H H
HH H
第三章环烷烃
(2 0 0 p m )
CH3
取代基的体积越大,e键的比例越高
C(CH
3)3
~100%
2) 二取代环己烷的构象
CH3 E=10.4 kJ/mol CH3 CH3 CH3
试比较顺式和反式 1,4-二甲基环己烷的稳定性。
H3 C CH3
CH3 a CH3 a
1-甲基螺[3.4]辛烷
2.编号从连接螺碳的小环的碳开始; 3.将编号和取代基名称写在螺字前.
2.桥环烃
两个环共用两个或两个以上碳原子的多环烃。两 个碳原子之间的距离叫桥,桥的交点为桥头碳。
二环[1.1.0]丁烷 bicyclo[1.1.0]butane
CH
3
二环[2.2.1]庚烷 bicyclo[2.2.1]heptane
四元环
60°
9 °44′
0 ° 44′ -5 °16 ′
五元环 六元环
109° 8′ 2
解释了小环化合物的性质,大环化合物的出现否 定了该学说。因六元环以上的环烷烃的碳原子能以正 常的键角成键,因此稳定性很高。
2.张力因素
引起分子不稳定的因素
范德华张力 非键原子之间的距离较近时引起的排斥作用。 角张力 键张力 扭转张力
信封式
4.环己烷及其衍生物的构象 (1) 环己烷的构象 极端构象: A)椅式构象 透视式
H 2 H H 1 H H 250pm H 3 H H 5 H H 4 H H
椅式
船式 纽曼投影式
H
H
H
H H
6 1
H H H
2 5
H H
4
H
6
交叉型
3
环烷烃

Monosubstituted Cyclohexanes
• The two conformers of a monosubstituted cyclohexane are not equal in energy • The equatorial conformer of methyl cyclohexane is more stable than the axial by 7.6 kJ/mol
Conformations of Cyclobutane
• Cyclobutane has less angle strain than cyclopropane but more torsional strain because of its larger number of ring hydrogens • Cyclobutane is slightly bent out of plane - one carbon atom is about 25°above
six axial bonds perpendicular to the ring
6 个键是直立键,a键
six equatorial bonds near the plane of the ring
6 个键是平伏键, e键
Drawing the Axial and Equatorial Hydrogens
Conformational Mobility of Cyclohexane
• Chair conformations readily interconvert, resulting in the exchange of axial and equatorial positions by a ring-flip
第三章 环烷烃

H H3C
H CH3
反-1,2-二甲基环丙烷 , 二甲基环丙烷
顺-1,2-二甲基环丙烷 , 二甲基环丙烷
这种立体异构体不能通过键的旋转而互变, 这种立体异构体不能通过键的旋转而互变,称 构型异构体,或顺反异构体 或顺反异构体。 为构型异构体 或顺反异构体。
三. 环烷烃的命名
1) 单环烷烃 a. 以环所含碳原子数的多少,称为环某烷; 以环所含碳原子数的多少,称为环某烷 环某烷; b. 对环上含有取代基的环烷烃,则要表明取代基的位 对环上含有取代基的环烷烃,则要表明取代基的位 数目,名称,其命名原则与直链烷烃相同。 置, 数目,名称,其命名原则与直链烷烃相同。
H
环己烷椅式构象
平伏键
画法 直立键
H
6
H H
5 2 4
H
H
H
1
H H
3
H
H
H
H
纽曼投影式: 纽曼投影式:
投影式中, 、 、 、 四个碳原子处于垂直于 在Newman投影式中,2、3、5、6四个碳原子处于垂直于 投影式中 纸面的平面上, 、 两个碳原子一个在上 一个在下。 两个碳原子一个在上, 纸面的平面上,1、4两个碳原子一个在上,一个在下。
二. 构造异构和立体异构
1)构造异构: )构造异构: 含四个碳的一元环有两种 两种; 三元环只有一种 三元环只有一种 ;含四个碳的一元环有两种;含五 个碳的环烷烃有: 个碳的环烷烃有:
CH3
CH3
环戊烷 1-甲基环丁烷
1-乙基环丙烷
CH3
H
CH2CH3
1,1-二甲基环丙烷
H3C
1,2-二甲基环丙烷
2 3 4 5
第三章--环烷烃PPT课件

Cyclohexane
船 式 构 象 球 棒 模 型
32
Cyclohexane
船 式 斯 陶 特 模 型
33
转环作用中的能量变化
半椅式
船式
扭船式
椅式
34
环己烷的椅式构象最稳定
✓ 角张力为0
✓ 采取邻位交叉式构象,扭转张力最小
✓
1,3-二a键相互作用小。因为H原子 范德华半径小,所以范德华张力为0
环数:使环状化合物 变成开链化合物所需 打破的碳碳键的数目
单环: 如
C
H
C
2
H
2
C
H
2
(
环
丙
烷
)
、
(环 己 烷 )
二环:如
(十 氢萘) 又叫二 环[4.4.0]癸烷
多环:二环以上。 如 金刚烷
螺环:共有1个碳 如 按环的连接方式 稠环:共有2个碳 如十氢萘
桥环:共有2个以上碳原子 如
3
二. 单环烷烃的命名
1,1-二甲基-4-乙基环己烷
4-Ethyl-1,1-dimethylcyclohexane 7
例3
CH3
CH3 CH CH3
CH 3 CH 2 C CH 2 CH 3 CH 3
1-甲基-2-异丙基环己烷 1-甲基-2-(1-甲基乙基)环己烷
3-甲基-3-环丁基环戊烷 (长链作母体) 8
环烷烃顺反异构
h
C H 2 H 2 CC H C l+ H C l
甲基环己烷+氯r
+Br2
Br
3. 环烯烃的氧化
O 3 Z n /H 2 O C H 3 C O C H 2 C H 2 C H (C H 3 )C H O
第三章 环烷烃

有机化学中的同分异构现象
碳架异构体
位置异构体
( 结同 构分 异异 构构 体体 )
构造异构体
官能团异构体 互变异构体 价键异构体 构型异构体
几何异构体(不能旋转)
旋光异构体
立体异构体
构象异构体
交叉式构象 重叠式构象
电子互变异构体
* 分子式相同, 结构不同的化合物称为同分异构体, 也叫结构异构体
互变异构体: 因分子中某一原子在两个位置迅速移动而产生的 官能团异构体
那么,1,3和1,4二取代物呢?
结论:
(1)环己烷多元取代物中, e-取代基最多的构 象最稳定 (2)环己烷多元取代物中,大体积的取代基在 e-位的构象最稳定
3.环己烷环的平面表示法
3.6
多环烷烃的命名
① 螺环烃:两碳环共用一个碳原子(螺原子)
② 桥环烃:分子内环与环之间有两个或两个以上 共用碳原子的多环烃。
*若环上有取代基,则取代基的编号,名称放在母体前。若有 多个取代基:中文命名时,取代基的位次按顺序规则由小到 大排列;英文命名时,取代基的位次按英文字母排列; *编号的方式若有各种选择时, 要使取代基的号码尽可能小。
练
7 4 5 6 1 3 2
习
三环[2.2.1.02,6]庚烷
H3C
CH3
1,2,4-三甲基二环[4.3.0]壬烷
1、螺环烷烃的命名步骤
(1) 确定母体烃的名称:根据成环碳原子的数目确定母体烃的名称。
(2) 确定螺数:根据螺原子的个数分为单螺,二螺,三螺等。
(3) 编号: 编号从与端螺原子相邻的一个碳原子开始,沿多环的 边使所有的螺原子位号都尽可能小的路径编号。 (4) 标明结构:确定方括号内的数字,顺着环的编号次序,用数字 表明螺原子之间的碳原子数目,依次写在方括号内。 (5) 写出母体的名称:螺数、带有数字的方括号、母体烃的名称 三部分共同组成母体的名称; (6) 若有取代基,取代基的编号和名称放在母体前。若有多个取代 基,中文命名时,取代基的位次按顺序规则由小到大排列。英 文命名时,取代基的位次按英文字母排列。编号的方式若有各 种选择时, 要使取代基的号码尽可能小。
第三章环烷烃

CH3 CH3 H H CH3 H
H CH3
H
H
顺式(较稳定)
CH3
1,4-二甲基环己烷
CH3
CH3 H H
CH3 CH3
顺式(较不稳定)
反式(较稳定)
H
H
CH3 H CH3 CH3 H
H
CH3 H
CH3 (CH3)3C H H
C(CH3)3 H CH3 H
①具有相同取代基时,e键上取代基越多的构象越稳定。 ②取代基不同时,较大取代基在e键上的构象较稳定
环丁烷:与环丙烷相似,环丁烷分子中也存在着张力, 但比环丙烷的小,在环丁烷分子中四个碳原子不在 同一平面上
90
o
Eф ≠0
Eθ ≠ 0
El ≠0
Enb ≠ 0
折叠构象
平面构象
折叠构象
根据结晶学和光谱学的证明,环丁烷是以折叠构象 存在的,这种非平面型结构可以减少C-H的重叠, 使扭转张力减小。折叠构象与平面构象能量相差 较小(6.3kJ/mol),因此在平衡混合物中,平面构 象也占一定比例,
CH(CH3)2
约占97% >99.99%
C(CH3)3
如果环己烷上有叔丁基,一般叔丁基总是在e键。 X (书上P51)
X (CH3)3C 反式e-X (CH3)3C 顺式a-X
二、二取代 环己烷的构象 (书上P52) 1,2-二甲基 环己烷
1,3-二甲基环己烷
反式(较不稳定)
H CH3 H CH3 CH3
CH3 H
CH3 H cis-
mp:-87℃ bp:124℃
mp:-37.1℃ bp:119.4℃
二、环烷烃的命名 与烷烃相似,某烷前面加“环”,有取代基时, 标出取代基位置(自学)。 第二节 环烷烃的物理性质和化学性质
《chapter3环烷烃》PPT课件

22
Br Br2
Br
精选课件ppt
23
(3) 与卤化氢反应
主要产物为:溴加到含氢少的碳上
精选课件ppt
24
(4) 氧化反应(小环对氧化剂相当稳定)
O
O
O2
+
O
? 原因:
(考虑羰基碳的杂化)
精选课件ppt
25
3.4 环的张力
3.4.1 拜尔张力学说
1880年以前,只知道有五元环,六元环。 1883年,W.H.Perkin合成了三元环,四元环。 1885年,A.Baeyer提出了张力学说。
精选课件ppt
11
H3C H
CH3 H
顺-1,2-二甲基环丙烷
实
cis-1,2-dimethylcyclopropane
例
三
H
CH3
H3C
H
反-1,2-二甲基环丙烷 trans-1,2-dimethylcyclopropane
精选课件ppt
带有二 个或二 个以上 取代基 时,构 型用顺 反表示 。
从现在的角度看,三员环的张力能是由以下几种因素造成的:
1 由于二个氢原子之间的距离小于范德华半径之和,所以产生
非键连作用,造成内能升高;Enb 2 轨道没有按轴向重迭,导致键长伸长或缩短,电子云重叠
减少,造成内能升高;El 3 E是由于偏转角引起的张力(即角张力)能。 4 E是由全重叠构象引起的。
张力能 = Enb(非键连作用) + El(键长) + E(键角) + E(扭转角)
45 3
6 7
2 19 8
二环[ 4.3.2]十一烷
8 CH3 Cl 6 5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章环烷烃
教学目的与要求:
1.掌握环烷烃的构造异构和顺反异构及其命名方法;
2.了解环烷烃的物理性质,掌握环烷烃的化学性质;
3.理解环的张力;
4.掌握环己烷和取代环己烷的的构像;
5.了解多环烃命名方法。
教学重点、难点:
环烷烃的化学性质;环己烷和取代环己烷的的构像。
环烷烃是指分子中碳原子以单键互相连接成闭合的碳环,剩余的价完全与氢原子相连。
将链烃变为环烃,要在分子中增加一个碳-碳单键,同时减少两个氢原子,因此,单环烷烃的通式为C n H2n 。
§ 3.1环烷烃的异构和命名
3.1.1 环烷烃的异构
1.构造异构:环烷烃由于环的大小,侧链的长短及位置的不同而产生构造异构体。
C3H6
无构造异构
C4H8
C5H10
2. 顺反异构
1,4-二甲基环己烷分子中,两个甲基可以在环平面的同侧,也可以在环平面的异侧,形成顺反异构:
333
3
顺反异构体由于环的存在,不能互变(断键)。
其物理性质有差异。
3.1.2 环烷烃的命名 1.单环体系
1)根据环中碳原子数目叫做环某烷。
2)有取代基时,编号应使取代基位次尽可能小。
3)有不同取代基时,编号从小基团开始。
CH 3
CH 3
CH 3
CH 3
CH 2
CH
CH 3
1-甲基-3-乙基环戊烷 1-甲基-4-异丙基环己烷
2. 顺反异构体命名时,取代基在环平面同侧称顺式(cis-),异侧称反式(trans-)。
3
3
3
3
顺-1.4-二甲基环己烷 反-1.4-二甲基环己烷
为书写方便,环烷烃常用键线式:
戊烷
3-环己基己烷
§3.2 环烷烃的物理性质和化学反应 3.2.1 环烷烃的物理性质
环烷烃的熔点、沸点和比重都较相应的开链烷烃高。
因环烷烃的环状结构,分子较有序,排列较紧密,分子间作用力较大。
而直链烷烃分子自由摇摆,有序度小,分子间作用力较弱,故熔点、沸点和比重较小。
3.2.2 环烷烃的反应
环烷烃与直链烃结构相似,所表现出的化学性质也相似(常温下,不与强酸、强碱、强氧化剂、强还原剂起反应,可以起燃烧、热解、卤代等反应)。
三元环和四元环等小环化合物有一些特殊的性质,即容易开环生成开链化合物。
1. 氢解
+
+
+
H 2
H 2
H 2
Ni Ni 。
CH 3CH 2CH 3
CH 3CH 2CH 2CH 3
CH 3CH 2CH 2CH 2CH 3
2. 加溴
+
+
+
BrCH 2CH 2CH 2Br
Br 2
Br 2
Br
2
Br
hv
Br
Br
+
Br 2
Br
Br
3. 加溴化氢
+
CH 3CH 2CH 2Br HBr
+
CH 3CH 2CHCH 3
CH 3
HBr
4. 氧化
三元环烷烃对氧化剂相当稳定:
+
O
O
O
2
§ 3.3 环烷烃的来源和用途(阅读)
§ 3.4 环的张力
3.4.1 拜尔张力学说
由环烷烃的化学性质可看出,环的稳定性与环的大小有关。
小环不稳定,大环较稳定。
为了解释这一事实拜尔在1885年提出了张力学说。
1.假定成环的碳原子都在同一平面上,并排成正多边形;
2.环中碳-碳键键角的变形会产生张力。
环中碳-碳键键角的偏转程度:
正常键角:109028ˊ109028ˊ109028ˊ109028ˊ
实际键角:60090010801200
偏转程度:+24044ˊ+9044ˊ+0044ˊ-5016ˊ
示意图:
028ˊ
240
3. 张力使环的稳定性降低,张力越大,环的反应活性也越大。
张力环为减小张力,有生成更稳定的开链化合物的倾向。
与正常键角偏差越大,环张力越大,越易起开环反应。
角向内压缩,负值表示键角向外扩张。
根据张力学说,环己烷以上因键角向外扩张而存在张力,且环越大,键角扩张越大,环越不稳定,而事实上,它的都是稳定的。
拜尔张力学说对小环的结论是正确的,但无法解释负环以上大环的稳定性,其原因是成环碳原子都处于同平面这个假设是错误的,它们实际上是不共平面的。
3.4.2 环烷烃的燃烧热
小环烷烃不稳定,内能较高,燃烧热数值大。
主要由张力能引起。
由燃烧热数值可得出,张力越大,环越不稳定,张力越小,环越稳定,环己烷,及大环烷烃几乎为无张力环,都很稳定。
3.4.3 张力能
有机化合物中能产生张力的因素有四种:
1.非键作用
分子中两个非键合的原子或原子团由于几何原因互相靠近,当它们之间的距离小于两者范德华半径之和时,这两个原子或原子团就强烈的互相排斥,由此引起的体系能量的升高用E nb 表示。
2.键长变化
分子中由于几何原因,必须使某一个键伸长或缩短,体系能量随之升高,用El 表示。
3.键角变化
分子中由于几何原因要使键角的大小发生变化,就引起的体系的能量升高,用E θ表示。
4. 扭转角变化
分子中由于几何原因,使扭转角发生变化就引起能量升高,用E φ表示。
如环癸烷:
HH
H
H H H
§3.5 环己烷的构象
3.5.1 椅式构象
H H
H H H
H H H H
H
H H
H
球棍模型 透视式 纽曼投影式
椅式构像中,碳原子1,3,5在同一平面上,2,4,6在同一平面上:
4
直立键
平伏键
e
e
3.5.2 船式构象
H
H
球棍模型 透视式
纽曼投影式 3.5.3扭船式构象
球棍模型 透视式
室温下,环己烷的椅式构像通过环的翻转,变成另一椅式构像:
H
H
室温下,环己烷的椅式构像约占99.9% 。
§3.6 取代环己烷的构像分析
3.6.1 一取代环己烷
两种构像形成动态平衡:
CH 3
CH 3
95%
5%
构像所占的百分数不同,是因为取代基上的氢原子与邻近氢原子间存在的排斥作用不一样:
H
H H
H H
H
C
e-甲基
a-甲基
e-取代排斥作用小,a-取代排斥作用大。
再如:
H
H
C C(CH 3)3
3
3
CH 3>99.99%
3.6.2 二取代环己烷
ae 型
ae 型
aa 型
ee 型
H
CH 3
CH 3CH 3
CH 3
H H
H
H
CH 3
CH 3CH 3
CH 3
H H H
顺-1,2-二甲基环己烷 反-1,2-二甲基环己烷
稳定性: 顺-1,2-二甲基环己烷 < 反-1,2-二甲基环己烷 原 因: 反-1,2-二甲基环己烷稳定构像中, e-键甲基比顺-1,2-二甲基环己烷多。
3.6.3 环己烷的平面表示方法
3
3
3
3
3
3
§3.7 其它单环环烷烃的构像
3.7.1 小环
3.7.2 环戊烷
信封式
§3.8 多环烃 §3.8.1 多环烃的命名
1. 螺环:两环共用一个碳原子的环烷烃。
(1) 根据碳原子数,称螺某烷,在方括号中标出除共用碳以外两环的碳数。
(2) 编号从较小环中与共用碳相邻的碳原子开始,从小环经共用碳到大环,并使取代基位数最小。
CH 2CH 2
CH 2CH 2
CH 2CH 2CH 2CH 2
C
CH 2CH 2
CH 2CH 2
CH 2
CH 2CH 2
C
螺 [ 4.4 ] 壬烷
螺 [ 3.4 ] 壬烷
CH 2CH 2
CH 2CH 2
CH 2
CH 2
C
CH 3
1-甲基 螺 [ 3.4 ] 壬烷
2. 桥环:两环共用两个以上碳原子的环烃。
(1)以环数为词头,按环上碳总数称某烷。
(2)找出桥头碳,排出长短桥,编号从桥头开始从大桥到小桥,并使取代基位数最小。
(3)方括号内由大到小注明各桥的碳数。
2
10
5
9
1
3
7
6
8
4
二环[ 2.2.1 ] 庚烷二环[ 4.4.0 ] 癸烷三环[ 3.3.1.13,7 ] 庚烷§3.8.2 十氢萘
顺和反十氢萘的平面投影式:
或
H
H H
顺十氢萘反十氢萘用圆点表示向上方申出的氢:
顺十氢萘反十氢萘。
