KE6有效性鉴定
KLF3基因3'-UTR区双荧光素酶报告载体及其突变载体的构建与活性鉴定

()2
TG$VVHF"EVF,,7VVRFDDE,#-VHUF,H7" AO9*I7-7*a!NT; "F9DDF,$R7U9V7U7A#UH7UZ7,H#U9-"$HV :FH9H$#-Z7,H#U&<U7D$:$-9UE7Z$"7-,7VG#W7"HG9H:$;!0%,#FD"U7IFD9H7HG77XAU7VV$#-#RAO9* I7-7' H6BF/:>4$AO9*I7-7&"F9DDF,$R7U9V7U7A#UH7UZ7,H#U&:$;!0%&*a!NT;
中 国 畜 牧 兽 医 !!"#$!%%"&#$'%%!'K"
!"#$%&$#'%()*+,%$-./ 0 1232.#$%./ 42-#5#$2
"#$$%&'%()*%%+',-.$'%(/%!/0*('0&%/'&*'&&)
/01&基因&VUX3J 区双荧光素酶报告载体及其 突变载体的构建与活性鉴定
张 明 新 "%B(0!#!男 !辽 宁 昌 图 人 !学 士 !研 究 员 !研 究 方 向 $毛 羊 育 种 与 生 产 !C!:9$D$[::$-!%(*',#:
Copyright©博看网. All Rights Reserved.
!* 期
翟!博等$AO9*基因*a!NT; 区双荧光素酶报告载体及其突变载体的构建与活性鉴定
<=; 扩 增 体 系 *& %J$2 \ <GFV$#- 8FRR7U (%J!0'2 ::#D%J"4T< M$X0')%J!上(下 游 引 物 "%& %:#D%J#各 % %J!<GFV$#- 345 聚 合 酶 "0N%%J#&'*%J!345 模板"约%&&-I#%%J!灭菌 水补足体 系' 首 先 进 行 降 落 <=;!之 后 对 <=; 产 物进行 纯 化' 用 M":# 和 D:3# 对 <=; 产 物 和 载 体进行双酶切!酶切反应体系)&%J$%&\Q 缓冲 液 )%J!345 约 0%I!内 切 酶 "%& N%%J#各 %%J!双 蒸水补足体 系'*/ ^ 酶 切 )G 后 进 行 回 收 纯 化 与 连接'连 接 反 应 体 系 %& %J$目 的 片 段 345"约 %2&-I#0%J!载体"约2&-I#&'2%J!>#DFH$#- #快 速连接液2%J!双蒸水补足体系'%( ^连接*&:$后进行转化及菌液 <=; 鉴定!并送广州市锐博生 物 科技有限公司测序!测 序 鉴 定 正 确 的 重 组 载 体 命 名
SOP的管理

SOP的管理The management of SOP1.目的- PURPOSE规范Botny SOP的书写要求,确保SOP系统的有效管理,确保只有规范的唯一的有效的完整的SOP及其附件被操作人员使用。
2.责任- RESPONSIBIRITYSOP管理人:按照本SOP的要求,确保公司SOP系统的有效运行。
SOP作者:负责按照标准样式的要求书写或改写SOP。
部门负责人:负责审核新作成的或修改后的SOP。
QA经理:负责批准新作成的或修改后的SOP。
培训负责人:负责确保新作成的或修改后的SOP在生效前及时正确地完成了培训。
各部门人员:必须严格遵照SOP文件管理的要求查阅或使用SOP。
各部门人员有权利在发现现行SOP不符合实际操作时要求SOP作者修改SOP。
3. 范围- SCOPE适用于Botny所有的SOP的形成以及管理。
4. 操作程序- OPERATION PROCEDURE一SOP的标准样式所有SOP的式样必须按照(附件1)SOP标准样式中的形式的形成。
SOP一般由标题栏,内容部分,考核问卷和附件四部分组成。
1.SOP的标题栏内应包括以下内容,最终发布的SOP以下内容都必须填写完成。
1) SOP NO:SOP的管理编号。
2) 标题:SOP的标题名。
3) 版数:SOP的当前版本号,每次SOP的修改都需要更改版本号。
4) 作者:SOP的作者或是最新版本的修改人姓名。
5) 作成时间:本次SOP的作成日期,若是修改则为本次修改的日期。
6) 页码:SOP的页码及总页数。
7) 年限:该SOP的有效年限,SOP的有效期即SOP的生效日期加上有效年限。
8) 部门负责人的审核及日期:部门负责人的签字及审核的年月日。
9) QA经理的批准及日期:QA部长的签字及批准的年月日,如为QA部所属SOP,QA经理亦需要签属部门负责人承认栏。
10) 发布日期:SOP原件及复印件分发的日期。
2. 在SOP内容部分中一般需记入的内容如下:1) [目的- PURPOSE]一项中,记入这个SOP编写的目的。
bartha-k61质量标准

bartha-k61质量标准
Bartha-K61 是一种常用的鼠伤寒沙门氏菌(Salmonella typhimurium)突变株,常用于检测抗药性和抗生素敏感性。
其质量标准通常包括以下方面:
纯度:Bartha-K61 应该是纯净的,没有其他细菌或杂质污染。
生长特性:Bartha-K61 应该具有良好的生长特性,能够在适当的培养基上快速生长。
抗药性:Bartha-K61 应该具有特定的抗药性,例如对氨苄西林和氯霉素的抗药性。
抗生素敏感性:Bartha-K61 应该对特定的抗生素敏感,例如对链霉素和庆大霉素的敏感性。
稳定性:Bartha-K61 应该具有良好的稳定性,能够在适当的条件下长期保存。
这些质量标准通常由相关的实验室或机构制定,并通过严格的质量控制程序来确保 Bartha-K61 的质量。
Validation(有效性鉴定

Validation(有效性鉴定Process Validation有效性鉴定P rocess V alidation 有效性鉴定About The Course关于该培训Background for the training背景–P&G QAKE KE6Not a Training but a forum讨论?Raise question any time欢迎提问?Time:2-3hrsObjective学习本课程要求达到的⽬标1.有效性鉴定的基本概念和其重要性2.有效性鉴定的种类和⽅法。
3.有效性鉴定系统和主计划4.编写与执⾏有效性鉴定协议草案与报告What is Validation?什么是有效性签定什么是有效性签定??Validation is establishing documented evidence that a specific process will consistently produce a product meeting its pre-determined specifications and quality attributes.有效性签定是⽂件化地证实⼀个⼯艺过程能够持续地⽣产符合既定规格或质量要求的产品. ProcessMaterial Machine MethodProductEquipmentdesign features(e.g.ProcessConditions(e.g,temp,Physical property orfunction of material(e.g.,thickness,Actions criticalfor quality(e.g.,positioning,Skillsrelated toQ-TasksMachine Material Methods huMan What is Process?什么是⼯艺过程Why Important为什么有效性鉴定重要Cost(minimize re-work,reduce scrap)by process control成本(减少返⼯,报废)Those not be able to be verified by inspection某些不能事后检验Quality(guarantee quality product to the consumer–same quality every time)保证向⽤户提供优质稳定产品Speed to the market(do it right1st time)加速进⼊市场(⼀次做好)Regulatory Basis(the law)法规的需要Food and Drug Requirement(Drugs&Devices)药品和医疗器械要求Required by P&G(via the Key Elements)Any system that is designed to deliver specific conditions for the production of a specified product.任何设计⽤于为⼀个专门产品的⽣产提供专门条件的系统。
宝洁19要素培训

证每个人都了解他/她在研发、生产等中的职责 2. 必须有系统去确保所有(包括合同商、临时和兼职人员)和产品
质量或质量数据相关的员工有足够的培训和经验来完成赋予给他 们的工作 3. 必须有系统去确保新员工在开始工作之前已知道自己的工作职责 和期望 4. 培训讲师应是考核合格的老师,适当地,培训老师应在培训技巧 方面也是考核合格的 5. 培训效果必须通过笔试或实地评估进行检验 6. 未经考核的员工不应被允许去执行或参与任何与产品质量或质量 数据的工作,除非在考核合格的人员的直接监督下
关人员和部门,包括客户。 6. 如果要求,规格和标准应包括任何特殊的原材料和产品的储存条件。
2012~2013年 宝洁QAC审核问题点汇总-140509
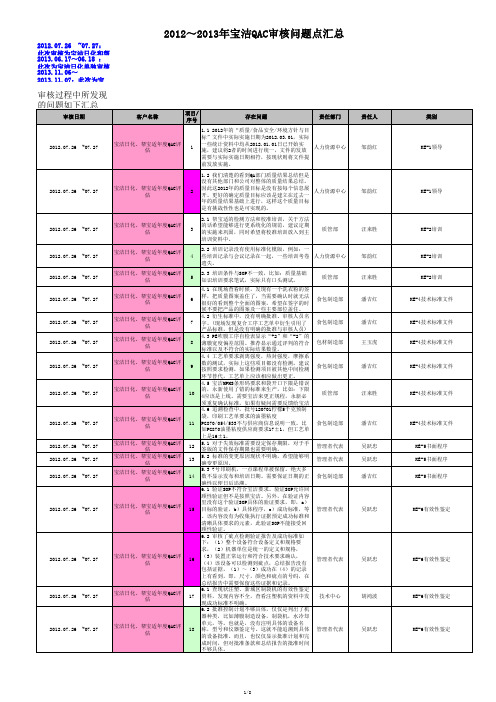
邹韵红
2012.07.26
~07.27
5
汪来胜
2012.07.26
~07.27
6
食包制造部
潘吉红
2012.07.26
~07.27
7
食包制造部
潘吉红
2012.07.26
~07.27
8
包材制造部
王玉虎
2012.07.26
~07.27
9
食包制造部
潘吉红
2012.07.26
~07.27
宝洁日化、帮宝适年度QAC评 估
32
2012.07.26
~07.27
33
2012.07.26
~07.27
34
质管部
汪来胜
2012.07.26 2012.07.26 2012.07.26
~07.27 ~07.27 ~07.27
10
质管部
汪来胜
2012.07.26
~07.27
宝洁日化、帮宝适年度QAC评 估 宝洁日化、帮宝适年度QAC评 估 宝洁日化、帮宝适年度QAC评 估 宝洁日化、帮宝适年度QAC评 估
11
食包制造部
潘吉红
2012.07.26 2012.07.26 2012.07.26
~07.27 ~07.27 ~07.27
24
行政中心
汪辉
2012.07.26 2012.07.26
~07.27 ~07.27
25 26
财务中心 食包制造部
吴旭峰 潘吉红
2012.07.26
~07.27
27
/
2012.07.26 2012.07.26
~07.27 ~07.27
28 29 30
常见阳离子的鉴定实验报告

常见阳离子的鉴定实验报告实验名称:常见阳离子的鉴定实验实验目的:通过化学反应和实验方法,鉴定出一系列常见阳离子。
实验原理:常见阳离子包括铵离子NH4+、钠离子Na+、钾离子K+、铜离子Cu2+、铁离子Fe3+等。
鉴定方法:1. 铵离子的鉴定铵离子可以通过氢氧化铜蓝色沉淀方法鉴定。
加入少量2N氢氧化钠,然后再加入氢氧化铜试液,如果出现蓝色沉淀,则证明存在铵离子。
2. 钠离子的鉴定钠离子可以通过焰色反应鉴定。
将盐酸、钠离子样品和硫酸镁混合均匀后,将其加入火焰中,观察火焰颜色。
钠离子会使火焰变成黄色。
3. 钾离子的鉴定钾离子也可以通过焰色反应鉴定。
将氢氧化钾或氯化钾和硫酸镁混合均匀后,加入火焰中,观察火焰颜色。
钾离子会使火焰呈现紫色。
4. 铜离子的鉴定铜离子可以通过加入氢氧化钠或氢氧化钾方法鉴定。
当氢氧化钠或氢氧化钾加入到铜离子试液中时,产生的深蓝色就证明存在铜离子。
5. 铁离子的鉴定铁离子可以通过加入氢氧化钠和苦味酸方法鉴定。
在铁离子试液中加入氢氧化钠,使其变成氢氧化铁,并产生褐色沉淀。
然后,加入少量苦味酸,产生的红色就证明存在铁离子。
实验步骤:1. 铵离子的鉴定取少量铵离子试液,加入2N氢氧化钠,然后滴加氢氧化铜试液。
如果出现蓝色沉淀,则证明存在铵离子。
2. 钠离子的鉴定取少量钠离子试液,加入盐酸和硫酸镁混合液,然后加入火焰中。
观察火焰颜色,如果呈现黄色,则证明存在钠离子。
3. 钾离子的鉴定取少量钾离子试液,加入氢氧化钾和硫酸镁混合液,然后加入火焰中。
观察火焰颜色,如果呈现紫色,则证明存在钾离子。
4. 铜离子的鉴定取少量铜离子试液,加入氢氧化钠或氢氧化钾试液,产生深蓝色即证明存在铜离子。
5. 铁离子的鉴定取少量铁离子试液,加入氢氧化钠,使其变成氢氧化铁,并产生褐色沉淀。
然后,加入少量苦味酸,产生红色即证明存在铁离子。
实验结果:本次实验,通过化学反应和实验方法,鉴定出了铵离子、钠离子、钾离子、铜离子、铁离子等常见阳离子,其中铵离子表现为蓝色沉淀,钠离子表现为黄色火焰,钾离子表现为紫色火焰,铜离子表现为深蓝色,铁离子表现为褐色沉淀和红色。
HPV E6E7 mRNA检测在宫颈高级别病变筛查中的应用分析

浙江临床医学2021年3月第23卷第3期.417 .•检测诊断•HPV E6/E7 mRNA检测在宫颈高级别病变筛查中的应用分析厉瑶胡旻胡美旭陈盼【摘要】目的探讨H P V E6/E7m R N A检测在宫颈高级别病变筛查中的应用方法回顾性分析2018年丨月至2019年12月病理检查确诊为宫颈高级别病变[即宫颈上皮内瘤变彡11级((:旧11 + )]丨596例患者的临床资料,比较确诊前1年内1^)¥丨)\八、1^〃£6/£7111丨:^八检测以及液基薄层细胞学检查(T C T)结果,结果T C T、H P V D N A及H P V E6/E7m R N A检测的漏检率分别为17.31%、8.04%、3.39%,H P V E6/E7m R N A检测漏检率低于T C T检查和H P V D N A检测(P<0.05 ) 三者联合检测漏检率为0%.结论H P V E6/E7 m R N A检测比H P V D N A及T C T的漏检率低,选择H P V E6/E7 m R N A检测联合T C T检查能提高宫颈病变筛查的准确率【关键词】宫颈病变筛查H P V E6/E7 m R N A检测液基薄层细胞学检查[A bstract ] Objective T o e x p l o r e t h e a p p l i cati on o f H P V E6/E7m R N A d e t e c t i o n in cervical h i g h-g r a d e lesion sc r e e n i n g.Methods F r o mJ a n u a r y2018to D e c e m b e r 2019,Clinical d a t a o f 1596patients w i t h cervical h i g h-g r a d e lesions ( cervical intraepithelial n e o p l a s i a g r a d e II a n d a b o v e (C I N I I+)) in J i n h u a M u n i c i p a l C e n t r a l H o s p i t a l w e r e r etro spe ct iv el y a n a l y z e d.T h e results o f H P V D N A,H P V E6/E7m R N A tests a n d liquidb a s e d thin layerc y t o l o g y( T C T )tests w e r e c o m p a r ed in t he first y e a r b ef o r e diagnosis. R e s u l t s T h e m i s s e d d e t e c t i o n rates o f T C T,H P V D N A a n dH1》V E6/E7m R N A w e r e17.31%( 31/179 ),8.04%( 9/112 ),3.39%( 2/59 ) •丁h e m i s s e d d e t e c t i o n rate o f'H P V E6/E7m R N A d e t e c t i o n w a s significantly l o w e r t h a n that o f T C T a n d H P V D N A d ete ction. T h e m i s s i n g d e t e c t i o n rate o f H P V E6/E7 m R N A+T C T+H P V D N A w a s 0( 0/250 ).C o n c l u s i o n T h e m i s s i n g d e t e c t i o n rate o f H P V E6/E7 m R N A is l o w e r t h a n H P VD N A a n d T C T. S e l e cti o n o f H P V E6/E7 m R N A c o m b i n e d w i t h T C Twill i m p r o v e t h e a c c u r a c y o f cervical scr e eni ng.【Key words】C e r v i c a l l esion S c r e e n i n g H P V E6/E7 m R N A liquid b a s e d t hin layer c y t o l o g y子宫颈癌具有高发病率和高致死率。
有效期的测定

稳定性研究设计的要点
样品的批次和规模 包装和放置条件 考察时间点 考察项目 分析方法
考察项目
一般来说,药物 药物制剂的“显著变化”包括: 药物 1、含量测定 测定中发生 10%的变化(特殊情况应 测定 加以说明)。 2、任何一个降解产物超出标准规定。 3、性状、物理性质以及特殊制剂的功能性试 验(如颜色、相分离、再混悬能力、结块、硬 度、每揿给药剂量等)超出标准规定。 4、pH 值超出标准规定; 5、制剂溶出度或释放度超出标准规定。
思考题
1. 使用的50ml的磨口瓶为什么要事先干燥? 2. 取样分析时,为什么要先加入铁试剂和硫酸 溶液,然后对反应液进行比色分析? 3.请查阅资料,除了光度法,还可以用什么 方法来测定药物的有效期?并给出预习报告.
参考方法1 参考方法
康胃胶囊有效期的评价
作者单位:510006广州,广东药学院药物研究所 (余楚钦 林华庆);广州 固志医药科技有限公司 (邱五龙)
___康胃胶囊是由延胡索、甘草等组成的复方中药制剂 康胃胶囊是由延胡索、甘草等组成的复方中药制剂,
嗜酸耐热菌的检验方法

文件编号:TD/QM JB 05 2011 版本号: 3
嗜酸耐热菌的检验方法
1、 范围
本方法适用于浓缩果汁加工过程中,清(浊)汁、终产品以及其它被怀疑污染样品的测试程序。
还包括了环脂芽孢杆菌的鉴别确认。
果汁加工过程嗜酸耐热菌的监控可参照本测试方法。
当计算结果不是整数时,按四舍五入制计算结果,以整数的近似值来作为最终计算结果。在上
∑ ∑ 述公式中,也可以 C 或 a 来计算样品中存在的符合鉴定的环脂芽孢杆菌数。
根据确认试验结果,按以下方式记结论
·若使用 A 类样品的检验,在 20 克浓缩汁或 100mL 清汁、水样品中有“x”个环脂芽孢杆菌检出 (未
±0.1。经 121℃、15min 高压灭菌。
4. 3 K 氏平板(简称:K 板)
成分
蛋白胨
5.0g
酵母粉
2.5g
葡萄糖
1.0g
琼脂
15.0g
吐温 80
1.0mL
蒸馏水
1000 mL
制法
将各种成分混合于水中,加热搅拌使其溶解,经 121℃、15min 高压灭菌后,用苹果酸溶液调整
PH 值为 3.7±0.1,制成平板。
pH 计或精密 pH 试纸。
真空泵。
溶剂过滤器。
三角瓶,250mL 和 1000mL。
培养皿,Ø90mm。
滤膜,孔径 0.45µm Ø50mm。
灭菌镊子。
温度计,校准状态下。
涂布棒,L 型。
玻璃样品瓶,250mL。
酒精灯。
4、培养基和试剂
4.1 YSG 平板(简称 G 板)
成分
A: 酵母粉
一株鸭肝炎病毒的分离与鉴定

一株鸭肝炎病毒的分离与鉴定孙林杰;王雪平;宋国亮;陈凌燕;焦金波;白朝勇【摘要】从山东某养殖场送检的疑似鸭病毒性肝炎病料中分离到一株病毒(暂命名为SD株),分别用鸭胚、雏鸭进行传代和病毒含量测定,E1~E8代鸭胚适应毒的ELD50在10-5.0 ~ 10-60/0.1 mL之间,E1、E2代鸭肝组织毒的LD50分别为10-5.5/0.1 mL、10-6.7/0.1 mL.动物回归试验结果表明,SD株鸭胚适应毒E2对4日龄雏鸭的致死率为100%;雏鸭毒力测定试验结果表明SD株雏鸭肝组织毒E2代对12日龄内雏鸭具有较高致死率,12日龄后随着日龄的增大,雏鸭的死亡率逐渐降低;理化特性鉴定结果表明,SD株为无囊膜病毒,对脂溶剂(乙醚和氯仿)、胰酶、酸、热均不敏感,且无血凝性.血清交叉中和试验和交叉保护试验结果表明,在血清型上,SD株与DHV-1无关.通过对SD株与韩国N-DHV VP1基因的序列比对和进化树分析,发现二者同源性在99%以上.结果证实,SD株是新型鸭病毒性肝炎病毒,而不是DHV-1.【期刊名称】《中国兽药杂志》【年(卷),期】2014(048)004【总页数】5页(P19-23)【关键词】新型鸭肝炎病毒;分离与鉴定;理化特性【作者】孙林杰;王雪平;宋国亮;陈凌燕;焦金波;白朝勇【作者单位】国家兽用药品工程技术研究中心,河南洛阳471000;国家兽用药品工程技术研究中心,河南洛阳471000;国家兽用药品工程技术研究中心,河南洛阳471000;普莱柯生物工程股份有限公司,河南洛阳471000;国家兽用药品工程技术研究中心,河南洛阳471000;国家兽用药品工程技术研究中心,河南洛阳471000;国家兽用药品工程技术研究中心,河南洛阳471000;普莱柯生物工程股份有限公司,河南洛阳471000【正文语种】中文【中图分类】S858.32鸭肝炎(DH)是一种传播迅速并高度致死雏鸭的疫病,以肝炎为主要特征[1],主要侵害4周龄内雏鸭,特别是不足1周龄的雏鸭最易感染,死亡率高达 90% 以上[2]。
人类17_羟基类固醇脱氢酶的功能(1)

法, 它 被 命 名 为 AKR1C3。17β- HSD5 高 C7 黄体激素 ( 20α- HSD 和 21–HSD) 和
表 达 在 睾 丸 组 织 和 性 腺 外 组 织 , 象 前 列 C7 胆汁酸的另外活性 。 [12,24] 神经 变 性 进
腺的基底细胞、肾上腺和肝, 它通过 展的原因和药理学的抑制有效性仍需要
绝 经 后 的 妇 女 几 乎 100%的 性 激 素 在 性 P450CYP19 单 向 芳 香 化 分 别 生 成 E1 和 3α和 17βHSD 的 活 性 , 能 催 化 氧 化 反 应
腺 外 组 织 被 生 成 , 这 两 个 事 实 突 出 了 E2[8], E1 的 氧 化 生 成 具 有 生 物 活 性 的 E2 灭 活 雄 激 素 和 E2。 后 来 17β- HSD10 的
3 人类 17β- HSD 3.1 17β- HSD1 17β- HSD1 是 最 先 被 克 隆 和 阐 述 其 结 构 特 征 的 17β- HSD, 它 以 可 活 化 的 二 聚体形式存在, 主要 作 用 是 通 过 NADPH 来催化还原 E1 和 E2, 也有将 A2 转化为 T 的次要作用。17β- HSD1 主要在人卵巢 的粒层细胞、乳腺组织和胎盘的合胞体 滋养层中表达, 并且这个表达形式和优 先的还原反应直接使它成为周缘和性腺 E2 合成的关键物[2]。 3.2 17β- HSD2 17β- HSD2 被 克 隆 来 自 于 人 类 前 列 腺 cDNA 文 库 ,[14] 它 通 过 NAD ( H) 参 与 E2、T 和 DHT 的 灭 活 和 排 泄 , 以 及 黄 体 酮 的 活 化 。17β- HSD2 广 泛 表 达 在 人 类 的 各 种 组 织 , 象 乳 腺 、子 宫 、前 列 腺 、胎 盘 、肝 、肠 和 肾 脏 。17β- HSD2 不 但 能 够 限制活跃的性甾体进入血液循环, 而且 能通过催化雄激素和雌激素转变为低活 性的形式来保护激素效应部位免受过量 性激素的影响。在胎盘, 17β- HSD2 就象 是母体与胎儿之间的一道屏障, 既能限 制胎儿雄激素进入母体组织也能限制母 体 雄 激 素 进 入 胎 儿 [15]。 3.3 17β- HSD3 对睾 丸 特 异 性 17β- HSD3 的 克 隆 研 究得出了 17β- HSD3 在性腺 T 生 成 中 的 重要功能, 这个重要功能已在呈现出男 性假 两 性 畸 形 的 病 人 中 所 证 实[16]。17β- HSD3 通 过 NADPH 催 化 还 原 4 – A2 生 成 T、5α- A2 生 成 5α- DHT 和 E1 生 成 E2, 这些过程使它成为性激素合成的关
农药是否失效的简易检验方法

农药是否失效的简易检验方法
农药是保护作物生长的一种主要工具。
然而,农药的功效不是永久的。
随着时间的推移,农药会逐渐失效。
因此,农民们需要知道如何简单地检验农药是否失效。
以下是一些简易的方法,让农民们可以在家中轻松地检测农药的有效性。
1. 观察颜色
许多化学农药是由颜色指示剂制成的。
这些颜色指示剂是灵敏的,容易受到气体影响而改变颜色。
因此,颜色的变化可以作为检验农药是否失效的指标。
2. 检查储存条件
存储条件对于农药的有效性至关重要。
过度的热量、光线及湿度都会降低农药的有效性。
因此,在检验农药之前,首先需要检查储存条件是否符合要求。
3. 测量质量
如果农民们拥有数个批次的同一类农药,可以使用比重计或天平等工具测量农药的质量。
如果两个批次的农药密度或重量有很大区别,说明其中一个批次的农药失效或被稀释了。
4. 使用试纸
试纸是一种简单而有效的工具,可以用于测定农药溶液中化学物质的浓度。
许多类型的农药可以将试纸浸渍在其溶液中,以便农民们比较浓度的变化。
如果溶液中的浓度显著降低,则可能表明农药已失效或被稀释了。
综上所述,这些简易的方法可以帮助农民们检验农药的有效性。
然而,这些方法并不是百分之百准确的,只是提供了初步的指示。
因此,如果有疑问,请寻求专业人士的帮助。
棉花品种耐盐性鉴定指标可靠性的检验

7 96 作 物 学 报 27 卷
表 1 盐胁迫下 13 个棉花品种籽棉产量顺序 Table 1 Order in sa lt tolerance of 13 cotton cvs eva lua ting w ith seed cotton y ield
1 材料与方法
1. 1 材料 陆 地棉 (Gossyp ium h irsu tum L ) 栽培品种 (系) 为中棉所 12 号、中棉所 19 号、石远 321、
徐州 304、徐州 219、枝棉 3 号、苏棉 8 号、苏棉 9 号、苏棉 10 号、苏棉 12 号、泗棉 2 号、泗 棉 3 号、协作 9236。其中枝棉 3 号为国家“七五”、“八五”攻关课题鉴定的耐盐材料[3], 在本 鉴定试验中, 这一品种作为耐盐参照材料。 1. 2 试验设计与管理
关键词 棉花; 品种; 耐盐性; 鉴定; 指标
Test on Cr iter ia of Eva lua ting Sa lt Tolerance of Cotton Cultivars
SU N X iao 2Fang L IU You2L iang
(K ey L ab of C rop G row th R eg u la tion, M in istry of A g ricu ltu re, N anj ing A g ricu ltu ra l U n iversity N anj ing 210095, C h ina)
2 结果与分析
2. 1 盐胁迫下籽棉产量绝对值与相对值的比较 表 1 为 0 (对照) 及 0. 15%、0. 30%、0. 45%、0. 60% N aC l 胁迫下, 按照绝对籽棉产量和
KE6有效性鉴定

规范有效性鉴定和变更控制系统要素、运做流程,确保有效性鉴定和变更控制能够有效实施。 2.0 范围 本程序适用于公司厂所有有效性鉴定和变更控制。 3.0 定义 3.1 变更控制:变更指质量体系中受控内容的更改。识别变更过程,定义变更因素、方法,采取控制 措施,使其变更后仍符合系统要求,即变更控制。 3.2 变更和有效性鉴定小组:一个跨部门的功能小组,负责组织变更控制和评估有效性鉴定。它由工 程、质量、生产、采购、DCC、业务、仓库等部门技朮或管理人员组成,推选一名组长,领导整个 小组开展工作。小组成员由部门推荐,质量经理批准。 4.0 职责 4.1 变更和有效性鉴定负责人: 负责维持本程序的实施,每年一次对此程序回顾审核,变更和有效性鉴定清单的建立、维护并组 织小组成员评估变更或有效性鉴定实施的可行性。 4.2 质量经理: 负责变更申请及评估总结的审批,有效性鉴定协议和有效性鉴定总结报告的审批,参与对外沟通, 确定有效性鉴定的适宜性、充分性。 4.3 变更和有效性鉴定小组: 负责变更或有效性鉴定的评估,包括变更申请的评估、变更方案的确认,以及有效性鉴定方案选 取。 4.4 相关部门: 了解系统运作,反馈变更信息,及时申请变更或有效性鉴定,实施变更或有效性鉴定。 5.0 程序 5.1 变更控制系统 验证已控制项目的改动,确保改动后影响的结果仍然符合系统的要求的控制系统。 变更控制按照变 更流程运作(流程见附件 1) 。 5.1.1 变更控制 通过<变更控制一览表>规范需要实施变更控制的内容。 由变更和有效性鉴定小组整理<变更控制 一览表>,并受控发行,其每年至少评审更新一次,需要时,可以随时更新。更新数据来源可以来 自各部门反馈的变更内容。 5.1.2 月变更项目计划或新增申请 变更和有效性鉴定小组负责人每月统计各部门变更情况,各部在每月五号之前提交《月变更项 目计划或新增申请》 。变更和有效性鉴定小组负责人汇总部门的计划后,整理并且分发给相关部 门, 以便相关部门提前做好变更准备工作。 若是部门变更计划有更改, 则反馈给变更和有效性鉴定小组负责人, 小组负责人更新汇总计划, 通 知相关部门。
消毒用品有效性监测措施

消毒用品有效性监测措施第一篇压力蒸汽灭菌效果评价方法与标准1主题内容与适用范围本方法规定了压力蒸汽灭菌技术标准及其评价灭菌效果的检测方法本方法适用于对压力蒸汽灭菌设备灭菌效果的评价。
2试剂本标准所用试剂,凡未说明规格者,均为分析纯(AR),水为蒸馏水。
2.1蛋白胨。
2.2葡萄糖。
2.3溴甲酚紫酒精溶液:取溴甲酚紫2.0g,溶于100mL95%乙醇中。
2.4溴甲酚紫蛋白胨水培养基配制:蛋白胨10.0g,葡萄糖5.0g,溶于1000mL 蒸馏水中,调pH值至7.0〜7.2,然后再加2%溴甲酚紫酒精溶液0.6mL,摇匀后,按5mL/管,分装包口,置压力蒸汽灭菌器中,于1151灭菌40min后备用。
3指示菌嗜热脂肪杆菌芽胞(ATCC7953或SSIK31)菌片,含菌量为5X105〜5X106cfu/片,121°C下,杀灭90%微生物所需时间D121值为1.3〜1.9min,杀灭时间(KT 值)为W19min,存活时间(ST值)为$3.9min。
4化学指示剂需用卫生部批准的化学指示剂。
5技术要求压力蒸汽灭菌器压力,MPa/cm2 温度,C灭菌时间,min 下排气式0.070115400.10512130预真空式0.2101344-66检测方法6.1生物学指标(用作压力蒸汽灭菌设备灭菌效果的依据)。
6.1.1将嗜热脂肪杆菌芽胞菌片两个分别放入灭菌小纸袋内,置于标准试验包中心部位。
6.1.2灭菌柜室内,上、中层中央和排气口处各放置一个标准试验包(由3件平纹长袖手术衣,4块小手术巾,2块中手术巾,1块大手术巾,30块10cm X10cm.8层纱布敷料包裹成25cmX30cmX30cm大小)。
手提压力蒸汽灭菌器用通气贮物盒(22cmX13cmX6cm)代替标准试验包,盒内盛满中试管,指示菌片放于中心部位两只灭菌试管内(试管口用灭菌牛皮纸包封),将盒平放于手提压力蒸汽灭菌器底部。
6.1.3经一个灭菌周期后,在无菌条件下,取出标准试验包或通气贮物盒中的指示菌片,投入溴甲酚紫葡萄糖蛋白胨水培养基中,561培养48h,观察培养基颜色变化。
ke6钛 螯合物

ke6钛螯合物
摘要:
1.介绍ke6 钛螯合物
2.阐述ke6 钛螯合物的应用领域
3.讨论ke6 钛螯合物的研究现状与发展趋势
正文:
ke6 钛螯合物是一种新型材料,由钛元素与螯合剂分子通过化学键结合而成。
这种材料具有很高的比表面积、良好的生物相容性和优异的催化性能,因此被广泛应用于各个领域。
在环境保护领域,ke6 钛螯合物可用作水处理剂,去除水中的重金属离子和有机污染物。
它具有高效、环保、低成本等优点,有助于解决我国水污染问题。
在能源领域,ke6 钛螯合物可用作催化剂,促进太阳能、风能等可再生能源的转化和利用。
此外,它还可以作为锂离子电池的负极材料,提高电池的能量密度和循环稳定性。
在生物医学领域,ke6 钛螯合物具有良好的生物相容性和生物活性,可用作药物载体、生物传感器和创伤敷料等。
同时,它还可以用于制备抗肿瘤药物和基因载体,为癌症治疗提供新思路。
目前,ke6 钛螯合物的研究主要集中在提高其性能、扩大应用领域以及探索新型制备方法等方面。
农药有效期鉴定有五法.doc

农药有效期鉴定有五法
当今市场上的农药有多种多样的,农药鉴定有效期有以下五点:
一、漂浮法:适用于可湿性粉剂农药。
先取200克清水放于容器内,再取1克农药,轻轻地均匀撒在水面上,仔细观察,1分钟内湿润并能溶于水的为未失效农药,否则为失效农药。
二、直观法:对粉剂农药,先看药剂外表,如果受潮结块,药味不浓或有其它异味,并能用手捏成团,说明已经基本失效;对乳剂农药,先将药瓶倒置,如果药液混浊不清或出现分层(即油水分离),有沉淀物生成或絮状物悬浮,说明药剂可能已经失效。
三、加热法:适于粉剂农药。
取农药5-10克,放在一金属片上加热,如果产生大量白烟,并有浓烈的刺鼻气味,说明药剂良好,否则,表明已经失效。
四、溶解法:适用于悬浮剂农药。
把有沉淀物的农药连瓶一起放入温水(温度为50-60℃)中,一小时后观察,若沉淀物慢慢溶解,说明药剂尚未失效,否则说明已经失效。
五、悬浮法:适用于可湿性粉剂农药。
取农药30-50克,放在玻璃容器内,先加少量水调成糊状,再加入150-200克清水搅匀,静止10分钟观察,其中未失效的农药溶性好,药液的粉粒细小,沉降速度慢且沉淀量少。
合理使用农药可以使农作物获得稳产、高产,但是过期的农药一定要认准不要使用啊!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
表格编号/版本:KE-6/A Page 2 of 7
文件编号
Document No
02-42 2010-4-2 2010-4-12 A
制定日期
Constitute Date
生效日期
Effective Date
文件名称
Document Name
KE6 有效性鉴定
版次
Rev
5.1.3 变更申请 各部门根据《变更控制一览表》评估具体变更内容,填写《变更申请与结果评估表》,确定变更内 容,类别,变更范围, 及变更后期望的结果。变更小组审核《变更申请与结果评估表》,变更和有效 性鉴定小组负责人登录《变更项目目录表》,及时更新。主清单内容包括:序号,变更项目名称,内 容描述,预计变更时间,部门,变更方式,变更时间,相关报告编号。 5.1.4 变更评审 变更和有效性鉴定小组主导变更评审﹐通过小组会议或其它适当方式确定变更方案。评估方案的 实施过程, 由小组联系相关部门落实;若需要有效性验证评估﹐则通知变更部门填写有效性鉴定协 议,验证变更持续有性。 变更评审纪录应当保留。测试报告,分析数据﹐变更措施﹐以及有效性鉴定协议/总结报告应当附 加,作为判定是否实施变更的依据。 客户有特别要求的,依照客户要求进行评审。 5.1.5 变更行动 质量经理最终判定是否实施变更。部门确定具体变更措施﹐实施变更。若经过有效性鉴定﹐则可 以按照有效性鉴定总结报告实施变更。 5.1.6 变更结果的跟进与评估 变更部门实施变更,跟进变更结果﹐反馈变更信息。变更结果的评估可以通过 E-MAIL﹑联络单﹑ 会议的方式沟通﹑交流。 5.1.7 变更申请表 CRF(Change request form) 客人要求填写 CRF 的相关产品必须填写 CRF 表格,KE6 负责人将表格 e-mail,客人批复 只有变更申请表批复合格后,才能进行变更相关工作,同时更新变更控制状态跟踪表 通知客人.项目完成变更后,及时将 CRF 文件反馈给客人,完成 closed out.
规范有效性鉴定和变更控制系统要素、运做流程,确保有效性鉴定和变更控制能够有效实施。 2.0 范围 本程序适用于公司厂所有有效性鉴定和变更控制。 3.0 定义 3.1 变更控制:变更指质量体系中受控内容的更改。识别变更过程,定义变更因素、方法,采取控制 措施,使其变更后仍符合系统要求,即变更控制。 3.2 变更和有效性鉴定小组:一个跨部门的功能小组,负责组织变更控制和评估有效性鉴定。它由工 程、质量、生产、采购、DCC、业务、仓库等部门技朮或管理人员组成,推选一名组长,领导整个 小组开展工作。小组成员由部门推荐,质量经理批准。 4.0 职责 4.1 变更和有效性鉴定负责人: 负责维持本程序的实施,每年一次对此程序回顾审核,变更和有效性鉴定清单的建立、维护并组 织小组成员评估变更或有效性鉴定实施的可行性。 4.2 质量经理: 负责变更申请及评估总结的审批,有效性鉴定协议和有效性鉴定总结报告的审批,参与对外沟通, 确定有效性鉴定的适宜性、充分性。 4.3 变更和有效性鉴定小组: 负责变更或有效性鉴定的评估,包括变更申请的评估、变更方案的确认,以及有效性鉴定方案选 取。 4.4 相关部门: 了解系统运作,反馈变更信息,及时申请变更或有效性鉴定,实施变更或有效性鉴定。 5.0 程序 5.1 变更控制系统 验证已控制项目的改动,确保改动后影响的结果仍然符合系统的要求的控制系统。 变更控制按照变 更流程运作(流程见附件 1) 。 5.1.1 变更控制 通过<变更控制一览表>规范需要实施变更控制的内容。 由变更和有效性鉴定小组整理<变更控制 一览表>,并受控发行,其每年至少评审更新一次,需要时,可以随时更新。更新数据来源可以来 自各部门反馈的变更内容。 5.1.2 月变更项目计划或新增申请 变更和有效性鉴定小组负责人每月统计各部门变更情况,各部在每月五号之前提交《月变更项 目计划或新增申请》 。变更和有效性鉴定小组负责人汇总部门的计划后,整理并且分发给相关部 门, 以便相关部门提前做好变更准备工作。 若是部门变更计划有更改, 则反馈给变更和有效性鉴定小组负责人, 小组负责人更新汇总计划, 通 知相关部门。
文件编号
Document No
02-42 2010-4-2 2010-4-12 A
制定日期
Constitute Date
生效日期
Effective Date
文件名称
Document Name
KE6 有效性鉴定
修 订 记 录
版次
Rev
修订 日期 2010-4-2
文件 编号 02-42
原/新 版次 A
修 订 内 容 摘 要 制 定
表格编号/版本:KE-6/A Page 4 of 7
文件编号
Document No
02-42 2010-4-2 2010-4-12 A
制定日期
Constitute Date
生效日期
Effective Date
文件名称
Document Name
KE6 有效性鉴定
版次
Rev
告,并使总结报告通过审核批准。 5.2.5 有效性鉴定的范围: 适用公司厂所有部门 5.2.6 有效性鉴定的具体内容:S a. 原材料的储存、装卸,生产环境和位置; b. 产品/生产工艺 (包括设备、生产程序、流程); c. SOP (对质量有影响的标准操作程序); d. 分析方法 (原材料、 包装材料、 成品的分析方法有效性鉴定均由工程部负责,工厂负责进行 方法的验证); e. 计算器系统的有效性鉴定包含这个系统的发展周期,从开始贯穿了发展,测试,生产使用, 包括硬件,软件的应用,数据真实完整性,登陆安全性和错误的检测,用于数据的贮存,恢复 和备份的系统应进行有效性鉴定以证明数据的有效传输和数据的真实完整性。 使用者有责任确保从第三方购买的现货供应的软件的合法性。 安装和操作商业软件, 包括方程 式和宏的内部使用,当用于和产品质量相关的目的时,要对设计使用进行有效性鉴定 。 f. 成品的储存及装卸; g. 能源供应 (公用工程的水、电、压缩空气); h. 对质量有影响的变更(如:新项目、关键设备/工艺的变更、规格纸更新)。 i. 微生物控制有效性鉴定. 5.2.7 有效性鉴定的步骤: A.部门依据《有效性鉴定主计划》和《月变更项目计划或新增申请》评估意见﹐准备有效性鉴定工作。 B.部门可提前通知 KE6 负责人有效性鉴定项目,以便 KE6 负责人做有效性鉴定主计划。 C.部门根据项目内容,确定有效性鉴定方法,制定有效性鉴定协议,协议可包括: 目的: 工艺和系统介绍: 有效性鉴定的范围: 计划或者协议: 取样计划: 成功的标准: 计划实施目标日期: 计划的批准(由品管部经理和 P&G QA manager) D.有效性鉴定方法的选取: 有效性鉴定协议起草人,参照有效性鉴定作业指导书,确定适宜的有效性鉴定方法,然后编写 有效性鉴定协议。 E. 有效性鉴定的实施:有效性鉴定部门可邀请相关部门协助实施有效性质鉴定,采集数据,分析问题, 解决问题等。 F. 有效性鉴定的跟踪 跟踪表是一种用于跟踪全厂完成必要有效性鉴定的进展情况的重要工具, Page 5 of 7
文件编号
Document No
02-42 2010-4-2 2010-4-12 A
制定日期
Constitute Date
生效日期
Effective Date
文件名称
Document Name
KE6 有效性鉴定
版次
Rev
鉴定负责人将相关部门下月的有效性鉴定项目跟踪表派发到相应部门 KE6 负责人, 以此提示各项负责人及 时跟进如期完成,若非准期完成或不能完成均需更改《有效性鉴定主计划 》 ,向工厂有效性鉴定负责人申 请,批准后方可生效(如需要时须质量经理批准) 。 G. 有效性鉴定总结报告:鉴定完成后,根据协议要求,完成有效性鉴定报告,相关部门在报告上填写评 估建议和措施,总结报告需要质量经理和 P&G QA 经理批准。 H. 有效性鉴定成功后标准更新:有效性鉴定成功后,可建立或更新标准,相关部门根据需要更新标准, 工厂 KE4 负责人确定内容。 标准需要得到 P&G 相关部门确定认可,得到 P&G 的书面标准后,方可更新内部标准,指导生产。 6.0 记录及表格 《有效性鉴定主计划》 《有效性鉴定的总目录表》 《有效性鉴定协议》 《有效性鉴定总结报告》 《变更项目清单》 《变更控制一览表》 《工程变更申请表》 《工程变更确认表》 7.0 Relative Document 相关文件 E.O 作业指导书 IQ、OQ、PQ、CQV 作业指导书 KE4 产品设计和技术标准 8.0 附件 变更控制流程
制 定
审 核
批 准
表格编号/版本:KE-6/A Page 1 of 7
文件编号
Document No
02-42 2010-4-2 2010-4-12 A
制定日期
Constitute Date
生效日期
Effective Date
文件名称
Document Name
KE6 有效性鉴定
版次
Rev
1.0
目的
表格编号/版本:KE-6/A Page 3 of 7
文件编号
Document No
02-42 2010-4-2 2010-4-12 A
制定日期
Constitute Date
生效日期
Effective Date
文件名称
Document Name
KE6 有效性鉴定
版次
Rev
设备有效并达到设计标准的一项检查. PQ(性能验证):证明产品或工艺过程能持续地符合规格指针,至少连续生产 3 个批次, 确保某一特定工艺过程能够按照预先确定的规格在设备上进行连续生产的一项检查。 CQV: 试车(Commissioning).验证(Qualification), 核实(Verification); E.O( Experimental Order):试验(工程)定单。当一个新的产品或老产品更换原料投 入使用前需进行验证小批量的质量状况而鉴定其可行性。 GRR:测量的再现性和重复性。经常用于测试方法和测试夹具。 5.2.3 有效性鉴定研究类型 1. 现行型 1.1 生产过程中执行有效性鉴定 1.2 用于鉴定或者重新鉴定现行系统 2. 预期型 2.1 有效性鉴定报告必须在放行生产之前完成 2.2 用于新的工艺或者产品 5.2.4 有效性鉴定过程中人员职责定义 A.品管部经理的职责 a.回顾和批准有效性鉴定的程序/所有协议/总结报告. b.指导有效性鉴定的拥有者. c.为高效实施有效性鉴定工作提供正确的资源. . B.厂级有效性鉴定系统负责人的职责 a.起草/编写/更新有效性鉴定系统概述、有效性鉴定程序、有效性鉴定流程图、主计划. b.回顾和批准所有的主计划、所有协议及总结报告. c.对有效性鉴定的程序提供培训. d.跟踪有效性鉴定的进展及完成状况、建立工厂有效性鉴定的文档. e.指导和支持各部门的有效性鉴定并提出反馈. C,部门有效性鉴定负责人职责 a.起草/编写/更新部门主计划、有效性鉴定协议、有效性鉴定总结报告、有效性鉴定跟踪表. b.回顾和批准部门主计划、本部门的所有协议、本部门的所有总结报告. c.确保本部门的协议按跟踪表的进度如期完成实施. d.对部门所有人员进行有效性鉴定的基础知识培训,特别是对参与任何方案或总结报告的起草或实施的所 有人员进行培训. e.对部门所有的计划、协议和总结报告进行文件存盘. D.各项目有效性鉴定负责人职责 根据部门主计划的要求按期撰写鉴定协议并使协议通过审核批准,收集相关数据并进行分析,撰写总结报
