沪科版化学高一上册-1.2 原子结构 课件 优秀课件
合集下载
原子结构和结构示意图ppt课件

*将核内所有的质子和中子的相对原子质量之和取最接 近的整数叫质量数
2024/7/15
6
经营者提 供商品 或者服 务有欺 诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
1.3 原子结构示意图和电子式
2024/7/15
元素性质与最外层电子数的关系
❖稀有气体:最外层8个(氦最外层2个) 稳定结构 一般不发生反应
❖金属元素:最外层较少(1~3个) 易失去电子达
到稳定结构
❖ 非金属元素:最外层较多(4~7个)易得到电子
达到稳定结构
2024/7/15
10
经营者提 供商品 或者服 务有欺 诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
2024/7/15
14
经营者提 供商品 或者服 务有欺 诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
❖练习:下列微粒属于同位素的是( B )
A. O2, O3 C. ,H2
B.
,
D. ,
2024/7/15
❖ 卢瑟福在研究铀元素放射性时发现能产生两种不同 的辐射,一种称之为α辐射,卢瑟福认为α粒子是 氦原子失去电子后的正离子(He2+);另一种称之 为β辐射,被证实其本质是电子流;另外还存在一 种γ射线,它是波长很短的电磁波。
+
γα
β
放射源
2024/7/15
3
经营者提 供商品 或者服 务有欺 诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
2024/7/15
6
经营者提 供商品 或者服 务有欺 诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
1.3 原子结构示意图和电子式
2024/7/15
元素性质与最外层电子数的关系
❖稀有气体:最外层8个(氦最外层2个) 稳定结构 一般不发生反应
❖金属元素:最外层较少(1~3个) 易失去电子达
到稳定结构
❖ 非金属元素:最外层较多(4~7个)易得到电子
达到稳定结构
2024/7/15
10
经营者提 供商品 或者服 务有欺 诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
2024/7/15
14
经营者提 供商品 或者服 务有欺 诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
❖练习:下列微粒属于同位素的是( B )
A. O2, O3 C. ,H2
B.
,
D. ,
2024/7/15
❖ 卢瑟福在研究铀元素放射性时发现能产生两种不同 的辐射,一种称之为α辐射,卢瑟福认为α粒子是 氦原子失去电子后的正离子(He2+);另一种称之 为β辐射,被证实其本质是电子流;另外还存在一 种γ射线,它是波长很短的电磁波。
+
γα
β
放射源
2024/7/15
3
经营者提 供商品 或者服 务有欺 诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
原子的结构ppt课件

13.关于构成物质的微观粒子,下列说法正确的是( )
D
A. 离子带电,所以不能直接构成物质B. 氯离子的质子数比电子数多1个C. 离子是带电粒子,所有带电粒子一定是离子D. 原子得失电子变成离子,原子核不发生变化
14.下列关于、 两种粒子的判断,正确的是( )
C
①核电荷数相同 ②核外电子数相等比 稳定 ④质量几乎相等⑤质子数相等A. ①③⑤ B. ②④ C. ①③④⑤ D. ①②③④⑤
A
B
C
11.下图形象地表示了氯化钠的形成过程。下列叙述中,不正确的是 ( )
B
A. 钠原子在化学反应中容易失去电子B. 钠原子与钠离子都不显电性C. 氯原子得到1个电子形成氯离子D. 氯化钠由钠离子和氯离子构成
12.某粒子结构示意图如图所示,下列说法错误的是( )
D
A. 若 ,则该粒子是阴离子B. 若 ,则该粒子是原子C. 若 ,则该粒子是阳离子D. 若 ,则该粒子是由一个原子得到2个电子形成的
5、相同的原子层结构化学性质相似相同的原子层结构:
化学性质相似:
电子层数相同,切每层上电子数相等
条件:最外层电子数认为最终的结果是( )A.Na原子与Cl原子都无法构成相对稳定结构B.Na原子与Cl原子都构成了相对稳定结构C.Na原子与Cl原子只有一方构成了相对稳定结构
小练习:试着写出下面的离子示意图代表什么
Al3+
S2-
5、离子符号的意义
Al3+
3Al3+
表示一个铝离子
表示3个铝离子
表示一个铝离子带3个单位正电荷
6、离子也是构成物质的一种粒子
由离子构成的物质,化学性质由离子保存
如:NaCl由Na+和Cl-构成,所以化学性质由 Na+和Cl-保持。
D
A. 离子带电,所以不能直接构成物质B. 氯离子的质子数比电子数多1个C. 离子是带电粒子,所有带电粒子一定是离子D. 原子得失电子变成离子,原子核不发生变化
14.下列关于、 两种粒子的判断,正确的是( )
C
①核电荷数相同 ②核外电子数相等比 稳定 ④质量几乎相等⑤质子数相等A. ①③⑤ B. ②④ C. ①③④⑤ D. ①②③④⑤
A
B
C
11.下图形象地表示了氯化钠的形成过程。下列叙述中,不正确的是 ( )
B
A. 钠原子在化学反应中容易失去电子B. 钠原子与钠离子都不显电性C. 氯原子得到1个电子形成氯离子D. 氯化钠由钠离子和氯离子构成
12.某粒子结构示意图如图所示,下列说法错误的是( )
D
A. 若 ,则该粒子是阴离子B. 若 ,则该粒子是原子C. 若 ,则该粒子是阳离子D. 若 ,则该粒子是由一个原子得到2个电子形成的
5、相同的原子层结构化学性质相似相同的原子层结构:
化学性质相似:
电子层数相同,切每层上电子数相等
条件:最外层电子数认为最终的结果是( )A.Na原子与Cl原子都无法构成相对稳定结构B.Na原子与Cl原子都构成了相对稳定结构C.Na原子与Cl原子只有一方构成了相对稳定结构
小练习:试着写出下面的离子示意图代表什么
Al3+
S2-
5、离子符号的意义
Al3+
3Al3+
表示一个铝离子
表示3个铝离子
表示一个铝离子带3个单位正电荷
6、离子也是构成物质的一种粒子
由离子构成的物质,化学性质由离子保存
如:NaCl由Na+和Cl-构成,所以化学性质由 Na+和Cl-保持。
《原子的结构》PPT课件

电子的能级
电子在原子中具有不同的能级,每个 能级对应不同的电子轨道和能量状态。
电子的运动
电子在原子核外以极高的速度运动, 形成“电子云”或“概率分布”。
原子核与电子的关系
电荷平衡
原子核的正电荷与电子的负电荷 相互平衡,使得整个原子呈电中
性。
引力与斥力
原子核与电子之间存在引力和斥力, 引力使得电子被束缚在原子核周围, 斥力则使得电子不会塌缩到原子核 中。
电负性是衡量元素在化合物中吸引电子能力 相对大小的标度,电负性越大,元素的非金 属性越强。
元素周期表的应用
预测未知元素的性质
根据已知元素的性质和周期律, 可以预测未知元素的性质。
指导新材料的研发
利用元素周期表中的元素性质, 可以指导新材料的研发,如超导 材料、半导体材料等。
指导化学反应
利用元素周期表中的元素性质, 可以指导化学反应的进行,如选 择合适的催化剂、反应条件等。
3
汤姆生的“葡萄干面包”模型 发现电子后,提出原子由带正电的“面包”和嵌 在其中的带负电的“葡萄干”(电子)组成。
原子结构研究的重要性
01
02
03
理解物质本质
原子是构成物质的基本单 元,研究其结构有助于理 解物质的本质属性。
推动科技发展
原子结构的深入研究为量 子力学、核能利用、材料 科学等领域的发展奠定了 基础。
性质。
原子结构与元素性质的关系
原子半径
电离能
原子半径的大小与元素的化学性质密切相关, 原子半径越大,原子核对核外电子的吸引力 越小,元素的金属性越强。
电离能的大小反映了原子失去电子的难易程 度,电离能越小,原子越容易失去电子,元 素的金属性越强。
原子的结构完整版PPT课件

工业领域应用
放射性同位素可用于材料 检测、无损探伤、辐射加 工等。
其他领域应用
放射性同位素还可用于科 学研究、环境保护、农业 生产等领域。
放射性同位素对环境影响及安全防护措施
对环境影响
放射性同位素衰变产生的射线会对环境和生物体造成危害,如污 染空气、水源和土壤等。
安全防护措施
为了保障人类和环境安全,需要采取一系列安全防护措施,如合 理选址、屏蔽防护、废物处理等。
放射性同位素概念及来源
放射性同位素定义
01
具有相同原子序数但质量数不同的同位素,能自发地放出射线
并转变为另一种元素。
放射性同位素来源
02
天然放射性元素和人工合成放射性元素。
放射性同位素衰变类型
03
α衰变、β衰变和γ衰变。
放射性同位素在医学、工业等领域应用
医学领域应用
放射性同位素可用于诊断 和治疗疾病,如放射性碘 治疗甲状腺疾病、PET扫 描等。
过渡元素位于周期表中间部分, 包括3~12列的元素。它们具有 多种氧化态和丰富的化学性质, 是构成众多合金和催化剂的重要
成分。
稀有气体元素
稀有气体元素位于周期表的最右 侧,它们具有稳定的8电子构型 (氦为2电子构型),化学性质 极不活泼,一般不易与其他物质
发生化学反应。
04
化学键与分子间作用 力
化学键类型及特点
分子间作用力影响物质的物理性质
分子间作用力主要影响物质的熔点、沸点、密度、硬度等物理性质。一般来说,分子间作用力越强,物质的熔点 、沸点越高,密度越大,硬度也越大。例如,氢键的存在使得水的熔沸点异常高,范德华力则主要影响由分子构 成的物质的物理性质。
05
原子光谱与能级跃迁
《原子的结构》参考课件

Cl- 、OH-
失电子 阳离子 得电子
得电子 原子 失电子
阴离子
1.说出下符号的意义
S2-
一个硫离子 一个硫离子带了2个负电荷
3S2- 表示3个硫离子
2.填空
原子中: 核电荷数 = 质子数 = 核外电子数 阳离子: 核电荷数 = 质子数 > 核外电子数 阴离子: 核电荷数 = 质子数 < 核外电子数
氧原子结构示意图
2019/8/6
最外层电子数
该电子层上 ? 的电子数 ? 电子层 ? 核电荷数 ? 原子核
元素的化学性质是由原子 的最外层电子决定的。
2019/连8/6 接到13
连接到14
连接到15
1.某元素的原子结构示意图为
,该元素的核
电荷数为 13 个,核外有 3 个电子层,第二层上
有 8 个电子,最外电子层上有 3 个电子,该元素
2019/8/6
一、原子的构成
归纳:原子由居于原子中 心的带正电的原子核和核 外带负电的的电子构成。
原子
原子核
质子 每个质子带一个 单位的正电荷
中子 不带电
核外电子 每个电子带一个单位的负电荷
2019/8/6
表格3-1 几种原子的构成
原子种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
为 Al 元素。
2.下列关于原子的叙述中,正确的是( D )
A、原子是不能再分的粒子 B、一切物质都是由原子直接构成的
C、一切原子的原子核都是由质子和中子构成的 D、原子核内的质子数一定等于核外的电子数
失电子 阳离子 得电子
得电子 原子 失电子
阴离子
1.说出下符号的意义
S2-
一个硫离子 一个硫离子带了2个负电荷
3S2- 表示3个硫离子
2.填空
原子中: 核电荷数 = 质子数 = 核外电子数 阳离子: 核电荷数 = 质子数 > 核外电子数 阴离子: 核电荷数 = 质子数 < 核外电子数
氧原子结构示意图
2019/8/6
最外层电子数
该电子层上 ? 的电子数 ? 电子层 ? 核电荷数 ? 原子核
元素的化学性质是由原子 的最外层电子决定的。
2019/连8/6 接到13
连接到14
连接到15
1.某元素的原子结构示意图为
,该元素的核
电荷数为 13 个,核外有 3 个电子层,第二层上
有 8 个电子,最外电子层上有 3 个电子,该元素
2019/8/6
一、原子的构成
归纳:原子由居于原子中 心的带正电的原子核和核 外带负电的的电子构成。
原子
原子核
质子 每个质子带一个 单位的正电荷
中子 不带电
核外电子 每个电子带一个单位的负电荷
2019/8/6
表格3-1 几种原子的构成
原子种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
为 Al 元素。
2.下列关于原子的叙述中,正确的是( D )
A、原子是不能再分的粒子 B、一切物质都是由原子直接构成的
C、一切原子的原子核都是由质子和中子构成的 D、原子核内的质子数一定等于核外的电子数
沪科版化学高一上《原子结构和相对原子质量》ppt课件

126C相对原子质量=1.993×10-23÷1.661×10-24=12
168O相对原子质量=2.656×10-23÷1.661×10-24 =15.990
3517Cl相对原子质量= 5.8153×10-23÷1.661×10-24 =34.969
九、元素的平均相对原子质量:
同位素各原子的相对原子质量与同位素各 原子所占的原子百分比(丰度)的乘积之和。
作业
1、书面: P.3 P.4 2、熟记1-20元素的名称与原子序数
14C的含量每减少一半要经过约5730年。某考
古小组挖掘到一块动物骨骼,经测定14C还
剩
A
余1/8,推测该动物年代距今约为( )
A 5730×3年
B 5730×4年
C解57:30×(6年1 )n =
1D
5730×8年
n=3
2
8
七、核素:
具有一定数目的质子和一定数目的中子 的一种原子叫核素。(即质子数、中子 不完全相同的一种原子,就称为一种核 素,12C 13C 14C 234U 235U 238U都 各自独立称为核数,即为六种核素。同 种元素不同核素间互称同位素。
例3 元素M有质量数为16和18的两种同
位素,该元素的近似平均相对原子质量
为16.4,则其中18M的质量分数是B( )
A 20% B 22% C 50% D 7
8% 解:
16M 16
1.6 4
16.4
︰
18M 18
0.4 1
原子个数比(物质的量之比)
18×1
18M%=
×100% =21.95%
18×1+16×4
2.原子 A X 核电荷数=质子数=原子核外电子数
168O相对原子质量=2.656×10-23÷1.661×10-24 =15.990
3517Cl相对原子质量= 5.8153×10-23÷1.661×10-24 =34.969
九、元素的平均相对原子质量:
同位素各原子的相对原子质量与同位素各 原子所占的原子百分比(丰度)的乘积之和。
作业
1、书面: P.3 P.4 2、熟记1-20元素的名称与原子序数
14C的含量每减少一半要经过约5730年。某考
古小组挖掘到一块动物骨骼,经测定14C还
剩
A
余1/8,推测该动物年代距今约为( )
A 5730×3年
B 5730×4年
C解57:30×(6年1 )n =
1D
5730×8年
n=3
2
8
七、核素:
具有一定数目的质子和一定数目的中子 的一种原子叫核素。(即质子数、中子 不完全相同的一种原子,就称为一种核 素,12C 13C 14C 234U 235U 238U都 各自独立称为核数,即为六种核素。同 种元素不同核素间互称同位素。
例3 元素M有质量数为16和18的两种同
位素,该元素的近似平均相对原子质量
为16.4,则其中18M的质量分数是B( )
A 20% B 22% C 50% D 7
8% 解:
16M 16
1.6 4
16.4
︰
18M 18
0.4 1
原子个数比(物质的量之比)
18×1
18M%=
×100% =21.95%
18×1+16×4
2.原子 A X 核电荷数=质子数=原子核外电子数
沪科版化学高一上册-1.2 原子结构 课件 _2ppt

练习
7.在1911年前后,新西兰出生的物理学家卢瑟福 把一束变速运动的α粒子(质量数为4的带2个正电 荷的质子粒)射向一片极薄的金箔,他惊奇地发现, 过去一直认为原子是“实心球”,而这种“实心 球”紧密排列而成的金箔,竟为大多数α粒子畅 通无阻的通过,就像金箔不在那儿似的,但也有 极少数的。粒子发生偏转,或被笔直地弹回。根 据以上实验现象能得出关于金箔中Au原子结构的 一些结论,试写出其中的三点 ①_原__子__中__存__在__原__子__核__,__它_ 占原子中极小的体积 ②_原__子__核__带__正__电__,__且__电_ 荷数远远大于α粒子 ③_金__的_原__子__核__质__量__远__远__大_ 于α粒子
4、有人来打开我们的眼睛。因此,人们必须能够承受虚假事实并容忍敷衍。很明显,您需要知道什么。 13、一个人的气质掩盖了他对生活的良好态度。实际上,生活并没有我们想象的那么糟糕。毕竟,一个人的成长就是突破外面厚厚的土壤, 这样才能有希望的突破。
相对质量①
10/.10803065
1.007
1.008
37 35 12 14 17 17 6 6 20 18 6 8 17 17 6 6
二、质量数
质量数(A)= 质子数(Z)+ 中子数(N)
元素名 原子 称
质子数 中子数 核外电 质量数 子数
氯
3717Cl
氯
3517Cl
碳
126C
碳
146C
思考:1、Cl与C的根本区别是什么? 2、168O与“O” 所表示的意义是否相同? 3、 126C 与146C有什么关系呢?
则 a 与下列式子有相等关系的是( ) B
(A)b-m-n
(B) b+m+n
高一化学原子结构课件图文

04 元素周期律与化学键合 性质
元素周期律概述
01
02
03
元素周期律定义
元素的性质随着原子序数 的递增而呈现周期性变化 。
周期表结构
周期表按照原子序数排列 ,具有横行(周期)和纵 列(族)的结构。
周期表分区
根据电子排布的不同,周 期表可分为s、p、d、f等 区。
化学键类型及其特点
离子键
由正负离子通过静电作用形成的 化学键,具有高熔点、高沸点等
个人防护措施
实验人员需佩戴防护服、护目 镜等个人防护装备,减少放射 性物质对身体的伤害。
废弃物处理
对实验过程中产生的放射性废 弃物进行妥善处理,避免对环 境造成污染。
安全标识
在实验室醒目位置设置安全标 识,提醒实验人员注意安全事
项。
06 原子结构在生活和科技 中应用
原子结构在材料科学中应用
01
原子排列与晶体结构
元素周期表简介
元素周期表是按照元素原子的核电荷 数(即质子数)从小到大排列的表格 。
周期表中共有18个纵列,其中8、9 、10三个纵列共同组成一个族,其余 每个纵列为一个族,共有16个族。
周期表中共有7个横行,即7个周期, 每个周期中元素的性质具有相似性。
元素周期表反映了元素性质的周期性 变化,是学习和研究化学的重要工具 。
膜,如防腐、耐磨、导电等。
原子结构在能源领域应用
原子核能
01
利用原子核的裂变或聚变反应,可以释放出巨大的能量,用于
发电、推进等。
太阳能利用
02
太阳能电池板中的光电效应,实质上就是光子与电子的相互作
用,进而产生电流,实现对太阳能的利用。
新能源材料
03
沪教版化学高一上1 2《原子结构和相对原子质量》课件
本编为大家提供各种类型的PPT课件,如数学课件、语文课件、英语课件、地理课件、 历史课件、政治课件、化学课件、物理课件等等,想了解不同课件格式和写法,敬请下载!
Download prompt: This PPT courseware has been carefully prepared by our store. We hope that after downloading, it can help everyone solve practical problems. After downloading the PPT courseware, it can be customized and modified. Please adjust and use it according to actual needs. Thank you!
2、同位素:把质子数相同,中子数不同的同一类元 素中的不同原子互称为同位素。
思考
决定原子种上同一种元素中的不 同原子,你发现了什么?
3、放射性同位素的应用
探测金属 缺陷
放疗
研究化学 反应机理
放射性 同位素
育种
保存 食物
已知:
原子
质量(g)
氢
氧
碳
1.674×10-24 2.656×10-23 1.933×10-23
A
课堂例题
2、已知10B和11B的近似相对原子质量 为10.8,求其元素中各同位素的丰度。
课堂例题
❖ 3、由23Na跟35Cl和37Cl所生成的10g 氯化钠中含有37Cl的质量是 ________ (已知氯的平均相对原子质量为35.5)
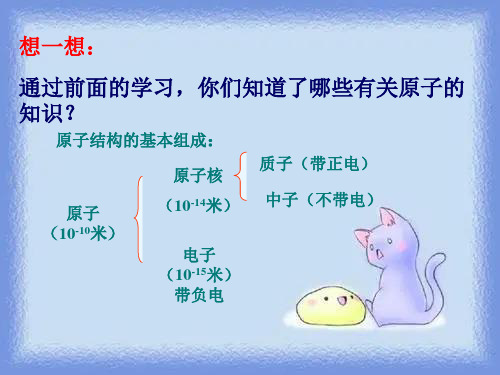
想一想:
通过前面的学习,你们知道了哪些有关原子的
知识?
Download prompt: This PPT courseware has been carefully prepared by our store. We hope that after downloading, it can help everyone solve practical problems. After downloading the PPT courseware, it can be customized and modified. Please adjust and use it according to actual needs. Thank you!
2、同位素:把质子数相同,中子数不同的同一类元 素中的不同原子互称为同位素。
思考
决定原子种上同一种元素中的不 同原子,你发现了什么?
3、放射性同位素的应用
探测金属 缺陷
放疗
研究化学 反应机理
放射性 同位素
育种
保存 食物
已知:
原子
质量(g)
氢
氧
碳
1.674×10-24 2.656×10-23 1.933×10-23
A
课堂例题
2、已知10B和11B的近似相对原子质量 为10.8,求其元素中各同位素的丰度。
课堂例题
❖ 3、由23Na跟35Cl和37Cl所生成的10g 氯化钠中含有37Cl的质量是 ________ (已知氯的平均相对原子质量为35.5)
想一想:
通过前面的学习,你们知道了哪些有关原子的
知识?
沪科版高中化学高一上册 1.2.2 同位素 PPT(25张)优质课件

质子数相同,中子 数不同的同一元素 的不同原子
由同种元素组成的 结构和性质不同的 单质
实例
H-氢元素 C-碳元素
11H、21H、31H
金刚石与石墨、 氧气与臭氧
区别与联系: 1、联系:同位素属于同一元素的原子;
同素异形体由同一元素的原子构成。 2、区别:同位素有1800余种,元素只有100多种。
沪科版高中化学高一上册 1.2.2 同位素 PPT(25张)优质课件
沪科版高中化学高一上册 1.2.2 同位素 PPT(25张)优质课件
[探究与深化]
同位素的应用十分广泛: 1、探测金属器件的缺陷。 2、粮食育种。 3、保存食物。 4、医疗疾病。 5、研究化学反应机理……
(7-7)
沪科版高中化学高一上册 1.2.2 同位素 PPT(25张)优质课件
沪科版高中化学高一上册 1.2.2 同位素 PPT(25张)优质课件
沪科版高中化学高一上册 1.2.2 同位素 PPT(25张)优质课件
[作业与拓展]
1.有关同位素概念的理解
(3-1)
⑴有关同位素的叙述,正确的是( B)
A.电子数相同,中子数不同 的两种微粒的互称 B.质量数不同,核电核数相同的多种原子间的互称 C.质子数相同,电子数不同的同一元素微粒 D.质子数相同,中子数不同的元素微粒间的互称
(3-2)
(1)1H 2H 3H相组合能形成几种构成不同的分子? 能形成几种相对分子质量不同的分子?能请列出式量。
H
D
T
H
H2(2) HD(3)
HT(4)
D DH(3)
D2(4)
DT(5)
T TH(4)
TD(5)
T2(6)
答:从表中可看出,一共是六种构成不同的分子,五 种相对分子质量不同的分子。
沪科版化学高一上册-1.2 原子结构和相对原子质量 课件

(不带电荷,相对质量为1)
核外电子(Z个)
(带一个单位的负电荷,质量为质子质量的1/1836, 质量可忽略不计)
4
例题:
与H2O具有相同质子数和电子数的微粒是 (C )
A、O2
B、N2
C、NH3
D、H2
5
±a
XA b±
Zc
A:质量数 Z:质子数,核电荷数 ±a:化合价 b±:离子所带的电荷数 c:分子中的原子个数
6
定义:指带电荷的原子或原子团。 阳离子:失去电子后变成阳离子,用Mn+表示 M - ne- → Mn+
阴离子:得到电子后变成阴离子,用Mn-表示 M + ne- → Mn-
7
阳离子: 核电荷数(Z) = 核内质子数 > 核外电子数 核外电子数 =核电荷数 - 电荷数
阴离子: 核电荷数(Z) = 核内质子数< 核外电子数 核外电子数= 核电荷数 + 电荷数
1
2
组成 电荷量
质量
相对质量
原子
原子核
质子
中子
+1
不带电电子-1 Nhomakorabea1.6726×10-27 kg 1.6748×10-27 kg 9.1095×10-31 kg
1.007
1.008
1/1836
3
原子核
质子(Z个)
(带一个单位的正电荷,相对质量为1)
X 质量数 A
质子数 Z
原子
中子(N个)N =A-Z
8
练习: 136C-NMB(核磁共振)可以用于含碳化合物的结
构分析,136C表示的碳原子 ( D )
A.核外有13个电子 B.核内有6个质子,核外有7个电子 C.质量数为13,原子序数为6,核内有7个质子 D.质量数为13,原子序数为6,核内有7个中子
【教学课件】《原子结构与相对原子质量》(化学沪科高一上)PPT共24页

谢谢!
【教学课件】《原子结构与相对原子 质量》(化学沪科高一上)
16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
Байду номын сангаас
61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4、今有AXZ与A+X1Z两种微粒,下列叙述正确的 是( A ) A、质子数一定相同,质量数和中子数一定不同 B、化学性质几乎相同 C、两中微粒一定都有质子、中子、电子构成 D、核电荷核,核外电子数一定相同
原子核半径小于原子半径的万分之一,体 积占原子体积的几千万亿分之一。(如同大型 体育场与蚂蚁)
表1-7中的相对质量怎样理解?若已知 一个C-12原子的质量是1.9932 x 10-26Kg, 能计算表中质子、电子和中子的相对质量
吗?
表1-7 质子、中子和电子的质量、相对质量和电量
质量/kg
相对质量①
电量/C
质子 1 .673 x 10-27
1.007
1.602 x 10-19
中子 1.675 x 10-27
1义86O是的否含一义样是?什么?与O的含 C-12原子指的是什么原子?
X A +d c-+-
Ze
中各个字母的含义:
A:质量数 Z:质子数 e:原子个数 c:电荷数
d: 化合价
质量数(A) 质子数(Z) 中子数(N) 核外电子数
Na Na+
S
S2Xn+ XmOHNH +
4
23
23
32
32 Z+N
20 、不要看不起任何人,因为弱小者在受到侮辱时也会报复。得罪了别人,哪怕他非常弱小,都可能会成为你成功的障碍。 10 、在漫长的人生旅途中,生活如果都是两点一线般的顺利,就会如同白开水一样平淡无味。只有酸甜苦辣咸五味俱全才是生活的全部,只 有悲喜哀痛七情六欲全部经历才算是完整的人生…… 12 、一个人要实现自己的梦想,最重要的是要具备以下两个条件:勇气和行动。 7 、如果真的想活得悠闲,那么,为何不学着让自己释放心灵的重负,学着忘却,忘记那些无碍于个人原则的得失;无关大局的磕磕碰碰;无伤 大雅的前嫌旧隙呢?学会让自己时时都轻装上阵,潇洒前行! 5 、只顾眼前的利益,得到的只是短暂的欢愉;目标高远,但也要面对现实。把理想和现实结合起来,才有可能成功。 18 、天使之所以会飞,是因为她们把自己看得很轻… 9 、善于发现,善于思考,处处都有成功力量的源泉。其实成功的本质是蕴藏在人的内心的,总想着成功的人,在什么地方都能受到启迪。 6 、经过奋斗,终于拨开了云雾,见到了日出,走上了阳光大道。面对取得的成绩,不要骄傲,再接再励,继续向前行。 5 、雄鹰可以飞得晚,但一定要飞得高。 7 、顶天立地的铮铮男儿,有着坚韧不拔的气质,忠诚和保卫国家,忠于和保护人民,吃苦在前,享乐在后,把祖国和人民的利益放在第一位 ;无条件的服从命令,听从指挥,跟着党走,一心一意;始终保持自信的战斗力,坚决果断,有第一就争,有红旗就要抗在自己的肩上;无怨无悔 ,自强不息,为国分忧,为民尽力,“一日为兵,终日为兵”。 13 、我心飞翔,路在脚下。 2 、赢家总有一个计划,输家总有一个借口。
B、电子数为13 D、质量数为6
2、已知R2-的核内有x个中子,R的质量数为 A,则m g R2-含有电子的物质的量为D ( )
A.m(A-x)/A
B.(A-x-2)/Am
C.m(A-x-2)/A
D.m(A-x+2)/A
3.在同温同压下,两个容积相等的密闭容器中 分别充满12C18O和14N2两种气体,以下关于这 两个容器中气体的说法正确的是( B ) A.分子数、质量分别相等 B.原子数相等,质量不相等 C.质子数相等,质量不等 D.分子数、质子数和中子数分别相等
原子是构成物质的一种微粒,原子 是否可以再分?如果原子可以再分,它 是由哪些更小的微粒构成的呢?
构成原子的三种基本粒子的带电荷情况, 质量大小等方面具体有什么差异? (阅读P29-30、表1-7及图1-32)
表1-7 质子、中子和电子的质量、相对质量和电量
质量/kg 相对质量① 电量/C
质子 1 .673 x 10-27
A
11
12
11
11
12
10
16
16
16
16
16
18
Z
N
Z-n
X-m
A+m-X
x
9
10
11
10
分子由原子构成 ,绝大多数原子是 由质子、中子、电子等基本粒子构成, 那么基本粒子可不可再分呢?
1、163C-NMR(核磁共振)可用于含碳化合物 的结构分析,有关163C的说法正确的是( A )
A、质子数为6 C、中子数为6
1.008
0
电子 9.109 x 10-31
1/1 836 1.602 x 10-19
①质子、中子的相对质量分别为质子和中子的质量与C-12原子质量的1/12相比较所得的数值。
3 、有大目标,须有大动作;有大追求,须有大改变。 4 、昔之得一者:天得一以清;地得一以宁;神得一以灵;谷得一以生;侯得一以为天下正。 15 、水的心是平静的,水的心是轻灵的,你看,水,一平如镜,云月其中,怡然自乐。水,怀着平静而轻灵的心,缓和的一淌而去,遇一些 阻隔且轻轻的绕过,何必那么多计较,心平而轻流自畅;如一路顺直,那更好了,我也可以尽情的奔流,一望千里,波涛澎湃,我也会挥洒我 的潇洒,我的纵情。
1.007
1.602 x 10-19
电子 9.109 x 10-31 1/1 836 1.602 x 10-19
①质子、中子的相对质量分别为质子和中子的质量与C-12原子质量(1.9932 x 10-26Kg)的 1/12相比较所得的数值。
据报道:国外某研究所发现了114号 元素的原子,这种原子核外共有114个 电子,你认为在计算该原子的质量时,
能否把114个电子都忽略不计?
阅读P30“问题解决”完成相关题目
表1-8 几种原子的质子数、中子数和相对原子质量
原子 质子数 中子数 质子数+中 相对原子 (Z) (N) 子数(A) 质 量
F
9
10
19
18.998
Na 11
12
23
22.990
Al
13
14
27
26.982
什么是质量数?AzX的含义是什么?
