铜族和锌族
【冶金精品文档】ds区元素(铜、锌)

CuCl 的盐酸溶液能吸收 CO,形成氯化羰基 铜(Ⅰ) [CuCl(CO)] ·H2O,此反应在气体中用于测 定混合气体中 CO 的含量。
2. 氯化铜
无水氯化铜为棕黄色晶体,在空气中潮解,它
易溶于水,也易溶于乙醇和丙酮。从溶液中结晶出
的二水合氯化铜为蓝色晶体。
Cu2O 主要用作玻璃、搪瓷工业的红色颜料。 CuOH 极不稳定,至今尚未制得 CuOH。
(二) 盐类
1. 氯化亚铜 氯化亚铜是一种白色晶体,熔点为 430 ℃,
难溶于水,吸湿后变为绿色,溶于氨水。
无机化学 在热的浓盐酸溶液中,用铜粉还原 CuCl2,
生成无色的 [CuCl2]-,用水稀释即可得到难溶于 水的 CuCl 白色沉淀:
[Ag(CN2)-] 作为镀银电解液的主要成分,电镀效 果很好,但因氰化物有剧毒,近年来逐渐被无毒镀银 液所代替。
第二节 锌族元素
一、锌族元素概述 二、锌的重要化合物 三、汞的重要化合物
Cd
一、锌族元素
第 12 族元素包括锌、镉、汞三种元素,通常 称为锌族元素。
(一) 锌族元素的通性
无机化学 锌族元素的价层电子组态为(n-1)d10ns2。锌族
Ag2O + H2O2
2Ag + H2O + O2↑
Ag2O 和 MnO2、Co2O3、CuO 的混合物在室温 下就能将 CO 迅速氧化成 CO2,因此常用于防毒面 具中。
(二) 硝酸银
硝酸银是最重要的可溶性银盐。将银溶于硝酸
溶液中,蒸发、结晶,得到硝酸银晶体。
AgNO3 加热到 713 K 时,按下式分解:
无机化学 成的配位个体的稳定性较差。 Cu2+ 还能与一些有机配体形成稳定的螯合物。
第二十章 铜族和锌族综述

西 昌 学 院
西昌学院
(2)、硫化物 Cu2S和Ag2S两种黑色化合物溶解度很 小,不溶于水和非氧化性酸。如可溶于氧 化性的硝酸: Cu2S+HNO3===? Ag2S+HNO3===? Cu2S可溶于KCN生成[Cu(CN)4]3-
(3)、AgNO3 Cu(I)不形成硝酸盐,AgNO3是一种重 要试剂。
西 昌 学 院
西昌学院
1、活泼性 IB族的最外层电子的Z*(有效核电荷 Z-)高,故第一电离势比碱金属的高。
由于d电子也包含在金属键中,故它 们的升华热和熔点也比碱金属的高得多。 其较惰性的特点与这些因素有关。结果是 其化合物有较多的共价性和较高的晶格能。
2、氧化数 铜、银、金三个元素,每一个元素都 有+1、+2和+3三种氧化数。最常见的氧化 数:铜为+2、银为+1、金为+3。
(5)、配合物 二价铜离子有较强的配合性。 [Cu(H2O)4]2+、[Cu(NH3)4]2+等,但实际上它们的 应该是[Cu(H2O)6]2+、[Cu(NH3)4(H2O)2]2+离子,原因 是因它们的结构是一种特殊的变形八面体结构。
西 昌 学 院
西昌学院
二价铜离子与CN-形成配合物时比较特殊: 2Cu2++4CN-===(CN)2↑+2CuCN↓(白色) 继续加入CN-则有: CuCN+3CN-===[Cu(CN)4]3用此方法可分离Cu2+和Cd2+离子,也说明Cu2+与 CN-不能共存。另外Cu2+还能形成螯合物。
西 昌 学 院
西昌学院
3、标准电极电势 Zn2++2e-==Zn =-0.786V Cd2++2e-==Cd =-0.4026V Hg22++2e-==2Hg =0.7986V 2Hg2++2e-==2Hg22+ =0.905V Ca2++2e-==Ca =-2.76V 化学活泼性远于碱土金属; 从上到下,金属活泼性递减;与碱土 金属的变化规律相反。 4、氢氧化物的碱性和稳定性 IIB族氢氧化物属弱碱,且易脱水形成 氧化物。 Be(OH)2和Zn(OH)2为两性氢氧化物。
知识总结——铜族元素和锌族元素
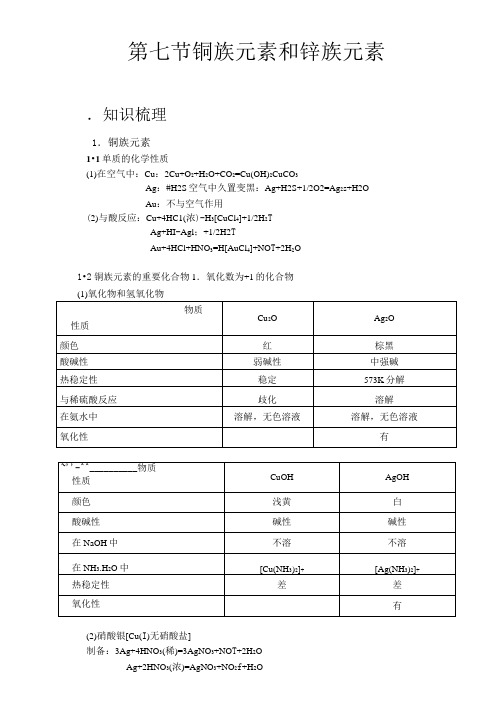
第七节铜族元素和锌族元素.知识梳理1.铜族元素1•1单质的化学性质(1)在空气中:Cu:2Cu+O2+H2O+CO2=Cu(OH)2CuCO3Ag:#H2S空气中久置变黑:Ag+H2S+1/2O2=Ag2s+H2OAu:不与空气作用(2)与酸反应:Cu+4HC1(浓)-H3[CuCl4]+1/2H2TAg+HI-Agl;+1/2H2TAu+4HCl+HNO3=H[AuCl4]+NO T+2H2O1•2铜族元素的重要化合物1.氧化数为+1的化合物(2)硝酸银[Cu(I)无硝酸盐]制备:3Ag+4HNO3(稀)=3AgNO3+NO T+2H2OAg+2HNO3(浓)=AgNO3+NO2f+H2O遇蛋白质生成黑色蛋白银,对有机组织有破坏作用,使用时勿使皮肤接触,在医药上用作消毒剂和腐蚀剂。
大量AgNO3用于制造照相底片上的卤化银,是重要的化学试剂。
(3)卤化物:①CuX2Cu2++2X-+SO2+2H2O-CuX;+4H++SO42-Cu2++2Cl-+Cu-2CuCl-2H[CuCl2]2Cu2++4I-=2CuI;+I2;CuX主要性质:在潮湿含氧环境下稳定性差:4CuCl+O2+4H2O=3CuOCuCl2^3H2O+2HCl8CuCl+O2=2Cu2O+4Cu2++8Cl-在相应卤化物中形成较稳定的卤配离子:CuX+X-=^CuX2-(无色)有一定氧化性:4CuI+Hg=Cu2[HgI4]+2Cu白暗红此反应用于检验实验室空气中的汞含量。
②AgX性质:见光分解:AgBr-Ag+Br因此AgBr用作感光材料。
(4)硫化物:Cu2S,Ag2S:黑色;难溶于水;溶于热浓硝酸3Cu2s+16HNO3(浓)一6Cu(NO3)2+3s;+4NO f+8H2O3Ag2s+8HNO3(浓)一6Ag(NO3)2+3S;+2NO f+4H2O2.氧化数为+2的化合物(1)氢氧化铜和氧化铜CuSO4+2NaOH=Cu(OH)2J+Na2SO4Cu(OH)2O①氧化铜热稳定性:在高温时明显分解2CuO1237K>Cu2O+1/2O2加热可被H2、CO、NH3还原3CuO+2NH3=3Cu+3H2O+N2②氢氧化铜(浅蓝色)微显两性(以碱性为主),可溶于浓强碱:Cu(OH)2+2OH-[Cu(OH)4]2-溶于氨水Cu(OH)2+4NH3^^[Cu(NH3)4](OH)2(2)氯化铜CuCl2无水CuCl2为共价化合物,结构为链状,其中Cu采取dsp2杂化方式。
第二十章 铜族 锌族综述

第二十章铜族锌族铜锌族处于ds区副族元素是不是过渡元素呢?一、关于过渡元素的区分1.只有ⅧB族早期使用的元素周期表是短式的,每个长周期有两行。
ⅧB为过渡位置强调的是从第一行到第二行之间过渡2.d区元素是过渡元素但d区有两种方法d区Sc Ti V Cr Mn Fe Co Ni Cu ZnY Zr Nb Mo Tc Ru Rh Pd Ag CdLa Hf Ta W Re Os Ir Pt Au HgAcd区ds区(1)(n-1)d1-10ns1-2副族除La系Ar 系以外(2)有空d电子ⅢB~ⅧB强调的是s区与p区间的过渡(3)ⅣB族~ⅠB族是过渡元素它不包括Sc副族,因为Sc3+和I1的变化Zn族最高正价为+2和Cu族不同(+1、+2、+3)不用d电子用d电子熔沸点低,金属键弱一家之说∴目前较普遍的看法是第二种其中又以ⅢB~ⅧB说法为多第一节铜锌分族的通性和单质§1-1 通性(见书P779 、P801页表)投影人们总是习惯于B ⅡB之间A---B之间进行比较一、书P800 ⅠA---ⅠB之间性质比较无一不是来源于结构二、Cu族和Zn族间性质有何不同?1.还原性Cu族< Zn族Cu族和3d和4s能量近,偶合作用强,不易失电子,而又易失去d电子,所以最高氧化态>族数周期表中除La系Ac系外独一无二的现象Zn 3d104s2全充满,偶合作用小,最高正价+2价§1-2 存在和提取人类历史上发现最早的三种金属:金、铜、银可能顺序黄铜矿CuFeS2XZ 闪锌矿ZnS 辉铜矿Cu2S 展砂HgS闪银矿Ag2S 孔雀石Cu(OH) 2CO3蓝铜矿Cu(OH) 2(CO)3角银矿AgCl甘肃铅锌矿(Ag)陕西汞锑矿一、CuFeS2Cu(本章中主要为)二、ZnS Zn三、粗汞Hg一、黄铜矿(CuFeS2) 精富集浮选矿除去脉石冰铜 粗Cu 精铜焙烧:2CuFeS 2 + O 2 Cu 2S + 2FeS +SO 22FeS + 3O 2 2FeO + 2SO 2 除渣 FeO + SiO 2 FeSiO 3顶吹 2Cu 2S(s) + 3O 2 (g) 2CuO(s) +2SO 2 (g)ΔH 0 =116.8KJ·mol ΔG 0 =78.6KJ·mol 精炼铜时 阳极泥 主要提炼贵金属的原料工业、工厂中的铜粗铜二、ZnS Zn (CdS Ca 2S 3)1.2MS(s) + 3O 2 (g) 2(MO) +2SO 2 (g)焙烧 砂子 1273K转炉 顶吹电解ΔG 0(Zn) = - 840.6 KJ·molΔG 0(Cd) = - 769.8 KJ·mol2.MO(s) + C(s) M(g) + CO(g) M = Zn ΔH 0 = 368KJ·molΔS 0 = 0.295KJ·molM = Cd ΔH 0 = 257.3KJ·molΔS 0 = 0.305KJ·mol反应温度 ~ 1100 0CCd(bp. 765 0C) Zn(907 0C)Cd 先蒸出 粗Cd 纯Cd Zn 用分级蒸馏 99.9%的ZnOr2’ ZnO Zn 2+ 电解Zn99.97%区域熔炼法 6个93.HgS HgHgS+ Fe Hg + FeSΔG 0 = - 46.7 KJ·molHgS + O 2 Hg + SO 2ΔG 0 = - 251.6 KJ·mol4HgS +4CaO 4Hg+ 3CaS + CaSO 4ΔG 0 = - 140.5 KJ·mol实验室制Hg 粗汞(Cu)H 2SO 4 Zn 除渣Cu + Hg2(NO3)2Cu(NO3)2 + 2Hg §1-3 物性(投影)书P783 804 1.Hg为液态惰性电子对效应2.ⅡB族熔点都低,且从上到下降低3.硬度小4.Ag器盛水可杀菌5.汞齐6.Hg蒸气为唯一(除稀有气体)单元子分子§1-4 化学性质(提问的方式)一、Zn + O2氧化层保护1. O2 ZnO空气(潮) Zn2(OH)2CO3 2.H2O ZnO +H↑H2O(室温) Zn(OH)2层3.Cl2 Br2 I 2表面反应,高于ZnX2沸点时完全反应S 很慢反应4. H2S ZnS层SO2ZnS + ZnO5. NH3ZnNNO NO x ZnO层HCl(g) 低于ZnCl2熔点时反应很慢HCl(稀) 2+ + H26. H2SO4 (浓) SO2+S+H2S+H2HNO3NO2 NO N2 NH4+ H2NaOH Zn(OH)42-H27. 金属氧化物置换金属卤化物置换二、Au + 王水H[AuCl4] + NOHNO3+4HCl三、2Cu + 6HCl(浓) 2H2CuCl3 + H2求算它的平衡常数Cu + e Cu E0Cu+/Cu = 0.52VCuCl + e Cu + Cl-K稳=2.0×1052H + 2e H2↑E Cu+/Cu=E0Cu+/Cu- lgQE0CuCl32-/Cu=E0Cu+/Cu - lgK稳=0.52-0.05916lg(2.0×105)V即E0CuCl32-/Cu > E0H+/H2不能反应?为什么?10.0591610.059160.21V<0.24V只要加浓HCl的浓度,即可反应推论:如何让Ag也还原出H2来?2Ag + H2S AgS + H22Ag + 2H+2Ag+ + H2↑εK HS 2H + S2-Ka1Ka22Ag+ + S2-Ag2S Ksp-1ε=-0.799V lgK=K=KKa1Ka2ksp-1=9.74×10-28×1.3×10-7×7.1×10-15×(2×10-49)-1有H2放出加快了这个反应例二.计算并判断2Ag + HI 2AgI +H2能否发生?2Ag + 2H+2Ag++ H2↑2Ag+ + 2I-2AgI Ksp=8.9×10-7向右进行作业:计算1)Cu + 4CN-+ H2O Cu(CN)43-2)2 Cu + 8NH3 + O2 + 2H2O2Cu(NH3)42+ + 4OH-第二节化合物氢氧化物氧化物硫化物卤化物§2-1氢氧化物Cu(OH)2Zn(OH)2Cd(OH)2 80~900C分解1250C 2000CΔ其他不稳定AgOH -450C稳定AgO 其中Zn(OH)2两性Cu(OH)2加40% NaOH也溶解[演示实验] Cu(OH)4- 葡萄糖§2-2氧化物有颜色的原因:极化作用 和碱金属氧化物相比Cu O∵极化作用 ∴向共价键过渡电荷迁移能↓吸收光波向长波移动一、制备(氧化物)1. 直接反应2M + O 2 2MO (Zn Cd )Cu + O 2 CuO , Cu 2OHg + O 2 HgO2.M n+和OH -反应1)Cu 2+ Zn 2+ Cd 2+2)其他Hg 2+ Ag +3.热分解含氧酸盐 Δ Δ Δ Δ2M(NO 3)2 2MO + 4NO 2 + O 2二、性质 1. 氧化性 Ag 2O +H 2O 2Ag +H 2O +O 22. CuO Cu 2O + O 2∴实验 CuSO 4·5H 2O CuSO 4CuO Cu 2O另外的例子Fe 2O 3·H 2O Fe 2O 3 Fe 3O 4 FeO 常温点燃 炼钢演示实验1)Zn 2+ + OH - Zn(OH)2不溶 why?1)Zn + NH 3 2)Zn + OH - + NH 33)ZnO + NH 3 4)Cu§2-3 硫化物ZnS 白色 CdS 黄色 其它为黑色 天然HgS 白色根据软硬酸碱规则 1)硫化物稳定2)很小一、制备:1)可直接化合制得2)阳离子 + H 2S 制得Δ Δ Δ NH 3其中ZnS Ksp 最大 可溶于强酸HCl0.1mol·l -1CdS 溶于浓盐酸 CuS 可溶于HNO 3 HgS Ksp 最小 王水将H 2S 通入M 2+溶液中M 2+ + H 2S MS + 2H + 起 0.1 0.1平 10-5 0.1 K 1K 2K= = = Ksp=2.3×10-26Ksp ZnS =2×10-22>10-26可溶于HCl K=4.6而 CuS 不溶考虑CdS 溶于HCl 的反应设[Cd 2+]=[HS]=0.1mol·l -1 求平衡时[H +]CdS + 2 H + Cd 2+ + H 2SX 0.1 0.1K=2Ka 1Ka Ksp =8.7×10-6 X=34 mol·l -1而实际浓HCl 12 mol·lCdS 不溶于HCl [H 2S] [Mn 2+] [H +]2 0.202 10-5·0.1 9.2×10-22 Ksp而实际上CdS 溶于的2 mol·l -1的HCl why?Cd 2+ + 2Cl2 CdCl 2 K 稳=3.2×10 2K=Ksp·K 稳/Ka 1·Ka 2=2.8×10-3[H +]=1.4 mol·l (如何计算,见下)CdS + 2H + + 2Cl - CdCl 2 + H 2S[]422.0X 10--=2.8×10-3 X=1.57(mol·l -1)同理 PbS 可溶于2.5 mol·l -的HCl 中若不考虑其Pb 2+ + Cl -的络合作用[H +]=30.0 mol·l -(用书上数据45.05)二、HgS + 王水 溶解HCl + KI HgI 42-Na 2S Na[HgS 2]三、ZnS + 4OH - Zn(OH)42- + S 2-§2-4卤化物Cu(ⅠⅡ) Ag(Ⅰ) Zn(Ⅱ) Hg(ⅠⅡ)一、CuX制备: 2CuCl 2 + SnCl 2 2CuCl ↓+ SnCl 42CuCl 2 + SO 2 + 2H 2O 2CuCl ↓ + H 2SO 4 + 2HCl CuCl 2 + Cu 2CuCl (并非溶液)2Cu 2+ + 5I - 2CuI + I 3-干燥CuCl 稳定 潮湿CuCl 不稳定 4CuCl + O 2 + 4H 2O 3CuO·CuCl 2·3H 2O8CuCl + O 2 2Cu 2O + 4Cu 2+ + 8Cl -可用于检测空气中含量,将涂有CuI 的纸条悬挂于空气中,如3小时(150C)不变色则达标4CuI + Hg Cu 2HgI 4 + 2Cu从亮黄至暗红色二、CuX 2 CuF 2 CuCl 2 CuBr 2白 棕 黑 极化作用问题:CuCl 2(0.1 mol·l 中有CuCl + 25%)颜色为天蓝色CuCl 2在HCl 中为黄绿色 why?生成配离子1. 制备CuCl 2·2H 2O CuCl 2 ? CuCl + 21Cl 2 100 0C 100 0C2. 磁性CuX 抗磁性CuX2顺磁性3.CuF中Cu--F键最弱(副族)可作氟化剂CuF2 + Mn MnF2 + CuTa TaF5三、AgXAg+ + X-- CN-AgO + 2HF 2AgF + H2OAgF AgCl AgBr AgI 极化作用上升1.感光材料AgX Ag +21X2(Cl Br I)显影曝光部分形成银核2AgX + + OH-2Ag + +2H2O对苯二酚显影剂其关键是含有Ag的才反应,不含Ag不反应曝光多的颜色深,少的颜色浅不曝光的:AgX + S2O32-Ag(S2O3)3-+X-定影液回收银:Ag(S2O3)3- + Fe Ag* Ag价贵,工业上、科研一直想法以Cu 代AgAgX不溶,但在X-中溶解度增大AgX2-hγAgX32- AgX43-AgCN + CN Ag(CN) 2-AgCl + Cl- 溶解度上升,不溶四、ZnX2 (ZnCl2)1.制备Zn + X2ZnX2 (Cl Br I)ZnO + 2HX ZnX2 + H2O ZnCl2极易溶于水ZnCl·H2O常见化合物有最高溶解度2.酸性ZnCl2 + H2O H[ZnCl2(OH)] FeO + 2H[ZnCl2 (OH)]Fe[ZnCl2(OH)]2 + H2O 电焊时用溶液清除氧化物3.ZnCl2溶液浓缩成Zn(OH)Cl ZnCl2·xH2O + xSOCl2ZnCl2+二氯亚砜2xHCl + xSO2如何由含水卤化物制备无水物?1)直接加热ΔMCl2·xH2O MCl2 + xH2O (M=Ca Sr Ba) M2+的水解能力极弱2)在HCl气氛下和NH4Cl一起加热,适用于有中等离解力的M2+ΔMgCl 2·6H 2O(s)Mg(OH)Cl(s) + HCl(g)+ 5H 2O(g)提问对于 Hg Hg Hg2Hg 2+ + 2e Hg 22+ 0.905V -2F ·0.905 Hg 22+ + 2e Hg 0.7986V -2F ·0.7986Hg 2+ + Hg Hg 22+ ε=0.1064V -F ·0.7986而 Hg 2+ + 2e Hg 22+ 0.8518V -2F ·0.8518Hg 22+ + 2e 2Hg 0.7986V -2F ·0.7986Hg 2+ + Hg Hg 22+ε=0.0602V -2F ·0.0602 3)M 2+水解力强的 + SOCl 2SOCl 2 + H 2O SO 2 + HCl (吸去了水又造成了HCl 气氛)五、Hg 2X 2X Hg Hg XHg 2X 2甘汞(甜的)SnCl 2SO 2 + HgCl 2 Hg 2Cl 2Hg适量 SnCl 2 + 2HgCl 2 Hg 2Cl 2 + SnCl 4 0.7986 0.905 0.8518适量Hg2Cl2 + SnCl22Hg + SnCl4HgCl2 + Hg Hg2Cl2↓升汞易升华1.甘汞电极Hg2Cl2 + 2e 2Hg(l) + 2Cl- E0=0.2682参比电极Reference electrodeHg2Cl2(s) Hg(s) + HgCl2(s)ΔG=-185.77+210.66=24.89KJ·mol>0后<40 甘汞有可能分解,由于∴甘汞有可能分解,由于ΔS>0 T↑分解越多∴含Hg2Cl2的要应放于干燥处条件变化时Hg2Cl2 + 2OH-Hg + HgO + 2Cl- + H2OHg2Cl2 + NH3Hg + Cl-Hg-NH + HCl氯化氨基汞NHCl 问:以上什么条件发生了变化?六、HgCl2Hg + X2HgX2HgO + 2HX HgX2 + H2OHg2+ + 2I-HgI2↓3000CHgSO + 2NaCl HgCl2↑+ NaSO4利用它易升华1. 溶解度 HgF 2HgCl 2 HgBr 2 HgCl 2 降低 离子化合物 共价 ∴水解 HgF + HO HgO + 2HF (80%水解)2. HgCl 2水解很弱,导电能力低HgCl 2 HgCl + + Cl - K=3.3×10-7HgCl + Hg 2+ + Cl - K=1.8×10-7说明HgCl + Cl - HgCl 3- Hg 2+ HgCl 42-少 极少易溶于有机溶剂 甲醇、丙酮试解释下列现象软硬酸碱规则演示实验 Hg 2+ + KI HgI 2 HgI 42-+KOH 和NH 4+ 红色方程式:Hg 2+ + 2I - HgI 2↓ 红色HgI + 2I - HgI 42- 无色 + KOH奈斯勒试剂NH 4Cl + 2K 2[HgI 4] + 4KOH KI Hg HgONH 2 I ↓KCl + 7KI + 3H 2O卤化物总结:1. Cu 族 Zn 族 极化作用和附加极化作用大 共价性强2. 都易挥发 HgCl 2升汞3. 氯化物溶解度和卤化物差别大 易溶 难溶 4. 易形成卤络离子,且Cl -<Br -<I -<CN -如无外加的X -时,如在CdCl 2中有CdCl + CdCl 3-等(由于软硬酸碱规则)§2-5其他化合物一、Cu(Ⅱ) CuSO 4·5H 2O 结构,见书Cu(NO 3) 2·3H 2OCu(Ac)2·H 2OCu 2[Fe(CN)6] 红棕色 Cu 2+的鉴定H H O H H O OSO 3 O OOS OO H H Cu O H H H H O H H O OSO 3 O O O S O O HH CuOH H H O HCu2+ + OH- + SO42-xCu(OH)2·yCuSO4↓生成氢氧化铜沉淀时带硫酸铜(碱式盐) 二、Ag(Ⅰ)AgNO3AgF易溶Ag + 2HNO3 (浓) AgNO3 + NO2 + H2O 快3Ag + 4HNO3 (稀) 3AgNO3 +NO +2H2O 慢权衡利弊1:3的HNO3银盐见光都分解,但AgX分解最快2Ag3PO4 + H3PO43Ag2HPO4问题:欲求3Ag2HPO42Ag3PO4 +H3PO4的平衡常数,应将上方程如何分开?3Ag2HPO46Ag+ + 3HPO4-Ksp3(Ag2HPO4)=K3sp12HPO4-2H+ + 2PO43-Ka322H+ + HPO4-H3PO4(Ka1Ka2)6Ag+ + 2PO4-2Ag3PO4Ksp-2(Ag3PO4)=Ksp2-2K=Ksp13Ka32/Ka1Ka2Ksp23三、Hg(Ⅰ)Hg 2(NO 3)2 Hg 2(ClO 4)21.制备 Hg + HNO 3 Hg 2(NO)2·nH 2O 过量 中等浓度2. 性质 水解 Hg 2(NO 3)2 + H 2O配它时应加HNO 3 Hg 2(OH)NO 3 +四、Hg(Ⅱ) Hg(NO 3)2 HgCl 2 水解,故应加HNO 3 无水Hg(NO 3)2的制法HgO + N 2O 4 Hg(NO 3)2N 2O 4 Hg(NO 3)2这又是制无水硝酸盐的方法有机化合物 Hg(CH 3)2第三节 配合物§3-1 铜(Ⅰ) Cu(NH 3)2+ CuCl 32-Cu(CN)43-Cu + + 2NH 3 Cu(NH)2+ β2=6.3×1010Cu + + 4NH 3 Cu(NH)4+ β4=4.7×1012一、演示实验Cu + NH 3水 Cu(NH 3)42+ 兰色 n 天 真空Cu + Cu(NH 3)42+ 2Cu(NH 3)2+ 求此K 稳Cu + Cu 2+ 2Cu +Cu(NH 3)42+ Cu 2+ + 4NH 3 (4.7×1012)-12Cu + + 4NH 3 Cu(NH 3)2+ (6.3×1010)2ε= 0.16-0.52 = -0.36V 8.22×10-7二、2Cu(NH 3)42+ + S 2O 5 + 4OH -2Cu(NH 3)2+ + 2SO 32- (此实验亦可演示)三、[Cu(NH 3)2]Ac + CO + NH 3[Cu(NH 3)]Ac·COΔH=-35KJ·mol 故低温有利四、以前我们讲过Cu 2+ + I - CuI + I 3-Cu 2+ + CN - CuCN + (CN)2更软硬 43-(2.5×10-50)极稳定,通入H 2S 也不沉淀Cu 2S如何分离Cu 2+和Cd 2+? (2×1030)Cu 2+ Cu(CN)43- Cd 2+ Cd(CN)42- CdS ↓(8×1016)CN -CN - H 2S五、Cu(CN)43- + e Cu + 4CN- E0=-1.27V Zn(CN)42- + 2e Zn + 4CN-=-1.26V 镀黄铜时用Cu(CN)43- Zn(CN)42-混合液§3-2Cu(Ⅱ) 配位数4 顺磁CuCl42-Cu(H2O) 2+dsp2dsp2Cu(NH3)42+Cu(en)22+CuY2-一、NaCl(s) NH3·H2OCu(H2O)42+CuCl42-Cu(NH3) 2+浅蓝绿深蓝1.1×105 4.7×1012∴Cu2+是什么颜色:以前答蓝或绿,如今绿案是配离子色§3-3 Ag(Ⅰ) Ag(NH3)2+ Ag(S2O3)3- Ag(CN) 2-其最重要的是它们之间的转换注意:Ag(NH3)2+会转化为Ag2NH和AgNH2易爆炸§3-4 Zn配合物配位数4,6(sp3 sp3d2)价键,晶体场理论都外轨型ZnCl42-Zn(NH3 2+Zn(NH3)62+一、Zn(OH)2Zn2+ + 2OH-Ksp=1.2×10-17 Zn2+ + 4NH3Zn(NH3)42+ β=6.3×1010 Zn(OH)2 + 4NH3Zn(NH3)42+ + 2OH-K=3.5×10-8别以为该反应不发生,只是因为中碱性不大,可反应,不完全如加入NH4+降低OH-的浓度Zn(OH)2 + 4NH3Zn(NH3)42++ 2OH-3.5×10-82NH4+ + 2OH-2NH3·H2O (1.8×10-5)2 Zn(OH)2 + 2NH3 + 2NH4+Zn(NH3)42+ + 2H2O K=1.1×102推论有NH4+时K增大(1.8×10-5)2=3.1×109倍对MOH型(1.8×10-5)-1=5.6×104M(OH)3 (1.8×10-5)-3=1.7×1014§3-5汞(Ⅱ)配合物 配位数4Nessler 试剂已讲过HgCl 2 + NH 4SCN (NH 4)2[Hg(SCN)4] (无色) Co[Hg(SCN)4]↓(兰色)第四节 Cu(Ⅰ) Cu(Ⅱ) 相互转化 Hg(Ⅰ) Hg(Ⅱ)Cu(Ⅰ) Cu(Ⅱ)一、Cu 2O CuO(s) + Cu ΔG 0=19.2KJ·mol -1说明Cu 2O 很稳定 而CuO ΔG 0>0也稳定 二、2CuO(s) Cu 2O(s) +21O 2(g) ΔH 0=143.7 KJ·mol -1 ΔG 0=108 KJ·mol -1 ∴在高温下ΔS>0 T Δ较大,使ΔG 0<0 在温度不太高时,可发生,向左反应三、Cu 2+ Cu + Cu由上可知2Cu + Cu + Cu 2+ ε=0.36VK= 1.3×106∴ Co 2+ 0.52 0.16 0.34Cu 2+/mol -11.3×10-2 1.3×10-4 1.3×10-6 1.3×10-8 Cu +/mol -110-4 10-5 10-6 10-7 ∴当[Cu 2+]>10-6mol·l -1 [Cu 2+]>[ Cu +]当[Cu 2+]<10-6mol·l -1 [Cu 2+]<[ Cu +]a.试解释Cu 2SO 4在水中极不稳定Cu 2SO 4CuSO 4 + Cub.如生成难溶盐或配离子使[Cu +]则可稳定存在Ksp 小 (CuI Cu 2S)K 稳大 (Cu(CN)43-越易生成Cu(Ⅰ)四、水溶液中生成Cu(Ⅰ)盐1.CuClCu + CuCl 2 + HCl(浓) CuCl 32-CuCl 32- CuCl ↓+ 2Cl -Or 2CuCl 2 + SO 2 + H 2O 2CuCl ↓+ H 2SO 4 + HCl2.CuICu 2+ + I - + e CuI(s) ΔG 0= -82.72KJ·mol -1E 0=0.86V∴E 0Cu 2+,I -/CuI > E 0I 2/I 3-∴2Cu 2+ + 5I - CuI +I 3-分析化学中Cu 2+将加入3~5倍量的I -然后水用Na2S2O3滴定五、Cu(Ⅰ)配离子如CuCl3-由于CuCl3-不够稳定∴同上2Cu2+ +6CN-2Cu(CN)2- +(CN)2Cu(CN)33-总之,生成难溶盐,配离子可使Cu(Ⅰ)存在§4-2 Hg() Hg()HgCl(s) + Hg(s) HgCl(s)ΔG0=-24.9KJ·mol-1这与Cu正好相反问题:Cu为ⅠB反而+1价不稳定Hg为ⅡB反而+2价不稳定这是因为Cu为3d104s1 , 3d和4s间偶合作用大使能级相差不大如I1I2I3 Cu 7.73ev 20.29ev 36.83ev 从电离能中也看不出明显的不同所以不象K那样为+1价而Hg 由于多谢电子对效应:Hg 22+有6s 电子 何去何从 Hg 2+无6s 电子水溶液中 Hg(NO 3)2 + Hg Hg 2(NO 3)2 更易生成Hg 2+ Hg 22+ Hg Hg 2+ + Hg Hg 22+ ε=0.131V K=166Cu +反应(歧化)平衡常数106 故逆转难 Hg 2+ + Hg Hg 22+反应K=166 逆转易一、 生成Hg(Ⅱ)难溶盐1.Hg 2Cl 2 + 2NH 3 NH 2Hg 2 NH 4ClNH 2Hg 2Cl NH 2HgCl ↓+ Hg ↓ 2.Hg 2(NO 3)2 Hg 2S HgS + S10-45 4×10-53二、 生成Hg(Ⅱ)配离子Hg 2(NO 3)2 + 2HCl Hg 2Cl 2↓+ 2HNO 3 Hg 2Cl 2 + 2HCl(浓) Hg 2[HgCl 4] + HgHgBr 42- HgI 42- Hg(SCN)42- Hg(CN)42-比HgCl 42-还稳定故Hg 22+ + Br -(I - SCN - CN -)亦反应,生成 0.920 0.789 H 2SHg2X2↓然后X -过量时HgX42-三、其他方法(氧化还原)2HgCl2 + SnCl2Hg2Cl2↓+ SnCl4Hg2Cl2 + SnCl22Hg↓+ SnCl4反之Hg2(NO3)2 + 4HNO32Hg(NO3)2 + 2NO2 + 2H2O第五节化学反应系统比化学反应,千千万万,要想将它们一一记住是不可能的如Cu Ag Hg的酸碱反应,沉淀反应,络合反应以Ag为例(1)对Ag的难溶(强酸制弱酸)AgAc + HNO3AgNO3 + HAc2Ag2CrO4 + 4HNO34AgNO3 +H2Cr2O4 + H2O (why Ag2S不反应?)(2)K稳不大的配合物可用浓度积小的沉淀Ag(NH3)2+ + Br-AgBr↓+ 2NH3Ag(S2O3)23+ + I-AgI↓+ 2S2O3 2-(3)沉淀间的转化Ag2O + H2O + 2I-2AgI + 2OH-如何确定它们之间的关系呢?见表(投影)[解释]我们以前的顺序是:同类比Ksp K稳那么,不同类呢?比E0注意1.Ag2C2O4 + CO32-Ag2CO3+ C2O42-K=1.4Ag2CO3 + CrO42-Ag2CrO4+ CO32- K=4.0反应进行不完全注意2. Ag(CN)-不可以生成AgCl 但如向其中加HCl则Ag(CN)- + 2H+ + Cl-AgCl↓+ HCN 问题:金属活动性顺序表K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au以前此顺序颠倒,后因电极势才改过来而Cu2+ + 2e Cu E0=0.34VHg2+ + 2e Hg E0=0.845VAg + + e Ag E 0=0.799V 怎么回事? 为什么没有改过来提示:以前 Fe + 2HCl FeCl 2 + H 2 2Fe + 6HCl 2FeCl 3 + 3H 2 老师是怎么讲的?故 Hg 2+ Hg 22+ Hg是不是只生成低价的 那为什么以Cu 2+ Cu而不以Cu + Cu 呢?Cu 2+ Cu + Cu 其关键是看哪一个稳定Fe 3+ Fe 2+ Fe 0.920 0.789 0.8450.158 0.522 0.34020.77 -0.44 -0.44。
第二十章铜族和锌族元素ds区

第19章 铜族和锌族元素§19-1铜族元素19-1-1铜族元素的通性铜族元素即ⅠB 的Cu 、Ag 、Au 三个元素。
1.价电子层结构(n-1)d 10s 1 最外层均只有1个s 电子,次外层18e 。
2.氧化数铜族元素具有+Ⅰ、+Ⅱ、+Ⅲ三种氧化态,而碱金属则只有+Ⅰ一种,这是因为铜族元素的ns 电子和(n-1)d 电子的能量相关不太大,在反应时容易补偿再被夺去1-2个电子的能量,例如我们比较同属四周期的Cu 和K ,Cu 的I 1=750KJ·mol -1,I 2=1970KJ·mol -1,而K 的I 1=421KJ·mol -1,I 2=3088KJ·mol -1,可见Cu 第二个电子的电离能较K 小得多。
铜族元素的I 1与I 2相相差约为1100-1400KJ·mol -1,而碱金属元素则相差2100KJ·mol -1 —6700KJ·mol -1。
3.金属活泼性同族从上到下按Cu 、Ag 、Au 的顺序金属活泼性减弱,这与所有副族元素一致,而与ⅠA 族等主族元素的金属性递变规律恰好相反。
其原因是因同副族元素从上到下原子半径增加不大,而新增加的次外层(对Au 还包括倒数第三层的f 电子)d 电子的屏蔽作用较小,因而有效核电荷从上到下增大的影响超过原子半径增大的影响所致。
从φ0值可以说明这一顺序:φ0Cu+/Cu =0.522V,φ0Ag+/Ag =0.796V ,φ0Au+/Au =1.68V与同周期碱金属元素相比,铜族元素由于次外层18e 结构, 核电荷又较同周期碱金属元素增加了10个单位,因此Z *增加明显,于是表现出x,I 均较大, 而原子半径和M +离子半径均较小,金属性较弱。
4.由于化合物共价性较明显,18e 结构离子有很强的极化力和变形性, 因此形成化合物时共价性较明显(如AgI )。
这可从它们的电负性值看出,按Pauling 提出的键的离子性百分数计算式键的离子性%=()1001241⨯⎥⎦⎤⎢⎣⎡---B A X X e当x A -x B >1.7键才属离子键。
铜族元素和锌族元素

Cu2O 不溶于水,对热稳定,在潮湿空气中缓慢被氧化成 CuO。它具 有半导体性质,曾用作整流器的材料。 Cu2O 的制备有干法和湿法: Cu2O 的干法制备在密闭容器中煅烧铜粉和 CuO 的混合物,即 得暗红色的 Cu2O: Cu+CuO→Cu2O Cu2O 的湿法制备在水溶液中,以硫酸铜为原料,亚硫酸钠为还 原剂,陆续加入适量氢氧化钠,反应过程中溶液维持微酸性 (pH=5) ,Cu2O 即按以下反应析出: 2CuSO4+3Na2SO3→Cu2O↓+3Na2SO4+2SO2↑ Cu2O 溶于稀硫酸,之后立即歧化: Cu2O+H2SO4→CuSO4+Cu+H2O Cu2O 溶于氨水和氢卤酸时,仍保持+的氧化值,分别形成稳定 的无色配合物,例如[Cu(NH3)2]+、[CuX2]-、[CuX3]2-等。 Cu2O+4NH3·H2O→2[Cu(NH3)2]OH+3H2O 可见 Cu+在水溶液中不稳定会发生岐化反应,而 Cu(I)在固相或 配位状态下可以稳定存在。 (2)氯化亚铜(CuCl) CuCl 为白色固体物质,属于共价化合物,其熔体导电性差。通 过测定其蒸气的相对分子质量,证实它的分子式应该是 Cu2Cl2,通 常将其化学式写为 CuCl。CuCl 是重要的亚铜盐,在有机合成中用 作催化剂和还原剂,在石油工业中作为脱硫剂和脱色剂,肥皂、脂
13.1.1 过渡元素的电子构型
过渡元素的原子结构特点是它们的原子最外层大多有 2 个 s 电 子(少数只有 1 个 s 电子,Pd 无 5s 电子),次外层分别有 l~10 个 d 电子,其价层电子构型为(n-1)d1-10ns1-2,其中ⅠB 和ⅡB 族为(n- 1)d10ns1-2。由于过渡元素原子最外层只有 1~2 个电子,较易失 去,故过渡元素都是金属元素。
铜、锌

II B
Zn Cd Hg
§ 18-1 铜族元素
1-1 通性
铜族元素虽能形成与碱金属相同的+1氧化态的化合物,但它们却很 少相似。碱金属在周期表中是最活泼的金属,尤其是铯、而铜族金 属是不活泼的,且由Cu→Ag→Au活泼性递减。金是很惰性的金属。
铜族元素电势图
/V
铜族与碱金属元素性质不同的内在原因在于它们电子构型的不同。 铜族元素次外层比碱金属多10个d电子。由于d电子屏蔽核电荷的作 用较小,致使铜族元素的有效核电荷比相应的碱金属元素增大,核 对价电子吸引力增强,第一电离能增大,活泼性比碱金属差。 铜的第二、第三电离势较银低得很多。这是由于铜族元素的(n— 1)d轨道刚填满,刚填满的■能级还不稳定,与ns轨道能极差小。 因此,d电子参与成键,能形成大于族数的+2、+3氧化态化合物。它 的多变价体现了过渡元素的特性。
(2)氧化数为+2的化合物
(a)氢氧化铜和氧化铜
Cu2++2OH-→Cu(OH)2↓ Cu(OH)2显两性,既溶于酸,又溶于过量浓碱生成蓝色[Cu(OH)4]2-。 Cu(OH)2+2NaOH—→Na2[Cu(OH)4] 由于Cu(OH)2的酸性较弱及溶度积较小(Ksp=2.6×10-19),故需和较浓的 强碱溶液反应才能溶解。 Cu(OH)42- + C6H12O6 = CuOH + H2O + C6H12O7 ↓
(1)氧化数为+1的化合物
(a)氧化物和氢氧化物
Cu和Ag都能生成M2O型的氧化物和MOH型的不稳定 的氢氧化物
(b)硝酸银
AgNO3是可溶的银盐,也是制备其它Ag(Ⅰ)盐的原料。 工业上是将Ag和HNO3作用制得 Ag+2HNO3(浓)—→AgNO3+NO2+H2O 3Ag+4HNO3(稀)—→3AgNO3+NO+2H2O
常见金属元素及其化合物—铜族和锌族元素及其化合物的性质识用

它们都可形成许金多合金。
2. 物理性质
(1) 特征颜色:Cu(紫红),Ag(白), Au(黄) (2) 溶、沸点较其它过渡金属低 (3) 导电性、导热性良好,且Ag>Cu>Au (4) 延展性良好
3.化学性质
铜族元素的化学活性从Cu至Au降低,主要表现 在与空气中氧的反应和与酸的反应。
425℃熔化约 1000℃沸腾
1.5(25℃),难溶 于水。在空气中吸 湿后变绿,溶于氨
水
(1) Cu(Ⅰ)的化合物: 通常为无色。 Cu(Ⅰ)的化合物在固态时稳定性高于Cu(Ⅱ),但在溶液
中容易被氧化为Cu(Ⅱ)。 几乎所有的Cu(Ⅰ)化合物都难溶于水,其溶解度顺序为:
CuCl>CuBr>CuI>CuSCN>CuCN>Cu2S
2Cu + 2H2SO4(浓) 2Ag + 2H2SO4(浓) 金只能与王水作用:
2CuSO4 + SO2↑+ 2H2O Ag2SO4 + SO2↑+ 2H2O
Au + 4HCl + HNO3 HAuCl4 + NO↑+ 2H2O
(5)Cu、Ag、Au溶于含氧的碱性氰化物中。
4Au+O2+8CN-+2H2O
Cr
3d54s1
Mn
3d54s2
Fe
3d64s2
Co
3d74s2
Ni
3d84s2
Cu
3d104s1
Zn
3d104s2
表3-3 过渡元素的一般性质
熔点 /℃
沸点 /℃
原子半 径
pm
第一离解 能
kJ·mol-1
铜族和锌族.

容易形成合金,尤其以铜合金居多。常见的铜合金有黄铜(锌 40%),青铜(锡∼15%,锌5%),白铜(镍13%∼ 15%)。
(2)化学性质
铜族元素的氧化态有 +1,+2,+3 三种,这是铜 族元素原子的 (n-1)d 和 ns 轨道能量相近造成的,不仅 4s 电子能参加反应,3d 电子在一定条件下也可失去一个 到两个,所以呈现变价。相比之下,碱金属 3s 与次外层 2p 轨道能量相差很大,在一般条件下很难失去次外层电 子,通常只能为 +1价。
闪锌矿
辰砂
铅锌矿
IA ns1
IIA ns2
IB (n-1)d10ns1
IIB (n-1)d10ns2
由价电子构型可见,IA、IIA和IB、IIB在失去最外层
s电子后分别都呈现+1和+2价氧化态,所以IB与IA、IIB
与 IIA 有相似之处。
但是,由于 ds 区元素原子的次外层有18 个电子, 而 IA与IIA元素原子次外层有8个电子,因此,无论是 单质还是化合物都表现出显著的差异。
Cu2O基本属于共价化合物,不溶于水。
Cu2O呈弱碱性,溶于稀酸,并立即歧化为Cu和 Cu2+,反应如下:
Cu2O + 2H+
Cu + + Cu2+ + H2O
Cu2O十分稳定,在 1235 ℃ 熔化但不分解。
Cu2O溶于氨水,生成无色的络离子:
Cu2O + 4 NH3 + H2O
2 [Cu(NH3)2]+ + 2OH-
Cu2+和酒石酸根 C4H4O62-的配位化合物,其溶液呈
深蓝色,有机化学中称为Fehling(斐林)溶液,用来鉴定醛
第18章-铜族元素 锌族元素

第18章铜族元素锌族元素18.1 铜族元素18.1.1通性铜族元素:周期表ds区,第IB副族,包括铜(c opper)、银(s ilver)、金(g old)三种元素。
价电子构型为(n-1)d10ns1,最外电子层只有一个s电子,次外层为18个电子。
铜族元素与碱金属元素的性质差异主要体现在以下三点:●铜族元素的最外层电子受到的有效核电荷较大,使铜族元素的电离能高,原子半径小,密度大,化学活性差。
●铜族元素有多种氧化态,主要有+Ⅰ、+Ⅱ、+Ⅲ三种,而碱金属的氧化态只有+Ⅰ。
●碱金属从Na到Cs,金属活泼性增高;铜族元素恰恰相反,从铜到金化学活性逐渐降低。
从Cu到Au,原子半径增加不大,而核电荷却有明显增加,次外层18电子的屏蔽效应又小,使核对电子的吸引力增大,因而金属活泼性依次减弱。
铜族元素通性及变化规律:●从Cu到Au形成一价水合离子的活性越来越弱,金属的活泼性减弱。
●Cu+在高温和固态时很稳定--- ①d10全充满的稳定构型电子;②铜的第二电离能比第一过渡系任何元素都大的缘故。
但在溶液中Cu+不稳定,易歧化成Cu2+和Cu----Cu2+的水和热很大。
●一价离子具有18电子构型,有很强的极化能力和明显的变形性,本族元素易形成共价化合物;●原子中(n-1)d、n s、n p轨道的能量相差不大,有能级较低的空轨道,所以有很强的形成配合物的倾向。
18.1.2单质的物理性质和化学性质1.物理性质铜族元素单质的密度较大,熔沸点较高,但硬度较小。
它们都有很好的延展性,特别是金,1克金能抽成长达3 km的金丝或压成厚约0.0001mm的金箔,500 张的总厚度比头发丝的直径还薄些。
铜族元素都有良好的导电性和导热性。
银的导电性在金属中位居首位,铜列次席。
铜族金属之间以及和其它金属之间,都很容易形成合金,其中铜合金种类很多,历史也最久远,如青铜(80%Cu,15%Sn, 5%Zn)质地坚韧、易铸;黄铜(60%Cu、40%Zn)广泛用于制作仪器零件;白铜(50~70%Cu,18~20%Ni,13~15%Zn)主要用作刀具等。
第13章过渡元素(一) 铜族和锌族元素
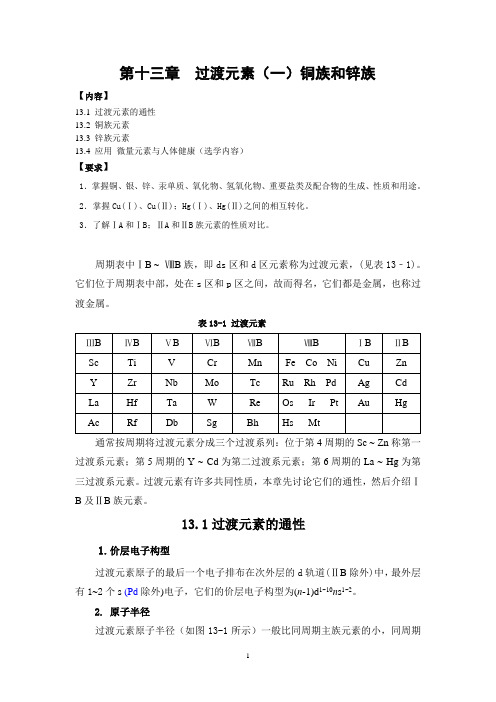
第十三章过渡元素(一)铜族和锌族【内容】13.1 过渡元素的通性13.2 铜族元素13.3 锌族元素13.4 应用微量元素与人体健康(选学内容)【要求】1.掌握铜、银、锌、汞单质、氧化物、氢氧化物、重要盐类及配合物的生成、性质和用途。
2.掌握Cu(Ⅰ)、Cu(Ⅱ);Hg(Ⅰ)、Hg(Ⅱ)之间的相互转化。
3.了解ⅠA和ⅠB;ⅡA和ⅡB族元素的性质对比。
周期表中ⅠB ~ⅧB族,即ds区和d区元素称为过渡元素,(见表13﹣1)。
它们位于周期表中部,处在s区和p区之间,故而得名,它们都是金属,也称过渡金属。
表13-1 过渡元素通常按周期将过渡元素分成三个过渡系列:位于第4周期的Sc ~ Zn称第一过渡系元素;第5周期的Y ~ Cd为第二过渡系元素;第6周期的La ~ Hg为第三过渡系元素。
过渡元素有许多共同性质,本章先讨论它们的通性,然后介绍ⅠB及ⅡB族元素。
13.1过渡元素的通性1.价层电子构型过渡元素原子的最后一个电子排布在次外层的d轨道(ⅡB除外)中,最外层有1~2个s (Pd除外)电子,它们的价层电子构型为(n-1)d1~10n s1~2。
2. 原子半径过渡元素原子半径(如图13-1所示)一般比同周期主族元素的小,同周期元素从左到右原子半径缓慢减小,到铜族前后又稍增大。
同族元素从上往下原子半径增大,但第二、第三过渡系(除ⅢB外)由于镧系收缩使同族元素原子半径十分接近,导致元素性质相似。
图13-1过渡元素原子半径3. 氧化态过渡元素有多种氧化态,因其最外层s电子和次外层部分或全部d电子都可作为价电子参与成键,一般可由+2依次增加到与族数相同的氧化态(Ⅷ族除Ru、Os外,其它元素尚无Ⅷ氧化态),这种氧化态的显著特征以第一过渡系最为典型。
表13-2第一过渡系元素的氧化数(下划线表示常见的氧化态)由13-2表可看出随着原子序数的增加,氧化数先是逐渐升高,后又逐渐降低。
这种变化主要是由于开始时3d轨道中价电子数增加,氧化数逐渐升高,当3d轨道中电子数达到5或超过5时,3d轨道逐渐趋向稳定。
理学铜族元素和锌族元素by啥子一家

② Cu(Ⅱ)的化合物: 特点:
Cu(Ⅱ)为d9构型,有一个成单电子, 顺磁性,它的化合物或配合物因 Cu2+可发生d-d跃迁而呈现颜色。 Cu(Ⅱ)的化合物在固态或水溶液中 都稳定,且易溶于水。
氧化铜:
• 性质:碱性氧化物、具有一定的氧化性(能被还 原)、热稳定性高(1273K以上分解成Cu2O)。
(4).与卤素反应
铜族元素均能和卤素反应。铜在常温下就能 与卤素反应,银反应很慢,金必须加热才能与干 燥的卤素反应。(从铜到金越老越难反应)
三、 铜族元素的重要化合物
1.铜的化合物
Cu(+1)、 Cu(+2)的化合物主要是氧化物及其氢氧化物、卤 化物、硫化物和配合物。
① Cu(Ⅰ)的化合物:
特点:亚铜化合物是反磁性的,d轨道全满,没有d-d 跃迁,通常为无色。 Cu(Ⅰ)的化合物在固态时稳定 性高于Cu(Ⅱ),但在溶液中容易被氧化为Cu(Ⅱ)。几 乎所有的Cu(Ⅰ)化合物都难溶于水,其溶解度顺序为: CuCl>CuBr>CuI>CuSCN>CuCN>Cu2S
第十七章 铜、锌副族
由于铜、锌族元素价电子层构型为 (n-1)d10ns1、(n-1)d10ns2,都属ds区, 故一并进行讨论。铜族元素包括铜、 银、金,位于周期表ⅠB族;锌族 元素包括锌、镉、汞,位于周期表 ⅡB族。
• 本章要求:
• 1. 掌握铜族和锌族元素单质的性质和用 途。
• 2. 掌握铜、银、锌、汞的氧化物 氢氧化 物 重要盐类以及配合物的生成与性质。
氢氧化铜:
• 性质:两性偏碱: Cu(OH)2 + OH- ⇌ Cu(OH)42- 作 为沉淀,Cu(OH)2 在溶液中存在的pH 范围是5-15。
卤化物:
铜族元素锌族元素优秀课件

II B (n-1)d10ns2
Zn Cd Hg 锌族
与主族金属接 近一些,氧化 态以+2为主
同周期,IB---IIB族比较
性质
IB
价电子构型 (n-1)d10ns1
原子半径r/pm
<
金属活泼性
<
II B (n-1)d10ns2
(n-1)d电子未参与 成键,性质与过渡 元素有较大差别
● 与NH3反应
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]+ + 2OH-
红色
无色
(很快被空气中的氧氧化)
4 [ C u ( N H 3 ) 2 ] + + 8 N H 3 + 2 H 2 O + O 2 4 [ C u ( N H 3 ) 4 ] 2 + + 4 O H -
18.1.3 存在和冶炼
1. 存在 2. 冶炼
单质:Cu,Ag,Au 矿物:孔雀石:Cu2(OH)2CO3
辉银矿:Ag2S 碲金矿Байду номын сангаасAuTe2
氰化法提炼金和银
Ag2S+ 4NaCN= Na[Ag(CN)2] + Na2S 4Ag + 8NaCN + 2H2O + O2 = 4Na[Ag(CN)2] + 4NaOH 4Au+8NaCN+2H2O+O2 = 4Na[Au(CN)2] + 4NaOH 2Na[Ag(CN)2] + Zn = 2Ag + 4Na2[Zn(CN)4]
无色
蓝色
∴ 可用[ Cu(NH3)2 ] + 除去混合气体中的O2
无机化学 第17章铜族和锌族元素

O2
2
不可用铜器盛氨水
7
[Cu(NH3 ) 4 ] (蓝)
4Au O2 8CN 2H 2 O 4[Au(CN)2 ] 4OH
17.3
铜族元素的主要化合物
1 . 氧化物及氢氧化物
加热Cu(OH)2、Cu2(OH)2CO3、Cu(NO3)2都可 以得到CuO:
Cu(OH)2 CuCO3 2CuO H2O CO2 Cu(OH)2 CuO H2O
H 2SO 4 Ag 2S(s, 黑)
21
Ag+的鉴定:
HCl AgCl Ag
NH 3
Ag(NH )
3 2
Br AgBr(s)
S2 O 3 3
-
HNO 3
Ag 2S(s) S Ag(CN)
2-
2
CN AgI(s) I Ag(S O ) 3 2 3 2 I AgI(趋势较小) 2
导热率(Hg=1)
51.3
57.2
39.2
3
熔沸点较低(相对于其他过渡金属): ①原子半径较大、结构不够紧密 ②次外层充满,电子不参与成键,价电 子较少 良好导电导热性和良好的延展性 1gAu可拉3.4km金丝,金也可被压成 0.0001mm厚的金箔 Cu、Ag、Au和许多金属形成合金 Cu-Zn 黄铜 Cu-Sn-Zn 青铜 60-40 80 -15 -5 Cu —— Ni —— Zn 白铜 50~70 - 13~15 - 13~25 4
Au 4HCl(浓) HNO3 (浓) H[AuCl4 ] NO(g) 2H 2 O
6
与沉淀剂、配合剂的作用
4Ag 2H2S O2 2Ag2S 2H2O
铜族元素和锌族元素

and Zinc Subgroup (2010级使用) 2011.4
寄
语
• 祝各位同学: • 在大学第一年即将结束的时间里目标明,学业成! • 愉快而充实的度过人生中最美好的大学时光! • 在专业学习上,会学、乐学加真学! • 在竞争与挑战面前冲向同仁们前面! • 珍惜这段最重要的经历,确立更高的人生奋斗 • 目标,不断的努力,不断的进取, 为人生的辉 • 煌积淀坚实的力量!
例如,NaCl和AgCl,前者易溶而后者难溶。同样,锌族元素与
碱土金属元素既有相似之处,也有明显的差异。例如MgO和 ZnO都难溶于水,但前者显碱性而后者显两性。
IB
II B
d 区元素的电子分别填充在 3d 亚层、4d 亚层和 5d 亚层
上 . 1996年2月德国科学家宣布发现112号元素, 使第四过渡 系的空格终于被填满.
二、铜族元素
铜(copper, cuprum) 银(silver, argentum) 金(gold, aurum) 位于长周期表中IB族,通常称为铜族元素, 又称货币金属。
(一)通性
已知铜族元素价电子构型为(n-1)d10ns1,铜族元素原子不仅 可以失去ns电子,也可进一步失去部分d电子。因此铜族元素 都有+1、+2、+3三种氧化态。但由于其稳定性不同,铜常见的 氧化态为+2,银为+1,金为+3。
Cu2S 颜色 Ksp 25 ℃ 稳定性 黑
CuS 黑
Ag2S 黑
ZnS 白
CdS 黄
HgS 黑
2.010-47
8.510-45
6.310-50
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3、活泼性顺序 Au3++3e-==Au =1.42V Ag2++e-==Ag+ =1.987V Ag++e-==Ag =0.7996V Cu++e-==Cu =0.52V K++e-==K =-2.925V 化学活泼性远小于碱金属; 从上到下,金属活泼性递减;与碱金属的变化 规律相反。 4、氢氧化物的碱性和稳定性 氢氧化物的碱性较弱,且极易脱水形成氧化物, 而碱金属氢氧化物是强碱,对热非常稳定。
化学与生命科学学院
专业基础课
无机化学
-----铜族和锌族
目
铜 族 元 素 锌 族 元 素
录
本 章 要 求 作 业
基本要求
1.了解铜、银、锌、汞单质的性质和用途
2.掌握铜、银、锌、汞氧化物及盐的性质
3.掌握Cu(I)Cu(II)Hg(I)Hg(II)之间的相互转化
4.掌握IA与IB、IIA和IIB族元素的对比
2 H2O+ 2Cu + 8 NH3 + O2
+ 4OH 2[Cu(NH3)4]
2+
所以在合成氨工厂不能用铜阀门或管道
Cu能直接溶于KCN溶液(生成[Cu(CN)2]-):
2 Cu+ 8 CN + 2 H2O
-
-
2 [Cu(CN)4] +H 2 +2OH
-
3-
-
在有氧时Ag和Au也能溶于KCN中,金还能溶 于王水
(3 )硫化物 Cu2S是黑色化合物溶解度很小,不溶于水和非氧 化性酸。如可溶于氧化性的硝酸: Cu2S+HNO3=== Ag2S+HNO3=== Cu2S可溶于KCN生成[Cu(CN)2]在硫酸铜溶液中,加入硫代硫酸钠溶液共热生成 硫化亚铜沉淀,在分析化学中以此反应除去铜,相应 的化学反应方程式:
(2)卤化物 Cu 2+ + 2Cl - + Cu --- 2CuCl ↓ [问题]该反应能否进行到底? HCl(浓)+Cu+CuCl2===2[CuCl2]-+2H+ 生成物用水稀释则得 CuCl白色沉淀。 除I-, 二价铜在有X-及还原剂同时存在时生成CuX。 2Cu 2+ + 2X- + SO2 +2H2O == 2CuX↓ + 4H+ + SO42+ 2Cu2++4I-===2CuI↓+I2 (滴定分析中用于测定铜) !将涂有CuI的纸条悬挂在实验室中,可以根据其颜 色的变化测定空气中汞的含量: 4CuI+Hg===Cu2HgI4 + 2Cu 若在288K经过3h白色不变,说明空气职汞低于允许 含量0.1mg/m3;若变为亮黄色至暗红色,说明汞超标!!!
4 Au + 8 CN +2 H2O + O2
Au + HNO3+ 4HCl
4 [Au(CN)2] + 4OH
-
H[AuCl4] + NO + 2H2O
铜族元素的提取
1、铜的冶炼:黄铜矿CuFeS2煅烧 CuFeS2+O2——SO2 +Cu2S+FeS FeS+O2+SiO2—— SO2+FeSiO3 浮渣 Cu2S和残余的FeS的混合物称冰铜
2、氧化数 铜、银、金三个元素,每一个元素都有+1、+2和 +3三种氧化数。最常见的氧化数:铜为+2、银为+1、 金为+3。
原因是IB族的ns电子和次外层(n-1)d电子能量相 差不大,在与其他元素化合时,不仅ns电子能参加反 应,(n-1)d电子也能依反应条件的不同,可以部分参 加反应,即表现出不同的氧化态。如:
2 2Cu 2 2S2O3 2H2 ) Cu2 S S 2SO4 4H 2
2、铜(II)的化合属却通常不形成配合
物。
6、化合物
铜族元素有许多二元化合物有相当的共价性。如: AgI是共价分子。而碱金属一般是离子型化合物。
单质的物理性质
硬度:比碱金属的较大
导电性:所有金属中 银最高,铜第二
合金:黄铜—含锌;青铜—含锡;白铜—含镍
单质的化学性质
惰性,但潮湿的空气中,或有难溶物生成时, 则会被氧化,例如: 2Cu + O2 + H2O + CO2 == Cu(OH)2CuCO3 孔雀石 4Ag+O2+2H2S==2Ag2S(黑色)+2H2O 有氧时Cu能溶于氨水(生成[Cu(NH3)4]2+)中:
900℃
2[Cu(OH)4]2- + C6H12O6 == Cu2O + C6H12O7 + 2H2O+2OH分析化学用此反应测定醛,医学上用来检查糖尿病。 Cu2O由于制备条件不同,得到的晶粒大小不同,呈 现的颜色会不同。 Cu2O在酸性溶液中会发生歧化反应 Cu2O溶于氨水:无色变蓝色 4[Cu(NH3)2]+ +8NH3•H2O+O2 == 4[Cu(NH3)4]2+ + 4OH-+6H2O 基于此性质,可以用来除去气体中的氧 [Cu(NH3)2]Ac+ CO+NH3 ↔ [Cu(NH3)3 CO] Ac 此反应可逆,则用于合成氨的铜洗工段,吸收CO。
进一步煅烧冰铜则得98%的粗铜
4 Au + 8 CN +2 H2O + O2
2、银和金的提取 -
4 [Au(CN)2] + 4OH
-
-
2Au(CN)2-+Zn==Zn(CN)42-+2Au
另一种方法是形成汞齐, 然后蒸发
二、铜的化合物
1、铜(I)的化合物 (1)氧化物 Cu2O是红色物质,共价型、难溶于水的化合物。 在高温下Cu直接与O2作用生成Cu2O,或CuO 高 温分解得到Cu2O+O2 4CuO===2Cu2O+O2 由此可见, 高温下Cu2O稳定,1508K才分解 这就是为什么电烙铁在使用很长时间后, 表面会脱落红色物质的原因。
第一节 铜族元素
铜 族 通 性
铜族元素的化合物
一、铜族通性
[问题] 铜族元素与碱金属相比有什么差异? 1、原子结构 IB族的价电子结构为(n-1)d10ns1。 IB族的最外层电子的Z*(有效核电荷Z-)高, 故第一电离势比碱金属的高。 由于d电子也包含在金属键中,故它们的升华 热和熔点也比碱金属的高得多。其化合物有较多的 共价性和较高的晶格能。
