纳米TiO2粉体制备方法
纳米TiO2粉体的制备
—
◆ 湿 凝胶— ’ 超 细 TO2 i
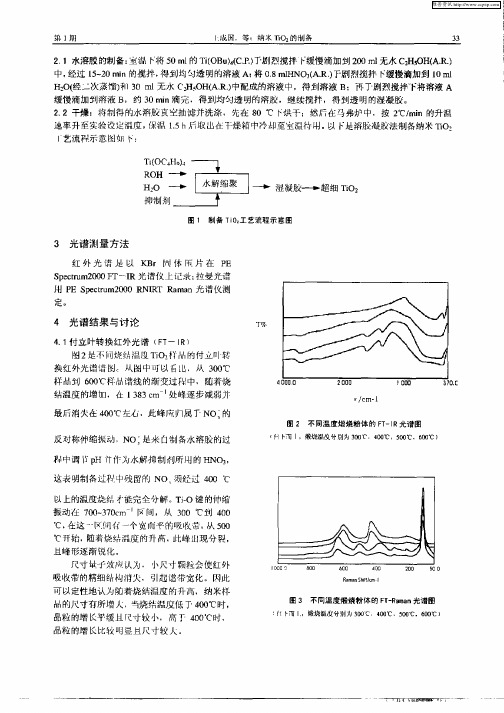
图 1 制备 T 0工艺流程示意图 i2
3 光谱 测 量方 法
红 外光 谱 是 以 K Br 刷 体 压 片 在 P E S et m2 0 T R光谱 仪 上 记录 ; p cr 0 0F —I u 拉曼光谱
固 4 0 ̄ 4 0C煅烧粉体 的 XR D图
固 5 5 0C煅烧粉体 的 X D图 0" R
图 6 0 1 煅烧粉体 的 XR 6 0 2 D图
( 中:a表小锐铁矿 ( aae ̄型 的吸收峰.r ÷ a t )u n s 表 金红 ( te ̄型的吸 收峰 ) r f) ul
刚 P pc u 0 0R R ma E S et m20 NIT Ra n光 谱仪测 r
定。
4 光谱 结 果 与讨 论
4 1 立叶转换 红 外 光谱 (T I) .付 F— R 图 2是不 同烧 结温度 TO2 品的付立 叶转 i 样 换红 外光谱 谱 从 中可 以看 山 ,从 30 0 ℃ 样 品到 60C样 品谱线 的渐 变 过 中 ,随着烧 0" 结温度 的增 加 ,在 l 8 m 处峰逐 步 减弱并 3c 3 最后 消失在 40 0 %左右 ,此 峰 应 门属 丁 NO: 的
22 干燥 :将 制 得 的水溶股 真空抽 滤 并洗 涤 ,先在 8 ℃ r 干 :然 后在 马弗炉 中 ,按 2 ri . 0 烘 ℃t n的升温 a 速 率升至 实验 设定温 度 , 温 1 I 山在 干燥箱 中冷却 至宝 hF取 5 i 以 i
二种样.的 X D 结果表明.TO 粉体经过不同温度 的煅烧所得粉体 现山不同的绢品状态。低温 R i (0 " )煅烧 生成 的 TO2 4 02 ( i 粉体 为 锐钛矿 结 构 .高温 (0  ̄ 6 0C)煅烧 生成 的 TO 粉 体为 金红 石结构 。 i2
纳米二氧化钛粉体的制备与表征

纳米TiO粉体的制备与表征2一:引言•纳米材料是指在三维空间中至少在一维方向上尺寸在1-100nm 之间并具有特殊性能的材料,这大约相当于10~100个原子紧密排列在一起的尺度。
由于纳米材料至少在一维方向上为纳米尺度,所以纳米材料具有普通材料所不具背的性能,如表面效应、小体积效应、量子尺寸效应、宏观量子隧道效应等。
因此纳米TiO 2粉体具备许多特殊的功能比如性能稳定、无毒、光催化活性高、价格低廉、耐化学腐蚀性好,是良好的光催化剂、消毒剂杀菌剂。
•光催化作为一种新型环境净化技术引起人们越来越多的关注。
纳米TiO2以良好的性能稳定、效率高、无二次污染、成本低廉等优点,在光催化降解废水中的有机物方面具有广阔的应用。
面临的问题:催化的效率比较低,而且对太阳能的利用率比较低。
二:TiO简介21:TiO2特性纳米TiO2作为一种新型的功能材料,是目前应用最广泛的一种纳米材料。
纳米二氧化钛具有粒径小、吸收紫外光能力强以及良好的随角异色、光催化和抗菌杀毒等优点。
纳米TiO2晶体主要有锐钛型和金红石型两种晶型。
金红石型晶体则主要用于防紫外线、增强、增韧、降解有机污染物,是一种环保型产品;锐钛型晶体的主要作用有抗菌,分解有机物。
锐钛型纳米TiO2是一种新型抗菌剂,具有良好的杀菌效用、耐热性好、安全性能佳、持续性长、使用方便;在抗菌过程中可以生成具有很强化学活性的自由基,因此能有效地分解空气中多种有毒气体。
金红石型纳米TiO2具有高光催化活性,抗紫外线能力强等优点。
对长波区紫外线的阻隔以散射为主,对中波区紫外线的阻隔则以吸收为主。
2:TiO2的光催化机理当能量大于TiO2禁带宽度的光照射半导体时,光激发电子跃迁到导带,形成导带电子(矿),同时在价带留下空穴(矿)。
由于半导体能带的不连续性,电子和空穴的寿命较长,它们能够在电场作用下或通过扩散的方式运动,与吸附在半导体催化剂粒子表面上的物质发生氧化还原反应,或者被表面晶格缺陷俘获。
纳米TiO2粉体制备方法

1.纳米TiO 2粉体制备方法1.1.物理法1.1.1.气相冷凝法:预先处理为气相的样品在液氮的气氛下冷凝成核制得纳米TiO2 粉体,但该法不适于制备沸点较高的半导体氧化物1.1.2.高能球磨法:工艺简单,但制得的粉体形状不规则,颗粒尺寸分布宽,均匀性差1.2.化学法1.2.1.固相法:依靠固体颗粒之间的混合来促进反应,不适合制备微粒1.2.2.液相法:就是将钛的氯化物或醇盐先水解生成氢氧化钛(或羟基氧钛) ,再经煅烧得到TiO2. 研究最广泛。
以四氯化钛为原料,其反应为TiCl4 + 4H2O → Ti (OH) 4 + 4HCl ,Ti (OH) 4 → TiO2 + 2H2O.以醇盐为原料,其反应为Ti (OR) 4 + 4 H2O → Ti (OH) 4 + 4 ROH ,Ti (OH) 4TiO2 + 2 H2O.−−−→煅烧主要包括硫酸法、水解法、溶胶-凝胶(Sol2gel) 法、超声雾化、热解法等。
溶胶- 凝胶法就是将钛醇盐制备成二氧化钛溶胶. 为了得到多孔催化剂,通常采用煅烧等方法将凝胶进行干燥,去除溶剂,制得干凝胶. Dagan 等[25 ]采用超临界干燥法所制得的TiO2气凝胶孔隙率为85 % ,比表面积高达600 m2·g - 1 ,晶粒尺寸为5. 0 nm ;对水杨酸的光催化氧化表明该催化剂具有比Degussa P - 25 TiO2粉末更高的催化活性.1.2.3.气相法:其核心技术是反应气体如何成核的问题. 通过四氯化钛与氧气反应或在氢氧焰中气相水解获得纳米级TiO2 ,目前德国Degussa 公司P-25 粉末光催化剂是通过该法生产的常用的化学制备方法有溶胶-凝胶法、沉淀法、水解法、喷雾热解法、水热法和氧化- 还原法等。
2.纳米TiO2薄膜制备方法:除了与粉体制备相同的制备方法如溶胶-凝胶法、热解法外,还有液相沉积法、化学气相沉积法、磁控溅射法等。
2.1.溶胶-凝胶法(Sol-Gel):制备的薄膜纯度高,且制备工艺简单,易批量生产;2.2.水热合成法:通过水解钛的醇盐或氯化物前驱体得到无定形沉淀,然后在酸性或碱性溶液中胶溶得到溶胶物质,将溶胶在高压釜中进行水热Ostwald熟化。
纳米TiO2的制备方法

31一、溶胶-凝胶法溶胶-凝胶法是一种较为重要的制备纳米材料的湿化学方法,主要包括4步:1.溶胶的制备。
Ti(OR)4与水不能互溶,但与醇、苯等有机溶剂无限混溶,所以可先配制Ti(OR)4的醇溶液(多用无水乙醇)A,配制水的乙醇溶液B,并向B中添加无机酸(HCl,HNO 3等)或有机酸(HAc或柠檬酸等)作水解抑制剂,也可加一定量NH 3,将A和B按一定方式混合、搅拌得透明溶胶。
2.溶胶-凝胶的转变。
随着搅拌的进行,溶胶经过缩聚过程转变成湿凝胶。
3.使湿凝胶转变成干凝胶。
4.热处理。
将干凝胶磨细,在一定温度下热处理,便可得到纳米TiO 2。
以Ti(OC 4H 9)4为原料,无水乙醇为溶剂,盐酸作水解抑制剂,按摩尔比为Ti(OC 4H 9)4:H 2O:C 2H 5OH:HCl=1:(1~4):15:0.3,得到不同粒径和晶型的TiO 2纳米晶。
用溶胶-凝胶法制备了Pt掺杂的TiO 2,得出在Pt含量为0.1% mol的时候光催化性能最好。
溶胶-凝胶法(Sol-Gel)是目前研究应用最多的TiO 2光催化剂的制备方法之一,溶胶-凝胶法制备纳米材料有如下优点为:(1)反应条件温和,成分容易控制;(2)工艺、设备简单;(3)产品纯度高,容易掺杂改性。
在溶胶-凝胶过程中,溶胶由溶液制得。
化合物在分子级水平混合,故胶粒内及胶粒间化学成分完全一致;颗粒细,胶粒尺寸小。
该法可容纳不溶性组分或不沉淀组分,不溶性颗粒均匀地分散在含不产生沉淀的组分的溶液,经凝胶化、不溶组分可自然地固定在凝胶体系中,不溶性组分颗粒越细,体系化学均匀性越好;掺杂分布均匀,可溶性微量掺杂组分分布均匀,不会分离、偏析。
它比醇盐水解法优越,粉末活性高。
一般情况下,溶胶-凝胶法在室温合成无机材料,能从分子水平上设计和控制材料的均匀性,获得高纯、超细、均匀的纳米材料。
二、水热法水热合成法是在特制的密闭反应容器里,采用水溶液或其他液体作为反应介质,通过对反应容器加热,反应环境使难溶或不溶的物质溶解,进而成核、生长、最终形成具有一定粒度和结晶形态的晶粒。
TiO_2粉体

《TiO2粉体的光谱特性与光催化性能的研究》《TiO2纳米粉体的制备及光催化降解水杨酸的研究》以钛酸丁酯为前躯体,采用溶胶-凝胶法制备了两种TiO2纳米粉体,并通过TEM和XRD分析方法对其结构性能进行了表征。
检测结果表明:两种TiO2纳米粉体均由5~10nm左右的球形颗粒组成,晶型均为锐钛矿型。
采用溶胶-凝胶法在不同溶剂中制备了两种TiO2纳米粉体光催化剂,其过程如下:(1)催化剂1的制备:准确量取一定量的钛酸丁酯并且缓慢溶于无水乙醇和少量水的混合溶液中,体积比控制在水∶钛酸丁酯∶无水乙醇=1∶50∶250。
通过滴加浓HCl控制溶液的pH=4.0;在室温、磁力搅拌下使钛酸丁酯缓慢水解30min,得到稳定的TiO2凝胶。
TiO2凝胶在室温下干燥8周,然后放入烘箱内保持40℃恒温放置20d,再放入马福炉内加热至400℃保温2h,取出置于干燥器中自然冷却至室温,研磨即得到TiO2纳米粉体的光催化剂1。
(2)催化剂2的制备:准确量取一定量的钛酸丁酯缓慢溶于正丁醇的水溶液中,体积比应控制在钛酸丁酯∶冰醋酸∶正丁醇∶H2O=20∶10∶40∶5。
滴加冰醋酸控制溶液的pH=4.0,在室温、磁力搅拌下使钛酸丁酯缓慢水解,得到稳定的TiO2凝胶;在同上条件下处理,即得到TiO2纳米粉体的光催化剂2。
《不同晶型的纳米TiO2粉体的低温制备及光催化性能研究》一般而言,在自然界中TiO2主要以锐钛矿型、金红石型和板钛矿型三种形式存在,前两种晶型可以通过合成的方法制备,而板钛矿型主要是天然存在的晶型。
在稳定性方面,锐钛矿和板钛矿型TiO2是亚稳态相,在一定的条件下可以转变为金红石型,锐钛矿型TiO2在热处理温度高于550℃时开始向金红石型转变。
由于晶型的不同,它们表现出的物理、化学性质也不一样,金红石型TiO2具有很强的散射和吸收紫外线能力,锐钛矿型TiO2则具有很好的光催化活性。
目前,制备纳米TiO2的方法主要有物理法和化学法,通过物理方法可以制得分散性好,粒径符合要求并且纯度较好的纳米TiO2,但由于该方法要求设备较复杂、成本较高,很少在实验室中采用。
纳米TiO2的制备方法

纳米TiO2的制备方法摘要:报告主要研究了纳米TiO2的制备方法,包括物理法、化学法和综合法。
其中物理法主要是气相蒸发沉积法,蒸发-凝聚法;化学法包括溶胶-凝胶法,沉淀法,水解法,气相水解法等;综合法涉及到激光CVD 法,等离子CVD 法。
关键词:气相蒸发沉积法水解法 CVD 法近年来,伴随着全球环境污染日益严重,纳米半导体光催化剂材料一直是材料学和光催化学研究的热点。
目前,比较简单的半导体光催化剂有TiO2、SnO2、Fe2O3、MoO3、WO3、PbS、ZnS、ZnO 和CdS 等,纳米TiO2因其具有性质稳定、抗光腐蚀性强、耐酸碱腐蚀性强、原料丰富等优点。
制备纳米TiO2粉体的方法有很多,按照所需粉体的形状、结构、尺寸、晶型、用途选用不同的制备方法。
根据粉体制备原理的不同,这些方法可分为物理法、化学法和综合法。
1 物理法物理法是最早采用的纳米材料制备方法,其方法是采用高能消耗的方式,“强制”材料“细化”得到纳米材料。
物理法的优点是产品纯度高。
1. 1 气相蒸发沉积法此法制备纳米TiO2粉体的过程为: 将金属Ti 置于钨舟中,在( 2 ~ 10) ×102 Pa 的He 气氛下加热蒸发,从过饱和蒸汽中凝固的细小颗粒被收集到液氮冷却套管上,然后向反应室注入5 ×103 Pa 的纯氧,使颗粒迅速、完全氧化成TiO2粉体。
利用该方法制备的TiO2纳米粉体是双峰分布,粉体颗粒大小为14 nm。
1. 2 蒸发-凝聚法此法是将将平均粒径为3 μm 的工业TiO2轴向注入功率为60 kW 的高频等离子炉Ar - O2混合等离子矩中,在大约10 000 K 的高温下,粗粒子TiO2汽化蒸发,进入冷凝膨胀罐中降压,急冷得到10 ~ 50 nm 的纳米TiO2。
2 化学法化学法可以根据反应物的物态,将其划分为液相化学反应法、气相化学反应法和固相反应法。
此类方法制造的纳米粉体产量大,粒子直径可控,也可得到纳米管和纳米晶须,同时,该法能方便地对粒子表面进行碳、硅和有机物包覆或修饰处理,使粒子尺寸细小且均匀,性能更加稳定。
实验三 溶胶-凝胶法合成TiO2纳米粉体

盐的水解盐的水解-聚合反应 1)无机盐的水解 无机盐的水解1)无机盐的水解-聚合反应
金属醇盐的水解2) 金属醇盐的水解-聚合反应
溶胶溶胶-凝胶的转化
溶胶的浓度小于10% 体系中含有大量的溶剂(水或醇) 溶胶的浓度小于10%,体系中含有大量的溶剂(水或醇). 10 可通过化学方法控制溶胶中电解质的浓度,实现胶凝 可通过化学方法控制溶胶中电解质的浓度, 作用,胶凝化过程只是体系失去流动性, 体积不减小或 作用 , 胶凝化过程只是体系失去流动性, 只略为减小。 只略为减小。 也可蒸发溶胶体系中的溶剂, 使胶体颗粒互相靠近, 也可蒸发溶胶体系中的溶剂 , 使胶体颗粒互相靠近 , 制得凝胶. 制得凝胶.
凝胶(gel) 凝胶(gel): 可以通过改变某种条件(如降低温度或控制 可以通过改变某种条件(如降低温度或控制 溶胶中电解质的浓度等 使胶体溶液(sol) 溶胶中电解质的浓度等)使胶体溶液(sol)中的 溶胶颗粒不能发生相互位移, 溶胶颗粒不能发生相互位移,整个胶体溶液失去 流动性,变成半刚性的固相体系, 流动性,变成半刚性的固相体系,此种固相体系 就是凝胶体( gel) 就是凝胶体 ( gel ) , 这种由溶胶转变为凝胶的 过程被称为胶凝作用(gelation)。 )
钛酸四丁脂在酸性条件下, 钛酸四丁脂在酸性条件下,水解产物为含钛离子溶胶
Ti(O-C4H9)4 + 4H2O
Ti(OH)4 + 4C4H9OH
含钛离子溶液中钛离子通常与其它离子相互作用 形成复杂的网状基团, 形成复杂的网状基团,最后形成稳定凝胶
Ti(OH)4 +Ti(O-C4H9)4 Ti(OH)4 + Ti(OH)4
溶胶溶胶-凝胶合成法的基本过程
起始原料: 金属无机盐(硝酸盐、氯化物等), 金属醇盐, 起始原料: 金属无机盐( 硝酸盐、氯化物等), 金属醇盐, 醋酸 盐, 草酸盐和金属有机化合物等 基本过程: 基本过程: 将原料(前驱体)分散(溶解)在溶剂(水或有机溶剂) (1) 将原料(前驱体)分散(溶解)在溶剂(水或有机溶剂)中,经过 水解(或醇解)反应,反应生成物缩合聚集形成溶胶; 水解(或醇解)反应,反应生成物缩合聚集形成溶胶; 再经过胶凝作用或蒸出溶剂等制成凝胶; (2) 再经过胶凝作用或蒸出溶剂等制成凝胶; 最后经过干燥和热处理制备出粉体粒子和所需材料. (3) 最后经过干燥和热处理制备出粉体粒子和所需材料
制备纳米氧化钛的方法

制备纳米氧化钛的方法
制备纳米氧化钛的方法主要有以下三种:
1. 四氯化钛水解法:以四氯化钛为原料,将其稀释成一定浓度后,加入向氢氧化钠溶液或者按水中和水解,所制备前驱物经过洗涤、干燥、煅烧处理后得到锐钛矿或者金红石相纳米氧化钛粉体。
2. 溶胶-凝胶法:先将醇盐溶解于有机溶剂中,通过加入蒸馏水,使醇盐水
解形成溶胶,溶胶凝化处理后得到凝胶,再经干燥和煅烧,即得到超细粉体。
目前认为有4个主要参数对溶胶-凝胶化过程有重要影响,即溶液pH值、
溶液浓度、反应温度和反应时间。
该工艺粒径小、粒度分布窄,品纯度高,缺点是原料成本高,干燥煅烧时纳米颗粒间容易团聚。
3. 水热合成法:是制备氧化物钠米晶的重要方法,是指在密闭体系中,以水为溶剂,在一定温度、水的自生压力下,原始混合物进行反应,通常是在不锈钢反应斧内内进行。
以上方法仅供参考,建议查阅专业化学书籍或咨询专业人士获取更多信息。
水热法合成TiO2纳米粉体材料

《水热法合成TiO2纳米粉体材料》实验目的:1、了解水热法制备纳米氧化物的原理及实验方法2、研究TiO2纳米粉制备的工艺条件3、学习用X射线衍射法(XRD)确定产物的物相结构4、学习用扫描电子显微镜检测产物的形貌及尺寸实验原理:在水热体系中,TiO2晶体的结晶过程包括成核过程和生长过程。
随着体系温度的升高,尿素缓慢分解,(NH2)2CO + H2O = 2NH3 + CO2,尿素的分解使溶液的pH值增大。
前驱物中的Ti4+发生如下水解反应:Ti4+ + (n+2) H2O↔TiO2·nH2O + 4H+,溶液的pH值增大,碱性增强,有利于上述水解反应向右进行。
随钛离子水解过程的进行,在形成的晶核上逐渐长大成为水合二氧化钛颗粒。
随着水热体系温度的进一步升高,水合二氧化钛的结晶水脱去,生成纳米二氧化钛微晶。
实验仪器:电子天平,不锈钢压力釜(高温型),恒温箱(带控温装置),离心机,X射线粉末衍射仪,扫描电子显微镜,玻璃仪器若干等。
实验试剂:硫酸氧钛,硫酸钛,尿素,硝酸钡,无水乙醇等。
实验步骤:1、TiO2纳米粉的合成将尿素加入到Ti(SO4)2水溶液中,搅拌至尿素完全溶解后,将溶液加入到高压釜中进行水热沉淀反应,填充度为80%。
所得产物用去离子水反复洗涤,至滤液中不再检出SO42-,最后在80℃下干燥8h得产物。
实验条件:硫酸钛摩尔浓度为0.5M,尿素摩尔浓度为1.0M,用水热沉淀法在140~280℃保温2~6h。
2、用X射线衍射法(XRD)确定产物的物相结构用X射线粉末衍射仪测定产物的物相,利用物质的XRD衍射数据库对照样品的结果,确定目标产物是否是TiO2。
实验结果文件转变为数据文档,利用软件origin 进行处理。
3、用扫描电子显微镜检测产物的形貌及尺寸按照扫描电子显微镜的要求,制作样品,利用SEM 观察产物的形貌及尺寸,并copy产物电镜照片的电子文档。
讨论与思考:1、水热法合成无机材料具有哪些特点?2、用水热法合成TiO2纳米粉体材料过程中,哪些因素影响产物的粒子大小及其分布?3、如何减少纳米粒子在干燥过程中的团聚?4、查阅资料比较水热法与溶剂热法合成纳米材料的异同。
沉淀法制备TiO2纳米粉体

沉淀法制备二氧化钛纳米粉体1.引言纳米二氧化钛粉体是近几十年来发展起来的一项新技术,它通常是指颗粒细度在1-100nm之间的超细粉体,有很好的表面效应和体积效应,粒子的表面原子数量与总原子数之比随粒度的变小而急剧增大,以其优异的补强性,光催化特性广泛应用于化妆品、纺织化妆、食品包装、高档油漆、水处理、抗菌陶瓷、环保涂料、催化剂载体等众多领域。
二氧化钛是一种无毒、化学稳定性好、光折射率高的多功能氧化物材料。
纳米二氧化钛自其问世以来,因其颗粒细小、比表面积大而具有常规材料所不具备的特殊效应,如量子效应、隧道效应、独特的颜色反应,以及光催化作用及紫外屏蔽等功能。
纳米二氧化钛由于具有无毒、高效、廉价、耐化学腐蚀以及高光催化活性、能耗低、可重复使用、绿色环保等特点,所以成为当今的热点。
二氧化钛具有良好的光电、气敏等特性,在太阳能电池、光催化降解污染物、各种传感器等领域有重要的应用前景,已成为国内外研究热点。
2.制备及检测方法2.1 实验材料原料使用化学试剂为CP级NH3∙H2O,AR级HCl,AR级四氯化钛,蒸馏水, 所有玻璃器皿用稀HCI浸泡、清洗,使用前用蒸馏水清洗。
化学纯(CP),又称三级试剂,纯度大于99.5%,纯度与分析纯相差较大,适用于工矿、学校一般分析工作。
使用蓝色(深蓝色)标签。
分析纯(AR),又称二级试剂,纯度很高,99.7%,略次于优级纯,适合于重要分析及一般研究工作,使用红色瓶签。
2.2制备采用沉淀法制备TiO2纳米粉体的工艺流程如下图所示。
其中溶液的PH值通过向溶液中滴加HCl和氨水进行调控。
将四氯化钛缓慢地注入PH<1的水溶液中,强力搅拌下缓慢加入体积比为1:1的NH 3∙H2O,将PH值调至l,然后迅速加入NH 3∙H2O分别将PH值调至2,4,7,9,继续搅拌3min ,使反应体系均匀化,然后以4000r/min的速度离心沉淀10min,汲取清液,沉淀物用乙醇混合液充分洗涤、离心沉淀,反复3次,直到用2%AgNO3溶液检查不到Cl−1,然后干燥至质量恒定,得水合TiO2粉末,锻烧30min,获得最后样品。
纳米粉体制备方法

纳米粉体制备方法纳米粉体制备办法纳米技术是当今世界各国争先进展的热点技术,纳米技术和材料的生产及其应用在中国已起步,可以产业化的惟独为数不多的几个品种,纳米二氧化钛(TiO2)、纳米氧化锌(ZnO)、纳米碳酸钙(CaCO3)便是其中较具代表性的几个品种。
纳米粉体的制备办法无数,可分为物理办法和化学办法。
以下是对各种办法的分离阐述并举例。
1. 物理办法(1)真空冷凝法用真空蒸发、加热、高频感应等办法使原料气化或形成等离子体,然后骤冷。
其特点纯度高、结晶组织好、粒度可控,但技术设备要求高。
1。
金属烟粒子结晶法是早期讨论的一种试验室办法。
将金属原料置于真空室电极处,真空室抽空(真空度1P a)导入102到103 P a 压力的氩气或不活泼性气体,然后像通常的真空蒸发那样,用钨丝蓝蒸发金属。
在气体中,通过蒸发、凝结产生的金属蒸气形成金属烟粒子,像煤烟粒子一样沉积于真空室内壁上。
在钨丝篮上方或下方位置可以预先放置格网收集金属烟粒子样品,以备各类测试所用。
2。
流淌油面上的真空蒸发沉积法(VEROS),VEROS法是将物质在真空中延续的蒸发到流淌着的油面上,然后把含有纳米粒子的油回收到储藏器内,再经过真空蒸馏、浓缩,从而实现在短时光制备大量纳米粉体。
(2)物理粉碎法通过机械粉碎、电火花爆炸等办法得到纳米粒子。
其特点操作容易、成本低,但产品纯度低,颗粒分布不匀称。
例,有一种制备纳米粉体材料新办法,最适用于碳化物、氮化物及部分金属粉体的制备。
第1页/共4页其办法是先对反应器抽真空,然后充入庇护气体或反应气体,在反应器中设置石墨电极,在石墨电极与反应器坩埚中的金属之间通电,使之产生高温碳电弧,由高温电弧产生金属蒸汽。
采纳庇护气体可以生产出由石墨原子包覆的纳米镍粉、铜粉、铝粉等不易团圆的金属纳米粉末;采纳反应气体可以生产碳化物、氮化物纳米粉末。
与现有技术相比,生产的纳米粉末不易团圆,具有成本低,电弧功率大,可以实现规模化生产,具有广泛的有用性。
纳米二氧化钛的制备及性质实验

(2)光降解实验
标准曲线的制作:
(1)最大吸收波长
取0.005g/100mL的溶液于比色皿中,以蒸馏水为参比,从500nm-700nm范围内每隔50nm,测吸光度,在最大吸收波长周围以10nm为间隔重新扫描,寻找最大吸收波长。
液,最后直接加热,仍然会生成溶胶,只不过由于受热不均匀,水解速率不一而出现了大量气孔。这说明转速和滴速对溶胶的生成影响很小,加入适当试剂使钛酸正丁酯缓慢水解才是至关重要的。
2.亚甲基蓝的催化光解
得此浓度亚甲基蓝最大吸收波长为615nm,并制作标准曲线:
质量浓度mg/L
1
2
3
4
5
吸光度
0.056
0.145
五、实验仪器
量筒、烧杯、磁力搅拌器、电子天平、电热炉、马弗炉、移液枪、离心机、分光光度计等
六、实验过程
实验开始的第一天,早上八点左右进入实验室,取完所需要的实验器材,我便开始了实验。首先我严格按照上述所设计的流程配置了A液,A液在完全无水(除空气中的水汽外)的情况下配置,为淡黄色液体,未见浑浊。然后我配置了B液,与设计不同的是,调节酸性时,我认为盐酸与硫酸对于实验没有太大区别,于是选用6mol/L的硫酸调节B液pH小于3,最后待A、B液搅拌均匀后,在室温水浴下,我缓慢的将A液滴加入B液,一开始剂量比较小,混合液依然澄清,但刚刚滴加两试管后,混合液便出现白色浑浊,表明钛酸正丁酯已然水解成了颗粒较大的乳浊液,实验失败。于是我开始思考,到底是哪出了问题?滴加速率过快吗?还是搅拌不均匀?于是我又做了一次尝试,这次我加大了转速,放慢了滴加速率,但不幸的是,得到的结果还是失败的。到了下午,在老师的提醒下,我意识到,问题可能出在调节B液pH所用的酸上,硫酸根的作用可能对Ti(OR)4的水解产生了影响。于是我改用了浓盐酸进行调节,其余流程不变,终于得到了凝胶。历经一整天时间,失败了两次,我最终将凝胶制备了出来,坚持取得了胜利。之后,我将凝胶放置在电热炉里,让其烘干12小时以上。
纳米二氧化钛的制备技术

纳米二氧化钛的制备技术一、固相法固相法是通过固相到固相的变化来制备纳米TiO2粉体,基础的固相法是钛或钛的氧化物按一定的比例充分混合,研磨后进行煅烧,通过发生固相反应直接制得纳米TiO2粉体,或者是再次粉碎得到纳米TiO2粉体。
固相法包括热分解法,固相反应法,火花放电法,高能球磨法等。
固相法虽然经济,工艺过程和设备简单,但是其耗能大而不够纯,且粒度分布和粒子外貌上不能令人满意,所以主要用于对粉体的纯度和粒度要求不高的情况。
如:高能球磨法是靠压碎、击碎等作用,机械粉碎成粉末,可得到粒径为15~50 nm的纳米TiO2粉体。
该法工艺简单,成本低廉,但颗粒易受污染,得到的TiO2产品纯度不高,粒度分布和晶型不理想。
二、气相法气相法指直接利用气体或者通过各种手段将物质变为气体,使之在气体状态下发生物理或化学反应,最后在冷却过程中凝聚长大形成纳米TiO2的方法。
气相法包括溅射法、化学气相反应法、化学气相凝聚法、气体蒸发法等,其中应用较多的是化学气相反应法。
化学气相反应法是利用挥发性的钛化合物的蒸发,通过化学反应生成所需化合物在保护气体环境下快速冷凝,从而制备纳米TiO2。
该法制备的纳米TiO2颗粒均匀,纯度高,粒度小,分散性好,化学反应活性高,工艺可控和连续。
三、液相法1、水解法水解法是在一定的条件下使前驱物分子在水溶液体系进行充分水解,以制备纳米TiO2粉体的方法。
其基本步骤包括:水解、中和、洗涤、烘干和焙烧。
纳米TiO2水解法常使用的前驱物一般是四氯化钛或钛醇盐。
均相水解法,以钛醇盐为钛源制备纳米TiO2微粒。
均相水解法是利用在脂肪酸和醇反应所生成的均相反应体系中的水与钛盐进行水解反应,保证水解反应的均匀性,改善了直接水解法因沉淀剂局部浓度过高引起的不均匀现象。
通过调节酯化反应和水解反应条件使得粒子的成核速率大于生长速率,反应体系处于过饱和状态,使生成的TiO2的粒径控制在纳米尺度,从而获得粒径分布均匀和纯度高的纳米TiO2粒子。
纳米TiO2的制备

纳米TiO2的制备方法综述关键字:纳米TiO2制备均匀沉淀法实验操作前言:TiO2由于其粒子具有表面效应、量子尺寸效应、小尺寸效应、宏观量子隧道效应等性质使得其晶体具有优异的特性。
纳米Ti02在可见光区有较强的紫外光吸收能力、反射能力和散射能力,因此它可以广泛应用于防晒化妆品、光催化剂、高档涂料、人造纤维中。
由于其具有非常好的催化性能,可应用于空气净化、除臭杀菌、污水净化等领域。
同时Ti02纳米颗粒具有很好的亲油性和亲水性,可以制成防雾和自净化玻璃。
另外Ti02微粒具有良好的耐候性、耐腐蚀性、较高的热稳定性和化学稳定性、高比表面积、无毒、易分散、易烧结和低熔点等独特性能,又被广泛应用于功能陶瓷、油墨、高性能涂料、半导体材料、太阳能电池等诸多领域[1]。
目前,纳米Ti02的制备方法很多,一般可以分为物理法和化学法。
以下对Ti02纳米粒子的制备工艺进行了详细的分析和比较[2]。
1、物理法常用的物理法有气相冷凝法、粉碎法、真空冷凝法。
气相冷凝法是通过多种方法使物质挥发成气相,并经过特殊工艺冷凝成核得到纳米粉体。
由于使材料气化的方法有很多种,因此气相冷凝法的具体工艺也千差万别。
在气化和冷凝过程中须有保护性气氛,可以通过控制蒸发和冷凝的工艺条件来控制粉体的粒径。
气相蒸发沉积法、溅射法、蒸发-凝聚法、等离子法都是气相冷凝制备纳米粉体的重要方法,该方法制备的粉体纯度高,颗粒大小分布均匀,尺寸可控,适合于生产高熔点纳米金属粒子或纳米颗粒薄膜。
粉碎法,是利用球磨机转动和振动时的巨大能量,将原料粉碎为细小颗粒。
其制备纳米粉体的优点是工艺简单,易实现连续生产,并能制备出高熔点的金属和合金材料;缺点是其对设备要求很高,而且颗粒大小不均匀,容易引入杂质。
真空冷凝法用真空蒸发、加热、高频感应等方法使原料气化或形成等离子体,然后骤冷。
其特点纯度高、结晶组织好、粒度可控,但技术设备要求高。
2、化学法化学法在制备纳米Ti02粉体的方法中很重要,而目前研究最多的是气相法和液相法。
纳米二氧化钛粉体的用途

纳米二氧化钛粉体的用途1. 引言纳米材料是指其尺寸在纳米级别的物质,由于其独特的物理、化学和光学性质,近年来引起了广泛的关注和研究。
纳米二氧化钛粉体作为一种常见的纳米材料,在各个领域具有广泛的应用。
本文将介绍纳米二氧化钛粉体的用途,并对其在不同领域中的具体应用进行详细阐述。
2. 纳米二氧化钛粉体的制备方法纳米二氧化钛粉体可以通过多种方法制备,常见的方法包括溶胶-凝胶法、水热法、溶剂热法、水相合成法等。
这些方法可以控制纳米颗粒的尺寸、形貌和分散性,从而得到不同性质和用途的纳米二氧化钛粉体。
3. 纳米二氧化钛粉体在光催化领域中的应用光催化是一种利用光能激发催化剂进行反应的技术。
由于纳米二氧化钛具有较高的光催化活性和稳定性,因此在光催化领域中得到了广泛应用。
纳米二氧化钛粉体可以用于水处理、空气净化、环境污染修复等方面。
例如,将纳米二氧化钛粉体添加到水中,通过光催化反应可以分解有机污染物,提高水质;将纳米二氧化钛粉体涂覆在建筑材料表面,可以通过吸收阳光中的紫外线来净化空气。
4. 纳米二氧化钛粉体在太阳能电池领域中的应用太阳能电池是一种将太阳能转化为电能的装置。
纳米二氧化钛粉体具有优异的光吸收性能和电子传输性能,因此被广泛应用于太阳能电池领域。
目前常见的太阳能电池类型包括染料敏化太阳能电池和钙钛矿太阳能电池,而纳米二氧化钛粉体作为这些太阳能电池中的关键材料之一。
通过将纳米二氧化钛粉体涂覆在电极表面,可以增强光吸收和电子传输效率,提高太阳能电池的转换效率。
5. 纳米二氧化钛粉体在防护材料领域中的应用纳米二氧化钛粉体具有良好的抗菌性能和自洁性能,因此被广泛应用于防护材料领域。
例如,在纺织品中添加纳米二氧化钛粉体可以使其具有抗菌、防臭、防污等功能;将纳米二氧化钛粉体涂覆在建筑材料表面,可以通过光催化反应降解空气中的有害物质,提高室内空气质量。
6. 纳米二氧化钛粉体在医疗领域中的应用纳米二氧化钛粉体在医疗领域中也有一定的应用。
水热法合成TiO2纳米粉体材料

4、查阅资料比较水热法与溶剂热法合成纳米材料的异同。
水热法又称热液法,属液相化学法的范畴。是指在密封的压力容器中,以水为溶剂,在高温高压的条件下进行的化学反应。水热反应依据反应类型的不同可分为水热氧化、水热还原、水热沉淀、水热合成、水热水解、水热结晶等。其中水热结晶用得最多。它的原理:水热结晶主要是溶解———再结晶机理。首先营养料在水热介质里溶解,以离子、分子团的形式进入溶液。利用强烈对流(釜内上下部分的温度差而在釜内溶液产生)将这些离子、分子或离子团被输运到放有籽晶的生长区(即低温区)形成过饱和溶液,继而结晶。
1、TiO2纳米粉的合成
将尿素加入到Ti(SO4)2水溶液中,搅拌至尿素完全溶解后,将溶液加入到高压釜中进行水热沉淀反应,填充度为80%。所得产物用去离子水反复洗涤,至滤液中不再检出SO42-,最后在不同温度下干燥若干小时得产物。实验条件:硫酸钛摩尔浓度为0.5M,尿素摩尔浓度为1.0M,用水热沉淀法在140~280℃保温2~12h。
2、用水热法合成TiO2纳米粉体材料过程中,哪些因素影响产物的粒子大小及其分布?
反应温度能促进晶体的生长和转化;反应时间的增加衍射峰的强度逐渐增加;酸洗对产物也有一定的影响。
3、如何减少纳米粒子在干燥过程中的团聚?
水的存在是干燥过程中形成硬团聚的根源,因此要消除硬团聚可以从两个方面着手:
1、在干燥前将粉体之间的距离增大,从而消除毛细管力,避免使得颗粒结合紧密;
利用强烈对流釜内上下部分的温度差而在釜内溶液产将这些离子分子或离子团被输运到放有籽晶的生长区即低温区形成过饱和溶液继而结晶
实验报告
2、实验目的(Purpose of experiment)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 纳米TiO 2粉体制备方法
物理法 气相冷凝法:
预先处理为气相的样品在液氮的气氛下冷凝成核制得纳米TiO2 粉体,但该法不适于制备沸点较高的半导体氧化物
高能球磨法:
工艺简单,但制得的粉体形状不规则,颗粒尺寸分布宽,均匀性差
化学法 固相法:
依靠固体颗粒之间的混合来促进反应,不适合制备微粒
液相法:
就是将钛的氯化物或醇盐先水解生成氢氧化钛(或羟基氧钛) ,再经煅烧得到TiO2. 研究最广泛。
以四氯化钛为原料,其反应为
TiCl4 + 4H2O → Ti (OH) 4 + 4HCl ,
Ti (OH) 4 → TiO2 + 2H2O.
以醇盐为原料,其反应为
Ti (OR) 4 + 4 H2O → Ti (OH) 4 + 4 ROH ,
Ti (OH) 4
−−−→煅烧TiO2 + 2 H2O. 主要包括硫酸法、水解法、溶胶-凝胶(Sol2gel) 法、超声雾化、热解法等。
溶胶- 凝胶法就是将钛醇盐制备成二氧化钛溶胶. 为了得到多孔催化剂,通常采用煅烧等方法将凝胶进行干燥,去除溶剂,制得干凝胶. Dagan 等[25 ]采用超临界干燥法所制得的TiO2气凝胶孔隙率为85 % ,比表面积高达600 m2·g - 1 ,晶粒尺寸为5. 0 nm ;对水杨酸的光催化氧化表明该催化剂具有比Degussa P - 25 TiO2粉末更高的催化活性.
气相法:
其核心技术是反应气体如何成核的问题. 通过四氯化钛与氧气反应或在氢氧焰中气相水解获得纳米级TiO2 ,目前德国Degussa 公司P-25 粉末光催化剂是通过该法生产的
常用的化学制备方法有溶胶-凝胶法、沉淀法、水解法、喷雾热解法、水热法和氧化- 还原法等。
2. 纳米TiO2薄膜制备方法:
除了与粉体制备相同的制备方法如溶胶-凝胶法、热解法外,还有液相沉积法、化学气相沉积法、磁控溅射法等。
溶胶-凝胶法(Sol-Gel):
制备的薄膜纯度高,且制备工艺简单,易批量生产;
水热合成法:
通过水解钛的醇盐或氯化物前驱体得到无定形沉淀,然后在酸性或碱性溶液中胶溶得到溶胶物质,将溶胶在高压釜中进行水热Ostwald熟化。
熟化后的溶胶涂覆在导电玻璃基片上,经高温(500℃左右)煅烧,即得到纳米晶TiO2薄膜。
也可以使用TiO2的醇溶液与商业Ti02(P25,3Onm)混合以后得到的糨糊来代替上面提到的溶胶。
反应中为了防止颗粒团聚,通常采用化学表面改性的方法,如加有机螫合剂、表面活性剂、乳化剂等,以降低粉末表面能,增加胶粒问静电排斥,或产生空问位阻作用而使胶体稳定。
这些有机添加剂在高温煅烧阶段会受热分解除去.
是溶胶-凝胶法的改进方法,主要在于加入了一个水热熟化过程,由此控制产物的结晶和长大,继而控制半导体氧化物的颗粒尺寸和分布,以及薄膜的孔隙率.得到的Ti02颗粒是锐钛矿型还是锐钛矿型与金红石型的混合物由反应条件(如煅烧温度)决定。
水热处理的温度对颗粒尺寸有决定性的影响。
一般来说,将溶胶在高压釜中(150Xl05~330×105Pa)于200~250℃处理12h,可得到平均粒径15~20nm的Ti02颗粒。
如果用丝网印刷术(也可用刮涂的方法)将TiO2溶胶涂覆在导电玻璃上,则得到
的薄膜厚度一般为5~20μm,Ti02的质量为l~4mg/cm2 ,孔隙率为50~60% 。
这种方法是目前商业DSC光电极的制备方法,所组装的DSC转换效率达到l0%以上。
是目前能够获得最高光电转换效率的DSC光电极制备方法。
局限性是它必须进行高温和高压处理,这限制了基底材料的选用。
如目前研究得比较多的用柔性有机聚合物取代玻璃作基底材料就会受到高温处理过程的限制。
此外,水热合成法需时较长,整个过程需要十几个小时,不能及时获得光电极。
前驱物结晶体升华成膜法[CR0505]:
首先把准确定量的TiCl4与氨水反应制得正钛酸Ti(OH)4,将洗涤后的正钛酸与
草酸进行络合反应就可以获得H2[TiO(C2O4)2], 经过浓缩析出结晶体, 在一定温度和真空度下使其在玻璃上形成前驱物H2[TiO(C2O4)2]薄膜, 进行热处理后即可制备出玻璃基TiO2 薄膜。
主要化学反应方程式:
TiCl4+4NH3·H2O=Ti(OH)4+4NH4Cl
Ti(OH)4+H2C2O4=TiOC2O4+3H2O(当草酸不足时)
Ti(OH)4+2H2C2O4= H2[TiO(C2O4)2] +3H2O
H2[TiO(C2O4)2]=TiO2+3H2O↑+CO2↑
电沉积法[CR0505]:
是一种氧化还原过程, 主要有阳极氧化法和电泳法。
阳极氧化法:
可以在钛片上制备出的纳米TiO2薄膜对近紫外入射光产生强烈的吸收。
其制备工艺为:将工业纯钛片浸入于电介质溶液, 适当控制氧化电压、溶液温度,得到非晶氧化膜, 再进行控制条件下的晶化处理,得到锐钛矿相纳米TiO2薄膜,其晶粒度约为10~30nm。
电泳法
是一种新颖实用的成膜方法, 所需实验设备简单、操作方便, 可以制备出大面积内均匀度好的薄膜。
液相沉积法:
可通过控制反应物的浓度、反应时间和温度得到预期厚度的薄膜,而且经光、热、掺杂等后续处理,还可实现薄膜的功能化,不过该法只适用于表面含有OH-的基片成
膜;
化学气相沉积法:
制备的薄膜结晶取向度比较高,一般用于电子工业中高纯材料和单晶材料的制备;
热分解法:
制备较大厚度的薄膜多采用该法,只需几次重复成膜即可,不像溶胶-凝胶法需提拉多次成膜,不过热分解法制备的薄膜易从基片上脱落;
磁控溅射法:
是薄膜物理气相沉积(PVD) 的一种方法,该法制备的薄膜质量高、密度大、结合性能好、强度大,而且生产重复性好,适于大面积沉积成膜,便于连续和半连续生产,缺点是薄膜活性较低。
磁控溅射沉积将金属靶作阴极,导电玻璃(如ITO)作阳极,在Ar和O2氛围下溅射沉积到导电玻璃基片上,得到TiO2薄膜。
磁控溅射沉积的TiO2薄膜为相互平行且垂直于导电玻璃基底的羽毛柱状通道结构,并且TiO2纳米颗粒之间通过枝节相连,这种结构应该有利于提高DSC光伏性能,接近于上述对TiO2薄膜形态的要求。
M. M. Gómez小组的研究结果也证明了这种结构的有效性。
由于是直接对原子进行操作,因而薄膜能够牢固地附着在基底上;粒子的大小及尺寸分布可以通过调整两电极间的电压、电流和气体压力来控制;此外,磁控溅射技术易于进行大面积的均匀镀膜,这对DSC的大面积化提供了可靠的技术支持,因而是一种非常有发展前途的制备方法。
磁控溅射沉积法还有一个最大的优点就是便于进行掺杂,这对光电极的修饰具有非常重要的意义,也使得这种方法有望成为一种控制性最好的DSC光电极制备技术。
但是磁控溅射得到的薄膜太致密,孔隙率相对较低且分布不均匀,孔隙较窄的部分仍然不利于染料分子的吸附,还不能满足高效DSC对薄膜多孔性的要求,因而制得的DSC的光电转换效率不高。
喷射高温分解沉积(SPD)法
是将羟乙酰丙酮化钛(Ⅳ)(TOA)溶于2-丁醇中作为初始源溶液,通过SPD设备将源溶液在空气压力下呈喷雾状间歇地喷射到被加热的玻璃基底上(基底温度为
500 ℃),形成TiO2薄膜。
所得TiO2薄膜表面形态为大约宽100nm的叶片状结构,粗糙因子为50,薄膜厚度为1μm。
这种方法制得的TiO2薄膜孔隙率较低,颗粒尺寸较大,不利于染料分子的大量吸附,因而组装的DSC不能获得较高的光伏性能。
后来,在羟乙酰丙酮化钛(Ⅳ)/2-丁醇源溶液中加入了少量乙酰丙酮(AA)化铝(II)来提高TiO2薄膜的孔隙率。
因为AA在400℃的时候会从源溶液中升华,从而在TiO2薄膜中留下大量孔隙。
喷射高温分解沉积法制备工艺大大简化,可以在空气中和常压下进行,但是所得到的TiO2薄膜的颗粒尺寸分布不均匀,孔隙率低,不规则的叶片状结构也不利于染料分子的吸附。
而且无法控制氧化物颗粒的尺寸和形态。
冷压法
冷压法是低温制备DSC用TiO2薄膜技术中备受推崇的一种方法。
它是将纳米Ti02粉体(通常是商业用的P25TiOa粉体)加入有机溶剂中制成悬浮液,然后将其刮涂到导电基片上。
待有机溶剂挥发之后,将基片放到两块钢压板之间施以压力,如果基片是玻璃,则获得有效DSC光电极的压力一般为1000kg/cm2;如果基片是塑料,则采用滚动挤压的方式,压力一般为400kN/m。
冷压法制得的Ti02薄膜颗粒细小,分布均匀,平均粒径为23nm,孔隙率为50~55%,膜厚度为8μm左右。
试验发现,随着压力的增大,薄膜逐渐被压实,因而其孔隙率减小。
此外,大粒径的颗粒被压碎,使得粒径分布变窄。
因此,通过压力的改变可以控制TiO2薄膜的孔隙率,调整其粒径范围由冷压法制备的TiO2薄膜组装的DSC在l00w/m2太阳光照下得到的光伏性能指标与传统水热合成法制得的DSC非常相近。
冷压法制备DSC光电极可以大大提高光电极的生产效率。
此外,低温制备DSC 光电极可以在柔性衬底(如塑料)上沉积Ti 薄膜,这对于降低DSC的生成成本,提高其外观可塑性等方面具有非常重要的意义。
冷压法是实现DSC商业化的一种非常有前途的制备方法,不过,薄膜是在有机溶剂蒸发后呈粉末状态时通过机械力压制在基片上的,因而薄膜与基片界面间的连接并不牢固,容易随外界环境条件如温度、湿度、机械作用等因素而发生Ti 层与基片的剥离。
Sonochemical Synthesis。
