浙江选考届化学选考复习专题第题化学反应原理
(浙江选考)2020版高考化学一轮复习专题二第三单元氧化还原反应课件

化学守恒观是进行化学计算及化学方程式配平的重要依据
典例2 Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原
为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为
( D A.2 ) B.3 C.4
2 x
D.5 xNa2 O S O4,NaCl
如在FeBr2溶液中通入少量Cl2时,因为还原性:Fe2+>Br-,所以Fe2+先与Cl2反应。
b.同时含有几种氧化剂 质。
首先被还原的是氧化性最强的物
如在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+ >H+,
所以铁粉先与Fe3+反应,然后依次与Cu2+、H+反应。
1-1 已知:2Fe2++Br2
2Fe3++2Br-,2Fe3++2I-
2Fe2++I2。向FeI2、
FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如 图所示。下列有关说法中不正确的是 ( C A.还原性:I->Fe2+>BrB.原混合溶液中FeBr2的物质的量为3 mol C.当通入1 mol Cl2时,溶液中发生的反应为 2Fe2++Cl2 2Fe3++2Cl)
(2)应用:判断物质发生氧化还原反应的先后顺序;判断氧化还原反应中 物质氧化性、还原性的相对强弱;判断某氧化还原反应能否发生。
典例1 已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性 的强弱顺序为Fe2+<H2O2<I-<SO2,则下列反应不能发生的是 ( C A.2Fe3++SO2+2H2O
年高考化学选考大二轮复习(浙江专用)课件:专题四 化学反应原理 13(27张PPT)

液混合,反应后的溶液为等物质的量浓度的MA和MOH的混合溶液,
故溶液中c(M+)>c(A-)>c(OH-)>c(H+)。(4)K点所对应的溶液中,由物
料守恒得,c(M+)+c(MOH)=2c(A-),由电荷守恒得,c(M+)+c(H+)=c(A)+c(OH-),故c(MOH)+c(OH-)=c(A-)+c(H+)≈c(A-)=0.005 mol·L-1。
-6-
重点梳理
精选例题
(2018·4·浙江选考)下列物质溶于水后溶液显酸性的是(
A.KCl
B.Na2O
C.NH4Cl
D.CH3COONa
)
关闭
A选项,氯化钾水溶液显中性;B选项,氧化钠与水反应生成氢氧化钠,氢氧化
钠的水溶液显碱性;C选项,氯化铵水溶液中铵根离子水解显酸性;D选项,醋
酸钠水溶液中醋酸根离子水解显碱性。
2c(H+)+c(Na+)=c(HCO3 )+2c(CO3 )+c(OH-)。
-20-
重点梳理
精选例题
(4)原子守恒(即物料守恒)
7(填“>”“<”
或“=”),用离子方程式表示其原因:
,此时,溶
液中由水电离出的c(OH-)=
。
(3)请写出K点所对应的溶液中离子浓度的大小关系: 。
(4)K点对应的溶液中,c(M+)+c(MOH)
2c(A-)(填“>”“<”或
“=”);若此时溶液的pH=10,则c(MOH)+c(OH-)=
(浙江选考)2020版高考化学二轮复习专题六第1讲化学反应中的热效应课件

解析:选 B。由题图可知,反应①是吸热反应,反应②是放热反应,总反应是放热反应, 且 ΔH=ΔH1+ΔH2,A、C、D 项正确;使用催化剂能降低反应所需的活化能,B 项错 误。
3.美国研究人员将 CO 和 O 附着在一种钌催化剂表面,用激光脉冲将其加热到 2 000 K, 成功观察到 CO 与 O 形成化学键生成 CO2 的全过程。下列说法不正确的是( ) A.CO2 属于酸性氧化物 B.CO 与 O 形成化学键的过程中放出能量 C.钌催化剂可以改变该反应的焓变 D.CO 与 O 形成化学键的过程中有电子转移
Δ H=-534 kJ·mol-1 (2)SiH4(g)+2O2(g)===SiO2(s)+2H2O(l)
ΔH=-1 520.0 kJ·mol-1
2.(1)已知 1 mol 钠的单质在足量 O2 中燃烧,恢复至室温,放出 255.5 kJ 热量,写出该 反应的热化学方程式: ________________________________________________________________________。 (2)贮氢合金 ThNi5 可催化由 CO、H2 合成 CH4 的反应。温度为 T 时,该反应的热化学 方程式为__________________________________________________________________ ________________________________________________________________________。 已知温度为 T 时:CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165 kJ/mol CO(g)+H2O(g)===CO2(g)+H2(g)
解析:选 A。氢能是易燃烧、热值高、资源丰富的新能源;但它也有储存难、制备成本
2022届浙江省选考化学一轮复习课件-23-化学反应的方向和限度

|△G|越大,则反应 K越大,即反应的限度越 大 . △G>0非自发,“非自发”可理解成该反应的K <1 .
|△G|越大,则反应 K越小 ,即反应的限度越小 . 个别人认为: △G=0表示处于平衡状态,是否妥当? (2)反应限度大小(K)与反应速率有无关系?没有关系
K与△G(△H)有关, 不受 催化剂影响. v与活化能有关, 受 催化剂影响.
二、熵、熵变 1、熵(S) ——衡量体系混乱度的物理量 体系混乱度越大——熵越大 体系混乱度越小——熵越小 2、影响熵的因素: 物质种类:其它条件相同时,不同物质熵不同
相对分子质量越大,熵越大 . 物质越复杂, 分子内原子数目越多,熵越大 . 熵越 大 . 排列方式越多,熵越大 . 如金刚石 < 石墨 温度:其它条件相同时,温度越高,熵越 大 . 状态:其它条件相同时,状态不同,熵不同 S(g) >> S(aq) >> S(l) >> S(s) 微粒数目:其它条件相同时,微粒数多,熵越 大 .
焓变
△H<0 △H>0 △H<0 △H>0
熵变
△S>0 △S<0 △S<0 △S>0
反应的自发性
低温
高温
自发
非自发
自发
不自发
不自发
自发
规律:高温下能否自发,主要看 熵变 .
低温下能否自发,主要看 焓变 . 不同过程,自发非/自发反转温度不同,高/低温是相对的
视野拓展 (1)△G与化学平衡常数的关系:
【练1】判断下列反应能否自发 1.2Na(s) +Cl2(g)=2NaCl(s) 低温自发 2.CaCO3(s)=CaO(s)+CO2(g) 高温自发 3.C(s,石墨) = C(s,金刚石) △H=1.9kJ/mol 非自发 4.S+O2 = SO2 自发 5.2H2+O2=2H2O 低温自发
(浙江选考)2021版高考化学一轮复习专题2离子反应氧化还原反应1第一单元离子反应课件

(2) 多 元 弱 酸 的 电 离 分 步 书 写 , 多 元 弱 碱 的 电 离 一 步 写 完 。 如 H2CO3 : __H_2_C_O__3____H_+_+__H__C_O__3-____ , __H_C__O_- 3____H__+_+__C_O__23_-_____ ; Fe(OH)3 : ___F__e(_O__H_)_3____F_e_3+_+___3_O_H__-。
(3)酸式盐的电离:多元强酸酸式盐与多元弱酸酸式盐的阴离子电离情况不同。 如 NaHSO4 溶液中:__N__a_H_S_O__4_=_=_=_N_a_+_+__H__+_+__S_O__24-______; NaHCO3 溶液中:_N_a_H__C_O__3_=_=_=_N_a_+_+__H__C_O__3-__、HCO3- H++CO23-。
专题2 离子反应 氧化还原反应
第一单元 离子反应
化学
01
考点1
02
考点2
03
考点3
04
考点4
05
考点5
06
课后达标检测
[考点分布]
知识内容
考试 2016 年 2017 年 2018 年 要求 4 月 10 月 4 月 11 月 4 月 10 月
(1)电解质和非 a
电解质的概念
T3 T3 T3 T3 T3
(7)BaSO4_____________________________________________________________;
2018版高考化学二轮复习浙江选考版讲义:第三编 化学
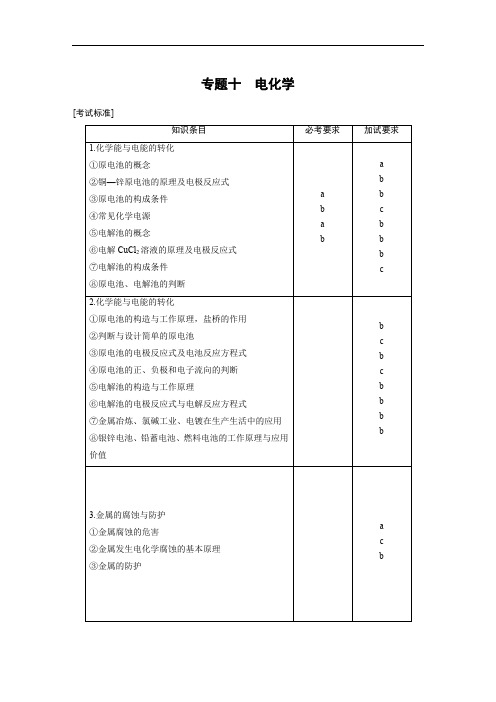
专题十电化学[考试标准]考点一原电池、化学电源1.原电池的工作原理(1)概念和反应本质原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。
(2)工作原理①反应原理②原理归纳(3)原电池的构成条件①一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
②二看两电极:一般是活泼性不同的两电极。
③三看是否形成闭合回路,形成闭合回路需三个条件:a.电解质溶液;b.两电极直接或间接接触;c.两电极插入电解质溶液中。
(4)盐桥原电池(加试)①构造②盐桥的组成和作用a.盐桥中装有饱和的KCl、KNO3等溶液和琼脂制成的胶冻。
b.盐桥的作用:连接内电路,形成闭合回路;平衡电荷,使原电池不断产生电流。
c.盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极。
③单池原电池和盐桥原电池的对比图1和图2两装置的相同点:正负极、电极反应、总反应、反应现象。
负极:Zn-2e-===Zn2+正极:Cu2++2e-===Cu总反应:Zn+Cu2+===Cu+Zn2+不同点:图1中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能转化成了电能,又有一部分化学能转化成了热能,装置的温度会升高。
图2中Zn和CuSO4溶液分别在两个池子中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。
关键点:盐桥原电池中,还原剂在负极区,而氧化剂在正极区。
2.常见化学电源(1)碱性锌锰电池——一次电池电池组成:锌、碳棒、二氧化锰、氯化锌、氯化铵特点:用途广泛正极反应:2MnO2+2H2O+2e-===2MnOOH+2OH-;负极反应:Zn+2OH--2e-===Zn(OH)2;总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。
(2)银锌钮扣电池——一次电池电池组成:锌、氧化银、氢氧化钾溶液特点:放电平稳,电流大负极反应:Zn+2OH--2e-===Zn(OH)2;正极反应:Ag2O+H2O+2e-===2Ag+2OH-;总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag。
2020版浙江新高考化学选考大一轮复习课件:化学反应中的热效应

专题6 化学反应与能量变化
判断热化学方程式正误可用的“五看”法 (1)看方程式是否配平; (2)看各物质的聚集状态是否正确; (3)看 ΔH 变化的“+”“-”是否正确; (4)看反应热的单位是否为 kJ·mol-1; (5)看反应热的数值与化学计量数是否相对应。
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l) Δ H=-890.3 kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(l) Δ H=+890.3 kJ·mol-1
D.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
答案:B
Δ H=-890.3 kJ·mol-1
境带来的问题
专题6 化学反应与能量变化
知识内容
(11)反应热 (12)焓变的涵 义 (13)焓变与键 能的关系
考试 2016 年 2017 年 2018 年
要求 4 月 10 月 4 月 11 月 4 月 11 月
a
T12
a
T12
c
T19
T21
专题6 化学反应与能量变化
知识内容
(14)中和热的 测定 (15)标准燃烧 热的概念
专题6 化学反应与能量变化
3.从反应热的量化参数——键能的角度分析
栏目 导引
专题6 化学反应与能量变化
题组一 化学反应中的能量变化 1.(2016·浙江 4 月选考,T19)2A(g) B(g) ΔH1(ΔH1<0); 2A(g) B(l) ΔH2。下列能量变化示意图正确的是( )
栏目 导引
专题6 化学反应与能量变化
栏目 导引
专题6 化学反应与能量变化
(3)注意符号单位 Δ H 应包括符号[放热反应为“____-_______”,吸热反应为 “____+_______”(可省略)]、数字和单位(kJ/mol)。 (4)注意热化学方程式的化学计量数 热化学方程式中各物质化学式前面的化学计量数仅表示该物质 的物质的量,可以是整数,也可以是分数,且化学计量数必须与 ΔH 相对应,如果化学计量数加倍,则 ΔH__也__要__加__倍___。 (5)与普通化学方程式的区别 一般不标注“↑”“↓”以及反应条件,如“点燃”“加热” 等。
(浙江专用)高考化学大二轮复习专题四化学反应原理10化学反应中的能量变化课件

专题四化学反应原理第10讲化学反应中的能量变化「血理考点一化学反应中的能量变化1・三个角度理解产生化学反应热效应的原因(1) 从宏观角度分析:生成物的总能量)旧2(反应物的总能量)(2) 从微观角度分析:△H 二EK 反应物的键能总和)迟(生成物的键能总和)⑶从活化能角度分析:兄生成物的总能量°反应过程放热反应A H<0反应过程 吸热反应AHX )AH=E、(正反应活化能)廻(逆反应活化能)重点梳理精选例题(2018-4.浙江选考)氢卤酸的能量关系如图所示,下列说法正确的是(A.己知HF 气体溶于水放热,则HF 的AH 】V0B ・•相同条件.T,HC1的•△禺比HBr 的小:关闭| A 项,ZXH ]为HX 从溶液变成气体吸收的能量,即AHpO,错误;B 项,CI 的非金属|性比Br 的强'故稳定性:HC 卜HBr;对应的更尢错误;C 项,HI 的(△仏+厶巴)与;HCI 的相等,错误亠项小巧即为H —X 键能,/\H 2=a kJ- mol 1,正确。
A时側H +(g)+X-(g)...... ….…b• •• ••• ••• • ••• ••• ••• ••• ••• ••• ••• • ••• ••• ••• ••• ••• ••• ••• ••• • ••• ••• ••• ••• ••• ••• ••• • ••• ••• ••• ••• ••• ••• ••• • ••• ••• ••• ••• ••• ••• ••• • ••• ••• ••• ••• ••• ••• ••• ••• • ••• ••• ••• ••• ••• ••• ••• • ••• ••• ••• ••• ••• ••• ••• ••• • ••• •••■bi 关闭I D精选例题跟踪训练1.已知Zn(s)+H2SO4(aq) — ZnSO4(aq)+H2(g) AHvO,则下列叙述不正确的是()A.该反应的值与反应物用量无关…B.・.该反应的化•学能可以转化为•电能........................关闭5■ A项,ZXH值与反应方程式的计量数有关,与反应物的用量无关,正确;B项,该| 反应可以设计为原电池,正确;C项,该反应为放热反应,正确;D项,化学键断| 裂吸收能量,化学键形成放出能量,错误。
浙江选考届化学选考复习专题第题化学反应原理

30.化学反应原理1.一以四甲基氯化铵CH34NCl水溶液为原料;通过电解法可以制备四甲基氢氧化铵CH34NOH;装置如图1所示..1收集到CH34NOH的区域是填a、b、c或d..2写出电池总反应..二乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOHl+C2H5OHl CH3COOC2H5l+H2OlΔH=-2.7kJ·mol-1已知纯物质和相关恒沸混合物的常压沸点如下表:纯物质沸点/℃恒沸混合物质量分数沸点/℃乙醇78.3 乙酸乙酯0.92+水0.08 70.4乙酸117.9 乙酸乙酯0.69+乙醇0.31 71.8乙酸乙酯77.1 乙酸乙酯0.83+乙醇0.08+水0.09 70.2请完成:1关于该反应;下列说法不合理...的是..A.反应体系中硫酸有催化作用B.因为化学方程式前后物质的化学计量数之和相等;所以反应的ΔS等于零C.因为反应的△H接近于零;所以温度变化对平衡转化率的影响大D.因为反应前后都是液态物质;所以压强变化对化学平衡的影响可忽略不计2一定温度下该反应的平衡常数K=4.0..若按化学方程式中乙酸和乙醇的化学计量数比例投料;则乙酸乙酯的平衡产率y=;若乙酸和乙醇的物质的量之比为n:1;相应平衡体系中乙酸乙酯的物质的量分数为x;请在图2中绘制x随n变化的示意图计算时不计副反应..3工业上多采用乙酸过量的方法;将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流;直到塔顶温度达到70~71℃;开始从塔顶出料..控制乙酸过量的作用有..4近年;科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OHg CH3COOC2H5g+2H2g在常压下反应;冷凝收集;测得常温下液体收集物中主要产物的质量分数如图3所示..关于该方法;下列推测合理的是..A.反应温度不宜超过300℃B.增大体系压强;有利于提高乙醇平衡转化率C.在催化剂作用下;乙醛是反应历程中的中间产物D.提高催化剂的活性和选择性;减少乙醚、乙烯等副产物是工艺的关键2.一十氢萘是具有高储氢密度的氢能载体;经历“十氢萘C10H18→四氢萘C10H12→萘C10H8”的脱氢过程释放氢气..已知:C10H18l C10H12l+3H2g△H1;C10H12l C10H8l+2H2g△H2△H1>△H2>0;C10H18→C10H12的活化能为E a1;C10H12→C10H8的活化能为E a2;十氢萘的常压沸点为192℃;在192℃;液态十氢萘的脱氢反应的平衡转化率约为9%..请回答:1有利于提高上述反应平衡转化率的条件是..A.高温高压B.低温低压C.高温低压D.低温高压2研究表明;将适量十氢萘置于恒容密闭反应器中;升高温度带来高压;该条件下也可显着释氢;理由是..3温度335℃;在恒容密闭反应器中进行高压液态十氢萘1.00mol催化脱氢实验;测得C10H12和C10H8的产率x1和x2以物质的量分数计随时间变化关系;如图1所示..①在8h时;反应体系内氢气的量为mol忽略其他副反应..②x1显着低于x2的原因是..③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图.....二科学家发现;以H2O和N2为原料;熔融NaOH-KOH为电解质;纳米Fe2O3作催化剂;在250℃和常压下可实现电化学合成氨..阴极区发生的变化可视为按两步进行;请补充完整..电极反应式:和2Fe+3H2O+N2=2NH3+Fe2O3..3.以氧化铝为原料;通过碳热还原法可合成氮化铝AlN;通过电解法可制取铝..电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用..请回答:1已知:2Al2O3s=4Alg+3O2gΔH1=3351kJ·molˉ12Cs+O2g=2COg ΔH2=-221kJ·molˉ12Alg+N2g=2AlNsΔH3=-318kJ·molˉ1碳热还原Al2O3合成AlN的总热化学方程式是;该反应自发进行的条件..2在常压、Ru/TiO2催化下;CO2和H2混和气体体积比1∶4;总物质的量a mol进行反应;测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示选择性:转化的CO2中生成CH4或CO的百分比..反应Ⅰ.CO2g+4H2g CH4g+2H2OgΔH4;反应Ⅱ.CO2g+H2g COg+H2OgΔH5①下列说法不.正确..的是..A.△H4小于零B .温度可影响产物的选择性C.CO2平衡转化率随温度升高先增大后减少D.其他条件不变;将CO2和H2的初始体积比改变为1∶3;可提高CO2平衡转化率②350℃时;反应Ⅰ在t1时刻达到平衡;平衡时容器体积为V L;该温度下反应Ⅰ的平衡常数为用a、V表示③350℃下CH4物质的量随时间的变化曲线如图3所示..画出400℃下0~t1时刻CH4物质的量随时间的变化曲线..3据文献报道;CO2可以在碱性水溶液中电解生成甲烷;生成甲烷的电极反应式是..4.氯及其化合物在生活和生产中应用广泛..1已知:900K时;4HClg+O2g2Cl2g+2H2Og;反应自发..①该反应是放热还是吸热;判断并说明理由..②900K时;体积比为4:l的HCl和O2在恒温恒容的密闭容器中发生反应;HCl的平衡转化率αHCl随压强P变化曲线如图..保持其他条件不变;升温到T K假定反应历程不变;请画出压强在1.5×l05~4.5×105Pa范围内;HCl的平衡转化率αHCl随压强P变化曲线示意图..2已知:Cl2g+2NaOHaq=NaClaq+NaClOaq+H2Ol△H l=-102kJ·molˉ13Cl2g+6NaOHaq=5NaClaq+NaClO3aq+3H2O1△H2=-422kJ·molˉ1①写出在溶液中NaClO分解生成NaClO3的热化学方程式:..②用过量的冷NaOH溶液吸收氯气;制得NaClO溶液不含NaClO3;此时ClOˉ的浓度为c0mol·Lˉ1;加热时NaClO转化为NaClO3;测得t时刻溶液中ClOˉ浓度为c t mol·Lˉ1;写出该时刻溶液中Clˉ浓度的表达式;c Clˉ=mol·L-1用c0、c t表示..③有研究表明;生成NaClO3的反应分两步进行:I.2ClOˉ=ClO2ˉ+ClˉII.ClO2ˉ+ClOˉ=ClO3ˉ+Clˉ常温下;反应II能快速进行;但氯气与NaOH溶液反应很难得到NaClO3;试用碰撞理论解释其原因:..3电解NaClO3水溶液可制备NaClO4..在电解过程中由于阴极上吸附氢气;会使电解电压升高;电解效率下降..为抑制氢气的产生;可选择合适的物质不引入杂质;写出该电解的总化学方程式..5.氨气及其相关产品是基本化工原料;在化工领域中具有重要的作用..1以Fe为催化剂;0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气;20min后达到平衡;氮气的物质的量为0.3mol..①在第25min时;保持温度不变;将容器体积迅速增大至2L并保持恒容;体系达到平衡时N2的总转化率为38.2%..请画出从第25min起H2的物质的量浓度随时间变化的曲线..②该反应体系未达到平衡时;催化剂对逆反应速率的影响是填增大、减少或不变..2①N2H4是一种高能燃料;有强还原性;可通过NH3和NaClO反应制得;写出该制备反应的化学方程式..②N2H4的水溶液呈弱碱性;室温下其电离常数K1≈1.0×10-6;则0.01mol·L-1N2H4水溶液的pH等于忽略N2H4的二级电离和H2O的电离..③已知298K和101kPa条件下:N2g+3H2g=2NH3gΔH1;2H2g+O2g=2H2OlΔH2;2H2g+O2g=2H2OgΔH3;4NH3g+O2g=2N2H4l+2H2OlΔH4则N2H4l的标准燃烧热ΔH=..3科学家改进了NO2转化为HNO3的工艺如虚框所示;在较高的操作压力下;提高N2O4/H2O的质量比和O2的用量;能制备出高浓度的硝酸..实际操作中;应控制N2O4/H2O质量比高于5.11;对此请给出合理解释..6.由某精矿石MCO3·ZCO3可以制备单质M;制备过程中排放出的二氧化碳可以作为原料制备甲醇;取该矿石样品1.84g;高温灼烧至恒重;得到0.96g仅含两种金属氧化物的固体;其中m M︰m Z=3︰5;请回答:1该矿石的化学式为..2①以该矿石灼烧后的固体产物为原料;真空高温条件下用单质硅还原;仅得到单质M和一种含氧酸盐只含Z、Si和O元素;且Z和Si的物质的量之比为2︰1..写出该反应的化学方程式..②单质M还可以通过电解熔融MCl2得到..不能用电解MCl2溶液的方法制备M的理由是..3一定条件下;由CO2和H2制备甲醇的过程中含有下列反应:反应1:CO2g+H2g COg+H2Og△H1反应2:COg+2H2g CH3OHg△H2反应3:CO2g+3H2g CH3OHg+H2Og△H3其对应的平衡常数分别为K1、K2、K3;它们随温度变化的曲线如图1所示..则△H2△H3填“大于”、“小于”或“等于”;理由是..4在温度T1时;使体积比为3︰1的H2和CO2在体积恒定的密闭容器内进行反应..T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件;假定t时刻迅速降温到T2;一段时间后体系重新达到平衡..试在图2中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线..7.1氮化铝AlN是一种人工合成的非氧化物陶瓷材料;可在温度高于1500℃时;通过碳热还原法制得..实验研究认为;该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物XX中Al与O的质量比为6.75:2;②在碳存在下;X与N2反应生成AlN..请回答:1X的化学式为.. 2碳热还原制备氮化铝的总反应化学方程式为:Al2O3s+3Cs+N2g2AlNs+3COg①在温度、容积恒定的反应体系中;CO浓度随时间的变化关系如下图曲线甲所示..下列说法不正确...的是..A.从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率B.c点切线的斜率表示该化学反应在t时刻的瞬时速率C.在不同时刻都存在关系:v N2=3v COD.维持温度、容积不变;若减少N2的物质的量进行反应;曲线甲将转变为曲线乙②该反应在高温下自发进行;则随着温度升高;反应物Al2O3的平衡转化率将;填“增大”、“不变”或“减小”;理由是..③一定温度下;在压强为p的反应体系中;平衡时N2的转化率为α;CO的物质的量浓度为c;若温度不变;反应体系的压强减小为0.5p;则N2的平衡转化率将α填“<”、“=”或“>”;平衡时CO的物质的量浓度..A.小于0.5c B.大于0.5c;小于c C.等于c D.大于c3在氮化铝中加入氢氧化钠溶液;加热;吸收产生的氨气;进一步通过酸碱滴定法可以测定氮化铝产品中氮的含量..写出上述过程中氮化铝与氢氧化钠溶液反应的化学方程式..8.2016杭州G20峰会期间;中美两国共同交存参加巴黎协定法律文书;展示了应对全球性问题的雄心和决心..其中燃煤、汽车、工业尾气排放等途径产生的CO、NO x的有效消除成为环保领域的重要课题..请根据题目提供信息回答相关问题..Ⅰ.已知:N2g+O2g=2NOg H=+180.5kJ·mol-12Cs+O2g=2COg H=-221.0kJ·mol-1Cs+O2g=CO2g H=-393.5kJ·mol-11汽车尾气转化器中发生的反应为:2NOg+2COg N2g+2CO2g;此反应的H=;2汽车燃油不完全燃烧时产生CO;有人设想选择合适的催化剂按下列反应除去CO:2COg=2Cs+O2g;则该反应能否自发进行并说明理由:..Ⅱ.已知:用NH3催化还原NO x时包含以下反应..反应①:4NH3g+6NOg5N2g+6H2Ol H1<0反应②:4NH3g+6NO2g5N2g+3O2g+6H2OlH2>0反应③:2NOg+O2g2NO2g H3<03为探究温度及不同催化剂对反应①的影响;分别在不同温度、不同催化剂下;保持其它初始条件不变重复实验;在相同时间内测得N2浓度变化情况如右图所示..下列说法正确的是..A.在催化剂甲的作用下反应的平衡常数比催化剂乙时大B.反应在N点达到平衡;此后N2浓度减小的原因可能是温度升高;平衡向左移动C.M点后N2浓度减小的原因可能是温度升高发生了副反应D.M点后N2浓度减小的原因可能是温度升高催化剂活性降低了4右图中虚线为反应③在使用催化剂条件下;起始O2、NO投料比和NO平衡转化率的关系图..当其他条件完全相同时;用实线画出不使用催化剂情况下;起始O2、NO投料比和NO平衡转化率的关系示意图..5由NO2、O2、熔融盐NaNO3组成的燃料电池如下图所示;在使用过程中石墨Ⅰ电极反应生成一种氧化物Y;请写出石墨Ⅱ极的电极反应式:..30.化学反应原理参考答案:1.一1d22CH34NCl+2H2O通电2CH34NOH+H2↑+Cl2↑二1BC20.67或67%3提高乙醇转化率;提高反应温度;从而加快反应速率;有利于后续产物分离4ACD2.一1C2温度升高;加快反应速率;温度升高使平衡正移的作用大于压强增大使平衡逆移的作用..3①1.95②催化剂显着降低了C10H12→C10H8的活化能;反应生成的C10H12快速转化为C10H8..③作图:二Fe2O3+6e-+3H2O=2Fe+6OH-3.1Al2O3s+3Cs+N2g=2AlNs+3COgΔH=1026kJ·mol-1高温2①CD②③3CO2+6H2O+8e-=CH4+8OH-4.1①放热反应;ΔS<0且反应自发②2①3NaClOaq=2NaClaq+NaClO3aqΔH=-116kJ·mol-1②c0+c0-c t ;3或③反应Ⅰ的活化能高;活化分子百分数低;不利于ClO-向ClO转化32NaClO3+O2通电2NaClO45.1①②增大2 ①2NH3+NaClO=N2H4+NaCl+H2O②10③ΔH2―ΔH1―ΔH43 2N2O4+2H2O+O2=4HNO3;N2O4/H2O质量比等于5.11时恰好完全反应;高于5.11是为了提高N2O4浓度;有利于平衡正向移动;得到高浓度的硝酸..6.1MgCO3·CaCO32①2MgO+2CaO+SiCa2SiO4+2Mg②电解MgCl2溶液时;阴极上H+比Mg2+容易得电子;电极反应式2H2O+2e-=H2↑+2OHˉ;所以不能得到Mg单质3小于由图1可知;随着温度升高;K1增大;则ΔH1>0;根据盖斯定律又得ΔH3=ΔH1+ΔH2;所以ΔH2<ΔH347.1Al2O;2①CD;②增大;该反应在高温下自发;且△S>0;所以△H>0;即正反应为吸热反应;则升高温度;平衡向正方向移动..③>;B;3AlN+NaOH+H2O △NaAlO2+NH3↑8.1-746.5kJ·molˉ12否;该反应△H>0;△S<03CD 4画图实线与虚线重合5O2+4eˉ+2N2O5=4NO3ˉ。
2020版浙江新高考化学选考大一轮复习课件:氧化还原反应

栏目 导引
(2)金属单质与相应阳离子
专题2 离子反应 氧化还原反应
(3)非金属单质与相应阴离子
栏目 导引
专题2 离子反应 氧化还原反应
题组三 外界条件影响物质的氧化性、还原性 4.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与 物质的浓度和反应温度等有关。现有下列各组物质:①Cu 与 HNO3 溶液;②Cu 与 FeCl3 溶液;③Zn 与 H2SO4 溶液;④Fe 与 FeCl3 溶液;⑤Cl2 和 NaOH 溶液;⑥Fe 和 HNO3 溶液;⑦Fe 和 H2SO4 溶液;⑧Na 和 O2。 (1)由于浓度不同而发生不同氧化还原反应的是_________。 (2)由于温度不同而发生不同氧化还原反应的是______________。 (3)氧化还原反应不受浓度、温度影响的是_____________。
专题2 离子反应 氧化还原反应
第二单元 氧化还原反应
[考点分布]
专题2 离子反应 氧化还原反应
知识内容
考试 2016 年 2017 年 2018 年 要求 4 月 10 月 4 月 11 月 4 月 11 月
(1)氧化还原反应
中电子转移的方 向和数目
c T4 T4 T4 T22 T7
(2)根据氧化还原
氧化还原反应的概念
1.氧化还原反应的概念 (1)氧化还原反应的特征及本质 ①特征:有元素化合价的变化; ②本质:有电子的转移(得失或偏移)。
栏目 导引
专题2 离子反应 氧化还原反应
(2)氧化剂:在氧化还原反应中得到电子(或电子对偏向)的反应物 (即所含元素的化合价降低)。 (3)还原剂:在氧化还原反应中失去电子(或电子对偏离)的反应物 (即所含元素的化合价升高)。 (4)还原产物:氧化剂得到电子后生成的对应产物。 (5)氧化产物:还原剂失去电子后生成的对应产物。
(浙江选考)高考化学二轮复习 第三编 化学反应原理 专题九 化学反应中的热效应课件.pptx

12345678
解析 答案
2.(2017·浙江省东阳中学高一3月阶段性考试)(1)下列变化属于吸热反应的 是 ③⑧ (填序号)。 ①葡萄糖在人体内被氧化成CO2;②天然气的燃烧;③煅烧大理石;④稀 盐酸与稀氨水混合;⑤生石灰与水反应生成熟石灰;⑥干冰的升华;⑦钠 与水反应;⑧消石灰与氯化铵晶体的反应
(2)反应热(焓变) ①定义:在恒温、恒压的条件下,反应过程中吸收或释放的热量。 ②符号: ΔH 。 ③单位: kJ/mol或kJ·mol-1 。 ④测量:可用量热计测量。 ⑤表示方法:吸热反应的ΔH > 0;放热反应的ΔH < 0。 ⑥产生原因:化学反应过程中旧键断裂吸收的能量与新键形成放出的能 量不相等,故化学反应均伴随着能量变化。
表示方法
ΔH<0
ΔH>0
实例
H2(g)+Cl2(g)===2HCl(g) C(s)+H2O(g)===CO(g)+H2(g) ΔH=-184.5 kJ·mol-1 ΔH=131.3 kJ·mol-1
特别提醒 (1)化学反应表现为吸热或放热与反应开始是否需要加热无关。 需要加热的反应不一定是吸热反应,如C(s)+O2(g)===CO2(g) ΔH<0; 不需要加热的反应也不一定是放热反应,如Ba(OH)2·8H2O与NH4Cl的反应。 (2)浓硫酸、NaOH固体溶于水放热,NH4NO3溶于水吸热,但此类热效应 属于溶解热,不属于放热反应或吸热反应。 (3)利用放热反应和吸热反应可以比较反应物和生成物的相对稳定性,能 量越低越稳定。
(2)生物质能的利用 农业废弃物(如植物的秸秆、枝叶)、水生植物、油料植物、城市与工业 有机废弃物、动物粪便等这些物质中蕴藏着丰富的能量,我们把这些 来自于植物及其加工产品所贮存的能量叫做生物质能。 生物质能利用的主要方式: ①直接燃烧 (C6H10O5)n+6nO2―点―――――燃―→6nCO2+5nH2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
30.化学反应原理1.(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图1所示。
(1)收集到(CH3)4NOH的区域是(填a、b、c或d)。
(2)写出电池总反应。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l)CH3COOC2H5(l)+H2O(l)ΔH=-2.7kJ·mol-1纯物质沸点/℃恒沸混合物(质量分数)沸点/℃乙醇78.3 乙酸乙酯(0.92)+水(0.08) 70.4乙酸117.9 乙酸乙酯(0.69)+乙醇(0.31) 71.8乙酸乙酯77.1 乙酸乙酯(0.83)+乙醇(0.08)+水(0.09) 70.2请完成:(1)...A.反应体系中硫酸有催化作用B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零C.因为反应的△H接近于零,所以温度变化对平衡转化率的影响大D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计(2)一定温度下该反应的平衡常数K=4.0。
若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y=;若乙酸和乙醇的物质的量之比为n:1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图2中绘制x随n变化的示意图(计算时不计副反应)。
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。
控制乙酸过量的作用有。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g)CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图3所示。
关于该方法,下列推测合理的是。
A.反应温度不宜超过300℃B.增大体系压强,有利于提高乙醇平衡转化率C.在催化剂作用下,乙醛是反应历程中的中间产物D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键2.(一)十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。
已知:C10H18(l)C10H12(l)+3H2(g)△H1,C10H12(l)C10H8(l)+2H2(g)△H2△H1>△H2>0;C10H18→C10H12的活化能为E a1,C10H12→C10H8的活化能为E a2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。
请回答:(1)有利于提高上述反应平衡转化率的条件是。
A.高温高压B.低温低压C.高温低压D.低温高压(2)研究表明,将适量十氢萘置于恒容密闭反应器中,升高温度带来高压,该条件下也可显着释氢,理由是。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图1所示。
①在8h时,反应体系内氢气的量为mol(忽略其他副反应)。
②x1显着低于x2的原因是。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量~反应过程”示意图...。
(二)科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。
阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:和2Fe+3H2O+N2=2NH3+Fe2O3。
3.以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。
电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。
请回答:(1)已知:2Al2O3(s)=4Al(g)+3O2(g)ΔH1=3351kJ·molˉ12C(s)+O2(g)=2CO(g) ΔH2=-221kJ·molˉ12Al(g)+N2(g)=2AlN(s)ΔH3=-318kJ·molˉ1碳热还原Al2O3合成AlN的总热化学方程式是,该反应自发进行的条件。
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ.CO2(g)+4H2(g)CH4(g)+2H2O(g)ΔH4,反应Ⅱ.CO2(g)+H2(g)CO(g)+H2O(g)ΔH5①下列说法不正确...的是。
A.△H4小于零B.温度可影响产物的选择性C.CO2平衡转化率随温度升高先增大后减少D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率②350℃时,反应Ⅰ在t 1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为(用a、V 表示)③350℃下CH4物质的量随时间的变化曲线如图3所示。
画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是。
4.氯及其化合物在生活和生产中应用广泛。
(1)已知:900K时,4HCl(g)+O2(g)2Cl2(g)+2H2O(g),反应自发。
①该反应是放热还是吸热,判断并说明理由。
②900K时,体积比为4:l的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图。
保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×l05~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(P)变化曲线示意图。
(2)已知:Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△H l=-102kJ·molˉ13Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△H2=-422kJ·molˉ1①写出在溶液中NaClO分解生成NaClO3的热化学方程式:。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClOˉ的浓度为c0mol·Lˉ1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClOˉ浓度为c t mol·Lˉ1,写出该时刻溶液中Clˉ浓度的表达式;c(Clˉ)=mol·L-1(用c0、c t表示)。
③有研究表明,生成NaClO3的反应分两步进行:I.2ClOˉ=ClO2ˉ+ClˉII.ClO2ˉ+ClOˉ=ClO3ˉ+Clˉ常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:。
(3)电解NaClO3水溶液可制备NaClO4。
在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降。
为抑制氢气的产生,可选择合适的物质(不引入杂质),写出该电解的总化学方程式。
5.氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用。
(1)以Fe为催化剂,0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为0.3mol。
①在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时N2的总转化率为38.2%。
请画出从第25min起H2的物质的量浓度随时间变化的曲线。
②该反应体系未达到平衡时,催化剂对逆反应速率的影响是(填增大、减少或不变)。
(2)①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式。
②N2H4的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01mol·L-1N2H4水溶液的pH等于(忽略N2H4的二级电离和H2O的电离)。
③已知298K和101kPa条件下:N2(g)+3H2(g)=2NH3(g)ΔH1,2H2(g)+O2(g)=2H2O(l)ΔH2,2H2(g)+O2(g)=2H2O(g)ΔH3,4NH3(g)+O2(g)=2N2H4(l)+2H2O(l)ΔH4则N2H4(l)的标准燃烧热ΔH=。
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸。
实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释。
6.由某精矿石(MCO3·ZCO3)可以制备单质M,制备过程中排放出的二氧化碳可以作为原料制备甲醇,取该矿石样品1.84g,高温灼烧至恒重,得到0.96g仅含两种金属氧化物的固体,其中m(M)︰m(Z)=3︰5,请回答:(1)该矿石的化学式为。
(2)①以该矿石灼烧后的固体产物为原料,真空高温条件下用单质硅还原,仅得到单质M和一种含氧酸盐(只含Z、Si和O元素,且Z和Si的物质的量之比为2︰1)。
写出该反应的化学方程式。
②单质M还可以通过电解熔融MCl2得到。
不能用电解MCl2溶液的方法制备M的理由是。
(3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:反应1:CO 2(g)+H2(g)CO(g)+H2O(g)△H1反应2:CO(g)+2H2(g)CH3OH(g)△H2反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H3其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图1所示。
则△H2△H3(填“大于”、“小于”或“等于”),理由是。
(4)在温度T1时,使体积比为3︰1的H2和CO2在体积恒定的密闭容器内进行反应。
T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件,假定t时刻迅速降温到T2,一段时间后体系重新达到平衡。
试在图2中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线。
7.(1)氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得。
实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75:2);②在碳存在下,X与N2反应生成AlN。
请回答:(1)X的化学式为。
(2)碳热还原制备氮化铝的总反应化学方程式为:Al2O3(s)+3C(s)+N2(g)2AlN(s)+3CO(g)①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如下图曲线甲所示。
下列说法不正确...的是。
A.从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率B.c点切线的斜率表示该化学反应在t时刻的瞬时速率C.在不同时刻都存在关系:v(N2)=3v(CO)D.维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙②该反应在高温下自发进行,则随着温度升高,反应物Al2O3的平衡转化率将,(填“增大”、“不变”或“减小”),理由是。
