2017化学双向细目表
2017年新课标全国卷双向细目表

能力要求
知识要求
难度
要求
接受、吸收、整合化学信息的能力
分析问题和解决问题的能力
化学实验与探究能力
了解
理解掌握
综合应用
7
选
择
题
6
化学与生活[PM2.5、绿色化学、燃煤脱硫、清洁能源
√
√
8
6
有机物性质[植物油加氢加成、同分异构、有机物的鉴别、萃取和分液]
√
√
9
6
实验操作[酸式滴定管的使用与读数、碘的洗涤、pH试纸的使用、溶液配制
√
√
√
√
√
28
14
化学反应能量与化学平衡[砷原子结构示意图、氧化还原反应方程式、压强对速率和平衡的影响、计算反应热(表达式)、平衡判据、速率大小比较(原因分析)、计算平衡常数]
√
√
√
35
15
Co电子排布式、分子间作用力、电离能、sp3杂化、氢键、σ键和π键等[选3/概理+计算]
√
√
√
√
36
15
有机物的结构、名称、官能团的性质、化学方程式书写及同分异构体书写等[选5]
√
√
易
8
6
阿伏伽德罗常数[阿伏伽德罗常数的应用]
√
√
中
9
6
元素周期表[元素周期表的结构;元素周期律的应用]
√
√
√
中难
10
6
实验[实验方案的设计与评价]
√
√
√
中难
11
6
原电池电解池原理[阴阳极的判断;阴阳离子的移动方向;阴阳极电极反应式的书写]
√
初中化学双向细目表(新版)

初中化学双向细目表(新版)简介本文档是初中化学课程的双向细目表,包括了各个知识点和对应的研究目标。
旨在帮助学生了解和研究初中化学知识,提升他们的研究效果和知识掌握程度。
第一章:物质的分类1.1 纯净物和混合物- 研究目标1:了解纯净物和混合物的定义和区别。
- 研究目标2:能够通过实验和观察判断物质是纯净物还是混合物。
1.2 元素和化合物- 研究目标1:掌握元素和化合物的概念。
- 研究目标2:能够通过实验和观察判断物质是元素还是化合物。
第二章:反应与变化2.1 物理变化和化学变化- 研究目标1:理解物理变化和化学变化的定义和区别。
- 研究目标2:能够通过实验和观察判断变化是物理变化还是化学变化。
2.2 酸、碱和盐- 研究目标1:研究酸、碱和盐的基本概念和性质。
- 研究目标2:能够进行酸碱中和实验,观察颜色变化和气体产生等现象。
第三章:常见物质与性质3.1 金属和非金属- 研究目标1:掌握金属和非金属的特征和性质。
- 研究目标2:能够通过实验和观察判断物质是金属还是非金属。
3.2 氧气、水和二氧化碳- 研究目标1:了解氧气、水和二氧化碳的性质和用途。
- 研究目标2:能够进行氧气、水和二氧化碳的实验,观察其性质和现象。
...第四章:实验与应用4.1 实验方法和实验技巧- 研究目标1:研究实验方法和实验技巧,包括观察、测量、记录等。
- 研究目标2:能够根据实验要求选择合适的实验方法和仪器。
4.2 化学实验与应用- 研究目标1:掌握常见的化学实验,如制取氧气、制取水等。
- 研究目标2:了解化学实验在生活和科学研究中的应用。
总结本文档细目表列举了初中化学的各个知识点以及对应的学习目标。
通过学习,学生能够全面了解物质的分类、反应与变化、常见物质与性质,以及实验与应用等方面的内容。
希望本文档能够对初中化学学习者有所帮助,提高他们在化学学科上的学习成果。
高考化学知识点双向细目表

8化肥农药与污染
空气,土壤,水污染
55
9精细化工
表面活性剂
本文来自布克网:()
范文栏目:/fanwen/
个人总结栏目:/fanwen/grzj/
有机反应
43
6以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构、性质上的差异。
有机物的类型,结构与性质
44
7认识卤代烃、醇、酚、醛、羧酸、酯典型代表物的组成和结构特点,知道它们的转化关系。
45
8认识糖类的组成和性质特点
46
9能说出氨基酸的组成、结构特点和主要化学性质,了解蛋白质的组成、结构和性质
高考化学知识点双向细目表
序号
内容标准
涉及相关概念及主要知识
必修模块
1
认识摩尔是物质的量的基本单位。
摩尔
2
初步学会根据物质的组成和性质对物质进行分类。
单质、化合物、有机化合物、无机化合物
3
知道胶体是一种常见的分散系
分散系、胶体
4
知道酸、碱、盐在溶液中能发生电离,通过实验事实认识离子反应及其发生的条件
酸碱盐电解质非电解质、强弱电质、电离
10
通过生产、生活中的实例了解化学能与热能的相互转化
放热反应、吸热反应、反应热
11
举例说明化学能与电能的转化关系及其应用
原电池、电解池
12
认识化学反应的速率和化学反应的限度
化学反应速率、化学反应限度
13
了解甲烷、乙烯、苯等的主要性质,知道乙醇、乙酸、糖类、油脂、蛋白质的组成和主要性质
有机化合物种类、反应
盐类的水解
24
能描述沉淀溶解平衡,知道沉淀转化的本质
沉淀溶解平衡
2017学年第一学期期中杭州地区五校联考高一化学双项细目表

题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26
知识点 物质的分类 实验仪器 电解质 电离方程式 物质的分离方法 核素 氧化还原反应概念 分散系 原子结构模型 物质体积的影响因素 氯气的性质 氧化还原反应的判断 物质的量浓度 物质的保存 反应类型 实验方案 物质的量简单计算 常见物质的检验 原子结构 氧化还原反应的应用 氯气的化学性质 阿伏伽德罗常数 氧化还原反应规律 氧化还原反应综合应用 物质的推断 Ⅰ有关物质的量计算和化学用语 Ⅱ氧化还原反应的应用
分值 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 15
7 6 12
10
1
27 氯水的性质 28 氯气性质的综合应用 29 物质的量浓度配制及误差分析、电
子转移的表示方法
30、31 有关物质的量的综合计算
能力层级 a a b a b a b a a a a a b a b b b b b c b c b c c b b b b b
c
Hale Waihona Puke 题型 单项选择题填空题 填空题 实验题 实验题 计算题
初中化学学业水平双向细目表
3/3 √
9 10/16(2) 23
3
√
3/2/4 √
1/14
3/3 √
质量守恒定律
16(3)/18(3) 2/2/6 24
化学与能源和资源的利 19/20(1)
用
常见的化学合成材料
5
化学物质与健康
4/2
3
√
保护好我们的环境
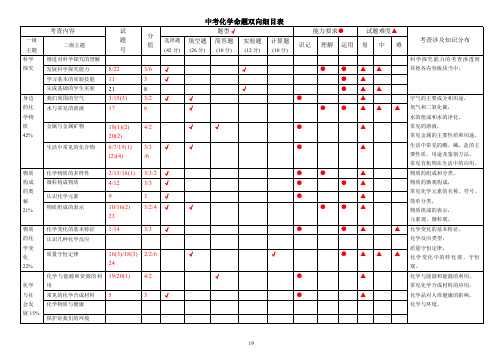
中考化学命题双向细目表
题型√ 填空题 简答题 实验题 计算题
(26 分) (10 分) (12 分) (10 分)
19
一级 主题 科学 探究
身边 的化 学物 质 42%
物质 构成 的奥 秘 21%
物质 的化 学变 化 22%
化学 与社 会发 展 15%
考查内容
二级主题
增进对科学探究的理解 发展科学探究能力 学习基本的实验技能 完成基础的学生实验 我们周围的空气 水与常见的溶液
试 题 号
8/22 11 21 3/15(3) 17
分
选择题
值
(42 分)
3/6 √
3
√
8
3/2 √
6
金属与金属矿物 生活中常见的化合物
18(1)(2) 4/2 20(2)
6/7/15(1) 3/3 √
(2)(4)
/6
化学物质的多样性 微粒构成物质 认识化学元素 物质组成的表示
化学变化的基本特征 认识几种化学反应
2/13/16(1) 3/3/2 √
4/12
√
√ √ √
√
√
√
√
√
√
√
能力要求● 识记 理解 运用
●● ● ●
● ●●
●
●
●
人教版新教材化学课堂教学双向细目表(上)

人教版新教材化学课堂教学双向细目表(上)绪言教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)化学于人类进步以及社会发展的密切关系,学习化学的价值√化学是在分子、原子层次上研究物质的性质、组成、结构与变化规律的科学√√化学作为一门独立学科的发展史√√原子论、分子学说在学科发展中的作用√运用化学知识也需要坚持科学发展观√化学对其它学科的发展起到促进作用√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D化学于人类进步以及社会发展的密切关系,学习化学的价值√化学是在分子、原子层次上研究物质的性质、组成、结构与变化规律的科学√√化学作为一门独立学科的发展史√原子论、分子学说在学科发展中的作用√√√√运用化学知识也需要坚持科学发展观√化学对其它学科的发展起到促进作用√第一单元走进化学实验室课题1 物质的变化和性质教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)化学变化、物理变化的概念√√区分物质的物理性质和化学性质√√√物理变化和化学变化的联系√化学变化时常伴随能量变化,物理技术和方法对研究化学也是很重要的√物质的性质与物质的组成和结构的联系√物质性质与物质变化规律以及用途之间的关系√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D化学变化、物理变化的概念√√√√区分物质的物理性质和化学性质√√√√√√物理变化和化学变化的联系√√化学变化时常伴随能量变化,物理技术和方法对研究化学也是很重要的√√物质的性质与物质的组成和结构的联系√√物质性质与物质变化规律以及用途之间的关系√√课题2 化学是一门以实验为基础的科学教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)实验是学习化学的重要途径√对实验现象进行观察和描述,记录①条件②变化前后的颜色和状态③过程中的现象√√√认识蜡烛及蜡烛燃烧现象√√吸入和呼出气体成分的差异√√根据方案进行实验,及写实验报告√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D实验是学习化学的重要途径√√√√对实验现象进行观察和描述,记录①条件②变化前后的颜色和状态③过程中的现象√√√√√√√√√认识蜡烛及蜡烛燃烧现象√√√√√√吸入和呼出气体成分的差异√√√√√√根据方案进行实验,及写实验报告√√课题3 走进化学实验室教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)实验室规则√化学试剂取用原则,药品取用的方法(粉末状、块状、液体药品的取用,量筒、滴灌的使用等)√√酒精灯使用的注意事项√√给试管里的液体或固体物质加热的方法√√玻璃仪器的洗涤方法√√常用仪器的使用及操作注意事项√√正确使用托盘天平,对错误称量进行正确的数据处理√√√分析量筒量液时读数错误(俯视,仰视)给实验数据的计算带来误差√√√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D实验室规则√√√化学试剂取用原则,药品取用的方法(粉末状、块状、液体药品的取用,量筒、滴灌的使用等)√√√√√√酒精灯使用的注意事项√√√√√√给试管里的液体或固体物质加热的方法√√√√√√玻璃仪器的洗涤方法√√√√√√常用仪器的使用及操作注意事项√√√√√√正确使用托盘天平,对错误称量进行正确的数据处理√√√√√√√√√分析量筒量液时读数错误(俯视,仰视)给实验数据的计算带来误差√√√√√√√√√第二单元我们周围的空气课题1 空气教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)空气成分实验,及各成分的用途√纯净物和混合物√√√设计实验,探究空气中氧气的体积分数√√√探究空气中氧气体积分数实验结果的误差原因分析√√√√氧气、氮气、稀有气体的主要用途及相关性质√√空气污染的原因、危害及防治措施√√√文字表达式表示化学反应过程√√绿色化学的理念√√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D空气成分实验,及各成分的用途√√纯净物和混合物√√√√√√设计实验,探究空气中氧气的体积分数√√√√√√探究空气中氧气体积分数实验结果的误差原因分析√√√√√√√√√氧气、氮气、稀有气体的主要用途及相关性质√√√√空气污染的原因、危害及防治措施√√√√√√文字表达式表示化学反应过程√√√√√√绿色化学的理念√√√√课题2 氧气教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)氧气的物理性质√氧气能与很多物质发生化学反应,氧气的化学性质比较活泼√√√许多物质在氧气中和在空气中燃烧现象不同,从实验中获取化学信息√√√化合反应、氧化反应√√√√缓慢氧化及相关事例√√化学反应中的能量变化√√文字表达式表示化学反应过程√√√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D氧气的物理性质√√√氧气能与很多物质发生化学反应,氧气的化学性质比较活泼√√√√√√许多物质在氧气中和在空气中燃烧现象不同,从实验中获取化学信息√√√√√√√√√化合反应、氧化反应√√√√√√√√√√√√缓慢氧化及相关事例√√√√化学反应中的能量变化√√√√文字表达式表示化学反应过程√√√√√√√课题3 制取氧气教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)实验室制取氧气的原理、装置、步骤及注意事项√√√√催化剂及催化作用√√√运用简单装置制取氧气√√通过铁、碳在氧气中燃烧的实验探究,验证氧气的性质√√分解反应的特点√√√通过实验认识氧化铁、氧化铜也可做实验室制取氧气的催化剂√√通过比较分析,探究温度、浓度等也会影响过氧化氢溶液制取氧气的速率√√√√对实验失败,收集氧气不纯等的原因进行分析、纠正√√√√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D实验室制取氧气的原理、装置、步骤及注意事项√√√√√√√√√√√√√√√√催化剂及催化作用√√√√√√√√√运用简单装置制取氧气√√√√√√通过铁、碳在氧气中燃烧的实验探究,验证氧气的性质√√√√√√分解反应的特点√√√√√√通过实验认识氧化铁、氧化铜也可做实验室制取氧气的催化剂√√√√√√通过比较分析,探究温度、浓度等也会影响过氧化氢溶液制取氧气的速率√√√√√√√√√√√√对实验失败,收集氧气不纯等的原因进行分析、纠正√√√√√√√√√√√√第三单元物质构成的奥秘课题1 分子和原子教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)物质是由分子原子等微小的粒子构成的√通过实验探究活动和自测的分子模型,由形象到抽象认识分子、原子的特征√√√用分子原子的观点解释一些简单的现象√√分子是保持物质化学性质的最小粒子,原子是化学变化中的最小粒子,分子与原子的区别和联系。
化学选考题双向细目表
3.了解蛋白质的组成、结构和性质。
4.了解化学科学在生命科学发展中所起的重要作用。
(四)合成高分子化合物
1.了解合成高分子的组成与结构特点,能依据简单合成高分子的结构分析其链节和单体。
2.了解加聚反应和缩聚反应的特点。
3.了解新型高分子材料的性能及其在高新技术领域中的应用。
(三)化学与工农业生产
1.了解化学在水处理中的应用。
2.了解合成氨的主要原理、原料、重要设备、流程和意义,认识催化剂的研制对促进化学工业发展的重大意义。
3.了解精细化工产品的生产特点、精细化工在社会发展中的作用。
4.了解化学肥料、农药等在农业生产中的作用。
A
A
A
A
A
A
A
A
A
A
A
A
15
物质结构与
性质
(一)原子结构与元素的性质
4.了解合成高分子化合物在发展经济、提高生活质量方面的贡献。
A
A
A
A
A
A
B
A
A
A
A
A
A
A
A
A
A
A
A
A
15
6.能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或者离子的空间结构。
(三)分子间作用力与物质的性质
1.了解化学键和分子间作用力的区别。
2.了解氢键的存在对物质性质的影响,能列举含有氢键的物质。
3.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
4.能根据晶胞确定晶体的组成并进行相关的计算。
(二)化学与材料的制造和应用
双向细目表(化学)
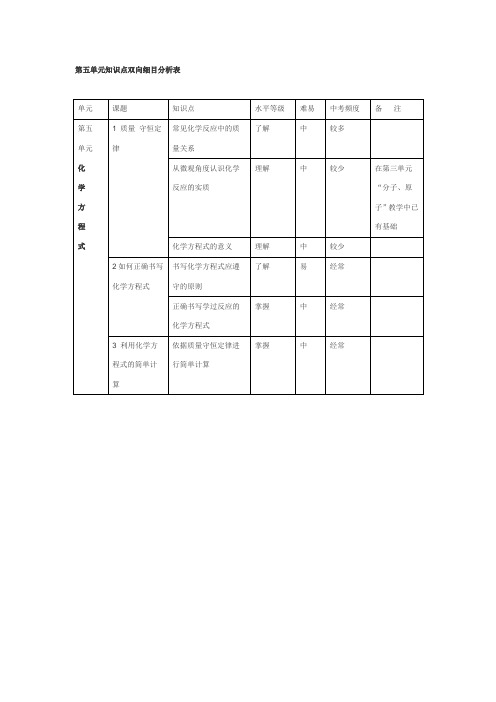
单元
课题
知识点
水平等级
难易
中考频度
备注
第五
单元
化
学
方
程
式
1质量守恒定律
常见化学反应中的质量关系
了解
中
较多
从微观角度认识化学反应的实质
理解
中
较少
在第三单元“分子、原子”教学中已有基础
化学方程式的意义
理解
中
较少
2如何正确书写化学方程式
书写化学方程式应遵守的原则
了解
易
经常
正确书写学过反应的化学方程式
掌握
中Hale Waihona Puke 经常3利用化学方程式的简单计算
依据质量守恒定律进行简单计算
掌握
中
经常
2017高考化学知识点双向细目表(新考纲修订。原创。涂)

√ √ √ √ √ √ √ √ √ √ √ √ √
√ √ √
√√√ √ Nhomakorabea√ √
√
√ √ √ √ √ √
√ √
电解质溶液 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 常见有机物及其应用 71 72 73 74 75 76 77 78 79 80 81 化学实验 82 83 84 85 86 87 88 有机化合物的 组成与结构 89 90 91 有机化 学基础 模块 烃及其衍生物 的性质与应用 92 93 94 95 96 糖类、氨基酸 和蛋白质 合成高分子 97 98 99 盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。 离子反应的概念、离子反应发生的条件。 常见离子的检验方法。 难溶电解质的沉淀溶解平衡。 溶度积(Ksp )的含义,能进行相关的计算。 以上各部分知识的综合应用 常见金属元素 (如Na、Mg、 Al、Fe、Cu 等) 常见无 机物及 常见非金属元 其应用 素(如H、C、N 、O、Si、Cl 等) 常见金属的活动性顺序。 常见金属及其重要化合物的制备方法。 常见金属及其重要化合物的主要性质及其应用。 合金的概念及其重要应用。 常见非金属单质及其重要化合物的制备方法。 常见非金属单质及其重要化合物的主要性质及其应用。 常见非金属元素单质及其重要化合物对环境质量的影响。 以上各部分知识的综合应用 有机化合物中碳的成键特征。 有机化合物的同分异构现象。 能正确书写简单有机化合物的同分异构体。 常见有机反应类型。 甲烷、乙烯、苯等有机化合物的主要性质及其重要应用。 氯乙烯、苯的衍生物等在化工生产中的重要作用。 乙醇、乙酸的结构和主要性质及重要应用。 糖类、油脂、蛋白质的组成和主要性质及其重要应用。 常见高分子材料的合成反应及其重要应用。 以上各部分知识的综合应用 化学实验是科学探究过程中的一种重要方法。 化学实验室常用仪器的主要用途和使用方法。 化学实验的基本操作。 能识别化学品标志。实验室一般事故的预防和处理方法。 常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。 常见物质进行检验、分离和提纯的方法。 溶液配制方法。 根据化学实验的目的和要求,能做到:设计实验方案;正确选用实验装置;掌握控制实 验条件的方法;预测或描述实验现象、分析或处理实验数据,得出合理结论;评价或改 进实验方案。 以上各部分知识的综合应用 能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。 常见常见有机化合物的结构。 有机物分子中的官能团,能正确表示它们的结构。 确定有机化合物结构的化学方法和某些物理方法(如质谱、红外光谱、核磁共振氢谱等) 。 能正确书写有机化合物的同分异构体(不包括手性异构体)。 能根正确命名简单的有机化合物。 有机分子中官能团之间存在相互影响。 烷、烯、炔和芳香烃的结构与性质。 卤代烃、醇、酚、醛、羧酸、酯的结构与性质,以及它们之间的相互转化。 烃类及衍生物的重要应用以及烃的衍生物合成方法。 根据信息能设计有机化合物的合成路线。 糖类、氨基酸和蛋白质的组成、结构特点、主要化学性质及应用。 糖类、氨基酸和蛋白质在生命过程中的作用。 合成高分子的组成与结构特点。能依据简单合成高分子的结构分析其链节和单体。 √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √
化学试题双向细目表
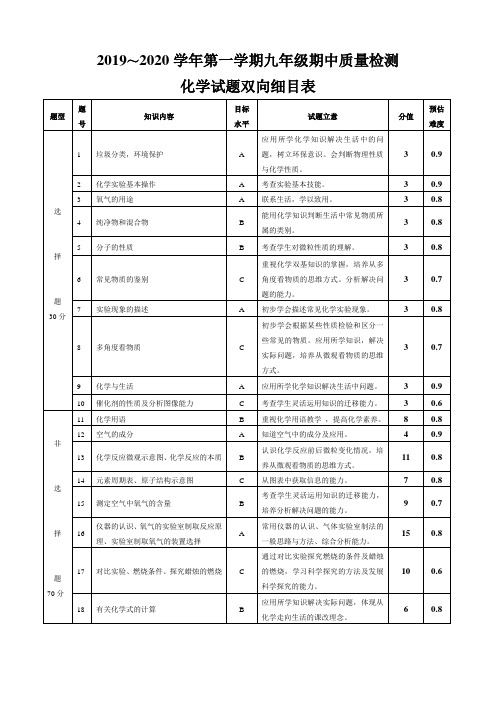
题号
知识内容
目标水平
试题立意
分值
预估难度
选
择
题
30分
1
垃圾分类,环境保护
A
应用所学化学知识解决生活中的问题,树立环保意识。会判断物理性质与化学性质。
3
0.9
2
化学实验基本操作
A
考查实验基本技能。
3
0.9
3
氧气的用途
A
联系生活,学以致用。
3
0.8
4
纯净物和混合物
B
能用化学知识判断生活中常见物质所属的类别。
11
0.8
14
元素周期表、原子结构示意图
C
从图表中获取信息的能力。
7
0.8
15
测定空气中氧气的含量
B
考查学生灵活运用知识的迁移能力,培养分析解决问题的能力。
9
0.7
16
仪器的认识、氧气的实验室制取反应原理、实验室制取氧气的装置选择
A
常用仪器的认识、气体实验室制法的一般思路与方法、综合分析能力。
15
0.8
3
0.7
9
化学与生活
A
应用所学化学知识解决生活中问题。
3
0.9
10
催化剂的性质及分析图像能力
C
考查学生灵活运用知识的迁移能力。
3
0.6
非
选
择
题
70分
11
化学用语
B
重视化学用语教学,提高化学素养。
8
0.8
12
空气的成分
A
知道空气中的成分及应用。
4
0.9
13
化学反应微观示意图、化学反应的本质
高一化学必修1双向细目表
√
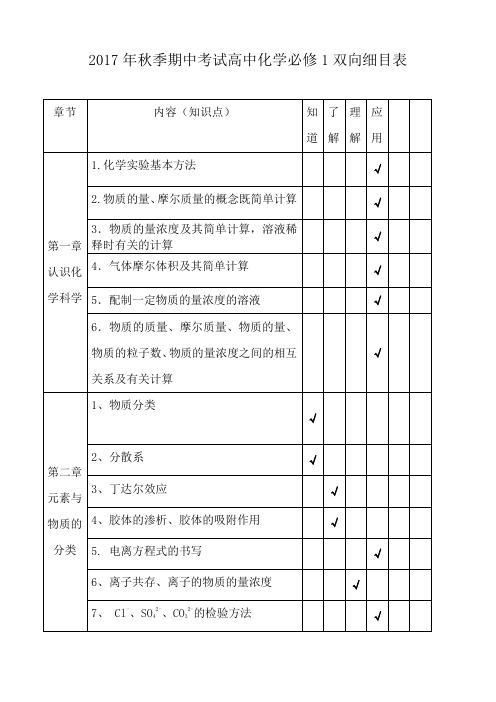
第二章
元素与物质的分类
1、物质分类
√
2、分散系
√
3、丁达尔效应
√
4、胶体的渗析、胶体的吸附作用
子共存、离子的物质的量浓度
√
7、Cl-、SO42-、CO32-的检验方法
√
8.氧化还原反应、氧化、还原、氧化剂、还原剂等概念
√
9.简单的氧化还原反应方程式的配平、标出电子转移的方向和数目
2017年秋季期中考试高中化学必修1双向细目表
章节
内容(知识点)
知道
了解
理解
应用
第一章认识化学科学
1.化学实验基本方法
√
2.物质的量、摩尔质量的概念既简单计算
√
3.物质的量浓度及其简单计算,溶液稀释时有关的计算
√
4.气体摩尔体积及其简单计算
√
5.配制一定物质的量浓度的溶液
√
6.物质的质量、摩尔质量、物质的量、物质的粒子数、物质的量浓度之间的相互关系及有关计算
高中化学双向细目表

高中化学双向细目表高考化学双向细目表分类序号知识点内容1 物质的组成、性质和分类2 化学基本概念3 物质的分子、原子、离子、元素等概念的含义;初步了解原子团的定义4 物理变化与化学变化的区别与联系5 混合物、纯净物、单质和化合物、金属和非金属的概念6 同素异形体的概念7 酸、碱、盐、氧化物的概念及其相互联系8 熟记并正确书写常见元素的名称、符号、离子符号9 熟悉常见元素的化合价;能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价10 掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法;理解质量守恒定律的含义;掌握热化学方程式的含义11 能正确书写化学方程式、离子方程式、电离方程式、电极反应式12 了解相对原子质量、相对分子质量的涵义13 掌握物质的量的单位--摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol-1)的含义14 物质的量浓度(mol·L-1)、阿伏加德罗常数的含义15 掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系16 掌握化学反应的四种基本类型:化合、分解、置换、复分解17 理解氧化还原反应,了解氧化剂和还原剂等概念;掌握重要氧化剂、还原剂之间的常见反应18 能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式19 了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念20 了解溶液的涵义21 了解溶液的组成,理解溶质的质量分数的概念22 了解饱和溶液、不饱和溶液的概念;了解溶解度的概念;了解温度对溶解度的影响及溶解度曲线23 初步了解结晶、结晶水、结晶水合物、风化、潮解的概念24 了解胶体的概念及其重要性质和应用25 了解原子的组成及同位素的概念26 掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系注:综合应用部分不在此表中列出。
高中化学命题双向细目表

高中化学命题双向细目表
高中化学命题双向细目表是一个指导教师命题的重要工具,它详细列出了高中化学的各个知识点和技能,以及它们在试卷中的比重和难度。
以下是一个简化的高中化学命题双向细目表,供您参考:
高中化学命题双向细目表
一、目标领域与认知层级
1. 知识
回忆
理解
应用
2. 技能
分析
判断
实验
3. 态度与价值观
兴趣与好奇心
安全意识
环境保护
二、内容主题
1. 物质结构与性质
分子、原子、离子的基本性质
元素周期表与元素性质
酸、碱、盐、氧化物的性质与反应2. 化学反应与能量
化学反应的类型与能量变化
电化学基础(原电池、电解池)3. 有机化学基础
常见有机物的结构与性质
有机反应类型与机理
4. 实验技能与安全
实验操作与仪器使用
实验设计与数据处理
实验安全与环境保护
5. 化学计算
物质的量与摩尔质量计算
化学反应中的定量关系与计算
6. 化学工艺流程与合成
实际生产中的化学工艺流程
有机合成与高分子合成基础
7. 综合应用
各主题的综合应用与分析解决实际问题能力。
高中化学必修和必修双向细目表

高中化学必修1双向细目表
章节
内容(知识点)
知道
了解
理解
应用
第一章认识化学科学
1.研究物质性质的方法和程序
√
2、钠、氯气的物理性质
√
3、钠及其氧化物、氯气的化学性质。
√
4.物质的量、摩尔质量的概念既简单计算
√
5.物质的量浓度及其简单计算,溶液稀释时有关的计算
√
6.气体摩尔体积及其简单计算
√
3、原子核外电子的排布规律,写出1~18号元素的原子结构示意图及相关离子的表示方法
√
4、能举例说明原子的最外层电子排布与元素性质(原子的得失电子能力、化合价)的关系。
√
5、元素原子最外层电子排布、原子半径、元素最高化合价和最低化合价的周期性变化,认识元素周期律。
√
6、元素周期表的结构(周期、族)以及1~18号元素在周期表中的位置。
√
5、生物固氮和人工固氮形式,认识N2、NO、NO2的性质;
√
6、NH3性质及制取、铵盐的性质及铵态氮肥的使用问题;
√
7、HNO3的性质。
√
8、硫的主要性质;
√
9、不同价态硫元素之间的相互转化
√
10、二氧化硫和浓硫酸的主要性质。
√
11、硫及其化合物在生产中的应用及酸雨的危害
√
12、镁单质的还原性和重要用途。
√
12、复合材料的概念,
√
13、复合材料的基本组成、优点。
√
高中化学必修2双向细目表
章节
内容(知识点)
知道
了解
理解
应用
第一章
原子结构元素周期律
1、原子核的构成,质量数与质子数、中子数的关系;质子数、核电荷数、核外电子数的关系,能说出AZX的含义。
高二化学第一学期双向细目表

内容
A
B
C
D
第九章
物质结构元素周期律
第一节
元素周期律的应用
1、元素原子核外电子排布,原子半径,主要化合价的周期性变化。
√
第二节
元素周期表
1、元素周期表的结构以及周期、族等概念
√
2、原子结构与元素在周期表中位置间的关系
√
3、通过对碱金属、卤族元素性质的探究,理解元素性质与原子结构以及元素在周期表中的位置的相互关系,掌握碱金属和卤族元素的相似性和递变性
2017学年第一学期期中阶段测验命题范围
年级学科
备课组Байду номын сангаас:,时间:月日
(备课组提供)
说明:本学期期中阶段测验时间暂定为高一在11月2日、11月3日,其他年级在11月6日、11月7日。本表在各备课组充分讨论、备课组长填写后,由教研组长审核,9月27日12:00前发给教导处乐菁老师。
序号
内容
A
B
C
D
如:高二化学第一学期第九章双向细目表
√
4、原子核结构,理解质量数的含义,构成原子的微粒间的关系,元素、同位素的涵义
√
第三节
元素周期律的应用
1、原子核外电子的排布规律,1~20号元素的原子结构示意图;原子最外层电子排布与元素的原子得失电子能力和化合价的关系
√
2、第三元素和ⅰA族,ⅶA族元素为例,掌握同周期,同主族元素性质的递变规律,并能运用原子结构理论初步解释这些递变规律
√
3、原子结构、元素性质及该元素在周期表中的位置三者间的关系,学会运用周期表
√
2015-2017全国新课标化学1卷双向细目表及复习建议
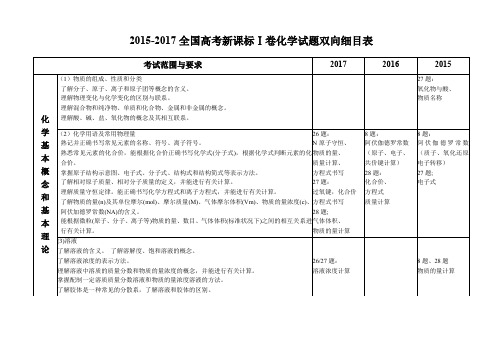
2015-2017全国高考新课标Ⅰ卷化学试题双向细目表
复习建议:
1.知识梳理
(1)精读课本。
课本要看细看全,不留死角,易混、易错、易漏的知识点要用不同颜色的彩笔勾划,概念理论要能理解并准确复述。
(2)构建网络。
结合思维导图,对模块知识、主干内容进行梳理,构建知识网络,形成脑海中的资料库。
(3)研究考纲。
对照考纲、考题和双向细目表,明确自己的复习方向,自我诊断复习的效果。
2.规范答题
(1)规范审题。
审题时,笔随题走,逐字逐句读全,对关键字词、条件、数据及时勾划并作出醒目标记,保证不遗漏,提高审题的效率。
(2)规范答题。
文字书写要工整、化学用语要规范、解释简答要全面,计算时要多写步骤。
(3)要了解阅卷标准。
3.错题整理
错题整理的关键不是汇总题目,而是找到错因、对症下药、及时解决问题。
特别是有疑问的点要重点解决,将考点、规律与思路紧密联系,提高对题目分析能力。
高考化学知识点双向细目表ok

高考化学知识点双向细目表
高考知识要求的三个层次(高层次包含低层次):
了解:对所学化学知识有初步认识,能够正确复述、再现、辨认或直接使用。
下表标为“A”。
理解(掌握):领会所学化学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题,即不仅“知其然”,还能“知其所以然”。
下表标为“B”。
综合应用:在理解所学各部分化学知识的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体的化学问题。
下表标为“C”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原子结构与元 素性质 物质结 构与性 质模块 化学键分子间 作用力与物质 性质 分子间作用力 与物质的性质
2017年最新高考化学知识点双向细目表
分类 序号
1 物质的组成、 性质和分类 2 3 4 5 6 7 化学用语及常 用计量 8 9 10 11 12 13 14 溶液 15 16 17 18 19 20 21 物质结构元素 周期律 22 23 24 25 26 27 化学基 本概念 和基础 理论 28 29 30 31 32 化学反应与能 量 33 34 35 36 37 38 39 40 41 42 43 化学反应速率 和化学平衡 44 45 46 47 48 49 50 51 52 53 电解质溶液 54
√ √ √ √ √ √ √ √ √ √ √ √ √
√ √ √
√
√
√ √
√ √
√
√ √ √ √ √ √
√ √
电解质溶液 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 常见有机物及其应用 71 72 73 74 75 76 77 78 79 80 81 化学实验 82 83 84 85 86 87 88 有机化合物的 组成与结构 89 90 91 有机化 学基础 模块 烃及其衍生物 的性质与应用 92 93 94 95 96 糖类、氨基酸 和蛋白质 合成高分子 97 98 99 盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。 离子反应的概念、离子反应发生的条件。 常见离子的检验方法。 难溶电解质的沉淀溶解平衡。 溶度积(Ksp )的含义,能进行相关的计算。 以上各部分知识的综合应用 常见金属元素 (如Na、Mg、 Al、Fe、Cu 等) 常见无 机物及 常见非金属元 其应用 素(如H、C、N 、O、Si、Cl 等) 常见金属的活动性顺序。 常见金属及其重要化合物的制备方法。 常见金属及其重要化合物的主要性质及其应用。 合金的概念及其重要应用。 常见非金属单质及其重要化合物的制备方法。 常见非金属单质及其重要化合物的主要性质及其应用。 常见非金属元素单质及其重要化合物对环境质量的影响。 以上各部分知识的综合应用 有机化合物中碳的成键特征。 有机化合物的同分异构现象。 能正确书写简单有机化合物的同分异构体。 常见有机反应类型。 甲烷、乙烯、苯等有机化合物的主要性质及其重要应用。 氯乙烯、苯的衍生物等在化工生产中的重要作用。 乙醇、乙酸的结构和主要性质及重要应用。 糖类、油脂、蛋白质的组成和主要性质及其重要应用。 常见高分子材料的合成反应及其重要应用。 以上各部分知识的综合应用 化学实验是科学探究过程中的一种重要方法。 化学实验室常用仪器的主要用途和使用方法。 化学实验的基本操作。 能识别化学品标志。实验室一般事故的预防和处理方法。 常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。 常见物质进行检验、分离和提纯的方法。 溶液配制方法。 根据化学实验的目的和要求,能做到:设计实验方案;正确选用实验装置;掌握控制实 验条件的方法;预测或描述实验现象、分析或处理实验数据,得出合理结论;评价或改 进实验方案。 以上各部分知识的综合应用 能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。 常见常见有机化合物的结构。 有机物分子中的官能团,能正确表示它们的结构。 确定有机化合物结构的化学方法和某些物理方法(如质谱、红外光谱、核磁共振氢谱等) 。 能正确书写有机化合物的同分异构体(不包括手性异构体)。 能根正确命名简单的有机化合物。 有机分子中官能团之间存在相互影响。 烷、烯、炔和芳香烃的结构与性质。 卤代烃、醇、酚、醛、羧酸、酯的结构与性质,以及它们之间的相互转化。 烃类及衍生物的重要应用以及烃的衍生物合成方法。 根据信息能设计有机化合物的合成路线。 糖类、氨基酸和蛋白质的组成、结构特点、主要化学性质及应用。 糖类、氨基酸和蛋白质在生命过程中的作用。 合成高分子的组成与结构特点。能依据简单合成高分子的结构分析其链节和单体。 √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √
√ √ √ √
√ √ √
√
√ √ √ √ √ √ √
√ √
√ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √
√ √ √ √ √ √ √ √
√
100 加聚反应和缩聚反应的含义。 101 合成高分子在高新技术领域的应用以及在发展经济、提高生活质量方面中的贡献。 102 原子核外电子的运动状态、能级分布和排布原理。 103 能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表达式。 104 105 106 107 108 109 110 111 112 电离能的含义,并能用以说明元素的某些性质。 电子在原子轨道之间的跃迁及其简单应用。 了解电负性的概念,并能用以说明元素的某些性质。 离子键的形成,能根据离子化合物的结构特征解释其物理性质。 共价键的形成、极性、类型(σ 键和π 键),配位键的含义。 杂化轨道理论及简单的杂化轨道类型(sp、sp2、sp3)。 能用价层电子对互斥理论或者杂化轨道理论推测简单分子或离子的空间结构。 范德华力的含义及对物质性质的影响。 氢键的含义,能列举存在氢键的物质,并能解释氢键对物质性质的影响。
知 识 点 内 容
分子、原子、离子、原子团等概念的含义; 物理变化与化学变化的区别与联系。 混合物和纯净物、单质和化合物、金属和非金属的概念
了解
√
理解 掌握
√ √ √
综合 应用
酸、碱、盐、氧化物的概念及其相互联系。
熟记并正确书写常见元素的名称、符号、离子符号。 熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),或根据化学式判断 化合价。 原子结构示意图、电子式、分子式、结构式和结构简式的表示方法。 相对原子质量、相对分子质量的定义,并能进行有关计算。 能正确书写化学方程式、离子方程式,并能进行有关计算。 质量守恒定律。 物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度 (c)、阿伏加德罗常数(N A )的含义。 能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的 相互关系进行有关计算。 溶液的含义。 溶解度、饱和溶液的概念。 溶液浓度的表示方法。 溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。 配制一定溶质质量分数溶液和物质的量浓度溶液的方法。 胶体是一种常见的分散系。溶液和胶体的区别。 元素、核素和同位素的含义。 原子构成。原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关 系。 原子核外电子排布规律。 元素周期律的实质。 元素周期表(长式)的结构(周期、族)及其应用。 以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系 以IA和ⅦA族为例,掌握同一主族元素性质递变规律与原子结构的关系。 金属、非金属在元素周期表中的位置及其性质递变规律。 化学键的定义。离子键、共价键的的形成。 氧化还原反应的本质是电子转移。 常见的氧化还原反应。 常见氧化还原反应的配平和相关计算。 化学反应中能量转化的原因及常见的能量转化形式。 化学能与热能的相互转化。吸热反应、放热反应、反应热等概念。 热化学方程式的含义,能正确书写热化学方程式。 能源是人类生存和社会发展的重要基础。化学在解决能源危机中的重要作用。 焓变(Δ H)与反应热的含义。 盖斯定律,并能运用盖斯定律进行有关反应焓变的计算。 原电池和电解池的构成、工作原理及应用。 写出电极反应和电池反应方程式。 常见电源的种类及其工作原理。 金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。 化学反应速率的概念、反应速率的定量表示方法。 能正确计算化学反应的转化率(α)。 反应活化能的概念,催化剂的重要作用。 化学反应的可逆性及化学平衡的建立。 化学平衡的特征。 化学平衡常数的含义,能够用化学平衡常数进行简单计算。 外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论 解释其一般规律。 化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 电解质的概念、强电解质和弱电解质的概念。 电解质在水溶液中的电离,以及电解质的导电性。 水的电离,离子积常数。 了解溶液pH的含义及其测定方法,能进行pH的简单计算。 弱电解质在水溶液中的电离平衡。 利用电离平衡常数进行相关计算。 √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √
