愈伤组织培养
植物愈伤组织培养的关键技术

植物愈伤组织培养的关键技术在现代农业中,植物愈伤组织培养技术广泛应用于种植业和植物育种中。
该技术通过培养和再生植物愈伤组织,可以实现快速繁殖、基因转化和育种改良等目的。
以下是植物愈伤组织培养中的关键技术:1. 材料准备:选择适宜的植物组织(如茎尖、叶片等)作为外植体,确保其健康和无病虫害。
外植体的选择对成功培养愈伤组织至关重要。
2. 外植体的消毒:使用适当的消毒方法,如漂白剂或酒精处理,以杀灭外植体表面的微生物。
3. 媒体配制:选择适宜的基础培养基,并添加必要的植物生长调节剂(如激素)和营养物质,以提供愈伤组织生长和分化所需的条件。
4. 培养条件控制:为愈伤组织提供适宜的光照、温度和湿度条件,以促进其生长和分化。
光照和温度的合理控制对于植物愈伤组织的培养成功至关重要。
5. 组织诱导和增殖:通过添加适当的激素和营养物质,诱导外植体形成愈伤组织,并通过继代培养,实现愈伤组织的快速增殖。
6. 分化和再生:通过调整培养基的成分和激素的添加量,促进愈伤组织分化为根、茎和叶等不同的组织器官,并进一步培养和培育出整株植物。
7. 病害防治:在愈伤组织培养过程中,要注意病害的防治,如消毒外植体、灭菌培养器具等,以避免病原微生物的侵染。
8. 营养调控:根据不同植物的营养需求和生长阶段的需要,合理调节培养基中的营养物质的含量和比例,以促进愈伤组织的生长和发育。
植物愈伤组织培养技术的成功与否,往往取决于以上关键技术的合理应用和控制。
这些技术的正确操作和调控,能够为植物育种和种植业的发展提供有力支持。
以上是关于植物愈伤组织培养的关键技术的简要介绍。
希望对您有所帮助!。
CHAPTER,愈伤组织培养

分生组织结节可以成为愈伤组织的生长中心,或者进一步分化为维管组织结 节——由分生组织结节外围的细胞作平周分裂成为形成层状细胞,并形成了 部分维管组织如管胞、纤维细胞等,但不形成维管系统。由于此期细胞分裂 已基本停止,细胞内发生生理代谢等的变化而开始形成一些不同形态和功能
的细胞,因此有人又将此期称为分化期。
分生状态:细胞变小、细胞质稠密、液泡变小、核和核仁变 大并趋向细胞中央
小麦花粉分化和脱分化第一次有丝分裂的差异
分化
脱分化
1、分裂前细 胞
核的位置 2、分裂前、
中的细 胞质
3、纺缍体
4、新细胞壁
必定在萌发孔对面紧靠 在花粉粒中无确定的位
胞壁
置
除一部分靠胞壁外,大 部分集中在核对着 萌发孔的一侧
在核的周围分布比较均 匀
(3)愈伤组织形成期:
愈伤进一步发育,其周缘近表面部分细胞分裂较多,(垂周分裂)形成 愈伤形成层,而愈伤深层细胞显著增大,细胞质变稀薄,液泡变大,核和 核仁变小并移到细胞边缘,RNA含量下降,在外植体切口处明显可见一团 团有一定生长型式的愈伤组织。
三个发育时期各有其主要特征,但并不专一,有时会交叉混杂发生。 形成期是指外植体经过诱导期和分裂期后形成了无序结构的愈伤组织的时期。
分化是在失去极性的状态下进行的分裂
陆文樑(1982)
脱分化后的愈伤组织其薄壁细胞是非匀质的:愈伤组织虽然未分化出 其它特化组织(如维管束等),其薄壁细胞在组成上仍是有差异的
在脱分化过程中,伴随着细胞形态结构的变化
通过脱分化形成的愈伤组织在培养过程中保持具分生能力的薄壁细胞或肉 眼观察不出的分化程度较低的状态(内部已形成一定的形态组织或细胞), 因此习惯上称愈伤组织是处在“没有分化”、“脱分化”状态的细胞
第五章愈伤组织培养

例:百合:鳞茎的鳞片分化能力:外层>中层>内层
(2)植物激素的作用(外因)
适宜的植物激素配比在器官分化中有着重要的作用。
生长素
高:有利于根的形成和愈伤组织的形成;
= 适中:有利于根芽的分化;
细胞分裂素 低:有利于芽的形成
芦荟的植物组织培养过程
1
2
3
4
5
6
7
10
8
9
11
芽(单芽、丛芽)
第二节 愈伤组织中的形态发生
➢ 脱分化:细胞由静止期进入分裂期,恢复分裂机能
分裂期外植体的特征:
细胞分裂快,结构疏松, 缺少有组织的结构,维持 其不分化的状态,颜色浅 而透明。
细胞的主要表现:
外层细胞在外源激素的作用下,迅速分裂, 使得外层细胞数目增加, 细胞体积缩小,细胞的核和核仁增大到最大。 逐步回到分生组织状态。 随着细胞不断分裂和生长,细胞总干重、蛋 白质和核酸量大大增加,新细胞壁合成极快。 细胞分裂快,结构疏松,缺少有组织的结构, 维持其不分化的状态,颜色浅而透明。
生愈伤组织
愈伤组织生长良好
愈伤组织增殖强
NOA 萘氧乙酸
无愈伤组织形成 愈伤组织增殖中等
愈伤组织增殖中等
NOP 萘氧丙酸
无愈伤组织形成 愈伤组织增殖中等愈伤组 愈伤组织增殖强 织增殖强
第五章 愈伤组织的培养
第一节 愈伤组织的诱导和分化 第二节 愈伤组织中的形态发生 第三节 人工种子
第二节 愈伤组织中的形态发生
3.4 体细胞胚状体诱导的影响因素
1)生长素 形成体细胞胚的关键是除去或降低培
养基中的生长素成分(如2,4-D)。 愈伤组织在生长素0.5~1mg/L的培养
植物愈伤组织培养

酶活力 增加
细胞的 大小变 化不大
第一节 植物愈伤组织及形成过程
二 植物愈伤组织的形成过程:
诱导期长短
植物种类
外植体生理状 况
外部因素
第一节 植物愈伤组织及形成过程
二 植物愈伤组织的形成过程:
分裂期:细胞通过一分为二的分裂,不断
增生子细胞
细胞分裂 快
结构疏松
缺少有组 织的结构
颜色浅而 透明
第一节 植物愈伤组织及形成过程
第6章 植物愈伤组织培养
•2024/8/27
愈伤组织:原是指植物受伤之后于伤口表面形成的一团薄
壁细胞,在组织培养中,则指在人工培养基上由外植体的增 生细胞产生的一团不定形、疏松的薄壁细胞。
第一节 植物愈伤组织及形成过程
增殖培 养基
连续有 丝分裂
分化组织中不 分裂的静止细
胞
细胞进入分裂 状态,变为分
养
体 获 取
的 芽
的 种 子
花 序
长 的 幼
胚
光培 诱 白不紧 保 分软软 下养 导 色透密 持 离而而
或皿 暗易 处于
到明的 浅的 黄
和
胚胶透 性质明
培 组状的
培观 养察
色 的
养
织的, ,,有
继常时
代带生
培根根
养
愈伤组织培养的应用
1、加快了园艺植物新品种和良种繁育速度; 2、培育无病毒苗木; 3、获得倍性不同的植株; 4、克服远缘杂交困难; 5、利于种质资源长期保存和远距离运输; 6、提供育种中间材料; 7、诱发和离体筛选突变体; 8、制造人工种子。
第一节 植物愈伤组织及形成过程
二 植物愈伤组织的形成过程:
诱导期(起动期)
愈伤组织培养

主要教学内容
愈伤组织的诱导与分化 愈伤组织的继代培养 愈伤组织的形态发生及调控 愈伤组织培养的应用
愈伤组织
一、愈伤组织的诱导与分化
愈伤组织,原是指植物受伤之后于伤口表面形成 的一团薄壁细胞,在组织培养中,则指外植体的 增生细胞产生的一团不规则、疏松的薄壁细胞。
一般情况下,植物组织均能诱发形成愈伤组织。 由外植体形成愈伤组织,标志着组织培养的开始。
复习思考题
1、愈伤组织形态发生的影响
?
因子有哪些?如何进行调节? 2、愈伤组织培养在植物育种 中的应用有哪几方面?
由于代谢产物的积累会产生毒害作用,如 果长时间不继代培养,就会使愈伤组织变 成黑褐色,继而死亡。
用继代培养维持愈伤组织生长,是长期保 存愈伤组织的一种方法。
一般来说,愈伤组织的增殖生长只发生在不与琼 脂接触的表面,而与琼脂接触的一面极少细胞增 殖,只是细胞分化形成紧密的组织块。因此,由 于愈伤组织的迅速增殖,整个愈伤组织小方块变 成了一个不规则的馒头状的组织块。
地,节省人力、物力,手续简便,易于远 距离运输,而且不受病虫害的侵袭,便于 交流的优点。
(3)提供育种中间材料 通过组织培养可获得不同性质的愈伤组
织,可为原生质分离、融合或遗传转化提 供优质材料。 (4)可诱导和筛选突变体
(5)制造人工种子 为某些濒危和珍贵物种的繁殖,提供一
种高效的手段。
(二)培养基
1.生长调节剂 细胞分裂素/生长素的比例是控 制芽和根形成的重要条件之一。细胞分裂素/生 长素比例高时有利于芽形成;而这一比例低时, 有利于根的形成。
2.无机营养元素 营养元素的缺失会导致愈伤 组织生长不良,如: 缺铁:细胞分裂停止; 缺氮:细胞过度生长,形成层组织减退。
第二章: 愈伤组织培养

一)、 愈伤组织形成
1 、器官的形成 一般愈伤组织开始分化时,由大小不等的细
胞开始逐渐形成大小均匀的细胞,保持相对稳定 状态。
在分化时,愈伤组织的表层和内部都可形成 分生中心。芽多发生在愈伤组织的表层,属外起 源。
根发生在组织的深处,与整体植株发生类似, 是内起源。
愈伤组织的外部形态也随分化而改变,一般 由疏松转向紧密。
• 无论在MS还是在H或B5培养基中,不附加激素2, 4-D均不能诱导 扁桃花药愈伤组织的形成,
• 扁桃花药在H+1.0mg/L 2,4-D的培养基上诱导率最高为47%;在 MS+1.0mg/L 2,4-D培养基上诱导率为67.0%;在B5+0.5~ 1.0mg/L2,4-D,出愈率都在84.0%以上,其中以2,4-D为0.5mg/L时, 出愈率高达100%.。说明在扁桃花药诱导过程中,最适基本培养 基是B5,最佳 2,4-D浓度为0.5mg/L。
分裂期:
外植体(explant)中已分 化的活细胞在外源激素的作 用下,外植体外层细胞出现 了分裂,由于外层细胞的迅 速分裂使得这些细胞的体积 缩小,逐渐回复到分生组织 状态,该时期细胞通过脱分 化的起动期而进入分裂,并 开始形成愈伤组织。
分裂期特征:
生理生化上分裂期的一个明显特征 是外层细胞进行分裂,而中间的细胞不 分裂。另外还有细胞数目增加,体积变 小;细胞核和核仁增到最大,RNA含量 达到最高等。
• 此时期的愈伤组织:细胞分裂快, 结构疏散,缺少组织的结构,颜色浅 而透明。
分裂期愈伤组织
形成期:
• 细胞分裂从分裂期的周缘细胞分 裂为主逐渐转向内部的组织细胞, 愈伤组织表层细胞分裂减缓或停 止,内部深层细胞分裂并形成像 维管束或类似于分生组织组成的 鸟巢状结构的次生组织。
《愈伤组织培养》课件

激素与生长调节剂
激素:植物激 素如生长素、 细胞分裂素等 对愈伤组织培 养有重要影响
生长调节剂:人 工合成的生长调 节剂如2,4-D、 NAA等可以促 进愈伤组织的形
成和生长
激素与生长调节 剂的相互作用: 激素和生长调节 剂共同作用,影 响愈伤组织的形
成和生长
激素与生长调节剂 的浓度:激素和生 长调节剂的浓度对 愈伤组织的形成和 生长有重要影响, 过高或过低都会影
主要应用于植物育 种、基因工程、植 物病理学等领域
愈伤组织培养可以 快速繁殖植物,提 高植物产量和质量
愈伤组织培养的原理
外植体:从植物体上切取下 来的组织或器官
植物细胞全能性:植物细胞 具有发育成完整植株的能力
培养基:提供植物细胞生长 所需的营养物质和环境条件
愈伤组织:植物细胞在培养 基上生长形成的无定形组织
愈伤组织培养的应用
植物育种:通过愈伤组织培养,可以快速繁殖优良品种,提高育种效率
植物基因工程:利用愈伤组织培养,可以方便地进行基因转化和基因编辑,实现 植物基因工程的目标
植物细胞工程:通过愈伤组织培养,可以实现植物细胞的融合和重组,为植物细 胞工程提供技术支持
植物生物反应器:利用愈伤组织培养,可以构建植物生物反应器,生产生物活性 物质,如药物、酶等
营养成分:包 括糖类、氨基 酸、维生素、
无机盐等
生长调节剂: 如生长素、细 胞分裂素、赤
霉素等
植物激素:如 生长素、细胞 分裂素、赤霉
素等
琼脂:作为培 养基的凝固剂
和支撑物
水:作为培养 基的溶剂和营 养物质的载体
培养基的pH 值:影响植物 细胞的生长和
分化
环境因素与培养条件
光照:光照强度和光照时间对愈伤组织的生长有重要影响 温度:温度过高或过低都会影响愈伤组织的生长 湿度:湿度过高或过低都会影响愈伤组织的生长 培养基:培养基的成分和浓度对愈伤组织的生长有重要影响
植物愈伤组织培养

03
植物愈伤组织培养的成功应用案例包括生产次生代谢产物、新品种的快速繁殖 、基因工程研究和重造植物等。
展望植物愈伤组织培养的发展趋势和应用前景
植物愈伤组织培养的发展趋势包括深 入研究其生理生化机制、优化培养条 件和寻找更高效的诱导和增殖方法。
随着生物技术的不断发展,植物愈伤 组织培养将与基因工程、细胞工程和 代谢工程等技术结合,实现更高效的 植物繁殖和次生代谢产物的生产。
基本培养基
指具有共性特点的基础培养基,如MS、1/2MS等。
特殊培养基
指在基本培养基上添加特殊成分或调整某些成分而形成的新型培养基,如B5、N6等。
优化培养基
指根据不同植物或不同生理阶段的特点,对外植体、激素、盐分等成分进行调整而形成的 培养基,如分化培养基、生根培养基等。
03
愈伤组织培养的产业化应用
植物激素与信号转导途径的研究
研究植物激素在愈伤组织形成和分化过程中的作用及其信号转导途径,解析激素调控网络 。
比较基因组学和功能基因组学研究
通过比较不同植物愈伤组织形成的基因表达模式,挖掘关键基因和调控网络,为改良植物 品种提供理论依据。
创新愈伤组织培养技术及其在植物生产中的运用
01
创新愈伤组织培养技术
05
结论与展望
总结植物愈伤组织培养的研究成果
01
植物愈伤组织培养是一种有效的植物繁殖方式,能够快速繁殖和保存植物种质 资源,同时还可以生产次生代谢产物和进行基因工程研究。
02
植物愈伤组织培养的研究已经取得了许多成果,包括建立高效的愈伤组织诱导 和增殖培养基、探索不同因素对愈伤组织诱导和增殖的影响、研究愈伤组织分 化成根和芽的规律和机制等。
植物愈伤组织培养在农业、林业、园 艺和中药等领域具有广泛的应用前景 ,未来将会有更多的应用案例和研究 成果出现。
愈伤组织培养步骤

愈伤组织培养步骤
愈伤组织培养是生物科学研究中的重要技术,它能够让细胞在体外环境下生长和分化。
以下是愈伤组织培养的详细步骤:
1、准备培养基:愈伤组织培养需要特殊的培养基,其中包含细胞生长所需的各种营养成分。
按照培养基的说明书进行配制,确保准确无误。
2、灭菌:在培养之前,所有的培养器具和培养基都需要经过高温高压灭菌,以确保无菌环境。
这是细胞生长的关键,因为任何污染都可能导致实验失败。
3、细胞分离:从植物中分离出细胞是培养愈伤组织的第一步。
通常采用酶解法,即用纤维素酶和果胶酶分解细胞壁,使细胞分离成单个。
这一步要特别小心,因为酶的作用会影响后续的细胞生长。
4、接种:将分离出的单个细胞接种到培养基上。
这一步骤需要使用显微操作技术,确保每个细胞都准确地放置在培养基上。
5、培养:将接种了细胞的的培养基放入恒温箱中,设定适宜的温度和湿度。
在培养期间,要定期检查细胞的生长情况,确保没有污染。
6、观察与记录:每天使用显微镜观察细胞的生长情况,记录生长速度、形态变化等数据。
这些数据对于后续的研究非常重要。
7、换液与传代:随着细胞的生长,营养物质会被消耗。
因此,需要定期更换新鲜的培养基,以保证细胞的正常生长。
当细胞数量足够多时,可以进行传代,即将一部分细胞重新接种到新的培养基上。
8、实验结束后的处理:实验结束后,对使用过的器具和培养基进行消毒处理,避免对环境造成污染。
以上是愈伤组织培养的基本步骤,但实际操作中可能还需要根据具体的实验需求进行调整。
在进行实验时,一定要注意遵守实验室规则,保证实验安全。
愈伤组织培养

(2)分裂期:
外植体的细胞一但经过诱导,细胞脱分化,其外层细胞开始 细胞分裂。
分生状态:细胞变小、细胞质稠密、液泡变小或无、核和核 仁变大并趋向细胞中央。 处于分裂期的愈伤组织的特片是:细胞分裂快, 结构疏松, 缺少组织结构,颜色浅而透明。 已具一定功能和结构的分化和成熟的细胞 回复到具分裂能 力的分生状态.细胞分裂的结果标志着脱分化的完成。
分裂期:起动后的细胞进行活跃的细胞分裂. 1.细胞的数目迅速增加(外层先开始旺盛分裂)。胡萝卜培养7天后,细胞数 可增加10倍。 2.每个细胞平均鲜重下降。这是由于细胞鲜重的增加不如细胞数目的增加快的 缘故。 3.细胞形态改变:体积小,成多边型,质浓,液泡小或无,如同根尖和茎尖的 分生组织细胞一样。 细胞的核和核仁增大到最大。 4.细胞中 RNA含量减少,而DNA含量保持不变。 5.随着细胞不断分裂和组织生长,组织的总干重、蛋白质和核酸含量大大增加, 新细胞壁的合成极快。 小愈伤颗粒
C 细胞的体积不再减小 愈伤组织分化时外植体细胞的大小发生十分明显的变化, 生长的愈伤组织的细胞平均大小不再减小,至此以后,保持 相对不变。 D 出现各种类型的细胞 如薄壁细胞,分生细胞,管胞,石细胞,纤维细胞,色素细 胞,毛状细胞以及细胞丝状体等。
E 出现一定的形态特征 生长旺盛的愈伤组织一般呈奶黄色或白色,有光泽,也有淡 绿或绿色,老化的愈伤组织多转变为黄色甚至褐色。
2、愈伤组织的继代
愈伤组织诱导并生长一段时期后, 必须转移到新鲜培养 基上培养,这个过程叫做继代培养(营养、水分的耗失和 代谢产物积累的毒害)。
• 合适时间:愈伤生长即将达到顶峰以前,这时处于旺盛分裂时,继代
后容易生长,继代间隔一般四周,继代后3-7天恢复生长,2-3周内旺
3-愈伤组织的培养

2.愈伤组织形态学和组织学
(1)愈伤组织的形态学
① 愈伤组织的生长 ② 愈伤组织的形态
(2)愈伤组织组织学
愈 伤 组 织 的 形 态
1.
愈 伤 组 织 形 态
愈 伤 组 织 的 颜 色
* 分生组织结节:又称拟分生组织
(meristemoid),指生长的愈伤组 织中出现的类似分生组织的细胞群, 即胚性细胞群。分生组织结节可分化 产生芽、根、胚状体。
分化有重要作用(特别是IAA)。 ② 蔗糖(1.5~:又称传代培养, 指由最初外植体上切下初代新 增殖的组织转入另一培养基继 续培养。按照类似方法外植体 可以进行连续多代继代培养。
继代培养
第二节
愈伤组织分化 与植株再生
器官发生与植株再生 影响器官分化的因素
2.组织分化表现为分生组织结 节和愈维管组织结节的形成。 3.器官分化出现芽原基与根原 基。通常,芽原基是外起源;而根 原基属内起源。芽原基与根原基在 发生时常具单极性。
愈 伤 组 织 根 发 生
不
定
根
发
生
脱分化
再分化
体细胞胚→ 发育为植株
外植体→愈伤→ 具根茎的两极器官 → 植株 器官分化→ 单极器官→ 先茎后根→ 植株
先根后茎→ 植株
外植体脱分化与再分化形成完整植株的途径
愈 伤 组 织 分 化 不 定 芽
当归愈伤组织分化培养
豆瓣菜愈伤组织转化与植株再生
愈
伤
组
织
分
化
二、影响器官分化的因素 1.培养材料 (1)遗传型(基因型)差异 (2)器官和组织类型 (3)个体发育年龄
2.培养基
激素对组织培养中器官的形成,起 着重要而明显的作用。
愈伤组织培养 -回复

愈伤组织培养-回复标题:愈伤组织培养:理论与实践一、引言愈伤组织培养是植物组织培养技术中的一个重要环节,它是指在无菌条件下,通过切割、磨碎或酶解等方式处理植物体的一部分,使其形成一种无定形、高度液泡化的、具有分生能力的细胞团,即愈伤组织。
愈伤组织培养在植物繁殖、基因工程、次生代谢产物生产等方面具有广泛应用。
二、愈伤组织的形成1. 初始阶段:当植物组织受到损伤后,周围的活细胞会启动防御反应,产生大量的酚类物质和蛋白酶,以防止病原微生物的入侵。
同时,这些细胞开始进行分裂和脱分化,形成愈伤组织的初始细胞。
2. 扩增阶段:随着细胞的不断分裂和生长,愈伤组织逐渐扩大。
在这个过程中,细胞会失去原有的形态和功能特性,转变为具有高度分生能力的未分化细胞。
3. 分化阶段:在适宜的培养条件下,愈伤组织可以通过调控某些内源性或外源性的信号分子,诱导其分化为特定类型的细胞或组织,如根、芽、叶等。
三、愈伤组织培养的步骤1. 植物材料的准备:选择健康、无病虫害的植物材料,通常采用幼嫩的茎尖、叶片、花瓣、种子等部位。
2. 材料的消毒:使用70的酒精和0.1的升汞溶液对植物材料进行表面消毒,以杀死表面的微生物。
3. 培养基的制备:根据不同的实验目的和植物种类,选择合适的培养基配方,一般包括基础培养基、激素、维生素、氨基酸、糖类等成分。
4. 材料的接种:将消毒后的植物材料切成小块,放入装有培养基的培养皿中,然后密封并在无菌条件下培养。
5. 培养条件的控制:愈伤组织的生长和分化受光照、温度、湿度、气体环境等多种因素的影响,需要根据实验需求进行精细调控。
6. 愈伤组织的观察和鉴定:定期观察愈伤组织的形态、颜色、质地等变化,并通过显微镜、生物化学、分子生物学等方法进行鉴定和分析。
四、愈伤组织培养的应用1. 植物繁殖:通过诱导愈伤组织分化为芽和根,可以实现无性繁殖和快速繁殖,提高种苗质量和生产效率。
2. 基因工程:愈伤组织具有容易转化和筛选的优点,可以作为基因转移和表达的载体,用于植物遗传改良和功能基因的研究。
愈伤组织培养
愈伤分化
第四节 愈伤组织的诱 导与分化
Callus
• Definition • Initiation • Origin • Callus establishment • Callus type
二、Initiation of callus 愈伤的 萌动
Wounding may result in callus formation at the cut/damaged ends of stems or roots. Callus formation has been observed in almost all groups of living plants.
一、培养基
培养基一般包括大量元素、微量元素和一种碳 水化合物,最常用的碳水化合物是蔗糖。
这样简单的培养基(基本培养基)只有很少几种植 物组织能够培养和维持下去,大多数组织需要 添加各种各样的附加物(完全培养基),如维 生素、氨基酸、糖醇,生长素、细胞分裂素、 赤霉素、螯合剂如EDTA、各种营养性的提取物
外植体细胞在完整植株中随着细胞的分化过程 而逐渐停止分裂,开始执行它们各自不同的功 能。外植体细胞一般处于静止状态,称为静止细 胞。
※特点:在诱导期,代谢活化了,细胞内 的合成代谢迅速进行,但是细胞 的大小仍然和外植体时一样, 没有多大改变。
大多数植物容易产生愈伤,
但许多植物趋向于细胞快速分裂
From most kinds of plants callus can be established relatively easy; in dicots, monocots, gymnosperms (裸子植物), ferns (蕨类) and mosses(苔藓). Tissues from many organs may have the potential to divide and proliferate on appropriate culture media, however, some tissues are more predisposed to rapid cell division than others.
愈伤组织培养

愈伤组织培养一、外植体的选择愈伤组织培养的第一步是选择适当的外植体。
外植体可以是植物的根、茎、叶、花、果实等任何部分,但必须具有分生能力。
通常,选择新鲜、健康的幼嫩组织作为外植体,因为这些组织分生能力强,容易诱导出愈伤组织。
同时,外植体的选择还必须考虑其遗传背景、生理状态以及是否容易进行消毒等。
二、愈伤组织的诱导外植体在适当的培养基和条件下,能够被诱导形成愈伤组织。
这个过程涉及到细胞的脱分化,即细胞从特定的组织类型转变成未分化的状态。
为了成功诱导出愈伤组织,需要使用含有足够营养物质和植物生长调节物质的特殊培养基。
例如,高浓度的生长素和细胞分裂素可以促进细胞分裂和组织形成。
三、愈伤组织的增殖诱导出的愈伤组织需要在适合的培养基中进一步增殖。
这个过程需要持续监控并调整培养基的成分,以确保愈伤组织能够快速、健康地生长。
同时,还需要控制培养条件,如温度、光照、湿度等,以提供最佳的生长环境。
四、细胞分化的诱导增殖后的愈伤组织可以进行进一步的分化。
这个过程可以通过改变培养基的成分或添加特定的生长调节物质来实现。
例如,某些激素可以诱导愈伤组织分化成特定的组织或器官。
五、遗传稳定性的维持为了保持愈伤组织的遗传稳定性,通常需要进行长期的培养和多代的筛选。
这个过程可以通过定期检查染色体数目和结构来实现,以确保细胞的遗传稳定性。
同时,通过定期进行克隆繁殖,可以进一步维持细胞的遗传稳定性。
六、培养基的选择与优化愈伤组织培养的成功与否,很大程度上取决于培养基的选择和优化。
培养基是愈伤组织获取营养的来源,必须含有细胞生长所需的各类营养物质,如碳源、氮源、维生素、矿物质等。
同时,还需要添加植物生长调节物质,如生长素、细胞分裂素等,以调节细胞的生长和分化。
对于不同的外植体和实验目的,可能需要选择不同的培养基。
例如,MS、N6、B5等都是常用的培养基配方。
此外,培养基的pH值、渗透压等也需要进行适当的调整。
为了优化培养基,通常需要进行一系列的试验和筛选,以找到最适合特定组织或细胞的培养基配方。
愈伤组织与组织培养

愈伤组织与组织培养
愈伤组织与组织培养是一种诊治外科创伤的特殊技术,又被称为“愈合系统性治疗”。
它是一种旨在促进创伤愈合的技术,以减轻对
病人术后恢复阶段带来的各种不佳影响,比如减少肿胀、减少纤维化、改善肌肉功能和减少运动康复期间的疼痛。
愈伤组织与组织培养的本质是将细胞的分子调节功能最大化,以
减少损伤因子的作用。
当细胞受到结构损伤或内部问题时,通常会导
致细胞代谢和功能受损,同时也会降低免疫力和自愈能力,甚至可能
会在伤口重叠。
因此,组织培养的目的是通过强制细胞重新分泌代谢,从而促进伤口的快速愈合。
愈伤组织与组织培养通常由三大步骤组成:细胞源收集、细胞活
化和细胞植入。
首先,需要从伤口处收集细胞样本,例如脂肪细胞或
血液细胞,以分析培养基的成分和避免潜在的感染病原体。
然后,上
述细胞样本需要进行活化处理,这有助于增强细胞的代谢过程和细胞
再生能力,以促进伤口愈合。
最后,细胞样本需要植入伤口,以提供
充足的氧合作用,加速伤口的愈合。
另外,还有几种特殊方法可以提升愈伤组织与组织培养的治疗效果,例如使用激素、可见光或激光来增强细胞活化;使用免疫疗法,
即将有剂量的免疫系统激素、血清因子注入伤口;使用局部药物,例
如抗炎药或抗感染药物,以改善伤口组织的形态和功能等。
总之,愈
伤组织与组织培养是一种有效的治疗创伤的方法,可以帮助病人减少
创伤带来的不良影响,从而实现快速愈合。
植物愈伤组织培养

针对不同植物,选择适宜的基因型和生理状态进 行愈伤组织培养,以提高成功率。
3
采取抗污染和抗褐化措施
在愈伤组织培养过程中,采取抗污染和抗褐化措 施,如定期更换培养基、添加抗氧化剂等。
加强愈伤组织培养研究的建议与展望
加强基础研究
深入研究植物愈伤组织培养的机理和调控机制,为实际应用提供 理论支持。
遗传改良
愈伤组织培养可用于植物的遗传改良,通过细胞工程和基 因工程技术将优良性状导入到其他植物中,培育出抗逆性 更强、产量更高、品质更优的新品种。
生物技术研究
愈伤组织培养是植物生物技术研究的重要基础,可以用于 研究植物生长发育规律、细胞分化与形态发生、基因表达 与调控等生物学问题。
愈伤组织培养的历史与发展
将已经形成的愈伤组织进行继代培养,通过不断 的切割和重新接种,实现愈伤组织的快速增殖。
悬浮培养法
将已经形成的愈伤组织进行悬浮培养,通过细胞 分裂和增殖,实现愈伤组织的快速增殖。
添加激素法
在培养基中添加适当的激素,如生长素和细胞分 裂素,促进愈伤组织的增殖。
愈伤组织的分化技术
器官分化法
将愈伤组织进行器官分化 培养,通过特定的培养条 件诱导产生根、茎、叶等 器官。
基的营养成分和激素水平也需要精确控制。
基因型和生理状态的影响
02
不同基因型和生理状态的植物在愈伤组织培养中的表现差异较
大,需要针对不同情况进行调整。
污染和褐化问题
03
愈伤组织培养过程中易出现污染和褐化现象,影响培养效果。
提高愈伤组织培养效率的方法与策略
1 2
优化培养条件
根据不同植物的特点,调整温度、光照、湿度等 环境条件,以及培养基的营养成分和激素水平。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•
第三节 愈伤组织形态的发生
愈伤组织培养物在某些条件下,可以再分
化产生不定芽或根的分生组织甚至是胚状
体,继之,由这些有结构的组织而发育成
苗或完整小植株。
一、愈伤组织通过再分化形成再生植株的 方式:主要有三种(1)先产生芽,后在茎的
外植体的细胞数目多,获得愈伤组织的机会也多。
如果目的仅在于得到愈伤组织,那末将茎的切
段、叶、根、花、果实或种子,或其中的某种 组织切成一片片或一块块放到培养基上就可以 了。
如果要定量地研究愈伤组织的发生,那末外植体
的大小必须一致,形状和组成也要基本相同。进 行这类研究常选用组织块较大的材料,例如胡萝 卜的贮藏根、马铃薯的块茎、菊芋、荷兰防风草
成的能力,因此表面积越大,产生分泌物数量也
越多,愈伤组织的得率也越高。
外植体的体积应尽可能小,从而得到较大数量的
外植体。外植体最小的限度由其亲本组织细胞的
平均大小来决定。细胞数目。
例如菊芋的细胞比胡萝卜根次生韧皮部的细胞 大三倍,一个3.8毫克的胡萝卜外植体大约包含
25,000个细胞,这样一个外植体是能够成活的。
• 理论上愈伤组织是可以无限制继代,但 愈伤组织继代次数增加,形态发生能力 逐渐丧失。 • 原因:遗传因素即继代培养中通常出现 染色体紊乱。
REASONS
遗传上表现不稳定:染色体出现多倍 体和非整倍体
• 四、培养条件
• 1、光照:愈伤组织的诱导需弱光或不需 光,分化需光。继代培养一般需光。此 时光对器官的作用是一种诱导反应。 • 2、温度:一般采用24~28℃的恒温条件 进行。 • 3、湿度:较大,以免引起培养基干缩。
有好几种化学试剂都能起到表面消毒的作
用,试剂的选择及处理时间的长短要根据 材料对试剂的敏感性来决定。
一般都采用在消毒后能很容易去除的药剂。 因为消毒剂对植物细胞也有杀伤作用,若
不去除就会妨碍愈伤组织的发生。 例如用无菌水反复冲洗后可以把大部分药 剂都洗掉,或者能自动分解变成低毒性物 质。
本氯酸钠能分解成为具有杀菌效能的氯气,然
等。这样才能得到足够数量的、无菌的、一致的、 适合于培养的外植体。
具体的操作过程: 无菌的块茎或块根,用钻孔器钻出一批同一类薄 壁组织圆柱形的组织,平行排列好。多把刀片等 距离地固定在一组金属片之间,一次切下去得到
许多个长短一致的圆柱形的外植体。
圆柱形大量地、准确地得到外形相同的外植体。 圆柱体的表面积大,利于组织块和外界气体和营 养物的交换。 外植体的损伤表面分泌物,具有促进愈伤组织形
裸子植物、蕨类和藓类植物也有诱发成功的例子。
2.材料必须完全无菌
微生物一旦与培养基接触,就迅速繁殖,抑制
愈伤组织的生长。
用抗菌素来抑制微生物的生长,在短时间有效, 而且抗菌素只能对一定谱系中的细菌才产生作 用,该谱系以外的微生物仍然可以大量繁殖。 抗菌素还可能抑制植物组织的生长。
得到无菌材料,植物组织必须先进行消毒。
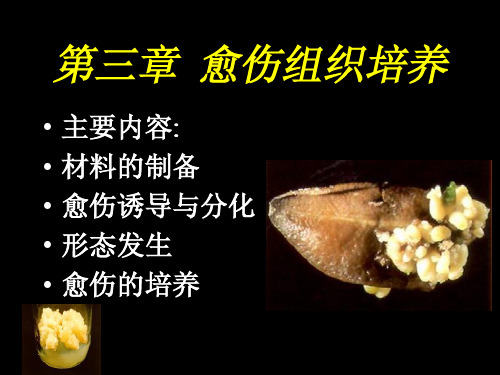
愈伤组织培养
• • • • • 主要内容: 材料的制备 愈伤诱导与分化 形态发生 愈伤的培养
第一节
植物材料(外植体)的制备
1.一般植物组织都能诱发愈伤组织。 : 诱导愈伤组织的成败关键主要不是实验材料,而
是培养条件,其中激素的成分和浓度是最重要的
因素。
双子叶植物为最多,单子叶植物(1990’s),此外,
而同样重量的菊芋外植体,由于细胞大而数目 少,在分离过程中造成损伤往往难以成活。必
须重量达到8毫克才包含约20,000个细胞,使
之易于成活。
第四节
一、培养基
愈伤组织的 培养
培养基一般包括大量元素、微量元素和一种碳 水化合物,最常用的碳水化合物是蔗糖。 这样简单的培养基(基本培养基)只有很少几种植 物组织能够培养和维持下去,大多数组织需要 添加各种各样的附加物(完全培养基),如维 生素、氨基酸、糖醇,生长素、细胞分裂素、 赤霉素、螯合剂如EDTA、各种营养性的提取物
到新的培养基上。
一般在25-28℃下进行固体培养时,每隔45周进行一次继代培养。
组织块较小时,继代培养时可将整块组织 转移。组织块较大时,可先将组织分成 几小块再接种。继代培养必须及时进行, 长期不传代常常由于代谢产物的累积, 对组织起毒害作用,某些植物愈伤组织 的褐化现象即往往由此引起的。褐化的 愈伤组织反复地进行继代培养,可使愈 伤组织恢复活力而迅速生长
后就散失到空气中。
低浓度的氯化汞是一种令人满意的消毒剂,只
是难以去除,故在消毒后必须用大量清水冲洗 材料。 在材料放入消毒剂之前,先在乙醇中漂洗一下, 可以使材料表面弄湿,从而使消毒剂易于渗入
并杀死微生物。
3.外植体的大小和形态
消毒后的植物材料,即可进行培养。
从外表均一的外植体长出的愈伤组织,在开始阶 段是相当一致的,而从茎、根等器官切段上长出 的则是一个混杂的愈伤组织。
烟草的愈伤组织。
• 注意:
• 激素的种类和用量的添加
•一般诱导愈伤常添加2.4-D
二、愈伤的培养方式: 培养分为固体和液体培养两大类。
液体培养又分静止和振荡培养的二类。
继代培养(传代):愈伤组织在培养基 上生长一段时间后,由于养分的枯竭,
水分的散失,组织代谢产物的积累,影
响愈伤组织生长,因此必须将组织转移
注意:选用完全已知的合成化合物,不大主张用 复杂的天然产物,如酵母提取物、番茄汁、椰子 汁等。 必须强调: 适合于诱发愈伤组织的培养基不一定适合于维持 这些愈伤组织;适合于液体培养的培养基也不一 定适合于固体培养。
培养基中的N,大多数都用硝态氮,只有MS培 养基和B5培养基中才用硝态和铵态的混合物。 K的水平在近代的培养基中有逐渐提高的趋势。 有趣的是,各种离子浓度大为不同的培养基往 往能使相同的组织快速生长。例如Hildebrandt 培养基与MS培养基显著不同,但二者都能培养
ห้องสมุดไป่ตู้
有些外植体外表上看来是由同一类细胞组成,例 如烟草的髓、胡萝卜的次生韧皮部、菊芋的块茎 等,这些细胞中DNA的含量有很大差别。这种差 别可能是由于细胞核中染色体数目的差别,即倍 性不同所造成的。
接种的外植体的大小和形状并不需要严格限制 不能太小,小于肉眼能见的限度时,细胞分裂可
能难以发生。故一般要求切块的大小要适当。
