第五章蛋白激酶
第5章 信号转导
Guanylate cyclase
乙酰胆碱
瓜氨酸
精氨酸 鸟苷酸环化酶
细胞信号转导的主要途径
一 G蛋白介导的细胞信号转导途径 二 酶耦联型受体介导的信号转导途径
三 离子通道偶联的受体介导的信号转导途径
四 核受体及其信号转导途径
一、G蛋白介导的细胞信 号转导途径
(一) 腺苷酸环化酶途径 (二)磷脂酰肌醇信号通路
信号应答。
第二信使的作用:
第二信使在细胞信号转导中起重要作用,它们 能够激活级联系统中酶的活性,以及非酶蛋白 的活性。 第二信使在细胞内的浓度受第一信使的调节, 它可以瞬间升高、且能快速降低,并由此调节 细胞内代谢系统的酶活性,控制细胞的生命活 动,包括:葡萄糖的摄取和利用、脂肪的储存 和移动以及细胞产物的分泌。 第二信使也控制着细胞的增殖、分化和生存, 并参与基因转录的调节。
盐皮质激素 性激素
无活性)
(位于胞浆,未与配体结合前与HSP结合存在, 受体 激活
与核内激素反应元件结合(HRE)
增强或抑制靶基因转录
HSP R
HSP
R
HSP
cell membrane
protein
R R
核转录因子
HRE
mRNA
A model of an intracellular receptor protein
钙调蛋白的结构
在不同的细胞中,Ca2+-钙调蛋白复合物可以同CaM-蛋白 激酶、cAMP磷酸二酯酶、以及质膜中的Ca2+运输蛋白结 合, 将它们激活,进行信号的放大
CaM-蛋白激 酶Ⅱ的激活
IP3、Ca2+—钙调蛋白激酶途径
α1肾上腺素能受体 内皮素受体 血管紧张素Ⅱ受体 与Gqα结合 PLCβ
第五章微生物的酶与代谢ppt课件
第二节 微生物的能量代谢
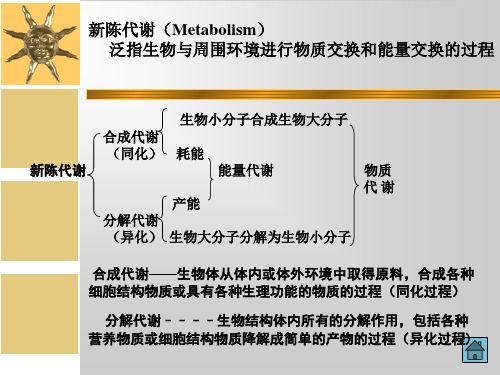
能量代谢––––微生物体内的能量转变过程 热力学第二定律 能量守恒 微生物的能量代谢是通过生物氧化反应来实现的 生物氧化–––微生物在细胞内酶作用下把营养物质氧化的过程
附窑睬胁淤豫穿般锑力恰炳应捧菏妥纱普清样掠跋铆祝应藏汉背厚丁吟帐第五章+微生物的酶与代谢第五章+微生物的酶与代谢
主要内容
微生物的酶 微生物的能量代谢 微生物的分解代谢
包熙候绵元赂吹迟俯瘸镑殷滴请浇辕咖颠希羹狐需疑西净汪雌珐歹伍横劫第五章+微生物的酶与代谢第五章+微生物的酶与代谢
第一节 微生物的酶
玫综闰惺查居亥巴卓肛斗具琶镇揽薯吻陈煌峨约戚艳演天穗革垢芽锤怔辨第五章+微生物的酶与代谢第五章+微生物的酶与代谢
3-磷酸甘油醛
(3-磷酸甘油醛脱氢酶)
1,3-二磷酸甘油酸
(磷酸甘油酸激酶)
3-磷酸甘油酸
(磷酸甘油酸变位酶)
2-磷酸甘油酸
烯醇式丙酮酸
磷酸烯醇式丙酮酸(PEP)
(丙酮酸激酶)
脱氢
氧化磷酸化
盒丹吃对虞它腾倾盈捉古句懂铺者射割惧付刽隐化烧仗溢射铱梭瞪御走谴第五章+微生物的酶与代谢第五章+微生物的酶与代谢
(1)在温和条件下进行(由酶催化) (2)反应步骤繁多,但相互配合、有条不紊、彼此协调,且逐步进行,表征了新陈代谢具有严格的顺序性 (3)对内外环境具有高度的调节功能和适应功能。
新陈代谢的特点
舍惊怔疫脚诉脸咕袁撩救锡蔓愈束昨黑镣馋麻霄碳矢茨剃慢霞亩阅牲馋灼第五章+微生物的酶与代谢第五章+微生物的酶与代谢
生物化学名词解释

第一章:蛋白质蛋白质的等电点:当蛋白质溶液处在某一pH值时,蛋白质解离成正、负离子的趋势和程度相等,即称为兼性离子或两性离子,净电荷为零,此时溶液的pH值称为该蛋白质的等电点。
蛋白质的一级结构:是指多肽链中氨基酸(残基)的排列的序列,若蛋白质分子中含有二硫键,一级结构也包括生成二硫键的半胱氨酸残基位置。
维持其稳定的化学键是-肽键。
蛋白质二级结构:是指多肽链中相邻氨基酸残基形成的局部肽链空间结构,是其主链原子的局部空间排布。
蛋白质二级结构形式:主要是周期性出现的有规则的α-螺旋、β-片层、β-转角和无规则卷曲等。
蛋白质的三级结构:是指整条多肽链中所有氨基酸残基,包括相距甚远的氨基酸残基主链和侧链所形成的全部分子结构。
因此有些在一级结构上相距甚远的氨基酸残基,经肽链折叠在空间结构上可以非常接近。
蛋白质的四级结构:是指各具独立三级结构多肽链再以各自特定形式接触排布后,结集所形成的蛋白质最高层次空间结构。
蛋白质的变性:在某些理化因素的作用下,蛋白质的空间结构受到破坏,从而导致其理化性质的改变和生物学活性的丧失,这种现象称为蛋白质的变性作用。
蛋白质变性的实质是空间结构的破坏。
蛋白质沉淀:蛋白质从溶液中聚集而析出的现象。
构象:指有机分子中,不改变共价键结构,仅单键周围的原子旋转所产生的原子的空间排布。
一种构象改变为另一种构象时,不涉及共价键的断裂和重新形成。
构象改变不会改变分子的光学活性。
结构域:指蛋白质多肽链在二级结构的基础上进一步卷曲折叠成几个相对独立的近似球形的组装体。
构型:指在立体异构体中不对称碳原子上相连的各原子或取代基团的空间排布。
构型的转变伴随着共价键的断裂和重新形成。
构形的改变往往使分子的光学活性发生变化。
生物活性肽:生物体内具有调节及保护作用的小分子肽。
模体:模体是具有特殊功能的超二级结构。
分子伴侣:分子伴侣是一类帮助新生多肽连正确折叠的蛋白质,参与蛋白质空间构想的正确形成。
蛋白质的变构效应:蛋白质变构效应指在某些代谢物或调节因子与蛋白质结合,其结构发生适应性改变的现象。
细胞通讯-参考答案

细胞通讯-参考答案第五章细胞通讯一、填空题1.细胞通讯的方式有(分泌化学信号进行的通讯)(间隙连接通讯)和(细胞接触通讯)2. G蛋白的α亚基上有三个活性位点,分别是(鸟苷结合位点),(GTP酶活性位点),和(ADP核糖基化位点)。
3. 动物细胞间通讯是是通过连接的主要方式是(间隙连接),植物细胞的通讯连接方式是通过(胞间连丝)。
4. 钙调蛋白是由148个氨基酸组成的肽,有(四)个钙结合位点。
5. NAP是了解较多的一类肽类激素,它可以降低血压。
这类信号的传递需要通过第二信使(cGMP )的放大作用,并产生两种效应:1)( 刺激肾分泌钠和水);2)(诱发血管内壁平滑肌松弛).6. 细胞识别作用引起三种反应:1)(内吞作用);2)(细胞粘着);3)(接触抑制).7. 根据参与信号传导的作用方式的不同,将受体分为三大类:1)(离子通道偶联受体);2)( G蛋白偶联受体);3)(酶关联受体)。
8. Gi是起抑制作用的G蛋白,作用方式是(Gi的α亚基与腺苷环化酶结合起抑制作用)。
9. Gs的α亚基和Gi的α亚基上都有细胞毒素ADP核糖基化位点,但结合的毒素是不同的,前者结合是(百日咳病毒),后者结合的是(霍乱毒素)。
10. 细胞外信号分子都有一个基本的功能:(与受体结合传递信息)。
11. 受体交叉是指(两种不同的受体除了与各自的配体结合外,还可以与对方的配体结合)。
12. 胞内受体一般有三个结构域:1)(与信号分子结合的C端结构域);2)(与DNA结合的中间结构域);3(活化基因转录的N 端结构域)。
13. 蛋白激酶C(PKC)有两个功能域:一个是(亲水生物催化活性中心),另一个是(疏水的膜结构域)。
14. 甘油二酯(DAG)可被(DAG激酶磷酸化成磷脂酸)而失去第二信使的作用,也可被(DAG激酶水解成单脂酰甘油)而失去第二信使的作用。
15. 从蛋白质结构看,蛋白激酶A是由(四个亚基)组成的,而蛋白激酶C是由(一条肽链)组成。
4测试

流入肠。这些酶的向后渗漏能引起自消化。您预计在胰腺腺泡细胞间通过何种连接阻止酶
的向后渗漏?
A.间隙连接 B.紧密连接 C.桥粒
D.黏着连接
4. 下列连接方式中,除( )外,都具有通讯的作用。
A.桥粒连接 B.间隙连接 C.胞间连丝
5. 植物细胞通讯连接的方式是(
)。
D.化学突触
A.间隙连接 B.桥粒连接 C.紧密连接 D.胞间连丝 6. 细胞内中间纤维通过( )连接方式,可将整个组织的细胞连成一个整体。
换。
4.(纤连蛋白以不溶的方式存在于血浆,以可溶的方式存在于细胞外基质。
5 间隙连接将一个细胞的细胞骨架与相邻细胞的细胞骨架连接起来或与胞外基质相连。
6 在电子显微镜下观察到的层粘连蛋白是一个对称的十字形结构。 7. 参与信号转导的受体都是膜蛋白。 8. 神经递质(neurotransmitter)是从神经末梢释放出来的小分子物质,是神经元与靶细胞的化学信
使,也可进行远距离通讯。 9. 来源于质膜的不同信号能通过细胞内不同信号途径间的相互作用而被整合。 10.乙酰胆碱对一个动物的不同细胞有不同的效应,而且它和不同细胞上的不同受体分子相结
合。 11. cAMP、cGMP、DAG、IP3都是细胞内第二信使,它们的产生都与G蛋白有关。 12.蛋白激酶C是一种Ca2+和脂依赖性的酶。 13. 胞外信号分子都是通过与膜受体结合来传递信息。 14.胞内受体一般处于受抑制状态,细胞内信号的作用是解除抑制。 15. IP3是PKC系统中的第二信使,它直接激活内质网上的钙泵,动员Ca2+的释放。 16. ras是一个癌基因。 17. 信号分子与受体的结合具有高度的特异性,并且不可逆。 18.钙调蛋白调节细胞内钙的浓度。 四.简答题
5细胞通讯 中山大学研究生入学考试细胞生物学真题各章节专项整理

C.DAG和Ca2+ D.DAG和磷脂
17.蛋白激酶C的激活依赖于(D)(99年)
A.IP3 B.DAG C.IP3+Ca2+; D.DAG+Ca2+.
18.下列关于信息分子的描述中,不正确的一项是(D)。(00年)
A.本身不介于催化反应 B.本身不具有酶的活柱,
8.在细胞信号传导系统中,根据蛋白激酶作用于靶蛋白的氨基酸残基的不同,分为型和型。(02年)
9.NO是一种气体信号分子,在体内主要由精氨酸产生,它的半衰期很短,故只作用于邻近细胞,它作用的靶酶是鸟苷酸环化酶。(03年)
10.NAPs 是了解得较多的一类肽类激素,它可以降低血压。这类信号的传递需要通过第二信
40.( )亲脂性信号分子的受体通常位于细胞核内.(01年)
41.( )胞内受体一般处于受抑制状态,细胞内信号分子的作用是解除抑制。(02年)
42.( )CTP 结合的A 亚基,游离的BY 复合物都能激活G 蛋白偶联受体下游的分子. (04年)
43.( )与细胞表面受体结合的信号分子与细胞内受体结合的信号分子没有根本的不同. (04年)
A.胆固激素在细胞内的作用是由整合膜蛋白介导的
B.它们对细胞的影响需要水溶性的细胞内信号
C.它们的效应是通过与水溶性受体蛋白结合介导的
D.它们是由氨基酸前体物合成的
E.它们的效应通常涉及细胞内其他一些酶的活性
32.ras 基因的突变通常伴随这癌症发现,这些ras 基因的突变:( )(04年)
A.可以发生在v-ras 和c-ras 中
A.IRS 的结合→具有SH2 区域的蛋白质的磷酸化→效应
B.与具有SH2 区域的蛋白质结合→IRS 的磷酸化→效应
《生物化学》-第五章 酶化学

—CH2—·O·:
H
底物中典 型的亲电 中心包括:
磷酰基
Cys-SH
—CH2—·S·:
H
脂酰基 糖基
His-咪唑基
—CH2—C=CH
HN N:
CH
(五)金属离子催化
金属离子作为酶的辅助因子起作用的方式:
1.与酶蛋白紧密结合稳定酶的天然构象,亲电催化 2.与酶结合较弱,作为激活剂存在。 3.通过价态的可逆变化,参与氧化还原反应。
其他成分的酶:
核酶(ribozyme) :具有催化活性的天然RNA。 近年还有DNA分子具有催化活性报道。
酶的概念: 酶是生物催化剂。由活细胞产生的具有高效催化能力 和催化专一性的蛋白质、核酸或其复合体。
脲酶:专一性水解尿素。
第一个被分离提取的酶,并证明其化学本质为蛋白质。 抗体酶:是用化学反应的过渡态类似物作免疫原产生 的催化性抗体,是一种具有催化能力的蛋白质,其本 质上是免疫球蛋白。
(6)对于结合酶,辅酶、辅基往往参与酶活中心的 组成。
第二节 酶催化作用的机制
一、酶与底物的结合——中间复合物学说
该学说认为,在酶促反应中,酶(E)总是先和底 物(S)结合生成不稳定的中间复合物(ES),再 分解成产物(P),并释放出酶(E)。 ——中间复合物学说能较好的解释酶为什么能降 低反应的活化能。
实际上,底物与酶结合是一种相互作用的过程, 底物可诱导蛋白质构象改变,蛋白质必需基团也可使 底物敏感键发生变化,更好“契合” 。 3.“三点附着”模型:该模型认为底物与酶活中心的 结合有三个结合位点,只有当这三个位点都匹配的时 候,酶才会催化相应的反应。
二、酶作用高效率机制
(一)底物与酶的邻近、定向效应
1)绝对专一性
细胞生物学填空复习题

第一章:细胞概述一、填空题:4誉为19世纪自然科学的三大发现:能量守恒定律,细胞学说,达尔文进化论6前发现最小最简单的原核细胞是:支原体7去细胞壁的植物、微生物细胞称作:原生质体9核生物与真生物最主要的差别是:前者具有:定形的核后者只有:拟核10由于发现了:核酶(ribozyme)有理由推测RNA是最早形成的遗传信息的一级载体。
11无论是真核细胞还是原核细胞,都具有以下共性:1、都有DNA 2、都有核糖体3、都是分裂法增殖4、都有细胞质膜21构成细胞最基本的要素是:1、基因组2、细胞质膜和完整的代谢系统。
23细胞是生命活动的基本单位,最早于1665 年被英国学者胡克发现。
细胞是由质膜包围着一团原生质所组成。
核膜与质膜之间的部分叫细胞质。
动物细胞和植物细胞在表面结构上主要差别是:植物细胞有细胞壁(动物细胞没有细胞壁)第二章:细胞生物学的研究方法1透射电子显微镜由镜筒、真空系统、电力系统三部分构成5物质在紫外光照射下发出的荧光可分为自发荧光和诱发荧光两种。
其中诱发荧光需要将被照射的物质进行染色。
6用紫外光为光源照射物体比用可见光的分辨率要高,这是因为紫外光波长比可见光波长短7通过突变或克隆化形成的细胞叫细胞珠11倒置显微镜与普通显微镜的不同在于其物镜和照明系统的位置颠倒12若用紫外光为光源,光学显微镜的最大分分辨率为0.1um ,透射电子显微镜的最大分别率为0.1nm ,扫描电镜的分辨率为3nm 。
13显微镜的分辨本领是指能够分辨出相邻两个点的能力,用最小分辨距离来表示16细胞培养的突出特点是:可在离体条件下观察和研究生命活动的规律。
19用细胞培养法来研究生命活动规律的局限性是体外环境下不能与体内的条件完全相同。
20 超薄切片染色常采用柠檬酸铅和醋酸双氧铀双染色法21免疫细胞化学技术是用来定位细胞中的抗原物质22电子显微镜使用的是电磁透镜,而光学显微镜使用的是玻璃透镜。
23电子染色是用重金属来增强电子的散射能力。
生物化学名词解释(下)

第五章 糖 代 谢1.糖异生:非糖物质(如丙酮酸乳酸甘油生糖氨基酸等)转变为葡萄糖的过程。
2.Q 酶:Q 酶是参与支链淀粉合成的酶。
功能是在直链淀粉分子上催化合成(α-1,6)糖苷键,形成支链淀粉。
3.乳酸循环乳:酸循环是指肌肉缺氧时产生大量乳酸,大部分经血液运到肝脏,通过糖异生作用肝糖原或葡萄糖补充血糖,血糖可再被肌肉利用,这样形成的循环称乳酸循环。
4.发酵:厌氧有机体把糖酵解生成NADH 中的氢交给丙酮酸脱羧后的产物乙醛,使之生成乙醇的过程称之为酒精发酵。
如果将氢交给病酮酸丙生成乳酸则叫乳酸发酵。
5.变构调节:变构调节是指某些调节物能与酶的调节部位结合使酶分子的构象发生改变,从而改变酶的活性,称酶的变构调节。
6.糖酵解途径:糖酵解途径指糖原或葡萄糖分子分解至生成丙酮酸的阶段,是体内糖代谢最主要途径。
7.糖的有氧氧化:糖的有氧氧化指葡萄糖或糖原在有氧条件下氧化成水和二氧化碳的过程。
是糖氧化的主要方式。
8.肝糖原分解:肝糖原分解指肝糖原分解为葡萄糖的过程。
9.磷酸戊糖途径:磷酸戊糖途径指机体某些组织(如肝、脂肪组织等)以6-磷酸葡萄糖为起始物在6-磷酸葡萄糖脱氢酶催化下形成6-磷酸葡萄糖酸进而代谢生成磷酸戊糖为中间代谢物的过程,又称为磷酸已糖旁路。
10.D-酶:一种糖苷转移酶,作用于α-1,4 糖苷键,将一个麦芽多糖的片段转移到葡萄糖、麦芽糖或其它多糖上。
11.糖核苷酸:单糖与核苷酸通过磷酸酯键结合的化合物,是双糖和多糖合成中单糖的活化形式与供体。
第六章 脂类代谢1.必需脂肪酸:为人体生长所必需但有不能自身合成,必须从事物中摄取的脂肪酸。
在脂肪中有三种脂肪酸是人体所必需的,即亚油酸,亚麻酸,花生四烯酸。
2.α-氧化:α-氧化作用是以具有3-18碳原子的游离脂肪酸作为底物,有分子氧间接参与,经脂肪酸过氧化物酶催化作用,由α碳原子开始氧化,氧化产物是D-α-羟脂肪酸或少一个碳原子的脂肪酸。
3. 脂肪酸的β-氧化:脂肪酸的β-氧化作用是脂肪酸在一系列酶的作用下,在α碳原子和β碳原子之间断裂,β碳原子氧化成羧基生成含2个碳原子的乙酰CoA 和比原来少2 个碳原子的脂肪酸。
生物物理 第五章2

膜脂分子(主要是磷脂分子)可以存在以下几种相 Nankai 结构: University 脂双层构象(Bilayers configuration) a. 液晶或流体相(Liquid-crystalline or fluid phase)(L-α) b. 固相或凝胶相(solid or gel phase)(L-β) 非脂双层构象(non-bilayers configuration) a. 六角形 HI (Hexagonal)相 (Hexagonal) b. 倒六角形HII(inverted Hexagonal)相 c. 立方体(II)相 d. 倒立方体(III)相 混合相(mixed phases) 例如在一些膜中,某 些区域可能是L- α脂双层构象,而另外的相结构可 能分散其间。
Nankai University
(1) 脂双层的不对称性
外层:glycolipids, phosphatidylcholine (PC) cholesterol 内层:phosphatidylserine (PS) phosphatidyl-ethanolamine (PE) phosphatidylinositol (PI) 糖脂仅存在于脂膜外侧小叶中。 这种不对称可能在内质网合成时已经开始了。 。
Nankai University
§5.4 生物膜的特性
膜的不对称性 膜的运动性 膜的相结构和相变 膜的通透性
Nankai University
临床免疫学检验-第五章-诊断酶学

(二)连续监测法测定酶活性
偶联反应中存在几个时相:
①预孵育期: ②延滞期: ③稳态期:
酶偶联法测定ALT的吸光度变化
米-曼氏方程
• Michaelis 和Menten提出的酶作用的中间产物学说
E+S
K1 K2
ES K3
E+P
1913年提出了著名的酶促反应速度与底物浓度关系 的
方程式,即米-曼氏方程(Michaelis-Menten equation):
酶 ALT AST ALP
ACP LD CK γ-GT
AMY LPS ChE#
方法 连续监测法 底物中含磷酸吡哆醛
底物中不含磷酸吡哆醛 连续监测法 底物中含磷酸吡哆醛
底物中不含磷酸吡哆醛 连续监测法(磷酸对硝基苯酚法)
比色法(磷酸麝香草酚法) 连续监测法 L→P,即LD-L法
P→L,即LD-P法 连续监测法(酶偶联法)
(三)干扰因素
1. 其他酶和物质的干扰 2. 酶的污染 3. 非酶反应 4. 分析容器的污染 5. 沉淀形成
(四)血清酶活性浓度测定的条件的优化
1.方法选择 尽可能采用连续监测法;尽量减少操作步骤。 2.仪器和设备 明确规定仪器和设备的各种性能规范。 3.试剂 化学试剂必须具有一定纯度;试验用水最好是纯水或双蒸水。 4.自动生化分析仪参数的设置
参考区间 男:≤45U/L;女:≤34U/L* 5~40U/L 男:≤35U/L;女:≤33U/L* 8~40U/L 1~12岁<500U/L; 男:12~15岁<750U/L,
>25岁40~150U/L; 女:>15岁40~150U/L 0.5~1.9U/L ≤252U/L* 200~380U/L 男:≤169U/L;女:≤143U/L*
第5章真核细胞内膜系统、蛋白质分选与膜泡运输

21
糖原分解与游离葡萄糖
释放
➢ 在肝细胞中,糖原裂解释放 葡萄糖-1-磷酸,然后再转变 成葡萄糖-6-磷酸,由于磷酸 化的葡萄糖不能通过细胞质 膜,光面内质网上的葡萄糖6-磷酸酶将葡萄糖-6-磷酸 水解为葡萄糖和磷酸后,葡 萄糖就可穿过细胞质膜进入 血液
光面内质网的功能
22
光面内质网的功能 解毒作用(detoxification)
27
粗面内质网的功能
新生多肽的折叠与装配
➢ 二硫键异构酶(protein disulfide isomerase ,PDI :ER 驻留蛋白)催化新合成的蛋白形成和改组二硫键,形成正 确的折叠状态。
➢ 分子伴侣BiP(Binding protein )识别错误折叠的蛋白或 未装配好的蛋白亚单位,并促进重新折叠与装配。
➢ 水解 ➢ 糖基化 ➢ 硫酸化:蛋白聚糖
膜循环:内质网上合成的脂质一部分转移至高尔基体 后,经过修饰和加工,形成运输泡,向细胞膜和溶酶 体膜等部位运输。
36
高尔基体的主要功 能是将内质网合成 的多种蛋白质进行 加工、分类与包装, 然后分门别类地运 送到细胞特定的部 位或分泌到细胞外。 (见第三节)
37
2、高尔基体的功能
O-连接的糖基化
➢ O-连接的糖基化在高尔基体中进行,糖的供体为核苷 糖(半乳糖或N-乙酰半乳糖胺)。将糖链转移到多肽 链的丝氨酸、苏氨酸或羟赖氨酸的羟基上。
➢ 不能正确折叠的畸形肽链或未装配成寡聚体的蛋白质亚单 位,不能进入高尔基体。这些多肽一旦被识别,便从内质 网腔转至细胞质基质(通过Sec61p复合体),被蛋白酶体 (proteasomes-protein-degrading machine)所降解。 (see next)
《药学分子生物学》第5章细胞信号转导基础

a
7
EGFR介导的信a 号转导过程
8
MAPK家族
ERK家族:调控细胞增殖与分化
JNK/SAPK家族:参与细胞对辐射、渗透压和温度变化的 应急反应,促进细胞修复
p38MAPK家族:介导炎症和细胞凋亡等应激反应
a
9
(2)其他RTK信号转导途径
PI3K/PKB途径: (Akt途径)
a
10
a
11
(二)酪氨酸激酶偶联受体介导的信号转导
4、形成SH2结合位点的空间结构, 与具有SH2结构域的下一级信号 分子结合;
5、信号逐级传递;
a
5
2、RTK信号转导途径
(1)Ras-MAPK级联反应信号转导途径
组成内容:
信号分子:生长因子、细胞因子等信号
RTK:催化型受体
Grb-2:衔接蛋白,与RTK的SH2结构域结合
SOS:富含脯氨酸,可与Grb-2SH3结合,
大多为单次跨膜糖蛋白;
胞外区N端一般由500-850个氨基酸残基组成,为配体结合 部位;
胞内区具有酪氨酸激酶结构域,位于C端,包括ATP结合区 和底物结合区。
a
3
受体酪氨酸蛋白激酶的分子结构
a
4
(2)RTK的活化
1、结合配体后,受体形成二聚体 或寡聚体;
2、受体膜内部分发生构象变化;
3、酪氨酸残基发生自体磷酸化;
➢受体量调节
受体减量调节
a
29
(2)信号蛋白直接参与负性调节
➢I-κB ➢iSmad
a
30
思考题
G蛋白偶联受体信号通路与酶偶联受体信号通路的 相互作用?
a
31
THANK YOU!
生物化学第五章 酶

第五章酶第一节概述一、酶的概念酶是由活性细胞产生的、具有高效催化能力和催化专一性的蛋白质,又叫生物催化剂。
酶(enzyme) 是由生物细胞合成的,以蛋白质为主要成分的生物催化剂。
不同生物体所含的酶在种类和数量上各有不同,这种差异决定了生物的代谢类型。
二、酶催化作用的特点1、酶与非生物催化剂的共性:1) 用量少、催化效率高。
2) 都能降低反应的活化能。
3) 能加快反应的速度,但不改变反应的平衡点。
4) 反应前后不发生质与量的变化。
2、酶作为生物催化剂的特性1) 催化效率极高(immense catalytic power )可用分子比(molecular ratio)来表示,即每摩尔的酶催化底物的摩尔数。
酶反应的速度比无催化剂高108-1020倍,比其他催化剂高107-1013倍酶作为催化剂比一般催化剂更显著地降低活化能,催化效率更高。
通常用酶的转换数(turnover number,TN,或催化常数K cat)来表示酶的催化效率。
它们是指在一定条件下,每秒钟每个酶分子转换底物的分子数,或每秒钟每微摩尔酶分子转换底物的微摩尔数。
Kcat:103~1062) 高度的专一性(highly specific )∶所谓酶的专一性是酶对反应物(底物)的选择性绝对专一性:一种酶只能作用于特定的底物。
发生特定的反应,对其他任何物质都没有作用。
相对专一性:有些酶的专一性较低,对具有相同化学键或成键基团的底物都具有催化性能。
立体异构专一性(光学专一性):几乎所有酶对立体异构物的作用都具有高度专一性。
内肽酶胃蛋白酶R1,R1:芳香族氨基酸及其他疏水氨基酸(NH2端及COOH端胰凝乳蛋白酶R1:芳香族氨基酸及其他疏水氨基酸(COOH端)弹性蛋白酶R2:丙氨酸,甘氨酸,丝氨酸等短脂肪链的氨基酸(COOH端胰蛋白酶R3:碱性氨基酸(COOH端)外肽酶羧肽酶A R m:芳香族氨基酸羧肽末端的肽键羧肽酶B Rm:碱性氨基酸羧肽末端的肽键氨肽酶氨肽末端的肽键二肽酶要求相邻两个氨基酸上的α-氨基和α-羧基同时存在3) 反应条件温和4) 酶的催化活性是受调节控制的5) 酶不稳定,容易失活2. 酶的分类(1) 氧化-还原酶Oxidoreductase氧化-还原酶催化氧化-还原反应。
第五章 物质的跨膜运输与信号传导

第五章物质的跨膜运输与信号传导填空题1.物质跨膜运输的主要途径是。
2.被动运输可以分为和两种方式。
3.协助扩散中需要特异的完成物质的跨膜转运,根据其转运特性,该蛋白又可以分为和两类。
4.主动运输按照能量来源可以分为。
5.协同运输在物质跨膜运输中属于类型。
6.协同运输根据物质运输方向于离子顺电化学梯度的转移方向的关系,可以分为7.在钠钾泵中,每消耗1分子的ATP可以转运个钠离子和个钾离子。
8.钠钾泵、钙泵都是多次跨膜蛋白,它们都具有酶活性。
9.真核细胞中,质子泵可以分为三种。
10.真核细胞中,大分子的跨膜运输是通过和来完成的。
11.根据胞吞泡的大小和胞吞物质,胞吞作用可以分为和两种。
12.胞饮泡的形成需要的一类蛋白质的辅助。
13.细胞的吞噬作用可以用特异性药物来阻断。
14.生物体内的化学信号分子一般可以分为两类,一是,一是。
15.细胞识别需要细胞表面的和细胞外的之间选择性的相互作用来完成。
16.具有跨膜信号传递功能的受体可以分为、和1.一般将细胞外的信号分子称为,将细胞内最早产生的信号分子称为。
2.受体一般至少包括两个结构域;。
3.由G蛋白介导的信号通路主要包括:。
4.有两种特异性药物可以调节G蛋白介导的信号通路,即可以使G蛋白α亚基持续活化,而则使G蛋白α亚基不能活化。
磷脂酰肌醇信使系统产生的两个第二信使是。
5.催化性受体主要分为。
6.Ras蛋白在RTK介导的信号通路中起着关键作用,具有,当结合时为活化状态,当结合时为失活状态。
7.Rho蛋白在膜表面整联蛋白介导的信号通路中起重要作用,当其结合时处于活化状态,当其结合时处于失活状态。
8.小分子物质通过脂双层膜的速度主要取决于。
9.协助扩散和主动运输的相同之处主要在于都,主要区别在于10.G蛋白的а亚基上有三个活性位点,分别是。
11.PKC有两个功能域,一个是,另一个是。
12.DAG可被而失去第二是信使的作用,另一个是。
13.EGF的信号接触是通过内吞作用进行的,即。
蛋白激酶的基本组成单位

蛋白激酶的基本组成单位
1.蛋白激酶本体:蛋白激酶是由几个蛋白质亚单位组成的复
合物,包括一个或多个催化亚单位(catalyticsubunit)和可能
存在的一些调节亚单位。
催化亚单位是蛋白激酶的主要功能部分,通过催化底物的磷酸化反应来启动细胞内的信号传导。
调
节亚单位能够改变催化亚单位的活性、稳定性或亚细胞定位,
从而影响蛋白激酶的功能。
2.受体:蛋白激酶要发挥作用,需要与适当的受体结合。
受
体通常是膜上的跨膜蛋白,能够感知细胞外的信号,并将信号
传递给蛋白激酶,从而激活或抑制其酶活性。
3.底物:蛋白激酶的酶活性主要表现在磷酸化底物上。
底物
是蛋白激酶直接作用的对象,通过磷酸化底物,蛋白激酶能够
改变底物的结构、活性或亚细胞定位,从而影响细胞信号传导。
4.辅助分子:蛋白激酶的活性和稳定性还可能受到一些辅助
分子的影响。
辅助分子可以与蛋白激酶相互作用,调节其在细
胞内的定位或活性状态。
第五章蛋白激酶

SH3 Domain
d)PH结构域
最初于一种血小板内PKC底物 pleckstrin中发现的结构域,称为 pleckstrin 同源 (pleckstrin homology, PH) 结构域。
GAP、PLC等含有PH结构域,后者可 同G蛋白及磷脂类分子PIP2、PIP3、IP3等 结合。
2+
• 佛波酯(TPA or PMA)是一种促癌剂, 其结构与DAG相似,可持续活化PKC,促 进细胞增殖。
乙酸豆蔻佛波
(3)钙/钙调素依赖性蛋白激酶(CaMK)
包括肌球蛋白轻链激酶(myosin light chain kinase,MLCK)、磷酸化酶 激酶、CaMKⅡ等。
(4)CMGC组蛋白激酶
a)SH1结构域
非受体型的PTK的催化区因与Src家 族催化结构域的一级结构高度同源,因此 称为Src同源结构域1( SH1 )。
大部分SH1区有一个自主磷酸化位点。
SH1有PTK活性。
b)SH2结构域
主要存在于多种胞质信号蛋白中。如 PIP2特异性PLC、PI3K的调节亚基(p85)、 Ras-GTP酶激活蛋白(GTPase activating protein,GAP)以及crk、abl和vav原癌基 因产物等。
(3)核内酪氨酸蛋白激酶
(1)非受体酪氨酸蛋白激酶(NRTK)
1)非受体酪氨酸蛋白激酶的重要结构域
有SH1(c-Src homology domain 1)、SH2、SH3、PH、PTB等。它们在激 酶的催化反应、酶定位、活性调节以及与 其他分子相互作用中起重要作用。
SH结构域是Src同源结构域的简称。
C组-非典型PKC (atypical PKC,aPKC): 和 / 。 活化不需要Ca2+和DAG。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PLC-1的PH domain与IP3结合
血影蛋白的PH domain与膜磷脂结合
e)PTB结构域
PTB结构也可识别一些含磷酸化酪氨 酸的模体。
Shc PTB Domain
非受体酪氨酸蛋白激酶重要结构域的特点:
• 一个信号分子可含有两种以上的结构域, 因此可同时与两种以上的其他信号分子结 合。
(一)蛋白激酶的结构
共同的结构特征:
• 保守的催化结构域/亚基
• 调节结构域/亚基
• 其他功能结构域
PKC
1. 催化结构域/亚基
催化核心含有12个高度保守的亚区。
功能: • 与蛋白质或多肽底物结合; • 与磷酸供体ATP/GTP结合; • 转移磷酸基到底物相应的氨基酸残基上。
2. 调节结构域/亚基
p p
ANK ANK ANK ANK
Kinase domain
Mig-2
RTK
paxillin
Integrins
ECM
Generously provided to the CMC by Cary Wu (Apr-03
(9)DNA依赖性蛋白激酶 DNA依赖性蛋白激酶(DNA-dependent protein kinaes,DNA-PK)可磷酸 化许多核蛋白,包括核受体、转录因子、 DNA拓扑异构酶和RNA聚合酶Ⅱ等。 DNA-PK可发生自主磷酸化,其催化 亚基和Ku蛋白都依赖于DNA和ATP而磷酸 化。
(2)受体酪氨酸蛋白激酶
PDGF一类的跨膜受体,可磷酸化靶蛋 白的酪氨酸,因此称为受体酪氨酸蛋白激 酶(receptor tyrosine kinase,RTK)。
1)受体酪氨酸激酶的自主磷酸化位点
常位于受体的羧基末端胞质域的非催 化区,或质膜与酪氨酸激酶结构域之间。 主要功能是与靶蛋白的SH2结构域结合, 激活靶蛋白。 靶蛋白与磷酸化位点的结合依赖于 pTyr附近的氨基酸组成及顺序。
第五章
蛋白激酶、蛋白磷酸酶 与信号转导
【目的要求】
1.掌握蛋白激酶的概念及其催化的蛋白质磷酸 化反应;丝氨酸/苏氨酸蛋白激酶的主要种类及 其激活剂;PKC的分类及其特点;酪氨酸蛋白 激酶的概念、分类及其重要的结构域;受体酪 氨酸蛋白激酶的概念;蛋白磷酸酶的概念及分 类。
【目的要求】
2.熟悉受体酪氨酸蛋白激酶的分类;双重特异 性蛋白激酶;蛋白激酶在信号转导中的作用; 丝氨酸/苏氨酸蛋白磷酸酶的生物学作用;酪氨 酸蛋白磷酸酶的分类及其在信号转导中的作用; 双重特异性蛋白磷酸酶。
NH HC CH2 O C OH NH HC CH2 O C O O P O O
(1)蛋白激酶A(protein kinase A,PKA)
即cAMP依赖性蛋白激酶。
全酶存在胞浆,被cAMP激活后,催化亚 基可① 调节代谢;②调节离子通道;③调 节其他信号转导途径的蛋白;④ 进入细胞 核调节基因表达。
Src激酶家族是一组膜结合蛋白,与 受体结合存在,当配体与受体结合后被激 活。
Src羧基端有一酪氨酸磷酸化位点 Tyr527,其磷酸化可与Src 自身的SH2结构 域结合。
Src 的SH3结构域能与分子内调节区和 激酶区交界部的脯氨酸残基结合。 这种结合可阻止底物与Src的结合,起 自身抑制作用。其磷酸化位点是激酶的负调 节点。
ห้องสมุดไป่ตู้
c)Syk/ZAP-70家族
包括Syk和T细胞受体链连接蛋白-70 (zeta chain-associated protein-70, ZAP-70 )。
二者可介导淋巴细胞抗原受体和某些 细胞因子受体的信号转导,在淋巴细胞的 分化、发育和活化中具有重要作用。
d)CSK家族
CSK (C terminal Src-family kinase) 家族中p50CSK含有SH1、SH2和SH3结构域, 能使Src的羧基端Tyr527磷酸化,从而抑制 Src的活性。
• 同一类结构域可存在于多种不同的信号分 子中。
• 本身均为非催化结构域。
2)非受体酪氨酸蛋白激酶的种类
分为11个家族,至少有30个成员。它 们介导多种生长因子受体、细胞因子受体、 淋巴细胞抗原受体以及黏附分子整合素的 信号转导。
a)Src激酶家族
Src是原癌基因c-Src的产物,参与抗 原受体、细胞因子受体和整合素介导的跨 膜信号转导。
C组-非典型PKC (atypical PKC,aPKC): 和 / 。 活化不需要Ca2+和DAG。
各亚型均由一条肽链组成,分为四个保 守区C1~C4和五个可变区V1~V5。 • 调节区:
C1是膜结合区,与佛波酯、DAG和PS结合 有关。 C2是Ca2+结合位点。
• 催化区:
C3是ATP结合位点。 C4是底物蛋白结合位点。
2. 酪氨酸蛋白激酶(PTK)
是一类催化ATP上 -磷酸基团转移到 蛋白酪氨酸残基酚羟基上的激酶,使多种底 物蛋白磷酸化,在细胞增殖、分化中起重要 作用。
NH HC CH2 O C OH NH HC CH2 O C O O P O O
分类:
(1)非受体酪氨酸蛋白激酶(NRTK)
(2)受体酪氨酸蛋白激酶(RTK)
(2)蛋白激酶C 即Ca 和磷脂依赖的蛋白激酶,受 Ca2+ 、DAG和PS激活。
2+
PKC有11种亚型:
A组-典型PKC (classical PKC,cPKC): 、Ⅰ、Ⅱ和 活化需要Ca2+ 、DAG和PS。
B组-新型PKC (new PKC,nPKC):、、 (L) 、、 和 。 活化不需要Ca2+。
一、 蛋白激酶
蛋白磷酸化是多种信号转导途径中 的重要环节,细胞内大部分重要的生命过 程都涉及蛋白磷酸化。
可逆的蛋白质磷酸化:
ATP 蛋白激酶 蛋白质 蛋白磷酸酶 Pi H2O 蛋白质 P ADP
蛋白激酶(protein kinase,PK):
是一类磷酸转移酶,其作用是将 ATP 的 - 磷酸基转移到底物特定的氨基 酸残基上,使蛋白质磷酸化, 发挥其生理 生化功能。
• •
脯氨酸依赖性激酶(proline depedent kinase,PDK) 酪蛋白激酶Ⅱ(casein kinase Ⅱ ,CK Ⅱ )家族
PDK: 细胞周期素依赖性蛋白激酶(cyclin depedent kinase,CDK)家族 丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)家族 糖原合成酶激酶3(glycogen synthetase kinase 3,GSK3) CDK样激酶(CDK-like kinase, CLK)家族
MAPK途径:
EGF途径
(5)蛋白激酶G
即cGMP依赖性蛋白激酶( cGMP – dependent protein kinase,PKG),以 cGMP 为变构剂,在脑和平滑肌中含量较 丰富。
(6)G蛋白偶联受体激酶
有肾上腺素受体蛋白激酶( adrenergic receptor kinase, -ARK)、 -ARK相关激酶和视紫红质激酶等。
PS DAG
Ca2+
ATP
PKC底物:
•
参与信号转导的底物,如表皮生长因子 受体、胰岛素受体、T细胞受体(TCR)、 Ras、GTP酶活化蛋白等;
参与代谢调控的底物,如膜上的通道和 泵; 调节基因表达的底物,如转录因子、翻 译因子、S6K、Raf激酶等。
• •
PKC分布:
•
广泛分布于各组织的胞质,以Ca 依赖 的形式从胞质中移位到细胞膜上,此过程 称之为转位。PKC转位是其活化的标志。
PINCH Nck-2
SH3 SH3
LIM4 LIM5
Actin Cytoskeleton CH-ILKBP/actopaxin parvins/affixin
N-ter
SH3
LIM3
Filamin
SH2
LIM2
CH1
N-ter
LIM1
ILK
PH
CH2
Migfilin
LIMS
FERM PH FERM
2+
• 佛波酯(TPA or PMA)是一种促癌剂, 其结构与DAG相似,可持续活化PKC,促 进细胞增殖。
乙酸豆蔻佛波
(3)钙/钙调素依赖性蛋白激酶(CaMK)
包括肌球蛋白轻链激酶(myosin light chain kinase,MLCK)、磷酸化酶 激酶、CaMKⅡ等。
(4)CMGC组蛋白激酶
e)Tec家族
包括Btk、Itk、Tec、Txk、Bmx等, 其成员有不同的组织表达。
f)黏附斑激酶
黏附斑激酶(focal adhesion kinase, FAK)在黏附分子整合素介导的细胞与细 胞外基质的黏附和信号转导中具有起始作 用。
整 合 素 结 构 模 型
Linear structure of FAK
(7)核糖体S6激酶(S6K)
包括S6KⅠ和S6KⅡ,能催化核糖体 S6蛋白磷酸化。
(8)整合素连接激酶
整合素连接激酶(intergrin-linked kinase,ILK)可直接磷酸化PKB/Akt, 其活性依赖PI3K。
PINCH, ILK domain structures & interacting partners
SH3 Domain
d)PH结构域
最初于一种血小板内PKC底物 pleckstrin中发现的结构域,称为 pleckstrin 同源 (pleckstrin homology, PH) 结构域。
GAP、PLC等含有PH结构域,后者可 同G蛋白及磷脂类分子PIP2、PIP3、IP3等 结合。
SH2能特异地识别磷酸化的酪氨酸残 基以及磷酸化残基的羧基端氨基酸序列并 与其相互结合。 SH2的主要功能是介导胞质内多种信 号蛋白的相互连接,形成蛋白异聚体复合 物,从而调节信号传递。
