同素异形体PPT
合集下载
碳的同素异形体ppt课件

arbon
同素异形体
• 同素异形体是指由同样的单一化学元素组成,但性质却
不相同的单质。同素异形体之间的性质差异主要表现在物 理性质上,化学性质上也有着活性的差异。
例: 物质名称
化学性质
着火点 外观
毒性
白磷 红磷
活泼 不活泼
40℃ 240℃
淡黄色 紫红色
有毒 无毒
返回
C-60(富勒烯)
C60分子具有芳香性,溶于苯呈酱红色。可用电阻加热石墨棒或电
弧法使石墨蒸发等方法制得。C60有润滑性,可能成为超级润滑剂。金 属掺杂的C60有超导性,是有发展前途的超导材料。C60还在半导体、 催化剂、蓄电池材料和药物等许多领域得到应用。C60分子可以和金属 结合,也可以和非金属负离子结合。富勒烯的成员还有C78、C82、 C84、C90、C96等也有管状等其他形状。
返回
总结
碳的同素异形体它们晶体结构和键型都不同。碳同素异形体系统
横跨完全极端且十分不同的范围。化学性质与物理性质均有差异,以熟 知的金刚石与石墨为例,金刚石每个碳原子与相邻的四个碳原子以共价 键连接,形成四面体结构。而石墨中,碳原子呈层状排列,每一层的碳
同原素子以异共形价键体连的接不形成同平性面六质边是形由。 微观结构的不同所决定的。
碳的同素异形体
·石墨 ·钻石(金刚石) ·C-60(富勒烯、足球烯) ·碳纳米管 ·蓝丝黛尔石 ·直链乙炔碳 ·[无定形碳(内部结构为石墨)]
自然界中C的存在形式主要为气态 和固态。碳同素异形体指的是元素 碳的同素异形体,即纯碳元素所能 构成的各种不同的分子结构。
碳纳米管
生活中的应用及明显区别
• 钻石及石墨
返回
金刚石
金刚石是最为坚固的一种碳结构,成空间网状结构,最终形成了一种
同素异形体
• 同素异形体是指由同样的单一化学元素组成,但性质却
不相同的单质。同素异形体之间的性质差异主要表现在物 理性质上,化学性质上也有着活性的差异。
例: 物质名称
化学性质
着火点 外观
毒性
白磷 红磷
活泼 不活泼
40℃ 240℃
淡黄色 紫红色
有毒 无毒
返回
C-60(富勒烯)
C60分子具有芳香性,溶于苯呈酱红色。可用电阻加热石墨棒或电
弧法使石墨蒸发等方法制得。C60有润滑性,可能成为超级润滑剂。金 属掺杂的C60有超导性,是有发展前途的超导材料。C60还在半导体、 催化剂、蓄电池材料和药物等许多领域得到应用。C60分子可以和金属 结合,也可以和非金属负离子结合。富勒烯的成员还有C78、C82、 C84、C90、C96等也有管状等其他形状。
返回
总结
碳的同素异形体它们晶体结构和键型都不同。碳同素异形体系统
横跨完全极端且十分不同的范围。化学性质与物理性质均有差异,以熟 知的金刚石与石墨为例,金刚石每个碳原子与相邻的四个碳原子以共价 键连接,形成四面体结构。而石墨中,碳原子呈层状排列,每一层的碳
同原素子以异共形价键体连的接不形成同平性面六质边是形由。 微观结构的不同所决定的。
碳的同素异形体
·石墨 ·钻石(金刚石) ·C-60(富勒烯、足球烯) ·碳纳米管 ·蓝丝黛尔石 ·直链乙炔碳 ·[无定形碳(内部结构为石墨)]
自然界中C的存在形式主要为气态 和固态。碳同素异形体指的是元素 碳的同素异形体,即纯碳元素所能 构成的各种不同的分子结构。
碳纳米管
生活中的应用及明显区别
• 钻石及石墨
返回
金刚石
金刚石是最为坚固的一种碳结构,成空间网状结构,最终形成了一种
同素异形体现象PPT课件

很高
石墨
深灰色不透明固体, 有滑腻感 最软的矿物之一 有优良的导电性
很高
外形 硬度 导电性
熔沸点
金刚石
问题探究
为何金刚石和石墨在性质方 面有很大的差异?
主要是由于碳原子成键 方式和排列方式的不同引起 的
金刚石的结构
石墨的结构
金刚石和石墨的结构区别
金刚石 排列方式 空间网状结 构 空间排列 层内排列 石墨
研究对象
常见实例 金刚石、石墨
1 1
2、下列各组中互为同位素的是(
素异形体的是( A ) A.O2和O3 B.11H和21H D.O2-和O
) ,互为同 B
C.H2O和H2O2
3、下列各组中属于同素异形体的是
A 金刚石与C60 B H和 D C NO与NO2 18 D16 O 与 8 8O
1.3.1同素异形现象
你知道吗
人类已发现的元素仅100多种,而这 些种类有限的元素却构成数千万种不同 的物质,你们知道这是为什么吗?
原因之一: 同素异形现象
世界上最大的宝石金刚石---库利南(Cullinan)
金刚石
石墨
金刚石和石墨的物理性质
物理性质
金刚石
无色透明 在自然界里硬度最大 不良导体
红磷
P
斜方硫
单斜硫
思考:
1、钠原子(Na)和钠离子(Na+)都是同一种元
素----钠元素形成的,它们是同素异形体吗? 2、Fe2O3和Fe3O4的组成元素完全相同,它 们是同素异型体吗? 3、12H与11H是同素异形体吗?
同素异形体与同位素的比较
同素异形体 定义 同位素 同一种元素形 质子数相同、中 成的不同单质 子数不同的原子 单质 原子 1H、2H、3H 35Cl、37Cl
化学课件-苏教版-化学必修2《同素异形现象和同分异构现象》(一)

(C )
A.CH3—CH2—CH3 和 CH3—CH2—CH2—CH3
B.NO 和 CO
C.CH3—CH2OH 和 CH3—O—CH3 D.红磷和白磷
解析 首先对比各组物质的分子式,只有 C 项中
分子式相同,CH3CH2OH 和 CH3OCH3 中原子排列 顺序不同,二者互为同分异构体。
7.下列说法正确的是
B.化学变化
C.氧化还原反应 D.分解反应
解析 红磷和白磷是不同的物质,二者之间的转化
属于化学变化;又因为它们都为单质,在转化过程
中没有化合价的变化,属于非氧化还原反应。
4.关于同分异构体的叙述正确的是
()
A.相对分子质量相同而结构不同的化合物互称为
同分异构体
B.化学式相同而结构不同的化合物互称为同分异
(C ) A.碳纳米管和 C60 都是单质 B.碳纳米管和金刚石互为同素异形体 C.碳纳米管和石墨的结构和性质都相同 D.碳纳米管也能在氧气中燃烧生成二氧化碳 解析 碳纳米管和 C60 都是碳的单质,互为同分异构 体,故它们的结构不同,性质也有差异。
9.下列各组物质属于同系物的是__________,属于 同分异构体的是____________,属于同素异形体的 是____________,属于同位素的是____________, 属于同一种物质的是_________________________ __________________________________________。
D.14C 与 12C 互为同位素 解析 14C 是碳元素的一种原子,与其他原子的性质
相同,A 项错误;14C 的中子数为 8,14N 的中子数为 7,
二者的中子数不同,B 项错误;14C 和 12C 的质子数
同素异形现象和同分异构现象PPT教学课件

=0.01mol碳原子,即
0.01×6.02×1023=6.02×1021个碳原子,B项错误;有机物通常
指含碳元素的化合物,而石墨烯是由碳原子构成的单质,C项
错误;石墨烯是由石墨剥离而成,即是石墨中的一层,碳原子
间以共价键结合,D项正确。 答案 D
互动训练1 下列叙述中,正确的是( ) A.由碳元素的单质组成的物质一定是纯净物 B.金刚石和石墨具有相似的化学性质 C.金刚石转化为石墨,有单质生成,该反应属于氧化还原 反应 D.C60是新发现的一种碳的化合物
特别提示 ①C60、C70等这种形式的单质碳,称为富勒 烯,这一类物质的分子组成可以表示为Cn(n为28到540之间的 整数值),在这些分子中,碳原子与另外三个碳原子形成两个 单键和一个双键。
②因为臭氧具有极强的氧化性,它在灭菌消毒品中名列榜 首,成就了它的四大功用:灭菌、氧化、脱色、除味。
3.同分异构体的特点 (1)分子式相同,相对分子质量相同。但相对分子质量相同的 化合物不一定是同分异构体,因为相对分子质量相同时分子式不 一定相同,如CO和乙烯(C2H4)的相对分子质量都是28,但由于它 们的分子式不相同,它们不是同分异构体。同分异构体的最简式 (分子组成中原子的最简整数比的表达式,如C4H10的最简式为 C2H5)相同,但最简式相同的化合物不一定是同分异构体,因为最 简式相同时分子式不一定相同,如乙烯和环己烷(C6H12)的最简式 都是CH2,但它们的分子式不相同,它们不是同分异构体。
2.同素异形体的特点 (1)组成元素相同,所属物质类型相同(单质),在相同条件 下燃烧所得产物也相同。如红磷和白磷在氧气中充分燃烧产物 都是五氧化二磷。
(2)性质不同主要是指物理性质不同,化学反应活性有差 异。性质不同的根本原因是原子的成键方式和排列方式或组成 不同。如:金刚石是空间网状结构,每个碳原子以共价键结合 4个碳原子,而石墨是层状结构,每个碳原子以共价键结合3个 碳原子,各层间碳原子是以分子间作用力结合。氧气和臭氧分 子分别由2个和3个氧原子组成,且氧原子的成键方式不同,O3 的氧化性比O2的强。
《同素异形体》课件

造成O3与O2的这些化学性质差别 的原因是什么?
阅读书上P19 资料卡里的内容
臭氧空洞扩大的危害
(1) 直接危害人体健康,象皮肤癌、白 内障、各种传染病患者会大幅度增加;
(2) 对生态环境和农林牧渔业造成破坏, 农产品减产、品质下降,渔业产量减 少,森林覆盖率减少等等。
你知道吗
归纳总结:
同素异形体之间,
11H、21H、31H; 3517Cl、3717Cl
实例2:氧元素的不同单质 ——臭氧和氧气
臭氧与氧气的物理性质对比
臭氧
氧气
色 鱼腥味的淡蓝色 无色无味气体, 态 气体,液态深蓝 液态淡蓝色,固 味 色,固态紫黑色 态雪花状淡蓝色
溶解度
大
小
熔点 沸点
-251℃ -112.4℃
-218℃ -183℃
阅读并思考:
1.O3具有极强的氧化性,如不活泼金属Ag、
H情 物g况 在等下 常在却温空被下气O遇或3较氧氧多化气的,中分OO再不子33如会易与组酒立被O精即氧成2、着化的、棉火,絮,而等从在易而通燃引常 发不可想象的火灾。分子结构不 2.O3相对于O2不稳定,常同温下能缓慢分解,
若加热或高温或催化剂时可迅速分解,而且 O3生成O2的反应为放热反应
纳米碳管结构模型
它是石墨中一层或若干层碳原子卷曲而成 的笼状“纤维”,内部是空的,外部直径只有 几到几十纳米,轻而结实。
用途:防弹背心,电子枪; 可做成地球-月球乘人的电梯。
碳元素形成的不同单质的结构图
金 刚 石
石 墨
足球烯
纳米碳管
你知道吗
• 1.钠原子(Na)和钠离子(Na+)都是同一 种元素----钠元素形成的,它们是同素 异形体吗?为什么?
阅读书上P19 资料卡里的内容
臭氧空洞扩大的危害
(1) 直接危害人体健康,象皮肤癌、白 内障、各种传染病患者会大幅度增加;
(2) 对生态环境和农林牧渔业造成破坏, 农产品减产、品质下降,渔业产量减 少,森林覆盖率减少等等。
你知道吗
归纳总结:
同素异形体之间,
11H、21H、31H; 3517Cl、3717Cl
实例2:氧元素的不同单质 ——臭氧和氧气
臭氧与氧气的物理性质对比
臭氧
氧气
色 鱼腥味的淡蓝色 无色无味气体, 态 气体,液态深蓝 液态淡蓝色,固 味 色,固态紫黑色 态雪花状淡蓝色
溶解度
大
小
熔点 沸点
-251℃ -112.4℃
-218℃ -183℃
阅读并思考:
1.O3具有极强的氧化性,如不活泼金属Ag、
H情 物g况 在等下 常在却温空被下气O遇或3较氧氧多化气的,中分OO再不子33如会易与组酒立被O精即氧成2、着化的、棉火,絮,而等从在易而通燃引常 发不可想象的火灾。分子结构不 2.O3相对于O2不稳定,常同温下能缓慢分解,
若加热或高温或催化剂时可迅速分解,而且 O3生成O2的反应为放热反应
纳米碳管结构模型
它是石墨中一层或若干层碳原子卷曲而成 的笼状“纤维”,内部是空的,外部直径只有 几到几十纳米,轻而结实。
用途:防弹背心,电子枪; 可做成地球-月球乘人的电梯。
碳元素形成的不同单质的结构图
金 刚 石
石 墨
足球烯
纳米碳管
你知道吗
• 1.钠原子(Na)和钠离子(Na+)都是同一 种元素----钠元素形成的,它们是同素 异形体吗?为什么?
同素异形体PPT课件

B.与氧气具有相同的化学性质 C.与氧气互为同素异形体 D.与同质量的氧气具有相同的 体积(同温同压下)
7、有关O3的说法中错误的是(
C)
(1)O3具有特殊臭味,因此被称为”臭氧” (2)臭氧可用于漂白和消毒作用 (3)O3比O2在相同条件下密度大,比O2易 溶于水 (4)O3比O2稳定,高温下不易分解 (5)空气中高压放电、高压电机、复印机 工作时都会有O3生成 (6)空气中O3含量越高越好 (7)NO和氟里昂会促使O3分解
D
5 、纳米碳管是一种由碳原子构成的直径为几 个纳米的空心管.下列说法错误的是( )
A.纳米碳管是一种新型的有机化合物
二氧化碳
A
B.纳米碳管材料如果完全燃烧,生成物是 C.纳米碳管材料管道多,表面积大,吸附能 力强
D.纳米碳管在常温下化学性质稳定.
6 、下列有关 8O2叙述正确的是(B )
18
A.与氧互为同位素
隔绝空气加热到260℃ 隔绝空气加热到416℃迅速冷却
白磷
小结:
1.同素异形现象: 同种元素形成多种不同 单质 的现象。
2.同素异形体:
同一种元素形成的不同单质 。
3、实例: 金刚石和石墨;O2和O3; 红磷和白磷等
小结:
4.同素异形体的特征:
a.化学性质基本相同 (由同种元素组成的单质) b.物理性质不同 (空间结构不同) c.同素异形体之间可以相互转化
专题1.微观结构与物质的多样性
单元.从微观结构看物质的多样性
从微观结构
看物质的多样性
同素异形现象
实例1:碳元素的不同单质
金刚石
石墨
金刚石与石墨的比较
金刚石 硬 度 导电性 用 途 石 墨
大 不导电
7、有关O3的说法中错误的是(
C)
(1)O3具有特殊臭味,因此被称为”臭氧” (2)臭氧可用于漂白和消毒作用 (3)O3比O2在相同条件下密度大,比O2易 溶于水 (4)O3比O2稳定,高温下不易分解 (5)空气中高压放电、高压电机、复印机 工作时都会有O3生成 (6)空气中O3含量越高越好 (7)NO和氟里昂会促使O3分解
D
5 、纳米碳管是一种由碳原子构成的直径为几 个纳米的空心管.下列说法错误的是( )
A.纳米碳管是一种新型的有机化合物
二氧化碳
A
B.纳米碳管材料如果完全燃烧,生成物是 C.纳米碳管材料管道多,表面积大,吸附能 力强
D.纳米碳管在常温下化学性质稳定.
6 、下列有关 8O2叙述正确的是(B )
18
A.与氧互为同位素
隔绝空气加热到260℃ 隔绝空气加热到416℃迅速冷却
白磷
小结:
1.同素异形现象: 同种元素形成多种不同 单质 的现象。
2.同素异形体:
同一种元素形成的不同单质 。
3、实例: 金刚石和石墨;O2和O3; 红磷和白磷等
小结:
4.同素异形体的特征:
a.化学性质基本相同 (由同种元素组成的单质) b.物理性质不同 (空间结构不同) c.同素异形体之间可以相互转化
专题1.微观结构与物质的多样性
单元.从微观结构看物质的多样性
从微观结构
看物质的多样性
同素异形现象
实例1:碳元素的不同单质
金刚石
石墨
金刚石与石墨的比较
金刚石 硬 度 导电性 用 途 石 墨
大 不导电
化学课件《同素异形体》优秀ppt3 苏教版

94.对一个适度工作的人而言,快乐来自于工作,有如花朵结果前拥有彩色的花瓣。――[约翰·拉斯金] 95.没有比时间更容易浪费的,同时没有比时间更珍贵的了,因为没有时间我们几乎无法做任何事。――[威廉·班] 96.人生真正的欢欣,就是在于你自认正在为一个伟大目标运用自己;而不是源于独自发光.自私渺小的忧烦躯壳,只知抱怨世界无法带给你快乐。――[萧伯纳]
自1970年代以来,大气层臭氧浓度逐年减 少的问题就开始受到世界各国科学家的关注。 1985年,英国科学家首次在《自然》杂志 上报道了在南极上空发现的臭氧层空洞现象, 引起了全球的极大震动和担忧。
磷的同素异形体
白磷和红磷
一个白磷分子中有 6 个 共价键,有 6 对共用电
子对,白磷的分子式
为 P4 .
同素异形体
碳的同素异形体
金刚石 石墨 足球烯 纳米碳管
金刚石是典型的原子晶体,在这种晶体中的基 本结构粒子是碳原子。每个碳原子与四个碳原 子形成共价单键,构成金刚石的基本单元为正 四面体。每个碳原子位于正四面体的中心,周 围四个碳原子位于四个顶点上,在空间构成连 续的、坚固的骨架结构。因此,可以把整个晶 体看成一个巨大的分子。使得晶体中没有自由 电子,所以金刚石是自然界中最坚硬的固体, 熔点高达3 550 ℃,并且不导电。
√ √ D. O2 和 O3 E. 金刚石和石墨
氧的同素异形体
3O2=放电 2O3
臭氧在1849年首次被人类发现,臭氧(O3) 是氧气(O2)的一种异形体,在大气中的含量仅 占一亿分之一,其浓度因海拔高度而异。臭氧层
可以说是地球的保护层,它主要围绕在地球外部 离地面15—50Km大气平流层中,起到吸收太阳 紫外线中对生物有害部分UV-B(UV-B是紫外 线的一段波长,为280—315nm)的作用。同时, 由于紫外线是平流层的热能来源,臭氧分子是平
自1970年代以来,大气层臭氧浓度逐年减 少的问题就开始受到世界各国科学家的关注。 1985年,英国科学家首次在《自然》杂志 上报道了在南极上空发现的臭氧层空洞现象, 引起了全球的极大震动和担忧。
磷的同素异形体
白磷和红磷
一个白磷分子中有 6 个 共价键,有 6 对共用电
子对,白磷的分子式
为 P4 .
同素异形体
碳的同素异形体
金刚石 石墨 足球烯 纳米碳管
金刚石是典型的原子晶体,在这种晶体中的基 本结构粒子是碳原子。每个碳原子与四个碳原 子形成共价单键,构成金刚石的基本单元为正 四面体。每个碳原子位于正四面体的中心,周 围四个碳原子位于四个顶点上,在空间构成连 续的、坚固的骨架结构。因此,可以把整个晶 体看成一个巨大的分子。使得晶体中没有自由 电子,所以金刚石是自然界中最坚硬的固体, 熔点高达3 550 ℃,并且不导电。
√ √ D. O2 和 O3 E. 金刚石和石墨
氧的同素异形体
3O2=放电 2O3
臭氧在1849年首次被人类发现,臭氧(O3) 是氧气(O2)的一种异形体,在大气中的含量仅 占一亿分之一,其浓度因海拔高度而异。臭氧层
可以说是地球的保护层,它主要围绕在地球外部 离地面15—50Km大气平流层中,起到吸收太阳 紫外线中对生物有害部分UV-B(UV-B是紫外 线的一段波长,为280—315nm)的作用。同时, 由于紫外线是平流层的热能来源,臭氧分子是平
苏教版高中化学必修二 1.3.1 同素异形体和同分异构体 课件 (共23张PPT)

同;②相对分子质量相 子 结构
CH3OCH3;正
同的物质不一定是同分 丁烷与异丁
构物 式
异构体,如HCOOH和 烷
体
CH3CH2OH
运用拓展 下列物质中互为同分异构体的有_⑤_与_⑧__或__⑫_,
互 为 同 素 异 形 体 的 有 _③_ 与⑩__ , 互 为 同 位 素 的 有
___⑨_与__⑪__,是同一物质的有__①_和__④___。
象同
注意点
实例
①由于结构不同,化
同 元
学性质也有差异,如 C60、C70
素
、金刚
单素
白磷比红磷活泼;
异
结构
石、石
质种 形
类
②H2、D2、T2的关系 不是同素异形体,也
墨;O2
体
不是同位素
、O3
课堂小结
对相 相异
象同
注意点
实例
①因分子式相同,故组
同
分化 分
成和相对分子质量也相 CH3CH2OH与
异
合
(从研究对象、异同点、注意点、实例角度)
对相相 象同异
注意点
实例
①由于存在同位素,原
子的种类比元素的种类
同 位 素
原 子
质 子 数
中 子 数
多;②同位素的化学性 质几乎相同;③天然存 在的某种元素中,不论 是游离态还是化合态,
16O、17O 、18O;H 、D、T
各种同位素原子的含量
不变
课堂小结
对相 相异
1.同分异构现象
化合物具有相同的分子式,不同结构的现象。
2.同分异构体
(1)概念: 分子式相同而结构不同的化合物互称同分异构体。
人教版高中化学必修2课件 同位素及同素异形体

12 A. 6 C 14 和 6C
下列物质中,互为同素异形体的是( )
)
B.金刚石和石墨 D.硫酸和亚硫酸
C. NO 和 NO2
答案 B
干燥仪器
⑶在天然存在的某种元素里,不论是游离态还是 化合态,各种同位素的原子个数百分比(丰度)一 般为定值。
同位素及同素异形体
⑷ 同种元素的不同的同位素原子也可组成不同的单质 或化合物的分子。 如: 氢: 氕、 氘、 氚 氢 重氢 超重氢 元素符号: H H H 3H 原子符号: 11H 12H 1 H D T
同位素及同素异形体
对比同素异形体和同位素
同位素指质子数相同、中子数不同的同一元素的不同原子。
强调是原子间的互称,如
1 2 1H、 1H
、 31H 。
同素异形体是由同一种元素形成的几种性质不同的单质。
强调是特定物质 和石墨等。 单质间的互称,如O2和O3, 金刚石
同位素及同素异形体
练习
1.下列物质中,互为同素异形体的是 (
单质: H2、 D2 、 T2、H-D、H-T、D-T 与氧化合成水:H2O、D2O、T2O、HDO、DTO、HTO
22 , 这些水分子的最大式量_____ 18 ,共有___ 5 种式量。 最小式量_____
同位素及同素异形体
例如:氢元素的三种原子
氕 H
氘 D 重氢
氚 T 超重氢
同位素及同素异形子数 中子数 和简称 H H
1 1 1
0
氕(H) 氘(D) 氚(T)
1 2
H
同位素及同素异形体
这三种微粒是同一种原子吗?是同一种元素吗? 可见它们是氢元素的三种不同原子,把这三种 原子叫核素.把这三种原子互称为同位素.
下列物质中,互为同素异形体的是( )
)
B.金刚石和石墨 D.硫酸和亚硫酸
C. NO 和 NO2
答案 B
干燥仪器
⑶在天然存在的某种元素里,不论是游离态还是 化合态,各种同位素的原子个数百分比(丰度)一 般为定值。
同位素及同素异形体
⑷ 同种元素的不同的同位素原子也可组成不同的单质 或化合物的分子。 如: 氢: 氕、 氘、 氚 氢 重氢 超重氢 元素符号: H H H 3H 原子符号: 11H 12H 1 H D T
同位素及同素异形体
对比同素异形体和同位素
同位素指质子数相同、中子数不同的同一元素的不同原子。
强调是原子间的互称,如
1 2 1H、 1H
、 31H 。
同素异形体是由同一种元素形成的几种性质不同的单质。
强调是特定物质 和石墨等。 单质间的互称,如O2和O3, 金刚石
同位素及同素异形体
练习
1.下列物质中,互为同素异形体的是 (
单质: H2、 D2 、 T2、H-D、H-T、D-T 与氧化合成水:H2O、D2O、T2O、HDO、DTO、HTO
22 , 这些水分子的最大式量_____ 18 ,共有___ 5 种式量。 最小式量_____
同位素及同素异形体
例如:氢元素的三种原子
氕 H
氘 D 重氢
氚 T 超重氢
同位素及同素异形子数 中子数 和简称 H H
1 1 1
0
氕(H) 氘(D) 氚(T)
1 2
H
同位素及同素异形体
这三种微粒是同一种原子吗?是同一种元素吗? 可见它们是氢元素的三种不同原子,把这三种 原子叫核素.把这三种原子互称为同位素.
《同素异形体》课件5

11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰
15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东
足球烯——C60
• C60是由60个 碳原子形成 的封闭笼状 分子,形似 足球,人们 称之为“足 球烯”。
碳的其他几种单质
知道吗??
• 在常见元素中,哪些元素也 存在同素异形现象?
• 1、O元素 • 2、P元素 • 3、S元素
氧气在放电或紫外线照射下能 转化为臭氧(O3)。
打雷闪电时,有少量臭氧生成。 3O2 放电 2O3
白磷和红磷
• 磷元素可以形成 多种单质,白磷、 红磷是其中的两 种。在常温下, 白磷是蜡状固体, 有剧毒。白磷在 空气中能自燃, 应保存在冷水中。
白磷和红磷
• 常温下,红磷是 红棕色固体,在 空气中能稳定存 在,在加热或点 燃时也能在空气 中燃烧。
白磷和红磷
白磷和红磷完全燃烧都生成五氧化二磷(P2O5)。 P+O2 点燃 P2O5
同素异形体
金刚石-
• 晶体无色透明, 有光泽,十分坚 硬,可做装饰品, -可用于切割玻璃、 花岗岩,-可做地 质和石油勘探的 砖头等导 电,可做润滑剂 和电极等。-
成分 色态 光泽 硬度 熔点 密度 传热 导电 溶解性 用途
金刚石
石墨
游离态碳
游离态碳
无色透明固体
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东
足球烯——C60
• C60是由60个 碳原子形成 的封闭笼状 分子,形似 足球,人们 称之为“足 球烯”。
碳的其他几种单质
知道吗??
• 在常见元素中,哪些元素也 存在同素异形现象?
• 1、O元素 • 2、P元素 • 3、S元素
氧气在放电或紫外线照射下能 转化为臭氧(O3)。
打雷闪电时,有少量臭氧生成。 3O2 放电 2O3
白磷和红磷
• 磷元素可以形成 多种单质,白磷、 红磷是其中的两 种。在常温下, 白磷是蜡状固体, 有剧毒。白磷在 空气中能自燃, 应保存在冷水中。
白磷和红磷
• 常温下,红磷是 红棕色固体,在 空气中能稳定存 在,在加热或点 燃时也能在空气 中燃烧。
白磷和红磷
白磷和红磷完全燃烧都生成五氧化二磷(P2O5)。 P+O2 点燃 P2O5
同素异形体
金刚石-
• 晶体无色透明, 有光泽,十分坚 硬,可做装饰品, -可用于切割玻璃、 花岗岩,-可做地 质和石油勘探的 砖头等导 电,可做润滑剂 和电极等。-
成分 色态 光泽 硬度 熔点 密度 传热 导电 溶解性 用途
金刚石
石墨
游离态碳
游离态碳
无色透明固体
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
元素、核素、同位素、同素异形体之间的区别ppt课件
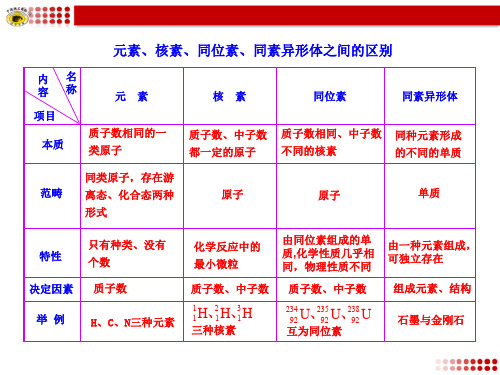
元素、核素、同位素、同素异形体之间的区别
内名 容称
元素
项目 本质
质子数相同的一 类原子
核素
同位素
同素异形体
质子数、中子数 质子数相同、中子数 同种元素形成
都一定的原子 不同的核素
的不同的单质
范畴
同类原子,存在游 离态、化合态两种 形式
ห้องสมุดไป่ตู้原子
原子
单质
特性 决定因素
举例
只有种类、没有 个数 质子数
H、C、N三种元素
化学反应中的 最小微粒
由同位素组成的单 由一种元素组成, 质,化学性质几乎相 可独立存在 同,物理性质不同
质子数、中子数 质子数、中子数 组成元素、结构
1 1
H、21 H、31 H
三种核素
234 92
U、29325
U、29328
U
互为同位素
石墨与金刚石
内名 容称
元素
项目 本质
质子数相同的一 类原子
核素
同位素
同素异形体
质子数、中子数 质子数相同、中子数 同种元素形成
都一定的原子 不同的核素
的不同的单质
范畴
同类原子,存在游 离态、化合态两种 形式
ห้องสมุดไป่ตู้原子
原子
单质
特性 决定因素
举例
只有种类、没有 个数 质子数
H、C、N三种元素
化学反应中的 最小微粒
由同位素组成的单 由一种元素组成, 质,化学性质几乎相 可独立存在 同,物理性质不同
质子数、中子数 质子数、中子数 组成元素、结构
1 1
H、21 H、31 H
三种核素
234 92
U、29325
U、29328
U
互为同位素
石墨与金刚石
苏教版高中化学必修二 1.3.1 同素异形体和同分异构体 课件 (共25张PPT)

相同点 同一种元素 分子式相同 质子数相同
不同点 结构不同 结构不同 中子数不同
研究对象 单质
化合物
原子
1、O2和O3
1、C4H10
11H、12H、13H
2、金刚石、石 正丁烷 异丁烷
墨、富勒烯
2、C2H6O
3、红磷、白磷 乙醇、二甲醚
• 有下列各组物质: A、 163C与162C
B、金刚石与石墨 D、 CH3
C4H10 可能的结构模型
HHHH HCC CCH
HHHH
正丁烷
HHH
HCC CH HH HCH H 异丁烷
共同点:
不同点:
分子式相同 结构不同
同分 异构
二、同分异构现象
化合物具有相同的分子式,但具有不 同结构的现象。
同分异构体
具有相同的分子式,但具有不同结构 的的化合物
同分异构体间的物理性质差异
物质 熔点/℃ 沸点/℃ 液态密度/g·cm-3 结论:
正丁烷
-138.4 -0.5
0.5788
异丁烷
-159.6 -11.7 0.557
C2H6O
分子式
球棍模型
C2H6O
结构式
名称 沸点
乙醇 78 ℃
C2H6O
二甲醚 -23℃
比较 同素异形体、同分异构体、同位素 三个概念
同素异形体 同分异构体 同位素
B.CO2和H2O D.CCl4和KCl
( B)
4.氮化硅(Si3N4)是一种新型的耐高温耐磨材料,
在工业上有广泛用途,它属于
( A)
A.原子晶体 B.分子晶体
C.金属晶体 D.离子晶体
5.下列每组物质发生状态变化所克服的微粒间
不同点 结构不同 结构不同 中子数不同
研究对象 单质
化合物
原子
1、O2和O3
1、C4H10
11H、12H、13H
2、金刚石、石 正丁烷 异丁烷
墨、富勒烯
2、C2H6O
3、红磷、白磷 乙醇、二甲醚
• 有下列各组物质: A、 163C与162C
B、金刚石与石墨 D、 CH3
C4H10 可能的结构模型
HHHH HCC CCH
HHHH
正丁烷
HHH
HCC CH HH HCH H 异丁烷
共同点:
不同点:
分子式相同 结构不同
同分 异构
二、同分异构现象
化合物具有相同的分子式,但具有不 同结构的现象。
同分异构体
具有相同的分子式,但具有不同结构 的的化合物
同分异构体间的物理性质差异
物质 熔点/℃ 沸点/℃ 液态密度/g·cm-3 结论:
正丁烷
-138.4 -0.5
0.5788
异丁烷
-159.6 -11.7 0.557
C2H6O
分子式
球棍模型
C2H6O
结构式
名称 沸点
乙醇 78 ℃
C2H6O
二甲醚 -23℃
比较 同素异形体、同分异构体、同位素 三个概念
同素异形体 同分异构体 同位素
B.CO2和H2O D.CCl4和KCl
( B)
4.氮化硅(Si3N4)是一种新型的耐高温耐磨材料,
在工业上有广泛用途,它属于
( A)
A.原子晶体 B.分子晶体
C.金属晶体 D.离子晶体
5.下列每组物质发生状态变化所克服的微粒间
同素异形体是指同一种元素形成的多种不同单质31页PPT
白磷分子里的键角是多少?与甲烷或四 氯化碳分子的空间构型相同吗?键角相 等吗?为什么?它们各有几个化学键?
可以对比以下图片,两实线的夹角为键角
二. 磷的化学性质
⑴磷跟非金属的化合反应
2P +5O2 == 2P2O5 或 P4 +10 O2 == 2P2O5 2P + 3H2 == 2PH3 2P + 3Cl2 === 2PCl3(氯气不足) 2P + 5Cl2 === 2PCl5(氯气充足)
⑵磷跟酸的反应 2P +5H2SO4 == 5SO2 +2H3PO4 +2H2O 2P +5HNO3 == 5NO2 +2H3PO4 +2H2O
Hale Waihona Puke 三. 磷的存在和用途矿石中 磷酸盐
磷
动物体内 骨骼、牙齿、脑髓、 神精组织中
植物体内 果实和幼芽里
维持着生物体内正常的生理机能。
白磷用于制磷酸;红磷用于制农药、 火柴以及烟幕弹。
3. 磷酸盐的检验方法,是利用磷 酸根离子和硝酸银溶液反应,生 成黄色的磷酸银沉淀来进行。
练习: 1、HPO3和 H3PO4的酸酐是什么? 2、磷酸的制法:
3、完成以下反应的化学方程式
P
P2O5
H3PO4
Ca3(PO4)2
b、试管左端红磷和右端的白磷放在一铜片上 c、干燥烧瓶 d、洗耳球
将火对着红磷、边加热、边挤压洗耳球,请
四. 磷的氧化物
P2O5 + H2O(冷)= 2HPO3
偏磷酸(剧毒)
P2O5 + 3H2O(热)= 2H3PO4
磷酸(无毒)
P2O5 是白色固体,强吸湿性,是 非氧化性酸性干燥剂
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金刚石
石墨
一、金刚石和石墨
1、金刚石和石墨的物理性质
金刚石
外形 无色透明,正八面 体形状固体
石墨
深灰色不透明细鳞 片状固体有滑腻感 质软 有优良的导电性
硬度
导电性
在自然界里硬度最大
不良导体
碳元素形成的单质
金 刚 石
石 墨 C60(足球烯)
在电车顶上的两根导 电杆跟电线接触处分别装 上一块石墨制成的滑块, 以保证行驶时供电。为什 么要选用石墨来制滑块? 石墨具有润滑、导电性质
红磷和白磷在一定条件下可以相 互转化,这一变化属于
A 物理变化 B 化学变化 C 氧化-还原反应 D 非氧化-还原反应
√ √
一个白磷分子中有
6 个共价键, ______
6 对共用电子对, 有_____ 白磷的分子式为______
P4
红 磷
P
磷化学性质较活 泼,在自然界中以化 合态形式存在。
ቤተ መጻሕፍቲ ባይዱ
磷酸盐矿物 动物骨骼、脑髓、神经组织 植物的果实和幼芽
同一种元素
异 √
B. H 和 D C. H2 和 D2 E. 金刚石和石墨
判断下列物质或微粒是否互称同素异形体 :
√
A. H2O 和D2O D. O2 和 O3
对比同素异形体和同位素
同位素指质子数相同、中子数不同的同一元素的不同原子。
强调是原子间的互称,如
1 H、 2 H 1 1
、 31H 。
同素异形体是由同一种元素形成的几种性质不同的单质。
通常为一无色
无气味的气体;
液态O2呈淡蓝色,
淡蓝色
固态O2呈雪花状,
小
-218℃ -183℃
熔点
沸点
2、臭氧的化学性质
不稳定性: 2O3 = 3O2 强氧化性: 除铂、金、铱、氟以外,臭氧几乎可与元素周期表中的所有 元素反应。臭氧可与K、Na反应生成氧化物或过氧化物,在臭 氧化物中的阴离子O3-实质上是游离基。臭氧可以将过渡金属元
一就是松林中常含有微量的臭氧。这些臭氧是松树的树脂在
氧化过程中产生的。微量的臭氧不但不臭,反而能使空气变 得清新,特别是对呼吸道病人的呼吸尤为有益。疗养院常常 设在松林中,道理就在这里。
三、白磷和红磷的比较
正四面体
链状复杂结构
密封贮存,少量存于水中
密封贮存
416C升华后冷却
红磷
260C
白磷 (隔绝空气)
2、1985年,科学家们发现了一种新的物 质,其化学式为C60,下列关于C60的 说法正确的是( D ) A. C60是由60个碳分子所构成 B. C60的相对分子质量为720 g C. C60是一种新型化合物 D. C60是一种单质碳
3、臭氧的用途
臭氧可用于漂白和消毒。某些染料受到臭氧的
强烈氧化作用会褪色,臭氧可以杀死许多细菌,因
此,它是一种很好的脱色剂和消毒剂。
臭氧发生器
臭氧空气除味机
3、臭氧的用途:
(1)、氧化剂
(2)、消毒剂
(3)、脱色剂 (4)、抵挡有害射线
你知道吗?
松树林里,空气往往格外清新,令人呼吸舒畅,原因之
白磷主要用于制高纯度磷酸 红磷用于制农药、安全火柴
军事上的烟幕弹和燃烧弹 也常以
磷为原料
红磷、Sb2S3
KClO3、MnO2、 S
1、金刚石和石墨的物理性质有很大的 差异的原因是( C ) A.金刚石不含杂质,而石墨含杂质
B.金刚石是单质,而石墨是化合物
C. 金刚石和石墨里碳原子的排列不同 D.金刚石和石墨是由不同元素组成的
强调是特定物质 和石墨等。 单质间的互称,如O2和O3, 金刚石
臭氧
雷雨后的空气也会变得十分清新,这除了雨水将空
气中的尘埃洗净以外,臭氧也起了相当的作用,原来闪
电能使空气中的部分氧气转变成臭氧。
雷雨天气
二、氧气与臭氧物理性质对比
O3 O2
通常为一有特殊
臭味的淡蓝色气体, 色、嗅、态 液态O3呈深蓝色, 固态O3为紫黑色 溶解度(水中) 大 -251℃ -112.4℃
素氧化到较高或最高氧化态,形成更难溶的氧化物,人们常利
用此性质把污水中的Fe2+、Mn2+及Pb、Ag、Cd、 Hg、Ni等重金
属离子除去。此外,可燃物在臭氧中燃烧比在氧气中燃烧更加
猛烈,可获得更高的温度。
臭氧的用途
高压电机和复印机在工作
时,也会产生臭氧。因此,
这些地方要注意通风,保 持空气流通。
同素异形现象和同素异形体
(1)同素异形现象——一种元素形成几 种单质的现象叫做同素异形现象。 (2)同素异形体——由同一种元素形 成 的多种单质,叫做这种元素的同素异形体。
金刚石 石墨 白磷 红磷 氧气O2 臭氧O3
C60
由同一种元素形成的多种单质互
称为同素异形体
同
原子间不同结合 方式(结构不同)
石墨
一、金刚石和石墨
1、金刚石和石墨的物理性质
金刚石
外形 无色透明,正八面 体形状固体
石墨
深灰色不透明细鳞 片状固体有滑腻感 质软 有优良的导电性
硬度
导电性
在自然界里硬度最大
不良导体
碳元素形成的单质
金 刚 石
石 墨 C60(足球烯)
在电车顶上的两根导 电杆跟电线接触处分别装 上一块石墨制成的滑块, 以保证行驶时供电。为什 么要选用石墨来制滑块? 石墨具有润滑、导电性质
红磷和白磷在一定条件下可以相 互转化,这一变化属于
A 物理变化 B 化学变化 C 氧化-还原反应 D 非氧化-还原反应
√ √
一个白磷分子中有
6 个共价键, ______
6 对共用电子对, 有_____ 白磷的分子式为______
P4
红 磷
P
磷化学性质较活 泼,在自然界中以化 合态形式存在。
ቤተ መጻሕፍቲ ባይዱ
磷酸盐矿物 动物骨骼、脑髓、神经组织 植物的果实和幼芽
同一种元素
异 √
B. H 和 D C. H2 和 D2 E. 金刚石和石墨
判断下列物质或微粒是否互称同素异形体 :
√
A. H2O 和D2O D. O2 和 O3
对比同素异形体和同位素
同位素指质子数相同、中子数不同的同一元素的不同原子。
强调是原子间的互称,如
1 H、 2 H 1 1
、 31H 。
同素异形体是由同一种元素形成的几种性质不同的单质。
通常为一无色
无气味的气体;
液态O2呈淡蓝色,
淡蓝色
固态O2呈雪花状,
小
-218℃ -183℃
熔点
沸点
2、臭氧的化学性质
不稳定性: 2O3 = 3O2 强氧化性: 除铂、金、铱、氟以外,臭氧几乎可与元素周期表中的所有 元素反应。臭氧可与K、Na反应生成氧化物或过氧化物,在臭 氧化物中的阴离子O3-实质上是游离基。臭氧可以将过渡金属元
一就是松林中常含有微量的臭氧。这些臭氧是松树的树脂在
氧化过程中产生的。微量的臭氧不但不臭,反而能使空气变 得清新,特别是对呼吸道病人的呼吸尤为有益。疗养院常常 设在松林中,道理就在这里。
三、白磷和红磷的比较
正四面体
链状复杂结构
密封贮存,少量存于水中
密封贮存
416C升华后冷却
红磷
260C
白磷 (隔绝空气)
2、1985年,科学家们发现了一种新的物 质,其化学式为C60,下列关于C60的 说法正确的是( D ) A. C60是由60个碳分子所构成 B. C60的相对分子质量为720 g C. C60是一种新型化合物 D. C60是一种单质碳
3、臭氧的用途
臭氧可用于漂白和消毒。某些染料受到臭氧的
强烈氧化作用会褪色,臭氧可以杀死许多细菌,因
此,它是一种很好的脱色剂和消毒剂。
臭氧发生器
臭氧空气除味机
3、臭氧的用途:
(1)、氧化剂
(2)、消毒剂
(3)、脱色剂 (4)、抵挡有害射线
你知道吗?
松树林里,空气往往格外清新,令人呼吸舒畅,原因之
白磷主要用于制高纯度磷酸 红磷用于制农药、安全火柴
军事上的烟幕弹和燃烧弹 也常以
磷为原料
红磷、Sb2S3
KClO3、MnO2、 S
1、金刚石和石墨的物理性质有很大的 差异的原因是( C ) A.金刚石不含杂质,而石墨含杂质
B.金刚石是单质,而石墨是化合物
C. 金刚石和石墨里碳原子的排列不同 D.金刚石和石墨是由不同元素组成的
强调是特定物质 和石墨等。 单质间的互称,如O2和O3, 金刚石
臭氧
雷雨后的空气也会变得十分清新,这除了雨水将空
气中的尘埃洗净以外,臭氧也起了相当的作用,原来闪
电能使空气中的部分氧气转变成臭氧。
雷雨天气
二、氧气与臭氧物理性质对比
O3 O2
通常为一有特殊
臭味的淡蓝色气体, 色、嗅、态 液态O3呈深蓝色, 固态O3为紫黑色 溶解度(水中) 大 -251℃ -112.4℃
素氧化到较高或最高氧化态,形成更难溶的氧化物,人们常利
用此性质把污水中的Fe2+、Mn2+及Pb、Ag、Cd、 Hg、Ni等重金
属离子除去。此外,可燃物在臭氧中燃烧比在氧气中燃烧更加
猛烈,可获得更高的温度。
臭氧的用途
高压电机和复印机在工作
时,也会产生臭氧。因此,
这些地方要注意通风,保 持空气流通。
同素异形现象和同素异形体
(1)同素异形现象——一种元素形成几 种单质的现象叫做同素异形现象。 (2)同素异形体——由同一种元素形 成 的多种单质,叫做这种元素的同素异形体。
金刚石 石墨 白磷 红磷 氧气O2 臭氧O3
C60
由同一种元素形成的多种单质互
称为同素异形体
同
原子间不同结合 方式(结构不同)
