辣椒红检测程序
辣椒色价检测

辣椒色价检测方法
一)样品准备
1. 将干辣椒去籽去把,取有代表性的样品200g左右。
2. 在粉碎机上磨碎(锣孔径0.5mm)。
将磨后辣椒粉搅拌10分钟,再点取出样品约10g,再用药匙充分搅拌5分钟,取样检测色价二)检测
1. 将辣椒粉充分搅匀后,称取样品1.0000±0.0010g,置于100ml
容量瓶中;
2. 加试剂油至刻度线下2cm,摇匀后于25℃条件下避光静置1
小时50分钟。
3. 取出容量瓶加试剂油定容至刻度并震摇几次使溶液均匀后再
避光静置10分钟,使溶液分层;
4. 移取容量瓶中上层清液5ml,用试剂B稀释至一定浓度,在分
光光度计上460nm处测吸光度A (0.300<A<0.700);
5. 按公式
一、色调
一)检测
1. 取检测色价时的稀释液,在分光光度计470nm及454nm处分
别测其吸光度 A470和A454(0.300<A<0.700);
2. 色调CR=A470/A454
二)产品合格判定:CR>0.800为合格。
DM-P-052辣椒红色素中苏丹红Ⅰ-Ⅳ检测

辣椒红色素中苏丹红的测定序列号:DM-P-0521 序言苏丹红是一种人工合成的染料,为亲脂性偶氮化合物,主要包括Ⅰ、Ⅱ、Ⅲ和Ⅳ四种类型。
常作为一种工业染料,在食品中非天然存在,如果食品中的苏丹红含量较高,达上千毫克,则苏丹红诱发动物肿瘤的机会就会上百倍增加,特别是由于苏丹红有些代谢产物是人类可能的致癌物。
早在2003年5月,法国发现从印度进口的红辣椒产品中含有苏丹红Ⅰ号。
随后,在欧盟成员国加强检测后,又在包括咖喱粉在内的一系列进口辣椒产品中发现了苏丹红Ⅱ、Ⅲ和Ⅳ号。
2005年2月,英国食品标准局在英国“第一食品公司”制造的伍斯特郡辣酱油使用的辣椒粉中查处了苏丹红Ⅰ号。
并于2月下旬,向全球发出十五安全警告。
随后,我国也加强了苏丹红Ⅰ~Ⅳ号的检测工作,发布了“食品中苏丹红染料的检测方法-高效液相色谱法”国家标准。
2 样品准备/提取(1) 称取0.1 g~0.2 g样品于离心管中,加入10 mL乙腈;(2) 涡旋混合5 min,超声提取5 min,6000 rpm下离心3 min,收集上清液;(3) 残渣再用10 mL乙腈提取,每次涡旋混合5 min,超声提取5 min ,6000 rpm下离心3 min;合并两次提取液;(4) 在40 ℃下用减压蒸馏将提取液蒸干,然后用5 mL正己烷溶解,待净化。
3 SPE柱净化——ProElut Silica 1 g/6 mL(Cat.#:63006)(1)活化:10 mL正己烷,流出液弃去;(2)上样:将待净化液加入小柱,流出液弃去;(3)洗脱:15 mL乙醚:乙腈=1:9洗脱,收集流出液;(4)重新溶解:在40 ℃下用减压蒸馏将收集的流出液蒸干,然后用乙腈定容至2 mL后供HPLC分析。
4 分析条件色谱柱:Diamonsil C8(2) 150×4.6 mm,5 μm(Cat.#:99650)流速: 1.0 mL/min检测器:* UV:478 nm柱 温: 30 ℃ 进样量: 20 μL 流动相: A :乙腈,B :水5添加回收结果辣椒油中苏丹红的添加回收结果Tim e (m in)V o l t s苏丹红5.0 mg/L 的标准液相色谱图Tim e (m in)V o l t s辣椒红色素中苏丹红(添加浓度50 mg/kg )的液相色谱图2468101214Tim e (m in)0.000.020.040.060.08V o l t s辣椒红色素中苏丹红(未添加)的液相色谱图。
辣椒红色素的分离提取及测定

实验七辣椒红色素的分离提取及测定综述:辣椒红色素为深红色粘性油状液体,是以辣椒为原料,用石油醚、丙酮、正己烷等有机溶剂提取得到的天然色素。
主要由辣椒红素、辣椒玉红素、辣椒酮、辣椒红呋喃素、玉米黄质等化合物组成,,依据来源和制法的不同,因含有辣椒碱而具有不同程度的辣味。
辣椒红素几乎不溶于水,可任意溶解于丙酮、乙酸乙酯、正己烷,易溶于乙醇,稍难溶于丙三醇。
紫外光可以使辣椒红素褪色,但辣椒红素对热稳定,160℃加热两小时几乎不褪色,Fe3+、Cu2+可使之褪色。
pH对色素色度无影响。
辣椒红素一、实验目的:本实验为自主设计实验,要求学生几人一些小组,自己查阅文献、制定实验方案、在教师指导下讨论通过后进行实验。
通过对辣椒红色素的提取、分离及测定,初步了解和掌握食品中某些成分的提取技术、分离技术以及测定方法,从而对食品有效成分的分析有比较系统的认识,为能灵活运用食品化学的研究方法打下良好的基础。
本次实验还拟通过这种方式,使同学们了解一个研究性试验的基本过程,从而提高对科学研究的兴趣,为今后创新性实验的开发奠定一定的能力基础,同时也在于培养大家团队协作的团队精神。
二、实验原理辣椒红色素为脂溶性色素,选用适当的方法提取后,可采用不同的分离技术对色素进行分离。
三、实验材料与设备1.材料:干红辣椒2.试剂:石油醚、丙酮、乙酸乙酯、乙醇、氯仿、甲醇、柱层析用硅胶、薄层层析用硅胶、0.5%羧甲基纤维素钠等。
3.设备:粉碎机、超声波清洗机、旋转蒸发仪、薄层层析板、柱层析、层析缸等。
四、实验步骤1.色素的提取:称取1-2g 干红辣椒,掰开去籽,放入粉碎机中粉碎。
将粉碎好的粉末倒入一干燥洁净的三角瓶,加入50-100ml 丙酮,用保鲜膜封口,并在保鲜膜上扎几个眼儿。
将三角瓶放入超声清洗机20-30min ,过滤后放入旋蒸瓶内旋蒸,直至完全蒸干。
向内壁附着有辣椒红色素的旋蒸瓶内加入3-4ml 左右的石油醚,轻摇将辣椒红色素溶解在石油醚中,最后把石油醚倒入小试管,密封好放入冰箱保存。
辣椒红色素的检测方法

取样量 的确 定 :先 称取 1克 样品 ,精确 至 o0 0 ,0 1 ( 上 页 )析速 度慢 。而 L MS GC MS具 有精确 可 接 C— 、 -
速 度 快 、 品 用量 少 、 样 操作 简 便 、 价格 低 廉 可实 现 连续 的在线 检测 和反 复使用 , 但稳 定性 很难 控 制 , 以实现 难
浓度 mgL / 1 O 1 O 1 0 1 O 1 0
2 8 77
本 方法 采用 索 氏提 取法 进行 提取 ,用 高效 液相 色
谱进 行检 测 。
1 高效液相色谱 条件选择 、
经 过 多次试验 ,我们 确定 了辣 椒红 色素 的检 测条
件为:
1 0
2 .8 78
提取温 度的 确定 : 回流速 度控 制在 5 5~6 0滴 / n mi
的温度 为 6  ̄ 。 5( 2
目标物在 线性 范围 内线性关 系 良好 , 并且在 不同 的 实验 室能 够得到 满意 的重现性 及再现性 等结果 。( 者 作
单 位 : 票 市 产 品质 量 监 督 检 验 所 ) 北
40 5 nm  ̄4 0n 。 7 m
辣 椒精深 加工 产品辣 椒红 色素 在国 内外 应用 前景 十分 广阔 。目前 , 国还没 有辣椒 精深加 工产品 的国家 我 标准 , 没有辣椒 深加 工产品检 测 的相关标准 。 也 为了填 补 国家 此项空 白 , 究辣 椒红 色 素简 便 、 速 、 研 快 准确 的 检验方 法尤 为必要 。 辣椒红 色素 主要 成分主 要 由辣椒 红素 组成 ,纯 的
3 建立辣 椒 红色素 的 高效液 相 色谱检 测方 法 、
本研 究考察 了方 法的精 密度 、 线性 范围 、 出限 、 检 添 加回收 等技术 参数 。 标准 曲线 := .1+ .1 相关 系数 为 097 。 y 22x 55 , .9 8 精 密度实验 :实验 以 1mgL的标准溶 液平行 测定 0 / 6次 , 结果 见下表 。
饲料中辣椒红的测定 高效液相色谱法-最新国标

饲料中辣椒红的测定高效液相色谱法1范围本文件描述了饲料中辣椒红的高效液相色谱测定方法。
本文件适用于配合饲料、浓缩饲料、添加剂预混合饲料中辣椒红的测定。
本文件的检出限为0.05mg/kg,定量限为0.1mg/kg。
2规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。
其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T6682分析实验室用水规格和试验方法GB/T20195动物饲料试样的制备3术语和定义本文件没有需要界定的术语和定义。
4原理试样中的辣椒红(以辣椒红素和辣椒玉红素表示)用乙腈提取,高效液相色谱仪测定,外标法定量。
5试剂或材料除非另有规定,仅使用分析纯试剂。
5.1水:GB/T6682,一级。
5.2乙腈:色谱纯。
5.380%乙腈溶液:取80mL乙腈,加水稀释至100mL,混匀。
5.4辣椒红素和辣椒玉红素标准储备溶液(100μg/mL):准确称取辣椒红素(CAS号:465-42-9,纯度不低于95%)和辣椒玉红素(CAS号:470-38-2,纯度不低于95%)标准品各10mg(精确至0.01mg),分别置于100mL棕色容量瓶中,用乙腈溶解、定容,混匀。
2℃~8℃保存,有效期为1个月。
5.5混合标准中间溶液(10μg/mL):准确移取1mL辣椒红素和辣椒玉红素标准储备溶液(5.4)于10mL 棕色容量瓶中,用乙腈稀释、定容,混匀。
临用现配。
5.6混合标准系列溶液:准确移取适量混合标准中间溶液(5.5)于10mL棕色容量瓶中,用80%乙腈溶液(5.3)稀释、定容,混匀。
配制系列标准溶液,浓度分别为0.020μg/mL、0.10μg/mL、0.20μg/mL、1.0μg/mL、2.0μg/mL和5.0μg/mL。
临用现配。
5.7微孔滤膜:0.2μm,有机相。
6仪器设备6.1高效液相色谱仪:配紫外检测器或二极管阵列检测器。
2红辣素色价及辣素含量的检测(3)1

公式应居中,一行写不完的长公式,最好在等号处转行,如做不到这点,在数学符号(如“+”、“-”号)处转行,数学符号应写在转行后的行首。公式的编号用圆括号括起放在公式右边行末,在公式和编号之间不加虚线,公式可按全文统一编序号,公式序号必须连续,不得重复或跳缺。重复引用的公式不得另编新序号。
辣椒红色素是以优质辣椒为原料,采用科学方法提取、分离、精制而成的天然色素。主要成份为辣椒红素、辣椒玉红素。产品为深红色油状液体,流动性好、溶解性好、色泽鲜艳、着色力强。该产品广泛应用于食品、医药、化妆品、饲料等行业,是方便面、酱菜、水产品、肉类、糕点、色拉、奶油、糖果、饮料理想的调色着色剂括、简短。
[12]孔学,王加宁,尹继刚,邱维忠,等.辣椒碱的制备与应用概述[J].山东科学,2006,19(4):26-27.
[13]陈思浩,赵伟.合成辣素的制备与应用[J].农药,2006,45(6):405-406.
4结果
本公司根据颗粒的色价检测出成品的色价,根据国标的要求。一般红色素的色价在200以上,辣度在0.2-0.4之间,具体如有要求就根据客户的要求来进行调配红色素的色价及红辣素的辣度
5结论
结论:标题为三号宋体加粗居中,内容为小四号宋体,首行缩进二个字。
结论包括对整个研究工作进行归纳和综合而得出的总结,还应包括所得结果与已有结果的比较和本课题尚存在的问题,以及进一步开展研究的见解与建议。结论集中反映作者的研究成果,表达作者对所研究的课题的见解,是全文的思想精髓,是文章价值的体现
1.2 实验试剂一览表
试剂名称 规格 生产厂家
氢氧化钠 AR 天津市化工厂
红辣椒中红色素的提取
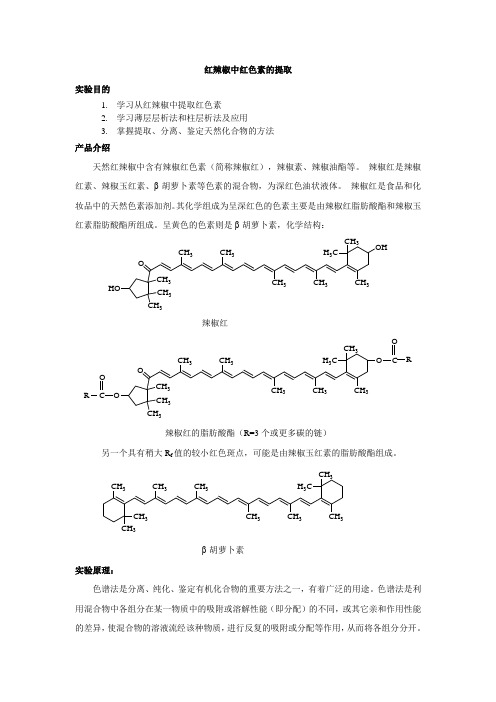
红辣椒中红色素的提取实验目的1. 学习从红辣椒中提取红色素2. 学习薄层层析法和柱层析法及应用3. 掌握提取、分离、鉴定天然化合物的方法 产品介绍天然红辣椒中含有辣椒红色素(简称辣椒红),辣椒素、辣椒油酯等。
辣椒红是辣椒红素、辣椒玉红素、β-胡萝卜素等色素的混合物,为深红色油状液体。
辣椒红是食品和化妆品中的天然色素添加剂。
其化学组成为呈深红色的色素主要是由辣椒红脂肪酸酯和辣椒玉红素脂肪酸酯所组成。
呈黄色的色素则是β-胡萝卜素,化学结构:HOCH 3CH 3OCH 3CH 3CH 3CH 3CH 3OHCH 3CH 3H 3C辣椒红OCH 3CH 3OCH 3CH 3CH 3CH 3CH 3CH 3CH 3H 3C OCO RCO R辣椒红的脂肪酸酯(R=3个或更多碳的链)另一个具有稍大R f 值的较小红色斑点,可能是由辣椒玉红素的脂肪酸酯组成。
CH 3CH 3CH 3CH 3CH 3CH 3CH 3CH 3CH 3H 3Cβ-胡萝卜素 实验原理:色谱法是分离、纯化、鉴定有机化合物的重要方法之一,有着广泛的用途。
色谱法是利用混合物中各组分在某一物质中的吸附或溶解性能(即分配)的不同,或其它亲和作用性能的差异,使混合物的溶液流经该种物质,进行反复的吸附或分配等作用,从而将各组分分开。
流动的混合物称为流动相;固定的物质称为固定相(可以是固体,也可以是液体)。
依据各组分在固定相中的作用原理不同,可分为吸附色谱、分配色谱、离子交换色谱、排阻色谱等;依据操作条件的不同,又可分为柱色谱、薄层色谱、纸色谱、气相色谱、高效液相色谱等。
下面着重介绍柱色谱与薄层色谱:柱色谱常用的有吸附色谱和分配色谱两种。
吸附色谱常用氧化铝和硅胶为吸附剂。
分配色谱用硅胶、硅藻土、纤维素等为支持剂,以吸收大量的液体作为固定相。
吸附柱色谱通常在玻璃管中填入表面积很大经过活化的多孔性或粉状固体吸附剂。
待分离的混合物溶液流过吸附柱时,各种组分同时被吸附在柱的上端。
食品添加剂 辣椒红标准文本(食品安全国家标准)

食品安全国家标准食品添加剂辣椒红1 范围本标准适用于以辣椒(Capsicum annuum L)果皮及其制品为原料,经萃取、过滤、浓缩、脱辣椒素等工艺制成的食品添加剂辣椒红。
2 分子式、结构式和相对分子质量2.1 分子式辣椒红素:C40H56O3辣椒玉红素:C40H56O42.2 结构式辣椒红素:辣椒玉红素:2.3 相对分子质量辣椒红素:584.87(按2007年国际相对原子质量)辣椒玉红素:600.87(按2007年国际相对原子质量)3 技术要求3.1 感官要求感官要求应符合表1的规定。
GB 10783—201X3.2 理化指标理化指标应符合表2的规定。
表2 理化指标附录A 检验方法A.1 一般规定本标准所用试剂和水,在没有注明其他要求时,均指分析纯试剂和符合GB/T 6682规定的三级水。
试验中所用标准溶液、杂质标准溶液、制剂及制品,在没有注明其他要求时,均按GB/T 601、GB/T 602、GB/T 603的规定配制。
试验中所用溶液在未注明用何种溶剂配制时,均指水溶液。
A.2 鉴别试验 A.2.1 溶解性溶于乙醇,易溶于植物油、丙酮、乙醚、三氯甲烷,几乎不溶于水,不溶于甘油。
A.2.2 显色反应在1滴试样中加2~3滴三氯甲烷和1滴硫酸,应呈现暗蓝色。
A.2.3 最大吸收峰样品溶解在正己烷中,在约470nm 处有最大吸收峰。
A.3 吸光度的测定 A.3.1 试剂和材料丙酮。
A.3.2 仪器和设备A.3.2.1 分光光度计,附1 cm 比色皿。
A.3.3 分析步骤准确称取0.1g 试样(精确至0.000 2g ),用丙酮稀释于100mL 容量瓶中,再精确吸取稀溶液10mL ,稀释至100 mL ,用分光光度计在460nm 波长处,用丙酮作参比液,于1cm 比色皿中测定其吸光度。
注:被测比色液的吸光度范围宜控制在A=0.30~0.70范围内。
A.3.4 结果计算吸光度nm E cm 460%11按公式(A.1)计算:1001460%11⨯⨯=m f A nm E cm ………………………………(A.1) 式中:A ——实测试样溶液的吸光度; f ——稀释倍数;m ——试样质量,单位为克(g )。
辣椒检测程序

辣椒检测程序一.辣椒的取样辣椒收购点的取样暂定方案:1、带袋或捆装大货样品取样:a:以进货件数计,200件以下抽取20件,200件以上按照件数的10%抽取。
从被抽到辣椒袋中各取300g左右有代表性的辣椒样品定为原始样品。
b:缩分样品:将取出的原始样品倒在清洁、干燥的路面上(也可在塑料布上进行),用四分法缩分。
由相对的两边对准中心混合,反复混匀后,将样品铺成厚度均匀的正方形平面,而后截划两条对角分割线,分成四个相等的三角形,任意舍去两个对顶三角形样,其余两个对顶三角形样品合并,按上法继续分取,直至最后两份对顶三角形样品的总重量略高于2kg,任取其中一份对顶三角形状样品作为平均样品。
分样时应注意散落椒籽、椒梗的均匀分配。
2、散装大货可以在装车过程中,间隔取样,取样量根据辣椒的均匀情况及批次大小而定,一般按照总量的10%取样,然后依据缩分法进行缩分,取出2kg样品。
也可以装包,依据方法1的取样过程进行取样。
3、包装:取样后样品应进行特殊包装,及时随车带回,避免水分和色价变化。
一般情况下,为避免水分损失,可将所取样品装入双层塑料袋中密封保存。
第二种方法,把取到的样品,称准确重量进行标识,实验室接到样品时,再称重量,这样就知道损失重量。
4、运送:将包装好的样品随大货由司机带回。
样品要与大货在一起。
到公司后,司机马上将样品交予仓库保管,并由仓库保管送实验室进行报检检测,如仓库保管不能及时送往实验室,应将样品避光暗处存放。
备注:货前样品由经营部采购人员取样。
二.辣椒报检1、批次合并:保管应知道各收购点的进货计划,为便于检测、辣椒加工的工作,可以选择相同产地、品种相同、入厂时间不超过3天、批量不超过40吨的批次进行合并,在报检时注明合并的批号、数量和检测项目,由质检部采取加权平均的方法出具检测结果。
2、报检:报检的辣椒要注明产地、品种、数量、车次、袋数,检测项目,需要合并批次的报检时注明,等样品到齐之后检测。
样品在检测之前由质检部负责保管。
辣椒红色素的提取和检测

生物与环境实验中心化学实验室 2013.05
一、实验目的
1、了解从辣椒中提取辣椒红色素的基本原理 和方法
2、进一步掌握索氏提取、薄层色谱和吸光度 测定等操作技术。
二、实验原理
红辣椒中含有多种色素,其含量可高达 3.2g/100g(成熟的干辣椒),已知的有辣椒红色素 (C40H56O3,M=584.85g·mol -1)、辣椒玉红素 (C40H56O4,M=600.85g·mol-1)和β-胡萝卜素,它 们都是类胡萝卜素,在结构上都属于二环四萜化合 物。辣椒红色素是深红色粘性液体或深胭脂红色结 晶的天然食用色素,并具有营养保健作用和抗癌能 力。辣椒红色素易溶于乙醇、丙酮、二氯甲烷、植 物油而不溶于甘油和水。
计算:E
换算:
1 1
4
% cm
60
红色素含量
计算Rf值
E
1 1
% cm
=
A× f m
×1/100
式中
E
1 1
% cm
460—被测试样为1%, 1cm比色皿,在
最大吸收峰460nm处的吸光度,即为色价;
A—实测试样的吸光度
f—稀释倍数
m—试样质量
六、思考题
1、干红辣椒用NaOH溶液浸泡后,为什么不采用过滤或抽滤的方法 进行固液分离? 答:辣椒容易覆盖住滤纸,难以固液分离。 2、干红辣椒的除辣操作时,水浴温度不能超过90℃,水浴时间不宜 过长,其原因是什么? 答:温度太高辣椒红色素会分解 3影、响薄?层色谱中的Rf值有何意义?不同的展开系统对Rf值会产生什么 答:Rf值为溶质迁移距离与流动相迁移距离之比。展开系统的两种溶剂 极性越接近,斑点越分散,越狭长。 4、薄层板上点样量过多或过少,对薄层色谱分离效果 有什么影响? 答:样品过多容易拖尾,样品过少点样不明显,溶剂未挥发就二次 点样会使点跑得比较大。
辣椒红色素提取与检测方法的研究进展

6 基金项目:国家科技攻关专项“食品安全关键技术”的子课题“天然 色 素 的 检 验 技 术 ”(!""’7)5"0)!’)。 第 一 作 者 (’8$59 ):女 ,副 教 授 ,硕 士 生 导 师 ,主 要 从 事 天 然 产 物 的 加
了 辣 椒 红 色 素 的 研 究 进 展 ;并 为 新 疆 红 辣 椒 进 行 辣 椒红色素深加工的产业化发展提供依据。 % 辣椒红色素的稳定性
硅 胶 柱 层 析 分 离 辣 椒 色 素 属 分 配 层 析 法 ,是 根 据色素和辣素的结构差异在束缚与硅胶上的固定 相 和 洗 脱 液 中 的 溶 解 度 不 同 ,因 此 在 固 定 相 和 洗 脱 液之间的分配系数不同而达到分离效果。这个操作 简 单 ,设 备 条 件 要 求 不 高 ,分 离 效 果 很 好 ,去 除 辣 味 完全。此柱层柱洗脱液为石油醚:乙醇(A"B)G!:’ 混 合 溶 剂&’-+;内 蒙 古 工 业 大 学 &’!+也 有 研 究 ,其 柱 层 析 法 采用 ’"")!"" 目硅胶为填料,石油醚与丙酮(体积比 为 ’":’)复合液为洗脱液;色素回收率为 $-,!B,而 且色价 较 高 为 $#;可 以 形 成 橙 黄 、红 色 与 淡 黄 色 % 条带,有利于红辣椒中有效成分的精细分离。 !,( 薄层色谱
检测色价辣度细节问题

色价、辣度细节问题一.检测色价细节问题在仪器、溶剂和外界环境稳定的情况下,容易出现失误的地方有:1.红辣素、饲料级辣椒红、超临界辣椒红、水溶辣椒红这几种产品在测色价时样品一定先在50度水浴锅中预热10分钟,然后充分摇匀,并且称完样品稀释100倍(定容)后一定要静止5分钟,移取上层清液2.食品级辣椒红在测之前样品要混匀,称完样品稀释100倍(定容)后一定要静止5分钟,移取上层清夜3.辣椒、辣椒粉、辣椒粒把温度控制好,辣椒粉和辣椒颗粒研磨粗细程度,研磨时每隔几分钟过40目筛一次,尽量把辣椒颗粒研磨地充分一致,容量瓶要记准瓶号,移液时移取上层清夜,把瓶号对应好,移一批拉一批数据,不要全移完再去拉数据4.测辣椒粉、辣椒粒水分是一定要写清批号,以免对应批号混错;5.关于辣椒精的色价测其吸光度时要用胶头滴管吸取上层清夜;6.测其吸光度时一定要测标准液,看其数据差距,以此来查看仪器稳定情况,发现异常停止使用;7.测其吸光度之前比较仪器,一定要校正基线,自动校零,并颠倒比色皿看其吸光度是否一致,最后一位相差一个数可以使用;8.长时间测色价注意参比池中的液体多少,不足比色皿2/3时要添加够方可用;9.每个人擦拭比色皿程度不同会有一些差距;10.测其吸光度时要用石英比色皿;11.计算结果、上台帐、填单据一定要小心谨慎,填完后再核对一遍,确保单据、台帐、原始记录一致,准确无误;12.审核人一定要做到实事求是,不能敷衍了事。
二.检测辣度细节问题在仪器、溶剂和外界环境稳定的情况下,我认为出现失误的地方有:1.样品一定要摇匀,称样时按1个辣度称5克反比例计算,加100ml70%的甲醇要精确;2.移纯净水的瓶号不能混淆,加入酸碱要对准瓶号,不能颠倒;3.样品震荡好后,根据辣度高低确定静止时间长短,辣度高静止时间短,反之就长,过滤是一定要加盖,先过滤25ml润洗过滤瓶后扔掉,等全部过滤完后把滤液摇几下,保证滤液均匀一致,低于1%辣度的需要用双层滤纸;4.移取4ml滤液一定要严格准确,移到容量瓶后一定要摇几下,使其反应充分、完全;5.最后加纯甲醇定容后再摇匀,摇匀后液面低于刻度线以下就不要再加到刻度线了,定容后可放置1分钟再测数据;6.测其吸光度之前比较仪器一定要校正基线,自动校零,并看其吸光度是否一致,最后第二位相差不大于5个数可以使用, 测其吸光度时要用石英比色皿; 7.长时间测辣度注意参比池中的液体多少,不足比色皿2/3时要添加够方可用;8.计算结果、上台帐、填单据一定要小心谨慎,填完后再核对一遍,确保单据、台帐、原始记录一致,准确无误;9.审核人一定要做到实事求是,认真负责,不能敷衍了事。
辣椒红色素反式辣椒红素检测方法-HPLC

辣椒红色素的反式辣椒红素检测方法一、实验器皿和仪器100ml,50ml容量瓶2ml、5ml、10ml、20ml、25ml移液管1cm比色皿50ml圆底烧瓶0.45um的微孔滤膜56℃水浴锅旋转蒸发移分析天平超声清洗器可见分光光度计高效液相色谱仪,色谱条件如下:HPLC柱:HYPERSIL Silica(3.0mm*250mm)流速:1.1ml/min检测器:紫外检测器474nm温度:20℃进样量:20ul二、试剂丙酮分析纯和色谱纯乙醇分析纯甲苯分析纯正己烷分析纯和色谱纯提取液:正己烷:乙醇:丙酮:甲苯(10:6:7:7)流动相:正己烷:丙酮(81:19)10%NaSO4溶液40%KOH/甲醇溶液三、实验步骤1.称量样品前必须确保样品混合均匀。
2.称取0.1500g的样品于100ml的容量瓶中,用提取液定容至刻度,于超声器上超声1分钟,使样品充分溶解,然后摇晃均匀。
3.吸取10ml的上述溶液于另一100ml的容量瓶中,移取20ml的提取液于此容量瓶中,加2ml的40%KOH/甲醇溶液。
摇晃均匀。
4.把容量瓶接上冷凝器于56℃的水浴锅中加热20min。
5.取出容量瓶,至冷水中冷却至室温。
移取30ml的正己烷于容量瓶中,摇晃均匀,再用10%NaSO4溶液定容至刻度。
剧烈振荡1分钟。
6.把溶液置于黑暗中静置50分钟,至上层溶液澄清。
7.吸取5ml的上层液于50ml的容量瓶中,用正己烷定容至刻度。
摇晃均匀。
8.用正己烷作空白于460nm处检测溶液吸光值A460nm。
9.另取上层液2ml于一个50ml的圆底烧瓶中,于旋转蒸发器中把溶液蒸干。
再加入2ml的流动相,把样品充分溶解,用0.45um的微孔滤膜过滤样品溶液于2ml的液相样品瓶中。
10.精确进样20ul于高效液相色谱仪中,出峰时间大概是15min。
从HPLC图谱中可以读出反式辣椒红色素的百分比。
辣椒红色素的检测方法

= H
, = $ * * 3 # # # H K n o p p q 7 qo D > r D qs t r q 5 t q u v w r x 5!7 y r t v p z v y qx 5 {u o y q " z y |}5 r ~ q y r " z | u v !B o v % H $ * * 3 # # # H . n o p p q 7 qo D u o o {s t r q 5 t qx 5 {F q t B 5 o p o 7 | u v w r x 5!7 y r t v p z v y qx 5 {u o y q " z y |}5 r ~ q y r " z | u v ! B o v % * * " # U Q W ‘ b Q $x 5 |6q z B o { "o D { r " z r 5 7 v r " B r 5 7x 5 {$q 5 " v y x z r 5 7%x % y r & x% r 7 6q 5 z ’B r t Br 5 t p v { qz q " z o D " o p v ( r p r z | * * t o p o v y { r " % p x | r 5 7y q x t z r o5* }:; }) sx 5 {) C" % q t z y v 6* q z t x y qy q ~ r q ’q {r 5z B q% x % q y +P ,S W T U . x % y r & x% r 7 6q 5 z / r " z r 5 7 v r " B 6q 5 zx 5 {6q 5 " v y x z r o 5 n o p o v y { r " % p x | r 5 7y q x t z r o 5 n x % " r t v 6 , . s % x % y r & x % q t z y o % B o z o 6q z y | F Br 5p x | q yn B y o 6x z o 7 y x % B |
DB13_T5159-2019辣椒红中反式辣椒红素含量的测定

ICS67X 04 DB13 河北省地方标准DB 13/T 5159—2019 辣椒红中反式辣椒红素含量的测定2019-12-27发布2020-01-28实施前言本标准按照GB/T 1.1—2009给出的规则起草。
本标准由邯郸市市场监督管理局提出。
本标准起草单位:晨光生物科技集团股份有限公司、河北省食品检验研究院。
本标准主要起草人:杨清山、王红、陶晓青、张兰天、刘亚玲、李挥、季邵东、周丽、石文杰。
辣椒红中反式辣椒红素含量的测定1 范围本标准规定了辣椒红中反式辣椒红素的高效液相色谱测定方法。
本标准适用于辣椒红中反式辣椒红素的测定。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682 分析实验室用水规格和试验方法。
3 原理反式辣椒红素是辣椒红的主要成分,属于类胡萝卜素类,其在辣椒红中的天然存在状态是反式辣椒红素酯。
反式辣椒红素酯经过碱液皂化后,均转化为游离的反式辣椒红素。
使用紫外-可见分光光度法测得辣椒红中的总类胡萝卜素含量,再使用高效液相色谱法测得反式辣椒红素在液相图谱中的面积归一化比例,以总类胡萝卜素含量乘以反式辣椒红素比例得到反式辣椒红素含量。
4 试剂或材料除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的二级水。
4.1 试剂a)正己烷(C6H14):色谱纯;b)甲醇(CH4O);c)无水乙醇(C2H6O);d)甲苯(C7H8);e)丙酮(C3H6O):色谱纯;f)乙酸乙酯(C4H8O2):色谱纯;g)氢氧化钾(KOH);h)无水硫酸钠(Na2SO4)。
4.2 试剂配制4.2.1 萃取剂(HEAT):将正己烷、无水乙醇、丙酮、甲苯按10:6:7:7的体积比例混合摇匀。
4.2.2 40%氢氧化钾—甲醇溶液(m/v):取氢氧化钾 40g(精确至0.1g)于250mL烧杯中,加入约10 mL水迅速用玻璃棒搅拌溶解后,加入甲醇50mL,搅拌至澄清,移入100 mL容量瓶中,用甲醇定容、摇匀静置待用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.1.5 测定吸光度时同时测定标准液,测定值跟标准液相比误差在±0.005 之间
时出结果,如果测定标准液超出±0.005 可暂时不出结果,需查明原因再
测。
1.1.6 注意:
1).容量瓶的瓶号要标清并写清各样品对应瓶号,一般情况下大号对应大号、小 号对应小号;
2).校比色皿时需颠倒较零;
3).检测多波长时需基线校正;
2
2
灰分%
≤
1.0
1.0
2.饲料级辣椒红 项目
外观
味觉
色价 E11c%m460nm
≥
辣椒素 %
≤
丙酮不溶物 %
≤
挥发份 %
≤
优级品
合格品
流动性良好不得有胶粒沉淀出现
不得有苦味酸味等异味
10.0
10.0
0.10 1.5 1.0
0.15 2.0 1.5
3.超临界辣椒红 项目
优级品
合格品
外观
深红色油状液体,流动性良好 深红色粘稠液体,有流动性
取 100ml 烧杯一只,滴入辣椒红色素一滴,加丙酮溶剂适量,溶解稳定后用 分光光度计分别于 470mm 和 454mm 处测吸光度 A470 和 A454(吸光度须在 0.300-0.700 之间)。
2.3 色调 CR=A470/A454 2.4 平行检测三次以上,相对偏差超过 2‰的值舍去后求其余值的算术平均值为 最终结果。 3.溶残 3.1 将一定理论值的标准样于 50 度水浴条件下放置 40±5min,在气相色谱上测 其峰面积。
六. 样品应区分轻重缓急:一般情况下过程样品比较急,出入库成品
检测一般应按送样顺序检测,如有特殊情况由调度员安排,报告 须符合《检验时限》,不得延误。 七.辣椒红检测指标表
根据市场需求及各公司自己的实际情况,理化指标一般应符合下表规定:
1.食品级辣椒红 项目
外观
优级品
合格品
流动性良好不得有胶粒沉淀出现
气味
无异味
无明显异味
味觉
不得有苦味酸味等异味
不得有苦味酸味等异味
色价 E11c%m460nm ≥
150.0
150.0
色调
≥
1.010
0.950
沉淀机溶剂残留
量(以正己烷),
5.0
25.0
mg/kg
≤
辣椒素% ≤
0.0005
0.0010
4.水溶辣椒红 项目
优级品
合格品
外观
流动性良好不得有胶粒沉淀 流动性良好不得有胶粒沉淀 出现,外观褐红,水样流动 出现
1.1.2 用玻璃片准确称取 0.05g(精确至 0.0001g)平行称两个试样,用 3#溶剂
冲洗于标有序号的 100mL 容量瓶中定容,摇匀,静止 2min,然后移液,
稀释一定倍数用丙酮溶剂定容。
1.1.3 用分光光度计于 460nm 处,用丙酮溶剂作参比液,于 1cm 比色皿中测定其
吸光度。
1.1.4 确保溶液的吸光度在 0.3-0.7 之间。
味觉
色价
E11c%m460nm
≥
色调
≥
辣椒素%
≤
沉淀物%
≤
总有机溶剂残留量(以正己烷),
mg/kg
≤
砷(以 As 计),mg/kg
≤
不得有苦味酸味等异味
50.0
50.0
0.950 0.001 2.0 25.0(入库) 40.0(出库)
3
0.800 0.002 2.6
50.0
3
铅(以 Pb 计),mg/kg ≤
3.2 准确称取样品 25g 于溶残瓶中,在 50 度水浴条件下放置 40±5min,然后在 气相色谱上测其峰面积。
3.3 计算时,样品中含有什么溶剂就以那些溶剂为标准样.即出、入库辣椒红、辣 椒精采用 95%乙醇溶剂分离的用乙丙醚和 95%乙醇溶剂为标准样,用甲醇溶剂分 离的用乙丙醚和甲醇溶剂为标准样。 3.4 由标准样的峰面积与理论值的对应关系,计算出该样品在其峰面积下的溶残 值。 3.5 当标准样出峰面积与第一次相比误差超过 15%时,标样不再用 3.6 超临界辣椒红检测溶残前,先用食用油将其稀释 1 倍,再按以上方法检测。 4.沉淀物(食品级辣椒红) 4.1 样品于 50℃水浴上预热 30 分钟; 4.2 取两支离心试管,分别称其质量 M1、M2(g); 4.3 向两离心试管各加入预热过的样品 8.00±0.10g,称其质量 M1'、M2'(g); 4.4 称好后在 1 分钟之内把两试管平衡放入离心机,在 4000r/min 条件下离心 30 分钟,取出后倒掉上部色素,擦到试管口丝扣处,于 40℃条件下控干 30min, 称其质量 M1”、 M2” 4.5 计算不溶物含量 X,%
辣椒红检测程序
天然色素应用技术推广试验
一. 各部门送来样品后,需在样品登记本上登记。
二. 样品在登记本上登记后,接样人须在检测前在《检测登记本》上
登记。 三. 样品开始检测时,检测人员须在《检测登记本》上相应的检测项
目登记自己的姓名、检测日期、时间。 四. 样品施行分区放置。 五. 样品施行专人调度,调度员一般为各组当值组长。
40
mg/kg
≤
砷(以 As 计),mg/kg
≤
3
3
铅(以 Pb 计),mg/kg ≤
2
2
灰分%
≤
1.0
1.0
EQ mg/kg
不得检出
不得检出
八.检测方法
1. 色价
1.1 检测
1.1.1 出入库样品取上中下混匀的三瓶各 15 克,于磁力搅拌器上不加热搅拌
10-15 分钟保证搅匀(若是单瓶样品直接晃匀)
25.0
50.0
≤
辣椒素% ≤
0.001
0.002
沉淀物% ≤
2.0
2.6
注:一般只测色价和水溶性,水溶性辣椒红溶剂残留和重金属含量一般都很小,
有特殊要求按特殊标准执行。
5.色素残渣 项目
合格
味觉
除辣椒特有苦醒味外,不得有异味
色价 E11c%m460nm
按实际检测值
辣度%
≤
0.15
总有机溶剂残留
量(以正己烷 500
4)要审核原始记录与台帐,保证原始记录与台帐的一致性,数据的合理性与准 确性
1.2 计算:
式(1)中:
E1% 1cm
460nm
=
Af m
×1 100
……………(1)
A——实测样品的吸光度;
f——稀释倍数;
m——样品质量(g);
460nm——辣椒红的最高吸收峰处波长。
2.色调
2.1 取检测色价时的稀释液,在分光光度计 470nm 及 454nm 处分别测其吸光度 A470 和 A454(吸光度须在 0.300-0.700 之间); 2.2 单独检测色调
气味
微小特有气味,不得有异味 特有气味,不得有异味
味觉
不得有苦味酸味等异味 不得有苦味酸味等异味
色价 E11c%m460nm
10.0-150.0
10.0-90.0
水分散性
E10-60 水溶性要求透明;E60-100 水溶性要求半透明;E100 以上要求分散均匀,不得有色素析出
总有机溶剂残留
量(以正己烷 计 ), %
计 ), %
≤
丙酮不溶物% 3
≤
6.红辣素成品
外观
项目
色价 E11c%m460nm 色调
优级品
合格品
流动性良好不得有胶粒 流动性良好不得有
沉淀出现
胶粒沉淀出现
≥
20.0
20.0
≥
0.950
0.800
沉淀物%
≤
2.0
2.6
辣椒素%
≥
0.1
0.1
已烷残留量 mg/kg
≤
25.0
25.0
总有机溶剂残留量(以正己烷计)
