江苏省包场高级中学高三化学复习素材:方程式默写8-25
江苏高中化学学业水平测试方程式整理

金属相关的方程式1.钠和氧气:常温:4Na + O2 =2Na2O 加热:2Na + O2Na2O22.铝和氧气:4Al +3O2 =2Al2O33.钠和水:2Na + 2H2O =2NaOH + H2↑离子反应:2Na + 2H2O =2Na++ 2OH—+ H2↑4.铝和盐酸:2Al + 6HCl =2AlCl3+ 3 H2↑5.铝和氢氧化钠溶液:2Al + 2NaOH + 2H2O =2NaAlO2 + 3 H2↑离子反应:2Al + 2OH—+ 2H2O =2AlO2—+ 3 H2↑6.氧化钠和水反应:Na2O + H2O =2NaOH离子反应:Na2O + H2O =2Na++2OH—7.过氧化钠和水反应:2Na2O2 + 2H2O =4 NaOH + O2↑离子反应:2Na2O2 + 2H2O =4Na++4OH—+ O2↑8.过氧化钠和二氧化碳反应:2Na2O2 + 2CO2=2Na2CO3 + O29.碳酸氢钠受热分解:2NaHCO3Na2CO3 + CO2↑ +H2O10.向饱和的碳酸钠溶液中通入CO2:11.Na2CO3 + H2O + CO2=2 NaHCO312.离子反应:CO32—+ H2O + CO2=2 HCO3—13.镁条在二氧化碳中燃烧:2Mg+CO 2C+2MgO14.氧化铝和盐酸:Al2O3+ 6HCl =AlCl3 + 3 H2O离子反应:Al2O3 + 6H+=2Al3+ + 3H2O15.氧化铝和氢氧化钠溶液:Al2O3 + 2NaOH =2NaAlO2 + H2O离子反应:Al2O3+ 2OH—=2AlO2—+ H2O16.电解氧化铝(工业炼铝):2Al2O3 4Al + 3O2↑17.氧化亚铁和盐酸:FeO + 2HCl =FeCl2 + H2O18.离子反应:FeO + 2H+=Fe2+ + 2H2O19.氧化铁和盐酸:Fe2O3 + 6HCl =2FeCl3 + 3H2O20.离子反应:Fe2O3 + 6H+=2Fe3+ + 3H2O21.铁和盐酸:Fe+ 2HCl =FeCl2 + H2↑22.(离子反应::Fe+ 2H+=2Fe2+ + H2↑)23.铁和水蒸气在高温下反应:3Fe+ 4H2O Fe3O4 +4 H2↑24.足量二氧化碳通入偏铝酸钠溶液:CO2 + NaAlO2 + 2H2O = Al(OH)3↓ +NaHCO3离子反应:CO2 + AlO2- + 2H2O = Al(OH)3↓ +HCO3-25.氢氧化铝和盐酸:Al(OH)3 + 3HCl =AlCl3 + 3H2O26.离子反应:Al(OH)3+ 3H+=Al3+ + 3H2O27.氢氧化铝和氢氧化钠溶液:Al(OH)3 + NaOH =NaAlO2 + 2H2O离子反应:Al(OH)3 + OH—= AlO2—+ 2H2O28.硫酸铝和氨水:Al2(SO4)3 + 6NH3·H2O =2Al(OH)3↓ + 3(NH4)2SO4离子反应:Al3+ + 3 NH3·H2O =Al(OH)3↓ + 3NH4+29.硫酸亚铁和氢氧化钠:FeSO4+2 NaOH =Fe(OH)2↓+Na2SO4离子反应:Fe2++ 2OH—=Fe(OH)2↓30.白色氢氧化亚铁在空气中转变灰绿色最终转化为红褐色氢氧化铁:4Fe(OH)2 + O2 + 2H2O=4Fe(OH)3电解31.氢氧化铝受热分解:2Al(OH)3Al2O3 +3H2O32.氢氧化铁受热分解:2Fe (OH)3Fe2O3 +3H2O33.氯化亚铁溶液中通入氯气2FeCl2 + Cl2 = 2FeCl3(离子反应:2 Fe2+ + Cl2 = 2 Fe3+ + 2Cl-)34.氯化铁溶液中加入铁粉或铜粉①2FeCl3 + Fe = 3FeCl2 (离子反应:2Fe3+ + Fe = 3Fe2+)②2FeCl3 + Cu = 2FeCl2 + CuCl2(离子反应:2Fe3+ + Cu = 2Fe2+ + Cu2+)35.氧化铁被一氧化碳还原(工业炼铁):Fe2O3 + 3CO 高温 2Fe + 3CO2非金属相关的化学方程式36.二氧化硅与氢氟酸:SiO2 + 4HF =SiF4↑ + 2H2O37.二氧化硅氢氧化钠:SiO2 +2NaOH =Na2SiO3 +H2O38.二氧化硅与氧化钙:SiO2+ CaO CaSiO339.实验室制备硅酸胶体:Na2SiO3+2HCl =H2SiO3↓+2NaCl40.二氧化硅与纯碱(生产玻璃):SiO2 +Na2CO3Na2SiO3 +CO2↑41.二氧化硅与石灰石:SiO2 +CaCO3CaSiO3 +CO2↑42.实验室制备氯气:MnO2+4HCl(浓)MnCl2 +2H2O +Cl243.离子反应:MnO2 + 4 H++2Cl—(浓)Mn2++2H2O +Cl2↑44.工业制备氯气和氢氧化钠:电解饱和的食盐水:2NaCl+2H2O 2NaOH+Cl2↑+H2↑45.氯气与水:Cl2+ H2O =HCl + HClO离子反应:Cl2+ H2O =H++Cl—+ HClO46.次氯酸分解:2HCl + O2↑47.氯气与氢氧化钠:Cl2 +2NaOH =NaCl +NaClO +H2O离子反应:Cl2 + 2 OH—=Cl—+ClO—+H2O48.氯气与氢氧化钙:2Cl2 + 2Ca(OH)2=CaCl2 + Ca(ClO)2 + 2H2O49.氯气与钠:2Na+Cl2 2NaCl50.氢气在氯气中燃烧:H2+Cl2 2HCl51.氯气与铁:2Fe+3Cl22FeCl352.新制氯水注入盛溴化钠溶液的试管中53.Cl2 + 2NaBr = Br2 + 2NaCl (离子反应:Cl2 + 2Br- = Br2 + 2Cl-)54.新制氯水使淀粉碘化钾试纸变蓝:55.Cl2 + 2KI = I2 + 2KCl (离子反应:Cl2 + 2I- = I2 + 2Cl-)56.硫在空气中燃烧:S + O2SO257.二氧化硫溶于水:SO2 + H2O H2SO358.亚硫酸氧化为硫酸:2H2SO3 + O2= 2H2SO459.二氧化硫与氧气催化氧化:2SO2 + O2催化剂加热2SO360.三氧化硫溶于水:SO3 + H2O =H2SO4电解61.二氧化硫与氧化钙:SO2+ CaO =CaSO362.二氧化硫与氢氧化钙:SO2 + Ca(OH)2=CaSO3 + H2O63.雷雨发庄稼:N2 + O2 2NO 2NO + O2=2NO23NO2+ 2H2O =2HNO3+ NO64.工业合成氨:N2 + 3H2催化剂高温高压2NH365.氨气和水反应:NH3 + H2O NH3·H2O66.氨水显碱性的原因:NH3·H2O NH4++ OH—67.氨水不稳定,易分解:NH3·H2O NH3↑ + H2O68.氨气与盐酸:NH3 + HCl =NH4Cl69.氯化铵分解:NH4Cl NH3↑ + HCl↑70.碳酸氢铵受热分解:NH4HCO3 NH3↑ + H2O + CO2↑71.氯化铵和氢氧化钠溶液共热:(铵盐的检验方法)72.NH4Cl+ NaOH NaCl + NH3↑ + H2O73.离子反应:NH4+ + OH—NH3↑ + H2O74.实验室制氨气的原理:2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑75.铜和浓硫酸加热:Cu + 2H2SO4(浓)△CuSO4 + SO2↑+ 2H2O76.木炭和浓硫酸加热:C + 2H2SO4(浓)△CO2↑+ 2SO2↑+ 2H2O77.铜和浓硝酸:Cu + 4HNO3 (浓) =Cu(NO3)2+ 2NO2↑ + 2H2O离子反应:Cu + 4H+ + 2NO3—=Cu2+ + 2NO2↑ + 2H2O 78.铜和稀硝酸:3Cu + 8HNO3(稀) =3Cu(NO3)2 + 2NO↑+ 4H2O离子反应:3Cu + 8H+ + 2NO3—=3Cu2+ + 2NO↑ + 4H2O 79.碳与浓硝酸反应:C + 4HNO3(浓)2H2O+CO2↑+4NO2↑80.氯气通入溴化钾溶液:Cl2 + 2NaBr =2NaCl + Br281.离子反应:Cl2 + 2Br—=2Cl—+ Br282.氯气通入碘化钾溶液:Cl2+2KI══I2+2KCl83.离子反应:Cl2 + 2I—= I2 + 2 Cl—84.溴通入碘化钾溶液:Br2 +2KI = I2 + 2 KBr85.离子反应:Br2 +2I—= I2 + 2Br—86.碳与高温下的水蒸气反应:C + H2O H2 + CO有机方程式整理:87.甲烷燃烧:CH4 + 2O2−−→−点燃CO2+ 2H2O88.甲烷与氯气反应:CH4+ Cl2 →CH3Cl + HClCH3Cl + Cl2 →CH2Cl2 + HClCH2Cl2 + Cl2 →CHCl3+ HClCHCl3 + Cl2 →CCl4 +HCl89.乙烯的燃烧:90.乙烯的加成反应:与溴水:CH2==CH2 + Br2→CH2Br—CH2Br与氢气:CH2==CH2 + H2→CH3—CH3放电与氯化氢: CH 2==CH 2 + HCl → CH 3—CH 2Cl 91. 乙烯加聚:92. 苯的燃烧:2C 6H 6 + 15O 2 −−→−点燃12CO 2 + 6H 2O93. 用C n H m 表示烃燃烧通式:94. C n H m + (n+m/4) O 2 → n CO 2 + m/4 H 2O 95. 苯的取代反应;1.与液溴反应(需铁作催化剂)96.+ Br2 纯溴)+HBr97. 2. 苯的硝化反应(55-60℃)98. +HNO 3 + H 2O99. 苯加成:与氢气 C 6H 6 + 3 H 2 → C 6H 12100. 乙醇和钠反应: 2CH 3CH 2OH + 2Na → 2CH 3CH 2ONa + H 2↑ 101. 乙醇的氧化反应:a 、 在氧气中燃烧:CH 3CH 2OH + 3O 2−−→−点燃 2CO 2 + 3H 2Ob 、 催化氧化:2CH 3CH 2OH + O 2−−→−AgCu 或 2CH 3CHO +2H 2O 102. 乙醛催化氧化:2CH 3CHO + O 2 2CH 3COOH 103. 淀粉水解:(C 6H 10O 5)n + n H 2O → n C 6H 12O 6 (葡萄糖)104. 乙酸的酸性:电离方程式CH 3COOHCH 3COO —+ H +105. 与烧碱反应:2CH 3COOH + NaOH → CH 3COONa + H 2O 106. 与纯碱反应:2CH 3COOH +Na 2CO 3 → 2CH 3COONa + H 2O + CO 2↑ 107. 乙酸和钠反应: 2CH 3COOH + 2Na → 2 CH 3COONa + H 2↑ 108. 乙酸和乙醇的酯化反应:CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3+H 2O109.浓H 2SO 455-60℃NO 2 FeBr 3 催。
江苏省包场高级中学高中化学氮及其化合物 知识点-+典型题

江苏省包场高级中学高中化学氮及其化合物知识点-+典型题一、选择题1.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。
A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是A.X使蔗糖变黑的现象主要体现了X的强氧化性B.若A为铁,则足量A与X在室温下即可完全反应C.工业上,B转化为D的反应条件为高温、常压、使用催化剂D.若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到有白色沉淀产生【答案】C【详解】X为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X是硫酸,D和水反应生成硫酸,则D 是三氧化硫,B和氧气反应生成三氧化硫,则B是二氧化硫。
A.X使蔗糖变黑的现象主要体现了X的脱水性,A错误;B.若A是铁,常温下,铁与浓硫酸发生钝化现象,所以足量铁与浓硫酸在室温下不能完全溶解,B错误;C.工业上,二氧化硫转化为三氧化硫的反应条件为450℃、常压、使用催化剂,C正确;D.若A是碳,浓硫酸和碳在加热时反应生成二氧化碳、二氧化硫和水,二氧化碳和少量氢氧化钙反应生成可溶性的碳酸氢钙,不能产生白色沉淀,D错误;故合理选项是C。
2.自然界的氮循环如下图所示,下列说法不正确的是()A.①中N2与O2反应生成NOB.②中合成氨属于人工固氮C.③中氮元素只被氧化D.氧元素参与了氮循环【答案】C【详解】A. N 2和O 2在放电作用下化合,生成NO ,NO 被氧化生成NO 2,NO 2溶于水生成硝酸,故A 正确;B. 氮的固定是指氮元素由游离态变为化合态的过程,大气中氮气转化成氮肥属于人工固氮,故B 正确;C. ③中细菌还原硝酸根中正五价的氮,生成无污染的0价的氮气,所以③中氮元素被还原,而不是被氧化,故C 错误;D. 如N 2在放电条件下与O 2直接化合生成无色且不溶于水的一氧化氮气体,氧元素参与,二氧化氮易与水反应生成硝酸(HNO 3)和一氧化氮,3NO 2+H 2O =2HNO 3+NO ,氧元素参加,故D 正确;题目要求选不正确的,故选C 。
高中化学方程式大全(默写训练版)

高考总复习之高中化学方程式总结 化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)( 10、O H NaCl NaClO Cl NaOH 222++→+11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHS O S O H NaCl 442(浓) 15、↑+−→−+∆HCl S O Na NaCl NaHS O 42416、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀) 24、4243324S O H 15PO H 6P Cu 5O H 24CuS O 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀) 27、O H 31S O K S O Fe 9S O Cr S O H 31O Fe 6O Cr K 2423423424243722+++→++)()( 28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃 43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆48、S H H S 22−→−+∆49、2CS C S −−→−+高温50、22S O O S −−→−+点燃51、O H 3S O K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 2253、2222S O 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足)55、↓+−−→−+S 3O H 2S O S H 2222点燃56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224S O H CuS S H CuS O +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeS O FeS S O H 2442(稀) 65、3222S O H O H S O ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223S O H O H S O →+68、↑++→+22424232S O O H S O Na S O H S O Na 69、O H S O Na NaOH 2S O 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2S O 2322+↓→+)( 72、23232HS O Ca O H CaS O S O )(→++73、O H 2S 3S H 2S O 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222S O 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+ 79、4232S O H S O O H →+第四节 硫酸 硫酸盐80、O H 2S O 2CO S O H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2S O 3S O H 2S 2242+↑−→−+∆(浓) 82、O H 2S O PO H S O H P 224342+↑+−→−+∆(浓) 83、O H 2S O S S O H S H 22422++−→−+∆(浓) 84、O H 2S O CuS O S O H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaS O S O H BaCl 4422+↓→+86、NaCl 2BaS O S O Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO89、↑++→+222333CO O H NO Ba HNO 2BaCO )( 90、↑++→+2223232CO O H S Na S O H CO Na91、42232S O H 2O S O H 2→+92、42232S O Na 2O S O Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3S O Fe S O H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H S O Na S O Br S O H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2S O Na S O H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuS O O H 2Na 2)( 第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+ 111、O H CO NaCl HCl NaHCO 223+↑+→+112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)( 120、O H S O NaCl HCl NaHS O 223+↑+→+120、HCl NaHSO +3第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
2019江苏高考化学方程式集锦(全国通用)(20200731163635)

江苏高考化学方程式集锦一、氯及其重要化合物I. H2+ CI2= 2HCI (条件:点燃或光照)2.2Na + CI2 = 2NaCI (条件:点燃)3.Cu + Cl2= CuCl2 (条件:点燃)4.2Fe + 3CI2= 2FeCl3 (条件:点燃)5.4HCI (浓)+ MnO = MnC2 + CI2 f + 2H2O (条件:加热)6.2NaCI + 2H2O= H2 f + Cl2f + 2NaOH(条件:通电)7. CI 2+H?O? HCI+HCIO8. CI 2+ 2NaOH= NaCI+ NaCIO+ H?O9.2CI 2 + 2Ca(OH)2= CaCl2+ Ca(CIO)2 + 2H2O10.4HCI + Ca(CIO)2= CaCl2 + 2H0+ 2CI2 fII. SOACI ?+2H?O=HSO+2HCI12. CI 2+2NaBr=2NaCI+Br213. Br 2+2NaI =I 2+2NaBr14.2KI+2FeCI 3=2FeCl2+2KCI+I 2二、氮及其重要化合物1. N2+3H2? 2NH5(条件:高温、高压、催化剂)2. N2+Q=2NO(条件:放电)3.2NO+Q=2NO4.3NO2+H?O=2HN3>NO5.4NO2+2H2O+O=4HNO6.2NO2? 207.2NO2+2NaOH=NaN®NaNO+HzO8.NH3+HO? NH3 • H2O9.4NH3+5Q=4NO+6HO (条件:高温、高压、催化剂)10. NH3+HCI=NHCI11. NH4CI=NH3 f +HCI f(条件:加热)12. NH4HCO=NH f +CO f +H2O(条件:加热)13. NH3 • HO=NH+H2O (条件:加热)14. Ca(OH)2 +2Nh4CI=CaCl2+2NH3f +HO (条件:加热)H H15. N H4+H2O? NH3 • HzO+ (水解)16.4HNQ=4NO f +Q f +H2O(条件:光照或加热)17.CU+4HNO (浓)=Cu(NO)2+2NO f +2冲O 18.3CU+8HNO (稀)=3C U (NQ)2+2NOT +4H2O 19.C+4HNO(浓)=CO f +4NO f +2H2O (条件:加热)三、氧、硫及其重要化合物I. 302=203 (条件:放电)2.2H2Q=2H2O+O f(条件:二氧化锰催化剂)3.2KMnO+5H2Q+2H2SO=K2SO+MnSO+502 f +2H2O4.2FeCI 2+H2Q+2HCI=2FeCI 3+2H205.5 + Fe= FeS (条件:加热)6.5 + 2Cu= Cu2S (条件:加热)7.S+O2=SO (条件:点燃)8.2SO2+Q? 2SO3 (条件:催化剂、加热)9. Z nS + 2HCI = Zn CI2+ HzS f10.2H2S+ SQ = 3S J + 2H2OII. H2S+ CuSO= H2SO+ CuSj(黑色)12.4FeS2+11Q=2Fe2O+8SO (条件:高温)13.2H2SO (浓)+Cu=CuSO+SO f +2H2O (条件:加热)14.2H2SO (浓)+ C= CQ f + 2H?O+ 2SO f (条件:加热)四、重要有机官能团的性质1. BrCH2-CH2Br+2NaOH》HOCHCH2OH+2NaBr(条件:水溶液、加热)2. BrCH2-CH2Br+2NaOH》CH三CH+2NaBr+2HO (条件:醇溶液、加热)3.2Na+CH3CH2OH ' CHCKONa+Hf4. C2H5OH+HCH C2H5CI+H2O(条件:加热)5.2CH3CHOH+OT 2CHCHO+22O (条件:铜、加热)2CH3CHO+O ' 2CHJCOO H条件:催化剂、加热)6. CH3CHOH+C3COO L CHCOOCCH+HzO (条件:浓H2SO4 加热)7. C6H5OH+NaCO T C5H5ONa+NaH(3O8. C6H5OH+NaO H CsHsONa+HO9. CH3CHO+2Ag(NH 2O出CH3COONHHO+2AgJ +3NH3 CHCHO+出CHCHOH (条件:催化齐V、加热)1O.2R-COOH+NaCO 宀2R-COONa+C0 +HO11. R COOR'+NaO H RCOONa+R'OH条件:加热)五、钠及其重要化合物1.2Na+O2=2Na2O2.2Na+O2=Ns2Q (条件:点燃)3.2Na+2H2O=2NaOH+H4.2Na TO^HOnANaOH+O5.2Na2Q+2CO=2Na2CO+Q6.2NaHCO=Na2CO+H2O+COf(条件:加热)7.2NaHCO+Ca(OH)2 (不足)=Ns2CO+CaCOj +2H2O8. NaHCO+Ca(OH)(足量)=CaCOj +NaOH+HO六、镁、钙及其重要化合物1.Mg+2H2O=Mg(OH2+H2f(条件:加热)2.2Mg+Q=2MgO(条件:点燃)3.3Mg+N?=Mg$N t (条件:点燃)4.2Mg+CQ=2MgO+(条件:点燃)5.Mg3N2+6H2O=3Mg(OH) J +2NH3 f6.2CaO2+2HzO=2Ca(OH2+C2 f7. CaO+HO=Ca(OH28. CO2+Ca (OH 2—CaCO j +H2O七、铝及其重要化合物I. 2AI+6HCI=2AICI 3+3H2f2.2AI+2NaOH+HaO=2NaAIO+3H2 f3.2AI+ Fe 2C3=Al2C3+ 2Fe (条件:高温)4. AI 2Q+ 6HCI=2AICI 3+3H2O5. AI 2O3+2NaOH=2NaAIOH2O6.2AI ?O?=4AI+3O?f(条件:冰晶石、通电)7. AI(OH) 3+ NaOH=NaAIO+2HzO8. AI(OH) 3+3HCI=AICI 3+3H2O9. AI 2(SO4) 3+ 6NH H2O= 2AI(OH) 3 J + 3(NH4) 2SO10. AICI 3+3NaOH=AI(OH> J +3NaCIII. AICI 3+3NaHCO=3NaCI+ AI(OH) 3 J +3CO f12. NaHCO+NaAIO2+H2O=AI(OH)3 J +Na2CO13. AICI ?+3NaAIO?+6H?D=3NaCI+4AI(OH) ?J八、铁及其重要化合物I. 3Fe+4H2O (g) =Fe3Q+4H22. Fe (不足)+4HNO(稀)=Fe(NO3)3+NO? +2H?O3.3Fe (过量)+8HNO(稀)=3Fe(NO3) 2+2NOT +4H2O4. Fe 2Q+6HNO=2Fe(NQ) 3+3HO5. Fe 3C4+8HCI=2FeCl3+FeCl2+4HzO6. Cu+2FeCI ?=2FeCI?+CuCI?7. Fe+2FeCI 3=3FeCI 28.2FeCI 3+HzS=2FeCl2+2HCI+S j9. FeCI 3+3H2C? 3HCI+Fe(OH)3 (胶体)10. FeCI 3+3KSCN=Fe(SCg (血红色)+3KCI3II. FeCI ?+3NHP- H?O=Fe(OH)?J +3NHCI12.2FeCI 2+Cl2=2FeCl313.3FeCI 2+4HNO=2FeCl3+Fe(NQ) 3+2H2O+NQ14.30FeCI2+6KMnO+24H2SO4=3K2SQ+6MnSO+2OFeCl3+5Fe2(SO4)3+24H2O 15.FeCI 2+2NaOH=Fe(OH»J +2NaCI16.4Fe(OH) 2+O2+2H2O=4Fe(OH)317.2Fe(OH) 3=Fe2O3+3H?O (条件:加热)九、碳、硅及其重要化合物1. C+4CuO=2CuO+COf(条件:高温)2. C+H2O(g)=CO+H (条件:高温)3. CuO+CO=Cu+CO(条件:高温)4.3CO+F4O3=2Fe+3CO (条件:高温)5. NaOH+CO (过量)=NaHCO6.2NaOH+CO (不足)=Na2CO+HO7.2NaOH (足量)+ Ca(HCO)2=CaCO J + Na2CO + 2H2O8. NaOH (不足)+ Ca(HCO)2=CaCO J + NaHCO H H2O9.2NaHCO=Na2CO+H2O+C Of (条件:加热)10.510 2+ 4HF= SiF4f + 2H2O11.510 2+ 2NaOH= Na2SiO3+ H2O12.510 2+ 2C=Si (粗硅)+ 2COf (条件:高温)13.Si (粗硅)+ 2Cl2=SiCl4 (条件:加热)14.SiCl 4+ 2H2=Si (纯硅)+ 4HCI (条件:高温)15.Na2SiO3 + CO+ H?O= H2SQ3J+ Na z CO。
高中化学高频考点方程式记背

1、2Na+2H2O=2NaOH+H2↑,2Na+2H2O=2Na++2OH-+H2↑(浮、游、熔、响、红)2、2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑ (蓝色沉淀和无色气体)2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑(同样有浮、游、熔、响的现象哦!)3、2Na2O2+2CO2=2Na2CO3+O2(Na2O2+SO2=Na2SO4相似中有差异!)4、2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2H2O=4Na++4OH-+O2↑ (作供氧剂)5、Na2CO3+H2O+CO2=2NaHCO3,CO32-+H2O+CO2=2HCO3-(若是饱和Na2CO3溶液的话,就会有沉淀生成哦!)6、2NaHCO3+Ca(OH)2(少量)=CaCO3↓+Na2CO3+2H2O2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O7、NaHCO3+Ca(OH)2(过量)=CaCO3↓+NaOH+H2OHCO3-+Ca2++OH-=CaCO3↓+H2O(亲,若Ca2+有剩余的话产物中就不会有CO32-哦!)8、2Al+2NaOH+6H2O=2Na[Al(OH)4] +3H2↑2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑(都考滥了,用小拇指也能记住了!)9、2Al+Fe2O3高温Al2O3+2Fe ,8Al+3Fe3O4高温4Al2O3+9Fe(焊接钢轨)10、Al2O3+2NaOH+ 3H2O=2Na[Al(OH)4] Al2O3+2OH-+ 3H2O=2[Al(OH)4] -11、NaOH+Al(OH)3=Na[Al(OH)4] OH-+Al(OH)3=[Al(OH)4]–12、 AlCl3+4NaOH =Na[Al(OH)4] + 3NaCl Al3++4OH- =[Al(OH)4] - +2H2O13、实验室制备氢氧化铝:Al3++3NH3·H2O=A l(O H)3↓+3NH4+14、Na[Al(OH)4] +HCl(少量)=Al(OH)3↓+NaCl+ H2O[Al(OH)4] - + H+(少量)=Al(OH)3↓+H2O(1:1哦,你懂的!)15、Na[Al(OH)4] +4HCl(过量)=AlCl3+NaCl+ 2H2O[Al(OH)4] - + 4H+(过量)=Al3++4H2O(1:4哦,你懂的!)16、2 Na[Al(OH)4] +CO2(少量)=2Al(OH)3↓+Na2CO3+H2O2[Al(OH)4] - + CO2(少量)=2Al(OH)3↓+CO32-+H2O17、Na[Al(OH)4]+CO2(过量)=Al(OH)3↓+NaHCO3(与16的差别在钠盐哦!)[Al(OH)4] - + CO2(过量)=Al(OH)3↓+HCO3-(氢氧化铝不会溶解的!)18、3Na[Al(OH)4]+AlCl3=4Al(OH)3↓+NaCl 3[Al(OH)4] - + Al3+=4Al(OH)3↓19、明矾净水的原理:Al3++3H 2O Al(OH)3+3H+或者Al3++3H2O=Al(OH)3(胶体)+3H+(再加上必要的文字叙述哦!)20、3Fe+4H2O(g)高温Fe3O4+4H221、4Fe(OH)2+O2+2H2O=4Fe(OH)3(白色沉淀迅速变为灰绿色,最后变为红褐色)22、2FeCl2+Cl2=2FeCl3 2Fe2++Cl2=2Fe3++2Cl-(浅绿色变棕黄色)23、2FeCl3+Fe=3FeCl22Fe3++Fe=3Fe2+(棕黄色变浅绿色)24、2FeCl3+Cu=2FeCl2+CuCl2 2Fe3++Cu=2Fe2++Cu2+(腐蚀印刷线路板)25、FeCl3+3KSCN=Fe(SCN)3+3KCl Fe3++3SCN-= Fe(SCN)3(检验Fe3+)26、FeCl3+3H2O △Fe(O H)3(胶体)+3H Cl(制备氢氧化铁胶体)Fe3++3H2O △Fe(O H)3(胶体)+3H+27、2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O 2Fe2++H2O2+2H+=2Fe3++2H2O28、2Mg + CO2点燃2MgO+C(发出耀眼的光,生成白烟,瓶壁上有黑色颗粒附着)29、Mg+2H2O△Mg(OH)2+H2↑(可与钠与水反应对比来证明钠的金属性强于镁)30、海水提镁的化学方程式:CaCO3高温CaO+CO2↑ CaO+H2O=Ca(OH)2MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2Mg(OH)2+2HCl=MgCl2+2H2OMgCl2(熔融)Mg+Cl2↑(海边的贝壳既好看又有用哦!)31、2Cu+S △Cu2S (黑色固体)32、Cu+Cl2CuCl2(产生棕黄色的烟)33、2H2SO4(浓)+Cu△CuSO4+SO2↑+2H2O(不可写离子方程式,硫酸变稀反应停止)34、3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O (可用于实验室制备NO气体)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (35可用于实验室制备NO2气体)35、Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O Cu+4H++2NO3-=Cu2++2NO2↑+2H2O36、2Cu+O2+CO2+H2O=Cu2(OH)2CO3(铜在空气中被腐蚀形成铜绿,不是所有的金属被腐蚀都生成氧化物哦!)37、3CuO+2NH3△3Cu+N2+3H2O (氨气的还原性)39、Cu2(OH)2CO32CuO+H2O+CO2↑40、Cl2+H2O=HCl+HClO,Cl2+H2O=H++Cl-+HClO (溶于水的氯气不能全部反应)41、Cl2+2NaOH=NaCl+NaClO+H2O,Cl2+2OH-=Cl-+ClO-+H2O(吸收多余的氯气)42、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(工业制取漂白粉)43、2HClO2HCl+O 2↑(氯水需要保存在棕色瓶中,置于冷暗处的原因)44、Na2S + Cl2=2NaCl+S↓ ,S2- + Cl2=2Cl-+S↓(可证明氯的非金属性比硫强)45、SO2+Cl2+2H2O=H2SO4+2HCl SO2+Cl2+2H2O=4H++SO42-+2Cl-46、MnO2+4HCl(浓)△MnCl2+Cl2↑ +2H2O(盐酸变稀后反应停止)MnO2+4H++2Cl-△Mn2++Cl2↑ +2H2O(实验室制氯气)47、2NaCl+2H2O2NaOH+H2↑+Cl2↑(工业制氯气)2Cl-+2H2O2OH-+H2↑+Cl2↑(氢气和碱在阴极区产生)48、Ca(ClO)2 +CO2+ H2O=CaCO3↓+2HClO (漂白粉的漂白原理)Ca2++2ClO-+ H2O+ CO2=CaCO3↓+2HClO(将CO2改成SO2产物可不是CaSO3哦!)49、SO2+2H2S=3S↓+2H2O(二氧化硫表现氧化性)50、2H2SO4(浓)+C△CO2↑ +2SO2↑+2H2O(检验产物的顺序:H2O、SO2、CO2)51、Na2SO3+ H2SO4(浓)= Na2SO4+ SO2↑+H2O(实验室制二氧化硫)52、Na2SO3+ 2Na2S+6HCl=6NaCl+3S↓+3H2O,SO32-+2S2-+6H+=3S↓+3H2O(SO32-与2S2-在酸性条件下不共存,在碱性条件下能共存)53、N2+O22NO(自然固氮中的高能固氮,直接不能生成NO2哦!)54、3NO2+H2O=2HNO3+NO,3NO2+H2O=2H++2NO3-+NO(对应电子转移数是2)55、4NH3+5O24NO+6H2O(工业氨氧化法制硝酸的基础)56、NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl (侯氏制碱法,记住先通氨气哦!)57、2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O (实验室制氨气,还有一种好方法哦!)58、NH4++OH-NH3↑+H2O(铵根离子的检验方法:加碱、加热、验氨)59、4HNO3(浓)+C△CO2↑+4NO2↑+2H2O(浓硝酸的系数怎么那么多4啊!)60、4HNO34NO2↑+O2↑+2H2O(见光或受热分解,置于棕色瓶中,放在冷暗处)61、C+H2O高温CO+H2(这是煤的气化的主要反应,煤的气化是化学变化)62、2C+SiO2高温Si+2CO↑(工业制粗硅)(产物不是CO2哦!)63、2NaOH(过量) +CO2=Na2CO3+H2O 2OH-+ CO2=CO32-+H2O64、NaOH +CO2(过量)=NaHCO3OH-+ CO2=HCO3-65、CaCO3+2H+=Ca2++CO2↑+H2O(二氧化碳的实验室制法)66、NaOH +SiO2=Na2SiO3+H2O ,2OH-+ SiO2=SiO32-+H2O(常温下强碱缓慢腐蚀玻璃,生成矿物胶Na2SiO3,不能用磨口玻璃塞的试剂瓶保存强碱性溶液)67、SiO2+Na2CO3高温Na2SiO3+CO2↑(工业制玻璃)68、SiO2+CaCO3高温CaSiO3+CO2↑(工业制玻璃)69、SiO2+4HF=SiF4↑+2H2O(氢氟酸刻蚀玻璃)70、Na2SiO3 + 2HCl == H2SiO3↓+ 2NaCl ,SiO32- + 2H+ == H2SiO3↓(制取硅酸)71、Na2SiO3 +CO2(少量)+ H2O == H2SiO3↓+ Na2CO3SiO32- + CO2(少量)+ H2O == H2SiO3↓+ CO32-72、Na2SiO3 +2CO2(过量)+2H2O == H2SiO3↓+ 2NaHCO3SiO32- + 2CO2(过量)+2 H2O == H2SiO3↓+ 2HCO3-73、2H2O2 2H2O+O2↑(实验室制氧气)74、2KClO32KCl+ 3O2↑(实验室制氧气)75、NaHSO4在水中和在熔融状态下的电离方程式。
高中化学必背方程式大全

高中化学必背方程式大全高中化学必背方程式大全高中化学必背方程式1、碳酸钠的第一步水CO32-+H2O HCO3-+OH-2、氯化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓3、硫溶于热的氢氧化钠溶液:3S+6OH-=2S2-+SO32-+3H2O4、醋酸钡溶液与硫酸反应:Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH5、醋酸与氢氧化钾溶液反应:CH3COOH+OH-=CH3COO-+H2O高中化学必背方程式1、醋酸与氨水反应:CH3COOH+NH3?H2O=CH3COO-+NH4++2H2 O2、苯酚溶于氢氧化钠溶液:C6H5OH+OH-=C6H5O-+H2O3、苯酚与氯化铁溶液反应:6C6H5OH+Fe3+=[Fe(C6H5O)6]3-+6H+4、苯酚钠溶于醋酸溶液:C6H5O-+CH3COOH=C6H5OH+CH3COO-5、苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-高中化学必背方程式1、碳酸钠溶液中加入过量苯酚:C6H5OH+CO32-=C6H5O-+HCO3-2、碳酸钙跟甲酸反应:CaCO3+HCOOH=Ca2++CO2↑+H2O+HCOO-3、甲酸钠跟盐酸反应:HCOO-+H+=HCOOH4、小苏打溶液与甲酸溶液反应:HCOOH+HCO3-=CO2↑+H2O+HCOO-5、Na2C2O4溶液中加入酸性高锰酸钾溶液:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O高中化学必背方程式1、酸性高锰酸钾溶液与双氧水:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O 2、酸性氯化亚铁溶液与双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O3、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+4、乙烯通入酸性高锰酸钾溶液生成CO2:5C2H4+12MnO4-+36H+=10CO2↑+12Mn2++28H2O5、乙酸乙酯与氢氧化钠溶液:CH3COOCH2CH3+OH-=CH3COO-+HOCH2CH3高中化学必背方程式1、硬脂酸甘油酯与氢氧化钠溶液:(C17H35COO)3(C3H5O3)+3OH-=3C17H35C OO-+CH2(OH)CH(OH)CH2OH2、氯乙烷在氢氧化钠溶液中水CH3CH2Cl+OH-=CH3CH2OH+Cl-3、硝酸银溶液中滴入少量氨水:Ag++NH3?H2O=AgOH↓+NH4+4、硝酸银溶液中滴加氨水至过量:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O5、葡萄糖发生银镜反应:CH2(OH)(CHOH)4CHO+2[Ag(NH3)2]++2OH-=CH2(OH)(CHOH)4COO-+NH4++3NH3+H2O +2Ag↓高中化学必背方程式1、硫酸铜溶液中加入氢氧化钠溶液:Cu2++2OH-=Cu(OH)2↓2、硫酸铜溶液中加入少量氨水:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+ 3、硫酸铜溶液中加入过量氨水:Cu2++4NH3?H2O=[Cu(NH3)4]2++4H2O 4、硫酸锌溶液中加入少量氨水:Zn2++2NH3?H2O=Zn(OH)2↓+2NH4+ 5、硫酸锌溶液中加入过量氨水:Zn2++4NH3?H2O=[Zn(NH3)4]2++4H2O。
江苏省包场高级中学高中化学硫及其化合物 知识点-+典型题
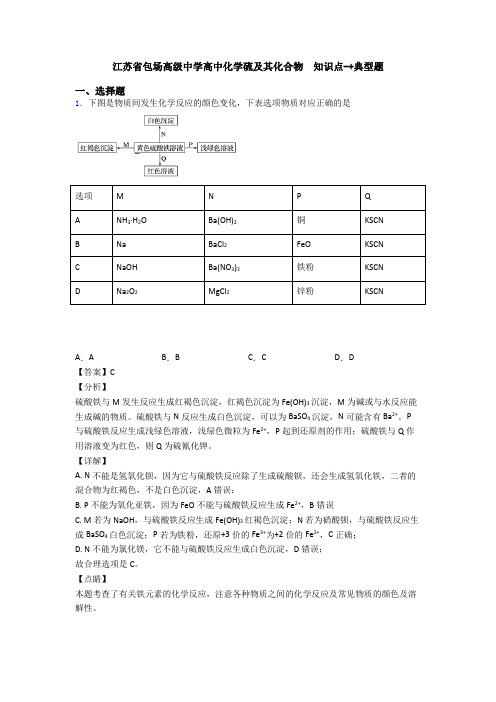
江苏省包场高级中学高中化学硫及其化合物知识点-+典型题一、选择题1.下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是选项M N P QA NH3·H2O Ba(OH)2铜KSCNB Na BaCl2FeO KSCNC NaOH Ba(NO3)2铁粉KSCND Na2O2MgCl2锌粉KSCNA.A B.B C.C D.D【答案】C【分析】硫酸铁与M发生反应生成红褐色沉淀,红褐色沉淀为Fe(OH)3沉淀,M为碱或与水反应能生成碱的物质。
硫酸铁与N反应生成白色沉淀,可以为BaSO4沉淀,N可能含有Ba2+。
P 与硫酸铁反应生成浅绿色溶液,浅绿色微粒为Fe2+,P起到还原剂的作用;硫酸铁与Q作用溶液变为红色,则Q为硫氰化钾。
【详解】A. N不能是氢氧化钡,因为它与硫酸铁反应除了生成硫酸钡,还会生成氢氧化铁,二者的混合物为红褐色,不是白色沉淀,A错误;B. P不能为氧化亚铁,因为FeO不能与硫酸铁反应生成Fe2+,B错误C. M若为NaOH,与硫酸铁反应生成Fe(OH)3红褐色沉淀;N若为硝酸钡,与硫酸铁反应生成BaSO4白色沉淀;P若为铁粉,还原+3价的Fe3+为+2价的Fe2+,C正确;D. N不能为氯化镁,它不能与硫酸铁反应生成白色沉淀,D错误;故合理选项是C。
【点睛】本题考查了有关铁元素的化学反应,注意各种物质之间的化学反应及常见物质的颜色及溶解性。
2.下列变化中,不属于化学变化的是()A.SO2使品红溶液褪色B.氯水使有色布条褪色C.活性炭使红墨水褪色D.漂白粉使某些染料褪色【答案】C【分析】产生新物质的变化是化学变化。
【详解】A. SO2具有漂白性,与品红结合生成不稳定的无色物质,发生了化学变化而使品红溶液褪色,A项错误;B. 氯水中存在HClO,HClO具有强氧化性,能使有色布条褪色,发生了化学变化,B项错误;C. 活性炭使红墨水褪色是因为活性炭具有吸附性,没有产生新物质,没有发生化学变化,C 项正确;D. 漂白粉的有效成分是Ca(ClO)2,与CO2等物质结合生成HClO,HClO具有强氧化性,能使有色物质褪色,过程中发生了化学变化,D项错误;答案选C。
江苏高级中学考试化学知识点复习.doc

2016江苏高考化学知识点复习2016江苏高考化学知识点复习(一)1) 、可使湿润的红色石蕊试纸变蓝的气体:NH3。
有漂白作用的气体:Cl2(有水时)和SO2,但两者同时使用时漂白效果减弱。
检验Cl2常用淀粉碘化钾试纸,Cl2能使湿润的紫色石蕊试纸先变红后褪色。
2)、能使澄清石灰水变浑浊的气体:CO2和SO2,但通入过量气体时沉淀又消失,鉴别用品红。
3)、有毒的气体:F2、HF、Cl2、H2S、SO2、CO、NO2、NO、Br2(g)、HCN。
4) 、常温下不能共存的气体:H2S和SO2、H2S和Cl2、HI和Cl2、NH3和HCl、NO和O2、F2和H2。
5)、其水溶液呈酸性的气体:HF、HCl、HBr、HI、H2S、SO2、CO2、NO2、Br2(g)。
2016江苏高考化学知识点复习(二)1) 往某溶液中逐滴加入稀盐酸,出现浑浊的物质:第一种可能为与Cl-生成难溶物。
包括:①AgNO3第二种可能为与H+反应生成难溶物。
包括:①S2O32-离子方程式:S2O32-+2H+=S +SO 2+H2O②可溶性硅酸盐(SiO32-),离子方程式为:SiO32-+2H+=H2SiO3③一些胶体如Fe(OH)3(先是由于Fe(OH)3的胶粒带负电荷与加入的H+发生电荷中和使胶体凝聚,当然,若继续滴加盐酸至过量,该沉淀则会溶解。
)若加HI溶液,最终会氧化得到I2。
④苯酚钠溶液加盐酸生成苯酚浑浊液。
⑤AlO2- 离子方程式:AlO2- +H+ +H2O==Al(OH)3当然,若继续滴加盐酸至过量,该沉淀则会溶解。
2) SO2能作漂白剂。
SO2虽然能漂白一般的有机物,但不能漂白指示剂如石蕊试液。
SO2使品红褪色是因为漂白作用,S O2使溴水、高锰酸钾褪色是因为还原性,SO2使含酚酞的NaOH溶液褪色是因为溶于不生成酸。
3) SO2与Cl2通入水中虽然都有漂白性,但将二者以等物质的量混合后再通入水中则会失去漂白性,2016江苏高考化学知识点复习(三)1) 、可导致酸雨的主要气体:SO2;NO2。
高级中学化学方程式全套汇编(高考必备)

目录一、高一化学方程式总结 (2)二、氯的化学方程式: (4)三、氯的离子方程式: (4)四、铝的化学反应方程式 (5)五、铜的化学反应方程式 (6)六、铁的化学方程式 (6)七、高中常用的离子方程式 (7)一、高一化学方程式总结(1) 硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl(2) 碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl(3) 碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑(4) 木炭还原氧化铜: 2CuO + C(高温)2Cu + CO2↑(5) 氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl(6) 氧化物的反应a) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Ob) 氧化钙与水反应:CaO + H2O = Ca(OH)2c) 氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2Od) 氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2Oe) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl(7) Na的化学反应方程式a) 钠在空气中燃烧:4Na + O2 = 2Na2Ob) 钠与氧气反应:2Na + O2 △ Na2O2 过氧化钠c) 过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑d) 过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2e) 钠与水反应:2Na + 2H2O = 2NaOH + H2↑(8) Fe及化合物的化学反应方程式a) 铁与水蒸气反应:3Fe + 4H2O(g) = 高温=F3O4 + 4H2↑b) 铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cuc) 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2Od) 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCle) 硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4f) 氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3g) 氢氧化铁加热分解:2Fe(OH)3 △Fe2O3 + 3H2O↑h) 三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2i) 氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3(9) Al及其化合物的化学反应方程式a) 铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑b) 实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH3)2SO4c) 氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2Od) 氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2Oe) 氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2Of) 二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2Og) 硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑h) 二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3i) 二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2Oj) 往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓ k) 硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓(10) Cl及其化合物的反应方程式a) 氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl3b) 氯气与金属铜反应:Cu + Cl2 点燃CuCl2c) 氯气与金属钠反应:2Na + Cl2 点燃2NaCld) 氯气与水反应:Cl2 + H2O = HCl + HClOe) 次氯酸光照分解:2HClO 光照2HCl + O2↑f) 氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2Og) 氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2Oh) 盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO3i) 漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO(11) N及其化合物的反应方程式a) 氮气与氧气在放电下反应:N2 + O2 放电2NOb) 一氧化氮与氧气反应:2NO + O2 = 2NO2c) 二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NOd) 二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂2SO3e) 三氧化硫与水反应:SO3 + H2O = H2SO4(12) 氨及其反应方程式a) 氨水受热分解:NH3·H2O △NH3↑ + H2Ob) 氨气与氯化氢反应:NH3 + HCl = NH4Clc) 氯化铵受热分解:NH4Cl △NH3↑ + HCl↑d) 碳酸氢氨受热分解:NH4HCO3 △NH3↑ + H2O↑ + CO2↑e) 硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △NH3↑ + NaNO3 + H2Of) 氨气的实验室制取:2NH4Cl + Ca(OH)2 △CaCl2 + 2H2O + 2NH3↑g) 氯气与氢气反应:Cl2 + H2 点燃2HClh) 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑ + Na2SO4 + 2H2Oi)(13) S及其化合物的化学反应方程式a) SO2 + CaO = CaSO3b) SO2 + 2NaOH = Na2SO3 + H2Oc) SO2 + Ca(OH)2 = CaSO3↓ + H2O d) SO2 + Cl2 + 2H2O = 2HCl + H2SO4e) SO2 + 2H2S = 3S + 2H2Of) 二氧化硫与水反应:SO2 + H2O ≈ H2SO3g) 浓硫酸与铜反应:Cu + 2H2SO4(浓) △ Cu SO4 + 2H2O + SO2↑h) 浓硫酸与木炭反应:C + 2H2SO4(浓) △CO2 ↑+ 2SO2↑ + 2H2Oi) 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑ + Na2SO4 + 2H2Oj)(14) N及其化合物的反应方程式a) NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2Ob) 浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑c) 稀硝酸与铜反应:3Cu + 8HNO3(稀) △ 3Cu(NO3)2 + 4H2O + 2NO↑(15) 硅Si的反应方程式冶炼纯硅a) Si + 2F 2 = SiF4 b ) Si + 2NaOH + H2O = NaSiO3 +2H2↑b) 硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉Si + 2CO (石英沙)(焦碳)(粗硅)c) 粗硅转变为纯硅:Si(粗)+ 2Cl2 △ SiCl4 SiCl4 + 2H2 高温== Si(纯)+ 4HCl二、 氯的化学方程式: 1)C l2+SO2+ 2H2O = H2SO4+2HCl2)2HCl = H2+Cl23)2NH3+3Cl2 = N2+6HCl4)8NH3+3Cl2 = N2+6NH4Cl5)S i(粗)+2Cl2 = SiCl46)C +2Cl2 = CCl47)C l2 +H2 = 2HCl8)3Cl2 +2P = 2PCl39)C l2 +PCl3 = PCl510)C l2 +2Na = 2NaCl11)3Cl2 +2Fe = 2FeCl312)C l2 +2FeCl2 = 2FeCl313)C l2+Cu = CuCl214)2Cl2+2NaBr = 2NaCl+Br215)C l2 +2NaI = 2NaCl+I216)5Cl2+I2+6H2O = 2HIO3+10HCl17) l2 +Na2S = 2NaCl+S 18) l2 +H2S = 2HCl+S 19) l2+SO2 +2H2O = H2SO4 +2HCl 20) l2 +H2O2 =2HCl+O2 21) KClO3与浓HCl 发生如下反应: KClO3+6HCl→KCl+3Cl2↑+3H2O, 该反应中被氧化的氯元素与被还原的氯元素的质量比是: D A.6:1 B.1:6 C.3:1 D.5:1 1个Cl 由-1 到-1,未变。
高中会考必背化学方程式

高中会考必背化学方程式1.钠在空气中氧化: 4Na+O2=2Na2O2.钠的燃烧: 2Na+O2 Na2O23.钠与水反应(现象:浮、熔、游、响、红): 2Na+2H2O=2NaOH+H2↑4.碳酸钠与盐酸反应: Na2CO3+2HCl=2NaCl + H2O+CO2↑5.碳酸氢钠的受热分解: 2NaHCO3 Na2CO3+H2O+CO2↑6.碳酸氢钠与氢氧化钠反应: NaHCO3+NaOH=Na2CO3+H2O离子方程式: HCO3-+OH-=CO32-+H2O7、碳酸氢钠与盐酸反应: NaHCO3+HCl=NaCl+H2O+CO2离子方程式: HCO3-+H+=H2O+CO2↑8、镁与氧气反应: 2Mg+O2 2MgO9、镁与二氧化碳反应: 2Mg+CO2 2MgO+C10、铝与氧气反应: 4Al+3O2 2Al2O311.铝热反应: 2Al+Fe2O3 Al2O3+2Fe12.铝与盐酸反应: 2Al+6HCl=2AlCl3+3H2↑离子方程式: 2Al+6H+=2Al3++3H2↑13.铝与氢氧化钠溶液反应: 2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式: 2Al+2OH-+2H2O=2AlO2-+3H2↑Al2O3是两性氧化物14.氧化铝与盐酸反应: Al2O3+6HC=2AlCl3+3H2O离子方程式: Al2O3+6H+=2Al3++3H2O15.氧化铝与氢氧化钠溶液反应: Al2O3+2NaOH=2NaAlO2+H2O离子方程式: Al2O3+2OH-=2AlO2-+H2OAl(OH)3是两性氢氧化物16.氢氧化铝与盐酸反应: Al(OH)3+3HCl=AlCl3+3H2O离子方程式: Al(OH)3+3H+=Al3++3H2O17、氢氧化铝与氢氧化钠溶液反应: Al(OH)3+NaOH=NaAlO2+2H2O 离子方程式: Al(OH)3+OH-=AlO2-+2H2O18、铁在氯气中燃烧: 3Cl2 +2Fe 2FeCl319、氯气与铜的反应: Cl2+Cu CuCl220、氯气与钠的反应: Cl2 +2Na 2NaCl21.氯气与氢气的反应: Cl2 +H2 2HCl22.氯气与水的反应: (氯气溶于水)Cl2+H2O HCl+HClO23.次氯酸不稳定见光或受热分解: 2HClO 2HCl+O2↑24.工业制漂粉粉: 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O25.大气固氮(氮气与氧气反应): N2+O2 2NO (放电)26.工业固氮(合成氨): N2+3H2 2NH327、二氧化氮与水反应: 3NO2+H2O=2HNO3+NO28、氨与水反应: NH3+H2O NH3·H2O29、氨与氯化氢反应: NH3+HCl=NH4Cl30、氨与氧气反应: 4NH3+5O2 4NO+6H2O31.铵盐受热分解: NH4Cl NH3↑+HCl↑NH4HCO3 NH3↑+H2O+CO2↑32.铵盐与碱反应: 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O(实验室制氨气)33.浓硝酸与铜反应: Cu +4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O34.浓硝酸与木炭反应: 4HNO3(浓)+C CO2↑+4NO2↑+2H2O35、浓硝酸分解反应: 4HNO3 4NO2↑+O2↑+2H2O(见光或受热分解)36.浓硝酸常温下能使铁、铝钝化37、稀硝酸与铜反应: 3Cu +8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O38、二氧化硫与氧气反应: 2SO2+O2 2SO339、二氧化硫与水反应: SO2+H2O H2SO340、三氧化硫与水反应: SO3+H2O=H2SO441.浓硫酸与铜反应: 2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O42、浓硫酸与木炭反应: 2H2SO4(浓)+C CO2 ↑+2SO2↑+2H2O43.浓硫酸常温下能使铁、铝钝化44.二氧化硅与氧化钙反应: SiO2+CaO CaSiO345.二氧化硅与氢氧化钠溶液反应: SiO2+2NaOH=Na2SiO3+H2O (常温下强碱缓慢腐蚀玻璃)46.二氧化硅与焦炭反应: SiO2+2C Si+2CO↑有机化学反应方程式:1.甲烷的主要化学性质(1)氧化反应 CH 4+2O 2−−→−点燃CO 2+2H 2O (2)取代反应 CH 4 + Cl 2 −−→−光照 CH 3Cl + HCl 2.乙烯的主要化学性质(1)乙烯使酸性高锰酸钾溶液褪色(2)乙烯与溴的加成反应 CH 2=CH 2 + Br 2 −→− CH 2BrCH 2Br (能使溴水褪色)(1) 3.苯的主要化学性质(2) 氧化反应(燃烧) 2C 6H 6+15O 2 −−→−点燃12CO 2+6H 2O 苯与硝酸发生取代反应, 生成无色、不溶于水、密度大于水的油状液体——硝基苯。
高中必背200化学方程式 高中化学方程式总结大全

高中必背200化学方程式高中化学方程式总结大全高中必背200化学方程式高中化学方程式总结大全高中必背化学方程式总结一. 物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温CaO + CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质+ 盐(溶液) ------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg (3)碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O (5)酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl (7)碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓+ Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓+ 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓+ 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓+ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH (8)盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O。
高中化学 阶段常用化学方程式素材 苏教版

高中阶段常用化学反应方程式1、钠在空气中燃烧〔黄色的火焰〕2Na + O2Na2O22、钠与水反应〔浮、熔、游、响、红〕2Na + 2H2O = 2H2O + H2↑2Na + 2H2O = 2Na+ + 2OH- + H2 ↑3、过氧化钠与水的反应〔放热反应、Na2O2是强氧化剂,用于漂白〕2Na2O2 + 2H2O = 4NaOH + O2↑2Na2O2 + 2H2O = 4Na++ 4OH- +O2↑4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O25、苏打〔纯碱〕与盐酸反应①盐酸中滴加纯碱溶液Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑CO32- + 2H+ = H2O + CO2↑②纯碱溶液中滴加少量盐酸Na2CO3 + HCl = NaHCO3 + NaClCO32- + H+ = HCO3-6、小苏打受热分解2NaHCO3△Na2CO3 + H2O +CO2↑7、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3 + NaOH △Na2CO3 + H2OHCO3-+ OH-= H2O + CO32-(假设是溶液中反应有离子方程式)8、金属锂在空气中燃烧4Li + O2△2Li2O9、铜丝在氯气中剧烈燃烧〔棕色烟〕Cu + Cl2点燃CuCl210、铁在氯气中剧烈燃烧2Fe + 3Cl2点燃3FeCl311、氢气在氯气中燃烧H2 + Cl2点燃2HCl12、氯气溶于水〔新制氯水中含H+、Cl-、ClO-、OH-、Cl2、HClO、H2O〕Cl2 + H2O = HCl + HClOCl2 + H2O = H+ + Cl- + HClO13、次氯酸见光分解〔强氧化剂、杀菌消毒,漂白剂〕2HClO 2HCl + O2↑14、工业制漂白粉的原理及漂白粉的失效光照2Ca(OH)2 + 2Cl 2 ===Ca(ClO)2 + CaCl 2 + 2H 2O 2Ca(OH)2 + 2Cl 2 ===2Ca 2++2ClO -+ 2Cl -+ 2H 2OCa(ClO)2 + CO 2 + H 2O =CaCO 3↓ + 2HClO 2HClO 2HCl + O 2↑ Ca 2++2ClO -+ CO 2 + H 2O =CaCO 3↓+ 2HClO15、氯气的实验室制法:〔仪器:分液漏斗,圆底烧瓶〕 MnO 2 + 4HCl(浓) MnCl 2 +Cl 2↑+ 2H 2O MnO 2 + 4H + +2Cl- Mn 2+ + Cl 2↑+ 2H 2O16、新制氯水注入盛溴化钠溶液的试管中 Cl 2 + 2NaBr = Br 2 + 2NaCl Cl 2 + 2Br - = Br 2 + 2Cl -17、铁与硫加热反应 Fe + SFeS18、硫化亚铁与稀盐酸反应 FeS + 2HCl = FeCl 2 + H 2S ↑ FeS + 2H + = Fe 2+ +H 2S ↑19、二氧化硫制三氧化硫〔无色固体,熔点16.8℃〕 2SO 2 + O 2催化剂 加热2SO 320、铜与浓硫酸反应: Cu + 2H 2SO 4 (浓〕CuSO 4 + 2H 2O+SO 2 ↑ 21、碳与浓硫酸反应: C + 2H 2SO 4〔浓〕2H 2O+CO 2↑+2SO 2↑22、工业制单质硅〔碳在高温下还原二氧化硅〕 SiO 2 + 2C高温Si + 2CO ↑23、二氧化硅与氢氧化钠反应 SiO 2 + 2NaOH = Na 2SiO 3 + H 2O SiO 2 + 2OH - = SiO 32-+ H 2O24、氮气和氢气反应〔工业合成氨〕 N 2 + 3H 2催化剂 高温高压2NH 325、氮气和氧气放电下反应 N 2 + O 2 2NO2NO + O 22NO 226、二氧化氮溶于水 3NO 2 + H 2O 2HNO 3 + NO3NO 2 + H 2O2H + + 2NO 3- + NO27、NO 2、O 2 的混合气通入水中无剩余气体 4NO 2 + O 2 + 2H 2O = 4 HNO 3 28、NO 、O 2 的混合气通入水中无剩余气体 4NO+ 3O 2 + 2H 2O = 4 HNO 3 29、五氧化二磷与热水反应 P 2O 5 + 3H 2O(热〕 = 2H 3PO 4 30. 磷在氯气中充分燃烧2P + 5Cl 2点燃2PCl 531. 氨的催化氧化4NH 3 +5O 2 4NO + 6H 2O放电光照32. 碳酸氢铵受热分解NH4HCO3△NH3↑+ H2O↑+ CO2↑33. 用浓盐酸检验氨气〔白烟生成〕HCl + NH3 = NH4Cl34. 硫酸铵溶液与氢氧化钠溶液混合加热(NH4)2SO4 + 2NaOH △2NH3↑+ Na2SO4 + 2H2ONH4+ + OH-△NH3↑+ H2O35. 硝酸铵溶液与氢氧化钠溶液混合〔不加热〕NH4NO3 + NaOH = NH3·H2O + NaNO3NH4+ + OH- = NH3·H2O36. 铝箔在氧气中剧烈燃烧4Al + 3O2点燃2Al2O337. 铝片与稀盐酸反应2Al + 6HCl = 2AlCl3 + 3H2↑2Al + 6H+ = 2Al3+ +3H2↑38. 铝与氢氧化钠溶液反应2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑39. 铝与三氧化二铁高温下反应〔铝热反应〕 2Al + Fe2O3高温2Fe + Al2O340. 镁在二氧化碳中燃烧 2Mg + CO2点燃2MgO + C41. 氧化铝溶于氢氧化钠溶液Al2O3 + 2NaOH 2NaAlO2 +H2OAl2O3 + 2OH-=== 2AlO2- + H2O42. 硫酸铝溶液中滴过量氨水Al2(SO4)3 +6NH3·H2O = 2Al(OH)3↓+ 3(NH4)2SO4 Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+43. ①氢氧化铝溶液中加盐酸Al(OH)3 + 3HCl = AlCl3 + 3H2OAl(OH)3 + 3H+ = Al3+ + 3H2O②Al(OH)3与NaOH溶液反应:Al(OH)3 + NaOH NaAlO2 +2 H2O Al(OH)3 + OH-= AlO2- +2 H2O44. *高温下铁与水反应3Fe + 4H2O〔g) 高温Fe3O4 + 4H245. 铁与盐酸反应Fe + 2HCl = FeCl2 + H2↑Fe + 2H+ = Fe2+ + H2↑46. 氧化铁溶于盐酸中Fe2O3 + 6HCl = 2FeCl3 + 3H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O47. 氯化铁中滴入氢氧化钠溶液〔红褐色沉淀〕FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl Fe3+ + 3OH- = Fe(OH)3↓48. 氢氧化亚铁在空气中被氧化〔白色沉淀变为红褐色沉淀〕4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)349. 氯化亚铁溶液中通入氯气2FeCl2 + Cl2 = 2FeCl32Fe2+ + Cl2 = 2Fe3+ + 2Cl-50. 氯化铁溶液中加入铁粉2FeCl3 + Fe = 3FeCl22Fe3+ + Fe = 3Fe2+51. 甲烷与氯气取代生成四氯化碳CH4 + 4Cl2CCl4 + 4HCl52. 乙烯实验室制法〔浓硫酸作催化剂,脱水剂〕CH3CH2OH H2O + CH2=CH2↑53. 乙烯通入溴水中CH2=CH2 + Br2CH2BrCH2Br54. 制取聚乙烯、聚丙烯n CH2=CH2催化剂n CH3–CH=CH2催化剂CH355. 乙炔的制取CaC2 + 2H2O Ca(OH)2 + ↑56. 由乙炔制聚氯乙烯+ HClH2C=CHCln H2C=CHCl催化剂57. 苯与液溴反应〔需铁作催化剂〕+ Br2+HBr58. 苯的硝化反应+ HNO32O59. 苯与氢气加成生成环己烷+ 3H2催化剂△浓H2SO4170℃CH2-CH2nCH-CH2nFe浓H2SO455-60℃NO2催化剂△HC≡CHCH-CH2nClHC≡CH60. 甲苯发生硝化反应+3HONO 2浓硫酸 △+3H 2O61. 溴乙烷水解CH 3CH 2Br + H 2O CH 3CH 2OH + HBr 62. 溴乙烷消去反应CH 3CH 2Br +NaOH +NaBr + H 2O 63. 乙醇与钠反应 2CH 3CH 2OH + 2Na 2CH 3CH 2ONa + H 2↑64. 乙醇催化氧化2CH 3CH 2OH + O 22CH 3CHO + 2H 2O65. 苯酚与氢氧化钠溶液反应+ NaOH + H 2O66. 苯酚钠溶液中通入二氧化碳+ CO 2 + H 2O + NaHCO 367. 苯酚的定性检验定量测定方法:+ 3Br 2↓ + 3HBr68. 丙醛制1-丙醇CH 3CH 2CHO + H 2催化剂 △CH 3CH 2CH 2OH69. 乙醛制乙酸 2CH 3CHO + O 2催化剂 △2CH 3COOH70. 乙醛的银镜反应 CH 3CHO+ 2[Ag(NH 3)2]OH H 2O+2Ag ↓+ 3NH 3↑+ CH 3COONH 471. 乙醛与新制氢氧化铜悬浊液CH 3––NO 2 | NO 2O 2N –– CH 3| NaOH△ 醇 △ CH 2 =CH2 Cu△ —OH—ONa—ONa —OH ––Br | BrBr –– OH |OH |CH 3CHO + 2Cu(OH)2 Cu 2O ↓+ 2H 2O + CH 3COOH72. *乙酸与氢氧化铜悬浊液2CH 3COOH + Cu(OH)2 = (CH 3COO)2Cu + 2H 2O 73. 乙酸乙酯制取〔用饱和碳酸钠溶液收集〕CH 3COOH + CH 3CH 2OH CH 3COOC 2H 5 + H 2O74. 葡萄糖结构简式CH 2OH─CHOH─CHOH─CHOH─CHOH─CHO 75. 蔗糖水解方程式 C 12H 22O 11 + H 2O催化剂C 6H 12O 6 + C 6H 12O 6蔗糖葡萄糖果糖 76. 淀粉水解 (C 6H 10O 5)n + nH 2O催化剂nC 6H 12O 6淀粉葡萄糖77. 硬脂酸甘油酯皂化反应+3NaOH 3C 17H 35COONa浓硫酸△CH 2–OH | CH –OH |C 17H 35COO─CH 2 C 17H 35COO─CH C 17H 35COO─CH 2。
高中化学方程式大全(默写训练版)

高考总复习之高中化学方程式总结化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuClCl Cu −−→−+点燃3、32FeCl 2Cl 3Fe 2−−→−+点燃4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl ClPCl→+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCOO H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222ClO H 2MnClMnO HCl 412、O H 8Cl5KCl 2MnCl2HCl 16KMnO22224+↑++→+(浓)13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢14、↑+→+HCl NaHSO SO H NaCl 442(浓)15、↑+−→−+∆HCl SONa NaCl NaHSO42416、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合)17、33HNOAgCl AgNO HCl +↓→+化学 第一册第一章 卤素第一节 氯气 1、−−→−+点燃2Cl Na 2、−−→−+点燃2Cl Cu 3、−−→−+点燃2Cl Fe 4、−−−−→−+点燃(光照)22Cl H 5、−−→−+点燃2Cl P 6、→+23Cl PCl7、→+O H Cl 22 8、→+22Cl OH Ca )( 9、→++O H CO ClO Ca 222)( 10、→+2Cl NaOH 11、−→−+∆2MnO HCl12、→+(浓)HCl KMnO413、−−→−见光HClO 第二节 氯化氢14、→+(浓)42SO H NaCl 15、−→−+∆NaCl NaHSO416、−→−+∆(浓)42SO H NaCl (14、15结合) 17、→+3AgNO HCl18、33NaNOAgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223COO H CaClCaCOHCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO4COHNO4C 2223+↑+↑→+23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15POH 6P Cu 5O H 24CuSO 15P 11++→++25、O H 3KCl Cl3HCl 6KClO223+↑→+(浓)26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀)27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO3N S K S C 3KNO2第四节 卤族元素 29、HF 2F H 22→+ 30、HB r 2B r H 22→+ 31、HI 2I H 22→+32、22B r NaCl 2Cl NaB r 2+→+ 33、22I KCl 2Cl KI 2+→+ 34、22I KB r 2B r KI 2+→+ 35、33NaNOAgBr AgNO NaBr +↓→+36、33KNOAgI AgNOKI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔18、→+3AgNO NaCl19、→+3AgNO KCl 20、→+3CaCOHCl第三节 氧化还原反应21、−→−+∆2H CuO22、→+3HNOC23、−→−+∆(极稀)3HNO Zn 24、→++O H CuSO P 2425、→+(浓)HCl KClO326、−→−+∆(极稀)3HNO Mg 27、→++4243722SO H O Fe O Cr K 28、→++S C KNO3第四节 卤族元素 29、→+22F H 30、→+22Br H 31、→+22I H 32、→+2Cl NaBr 33、→+2Cl KI 34、→+2Br KI 35、→+3AgNO NaBr36、→+3AgNOKI37、−−→−光照AgBr 第二章 摩尔 反应热第一节 摩尔38、22CO O C →+ 39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积 40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+ 第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆48、S H H S 22−→−+∆49、2CS C S −−→−+高温50、22SO O S −−→−+点燃51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足) 54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SOS H 2222点燃56、HBr 2S Br S H 22+↓→+38、→+2O C 39、→+HCl Mg 第二节 气体摩尔体积 40、→+HCl Zn第三节 物质的量浓度 41、→+42SO H NaOH 第四节 反应热42、−−→−+点燃(气)(固)2O C 43、→+(气)(气)22O H 44、→+(气)(气)22O H 45、−→−+∆(气)(固)O H C 2第三章 硫 硫酸第一节 硫46、−→−+∆S Cu47、−→−+∆S Fe 48、−→−+∆2H S 49、−−→−+高温C S 50、−−→−+点燃2O S 51、−→−+∆KOH S 第二节 硫的氢化物和氧化物52、−→−∆S H 2 53、−−→−+点燃足)(22O S H 54、−−→−+点燃不足)(22O S H 55、−−→−+点燃22SO S H 56、→+22Br S H 57、↑+→+S H FeClHCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+ 59、HAc 2PbS S H PbAc22+↓→+60、O H NaHS NaOH S H 22+→+ 61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl2S FeCl2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀)65、3222SO H O H SO⇔+66、3O V 22SO 2O SO252∆−−→←+67、4223SO H O H SO →+ 68、↑++→+22424232SOO H SONa SOH SO Na69、O H SO Na NaOH 2SO 2322+→+ 70、32CaSOCaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSOSO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++ 75、42222SO H HB r 2O H 2B r SO +→++ 76、42424422SO H 2SOK MnSOKMnO 2O H 2SO 5++→++第三节 硫酸的工业制法 77、↑+−−→−+23222SO8O Fe 2O 11FeS 4高温78、3O V 22SO 2O SO252∆−−→←+57、→+HCl FeS58、→+S H CuSO 2459、→+S H PbAc2260、→+NaOH S H 2 61、→+NaOH NaHS62、→+NaOH S H 2(60、61结合) 63、→+32FeClS H64、→+FeS SO H (稀)42 65、⇔+O H SO 22 66、∆−−→←+5222O V O SO 67、→+O H SO 23 68、→+4232SO H SO Na 69、→+NaOH SO 2 70、→+CaO SO 2 71、→+22)(OH Ca SO 72、→++O H CaSOSO 23273、→+S H SO 22 74、→++O H Cl SO 222 75、→++O H Br SO 222 76、→++422KMnO O H SO第三节 硫酸的工业制法 77、−−→−+高温22O FeS78、∆−−→←+5222O V O SO 79、4232SO H SO O H →+80、O H 2SO2CO SO H 2C 22242+↑+↑−→−+∆(浓)81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓)82、O H 2SOPO H SO H P 224342+↑+−→−+∆(浓)83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SOCuSO SO H 2Cu 22442+↑+−→−+∆(浓)85、HCl 2BaSO SOH BaCl 4422+↓→+ 86、NaCl 2BaSOSO Na BaCl 4422+↓→+ 87、NaCl 2BaCOCONa BaCl 3322+↓→+88、↑++→+2223COO H BaClHCl 2BaCO89、↑++→+222333CO O H NO Ba HNO2BaCO)(90、↑++→+2223232COO H S Na SOH CONa91、42232SO H 2O SO H 2→+ 92、42232SO Na 2O SO Na 2→+ 93、423CaSO2O CaSO2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓)95、O H SONa SO B r SO H 2NaB r 22422242++↑+−→−+∆(浓)96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+ 99、222O Na O Na 2→+ 79、→+32SO O H80、−→−+∆(浓)42SO H C 81、−→−+∆(浓)42SO H S 82、−→−+∆(浓)42SO H P 83、−→−+∆(浓)422SO H S H 84、−→−+∆(浓)42SO H Cu 85、→+422SO H BaCl 86、→+422SO Na BaCl87、→+322CO Na BaCl88、→+HCl BaCO 389、→+33HNOBaCO90、→+3232SO H CO Na 91、→+232O SO H 92、→+232O SO Na 93、→+23O CaSO94、−→−+∆(浓)42SO H Fe 95、−→−+∆(浓)42SO H NaBr 96、−→−+∆(浓)42SO H NaCl 97、−−−→−42112211SO H O H C 浓 第四章 碱金属第一节 钠 98、→+2O Na 99、→+2O Na100、NaCl 2Cl Na 22−−→−+点燃101、S Na S Na 22−−→−+研磨102、↑+→+22H NaOH 2O H 2Na 2 103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2 106、3222CO Na COO Na →+107、232222O CONa 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na 110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+ 112、O H COCONa NaHCO 222323+↑+−→−∆113、O H CONa NaOH NaHCO 2323+−→−+∆114、O H 2CONa CaCO OH Ca NaHCO 2232323++↓→+(少量))(115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))(116、NaCl 2BaCO BaCl CO Na 3232+↓→+ 117、NaCl 2CaCOCaClCONa 3232+↓→+118、O H 2CO2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CONa CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SONaCl HCl NaHSO223+↑+→+第三节 碱金属元素100、−−→−+点燃2Cl Na101、−−→−+研磨S Na 102、→+O H Na 2 103、→++42CuSO O H Na第二节 钠的氧化物 104、→+O H O Na 22 105、→+O H O Na 222 106、→+22CO O Na 107、→+222CO O Na 108、→+HCl O Na 2 109、→+HCl O Na 22 110、→+HCl CO Na 32 111、→+HCl NaHCO 3112、−→−∆3NaHCO113、−→−+∆NaOH NaHCO 3114、→+(少量))(23OH Ca NaHCO 115、→+(足量))(23OH Ca NaHCO116、→+232BaCl CO Na 117、→+232CaClCO Na118、→+HCl HCO Ca 23)( 119、→+NaOH HCO Ca 23)( 120、HCl NaHSO+3第三节 碱金属元素121、O Li 2O Li 422−−→−+点燃122、22KO O K −−→−+点燃123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
江苏省包场高级中学高中化学第六章 化学反应与能量 知识点-+典型题及答案

江苏省包场高级中学高中化学第六章化学反应与能量知识点-+典型题及答案一、选择题1.一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)2SO3(g)。
经过一段时间后达到平衡。
反应过程中测定的部分数据见下表:t / s02468n(SO3) / mol00.81.4 1.8 1.8下列说法正确的是( )A.反应在前2 s 的平均速率v(O2) = 0.4 mol·L-1·s-1B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率小于10%D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时() ()32n SOn O减小【答案】C【详解】A.根据表格中数据可知,当n(SO3)=1.8mol,该反应达到平衡状态,反应在前2s的平均速率v(SO3)=0.8mol÷2L÷2s=0.2mol·L-1·s-1,同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,v(O2)=0.5v(SO3)=0.5×0.2mol·L-1·s-1=0.1mol·L-1·s-1,故A错误;B.化学平衡常数只与温度有关,温度不变,化学平衡常数不变,与压强、物质浓度都无关,故B错误;C.原平衡,SO2的转化率为1.8mol÷2mol×100%=90%。
若起始时向容器中充入2molSO3时,将建立等效平衡,SO3的转化率等于10%,相同温度下,起始时充入4 molSO3,相当于对原平衡加压,SO3的转化率减小,应小于10%,故C正确;D.保持温度不变,向该容器中再充入2molSO2、1molO2,相当于缩小容器的体积,增大了压强,平衡正向移动,三氧化硫的物质的量增加,氧气的物质的量减少,所以() ()32n SOn O增大,故D错误。
江苏省包场高级中学高中化学第六章 化学反应与能量 知识点-+典型题

江苏省包场高级中学高中化学第六章化学反应与能量知识点-+典型题一、选择题1.1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g) + aY(g)bZ(g),反应达到平衡后,测得X的转化率为50% 。
而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是A.a=l,b=2 B.a=2,b=1 C.a=2,b=2 D.a=3,b=2【答案】D【分析】1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)⇌b Z (g)。
反应达到平衡后,测得X的转化率为50%.而且,在同温同压下反应前后混合气体的密度之比和气体体积成反比即和气体物质的量成反比,讨论分析判断得到a、b的取值。
【详解】X(g)+a Y(g)⇌b Z(g)。
起始量(mol) 1 a 0变化量(mol) 0.5 0.5a 0.5b平衡量(mol) 0.5 0.5a 0.5b依据在同温同压下反应前后混合气体的密度之比和气体体积成反比即和气体物质的量成反比,在同温同压下测得反应前混合气体的密度是反应后混合气体密度的34,即反应后气体物质的量是反应前气体物质的量34,则得到;(0.5+0.5a+0.5b):(1+a)=3:4,计算得到:2b=a+1,依据选项中的取值分析判断,a=3,b=2符合计算关系。
故选D。
2.完全燃烧一定质量的无水乙醇,放出的热量为Q,已知为了完全吸收生成的二氧化碳,消耗掉8mol•L-1的氢氧化钠溶液50mL,则1mol无水乙醇的燃烧放出的热量不可能是A.10Q B.10Q~5Q C.大于10Q D.5Q【答案】C【详解】n(NaOH)=0.05L×8mol/L=0.4mol,则由CO2~2NaOH~Na2CO3,可知n(CO2)=0.2mol,则n(C2H6O)=0.5×n(CO2)=0.1mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为10Q,由CO2~NaOH~NaHCO3可知,n(CO2)=0.4mol,则n(C2H6O)=0.5×n(CO2)=0.2mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为5Q,若二氧化碳和氢氧化钠反应生成碳酸氢钠和碳酸钠的混合物,则乙醇燃烧放出的热量介于5Q~10Q之间,所以选项C不符合;故答案选C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课前默写008 姓名:得分:
1、32gN2H4(肼)在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),
N2H4完全燃烧反应的热化学方程式是
2、肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼
-空气燃料电池放电时:负极的电极反应式是________________ __
正极的电极反应式是______________ _____
3、传统制备肼(N2H4)的方法,是以NaClO氧化NH3,制得肼的稀溶液。
该反应的
离子方程式是
4、右图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该
化合物的化学式为;Zn的配位数为:
该化合物的晶体熔点比干冰高得多,原因是
课前默写009 姓名:得分:
1、以H2SO4浸出粗氧化锌(含FeO、Fe2O3、ZnS等),同时加入H2O2;
加入H2O2时能浸出硫化锌,同时生成淡黄色固体,
写出其化学方程式。
2、某化工厂改进工艺,采用原理如图3所示的装置
(电极为石墨),通过电解提高阳极区溶液的酸性,
实现Na2CrO4转化为Na2Cr2O7.
写出阳极的电极方程式:
Na2CrO4转化为Na2Cr2O7的离子方程式:
3、CH3CHO分子中C原子的杂化类型为_____ ___;
金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图,请在下图中用箭头表示出配位键。
课前默写010 姓名:得
分:
1、Fe3O4与稀硝酸反应的离子方程式:
检验反应后的溶液中含Fe3+的方法:
2、已知甲醇燃料电池的工作原理如图所示.
①该电池工作时,a口通入的物质为,b口通入的物质为
②该电池负极的电极反应式为
3、硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。
其结构如右图:
⑴Cu元素基态原子的外围电子排布式为
(2)A中碳原子的轨道杂化类型为
(3)1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为
NH2
NH2
Cu O
O
O O。
