最新无机化学期末考试试卷(B卷)答案
无机化学期末考试试卷(B卷)答案

湖南大学无机化学期末卷B 湖南大学课程考试试卷C、Ag>Cu>AuD、Au>Ag>Cu8、元素原子的最外层仅有一个电子,该电子的量子数是n=4,l=0,m=0,下列那一元素不符合此条件()A、KB、CuC、CaD、Cr9、下列各对离子不能在同一溶液中共存的是()A、Sn2+和Fe2+B、Pb2+ 和Fe2+C、[PbCl4]2-和[SnCl6]2-D、Sn2+和Fe3+10、将IIA族与IIB族元素比较时,下列叙述中正确的是:()A、化学活泼性(还原性)都随原子序数增大而增强B、在水溶液中,从上到下,φ⊙M2+/M的数值都减小。
C、IIB族金属的熔、沸点都比IIA族的低D、自上而下,第一电离能都减小。
11、汞(II)盐如Hg(NO3)2溶液与强碱反应时,得到的产物是()A、Hg(OH)2 ↓B、HgO ↓C、[Hg(OH)4] 2-D、Hg(OH)NO3 ↓12、下列离子中心原子不属于杂化轨道类型的是()A、IO65-B、ClO4-C、ClO3-D、NH313、根据软硬酸碱理论,下列配合物稳定性最好的是()A、[CdCl4]2-B、[Cd(NH3)4]2-C、[CdI4]2-D、[CdBr4]2-14、下列配体的场强强弱顺序符合光谱化学序列的是()A、I-< F- < OH-< CN-B、F-<I-< OH-< CN-C、OH-< I- < F- < CN-D、CN-< OH- < F- < I-15、下列元素中,哪一个元素原子的外围电子构型为3d全充满,4s半充满。
()A、HgB、AgC、CuD、Ni二、填空题(每题1分,共10分)1、二氧化铅与浓硫酸反应的化学方程式2、BF3, SbF5, H2O, CH3COOH, C6H6, 在液态HF中, 作为酸物质是作为碱的物质是因为(3分)3、Al3+、Cr3+与(NH4)2S反应时生成;在以(NH4)2S为组试剂沉淀第三组阳离子时,第四组阳离子试液必须提前加处理。
无机化学试卷AB答案

无机化学试卷A一、单项选择题,(共24分,每题一分)1.下列物质中可以认为具有最大摩尔熵的是A.Li(g)B.Li(s)C.LiCl·H 2O(s)D.LiCO 3(s)2.下列说法正确的是( )A.放热反应均为自发反应B.∆S m 为正的反应均为自发反应 C.∆∆r S m 为正、∆r H m 为负的反应均为自发反应 D.∆r S m 为负、∆r H m 为正的反应均为自发反应3. 一个气相反应mA (g) + nB (g)qC (g) ,达到平衡时,下列说法正确的是( )A. 0=∆θmr G B. J =1 C. θK J = D. 反应物分压和等于产物分压和 4. 向平衡体系 2SO 2 (g) + O 2 (g)2SO 3 (g) 中加入惰性气体,若体系体积保持不变,则平衡() A.不移动 B. 向右移动 C. 向左移动 D.无法判断5.下列各组量子数(n,l,m ),不合理的是( )A.(3,2,0)B.(3,3,2)C.(3,1,0)D.(3,1,-1)6.下列离子的原子序数分别是25、26、27、28,其电子构型可以用[Ar]3d 6表示的是( )A.Mn 2+B.Fe 2+C.Co 3+D.Ni 2+7.下列元素原子半径排列顺序正确的是( )A.Mg>B>Si>ArB.Ar>Mg>Si>BC.Si>Mg>B>ArD.B>Mg>Ar>Si8.下列物质熔化时需要克服离子键的是( )A. H 2OB. SiO 2C. MgCl 2D.Na9.下列分子中极性最小的是( )A .H 2OB .NH 3C .H 2SD .CO 210.卤化银的溶解度依Cl—Br—I 的次序减小,能解释这种现象的理论是( )A .杂化理论B .分子间力C .共价键D .离子极化11. 0.1 mol·L –1的一元弱碱(8100.1-⨯=θbK )溶液与等体积水混合后,溶液的pH 值为( )A.8.7B.8.85C.9.0D.10.512.下列溶液中,其pH 值最小的是( )A. 0.010mol·L –1NaOHB. 0.010mol·L –1H 2SO 4C. 0.010mol·L –1HClD. 0.010mol·L –1H 2C 2O 413. 某一弱酸强碱盐MA (5100.1)(-⨯=HA K a θ),则MA 的水解常数θh K 为( )A. 1.0×10-9B. 1.0×10-2C. 1.0×10-19D. 1.0×10-514.在饱和H 2S 水溶液中,c (S 2–)近似为( )mol·L –1A. θ1a KB. θ2a KC. θ1a K ×θ2a KD. 0.115.Ag 2CrO 4的12100.9-⨯=θsp K ,则其饱和溶液中Ag +离子浓度为( )mol·L –1A. 1.3×10-4B. 2.1×10-4C. 2.6×10-4D. 4.2×10-416.在Mg(OH)2(11108.1-⨯=θsp K )饱和溶液中加入MgCl 2,使Mg 2+浓度为0.010mol·L –1,则该溶液的pH 值为( )A. 5.26B. 8.75C. 9.63D. 4.3717. 溴的元素电势图,-V 07.12V 45.0-V 54.0-3Br Br BrO BrO −−→←−−→←−−→←+++,则可求得)(--θBr /BrO E 为( )A. 1.52VB. 0.62VC.0.76VD. 0.35V18.向原电池 (-)Zn∣Zn 2+(1mol·L -1)‖Cu 2+(1mol·L -1)∣Cu(+)的正极中通入HS 气体,则电池的电动势将( )A. 增大B. 减小C. 不变D. 无法判断19.已知)(++24θ/E Sn Sn =+0.14V ,)(++23θF /F E e e =+0.77V ,则不能共存于同一溶液中的离子( )A. Sn 4+,Fe 2+B. Sn 4+,Sn 2+C. Fe 3+,Fe 2+D. Fe 3+,Sn 2+20.根据碱性溶液中溴的元素电势图,能自发歧化的物质是( )-V 07.12V 45.0-V 54.0-3Br Br BrO BrO −−→←−−→←−−→←+++A. BrO 3-B. BrO -C. Br 2D. Br -21. 在热碱溶液中,Cl 2的歧化产物是( )A. Cl -和ClO -B. Cl -和ClO 2-C. Cl -和ClO 3-D. Cl -和ClO 4-22.在Al 2(SO 4)3溶液中加入Na 2CO 3,其主要产物是( )。
《无机化学》期末考试试卷(B)

《无机化学》期末考试试卷(B)适用专业:注意:请将答案写在答题纸上。
一、单项选择题(每小题只有一个正确的答案,请将其代码填入括号中;每小题1分,共40分)1.下列物质不属于弱电解质的是()A.HAc B.NH3·H2O C.AgCl D.H2O2.下列元素中,非金属性最强的是()A.F B.Cl C.S D.O3.下列选项中导电性最好的金属是()A.Fe B.Cu C.Na D.Ag4.地壳中含量最多的元素是()A.O B.S C.Fe D.Si5.下列符号通常代表弱酸的解离常数的是()A.K a B.K b C.K w D.K sp6.0.1 mol·L 1氢氧化钠溶液的pH值为()A.1 B.12 C.2 D.137.原子核外电子层第一层最多容纳的电子数是多少个()A.2 B.6 C.8 D.10 8.配制FeCl3溶液时,常加入少量盐酸,其目的是()A.防止Fe2+被氧化B.防止Fe2+水解C.防止Fe3+被氧化D.防止Fe3+水解9.下列物质中,属于共价化合物的是()A.NaCl B.HCl C.Na2CO3D.Na 10.可逆反应达到平衡后()A.V正>V逆B.V正=V逆C.V正<V逆D.无法确定11.将pH=3.5的盐酸溶液与pH=10.5的NaOH溶液等体积混合后,溶液的pH是()A.7 B.<7C.>7 D 无法判断12.离子键最可能存在于()A.金属原子之间B.非金属原子之间C.金属原子与非金属原子之间D.任意两种元素的原子之间13.用0.1000 mol/L NaOH溶液滴定等体积、等pH值的HCl溶液和HAc 溶液时,所消耗NaOH溶液的体积()A.相同B.V NaOH(HCl溶液消耗)> V NaOH(HAc溶液消耗)C.V NaOH(HCl溶液消耗)< V NaOH(HAc溶液消耗)D.无法确定14.34.2 g/L蔗糖溶液的物质的量浓度为(蔗糖的摩尔质量为342 g/mol)()A.0.01 mol/L B.0.1 mol/LC.0.001 mol/L D.1 mol/L15.摩尔是表示()A.物质的量的单位B.摩尔质量的单位C.物质浓度的单位D.物质微粒的单位16.目前对人类环境造成危害的酸雨主要是由下列哪种气体污染造成的()A.CO2B.H2S C.SO2D.CO17.配制医疗上用的生理盐水是采用固体()A.NaCl B.KCl C.CaCl2 D.MgCl2 18.下列不能与氯气直接化合的物质是()A.H2B.Na C.Fe D.N219.没有强烈刺激性气味的气体是()A.O2 B.NH3C.SO2D.Cl220.原子序号11~17号的元素,随核电核数的递增而逐渐变小的是()A.电子层数B.最外层电子数C.原子半径D.元素最高化合价21.金属Na长时间放置在空气中,最终的产物是()A.Na2CO3B.NaOHC.Na2O D.Na2O222.已知某溶液,可使石蕊试液变红,使甲基橙变黄色,则该溶液的pH 值范围为( ) A.8~10 B.5~8C.4.4~5.0 D.3.1~4.423.一定温度下,加水稀释弱酸,下列数值将减少的是()A.[H+] B.pH C.Ka D.不确定24.可逆反应C(s)+H2+H2(g)-Q (表示正反应为吸热反应)达平衡状态时,若降低温度,则化学平衡向哪移动()A.正反应方向B.逆反应方向C.没有D.无法判断25.下列指示剂中,不属于酸碱指示剂的是()A.酚酞B.甲基橙C.石蕊D.淀粉26.下列关于催化剂作用的叙述中错误的为()A.可以加速某些反应的进行B.可以抑制某些反应的进行C.可以使正逆反应速度以相等的速度加快D.可以改变反应进行的方向27.醋酸与NaOH溶液等浓度等体积混合后,溶液的pH是()A.等于7 B.小于7 C.大于7 D.无法判断28.某同学选择HAc~NaAc作缓冲对,配制pH=5.0的缓冲溶液,经酸度计测定所配溶液的pH为4.78,则应向此缓冲溶液中滴加少量什么溶液来调节。
本科无机化学B卷及答案

#####成人高等教育《无机化学》试卷(B卷)年级13级专业化学工程层次本科注意事项:1.满分100分,考试时间120分钟。
要求卷面整洁、字迹工整、无错别字。
2.考生必须将“学生姓名”和“学号”完整、准确、清楚地填写在试卷规定的地方,否则视为废卷。
3.考生必须在签到表上签到,否则若出现遗漏,后果自负。
一·单项选择题(每小题2分,共20分)1.关于晶体的下列说法正确的是()A.只要含有金属阳离子的晶体就一定是离子晶体B.离子晶体中一定含金属阳离子C.在共价化合物分子中各原子都形成8电子结构D.分子晶体的熔点不一定比金属晶体熔点低2、氯化钠晶体的结构为()(A) 四面体 (B) 八面体 (C) 立方体 (D) 单斜体。
3、下列物质与水反应,不产生H2O2的是()(A) KO2 (B) Li2O (C) BaO2(D) Na2O24、在SnCl2溶液中滴加少量HgCl2,最终出现沉淀的颜色是()(A) 白色 (B) 黑色 (C) 棕色 (D) 黄色5、下列溶液分别与Na2S溶液混合不生成黑色沉淀的是()(A) Pb2+ (B) Hg2+ (C) Co2+ (D) Sb3+6、下列氢化物热稳定性顺序正确的是()(A) HF > HCl > HBr >HI (B) HF > HI > HBr > HCl(C) HI > HBr > HCl >HF (D) HI > HBr > HF >HCl7、下列金属中,硬度最大的是( C )(A) W (B) Mo (C) Cr (D) Ni8、下列氢氧化物中,颜色为白色的是( D )(A) Cr(OH)3(B) Ni(OH)2(C) Fe(OH)3(D) Mn(OH)29、下列各物质分别与酸化了的KMnO4(aq)混合,不能变成近乎无色溶液的是(D)(A) Na2O2(B) NaNO2(C) Na2SO3(D) NaI ( 过量 )10、下列化合物中颜色为黑色的是(A)(A) CuO (B) Cu2O (C) CuCl (D) CuI二.填空题(每空1分,共20分)1、表示晶体中原子排列形式的空间格子叫做,而是指能表示晶体结构的最小的晶格。
无机化学期末考试题及答案doc

无机化学期末考试题及答案doc一、选择题(每题2分,共20分)1. 下列元素中,原子半径最大的是:A. NaB. MgC. AlD. Si答案:A2. 以下化合物中,属于共价化合物的是:A. NaClB. MgOC. HClD. NaOH答案:C3. 金属晶体中,金属离子与自由电子之间的相互作用是:A. 离子键B. 共价键C. 金属键D. 范德华力答案:C4. 以下哪种物质是强酸?A. HClB. CH3COOHC. H2CO3D. H2SO35. 以下哪种反应是氧化还原反应?A. HCl + NaOH → NaCl + H2OB. 2H2 + O2 → 2H2OC. CaCO3 → CaO + CO2D. 2Na + Cl2 → 2NaCl答案:D6. 以下化合物中,属于离子晶体的是:A. SiO2B. NaClC. C60D. H2O答案:B7. 以下哪种物质是强碱?A. KOHB. NH3C. CH3NH2D. H2O答案:A8. 以下哪种物质是弱电解质?A. HClB. NaClC. H2OD. CH3COOH答案:D9. 以下哪种物质是两性化合物?B. Na2OC. CaOD. MgO答案:A10. 以下哪种物质是强氧化剂?A. H2O2B. Na2O2C. Na2SD. MgO答案:A二、填空题(每题2分,共20分)1. 元素周期表中,第IA族的元素是____。
答案:碱金属2. 酸的共轭碱是____。
答案:碱3. 金属晶体中,金属离子与自由电子之间的相互作用是____。
答案:金属键4. 离子晶体中,离子之间的相互作用是____。
答案:离子键5. 共价键的强度与原子之间的____有关。
答案:电子云重叠程度6. 氧化还原反应中,氧化剂是____。
答案:得到电子的物质7. 金属晶体中,金属离子与自由电子之间的相互作用是____。
答案:金属键8. 酸的共轭碱是____。
答案:碱9. 离子晶体中,离子之间的相互作用是____。
无机化学试卷及答案

☆☆ 密 封 线 内不要 答题 ☆ ☆《无机化学》试题(B 卷)(答案)本套试卷共 3 页一、判断是非题(每小题2分,共20分)1、同一温度下,溶液的蒸气压大于水的蒸气压。
( × )2、配位化合物在水中的溶解度很低。
( × )3、原子通过化学键结合成分子,所以化学键是分子中相邻原子间较强烈的结合力。
( √ )4、 光子的运动具有波粒二象性,同样原子核外电子的运动具有波粒二象性。
( √ )5、电负性越大的元素氧化性越强。
( √ )6、在同一温度下,某一化学反应的焓变等于其等容反应热。
( × )7、最稳定相态单质的焓值等于零( √ )8、催化剂可以增加活化能,提高反应速率。
( × )9、甲物体的温度比乙物体高,表明甲物体的热力学能比乙物体大。
( × ) 10、同一温度下,平衡常数随反应物浓度的不同而不同。
( × )二、选择题(每小题2分,共计20分)1、 在0oC 时,烧杯中盛有水,上面浮着冰块,保持温度不变,加入少量NaCl 并使其全部溶解,再加入AgNO 3 溶液,此时烧杯中共有( B )相。
A. 1; B 2; C 3; D 4;2、 一定温度下,已知某反应ΔG θ>0,则该反应的平衡常数K θ( C )A.> 0B.< 0C.< 1D.> 13、已知E◎(I2/I-) =;E◎(Br2/Br-) =;在标准状态下,比较I2和Br2氧化性强弱。
( B ) A. I2比Br2强;B. Br2比I2强;C. 一样强;D. 不能确定;4、下列含氢化合物中,不含有氢键的(C)A. CH4;2;C. H3BO3; D. HF ;5、第二十五号元素Mn(25)属于第(C)副族元素。
A. 2 ;B. 5 ;C. 7 ;D. 3 ;6、常温33-溶液中加入一些NaAC晶体并使之溶解,则发生的变化是(D)A. HAC的Kaθ增大;B. HAC的Kaθ减小;C. HAC解离度增大;D. HAC解离度减小;7、在盛有稀盐酸的开口玻璃烧杯中,加入锌粒进行反应生成氢气,问此化学反应系统是:( C )A. 封闭系统;B. 孤立系统;C. 敞开系统;D. 氧化还原系统;8、量子力学中,原子轨道的同义词是(B)A. 电子运动的轨迹;B.波函数;C.原子运动轨道;D.电子云;☆☆密封线内不要答题☆☆9、在下列电池反应中,Ni(s)+Cu+2(aq)=Ni+2·dm3-)+Cu(s);当该原电池的电动势为零时,Cu2+的浓度为(B)A.×1027- mol·dm3-; B.×1021-mol·dm3-;C.×1014- mol·dm3-; D.×1011-mol·dm3-;10、已知下列各电对的标准电极电势:E(Fe3+/Fe2+)=+ ;E(Cu2+/Cu)=+;E(Mg2+/Mg)= ;E(Cl2/Cl-)=+;则在标准条件下,最强的还原剂是( C )+ -三、完成下表:(每个元素2分,共10 分)四、简要回答下列问题(每小题4分,共20 分)1、简述CH4的分子结构:答:CH4中的C原子进行sp3杂化,形成4个等性sp3杂化轨道,每个sp3轨道中的单电子与4个氢原子中的1s电子形成4个等长共价键,故CH4空间构型是四面体。
渤海大学 无机化学 期末考试试卷及参考答案

渤海大学20 级专升本(食品科学与工程专业)第二学期《无机化学》试卷题号一二三四五六总分得分1.某元素的阳离子有3个电子层,则该离子可能有几种形状的电子云()A. 2;B. 3;C. 4;D. 以上答案都不对2、CuS溶于KCN的主要产物之一是()A. [Cu(CN)2]↓B. [Cu(CN)4]2-C. [Cu(CN)2]-D. [Cu(CN)4]3-3.10℃下A与B反应,每小时有5gA被转化,其它条件不变要使A每小时转化20g,则反应温度大约为()A. 20℃B. 30℃C. 40℃D. 无法估计4.ClO3F的分子构型为:()A. 四方锥B. 八面体C. 四面体D. 平面四边形5.下面哪一种说法最符合泡利(Pauli)原理()A.电子的运动状态需要用四个不同的量子数来描述B.同一原子中具有一组相同量子数的电子不能多于一个C.同一原子中不可能有能量完全相同的电子存在D.同一原子中每个电子的电子云伸展方向都不同6.下列分子中偶极矩最大的是:()A. H2OB. HFC. H2SD. HCl7.La2(C2O4)3饱和溶液的浓度是1.1×10-6mol·L-1,其Ksp为:()A. 1.2×10-12B. 1.6×10-30C. 1.6×10-34D. 1.7×10-288.下列物质碱性最强的是:()A. F-B. OH-C. NH2-D. H2O9.下列物质属于超氧化物的是:()A. BaO2B. KO3C. KO2D. Na2O10.下列物质不属于一元酸的是:()A. H3PO2 B. H3PO3 C. H3BO3 D. H2O11.下列说法那种是错误的:()A.固体物质溶于水均为熵增 B. 当△n(g)>0时,反应熵增C. 熵与焓一样只能有相对值D. 熵与Gibbs自由能的量纲相同12.下列物质溶于水不能产生气体的是:()A. PCl5B. Al2S3C. Al2(CO3)3D. BF313.磁性最弱的配离子是:()A. [FeF6]3-B. [Fe(CN)6]3-C. [Co(H2O)6]2+D. [Co(CN)6]3-14.下列哪种分子是极性分子:()A. P4B. S8C. O3D. PH315.已知反应PbS(s)+2HAc(aq)=Pb2+(aq)+H2S(aq)+2Ac-(aq),该反应的K值为:()A. Ksp·Ka1·Ka2/K2HacB. Ksp·K2Hac / Ka1·Ka2C. Ksp /Ka1·Ka2·K2HacD. Ksp·Ka1 /K2Hac·Ka216.P和V分别代表压力和体积,则乘积PV是哪种物理量的单位:()A. 熵B. 力C. 动量D. 能量17.0.2M甲酸溶液中,3.2%的甲酸已电离,它的电离常数是:()A. 9.6×10-3B. 2.1×10-4C. 1.25×10-6D. 4.8×10-518.500K时,反应SO2+1/2O2=SO3的Kp=50。
《无机化学》期末试题(B)卷

《无机化学》期末试题(B)卷姓名学号得分一、填空(每空1分,共19分)1、在0.10mol/dm3HAc溶液中加入少许NaCl晶体,溶液的pH 将会,若以Na2CO3代替NaCl,则溶液的pH将会。
2、PbF2的K sp为2.7×10-8,则PbF2的饱和溶液中,[F-]= mol/dm3;PbF2的溶解度为mol/dm3。
3、某温度下反应2NO(g)+O2(g)==2NO2(g)的速率常数k=8.8×10-2mol-2·dm6·S-1,已知反应对O2来说是一级反应,则对NO为级,速率方程为;当反应物浓度都是0.05mol/dm3时,反应的速率是mol·dm-3·S-1。
4、常温下,HCl(g)的生成热为-92.3kJ/mol,生成反应的活化能为113kJ/mol,则其逆应的活化能为kJ/mol。
5、加入催化剂可以改变反应速率,而化学平衡常数,原因是。
6、将Ag-AgCl电极(E0(AgCl/Ag)=0.222V)与饱和甘汞电极(E0=0.2415V)组成原电池,该原电池的电池符号为,正极反应为,负极反应为,电池反应为,电池反应的平衡常数为。
7、根据酸碱质子理论,[Fe(H2O)5(OH)]2+的共轭酸是,共轭碱是,HNO3的共轭酸是,NH2-的共轭碱是。
二、选择题1、已知反应NO(g)+CO(g)==1/2N2(g)+CO2(g)的Δr Hm=-373.2kJ/mol,若提高有毒气体NO和CO的转化率,可采取的措施是()A低温低压B低温高压C高温高压D高温低压2、将0.10mol/dm3下列溶液加水稀释1倍后,pH变化最小的是()A HClB H2SO4C HNO3D HAc3、下列叙述中正确的是()A溶度积大的化合物溶解度肯定大B向含AgCl固体的溶液中加入适量的水使AgCl溶解又达平衡时,AgCl溶度积不变,其溶解度也不变C难溶电解质放入纯水中,溶解达平衡时,电解质离子浓度的乘积就是该物质的溶度积D AgCl水溶液的导电性很弱,所以AgCl为弱电解质4、以惰性电极电解一段时间后,pH增大的溶液是()A HClB H2SO4C Na2SO4D NaHSO45、下列物质中,既是质子酸又是质子碱的是()A NH3,NH2-B NaOH,Na+C HS-,S2-D H2O,OH-6、可逆反应2SO2(g)+O2(g)===2SO3(g)达到平衡时,保持体积不变,加入惰性气体He,使总压力增加一倍,则()A平衡向右移动B平衡向左移动C平衡不移动D无法判断7、催化剂是通过改变反应进行的历程来加速化学反应速率。
无机化学期末试题

无机化学期末试题(A)专业姓名学号成绩一、单项选择题(每小题2分,共20分)1、重晶石的化学式是()A BaCO3 ,B BaSO4 ,C Na2SO4 ,D Na2CO32、在B12的单元中有多少等边三角形的面。
()A 12 ,B 24 ,C 20 ,D 403、BCl3分子中,除了B-Clσ键外,还有大Л键是()A П44,B П36 ,C П46D П354、原子序数为40的元素的元素符号是()A Ti ,B Zr ,C H f ,D Nb5、将过量的KCN加入CuSO4溶液中,其生成物是()A CuCN ,B Cu(CN)43- ,C Cu(CN)2 ,D Cu(CN)42-6、在下列硫化物中,溶于Na2S溶液的是()A CuSB Au2SC ZuSD HgS7、下列物质中,可能具有苯环结构的是()A BbH12B (BN)3H6C Si6H14D As4O108、在下列氢氧化物中,不能存在的是()A Al(OH)3B Cu(OH)3C Ir(OH)3D Ti(OH)39、下列物质中,有较强还原性的含氢酸是()A HPO3 ,B H3PO3C H3PO2D H3BO310、下列金属元素中,熔点最高的是()A Re ,B Au ,C Mo ,D W二、填空题(每小题2分,共20分)1、在乙硼烷分子中,两个硼原子各采取与两个氢原子形成键,每个B尚剩余分别与两个氢原子形成键。
2、研究表明,C60的球面上有五元环面六元环面,每个碳原子单取近似杂化,与周围个原子相连.3、钒的含氢酸根会随着溶液的酸性改变而变化。
当溶液为强酸性时,以为主,当溶液为强碱性时,以为主。
三、判断正误(每小题1分共10分)1、ClF3的空间构型为平面三角形。
()2、由于F的电负性大于Cl,所以HF的酸性大于HCl 。
()3、硝酸分子中,3个O—N键长相等。
()4、Cu(I)化合物在水溶液中不稳定,发生歧化反应。
()5、内过渡系列元素由于填充(n-2)f电子,外层电子基本相同,因此,性质特别相似。
复旦大学《无机化学》2023-2024学年第一学期期末试卷

7. 以下哪种化合物属于酸式盐? A. NaCl B. NaNO₃ C. Na₂ SO₃ D. Na₂ CO₃
8. 下列哪种元素属于过渡元素? A. 碳
B. 氮 C. 磷 D. 锌
9. 在化合物中,以下哪种键属于金属键? A. 氢键 B. 离子键 C. 金属键 D. π 键
复旦大学《无机化学》2023-2024 学年第一学期期末试卷
考试课程:无机化学 考试时间:120 分钟 专业:化学 总分:100 分
一、单项选择题(每题 2 分,共 20 分)
1. 以下哪种化合物属于酸式盐? A. NaCl B. NaNO₃ C. Na₂ SO₃ D. Na₂ CO₃
2. 下列哪种元素属于主族元素? A. 碳 B. 氮 C. 磷 D. 锌
子键。 27. 无机化合物的命名规则有_____________________。 28. 在化合物中,_____________________键是指原子之间的金
属键。 29. 氧化还原反应的类型有_____________________。 30. 无机化合物的性质有_____________________。
四、简答题(每题 10 分,共 40 分) 31. 请简述酸式盐和碱式盐的区别及其在化学反应中的应用。 32. 试述氧化还原反应的基本原理及其在化学反应中的应用。 33. 请简述无机化合物的命名规则及其在化学反应中的应用。 34. 试述金属键的特点及其在化合物中的应用。
考试说明: 1. 答题前请务必将姓名、学号及班级填写在答题纸上。 2. 所有答案必须写在答题纸上,不能在试卷上作答。 3. 本试卷共 100 分,考试时间为 120 分钟。
最新无机化学期末考试试卷(B卷)答案资料

内蒙古民族大学无机化学课程考试试卷答案(B卷)课程名称:普通化学和无机化学考试时间:120分钟年级:xxx级专业:xxx题目部分,(卷面共有53题,100分,各大题标有题量和总分)一、单项选择题(20小题,共20分)1、在标准状态下, 1.0 dm3氢气的质量应为A、0.089 gB、0.11 gC、9.0 gD、11.2 g答案:A2、扩散速率三倍于水蒸气的气体是A、HeB、H2C、CO2D、CH4答案:B3、欲配制pH = 13.00 的溶液10.0 dm3, 所需NaOH 固体的质量是(相对原子质量: Na 23 )A、40 gB、4.0 gC、4.0×10-11 gD、4.0×10-12 g答案:A4、有一种称“墨海”的带盖砚台,其结构如图所示,当在砚台中加入墨汁,在外圈加入清水,并盖严,经过足够的时间,开盖看到的情况是A、砚中墨汁干枯,外圈水成淡墨B、砚中墨汁变淡,外圈水成淡墨,且二者浓度相同C、砚中墨汁变淡,外圈水干枯D、没有发生变化答案:C5、下列说法正确的是A、当液体与其蒸气处于平衡时,蒸气的压力称为液体的饱和蒸气压B、液体混合物的蒸气压等于各纯组分液体的蒸气压之和C、非电解质稀溶液中某一液体组分的蒸气分压等于它在相同温度下的饱和蒸气压与其在溶液中的摩尔分数之积D、蒸气压的大小与容器体积的大小有关答案:C6、已知:2H 2(g) + S 2(g)2H 2S(g) K p 1 2Br 2(g) + 2H 2S(g)4HBr(g) + S 2(g) K p 2 H 2(g) + Br 2(g)2HBr(g) K p 3 则K p 3 等于A 、(K p 1 / K p 2 )1/2B 、(K p 2·K p 1)1/2C 、K p 2 /K p 1D 、K p 2·K p 1 答案:B7、氢硫酸电离常数K 1 = 1 ⨯ 10-7,K 2 = 1 ⨯ 10-13,在0.1 mol ·dm -3 H 2S 水溶液中溶液的pH 值是A 、10-2B 、 2C 、 3D 、4 答案:D8、用0.20 mol ·dm -3 HAc 和0.20 mol ·dm -3 NaAc 溶液直接混合(不加水),配制1.0 dm 3 pH = 5.00的缓冲溶液,需取0.20 mol ·dm -3 HAc 溶液为 (p K a (HAc) = 4.75)A 、6.4 ⨯ 102 cm 3B 、6.5 ⨯ 102 cm 3C 、3.5 ⨯ 102 cm 3D 、3.6 ⨯ 102 cm 3 答案:D9、钒的电势图为 1.000.360.25()()()()VVVV V V IV V III V II ++-已知: ϕ(Zn 2+/Zn) = -0.76 V , ϕ(Sn 4+/Sn 2+) = +0.15 Vϕ(Fe 3+/Fe 2+) = +0.77 V , ϕ(S/H 2S) = +0.14 V欲将V(V) 还原到V(IV),在下列还原剂中应选用 A 、FeSO 4 B 、Zn C 、SnCl 2 D 、H 2S答案:A10、对于下面两个反应方程式,说法完全正确的是 2Fe 3+ + Sn 2+Sn 4+ + 2Fe 2+Fe 3+ + 21Sn 2+21Sn 4+ + Fe 2+ A 、两式的 E , m r G ∆,K C 都相等 B 、两式的 E , m r G ∆,K C 不等 C 、两式的 m r G ∆相等, E ,K C 不等 D 、两式的 E 相等, m r G ∆,K C 不等答案:D11、铅蓄电池在充电时,阳极反应是A 、PbSO 4 + H 2O =PbO 2 + 4H + + SO -24+ 2e -B 、Pb + SO -24= PbSO 4+ 2e -C 、PbSO 4+ 2e -= Pb + SO -24D 、PbO 2+ 4H ++ SO -24+ 2e -= PbSO 4 + 2H 2O答案:A12、已知金属 M 的下列标准电极电势数据:(1) M2+ (aq) + e-= M+(aq) 1ϕ= -0.60 V(2) M3+ (aq) + 2e-= M+(aq) 2ϕ= 0.20 V则M3+ (aq) + e-= M2+ (aq) 的 ϕ是A、0.80 VB、-0.20 VC、-0.40 VD、1.00 V答案:D13、对于一个一级反应,如其半衰期t1/2在0.0100 s以下即称为快速反应,此时它的速率常数k值在A、69.3 s-1以上B、6.39 s-1以上C、0.0693 s-1以上D、6.39 s-1以下答案:A−B为二级反应,若A的起始浓度为1.00 mol·dm-3,在开始反应1 h之14、反应2A−→后减少了一半,那么2 h后,A的浓度将为A、0.125B、0.333C、0.250D、0.491答案:B15、在各种不同的原子中3d和4s电子的能量相比时A、3d一定大于4sB、4s一定大于3dC、3d与4s几乎相等D、不同原子中情况可能不同答案:D16、下列关于屏蔽效应的说法中,正确的一个是A、4s电子的屏蔽常数σ4s反映了4s电子屏蔽原子核作用的大小B、当n和Z相同时,某电子的σ值愈大,该电子的能量就愈低C、主量子数n相同,角量子数l不同;随l增大,电子的屏蔽作用增大D、当屏蔽电子数目愈多或被屏蔽电子离核愈远时,σ值也愈大答案:D17、下列各对分子型物质中,沸点高低次序不正确的是A、HF > NH3B、S2(g) > O2C、NH3 > PH3D、SiH4 > PH3答案:D18、已知金刚石晶胞是类似于立方ZnS 型的面心立方晶格,则晶胞中碳原子数是A、4B、8C、12D、6答案:BO的键级是19、按分子轨道理论,-2A、1B、2C、1D、答案:C20、下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V形)的是NH B、SO2C、H3O+D、OF2A、+4答案:D二、填空(20小题,共20分)1、0℃ 和标准压力下,1 dm 3水能溶解49.0 cm 3 O 2 和23.5 cm 3 N 2,在相同的条件下,1 dm 3水约能溶解空气 ________________________ cm 3。
《无机化学》期末考试试卷及参考答案
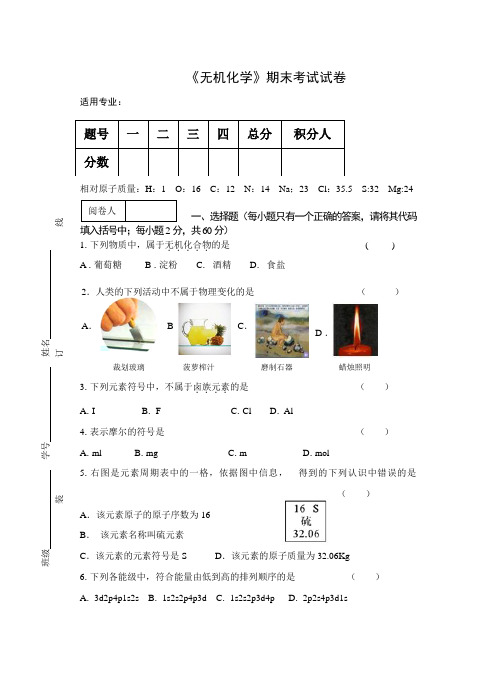
《无机化学》期末考试试卷适用专业:相对原子质量:H :1 O :16 C :12 N :14 Na ;23 Cl :35.5 S:32 Mg:24一、选择题(每小题只有一个正确的答案,请将其代码填入括号中;每小题2分,共60分) 1.下列物质中,属于无机化合物.....的是 ( ) A .葡萄糖 B .淀粉 C . 酒精 D . 食盐3.下列元素符号中,不属于卤族元素....的是 ( ) A .I B . F C .Cl D . Al4.表示摩尔的符号是 ( ) A .ml B .mg C .m D .mol5.右图是元素周期表中的一格,依据图中信息, 得到的下列认识中错误的是( )A .该元素原子的原子序数为16B . 该元素名称叫硫元素C .该元素的元素符号是SD .该元素的原子质量为32.06Kg 6.下列各能级中,符合能量由低到高的排列顺序的是 ( ) A . 3d2p4p1s2s B . 1s2s2p4p3d C . 1s2s2p3d4p D . 2p2s4p3d1s题号 一 二 三 四 总分 积分人 分数裁划玻璃A .B 菠萝榨汁C .磨制石器D .蜡烛照明2.人类的下列活动中不属于物理变化的是 ( ) 阅卷人班级 学号 姓名 - -------------------------------------装--------------------------------------------订---------------------------------------线-------------------------------------7. 5.5 mol 水的质量是 ( ) A . 18g B . 9g C . 99g D . 108g( )9.在标准状况下,任何气体的标准摩尔体积都是 ( ) A . 2.24L B . 11.2L C . 22.4L D . 224L10.下列物质的分子中属于极性分子的是 ( ) A . CO 2 B . O 2 C . HCl D . I 211.NaOH 的摩尔质量是 ( ) A . 4g B . 40 g/mol C . 40 Kg D . 28 mol12.在0.0001 mol/L 的NaOH 溶液中H +浓度为 ( ) A .10-4 mol/L B .10-10 mol/L C . 10-14 mol/L D .10-7mol/L14. 196g H 2SO 4的物质的量是 ( ) A .1mol B .2mol C .3mol D . 0.2mol 15. 浓度为0.01 mol/L 的稀盐酸的pH 是 ( ) A . 7 B . 2 C . 4 D . 816. 在标准状况下44.8L N 2气体的物质的量是 ( ) A .2mol B .1mol C .0.5mol D . 0.2mol17.配制250mL0.1mol/L 的NaOH 溶液需要NaOH 的质量是 ( ) A . 1g B . 10g C . 0.1g D .4gA . 试管B .烧瓶 D . 锥形C .容量瓶8.配制一定物质的量的浓度的溶液应选用的主要仪器是13.下列图像中不是..p 亚层电子云的是 ( ) A.C .B.D.19.配制250mL0.1mol/L 的NaCl 溶液应该选用的容量瓶的规格是 ( ) A . 250 mL B .200mL C . 100mL D . 500mL 20. 0.5mol 的水中含有的水分子个数是 ( ) A .3.01×1023B .6.02×1023C . 1.8×1023D .6.02×102221.标准状况下,与6.4gO 2的分子数目相同的CO 2气体的体积是 ( ) A . 22.4L B .11.2L C .4.48L D .2.24L22.在纯水中pH=7的原因是纯水 ( ) A . [H +]﹥[OH -] B . [H +]﹤[OH -] C . [H +]=[OH -] D .只有[H +] 无[OH -] 23.阿伏伽德罗常数是 A .5×1026B . 3.01×1022C . 6.02×1023D .3.01×1022.24.食盐属于 ( ) A .分子晶体 B .原子晶体 C . 离子晶体 D . 金属晶体 25.物质的量的国际单位是 ( ) A .千克 B .克 C .摩尔 D . 米27.非极性分子与非极性分子之间的作用力主要是 ( ) A .取向力 B .诱导力 C .色散力 D . 氢键28.在通常情况下,水的离子积常数.....是 ( ) A . 1×10-8B .1×10-7C .1×10-14D .1×10-1018.下图是元素周期表中某元素的原子结构示意图, ( ) 依据图中信息所得的结论错误的是 A .该元素的原子很容易得到电子 B .C. 该元素在第一主族 D . 该元素是碱金属元素v26.如图表示某可逆反应的化学平衡建立过程,下 列对于图像中的意义分析有错误的是A . 正反应速率在不断的减小B . 逆反应速率不断增大C .达到平衡时正反应和逆反应都停止,速率都为零D .达化学平衡时正、逆反应速率相等,29.某可逆反应的逆反应的平衡常数K 逆为4,则正反应的平衡常数K 正为( ) A .0.25 B .10 C .2 D .530. 金属铝属于 ( ) A . 原子晶体 B . 分子晶体 C .金属晶体 D .离子晶体 二、判断题(正确的打“√”,错误的打“×”;每小题1分,共10分)31.元素周期表中同一周期的元素随着原子序数的递增原子的半径由大变小 ( ) 32.元素周期表中同一主族的元素原子的最外层电子数一定相等 ( ) 33.分子是否有极性取决于整个分子中正负电荷的重心是否重合 ( ) 34.氧化还原反应的特征是有元素化合价的升降 ( ) 35. 强酸弱碱盐水解,溶液呈酸性 p H ﹤7 ( ) 36. 原电池是一种将电能转变为化学能的装置 ( ) 37. 物质的量就是指物质的质量 ( )38. 酸性溶液中[OH -]﹥[H +]﹥1×10-7mol/L ( ) 39.电子云图中的一个小黑点就代表一个电子. ( )40. 在NaAc-HAc 组成的缓冲溶液 中抗酸成分是HAc ( ) 三、填空题(每空1分,共10分)41. 硫酸四氨合铜(Ⅱ)的化学式是 。
无机化学期末试题题库(130道)

无机化学期末试题1、无机化学研究内容不包括的是()——[单选题]A 物质组成B 结构C 性质D 合成正确答案:D2、某元素处在周期表中的第三周期,该元素原子的电子层数为——[单选题]A 1B 3C 2D 4正确答案:B3、据报道,1995年我国科研人员在兰州首次合成了新核素镤-239,其原子核内有148个中子,则该元素的原子序数为——[单选题]A 148B 239C 91D 108正确答案:C4、不是共轭酸碱对的一组物质是——[单选题]A NH3, NH4+B NaOH, Na+C HS-, S2-D H2O, OH-正确答案:B5、生理盐水的质量浓度为——[单选题]A 4g/LB 9g/LC 15g/LD 50g/L正确答案:B6、2mol MgCl2 和1mol AlCl3中,Cl-的物质的量之比为——[单选题]A 3:2B 2:3C 4:3D 3:4正确答案:C7、物质的量浓度的单位是——[单选题]A mol/LB g/LC 1D g/mol正确答案:A8、下列溶液中渗透压最大的是——[单选题]A 0.1mol·L-1AlCl3B 0.1mol·L-1CaCl2C 0.1mol·L-1葡萄糖(C6H12O6)D 0.1mol·L-1NaCl正确答案:A9、下列说法正确的是——[单选题]A NaCl的质量浓度是0.1mol/LB 水的摩尔质量是18C 1mol H2的质量是2gD 1mol O的质量是32g正确答案:C10、正常人血浆(37˚C时)渗透浓度范围是——[单选题]A 210~280mmol/LB 280~320mmol/LC 280~320mol/LD 380~410mmol/L正确答案:B11、一个电对中,氧化态的氧化能力越强,则其共轭还原态的还原能力——[单选题]A 无法确定B 越强C 越弱D 影响不大正确答案:C12、将12.5g葡萄糖溶于水,配成250mL溶液,该溶液的质量浓度为——[单选题]A 25 g/LB 5.0 g/LC 50 g/LD 0.025 g/L正确答案:C13、决定多电子原子轨道能量的量子数是——[单选题]A n,lB nC lD n,l,m正确答案:A14、正常人血浆(37˚C时)渗透压范围是——[单选题]A 210~280kPaB 720~800kPaC 440~600kPaD 500~1000kPa /L正确答案:B15、下列说法正确的是——[单选题]A p轨道之间以“肩并肩”方式重叠形成σ键B p轨道之间以“头碰头”方式重叠形成π键C p轨道之间以“头碰头”方式重叠形成σ键D s轨道之间以“头碰头”方式重叠形成π键正确答案:C16、基态的电子组态是——[单选题]A [Ar]4s23d4B [Kr]4s23d4C [Ar] 3d54s1D [Xe] 3d54s1正确答案:C17、在氧化还原反应中失去电子的物质是——[单选题]A 氧化剂B 还原剂C 氧化产物D 还原产物正确答案:B18、如果将氮原子的价层电子的运动状态写成为:2,1,0,+1/2; 2, 1,0,-1/2; 2,1,1,+1/2。
无机化学b习题答案

无机化学b习题答案无机化学B习题答案无机化学是研究无机物质及其性质、结构和反应规律的科学。
在学习无机化学的过程中,我们经常会遇到各种各样的习题,通过解答这些习题可以帮助我们巩固知识、提高分析问题和解决问题的能力。
本文将为大家提供一些无机化学B习题的答案,希望能对大家的学习有所帮助。
1. 铝是一种常见的金属元素,其原子序数为13。
请问铝的电子排布是什么样的?答案:铝的电子排布为1s²2s²2p⁶3s²3p¹。
其中,1s²表示1s轨道上有两个电子,2s²表示2s轨道上有两个电子,2p⁶表示2p轨道上有六个电子,3s²表示3s轨道上有两个电子,3p¹表示3p轨道上有一个电子。
2. 铁是一种重要的金属元素,其原子序数为26。
请问铁的电子排布是什么样的?答案:铁的电子排布为1s²2s²2p⁶3s²3p⁶4s²3d⁶。
其中,1s²表示1s轨道上有两个电子,2s²表示2s轨道上有两个电子,2p⁶表示2p轨道上有六个电子,3s²表示3s轨道上有两个电子,3p⁶表示3p轨道上有六个电子,4s²表示4s轨道上有两个电子,3d⁶表示3d轨道上有六个电子。
3. 氯是一种常见的非金属元素,其原子序数为17。
请问氯的电子排布是什么样的?答案:氯的电子排布为1s²2s²2p⁶3s²3p⁵。
其中,1s²表示1s轨道上有两个电子,2s²表示2s轨道上有两个电子,2p⁶表示2p轨道上有六个电子,3s²表示3s轨道上有两个电子,3p⁵表示3p轨道上有五个电子。
4. 请问氯离子的电子排布是什么样的?答案:氯离子是氯原子失去一个电子形成的,因此氯离子的电子排布为1s²2s²2p⁶3s²3p⁶。
无机化学b1考试题型及答案

无机化学b1考试题型及答案一、选择题(每题2分,共20分)1. 下列哪种元素的原子序数为11?A. 钠B. 镁C. 铝D. 钾答案:A2. 以下化合物中,属于共价化合物的是?A. NaClB. HClC. NaOHD. MgO答案:B3. 哪种元素的电子排布式为1s²2s²2p⁶3s²3p⁶?A. 氧B. 硫C. 氯D. 氩答案:D4. 下列化合物中,属于离子化合物的是?A. H₂OB. CO₂C. NaClD. CH₄5. 根据元素周期表,下列元素中属于第ⅢA族的是?A. 硼B. 铝C. 镓D. 铟答案:C6. 哪种元素的原子半径在所有元素中最大?A. 氢B. 氦C. 铯D. 钫答案:C7. 以下化合物中,属于金属氧化物的是?A. Fe₂O₃B. H₂OC. COD. SO₃答案:A8. 哪种元素的电负性最高?A. 氟B. 氧C. 氮D. 氯答案:A9. 下列化合物中,属于共价键的是?B. HClC. NaOHD. MgO答案:B10. 根据元素周期表,下列元素中属于第ⅤA族的是?A. 氮B. 磷C. 砷D. 锑答案:B二、填空题(每题3分,共30分)1. 元素周期表中,第______周期的元素数量最多。
答案:六2. 原子的电子排布遵循______原理。
答案:泡利不相容3. 元素的金属性越强,其最高价氧化物对应的水化物的______性越强。
答案:碱性4. 元素的非金属性越强,其最高价氧化物对应的水化物的______性越强。
答案:酸性5. 元素周期表中,第______族的元素都是非金属元素。
答案:ⅦA6. 元素周期表中,第______族的元素都是金属元素。
7. 元素周期表中,第______周期的元素都是过渡金属元素。
答案:四至七8. 元素的电负性越大,其______性越强。
答案:非金属9. 元素的电离能越大,其______性越强。
答案:金属10. 元素的原子半径越大,其______性越强。
《无机化学》期末考试试卷及答案

《无机化学》期末考试试卷试卷(一)一、填空题(每空1分,共44分)1.当体系的状态被改变时,状态函数的变化只决定于_________,而与_________无关2.空气中的SO2与水作用并经氧化,生成___________ 使大理石转化为_________, ________,因而使雕象遭到破坏.3.已知:碘元素的电势图: 0.145V Eø0.535VIO3–IO–I2I–0.49V则:EøIO–/I2=_______, EøIO3–/I–=_____________4.电解浓度为1mol·L﹣1的H2SO4溶液(铂为电极),阴极产物是______, 阳极产物是______ 已知:Eø O2/OH﹣=1.229V, Eø H+/H2 = 0.000V, Eø S2O82﹣/SO42﹣=2.01V5.我国化学家徐光宪总结归纳出了能级的相对高低与____________________有关,且能级的高低与值有关的近似规律.6.制备胶体的方法有_______和_______.7.气体的基本特征是它的性和性。
8.在0.1mol·L-1的HAc溶液中加入0.1mol·L-1NaAc溶液,HAc的电离度将________________,这种作用被称为__________________.9.离子的结构特征一般包括: 离子电荷、、三个方面.10.已知:2A+B=2C为简单反应,此反应对A物质反应级数为___________,总反应为____________级反应.11.共价键按共用电子对来源不同分为_____________和_______________;共价键按轨道重叠方式不同分为_______________和________________。
12.亚氯酸可用_____________________反应而制得水溶液,它极不稳定迅速分解,反应式为:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机化学期末考试试卷(B卷)答案课程考试试卷答案(B卷)课程名称:普通化学和无机化学考试时间:120分钟年级:xxx级专业:xxx题目部分,(卷面共有53题,100分,各大题标有题量和总分)一、单项选择题(20小题,共20分)1、在标准状态下, 1.0 dm3氢气的质量应为A、0.089 gB、0.11 gC、9.0 gD、11.2 g答案:A2、扩散速率三倍于水蒸气的气体是A、HeB、H2C、CO2D、CH4答案:B3、欲配制pH = 13.00 的溶液10.0 dm3, 所需NaOH 固体的质量是(相对原子质量: Na 23 )A、40 gB、4.0 gC、4.0×10-11 gD、4.0×10-12 g答案:A4、有一种称“墨海”的带盖砚台,其结构如图所示,当在砚台中加入墨汁,在外圈加入清水,并盖严,经过足够的时间,开盖看到的情况是A、砚中墨汁干枯,外圈水成淡墨B、砚中墨汁变淡,外圈水成淡墨,且二者浓度相同C、砚中墨汁变淡,外圈水干枯D、没有发生变化答案:C5、下列说法正确的是A、当液体与其蒸气处于平衡时,蒸气的压力称为液体的饱和蒸气压B、液体混合物的蒸气压等于各纯组分液体的蒸气压之和C、非电解质稀溶液中某一液体组分的蒸气分压等于它在相同温度下的饱和蒸气压与其在溶液中的摩尔分数之积D、蒸气压的大小与容器体积的大小有关答案:C6、已知:2H 2(g) + S 2(g)2H 2S(g) K p 1 2Br 2(g) + 2H 2S(g)4HBr(g) + S 2(g) K p 2 H 2(g) + Br 2(g)2HBr(g) K p 3 则K p 3 等于A 、(K p 1 / K p 2 )1/2B 、(K p 2·K p 1)1/2C 、K p 2 /K p 1D 、K p 2·K p 1 答案:B7、氢硫酸电离常数K 1 = 1 ⨯ 10-7,K 2 = 1 ⨯ 10-13,在0.1 mol ·dm -3 H 2S 水溶液中溶液的pH 值是A 、10-2B 、 2C 、 3D 、4 答案:D8、用0.20 mol ·dm -3 HAc 和0.20 mol ·dm -3 NaAc 溶液直接混合(不加水),配制1.0 dm 3 pH = 5.00的缓冲溶液,需取0.20 mol ·dm -3 HAc 溶液为 (p K a (HAc) = 4.75)A 、6.4 ⨯ 102 cm 3B 、6.5 ⨯ 102 cm 3C 、3.5 ⨯ 102 cm 3D 、3.6 ⨯ 102 cm 3 答案:D9、钒的电势图为 1.000.360.25()()()()VVVV V V IV V III V II ++-已知: ϕ(Zn 2+/Zn) = -0.76 V , ϕ(Sn 4+/Sn 2+) = +0.15 Vϕ(Fe 3+/Fe 2+) = +0.77 V , ϕ(S/H 2S) = +0.14 V欲将V(V) 还原到V(IV),在下列还原剂中应选用 A 、FeSO 4 B 、Zn C 、SnCl 2 D 、H 2S答案:A10、对于下面两个反应方程式,说法完全正确的是 2Fe 3+ + Sn 2+Sn 4+ + 2Fe 2+Fe 3+ + 21Sn 2+21Sn 4+ + Fe 2+ A 、两式的 E , m r G ∆,K C 都相等 B 、两式的 E , m r G ∆,K C 不等 C 、两式的 m r G ∆相等, E ,K C 不等 D 、两式的 E 相等, m r G ∆,K C 不等答案:D11、铅蓄电池在充电时,阳极反应是A 、PbSO 4 + H 2O =PbO 2 + 4H + + SO -24+ 2e -B 、Pb + SO -24= PbSO 4+ 2e -C 、PbSO 4+ 2e -= Pb + SO -24D 、PbO 2+ 4H ++ SO -24+ 2e -= PbSO 4 + 2H 2O答案:A12、已知金属M 的下列标准电极电势数据:(1) M2+ (aq) + e-= M+(aq) 1ϕ= -0.60 V(2) M3+ (aq) + 2e-= M+(aq) 2ϕ= 0.20 V则M3+ (aq) + e-= M2+ (aq) 的 ϕ是A、0.80 VB、-0.20 VC、-0.40 VD、1.00 V答案:D13、对于一个一级反应,如其半衰期t1/2在0.0100 s以下即称为快速反应,此时它的速率常数k值在A、69.3 s-1以上B、6.39 s-1以上C、0.0693 s-1以上D、6.39 s-1以下答案:A−B为二级反应,若A的起始浓度为1.00 mol·dm-3,在开始反应1 h之14、反应2A−→后减少了一半,那么2 h后,A的浓度将为A、0.125B、0.333C、0.250D、0.491答案:B15、在各种不同的原子中3d和4s电子的能量相比时A、3d一定大于4sB、4s一定大于3dC、3d与4s几乎相等D、不同原子中情况可能不同答案:D16、下列关于屏蔽效应的说法中,正确的一个是A、4s电子的屏蔽常数σ4s反映了4s电子屏蔽原子核作用的大小B、当n和Z相同时,某电子的σ值愈大,该电子的能量就愈低C、主量子数n相同,角量子数l不同;随l增大,电子的屏蔽作用增大D、当屏蔽电子数目愈多或被屏蔽电子离核愈远时,σ值也愈大答案:D17、下列各对分子型物质中,沸点高低次序不正确的是A、HF > NH3B、S2(g) > O2C、NH3 > PH3D、SiH4 > PH3答案:D18、已知金刚石晶胞是类似于立方ZnS 型的面心立方晶格,则晶胞中碳原子数是A、4B、8C、12D、6答案:BO的键级是19、按分子轨道理论,-2A、1B、2C、1D、2答案:C20、下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V形)的是A 、+4NHB 、SO 2C 、H 3O +D 、OF 2答案:D二、填空(20小题,共20分)1、0℃ 和标准压力下,1 dm 3水能溶解49.0 cm 3 O 2 和23.5 cm 3 N 2,在相同的条件下,1 dm 3水约能溶解空气 ________________________ cm 3.答案:设空气组成为 79% N 2和21% O 2 ,溶解量与分压力(或分体积)成正比23.5×79 % + 49.0×21 % = 28.9 cm 32、有一种称“墨海”的带盖砚台,其结构如图所示,当在砚台中加入墨汁,在外圈加入清水,并盖严,经足够长的时间,开盖后发现外圈水已干枯,而砚台中墨汁变淡,这是因为 .答案:墨汁为浓的 溶液和悬浊液的混合物,其蒸气压低于纯溶剂水的蒸气压.从而是水不断蒸发并溶于墨汁中,使墨汁变淡,直至水蒸发完为止.3、 一个m r H ∆ > 0的反应,在 m r S ∆_____________、温度____________时可能自发进行. 答案: > 0、较高4、一定温度下,反应PCl 5(g)PCl 3(g) + Cl 2(g) 达到平衡后,维持温度和体积不变,向容器中加入一定量的惰性气体,反应将___________ 移动. 答案:不5、Zn 2+ 离子的第一步水解常数是 1.0 ⨯ 10-9,0.001 mol ·dm -3 ZnCl 2溶液的pH 值是____________. 答案:66、采用镍阳极,电镀液是硫酸镍溶液,电镀镍时:阳极反应___________________________________________________________;阴极反应___________________________________________________________; 总反应式___________________________________________________________. 答案:阳极反应:Ni – e - =Ni 2+阴极反应:Ni 2++ 2e - = Ni总反应:Ni (阳)+ Ni 2+= 2()NiNi +电解阴7、至今没有得到FeI 3这种化合物的原因是______________________________________________.答案:因为Fe 3+具有氧化性,而I -具有还原性,所以Fe 3+和I -不能共存.8、反应A −→−2B + 1 / 2C如对A来说,反应是一级反应,其速率方程表达式为______________________. 如dB 、 / d t = 1.0 mol ·dm -3·min -1, 则-dA 、 / d t =_____________________; dC 、 / d t =___________________________________. 答案:v = k A-d A d ()t = 0.5 mol ·dm -3·min -1 d C d ()t = 0.25 mol ·dm -3·min -1 9、某一级反应,其反应物消耗掉7/8所需时间是反应物消耗掉3/4所需时间的 倍. 答案:1.510、一粒1.0 ⨯ 10-7 g ,以1.0 cm ·s -1速率运动的尘埃相关的德布罗意波的波长是: _____________________________________. (h = 6.63 ⨯ 10-34J ·s) 答案:010.0100.1100.11063.63734⨯⨯⨯⨯⨯=---λ= 6.6×10-22 (m) 11、写出下列原子的中文名称、原子序数、质子数、中子数及质量数:H 21H 31 F199Sn11750U2359212、原子序数为77的元素,其原子核外电子分布式是_________________________________该元素在周期表中位于第_________周期第__________族. 答案:1s 22s 22p 63s 23p 63d 104s 24p 64d 104f 145s 25p 65d 7 6s 2 6, Ⅷ 13、下列气态原子或离子在基态时各有几个不成对电子?5B ( ) 8O ( ) 21Sc 3+( ) 24Cr 3+( ) 77Ir 3+( )答案:B(1) O(2) Sc 3+(0) Cr 3+(3) Ir 3+(4)14、第三周期有两个成单电子的元素是_______,_______;第四周期元素中未成对电子最多可达_____个;3d 轨道为半满的+3价阳离子是___________. 答案:Si S 6 Fe 3+15、法国科学家德布罗意依据E = mc 2和E = h ν 推导出预言物质波的波长的计算公式是 . 答案:λ=h p16、 Na 原子核最外层电子的四个量子数n , l , m , m s 依次为 ;Sc 原子最外层电子的四个量子数依次为 ;P 原子核外最高能级上的三个电子的量子数分别为 , ,和 . 答案:3, 0, 0,21(或21- ) 4, 0, 0,21 (或21-) 3, 1, 0,21;3, 1, 1,21 3, 1, -1,21 (后面三个空中,m s 也可同时为21-)17、波函数ψ 是描述_________________________数学函数式,它和____________是同义词.|ψ | 2的物理意义是____________,电子云是____________的形象化表示. 答案:核外电子运动状态 原子轨道 概率密度 概率密度18、在真空管、质谱仪和加速器中运动的电子,可以用____________力学处理,因为_____________________________________________________________________________. 答案:经典, x >> h , 不确定关系不起作用.19、下列各物种的几何构型是: SO 32-,IF 5 . 答案:三角锥 四方锥20、按分子轨道理论,下列离子或分子中未配对的电子数分别是:O 22- ,O 2- ,O 2 ,O 2+ ,NO .答案:0 1 2 1 1 三、计算(5小题,共20分)1、当一铜片暴露在室温空气下,为黑色CuO 覆盖,在较高一些温度,黑色CuO 转变成红色Cu 2O ,在更高温度下,氧化物覆盖层消失.根据热力学数据计算有关转变温度,分析上述反应过程.298 K Cu(s) CuO(s) Cu 2O(s) O 2(g) m f G ∆/ kJ ·mol -1 0.00 -130 -146 0m f H ∆/ kJ ·mol -1 0.00 -157 -169 0 m S / J ·mol -1·K -133.15 42.63 93.14 205.03答案:298 K C u(s) +21O 2(g)= CuO(s)mr G ∆ = -130 kJ ·mol -12Cu(s) +21O 2(g)= Cu 2O(s)mr G ∆ = -146 kJ ·mol -1 Cu 2O(s) +21O 2(g)= 2CuO(s) mrG∆ = -114 kJ ·mol -1Cu 无论氧化成Cu 2O 或CuO 皆可发生,但室温Cu 2O 可转化成CuO.CuO 不能转化成Cu 2O ,故Cu 片暴露在室温空气下,生成黑色CuO.2CuO(s)= Cu 2O(s) +21O 2(g)m r H ∆= -169 + 2 ⨯ 157 = 145 (kJ ·mol -1) m r S ∆=205032.+ 93.14 – 2 ⨯ 42.63 = 0.1104 (kJ ·mol -1·K -1) T 转 =mr m r S H ∆∆=14501104.=1.31⨯103 (K) 所以温度升至1.31 ⨯ 103 K ,CuO 转变成Cu 2O. Cu 2O(s) =2Cu(s) +21O 2(g)m r H ∆= 169 kJ ·mol -1m r S ∆=21⨯ 205.03 + 33.15 ⨯ 2 – 93.14 = 0.07568 (kJ ·mol -1·K -1)T 转 = 169 / 0.07568 = 2.23 ⨯ 103 (K) 温度升至2230 K ,Cu 2O 转变成Cu.2、(1) 0.055 mol ·dm -3二氯乙酸pH 为1.53,求二氯乙酸的K a . (2) 0.010 mol ·dm -3 NaOC 6H 5 pH = 11.0,求HOC 6H 5的K a .(3) 一定量的未知一元弱酸用NaOH 溶液滴定,加入12.6 cm 3 NaOH 溶液pH = 4.65,加入21.0cm 3 NaOH 溶液正好完全中和,求该未知酸的K a .答案:(2.9510)0.0550.029522⨯-=- 3.4⨯10-2(1) K b =(1.010)0.0100.001032⨯--= 1.1 ⨯ 10-4 K a =b w K K = 9.1 ⨯ 10-11(2)pH = p K a + lg12.6/(21.0-12.6)p K a = 4.47K a = 3.4 ⨯ 10-53、已知电池Pt |H 2 ( p ) |H + (1 mol ·dm -3) |O 2 ( p ) |Pt 电动势在298.15 K 时是1.229 V ,计算该温度下水的m f G ∆是多少?答案:该电池的两个半反应是:正极4H +(aq) + O 2(g) + 4e -= 2H 2O(l)负极H 2(g)= 2H +(aq) + 2e -电池反应:2H 2(g) + O 2(g) = 2H 2O(l)m r G ∆= - zFE = -4 ⨯ 96.5 ⨯ 1.229 = -474 (kJ ·mol -1)m f G ∆ (H 2O,l) =21 m r G ∆=21⨯ (-474) = -237 (kJ ·mol -1) 4、已知 PbSO 4 + 2e - =Pb + SO -24 ϕ= -0.359 VPb 2+ + 2e - =Pb ϕ= -0.126 V当[Pb 2+] = 0.100mol ·dm -3,[SO 42-] = 1.00mol ·dm -3时,由PbSO 4 / Pb 和Pb 2+ / Pb 两个半电池组成原电池.(1) 写出该原电池的符号及电池反应方程式,并计算原电池的电动势; (2) 计算PbSO 4的K sp .答案:(1) Pb(s),PbSO 4(s)│-24SO (1.0 mol ·dm -3)‖Pb 2+(0.100 mol ·dm -3)│Pb(s) 电池反应:Pb 2+ +-24SO = PbSO 4E =ϕ(+) –ϕ(-) = (-0.126 + (0.0591/2)·lg0.100 - (-0.359) = 0.203 (V) (2) lg K = zE / 0.0591 = 2 ⨯ [-0.126 - (-0.359)] / 0.0591 = 7.885lg K sp = -lg K = -7.885K sp = 1.30 ⨯ 10-85、金属铁(α)的晶格类型是体心立方,对称单元是铁原子,a = 286 pm.采用单晶(α)作合成氨催化剂,当截取不同晶面进行催化反应时,反应速率大不相同.如图a, b, c 三晶面,其中一个晶面上反应速率要比其它晶面快430倍,该晶面具有特殊的使N 2中化学键断裂的活性中心,该晶面通过的铁原子中心数目最小,而截过的铁原子数目最大.它是哪一个晶面?每平方厘米通过的铁原子中心数目是多少?b答案:该晶面是c 晶面N a a =⨯=⨯12122213/sin60(28610)-102= 7.06 ⨯ (cm -2)四、问答题(8小题,共40分)1、指出下列各种碱的共轭酸 .C 5H 5N ,HPO 42-,O 2+,CH 3COOH ,[Co(CO)4] - 答案:C 5H 5NH +,H PO 24-,OH -,CH CO H 322+,HCo(CO)42、指出下列各式中的Br φnsted 酸及其共轭碱:(1)-4HSO + OH - =-24SO+ H 2O (2)-34PO + H 2O=-24HPO+ OH -(3) H 2Fe(CO)4 + CH 3OH = [FeH(CO)4]-+CH OH 32+答案:酸/共轭碱:(1)HSO 4-/SO 42-,H 2O / OH -(2) H 2O / OH -,HPO 42-/PO 43-(3) H 2Fe(CO)4 / [FeH(CO)4] -,+23OH CH / CH 3OH 3、指出下列各式中的酸、碱、共轭酸和共轭碱: (1) HNO 3 + H 2O= H 3O + +-3NO(2) -23CO + H 2O=-3HCO+ OH -(3) NH 3 +H 2S=+4NH+ HS -答案:酸/共轭碱:(1) HNO 3 /NO 3-,H 3O + / H 2O (2) H 2O / OH -,HCO 3-/CO 32-(3) H 2S / HS -,NH 4+/ NH 34、在酸性溶液中,锰元素的电势图为:(1) 计算电OMnO -4/MnO 2 的ϕ;(2) 锰的哪几种氧化态在酸性溶液中是不稳定的,容易歧化?(3) 在酸性介质中,用KMnO 4氧化Fe 2+ 时,当KMnO 4过量时会发生什么现象?写出有关反应方程式.答案:(1) ϕ(-4MnO / MnO 2) =2126.2256.01+⨯+⨯= 1.69 (V)(2) Mn 3+易歧化为MnO 2和Mn 2+;-24MnO 易歧化为-4MnO 和MnO 2;(3)先发生下列反应:-4MnO + 5Fe 2+ + 8H + =Mn 2+ + 5Fe 3+ + 4H 2O当 KMnO 4过量时还发生下列反应:2-4MnO + 3Mn 2+ + 2H 2O =5MnO 2↓+ 4H + 所以-4MnO 可氧化Mn 2+成为MnO 2沉淀.5、化学反应的级数和反应分子数的区别是什么? 答案:反应级数是用于宏观化学反应的,它表明了反应速率与浓度的几次方成正比的关系,它既适用于基元反应,也适用于非基元反应,只要化学反应能纳入v = k (A)m (B)n …的形式,这里的m 、n 是由实验测定的;它们可以是零、整数或分数.而反应分子数是为描述基元反应的微观变化提出来的概念.反应分子数就是参加基元反应相碰撞的反应物的微粒数目,它只可能是一、二、三等正整数,不可能是更大的数目或零或分数.6、用价层电子对互斥理论估计 COCl 2分子的构型和键角. 答案:COCl 2分子以C 为中心价层电子对数 = (4 + 0 + 1 ⨯ 2) / a = 3分子构型为平面三角形,如图所示:ClC由于碳氧双键电子云密度较大,使Cl —C —Cl 键角略小于120°,而Cl —C —O 键角略大于120°. 7、(1) 用VSEPR 理论判断IF 6+和IF 7可能的结构; (2) 写出可能用于制备[IF 6][SbF 6]的反应方程式. 答案:(1) 八面体,五角双锥体(2) IF 7 + SbF 5−→−[IF 6][SbF 6] 8、应用价层电子对互斥理论,画出下列化合物的空间构型(标出孤电子对的位置) (1) XeOF 4 (2) -2ClO(3) -56IO(4) -3I (5) PCl 3 答案:(1) XeOF 4(2)-2ClO ClO(3)-56IO(4)-3I三角双锥) (5) PCl 3P ClCl。
