大学有机化学期末复习知识点总结.doc
完整版大学有机化学知识点整理考试必备

完整版大学有机化学知识点整理考试必备一、基础概念1. 有机化学的定义2. 同分异构体的定义和分类3. 共价键的构成和性质4. 电子云模型和分子轨道模型5. 共轭体系和杂环化合物的概念6. 化学平衡7. 离子的化学性质8. 酸碱性及其影响因素二、物质分类和性质1. 醇的性质及其与酸反应2. 烷基卤化酯的性质及其合成3. 胺的性质及其与酸碱反应4. 羧酸的性质及其合成5. 酯的性质及其制备、加成和加水反应6. 假脂类的性质及其与酸碱的反应7. 烷基磺酸酯的性质及其合成8. 脂肪族化合物的氧化和还原反应三、化学反应和机理1. 反应速率和速率常数2. 化学反应的平衡常数3. 酸催化和碱催化的化学反应4. 木质素的生物合成和人工合成5. 光化学反应的能量和机理6. 重绝旋化合物的立体化学和合成方法7. 质子转移催化的克鲁森斯基反应和迈克尔加成反应8. 半羧酸的制备和酯化反应四、有机分析和表征1. 元素分析和红外光谱分析2. 液体和气相色谱分析3. 质谱和核磁共振分析4. 过氧化氢值的测定和比色法分析5. 紫外光谱和拉曼光谱分析6. 纯度的测定和晶体衍射分析7. 氢谱和电子自旋共振分析8. 光电子能谱和电子能损谱分析五、应用和前沿1. 医药,例如:阿司匹林的合成和应用2. 食品,例如:食用油的合成和性质3. 环境,例如:污染物的分析和去除4. 原料化工和新能源,例如:糖基化合物的生产和利用5. 生物学和材料科学,例如:合成生物材料和功能化金属氧化物6. 多相催化和光化学反应机理研究7. 有机化学的计算方法和机器学习应用8. 网络化学和人工智能发展对有机化学的影响有机化学知识点非常广泛深奥,以上只是其中一部分,仅供参考。
在学习过程中,建议多数练习和思考,加强理解和记忆。
(完整版)大学有机化学知识点整理考试必备

大学有机化学知识点提纲(一)绪论共价键价键理论(杂化轨道理论);分子轨道理论;共振论.共价键的属性:键能;键长;键角;键的极性.键的极性和分子极性的关系;分子的偶极矩.有机化合物的特征(二)烷烃和环烷烃基本概念烃及其分类;同分异构现象;同系物;分子间作用力;a键,e键;构型,构象,构象分析,构象异构体;烷基;碳原子和氢原子的分类(即1,2,3碳,氢;4碳);反应机理,活化能.对于基本概念,不是要求记住其定义,而是要求理解它们,应用它们说明问题.命名开链烷烃和环烷烃的IUPAC命名,简单的桥环和螺环的命名.烷烃和环烷烃的结构碳原子sp3杂化和四面体构型;环烷烃的结构(小环的张力).烷烃的构象开链烷烃的构象,能量变化;环烷烃的构象:重点理解环己烷和取代环己烷的构象及能量变化,稳定构象,十氢萘及其它桥环的稳定构象.烷烃的化学性质自由基取代反应—卤代反应及机理;碳游离基中间体—结构,稳定性;不同的卤素在反应中的活性和选择性;反应过程中的能量变化.环烷烃的化学性质自由基取代反应(与烷烃一致);小环(3,4元环)性质的特殊性—加成.(三)烯烃烯烃的结构特点碳的sp2杂化和烯烃的平面结构;键和键.烯烃的同分异构,命名碳架异构,双键位置异构,顺反异构(Z,E).烯烃的物理和化学性质烯烃的亲电加成及其机理,马氏规则;碳正离子中间体—结构,稳定性,重排.其它加成反应:催化加氢(立体化学,氢化热);硼氢化—氧化(加成取向,立体化学);羟汞化—脱汞(加成取向);与HBr/过氧化物加成(加成取向);其它游离基加成.氧化反应:羟基化反应—邻二醇的形成;KMnO4/H+的氧化,臭氧化反应,烯烃结构的测定.α-位取代反应:烯丙基型取代反应(高温卤代和NBS卤代)及机理—烯丙基自由基.(四)炔烃和二烯烃炔烃①结构:碳的sp杂化和碳-碳三键;sp杂化,sp2杂化和sp3杂化的碳的电负性的差异及相应化合物的偶极矩.②同分异构体③化学性质:末端炔烃的酸性及相关的反应;三键的加成:催化加氢,亲电加成,亲核加成;碳—碳三键与H2/Lindlar催化剂反应(顺式烯烃);碳—碳三键与Na/液氨的反应(反式烯烃);加卤素;加HX(马氏规则);加H2O(羰基化合物的形成);加HBr/过氧化物;硼氢化—氧化;加HCN及乙炔的二聚;氧化反应:KMnO4氧化和臭氧化.二烯烃①共轭二烯烃的稳定性:键能和键长平均化,共轭效应.②二烯烃的化学反应:1,2-加成和1,4-加成(反应机理);反应的动力学控制和热力学控制(反应过程中的能量变化);烯丙型碳正离子的稳定性(p-共轭);Diels-Alder反应.(五)波谱分析紫外光谱理解各种跃迁(,n,,n)和各自的吸收能量波长;发色团和助色团;溶剂效应;最重要的是能够从一张UV谱图中得到有用的信息(判断结构)(不要求利用经验规则去计算某化合物之吸收波长).红外光谱理解IR光谱之基本原理,最重要的是利用IR光谱(结合其它波谱)推测有机分子的结构,这就要求对各类官能团的红外吸收范围有清楚的了解,并清楚影响峰位置变化的因素.核磁共振谱(1H NMR)(碳谱不要求)了解基本原理;基本概念:化学位移,内标,外标,偶合,偶合常数,屏蔽,去屏蔽等.清楚不同类型的枝质子的化学位移范围及影响因素;最重要的是利用NMR谱(结合其它波谱)推测有机分子的结构.质谱了解基本原理;几种重要的开裂方式(包括重要的重排开裂如麦氏重排,逆Diels-Alder重排等);最重要的是利用MS得出的分子离子峰(并结合其它波谱方法)推测有机分子的结构.本章最重要的是利用几种波谱方法结合推测有机分子的结构.(六)芳香烃苯的结构和芳香性理解芳香性的概念和判断芳香性的Hückel规则,能用此规则判断一给定的分子(或离子)是否是芳香性的.苯的异构,同系物和命名苯及其同系物的物理性质和波谱性质主要了解其波谱特征,例如芳香烃的NMR谱学特征,不同取代苯在IR指纹区的特征等.化学性质亲电取代反应及机理;傅氏反应的特点及局限;氯甲基化反应;Gatterman-Koch反应;芳香环上取代基的定位效应;其它反应:侧链氧化;侧链取代;芳香环上的还原:催化加氢,Birch还原.萘的结构和化学性质(七)立体化学基本概念对映异构(体);手性分子;镜像;旋光性,旋光度;对映体;非对映体;差向异构体;内消旋体;外消旋体;手征性;手性中心.对映异构体构型的表示法R/S法(次序规则).熟悉各类手性分子含1—3个手性碳原子的手性分子;不含手性碳原子的手性分子;环状化合物.立体异构体的制备和反应熟悉能产生立体异构体的化学反应及机理,象烯烃与卤素的反式加成,环氧乙烷的开环,羰基化合物的加成(Cram规则)等等.(八)卤代烃异构,分类,命名波谱性质,尤其是NMR谱化学性质亲核取代反应及机理(SN1,SN2);影响亲核取代及机理的因素;亲核试剂的亲核性;SN2反应的立体化学;SN1反应中的重排;邻基参与.消除反应及机理(E1,E2,E1cb):消除反应的取向(Saytzeff规则)和立体化学;消除反应和取代反应的竞争.卤代烃与Mg,Li,Na等的反应:Grignard试剂,有机锂试剂及其应用.(九)醇,酚,醚结构,分类,命名醇的物理性质和光谱性质氢键对其物理性质的影响;IR光谱和NMR谱的特征.醇的化学性质醇的酸性(与其它类型化合物如H2O,酚,羧酸酸性的比较);与酸性有关的反应(与金属如Na,Mg,Al的反应);醇的氧化(形成醛/酮,羧酸);熟悉各种氧化剂;醇的成酯反应:与无机酸成酯,与有机酸成酯(机理);卤化反应;用SOCl2卤化的立体化学及机理;用HX的卤代反应(Lucas试剂用来区别六个碳原子以下1,2和3醇);Wagner-Meerwein重排.醇的脱水反应:反应机理/扎依切夫规律;反应活性;重排;分子间脱水成醚.多元醇的反应:与HIO4或Pb(OAc)4的反应;片呐醇重排反应及机理.酚的物理性质和光谱性质酚的化学性质酸性及与之相关的反应;Fries重排;芳环上的亲电取代:卤代,硝化,磺化;其它亲电取代:与醛的作用;与CO2的作用;Reimer-Tiemann反应;酚的氧化反应.酚的制备方法异丙苯氧化法;氯苯水解法;苯磺酸碱熔法.醚的反应与HX的反应(醚键断裂)及机理;Claisen重排;环氧乙烷的反应.醚的合成方法Williamson合成法.(十)醛和酮醛酮的反应①加成反应,亲核加成以上反应适用于醛,脂肪族甲基酮和八个碳原子以下的环酮.②—碳原子上卤仿反应:③氧化和还原醛酮的制法①烃类氧化②醇的氧化及去氢③Friedel-Crafts酰化反应3.,—不饱和醛,酮的反应:(十一)羧酸及其衍生物羧酸的反应:①酸性:羧酸的酸性比碳酸强,比无机酸弱.②羧酸中羟基的取代反应③还原羧酸的制法①氧化法②水解法③Grignard试剂与二氧化碳作用羧酸衍生物的反应①水解都生成羧酸②醇解酰氯,酸酐和酯的醇解都生成酯,酯与醇作用生成原酸酯或酯.③氨解酰氯,酸酐和酯的氨解都生成酰胺④酸解生成平衡混合物羧酸衍生物的制法①酰氯:羧酸与无机酰氯作用;②酸酐:酰氯与羧酸盐作用;③酯:直接酯化: ④酰胺:羧酸的铵盐去水或酯的氨解;⑤腈:酰胺去水或卤代烃与氰化钠作用.(十二)取代羧酸卤代酸的反应①与碱的反应,产物与卤素和羧基的相对位置有关.-卤代酸羟基酸-卤代酸,-不饱和酸或-卤代酸内酯②Darzen反应诱导效应共轭效应醇酸的反应①去水,产物与羟基的相对位置有关-醇酸交酯-醇酸,-不饱和酸-醇酸内酯②分解:乙酰乙酸乙酯在合成上的应用①合成甲基酮:②合成酮酸丙二酸酯在合成上的应用①合成一元羧酸②合成二元羧酸(十三)胺和含氮化合物胺的化学性质①碱性②烃化③酰化(Hinsberg反应)④与亚硝酸的反应胺的制法①硝基混合物的还原②氨或胺的烃化③还原烃化④Gabriel合成法⑤Hofmann重排:芳香族重氮盐的反应①取代反应②还原反应③偶联反应(十四)含硫,含磷化合物硫醇的制备和性质①酸性和金属离子形成盐,还原解毒剂;②氧化反应,二硫化物,磺酸;③和烯键及炔键的加成反应.磺酸基的引入和被取代在合成上应用了解磺胺药物一般制备方法.磷Ylide的制备及Wittig反应在合成中的应用.(十五)杂环化合物杂环化合物的分类和命名呋喃,噻吩,吡咯的结构和芳香性.芳香性: 苯>噻吩>吡咯>呋喃离域能(kJ/mol—1) 150.6,121.3,87.6,66.9呋喃,噻吩,吡咯的性质①亲电取代:卤代,硝化,磺化,乙酰化;②呋喃易发生;Diels-Alder反应;③吡咯的弱碱性;④吡啶的碱性;⑤吡啶的氧化,还原性质;⑥Fischer吲哚合成法和Skraup喹啉合成法.(十六)周环反应在协同反应中轨道对称性守恒电环化反应的选择规律电子数基态激发态4n 顺旋对称4n+2 对旋顺旋环化加成反应的选择规律(同一边)电子数基态激发态4n 禁阻允许4n+2 允许禁阻迁移反应的选择规律(同一边)i+j 4n 4n+2基态禁阻允许Cope重排Claisen重排(十七)碳水化合物单糖的结构与构型①Fischer构型式的写法:羰基必须写在上端;②构型:编号最大手性碳原子上OH在竖线右边为D-型,在左边为L-型;③Haworth式:己醛糖的Haworth式中C1上的OH与C5上的CH2OH在环同一边为位异构体.单糖的反应①氧化:醛糖用溴水氧化生成糖酸,用稀硝酸氧化生成糖二酸②还原:用NaBH4还原生成多元醇③脎的生成:糖与苯肼作用——成脎.(十八)氨基酸,多肽,蛋白质1.①氨基酸的基本结构天然的-氨基酸,只有R取代基的差别.②等电点:等电点时氨基酸以两性离子存在,氨基酸溶解度最小;③氨基酸-茚三酮的显色的反应;④Sanger试剂及应用;⑤氨基酸的制备:a. -卤代酸的氨解,b. 醛和酮与氨,氢氰酸加成物水解,c. 二丙酸酯合成法;⑥多肽的合成方法.(十九)萜类和甾体化合物①掌握萜类化合物的基本结构:碳骨架由异戊二烯单位组成的;会划分萜类化合物中的异戊二烯单位.②掌握一些重要的萜类天然产物常规性质:如法尼醇;牛儿酮;栊牛儿奥;山道年;维生素A;叶绿醇;角鲨烯.-胡萝卜素.③了解甾体化合物的四环结构和命名.④了解萜类和甾体化合物的生物合成。
(完整版)大学有机化学知识点总结.doc

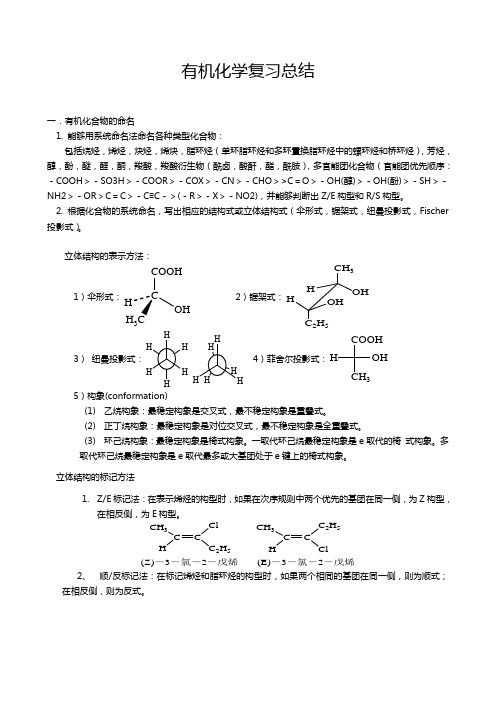
有机化学复习总结一.有机化合物的命名1.能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH>- SO3H>- COOR>- COX>- CN>- CHO> >C= O>- OH(醇 ) >- OH(酚 ) >- SH>- NH2>- OR> C = C>- C≡C-> ( -R>- X>- NO2),并能够判断出Z/E 构型和 R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:COOH CH 31)伞形式: C 2)锯架式:H H OHH OHOHH3C C 2 H 5H H COOHH HH4)菲舍尔投影式:H OH 3)纽曼投影式:H H HCH 3H H H H5)构象 (conformation)(1)乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2)正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是 e 取代的椅式构象。
多取代环己烷最稳定构象是 e 取代最多或大基团处于 e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为 E 构型。
CH 3 Cl CH 3 C 2 H 5C C C CH C 2H 5 H Cl(Z) - 3 -氯- 2 -戊烯(E) - 3 -氯- 2 -戊烯2、顺 / 反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH3 CH3 CH3 H CH3 CH3 H CH3C C C CH H H CH3 H H CH3 H顺- 2-丁烯反- 2-丁烯顺- 1,4-二甲基环己烷反- 1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
大学有机化学知识点归纳.doc

大学有机化学知识点归纳大学有机化学知识点归纳(一)1) 马氏规律:亲电加成反应的规律,亲电试剂总是加到连氢较多的双键碳上。
2) 过氧化效应:自由基加成反应的规律,卤素加到连氢较多的双键碳上。
3) 空间效应:体积较大的基团总是取代到空间位阻较小的位置。
4) 定位规律:芳烃亲电取代反应的规律,有邻、对位定位基,和间位定位基。
5) 查依切夫规律:卤代烃和醇消除反应的规律,主要产物是双键碳上取代基较多的烯烃。
6) 休克尔规则:判断芳香性的规则。
存在一个环状的大键,成环原子必须共平面或接近共平面, 电子数符合4n+2 规则。
7) 霍夫曼规则:季铵盐消除反应的规律,只有烃基时,主要产物是双键碳上取代基较少的烯烃(动力学控制产物)。
当-碳上连有吸电子基或不饱和键时,则消除的是酸性较强的氢,生成较稳定的产物(热力学控制产物)。
8) 基团的顺序规则。
大学有机化学知识点归纳(二)烷烃:烷烃的自由基取代:外消旋化烯烃:烯烃的亲电加成:溴,氯,HOBr (HOCl) ,羟汞化-脱汞还原反应-----反式加成;其它亲电试剂:顺式+反式加成烯烃的环氧化,与单线态卡宾的反应:保持构型烯烃的冷稀KMnO4/H2O 氧化:顺式邻二醇烯烃的硼氢化-氧化:顺式加成烯烃的加氢;顺式加氢环己烯的加成:(1-取代,3-取代,4-取代)炔烃:选择性加氢:Lindlar 催化剂-----顺式烯烃Na/NH3(L)-----反式加氢亲核取代:SN1:外消旋化的同时构型翻转SN2:构型翻转(Walden 翻转) 消除反应E2,E1cb: 反式共平面消除环氧乙烷的开环反应:反式产物大学有机化学知识点归纳(三)大学有哪些文科的专业值得去报考大学十大文科热门专业介绍大学十大文科热门专业:经济与金融专业培养目标:经济与金融专业旨在培养经济与金融专业方面的知识及理论,能应用所学知识进行相关工作的能力,能在经济和金融活动中进行实际工作的高层次金融人才。
就业前景:从整体上看,金融学专业这几年在报考方面比较热门,其职业前景普遍看好,但根据实际就业情况看,两极分化比较严重,据文都教育经济学考试中心的观察统计发现,知名院校的金融学硕士,如果导师影响力较大,在校期间注重实践,同时研究功底比较深厚,刚出校门拿到10万以上年薪者,不在少数。
大学有机化学复习重点总结(各种知识点,鉴别,命名)

X2的活性:F2>Cl2>Br2>I2 选择性:F2<Cl2<Br2<I2 2.烯烃的亲电加成反应活性 R2C=CR2>R2C=CHR>RCH=CHR>RCH=CH2>CH2=CH2>CH2=CHX 3.烯烃环氧化反应活性 R2C=CR2>R2C=CHR>RCH=CHR>RCH=CH2>CH2=CH2 4.烯烃的催化加氢反应活性: CH2=CH2>RCH=CH2>RCH=CHR'>R2C=CHR>R2C=CR2
2.试剂 亲电试剂: 简单地说,对电子具有亲合力的试剂就叫亲电试剂(electrophilicreagent)。亲电试剂
一般都是带正电荷的试剂或具有空的 p轨道或 d轨道,能够接受电子对的中性分子, 如: H+、Cl+、Br+、RCH2+、CH3CO+、NO2+、+SO3H、SO3、BF3、AlCl3等,都是亲电试剂 。
立体结构的表示方法:
1)伞形式:
2)锯架式:
3) 纽曼投影式:
4)菲舍尔投影式:
5)构象(conformation) (1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式 。 (2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式 。 (3) 环己烷构象:最稳定构象是椅式构象 。一取代环己烷最稳定构象是 e取代的
v五元环 >v六元环 >v中环,大环 >v三元环 7.消除反应
卤代烃碱性条件下的消除反应-----E2消除
>v四元环
RI >RBr > RCl 醇脱水-----主要 E1
大学有机化学知识点总结
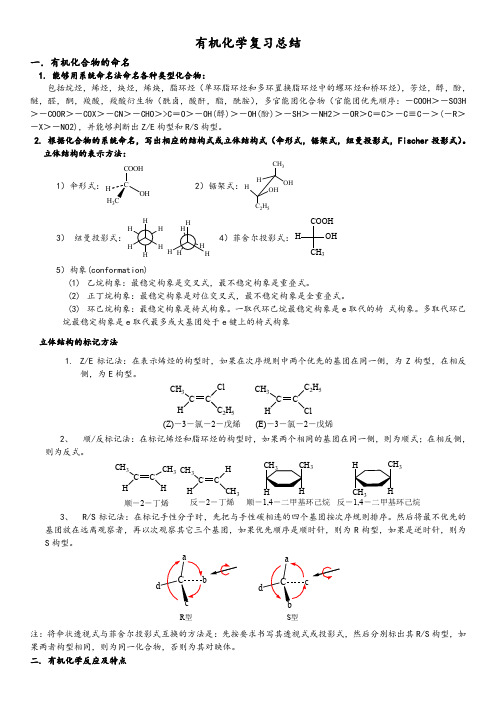
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:COOHOHH 3 2)锯架式:CH 3OHHHOH C 2H 53)纽曼投影式:4)菲舍尔投影式:COOH3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3CHC 2H 5CH 3CHC 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH3C CHCH3HCH3C CHHCH3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、R/S标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
大学有机化学知识点总结

大学有机化学知识点总结有机化学复总结一.有机化合物的命名1.能够用系统命名法命名各种类型化合物,包括烷烃、烯烃、炔烃、烯炔、脂环烃、芳烃、醇、酚、醚、醛、酮、羧酸、羧酸衍生物、多官能团化合物,并能够判断Z/E构型和R/S构型。
2.根据化合物的系统命名,写出相应的结构式或立体结构式,包括伞形式、锯架式、菲舍尔投影式、纽曼投影式。
立体结构的表示方法包括Z/E标记法、顺/反标记法和R/S标记法。
立体结构的标记方法1.Z/E标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z构型,在相反侧,为E构型。
2.顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
3.R/S标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
然后将最不优先的基团放在远离观察者,再以次观察其它三个基团,如果优先顺序是顺时针,则为R构型,如果是逆时针,则为S构型。
有机化学反应及其特点有机化学反应可以分为不同的类型,包括自由基取代、自由基加成、亲电加成、亲电取代、亲核取代、离子型反应、亲核加成、消除反应、协同反应、还原反应和氧化反应。
每种类型的反应都有其特点和规律。
马氏规律是亲电加成反应的规律,即亲电试剂总是加到连氢较多的双键碳上。
过氧化效应是自由基加成反应的规律,即卤素加到连氢较多的双键碳上。
空间效应是体积较大的基团总是取代到空间位阻较小的位置。
定位规律是芳烃亲电取代反应的规律,包括邻、对位定位基和间位定位基。
查依切夫规律是卤代烃和醇消除反应的规律,主要产物是双键碳上取代基较多的烯烃。
休克尔规则是判断芳香性的规则,存在一个环状的大π键,成环原子必须共平面或接近共平面,π电子数符合4n+2规则。
霍夫曼规则是季铵盐消除反应的规律,只有烃基时,主要产物是双键碳上取代基较少的烯烃(动力学控制产物)。
当β-碳上连有吸电子基或不饱和键时,则消除的是酸性较强的氢,生成较稳定的产物(热力学控制产物)。
大学有机化学知识点总结

大学有机化学知识点总结70538(总23页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--有机化学一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:COOHOH3 2)锯架式:CH 3OHHHOH C 2H 53)纽曼投影式:4)菲舍尔投影式:COOHCH 3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3CC HC 2H 5CH 3CC HC 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH3C CHCH3HCH3C CHHCH3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、R/S标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
大学有机化学期末复习知识点总结
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:CCOOHOHH 3CH2)锯架式:CH 3OHHHOH C 2H 53) 纽曼投影式:HHH H H HHH H HHH 4)菲舍尔投影式:COOHCH 3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象 立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C C H Cl C 2H 5CH 3C CH C 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3CCHCH 3HCH 3CC H HCH 3顺-2-丁烯反-2-丁烯CH 3H CH 3HCH 3H HCH 3顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
有机化学基础知识点归纳总结.doc

有机化学基础知识点归纳总结.doc(一)有机化学的定义与内容有机化学是研究有机化合物的形成、结构、性质、反应及其机理的化学分子科学,是物质组成和反应机理分析的主要科学。
它是植物和动物体内分子活动中最重要的学科之一。
有机化学是一门化学和生物学都有关系的科学,包括:有机材料的分子结构、构型、化学键及其相互作用的调控和机制;有机化合物的制备与合成;有机化合物的反应原理和物理化学性质;有机反应中金属催化、生物催化及活性催化体系的构建及其应用;有机材料的性质改性;以及有机聚合物、半导体材料、生物药物等的合成配方及结构修饰等相关研究。
(二)有机化学中重要的化学现象(1)杂原子取代反应:指在某种稳定的反应条件下,通过改变维持电性能的杂原子的形式或位置,使有机物的某些性质发生明显的改变的反应。
常见的杂原子取代反应有溴代反应、氯代反应、硝基取代反应、氰基取代反应、还原反应、抗坏血酸取代反应等。
(2)有机物的加成反应:指在有机化合物的定位碳原子当中发生了双卡几键的形成,从而形成稳定的大分子有机化合物的反应。
常见的有机物加成反应包括烷基化反应、异构化反应、偏极子共价加成反应等。
(3)宇称反应:指碳原子承受、转移或释放电子而发生的有机化学反应,即碳酸酯类和酮类有机化合物间反应形成水以及羧酸类和醛类有机化合物中氧原子转移或释放电子而形成活性歧化反应的反应。
常见的宇称反应有酯交换反应、醛解缩反应、酮脱氢反应、酰胺水解反应、羧酸和醛羰基化反应等。
(4)杂环反应:指碳原子原子间形成四唑环或螺环及其噁肩环或桥联环。
常见的杂环反应有Friedel-Crafts反应、Baeyer-Villiger 反应、Stevens反应、Swern反应等。
(三)有机化学中的主要结构类型烷基类有机物:烷基类有机物是指碳原子具有连续的三种氢原子,形成链状结构的有机物。
烷基类有机物又可以分为醇类、醚类、酰胺类、脂肪酸类等。
芳香类有机物:芳香类有机物是指通过共价键合形成含环结构的有机化合物,又称芳环类化合物。
大学有机化学知识点总结资料

有机化学复习总结一.有机化合物的命名 1. 能够用系统命名法命名各种类型化合物:,芳烃,包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),多官能团化合物(官能团优先顺序:醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺)C>-NH2OR >OH(酚)>-SH>->->>--COOH>-SO3HCOOR>-COX>-CN>-CHO>C=O>-OH(醇) R/S构型。
X>-NO2),并能够判断出Z/E构型和≡=C>-CC->(-R>-Fischer根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式, 2.。
投影式)立体结构的表示方法:CH COOH3HOH C 2)伞形式:)锯架式:1H H OHOHCH3HC52HHCOOH HHH OHH纽曼投影式:3)4)菲舍尔投影式:HHHCHHHH3H(conformation))构象5(1)乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2)正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
式构象。
多e取代的椅(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e键上的椅式构象。
取代环己烷最稳定构象是e取代最多或大基团处于立体结构的标记方法构型,1.Z/E标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型。
在相反侧,为E ClCHCHCH5233CCCC HCHHCl52(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;、2在相反侧,则为反式。
1CHHCHCHCH333HCHCH333CC HHHHCHHCHH33-二甲基环己烷-二甲基环己烷反-1,42反--丁烯顺-1,4-丁烯顺-2标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
最新大学有机化学复习总结-详细
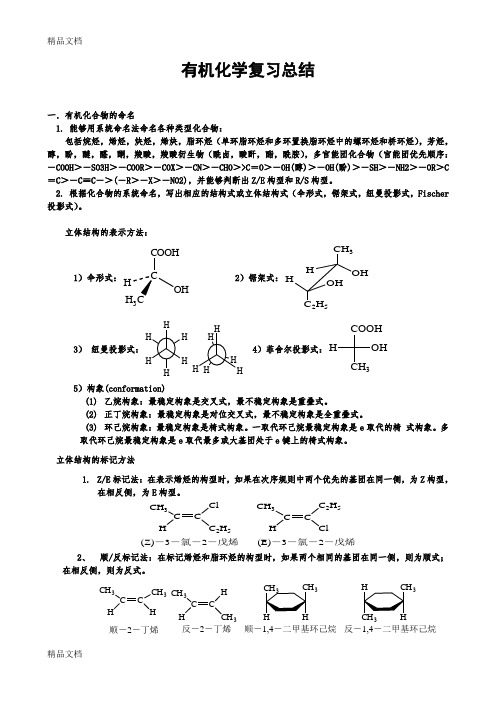
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:CCOOHOHH 3H 2)锯架式:CH 3HHOH 2H 53)纽曼投影式:4)菲舍尔投影式:COOHCH 3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C H C 2H 5CH 3C CH C 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3C CHCH 3HCH 3CH HCH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、R/S标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
(完整版)大学有机化学知识点总结
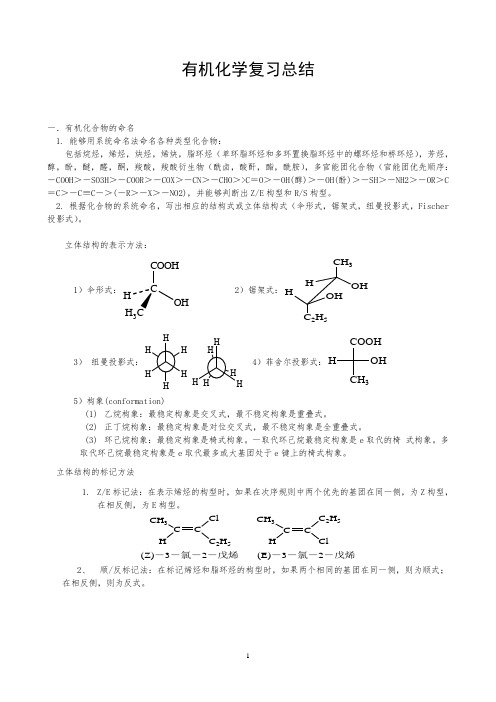
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:CCOOHOHH 3 2)锯架式:CH 3OH HHOH C 2H 53)纽曼投影式:H H 4)菲舍尔投影式:COOHCH 3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C H C 2H 5CH 3C CH 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3C CHCH 3HCH 3CCH HCH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
大学有机化学期末复习总结.docx

有机化学复习总结-、有机化合物的命名命名是学习有机化学的“语言”,因此,要求学习者必须掌握。
有机合物的命名包括 俗名、习惯命名、系统命名等方法,耍求能对常见有机化合物写出正确的名称或根据名称 写出结构式或构型式。
1、 俗名及缩写:要求掌握一些常用俗名所代表的化合物的结构式,如:木醇、甘醇、 口油、石炭酸、蚁酸、水杨醛、水杨酸、氯仿、草酸、苦味酸、肉桂酸、苯酹、廿氨酸、丙 氨酸、谷氨酸、巴豆醛、葡萄糖、果糖等。
述应熟悉一些常见的缩写及商品名称所代表的化 合物,女n : RNA 、DNA>阿司匹林、福尔马林、尼古丁等。
2、 习惯命名法:要求掌握“正、界、新”、“伯、仲、叔、季”等字头的含义及用法, 掌握常见坯基的结构,如:烯丙基、丙烯基、正丙基、异丙基、异丁基、叔丁基、节棊等。
3、 系统命名法:系统命名法是有机化合物命名的重点,必须熟练掌握各类化合物的命名 原则。
其中坯类的命名是基础,儿何界构体、光学开构体和多官能团化合物的命名是难点, 应引起重视。
耍牢记命名中所遵循的“次序规则”。
4、 次序规则:次序规则是各种取代基按照优先顺序排列的规则(1) 原子:原子序数人的排在前面,同位素质量数大的优先。
儿种常见原子的 优先次序为:I>Br>Cl>S>P>O>N>C 〉H(2) 饱和基团:如果第一个原子序数相同,则比较第二个原子的原子序数,依 次类推。
常见的烽基优先次序为:(CH3)3C->(CH3)2CH->CH3CH2->CH3-(3)不饱和基团:可看作是少两个或三个和同的原子相连。
不饱和怪基的优先 次序为:-C = CH>-CH=CH2> (CH3) 2CH-次序规则主要应用于烷桂的系统命名和烯烧中几何界构体的命名则” 一次列出, 按照次序规则,烷基的优先发"津緊'叔丁基〉异丁基〉异内基>丁基>1人j 基〉乙基〉甲基。
大学有机化学期末复习总结

位置异构:由于取代基或官能团在碳链或环上的位置不同而产生的,例如,正丁醇与2-丁醇。
官能团异构:由于官能团的不同而产生的,例如,正丁醇和乙醚。
互变异构:由于不同官能团之间迅速互变而形成的可逆异构化现象,例如,
CH3-C=CH2 CH3-C-CH3
⑶、自由基取代由自由基的引发而进行的取代称自由基取代。烷烃的卤代,烯烃和烷基苯的α卤代是自由基取代反应。反应条件是高温、光照或过氧化物存在。自由基的稳定性和中心碳原子上所连的烷基数目有关,烷基越多,稳定性越大。自由基的稳定次序为:
三级>二级>一级>·CH3
二、有机化合物的结构理论
1、碳原子的杂化和共价键 要求掌握杂化的概念、碳原子的三种杂化形式SP、SP2、SP3以及各种杂化形式的特点, 能判断有机化合物分子中各碳原子的杂化形式。掌握σ 键和π 键的形成及它们的区别,共轭π 键和芳香大π 键的特性以及双键、三键是由什么键组成的。掌握不同结构的碳正离子及自由基的稳定性。
2、习惯命名法 要求掌握"正、异、新"、"伯、仲、叔、季"等字头的含义及用法,
掌握常见烃基的结构,如:烯丙基、丙烯基、正丙基、异丙基、异丁基、叔丁基、苄基等。
3、系统命名法 系统命名法是有机化合物命名的重点,必须熟练掌握各类化合物的命名原则。其中烃类的命名是基础,几何异构体、光学异构体和多官能团化合物的命名是难点,应引起重视。要牢记命名中所遵循的"次序规则"。
④ 当羰基与羧基并存时,以羧酸为母体。
⑤ 当双键与三键并存时,应选择既含有双键又含有三键的最长碳链为主链,编号时给双键或三键以尽可能低的数字,如果双键与三键的位次数相同,则应给双键以最低编号。
大学有机化学期末复习总结

大学有机化学期末复习总结有机化学期末复习总结一、有机化合物的命名命名是学习有机化学的“语言”,因此,要求学习者必须掌握。
有机合物的命名包括俗名、习惯命名、系统命名等方法,要求能对常见有机化合物写出正确的名称或根据名称写出结构式或构型式。
1、俗名及缩写:要求掌握一些常用俗名所代表的化合物的结构式,如:木醇、甘醇、甘油、石炭酸、蚁酸、水杨醛、水杨酸、氯仿、草酸、苦味酸、肉桂酸、苯酐、甘氨酸、丙氨酸、谷氨酸、巴豆醛、葡萄糖、果糖等。
还应熟悉一些常见的缩写及商品名称所代表的化合物,如:RNA、DNA、阿司匹林、福尔马林、尼古丁等。
2、习惯命名法:要求掌握“正、异、新”、“伯、仲、叔、季”等字头的含义及用法,掌握常见烃基的结构,如:烯丙基、丙烯基、正丙基、异丙基、异丁基、叔丁基、苄基等。
3、系统命名法:系统命名法是有机化合物命名的重点,必须熟练掌握各类化合物的命名原则。
其中烃类的命名是基础,几何异构体、光学异构体和多官能团化合物的命名是难点,应引起重视。
要牢记命名中所遵循的“次序规则”。
4、次序规则:次序规则是各种取代基按照优先顺序排列的规则(1)原子:原子序数大的排在前面,同位素质量数大的优先。
几种常见原子的优先次序为:I>Br>Cl>S>P>O>N>C>H(2)饱和基团:如果第一个原子序数相同,则比较第二个原子的原子序数,依次类推。
常见的烃基优先次序为:(CH3)3C->(CH3)2CH->CH3CH2->CH3- (3)不饱和基团:可看作是与两个或三个相同的原子相连。
不饱和烃基的优先次序为: -C≡CH>-CH=CH2>(CH3)2CH-次序规则主要应用于烷烃的系统命名和烯烃中几何异构体的命名烷烃的系统命名:如果在主链上连有几个不同的取代基,则取代基按照“次序规则”一次列出,优先基团后列出。
按照次序规则,烷基的优先次序为:叔丁基>异丁基>异丙基>丁基>丙基>乙基>甲基。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学复习总结一.有机化合物的命名
1. 能够用系统命名法命名各种类型化合物:
包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥
环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO
>>C=O>-OH(醇)>-OH(酚)>-SH>-NH2>-OR>C=C>-C≡C->(-R>-X
>-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影
式,Fischer 投影式)。
立体结构的表示方法:
COOH
C H3
1)伞形式:H C 2)锯架式:
OH
H3C
H
H OH
C2 H5
OH
H
H H
H
H
COOH
3)纽曼投影式:4)菲舍尔投影式:
H OH H
H H
H H CH3
H
H
5)构象(conformation)
(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是 e 取代的椅
式构象。
多取代环己烷最稳定构象是 e 取代最多或大基团处于 e 键上的椅式构象
立体结构的标记方法
1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,
为Z 构型,在相反侧,为 E 构型。
2、顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,
则为顺式;在相反侧,则为反式。
3、R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
然后将最不优先的基团放在远离观察者,再以次观察其它三个基团,如果优先顺序是顺时针,则为R 构型,如果是逆时针,则为S 构型。
注:将伞状透视式与菲舍尔投影式互换的方法是:先按要求书写其透视式或投影式,然后分别标出其R/S 构型,如果两者构型相同,则为同一化合物,否则为其对映体。
二. 有机化学反应及特点
1. 反应类型
自由基反应自由基取代:烷烃卤代、芳烃侧链卤代、烯烃的α-H卤代自由基加成:烯, 炔的过氧化效应
还原反应(包括催化加氢):烯烃、炔烃、环烷烃、芳烃、卤代烃
亲电加成:烯、炔、二烯烃的加成,脂环烃小环的开环加成
亲电取代:芳环上的亲电取代反应氧化反应:烯烃的氧化(高锰酸钾氧化,臭氧氧化,环氧化);炔烃高锰酸钾氧化,臭氧氧
亲核取代:卤代烃、醇的反应,环氧乙烷的开环反应,醚键断裂反应类型
离子型反应反应, 卤苯的取代反应
(按历程分)
亲核加成:炔烃的亲核加成
化;醇的氧化;芳烃侧链氧化,芳环氧化)
消除反应:卤代烃和醇的反应
2. 有关规律
协同反应:双烯合成
1)马氏规律:亲电加成反应的规律,亲电试剂总是加到连氢较多的双键碳上。
2)过氧化效应:自由基加成反应的规律,卤素加到连氢较多的双键碳上。
3)空间效应:体积较大的基团总是取代到空间位阻较小的位置。
4)定位规律:芳烃亲电取代反应的规律,有邻、对位定位基,和间位定位基。
5)查依切夫规律:卤代烃和醇消除反应的规律,主要产物是双键碳上取代基较多的烯烃。
6)休克尔规则:判断芳香性的规则。
存在一个环状的大π键,成环原子必须共平面或接近共平面,π电子数符合4n+2 规则。
7)霍夫曼规则:季铵盐消除反应的规律,只有烃基时,主要产物是双键碳上取代基较少的
烯烃(动力学控制产物)。
当β-碳上连有吸电子基或不饱和键时,则消除的是酸性较强的氢,生成较稳定的产物(热力学控制产物)。
8)基团的“顺序规则”
3. 反应中的立体化学
烷烃:烷烃的自由基取代:外消旋化
烯烃:烯烃的亲电加成:
溴,氯,HOBr(HOCl ),羟汞化-脱汞还原反应-----反式加成
其它亲电试剂:顺式+反式加成
烯烃的环氧化,与单线态卡宾的反应:保持构型
烯烃的冷稀KMnO 4/H2O 氧化:顺式邻二醇
烯烃的硼氢化-氧化:顺式加成
烯烃的加氢:顺式加氢
环己烯的加成(1-取代,3-取代,4-取代)
炔烃:选择性加氢:
Lindlar 催化剂-----顺式烯烃
Na/NH 3(L)-----反式加氢
亲核取代:S N1:外消旋化的同时构型翻转
S N2:构型翻转(Walden 翻转)
消除反应:E2,E1cb: 反式共平面消除。
环氧乙烷的开环反应:反式产物
四.概念、物理性质、结构稳定性、反应活性
(一).概念
CH3
碳架异构H2C C
H C H 2CH 2H2C C CH 3
构造异构位置异构C H2 CHCH 2CH 3 CH3CH CHCH 3
官能团异构CH 3CH2OH CH 3OCH 3
同分异构
互变异构C H
CH OH CH3CHO
2
1. 同分异构体
2. 试剂
亲电试剂:
简单地说,对电子具有亲合力的试剂就叫亲电试剂(electrophilic reagent )。
亲电试剂
一般都是带正电荷的试剂或具有空的p 轨道或d 轨道,能够接受电子对的中性分子,如:H+、Cl+、Br+、RCH 2+、CH3CO+、NO2+、+SO3H、SO3、BF3、AlCl 3 等,都是亲电试
剂。
亲核试剂:
对电子没有亲合力,但对带正电荷或部分正电荷的碳原子具有亲合力的试剂叫亲核试剂(nucleophilic reagent )。
亲核试剂一般是带负电荷的试剂或是带有未共用电子对的中性分
子,如:OH-、HS-、CN-、NH2-、RCH 2-、RO-、RS-、PhO-、RCOO -、
X-、H2O、ROH 、ROR 、NH3、RNH 2 等,都是亲核试剂。
自由基试剂:
Cl2、Br2 是自由基引发剂,此外,过氧化氢、过氧化苯甲酰、偶氮二异丁氰、过硫酸
铵等也是常用的自由基引发剂。
少量的自由基引发剂就可引发反应,使反应进行下去。
3. 酸碱的概念
布朗斯特酸碱:质子的给体为酸,质子的受体为碱。
Lewis 酸碱:电子的接受体为酸,电子的给与体为碱。
4. 共价键的属性键长、键角、键能、键矩、偶极矩。
5. 杂化轨道理论sp3、sp2、sp 杂化。
6. 旋光性
平面偏振光:
手性:
手性碳:
旋光性:
旋光性物质(光学活性物质),左旋体,右旋体:内消旋体、外消旋体,两者的区别:
对映异构体,产生条件:
非对映异构体:
苏式,赤式:
H C HO
OH H
C HO
OH
H OH HO H 差
向异构体:
CH 2OH CH 2OH
赤式苏式
Walden 翻转:
7. 电子效应
1)诱导效应
2)共轭效应(π-π共轭,p-π共轭,σ-p 超 2 共轭,σ-π超共轭。
3)空间效应
OH
空间阻碍:已有基团对新引入基团的空间阻碍作用。
8. 其它
范德华张力:两个原子或原子团距离太近,小于两
者的范德华半径之和而产生的张力。
立体效应
(空间效应)
内型(endo), 外型(exo):
H
H
OH
CH3
SO3H
和
H
H H
SO
3
H
CH
3
扭转张力:在重叠构象中存在着要变顺反异构体,产生条件:
为交叉式构象的一种张力。
烯醇式:H H
H
H
H H
H。
