二维核磁简介
核磁共振二维谱简介

二维核磁共振谱:采用不同的脉冲序列技术,得到图谱中 一个坐标表示化学位移,另一个坐标表示偶合常数,或另 一个坐标表示同核或异核化学位移,这类核磁图谱称作二 维核磁共振谱。
3
技术依托
(1)自旋核调控脉冲技术 (2)自旋核特性的理论发展 (3)计算机技术的发展 (4)超导磁体的发展
9
三、2DHH相关谱(HHCOSY)
Correlatedspectroscopy(COSY)
主要解决的问题: 建立结构中存在偶合 1 1 关系的 H与 H的联系
对角峰
相关峰 偶合关系
10
ቤተ መጻሕፍቲ ባይዱ 11
1 四、检测 H的化学位移相关谱
1,HMQC谱
12
2,HMBC谱
13
Theend
14
1)确定复杂图谱中碳原子与连接质子之间偶合常数 2)确定复杂图谱中质子质子之间的偶合常数 3)建立相互偶合的质子之间的关系 4)建立质子与碳之间的连接关系 5)建立分子中碳原子之间的连接关系 6)对一维图谱中的信号进行准确归属
8
二、2DJ分解谱(Jresolvedspectroscopy)
分同核J分解谱和异核J分解谱,异核J分解谱可区分碳的级 数,可用DEPT谱代替。
4
一维NMR实验过程
射 频 脉
预备期
检测期 ( t ) 2
S(t ) 2 (FID ) 傅立叶 变 换
S(n2)
5
二维NMR多 脉冲序列 预备期 Preparationperiod 演化期(t1) Evolutionperiod 混合期 Mixingperiod 检测期(t2) Detectionperiod
二维核磁共振谱综述

3.二维谱的表达方式
(1)堆积图(stacked plot). • 堆积图的优点是直观,具有立体感.缺点是 难以确定吸收峰的频率。大峰后面可能隐 藏小峰,而且耗时较长。 • (2)等高线(Contour plot) 等高线图类似于等高线地图,这种图的优 点是容易获得频率定量数据,作图快。缺 点是低强度的峰可能漏画。目前化学位移 相关谱广泛采用等高线。
4.2 化学位移相关谱(Correlated Spectroscopy ,COSY)
• 二维化学位移相关谱包括 • 同核化学位移相关谱(Homonuclear correlation) • 1)通过化学键:COSY, TOCSY, 2DINADEQUATE。 • 2)通过空间:NOESY, ROESY。 • 异核化学位移相关谱(Heteronuclear correlation) • 强调大的偶合常数:1H-13C –COSY • 强调小的偶合常数,压制大的偶合常数: COLOC(远程1H-13C –COSY)
二维NMR谱原理及解析

(3)1H NMR谱图解析时的注意事项
杂质峰和溶剂峰 活泼氢 不符合一级谱图的情况
核磁共振碳谱
核磁矩:1H=2.79 270β; 13C=0.70 216β;
磁旋比γ为质子的1/4;
相对灵敏度为质子的1/5 600;
E
H splitting
I=
1 2
13C谱特点: (1)研究C骨架,结构信息丰富; (2)化学位移范围大;0~250;
2. 等价组合具有相同的共振频率.其强度与等价组合数有关.
3. 磁等价的核之间偶合作用不出现在谱图中.
4. 偶合具有相加性.
例如:
Ha
C
Hb C
observed spin
A
B
coupled spin
B B A A
intensity
1 1 1 1
HB
HB
பைடு நூலகம்
JAB
a
HA
HA
JAB
b
B,C是磁等价的核
令t=0,Mz=-M0 Mz Mo (1 2et /T1 )
横向驰豫时间(T2)
横向驰豫时间,又称自旋-自旋驰豫,指的是宏观磁化矢 量M在x,y平面(横向)的分量Mx,My。由于核自旋之间的相互 作用而消失过程。
可点击图片观看动画 Alt-F4退出动画
dMxy Mxy
dt
T2
脉冲前宏观磁化矢量的位置 (b)90ox后宏观磁化矢量的位置
给出各种含碳官能团 的信息,几乎可分辨 每一个碳核,光谱简 单易辨认
碳谱不足 氢谱补充
去耦谱峰高
常不与碳数成 比例
氢谱峰面积的积分 高度与氢数成比例
核磁共振碳谱的解析
2D NMR

四、二维相关谱—COSY
• 二维相关谱 (2D COSY)比二维J分解谱更重要,其中用的最广泛的是化 学位移相关谱,它的两维坐标F1和F2都表示化学位移,从中可以得到 各种核之间连接的信息。
•
Байду номын сангаас
2D COSY实验脉冲序列
♦ 第一个90°脉冲产生单量子相 干(横向磁化); ♦ t1和t2之间的混合脉冲产生相干 转移:
2D NMR
吴 瑞 2010.11
二维核磁共振(2D-NMR)
概述 基本原理 2D NMR谱的分类 二维J分解谱(J-resolved Spectroscopy) Add Your Text
一、概述
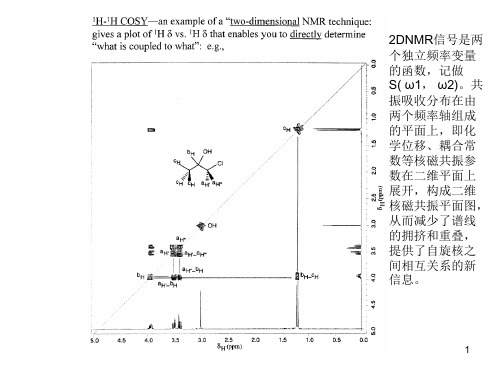
• 2D-NMR是Jeener首先提出,它可看成是1D-NMR的自然 推广。 • 一维谱的信号是一个频率函数,记为S(ω),共振峰分布 在一条频率轴上。而二维谱的信号是两个独立频率变量 的函数,记为S(ω),共振峰分布在由两个频率轴组成的 平面上。
三、2D NMR的分类
• 2D NMR谱基本可分为两类:
1. 二维J谱
在演化期t1利用自旋回波产生J调制,即化学位移在后半个演化期内进动, 聚焦或有效翻转,只保留J耦合的进动,FID仅受J耦合调制; 在检测期t2期间观察质子的化学位移(同核二维J分解谱)或观察质子的宽 带去耦13C谱(异核二维J分解谱); 经过两次FT变换后,得到的二维谱的两个频率轴中F1轴表示耦合常数,F2 轴表示化学位移。 二维J谱将谱峰重叠在一起的一维谱的化学位移和耦合常数分解在两个不同 的轴上,扩展成平面,使复杂谱峰的耦合常数的分析成为可能。
2. 二维相关谱
二维相关谱是在演化期t1中对核进行标记,在混合期中完成相干传递,即 把t1期间的相干传递给有关的另一相干,以供t2期间的检测。这种相干传递 是通过核间耦合作用实现的。
二维核磁共振(2D-NMR)
(1)
2 J jk I j Ik
jk
只与耦合常数有关
• 在检测期t2,系统受 :
(2) j I jz
2 J jk I j Ik
j
jk
♦ 同核二维J分解谱的脉冲序列靠J调制自旋回波来分解化学位移与J耦合。 ♦ 异核耦合系统若只加13C的180°脉冲会消去J耦合作用,所以必须同时加1H的 180°脉冲,这样才能保存J耦合作用。
1. 预备期(D1)
脉冲序列之间的弛豫延迟,类似一维谱实验的等待时间。理想状态是在 D1结束时磁化矢量M2保持最大,而且在xy平面上的磁化矢量Mxy已恢复 到零。理论上应取D1≥5T1.
2. 演化期(t1)和混合期(tm)
这是2D NMR的关键,正是在演化期和混合期对磁化矢量进行各种各样 的技术处理而产生了不同的2D实验。
a. 同核—一个90°脉冲 b. 异核—由1H的90°脉冲和13C
的90°脉冲组成
♦ 混合脉冲使耦合核之间进行磁 化矢量的交换,从而对耦合相 关信息进行“标记”。
♦ 对检测期t2所记录的时间域FID 信号进行FT变换得到频率域F2 谱,对t1方向的FT变换给出第 二个频率域坐标F1,这样就获 得一个完整的COSY谱。
四、二维J分解谱
• 如果在t1和t2的时间划分处没有任何物理操作,只是核自 旋在t1段受H(1)作用,在t2段受H(2)作用,由于自旋体系受 到的作用不同,因此时间轴被识别开了,这种方法得到
二维分解谱。
• 在液体分子常规NMR谱中共振峰的位置由化学位移Ω/2π 和标量耦合J两个参数确定。
• 若在演化期t1自旋系统受:
四、二维相关谱—COSY
• 二维相关谱 (2D COSY)比二维J分解谱更重要,其中用的最广泛的是化 学位移相关谱,它的两维坐标F1和F2都表示化学位移,从中可以得到 各种核之间连接的信息。
二维核磁

•如今二维NMR实验类型已经难以数计, 但是可以将它们主要地分为基于偶合的相 关转移谱和基于动力学过程的极化转移谱 两大类。
在NMR中,横向磁化强度总与相干相联系,纵向磁化强度 总与极化相联系。 二维谱一定与磁化强度的转移有关,要么是横向磁化强度 的转移或相干转移,例如化学位移相关谱COSY等,要么是 纵向磁化强度的转移或极化转移,例如化学位移交换谱 EXSY等。 二维谱的设计关键就是如何实现预定目标的相干转移谱或 极化转移谱。
尽管3D NMR谱的分辨率有所提高, 但解释较大的三维异核NMR谱时,仍存 在含糊性,因此,人们希望通过增加维 数进一步提高分辨率,随之出现了4D NMR谱,4D NMR谱常常是说明2D NMR谱的方法。4D NMR试验可以看成 是由三个2D NMR实验所组成。新的4D NMR技术仍在不断发展,并越来越广泛 的应用于蛋白质及核酸研究的报道。
13C-1H化学位移相关谱
13C-1H化学位移相关谱是把化
合物分子中的单键偶合(1JCH)的1H信 号与13C信号相关联,对于信号的确 认非常有效。它与1H-1H COSY一样 是应用最广泛和最重要的两个二维 实验技术 。
常规的13C-1H COSY可以得到 直接键合的碳和氢之间的偶合关 系(1JCH)。从其COSY谱得到的1H 谱线的归属,根据相互关系(1JCH 交叉峰),就可找到与之相连的13C信 号。反之,从一个已知的13C信号, 通过它的交叉峰也可找到与之相 连的1H信号。
相比,信噪比的提高就有了一个飞跃。
虽然HMQC实验成功率很高,但是它无法判定季 碳的化学位移。异核多重键相关谱(HMBC)实验弥补了 这一缺点。HMBC脉冲序列的基础仍然是HMQC实验, 只不过长程偶合常数比单键偶合常数小很多而已。 异核单量子相关谱(HSQC)实验是一种在演化期只涉 及单量子相干的逆检测开核相关实验。HSQC的图谱质 量要略差于HMQC谱。但是,HSQC谱在F1维的分辨率 要比HMQC谱高,这是因为在多量子谱中,量子数越大, 谱分辨率越差,尤其在高场仪器中。HSQC实验在三维 NMR中得到比HMQC实验广得多的应用。
二维核磁共振-1

X
MA
δH A
M F1
X
AM
X
CH2Br-CHBr-COOH
F2
δH
图为2,3-二溴丙酸的AMX体系1H-1H COSY谱。
F1和F2皆为化学位移。两组对角峰为对角线与两组交叉峰 组成正方形,说明这两组质子有偶合。2,3-二溴丙酸的碳上3 个质子为AMX系统。
液体二维核磁共振方法 (two-dimensional NMR)
二维核磁共振的基本原理
二维核磁共振(2D NMR)方法是七十年代提出并发展起来的。
NMR一维谱的信号是一个频率的函数,共振峰分布在一个 频率轴(或磁场)上,可记为S(ω)。
而二维谱信号是二个独立频率(或磁场)变量的函数,记 为S(ω1,ω2),共振信号分布在两个频率轴组成的平面上。也就 是说2D NMR将化学位移、偶合常数等NMR参数在二维平面上 展开,于是在一般一维谱中重迭在一个坐标轴上的信号,被分 散到由二个独立的频率轴构成的平面上,使得图谱解析和寻找 核之间的相互作用更为容易。
• HMBC可高灵敏度地检测13C-1H远程偶合( 2JCH,3JCH ),因 此可得到有关季碳的结构信息及其被杂原子切断地1H偶合系统 之间的结构信息。
ΝΟΕ类核磁共振谱
NOE( Nuclear Overhauser Effect )是一种双照射技术,其原 理是:用照射强度小于被照射谱线半高宽度的射频照射某个 核时,在空间上与之接近的核的信号强度会有所变化。
1H 13C
纵轴为碳谱,横轴为氢谱
异核多键相关谱
HMBC [(1H-detected) heteronuclear multiplebond correlation,(检出1H的)异核多键相关] 把1H核和远程偶合的13C核关联起来,它的作用 相当于长程多键H,C-COSY
二维NMR

F2
F1
X Q
(i) 横轴:F2轴;纵轴:F1轴 (ii) 对角线峰:出现在对角线 上的峰,实际上是由等高 线构成的点. 例如:P和Q
(iii) 交叉峰:对应出现在与对 角线垂直的位置的峰.
例如:X和Y
P
Y
注意: F1和F2为同种核时,一对交叉峰对称出现在与对角线垂直的位置.
用途:发现(或归属)存在着相互偶合关系的1H核,进而 确定分子中各种质子的配置或连接.
例3. 归属化合物中各个1H核之间的偶合关系.
注意
(i) 有时对于较远程的偶合也出现交叉峰.因此,显示 交叉峰的1H核之间不一定就相隔三根键.
H H C C H C C C C H C H H
(ii) 偶合常数(J)为零的1H之间不出现交叉峰.因此,不出 现交叉峰的1H核之间也有可能是相邻的.
2. 1H,13C-COSY (异核相关)
HA HB
HB
P
获得的信息
• 出现交叉峰P表示HA 和HB存在着相互偶 合关系.
HA
P
O
例1.
O
5 4 3 2 1 0
5
4
3
2
1
0
例2. 归属某化合物中HA,HB,HC之间的偶合关系.
HA HB HC
获得的信息
HC
Q
HB
P Q
HA
P
交叉峰P表示HA与HB存 在着偶合关系. 交叉峰Q表示HB与HC存 在偶合关系 HA与HC不存在偶合关系
H C H C C H C C C
(ii) -OH和-NH的1H核通过杂原子可观测到与相关13C核 的交叉峰.
C OH C NH C NH
二维核磁共振氢谱-解释说明

二维核磁共振氢谱-概述说明以及解释1.引言1.1 概述核磁共振(NMR)技本是一种非常重要的分析技术,广泛应用于化学、生物化学、药物研究等领域。
其通过原子核所具有的自旋和电荷产生的磁矩,与外加磁场相互作用,从而产生共振现象,通过测定不同原子核在不同化学环境中的共振频率,可以为分子结构的研究提供丰富的信息。
而二维核磁共振氢谱则是核磁共振技术的重要分支,它通过核磁共振原理和多维谱的记录方式,可以进一步提供复杂分子结构的详细信息,成为研究和分析的重要工具。
本文将深入介绍二维核磁共振氢谱的原理、应用和技术发展,以期对该领域的研究工作有所帮助。
1.2 文章结构文章结构部分应该包括对整篇文章的组织和内容安排进行介绍。
可以描述文章的逻辑顺序和各个部分的内容提要,让读者对整篇文章的架构有一个清晰的了解。
例如:文章结构部分将介绍本文的组织结构和内容安排。
首先,对于二维核磁共振氢谱的原理将进行详细的解释和讨论,包括其基本概念和相关理论知识。
其次,将探讨二维核磁共振氢谱在不同领域的应用,以及其在科学研究和医学诊断中的重要性。
最后,将阐述二维核磁共振氢谱的技术发展以及对未来可能的影响。
通过这样的结构安排,读者可以清晰了解本文的内容和重点讨论的方向。
1.3 目的本文的目的在于深入探讨二维核磁共振氢谱在化学领域中的重要性和应用价值。
通过对二维核磁共振氢谱原理、应用和技术发展的全面介绍,可以帮助读者更深入地理解这一技术在分析化学物质中的作用。
同时,也旨在对未来二维核磁共振氢谱技术的发展方向进行展望,为相关领域的研究和实践提供一定的指导和借鉴。
通过本文的阐述,读者将能够更好地把握二维核磁共振氢谱的前沿动态,从而为相关领域的研究和应用提供帮助和启发。
2.正文2.1 二维核磁共振氢谱的原理二维核磁共振氢谱(2D NMR)是一种核磁共振(NMR)技术,它通过在两个独立的核磁共振实验中收集数据,并通过两个独立的核磁共振实验之间的相互关联来提供额外的信息。
二维核磁共振
人体不同组织水的弛豫时间T1和T2
正常组织
病变组织
肝
T1
T2
胰 T1 T2
380 +- 20 40 +- 20 390 +- 20 60+- 40
570+- 190 40+- 10 840+- 130 40+- 10
E2
吸 收
N1
弛 豫
m=-1/2
E1
m=+1/2
N2
51
52
53
54
55
平面上展开.
4
2D NMR特点
含有两个频率轴和一个强度轴(减少谱峰的拥挤和 重叠)
提供相互耦合的观察核之间的相关关系信息 对复杂分子(如生物分子)的结构确定以及分子
与分子之间相互作用的研究非常有用。 可了解生物分子在溶液状态时的空间结构(X-单
晶衍射无法做到)
5
2D NMR 实验方法
45
2003年诺贝尔医学奖 :美国科学家保罗·劳特布尔 (Paul Lauterbur) 和英国科学家彼得·曼斯菲尔德(Peter Mansfield )
Peter
用核磁共振层析“拍摄”的脑截面图46象
47
MRI is used for imaging of all organs in the body.
14
• 堆积图由很多条“一维”谱线紧密排列构成的。堆积图的 优点是直观、有立体感,缺点是难以定出吸收峰的频率和 发现大峰后面可能隐藏着的较小峰,而且,作这样的图耗 时较多。
• 等高线图类似于等高线地图。最中心的圆圈表示峰的位置, 圆圈的数目表示峰的强度。最外圈表示信号的某一定强度 的截面,其内第二、三、四圈分别表示强度依次增高的截 面。这种图的优点是易于找出峰的频率、作图快,缺点是 强信号的最低等高线会波及很宽范围,从而掩盖附近的弱 信号,或者它们之间发生干涉而产生假信号,在解谱时应 加以注意。虽然等高线图存在一些缺点,但它较堆积图优 点多,故目前被广为采用。
二维核磁简介
HMQC
HSQC
8
HMQC和HSQC的区别
1. HSQC经过进一步处理后可以将纵轴的碳谱变换为DEPT谱形式,CH3, CH 与 CH2 的峰的相位有区别,可以给出更多信息;
2. 在HMQC谱的F1方向还会显示1H-1H之间的耦合裂分,它降低了F1 维
的分辨率,也使灵敏度下降。由于这个原因,近年来,HSQC常用 来代替HMQC,它不会显示F1方向1H-1H之间的耦合裂分; 3. HMQC和HSQC,尤其是HSQC由于测试要求的样品量相应减少, 特
Ha Hb Ha C C OHc
Ha Hb
Hc不参与耦合
Ha, Hb, Hc 化学环境不同
3个Ha, 2个Hb, 1个Hc 自身磁等价
Hc参与耦合
5
同核位移相关谱 (COSY)
Ha Hb Ha C C …
H, H-COSY的横坐标(F2)纵坐标(F1)方向上的投影均为该化合物的氢谱
Ha Hb
COSY谱一般反应的是3J 的耦合信息,在1H谱重叠或较为复杂(对峰的归属不清晰) 时,可使用COSY二维谱。
1D NOESY
2D NOESY
11
总结
一般用NMR测定化合物结构的顺序: 1H-NMR 测定氢核的化学位移,推测化合物结构 13C-NMR 测定碳核的化学位移,推测化合物结构
DEPT(135°) 确定碳核的级数 HSQC 确定碳氢之间的耦合相互作用,进一步推测化合物结构 HMBC 确定碳氢之间长程耦合作用,确定化合物结构 NOESY 测定空间相近的氢核,确定化合物构象
9
Ha Hb Hc
长程核位移相关谱 (HMBC) Ha C C C …
Ha Hb Hc HMBC谱突出表现相隔2个键(2J CH)和相隔3个键( 3J CH )的碳氢 之间的耦合。当遇到季碳无法确定远程耦合关系时可以用 HMBC谱解决。 但由于技术上的原因,尚不能完全去掉直接相连的碳氢之间的 耦合(1J CH )解析图谱时要注意区别。
第五讲:二维核磁共振谱介绍

中用合适的方法滤去 在4脉冲HMQC实验中,滤去1H主峰是通过相位循环完成的,
一般效率很高 当样品浓度极低时,需要借助BIRD序列增强滤波功能
HMQC脉冲序列
双线性旋转去耦(bilinear rotation decoupling, BIRD)
与HMQC实验相比,HMBC实验的信噪比要低很多,沿F1走 向的t1噪声峰特别强(可通过数学的方法消除)
HMBC谱中一个氢峰可以和多个碳峰相关,主要用于解决四 级碳信号的问题
HMBC的脉冲序列
HSQC(异核单量子相关谱)实验
在外形上与HMQC完全相同 各项参数要求颇高,当参数不是很完美时,
பைடு நூலகம்
相干转移谱和极化转移谱
基于耦合的相干转移谱:核自旋间的J耦合 (通过原子核间化学键电子的间接作用而发 生的耦合,又称间接耦合),与横向磁化强 度相联系
基于动力学过程的极化转移谱:D耦合(不 需要经过介质的空间相互作用,又称直接耦 合或偶极偶极耦合),与纵向磁化强度相联 系
二维核磁共振实验
一维谱:一个脉冲频率(一个频率)的函数,一个变量, 二维谱:两个独立的变量,nmr信号受这两个变量的影响
TOCSY可以将每一个耦合网络用一个方格网 连接起来
脉冲序列为一个90o脉冲加上一串自旋锁定功 能的组合脉冲: 90o-t1- 自旋锁定-t2
旋转坐标系实验(有自旋锁定过程,如 TOCSY和ROESY)和实验室坐标系实验 (无自旋锁定过程,如COSY、DQF-COSY 和NOESY)
NOESY实验
第五讲:二维核磁共振谱介绍 Introduction of 2D NMR Spectroscopy
二维核磁简介

二维NMR图谱的表现形式
1、堆积图
2、等高线图 contour
多量子跃迁谱( HSQC)的原理:
2DNMR是两个独立频率变量的函数,共振 吸收分布在由两个频率轴组成的平面上 ,耦合 常数在二维平面上展开,构成二位核磁共振平 面图. 异核单量子相干谱只检测ΔM=±1的单量 子跃迁,通过15N,1H的耦合关系(本文献)找出他 们之间的连接关系.
文献所用方法简述
• 1、实验部分: • 实验对照组1:15N,13C标记氧化型和还原型 的cVIMP-Cys,分别测NMR。 • 实验对照组2:15N标记的cVIMP-Cys,一组加 入做标记的p97N ,另一组不加.这组实验记 录IcpIx/Iapo(加p97N组的峰高值与不加p97N 组的峰高值的比值),并计算
二维NMR的分类
2D-NMR可以分为三大类: 1、2D-J分解谱:(1)同核二维J分解谱 (2)异核二维J分解谱 2、2D-化学位移相关谱 : 同核化学位移相关谱(1H-1HCOSY) 异核化学位移相关谱 (1H-13CCOSY) 异核远程相关谱 (nJCH correlations等同于 HMBC谱 ) 3、 多量子跃迁 谱: HSQC 谱 (1H捡出的,异核单量子相干谱) HMQC谱 (1H捡出的,异核多量子相干谱) HMBC谱 (1H捡出的,异核多键相关谱)
结果与讨论
• 1、NMR Spectroscopy Indicates that cVIMP-Cys Is Partially Disordered(存在 无规卷曲部分) • 进一步实验: • 目的:在单个残基水平上研究构象变化和 结构特征。对49-71和124-189残基做标记, NMR图如下:
A:用p97N滴定15N 标记的cVIMP-Cys 表明两个蛋白质之 间有相互作用。 B:50-71位的残基 的峰值显著线性扩 展,有些信号消失。 C:局部有化学位 移的变化。
二维核磁共振谱

4.检测期:在此期间检测作为t2函数的各种横向矢 量的FID的变化,它的初始相及幅度受到t1函数 的调制。
与t2轴对应的ω2(F2轴),通常是化学位移, 与t1轴对应的ω1(F1 轴)是什么,取决于二维谱 的类型。
的不同核之间的偶合(交叉)。
交叉峰有两组, 分别出 现在对角线两侧, 并以
1
2
34
5
对角线对称。这两组对
角峰和交叉峰可以组成
一个正方形, 并且由此
F1
来推测这两组核A和X
有偶合关系。
O
CH3 CH2
CH2 CH2 C
CH3
5432
1
F2
12
四、二维谱的分类
二维谱可分为三类: 1)J 分解谱
J 分解谱亦称J谱或者δ-J谱。它把化学位移和自 旋偶合的作用分辨开来,分别用F2.F1表示,包括 异核和同核J谱。 2)化学位移相关谱
化学位移相关谱也称δ-δ谱,它把不同自旋核的 共振信号相互关联起来,是二维谱的核心。包括同 核化学位移相关谱,异核化学位移相关谱, NOESY和化学交换谱。 3)多量子谱 用脉冲序列可以检测出多量子跃迁,得到多量子 二维谱 。
13
第二节 二维J分解谱
二维J分解谱是将不同的NMR信号分解在两 个不同的轴上, 使重叠在一起的一维谱的化学位 移δ和偶合常数J分解在平面两个坐标上, 提供了 精确的偶合裂分关系, 便于解析。二维J分解谱 分为同核和异核J分解谱。
2
一、1D-NMR到2D-NMR的技术变化 (一)一维核磁共振谱及脉冲序列 基本脉冲序列:
第五讲:二维核磁共振谱介绍

此外15N-1H,29Si-1H系统也得到了广泛的应 用
Байду номын сангаас
常用的3种二维异核实验
HMQC HMBC HSQC
HMQC(异核多量子相关谱)实验
HMQC实验是通过检测1H信号而达到间接检测13C或15N信号 的一种方法
是成功率最高的异核相关实验,正逐步取代一维的不灵敏核 检测
但是用于自旋锁定的组合脉冲是不相同的, 锁定功率和锁定时间也有较大的区别 ROESY也不可避免地受到J耦合的干扰,而 且难以用一般的方法予以消除
异核二维NMR谱简介
异核二维NMR谱主要指的是检测1H而同时间 接观测13C、15N等核的逆检测二维相关谱
记录不灵敏核FID的HECSY实验已被淘汰 直接观测灵敏核的FID,通过核间耦合间接地
检测期(t2) 在检测期t2期间采集的FID信号是F2域的时间函数,所对应的轴通 常是一维核磁共振谱中的频率轴,即表示化学位移的轴。但检测期t2期间采集的 FID信号都是演化期t1的函数,核进动的磁化矢量具有不同的化学位移和自旋偶 合常数,其FID信号是这些因素的相位调制的结果。因此,通过控制时间长度可 使某期间仅表现化学位移的相位调制,而某期间又仅表现自旋耦合的相位调制, 通过施加不同的调制就产生了各种不同的二维核磁共振谱。
演化期(t1) 在预备期末,施加一个或多个90脉冲,使系统建立共振非平衡状 态。演化时间t1是以某固定增量t1为单位,逐步延迟t1。每增加一个t1,其对应 的核磁信号的相位和幅值不同。因此,由t1逐步延迟增量t1可得到二维实验中的 另一维信号,即F1域的时间函数。
混合期(m) 由一组固定长度的脉冲和延迟组成。在混合期自旋核间通过相干 转移,使t1期间存在的信息直接影响检测期信号的相位和幅值。根据二维实验所 提供的信息不同,也可以不设混合期。
核磁二维谱

基本原理
一维核磁谱的信号是一个频率的函数,共振峰分 布在一个频率轴(或磁场)上,可记为S(ω)。
二维谱信号是二个独立频率(或磁场)变量的函 数,记为S(ω1,ω2),共振信号分布在两个频率轴组 成的平面上。也就是说2D NMR将化学位移、偶合常 数等NMR参数在二维平面上展开。
3
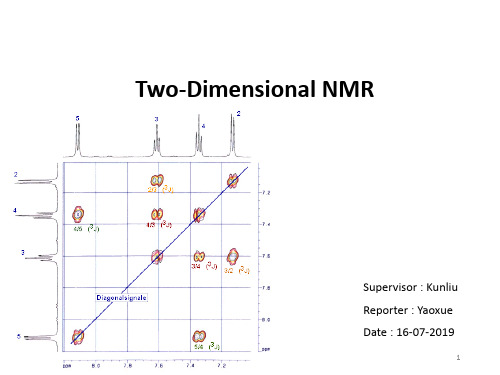
二维谱共振峰的名称
对角峰:它们处在坐标F1=F2的对角线上。对角峰在 F1或F2上的投影得到常规的一维偶合谱或去偶谱。
交叉峰:交叉峰也称为 2 1
34
5
相关峰(F1≠F2),在 对角线两侧并对称,和
对角峰可以组成一个正
F1
方形,由此可推测这两
组核存在偶合关系。
O
CH3 CH2
54
CH2 CH2
32
C
CH3
1
F2
4
同核化学位移相关谱
1H检测的异核化学位移相关谱:两个不同核的频率 通过标量偶合建立起来的相关谱。应用最广泛的是1H13C COSY。
11
13C-1H COSY
12
1H检测的异核多量子相关谱(HMQC)
常规的13C检测的异核直接相关谱,灵敏度低,样品的 用量较大,测定时间较长;
HMQC(异核多量子相关谱)技术很好地克服了上述缺 点,HMQC实验是通过多量子相干,检测1H信号而达到间 接检测13C的一种方法;
有机波谱分析
二维核磁谱(2D-NMR)
二维核磁共振波谱法
➢ 二维核磁共振(2D-NMR)是Jeener于1971年提出, 是一维谱衍生出来的新实验方法;
➢ 可将化学位移、偶合常数等参数展开在二维平面 上,减少了谱线的拥挤和重叠;
➢ 提供的HH、CH、CC之间的偶合及空间的相互作用, 确定它们之间的连接关系和空间构型。
二维核磁共振谱概述 ppt课件

ppt课件
2
二维谱的表现方式
等高线图中最中心的圆圈 表示峰的位置,圆圈的数 目表示峰的强度。
等高线图
ppt课件
3
化学位移相关谱
同核位移相关谱
异核位移相关谱 NOE
ppt课件
4
同核位移相关谱
1H-1H
COSY ,COSY是correlated spectroscopy的缩写。
交叉峰或 相关峰 对角峰或 自相关峰
ppt课件 7
3
1
4
5
6
ppt课件 2-己酮 H-HCOSY
8
1
1 234 56 7
23
56
7
4
3 2
H H
H 4 5 6 7 C=C-O-CH2-CH2-CH2-CH3
1
ppt课件
9
ppt课件
10
ppt课件
11
异核位移相关谱
C-H COSY 是13C 和1H 核之间的位移相关谱。 它反映了13C和1H 核之间的关系。
二维核磁共振谱概述
什么是二维核磁共振谱?
二维核磁共振谱:
是有两个时间变量,经两次傅利叶变换得到 的两个独立的频率变量的谱图。一般用第二个时 间变量 t2 表示采样时间,第一个时间变量 t1 则是 与 t2 无关的独立变量,是脉冲序列中的某一个变 化的时间间隔。
ppt课件
1
二维谱的分类
J分解谱 J Resolved Spectroscopy, d-J 谱 同核 (homonuclear), 异核(heteronuclear) 化学位移相关谱 Chemical Shift Correlation Spectroscopy, d- d 谱 同核耦合, 异核耦合, NOE 和化学交换 多量子谱 Multiple Quantum Spectroscopy
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二维NMR图谱的表现形式
1、堆积图
2、等高线图 contour
多量子跃迁谱( HSQC)的原理:
2DNMR是两个独立频率变量的函数,共振 吸收分布在由两个频率轴组成的平面上 ,耦合 常数在二维平面上展开,构成二位核磁共振平 面图. 异核单量子相干谱只检测ΔM=±1的单量 子跃迁,通过15N,1H的耦合关系(本文献)找出他 们之间的连接关系.
A:用p97N滴定15N 标记的cVIMP-Cys 表明两个蛋白质之 间有相互作用。 B:50-71位的残基 的峰值显著线性扩 展,有些信号消失。 C:局部有化学位 移的变化。
• 图谱说明50-71位残基就是预测的螺旋结构。 • C段部分受p97N的影响比N段部分小,c图 显示C段少数残基化学位移发生变化。B图 仍可观测到C段的线性展宽。 • 163-181残基扩展最多,说明在此cVIMPCys和p97N形成一个瞬时的结构。
文献所用方法简述
• 1、实验部分: • 实验对照组1:15N,13C标记氧化型和还原型 的cVIMP-Cys,分别测NMR。 • 实验对照组2:15N标记的cVIMP-Cys,一组加 入做标记的p97N ,另一组不加.这组实验记 录IcpIx/Iapo(加p97N组的峰高值与不加p97N 组的峰高值的比值),并计算
结果与讨论
• 1、NMR Spectroscopy Indicates that cVIMP-Cys Is Partially Disordered(存在 无规卷曲部分) • 进一步实验: • 目的:在单个残基水平上研究构象变化和 结构特征。对49-71和124-189残基做标记, NMR图如下:
二维NMR的分类
2D-NMR可以分为三大类: 1、2D-J分解谱:(1)同核二维J分解谱 (2)异核二维J分解谱 2、2D-化学位移相关谱 : 同核化学位移相关谱(1H-1HCOSY) 异核化学位移相关谱 (1H-13CCOSY) 异核远程相关谱 (nJCH correlations等同于 HMBC谱 ) 3、 多量子跃迁 谱: HSQC 谱 (1H捡出的,异核单量子相干谱) HMQC谱 (1H捡出的,异核多量子相干谱) HMBC谱 (1H捡出的,异核多键相关谱)
NMR spectroscopy
核磁ቤተ መጻሕፍቲ ባይዱ振实验的分类:
1、连续波NMR实验(简称CW),获得一维NMR谱,仅能做 1H- NMR实验。(依赖于-个FID信号) 2、单脉冲-傅立叶NMR实验(SPFT-NMR), 获得一维NMR谱,在 图谱上完全等同于CW,只是扫描时间短,可以做氢谱,也可 以做碳谱(依赖于-个FID信号)
• A:氨基酸序列,黑色的未标记,蓝/绿表示 氧化还原型可/不可转换的序列。 • B:蓝色的是氧化型,绿色的是还原型。箭 头指示出有变化的峰。 • C、D:I 、II区域放大图。 • 虚线区:含NH2的侧链。 • 内框:色氨酸信号。
• 结论:标记区域具有很小的紧致的结构。 对比发现二硫键对整个蛋白质的结构几乎 没影响。173-189位残基的转换表明在C端 有两个半胱氨酸。
3、一维多脉冲傅立叶NMR实验,获得一维NMR谱。mPFT-NMR在 SPFT-NMR基础上,得到特定的信息。(依赖于-个被调制FID信号)
4、二维多脉冲-傅立叶NMR实验(2D-mPFT-NMR), 得到二维NMR谱 (堆积图或等高线图)。(依赖于两个FID信号的图谱) 5、三维多脉冲-傅立叶NMR实验(3D-mPFT-NMR), 得到三维NMR谱 (堆积图或等高线图)。(依赖于三个FID信号的图谱)
