盐酸林可霉素注射液(成品)检验操作规程
019盐酸林可霉素检验记录
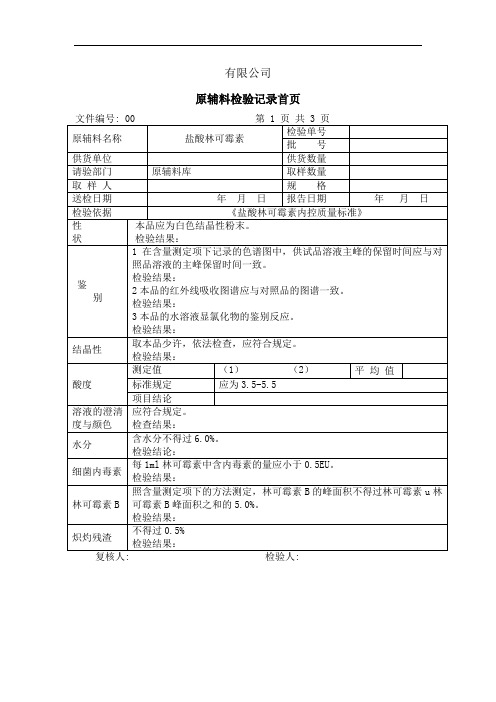
原辅料检验记录首页
文件编号: 00第 1 页 共 3 页
原辅料名称
盐酸林可霉素
检验单号
批 号
供货单位
供货数量
请验部门
原辅料库
取样数量
取 样 人
规 格
送检日期
年 月 日
报告日期
年 月 日
检验依据
《盐酸林可霉素内控质量标准》
性
状
本品应为白色结晶性粉末。
检验结果:
鉴
别
1在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液的主峰保留时间一致。
对照品制备:另取林可霉素对照品,同上法制得 。
样品编号
内 容
1
2
样品取量Vs(g)
样品峰面积As
对照品取量Wc(g)
对照品峰面积Ac
计算公式:
As×Wc×N N(对照品含量)=
X = ×100%
Ac×Vs×S S(样品标示量)=
按无水物计,样品含量X(%)
含 量 平 均 值(%)
A-B
相对偏差 ×100%主要Fra bibliotek分析仪器
名 称
型 号
精度
柱温
测定用波长
编 号
分 析 天 平
BT25S
0.00001
____
_______
MHT-007
高效液相色谱仪
UV200II
----
30℃
254nm
MHT-008
色谱柱
C-18
流动相:0.05mol/L硼砂溶液-甲醇(4:6)
样品制备:取本品约50mg,精密称定,置25ml量瓶中,加流动相溶解并稀释至刻度,摇匀,精密量取10ul,注入液相色谱仪 。
高级药物检验工技能辅导-HPL

岛津HPLC-10A色谱仪的使用
一、流动相排气泡
逆时针打开排液阀 排气泡
顺时针关闭排液阀
开泵运行 1min
流速设为 5ml/min
流速设为 1ml/min
二、 参数设置
设为 25MPa
设为D2
三、待测样品的准备
1.用待测液润洗微量注射器3次; 2.吸取规定量待测液(注射器内应无气泡); 3.将注射器插入进样口至底端,将六通阀手柄扳至LOAD状态。
高级药物检验工技能辅导
——高效液相色谱法
1、盐酸林可霉素注射液含量测定
⑴.精密量取本品 ml(规格为1ml:0.2mg),用流动相稀释成浓度为2mg/ml 的供试品溶液,摇匀,微孔滤膜(0.45um)过滤。用进样针精密吸取10ul注 入液相色谱仪,测定,记录色谱信息。
⑵.另取林可霉素对照液,同法测定。 ⑶.按外标法计算供试品中林可霉素的含量。
⑵.另精密量取黄体酮对照品溶液和内标溶液各5ml,置25ml量瓶中,用甲醇稀释 至刻度,摇匀,微孔滤膜(0.45um)过滤。用进样针精密吸取10ul注入液相 色谱仪,测定,记录色谱信息。
⑶.按照内标法计算校正因子和 R
含量%
f
CS
AX AS
W标
n
100%
V标
⑷.按照中国药典2005版,判断结果是否符合 规定。
3.盐酸林可霉素注射液中特殊杂质
林可霉素B的检查
⑴.取本品(规格为1ml:0.2g)适量,用流动相稀释成2mg/ml的溶液,摇匀,微 孔滤膜(0.45um)过滤。用进样针精密吸取10ul注入液相色谱仪,测定,记 录色谱信息。
⑵.按照中国药典2005版规定,判断结果是否符合规定。
四、样品测定
1.设置 2.将注射器内待测溶液快速注入色谱仪,并 将六通阀手柄扳至Inject状态。
盐酸林可霉素(省)工艺规程

盐酸林可霉素(无菌粉)原料药生产工艺规程目录1、适用范围 (2)2、引用标准 (2)3、职责 (2)4、产品名称及剂型 (2)5、产品概述 (2)6、生产工艺流程图 (3)7、工艺过程 (4)8、物料规格、质量标准 (4)9、生产工艺和质量控制检查成品质量标准 (5)10、技术安全与防火 (7)11、综合利用与“三废”治理 (8)12、操作工时与生产周期 (8)13、劳动组织与岗位定员 (8)14、设备一览表及主要设备生产能力 (9)15、原材料、动力消耗定额和技术经济指标 (9)16、物料平衡 (10)1、适用范围本规程规定了流感XXXXXXXXXX生产全过程的工艺技术、质量、物耗、安全、工艺卫生、环境保护等内容,经验证合格,符合GMP规范要求。
本工艺规程具有技术法规作用。
本工艺规程适用于流感XXXXXXXXXX的生产全过程,是各部门共同遵循的技术准则。
2、引用标准《中华人民共和国药典》2005年版(第三部)《中国生物制品主要原辅材料质控标准》(2000年版)《药品生产质量管理规范》(1998年修订)《XXXXXXXXXX制造和检定规程》批准件3、职责起草:生技部组织相关专业技术人员负责起草。
审批:技术总监和质量总监审核,总经理批准。
执行:各级生产质量管理人员及操作人员。
4、产品名称及剂型4.1产品通用名称:盐酸林可霉素汉语拼音:Yansuan Linkemeisu商品名:XXXXXXX英文名称:Lincomycin Hydrochloride4.2剂型:注射用无菌粉5、产品概述5.1定义、组成与用途本品为链菌属链丝菌菌群生长时的产物,即一种林可胺类碱性抗生素。
主要通过抵制细菌的蛋白质合成而起作用。
本品适用于链球菌、肺炎球菌和金黄色葡萄球菌等敏感菌所引起的严重感染性疾病的治疗,也可用于青霉素过敏的或临床医师判定为青霉素药物不适用的感染性疾病的治疗。
本品可能导致抗生素所致的伪膜性肠炎的危险,医师在选择本药时就当考虑感染的情况是否有较低毒性药物适用的可能(如红霉素)。
04盐酸林可霉素注射液工艺规程分则

主要内容与适用范围1. 本标准在小容量注射剂工艺规程通则的基础上,规定了盐酸林可霉素注射液的处方依据、原辅料质量标准,包装材料质量标准,半成品的检验方法和控制,成品质量标准等内容。
2. 本标准适用于盐酸林可霉素注射液的生产质量控制及检验。
产品名称、剂型、规格1. 产品名称:1.1. 通用名称:盐酸林可霉素注射液1.2. 汉语拼音:yansuan Linkemeisu Zhusheye1.3. 英文名:Lincomycin Hydrochloride Injection2. 剂型:注射剂3. 规格:2ml:0.2g 2ml:0.6g4. 性状:本品为无色的澄明液体。
产品处方和依据1. 处方:1.1. 2ml:0.6g盐酸林可霉素300g(活性)苯甲醇8ml亚硫酸氢钠3g活性炭0.1~0.5%注射用水加至1000ml1.2.2ml:0.2g盐酸林可霉素100g(活性)苯甲醇4ml亚硫酸氢钠 1.5g活性炭0.1~0.5%注射用水加至1000ml2. 依据: 中国药典2005年版二部3. 批准文号:(1)2ml :0.6g 国药准字H37021474 (2)2ml :0.2g 国药准字H370214754. 安瓶质量要求:玻璃瓶应为中性安瓶外观,尺寸,折断力应符合小容量注射剂工艺规程通则.5. 安瓶精洗:注射用水终端经0.22μm 微孔滤器滤过。
6. 滤器要求:除炭过滤(5μm 钛棒),粗滤(5μm 钛棒),保证过滤(0.45μm 聚砜),精滤(0.22μm 聚砜).7. 药液配制7.1. 根据配制量,向浓配罐内注入配制总量1/2的注射用水,温度控制在90℃,打开进料口盖向上反放稳妥.7.2. 向盛有亚硫酸氢钠的桶内注入适量注射用水,以溶解亚硫酸氢钠。
7.3. 启动搅拌电源开关进行搅拌,边搅拌边将称好的苯甲醇加入浓配罐中溶解.待苯甲醇溶解后,加入溶解好的亚硫酸氢钠,再加入林可霉素,加入溶解的活性炭.注意不要把原料撒在加料口. 7.4. 投完料关闭机械搅拌,用洁净工具在投料罐之处,手工搅拌5分钟(防止浓配罐底原料堆积结块)。
盐酸林可霉素检验记录

结果:
检验人:复核人:
检查
(4)水分
仪器名称与型号:ZSD-2型自动水分滴定仪仪器编号:0310-04-103
测定温度:
费休氏试液的标定:
F……………为每1ml费休氏试液相当于水的重量(mg)
W…………为称取重蒸馏水的重量(mg)
A……………为滴定所消耗费休氏试液的容积(ml)
B……………为空白所消耗费休氏试液的容积(ml)
W1=mg W2=mg W3=mg
A1=ml A2=ml A3=ml
B=ml
计算得:F1=F2=F3=
F平均值为相对平均偏差=
供试品测定:供试品中水分含量X=
W…………为称取供试品的重量(mg)
计算:含量X
…………为称取对照品的重量(g) …………为对照品峰面积
…………为称取供试品的重量(g) …………为供试品峰面积 ……………为对照品含量
MR=
Mx1=Mx2=
AR1=AR2=
AX1=AX2=
X1=X2=
检验人:复核人:
含量测定
平均值:
含量(按干品计)为
结果:
检验人:复核人:
(2)测定:取本品约50mg,精密称定,置25ml量瓶中,用适量流动相溶解并稀释至刻度,摇匀,精密量取10μl注入液相色谱仪,记录色谱图;另取盐酸林可霉素对照品适量,同法测定。按外标法以峰面积计算供试品中C18H34N2O6S的含量。
(3)含量
对照品来源:对照品批号:
对照品规格:对照品含量:
对照品溶液配制:精密称取盐酸林可霉素对照品,置于25ml量瓶中,用适量流动相溶解并稀释至刻度。
注射用盐酸林可霉素0.6工艺验证报告

验证报告编号:2305·429-00注射用盐酸林可霉素工艺验证报告起草人:日期:年月日审核人:日期:年月日批准人:日期:年月日海南霞迪药业有限公司注射用盐酸林可霉素(0.6g规格)生产工艺验证方案目录1.概述 (3)2.验证目的 (3)3.验证范围 (3)4.验证小组成员及职责范围 (3)4.1验证小组成员 (3)4.2 验证小组成员职责范围 (3)5.验证进度计划 (4)6.验证规程号 (4)7.粉针主要生产设备一览表 (4)8.生产洁净区的划分及工艺流程 (5)9.生产和检验标准文件的引用 (6)10.产品生产工艺过程综合指标确认 (7)11.验证内容 (10)12.验证条件监控 (22)12.1人员监控情况 (22)12.2关键工艺参数监控情况 (23)12.3生产环境监控情况 (23)12.4处理程序 (23)13.偏差报告 (23)14.拟订验证周期 (23)15.验证结果评价和结论 (24)16.验证会签 (24)1 概述:本公司生产的注射用盐酸林可霉素,其规格为0.6g/瓶。
为了证明在执行SP-MF-000-000-00注射用盐酸林可霉素生产工艺规程的情况下,能稳定地生产出符合质量标准的产品。
在这之前验证小组已对空调净化系统、纯化水和注射用水系统,以及在线设备分别进行了验证,同时对生产线也进行了验证合格,所以本报告主要就该产品生产工艺规程及其生产过程和最终产品质量等进行验证并作出评价。
2目的:为了证明在执行SP-MF-000-000-00注射用盐酸林可霉素生产工艺规程的情况下,连续生产三批,最终产品的稳定性、可靠性并符合标准要求。
3 范围: 本验证报告适用于粉针车间的厂房、设施、设备、工艺条件下注射用盐酸林可霉素(0.6g规格)的生产,当上述条件发生改变时,应重新验证。
4 验证小组成员及职责范围:4.1验证小组成员:部门职务姓名生产技术部组长质量部组员工程部组员物控部组员QA 组员QC 组员岗位操作组员4.2.1生产技术部:负责起草验证方案和有关规程,按批准的验证方案起草验证方案,组织培训考核人员,组织实施验证并同时收集验证资料,会签验证报告。
SOP-QC--00 盐酸克林霉素残留限度检验测定标准操作规程

目 的:建立盐酸克林霉素残留限度的检验标准操作规程。
范 围:适用于盐酸克林霉素残留限度检验的标准操作。
职 责:QC 负责盐酸克林霉素残留限度的检验。
内 容:1 测定内容1.1 仪器与用具高效液相色谱仪、量筒、容量瓶。
1.2 试剂与试药盐酸克林霉素对照品、色谱甲醇、磷酸氢二铵、磷酸。
1.3 操作方法色谱条件与系统适用性试验 用十八基键合硅胶为填充剂,以磷酸二氢铵溶液(取磷酸二氢铵2.88g ,加水溶解并稀释成1000ml ,用80%磷酸溶液调节pH 至3.0)-甲醇(210:300)为流动相;检测波长214nm ,流速为1ml/min ;理论板数按克林霉素峰计算应不低于1300,按外标法以峰面积计算含量。
对照品溶液的制备 取盐酸克林霉素对照品适量,加流动相溶解使制成含克林霉素为5μg/ml 的溶液,作为对照品溶液。
供试品溶液的制备 取设备清洁水(或取已清洁后擦拭过的棉球加入5ml 流动相超声5mim ),作为供试品溶液。
测定法 精密量取供试品溶液和对照品溶液各20µl ,分别注入液相色谱仪,记录色谱图,按外标法以峰面积计算含量。
1.4 结果判定 盐酸克林霉素残留限度检验标准操作规程文件编码:SOP -QC -版本号:00 制订人:制订日期: 会稿人:审核人:审核日期: 批准人:批准日期: 起草部门:质量控制部颁发部门:质量保证部 生效日期: 复印份数 共 份 受控号: 分发部门 □质量保证部、□质量控制部、□人力行政部、□设备工程部、□物控部、□仓储、□研发部、□生产技术部、□固体车间、□口服液车间、□洗剂车间、□提取车间、□冻干粉针车间、□生化提取车间淋洗法含克林霉素≤6.09μg/ml、擦拭法含克林霉素≤8.05 μg/ml(以具体设备清洁验证方案要求为准),则符合规定。
2 相关记录2.1盐酸克林霉素残留限度检验记录3 变更明细表序号章节变更内容变更日期变更编号现版本号。
注射用盐酸克林霉素细菌内毒素的检查方法

注射用盐酸克林霉素细菌内毒素的检查方法
李琳
【期刊名称】《中国医药指南》
【年(卷),期】2012(10)30
【摘要】目的研究并建立注射用盐酸克林霉素(Hydrochloric acid with colin)检查细菌内毒素(Bacterial endotoxin)的方法,明确影响细菌内毒素检查的因素及其控制办法.方法依据2010版《中国药典》(二部)附录XIE中收载的有关细菌内毒素检查方法,参照其方法的设计和思路进行试验并对其结果进行判定.对不同批号的供试品用不同厂家的鲎试剂进行干扰试验[1-2].结果当盐酸克林霉素被稀释至
6.0mg/mL时可消除对鲎试剂的干扰,其细菌内毒素的限值为0.25EU/mg.结论注射用盐酸克林霉素检查细菌内毒素的方法代替热原检查法是能够实现的,盐酸克林霉素可以对细菌内毒素检查进行质量的控制.
【总页数】2页(P455-456)
【作者】李琳
【作者单位】岳阳市长炼医院药剂科,湖南岳阳 414012
【正文语种】中文
【中图分类】R927.1
【相关文献】
1.注射用盐酸克林霉素的细菌内毒素检查 [J], 沈春燕;冯婧;陈益
2.注射用盐酸克林霉素细菌内毒素检查方法 [J], 刘雪莉;张敏;李晓利
3.注射用伏立康唑细菌内毒素检查方法研究 [J], 王红平;黄梅梅;荣祖元
4.注射用头孢硫脒细菌内毒素检查方法学研究 [J], 韩佩莲;游蓉丽
5.注射用卡络磺钠细菌内毒素检查方法研究 [J], 孙智培;何硕;胡翮
因版权原因,仅展示原文概要,查看原文内容请购买。
盐酸林可霉素注射液生产工艺规程

制药有限公司盐酸林可霉素注射液生产工艺规程颁发单位:GMP办公室工艺规程批准程目录1. 剂型、规格 (3)2. 生产工艺流程 (3)3. 操作过程及工艺条件 (4)4.质量控制要点 (7)5.设备一览表、主要设备生产能力 (8)6.工艺过程中的SOP (8)7.中间产品的控制 (9)8.验证工作要点 (9)9.工艺验证的具体要求 (10)10.工艺卫生和环境卫生 (10)11.劳动组织及岗位定员 (10)一、制剂类型:最终灭菌小容量注射液,10ml规格,安瓿瓶包装。
10ml:3g二、流程图:盐酸林可霉素注射液生产工艺流程图三、操作过程及工艺条件1 生产前的检查与确认1.1 是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。
1.2 检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格”标示。
1.3 所使用原辅料是否准备齐全。
是否有质量检验报告单,合格品才能使用。
1.4 检查工艺用水是否新鲜制备,贮存不得超过24小时。
1.5 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。
1.6 检查确认生产场所的温度是否在规定范围内(18-26℃,相对湿度在30%-65%)。
2 洗瓶、干燥灭菌2.1理瓶:根据“批生产指令”准备所需的清洁盘、领取必须的安瓶。
在理瓶室将安瓶的合格品摆满瓶盘。
2.2清洗:把安瓿瓶盘放在不锈钢传送链条上,开动洗瓶机用高压循环纯化水洗安瓿瓶内外壁。
将安瓿瓶盘对称放置,固定在甩水机上,启动甩水机,甩水处理8分钟,至安瓶甩干。
重复上述操作。
2.3 精洗:用水温50--60℃,经孔径0.45um滤膜滤过的澄明度合格的注射用水清洗安瓿瓶内外壁,重复粗洗步骤。
定时检查安瓿的清洁度:目检1000ml注射用水无可见异物,抽50支,毛、块≤2%。
2.4 干燥与灭菌:安瓿盘均匀放入烘干箱内,150℃烘干1小时,消除热原。
2.5 灭菌后的安瓿立即使用或清洁存放,贮存不得超过48小时。
注射用盐酸林可霉素工艺验证报告0.6g

验证报告编号:2305·429-00注射用盐酸林可霉素工艺验证报告起草人:日期:年月日审核人:日期:年月日批准人:日期:年月日海南霞迪药业有限公司注射用盐酸林可霉素(0.6g规格)生产工艺验证报告目录1.概述 (3)2.验证目的 (3)3.验证范围 (3)4.验证小组成员及职责范围 (3)4.1验证小组成员 (3)4.2 验证小组成员职责范围 (3)5.验证进度计划 (4)6.验证规程号 (4)7.粉针主要生产设备一览表 (4)8.生产洁净区的划分及工艺流程 (5)9.生产和检验标准文件的引用 (6)10.产品生产工艺过程综合指标确认 (7)11.验证内容 (10)12.验证条件监控 (22)12.1人员监控情况 (22)12.2关键工艺参数监控情况 (23)12.3生产环境监控情况 (23)12.4处理程序 (23)13.偏差报告 (23)14.验证周期 (23)15.验证结果评价和结论 (24)16.验证会签 (24)1 概述:本公司生产的注射用盐酸林可霉素,其规格为0.6g/瓶。
为了证明在执行SP-MF-000-000-00注射用盐酸林可霉素生产工艺规程的情况下,能稳定地生产出符合质量标准的产品。
在这之前验证小组已对空调净化系统、纯化水和注射用水系统,以及在线设备分别进行了验证合格,同时对生产线也进行了验证合格,所以本验证主要就该产品生产工艺规程及其生产过程和最终产品质量等进行验证并作出评价。
2目的:为了证明在执行SP-MF-000-000-00注射用盐酸林可霉素生产工艺规程的情况下,连续生产三批,最终产品的稳定性、可靠性并符合标准要求。
3 范围: 本验证报告适用于粉针车间的厂房、设施、设备、工艺条件下注射用盐酸林可霉素(0.6g规格)的生产,当上述条件发生改变时,应重新验证。
4 验证小组成员及职责范围:4.1验证小组成员:部门职务姓名生产技术部组长质量部组员设备部组员物控部组员QA 组员QC 组员岗位操作组员4.2.1制造部:负责起草验证方案和有关规程,按批准的验证方案起草验证方案,组织培训考核人员,组织实施验证并同时收集验证资料,会签验证报告。
盐酸林可霉素检验标准操作规程
4.4 计算
含量X
……………为称取对照品的重量(g) ……………为对照品峰面积
3.3.7微生物限度
取本品5g,加入45℃的pH7.0的无菌氯化钠-蛋白胨缓冲液至100ml,混匀,作为1:20的供试液。取供试液2ml,照微生物限度检查薄膜过虑法(《中国药典》2005版二部附录Ⅺ J)检查,细菌数、霉菌和酵母菌数分别不得过100个/g,金黄色葡萄球菌、铜绿假单胞菌不得检出。
4.[含量测定]
3.3.1 结晶性
取本品少许,依法检查(《中国药典》2005版二部附录Ⅸ D),应符合规定。
3.3.2 酸度
取本品,加水制成每1ml中含0.1g的溶液,依法测定(《中国药典》2005版二部附录Ⅵ H),pH值应为3.0~5.5。
3.3.3溶液的澄清度与颜色
取本品5份,各2g,分别加水5ml使溶解,溶液应澄清;如显浑浊,与1号浊度标准液(《中国药典》2005版二部附录Ⅸ B)比较,均不得更浓;如显色,与黄色或黄绿色1号标准比色液(《中国药典》2005版二部附录Ⅸ A)比较,均不得更深。
规程:
1.[性状]
取本品适量,置表面皿中,在自然光下检视,为白色结晶性粉末;有微乙醇中略溶。
2.[鉴别]
2.1 仪器与用具
分析天平 试管 红外分光光度计
2.2 试药与试液
盐酸林可霉素对照品
2.3 操作方法
2.3.1取本品,按红外分光光度法(《中国药典》2005版二部附录ⅣC)测定,红外光吸收图谱应与盐酸林可霉素对照品图谱一致(糊法)。
盐酸克林霉素氯化钠注射液检验标准操作规程

范围:盐酸克林霉素氯化钠注射液职责:检验室对本规程的实施负责正文:1.性状——本品为无色的澄明液体。
2.鉴别2.1在含量测定下项下记录的色谱中,供试品主峰的保留时间与盐酸克林霉素对照品主峰的保留时间一致。
2.2本品显钠盐与氯化物的鉴别反应。
3.检查3.1PH值——取本品,依法测定,PH值应为3.0--5.0。
3.1.1执行SOP-QM-418《pH值测定法标准操作规程》。
3.1.2执行SOP-EM-304《PHS-3C型酸度计标准操作规程》。
3.2有关物质——取本品作为供试液;精密量取1ml至50ml量瓶中,加0.9%的氯化钠溶液稀释至刻度摇匀作为对照液(1);另精密称取林可霉素对照品适量,加0.9%的氯化钠溶液溶解并定量稀释制成每1ml中含林可霉素为60μg的溶液作为对照液(2)。
照含量测定项下的方法试验,取对照溶液(1)20μl注入液相色谱仪,调节检测灵敏度,使主成分峰的峰高约为记录仪满量程的20%;再量取0.9%的氯化钠空白溶液、对照液(1)、对照溶液(2)、供试液各20μl,分别注入液相色谱仪,记录色谱图至主要成分峰保留时间的2倍。
供试液色谱图中,如有杂质峰,扣除溶剂空白的干扰,林可霉素的峰面积不得大于对照溶液(2)主峰面积的3倍(6.0%),其它单个杂质不得大于对照溶液(1)的主峰面积(2.0%),所有杂质峰面积的和(溶剂峰除外,)不得大于对照溶液(1)主峰面积的4倍(8.0%)。
3.3重金属——取本品50ml,蒸发至约20ml,放冷,加醋酸盐缓冲液(pH3.5)2ml与水适量使成25ml,依法检查,含重金属不得过千万分之三。
3.3.1执行SOP-QM-402《重金属检查标准操作规程》中的第一法。
3.4不溶性微粒——取本品1瓶,依法检查,应符合规定。
即≥10µm微粒数应≤10粒/ml,≥25µm 的微粒数应≤1粒/ml。
3.4.1执行SOP-QM-412《不溶性微粒检查标准操作规程》。
盐酸林可霉素内控质量标准2010版
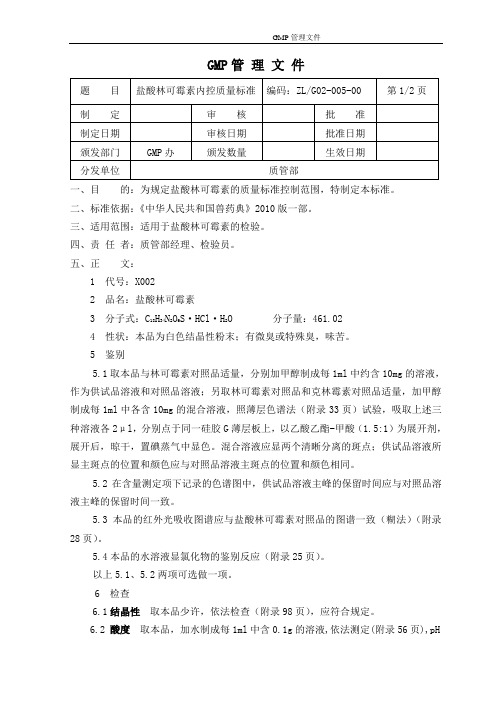
GMP管理文件一、目的:为规定盐酸林可霉素的质量标准控制范围,特制定本标准。
二、标准依据:《中华人民共和国兽药典》2010版一部。
三、适用范围:适用于盐酸林可霉素的检验。
四、责任者:质管部经理、检验员。
五、正文:1 代号:X0022 品名:盐酸林可霉素3 分子式:C18H34N2O6S·HCl·H2O 分子量:461.024 性状:本品为白色结晶性粉末;有微臭或特殊臭,味苦。
5 鉴别5.1取本品与林可霉素对照品适量,分别加甲醇制成每1ml中约含10mg的溶液,作为供试品溶液和对照品溶液;另取林可霉素对照品和克林霉素对照品适量,加甲醇制成每1ml中各含10mg的混合溶液,照薄层色谱法(附录33页)试验,吸取上述三种溶液各2μl,分别点于同一硅胶G薄层板上,以乙酸乙酯-甲酸(1.5:1)为展开剂,展开后,晾干,置碘蒸气中显色。
混合溶液应显两个清晰分离的斑点;供试品溶液所显主斑点的位置和颜色应与对照品溶液主斑点的位置和颜色相同。
5.2在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5.3本品的红外光吸收图谱应与盐酸林可霉素对照品的图谱一致(糊法)(附录28页)。
5.4本品的水溶液显氯化物的鉴别反应(附录25页)。
以上5.1、5.2两项可选做一项。
6 检查6.1结晶性取本品少许,依法检查(附录98页),应符合规定。
6.2 酸度取本品,加水制成每1ml中含0.1g的溶液,依法测定(附录56页),pH值应为3.0~5.5。
6.3溶液的澄明度与颜色取本品5份,各2g,分别加水5ml使溶解,溶液应澄清,如显浑浊,与1号浊度标准液(附录95页)比较,均不得更浓;如显色,与黄色或黄绿色1号标准比色液(附录91页第一法)比较,均不得更深。
6.4有关物质取本品适量,加流动相溶解并稀释制成每1ml中约含林可霉素4mg的溶液,作为供试品溶液;精密量取1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。
浅述盐酸林可霉素注射液快速检验法

TECHNOLOGY AND INFORMATION医疗与信息化科学与信息化2019年7月下 149浅述盐酸林可霉素注射液快速检验法李建珍 刘扬 张萍 远大医药(中国)有限公司制剂分公司 湖北 武汉 430040摘 要 目的:通过研究盐酸林可霉素注射液快速检验方法,方便相关机构和单位初步判断药品真伪,进而确保安全用药。
方法:基于化学方法鉴定叔胺这一特定基因,并在薄层色谱法的作用下,以比例为20:20:1的乙酸乙酯-无水乙醇-浓氨溶液为展开剂,配以格列苯脲、硅胶CF254、碘蒸汽分别为参比物、吸附剂、显色剂,对盐酸林可霉素加以鉴别。
结果:简单易操作且反应灵敏,斑点清晰且分离度好、重现性好。
结论 适用于盐酸林可霉素真伪的初步鉴别,值得推广。
关键词 盐酸林可霉素注射液;快速检验;供试品溶液由于盐酸林可霉素注射液对一般的需氧革兰阳性菌和一定的厌氧菌均有着良好的抗菌性,所以是一种常见的抗生素,有时还会被用作青霉素的替代药物。
然而现实中不法分子却制假贩假,致使人们难以区分真假,故为安全起见,积极探索盐酸林可霉素注射液的快速检验方法非常必要。
1 盐酸林可霉素注射液概述盐酸林可霉素具有类似于红霉素的抗菌谱,通过结合细菌核糖体5OS 亚基,在肽链的延长过程中发挥阻止作用,进而抑制细胞蛋白质的合成,达到抗菌的目的,通常可用于链球菌属、葡萄糖球菌属等引起的呼吸道感染,以及女性盆腔、腹腔、生殖道感染等疾病的治疗,若患者对青霉素过敏还可作为其替代药物使用[1]。
足以见得,盐酸林可霉素注射液有着非常重要的功能价值。
而这恰恰给了不法分子可乘之机,他们利用药品经营企业与基层医疗机构受条件限制,难以利用高效液相色谱法鉴别盐酸林可霉素注射液真伪的弊端,私自贩卖伪劣药品,不仅扰乱了市场秩序,更是为患者的身心健康埋下了安全隐患。
因此当务之急便是如何快速检验盐酸林可霉素注射液。
2 盐酸林可霉素注射液快速检验法根据有关规定,在鉴别主药盐酸林可霉素时应选择专业的高效液相色谱法,但受现实条件所限,不管是基层医疗机构还是药品经营企业,往往不具备这一能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
GMP管理文件
一、目的:为规定盐酸林可霉素注射液生产过程中的质量控制和
检验操作要求,特制定此操作规程。
二、适用范围:适用于盐酸林可霉素注射液成品的检验。
三、责任者:生产部经理、检验员、生产人员
四、正文:
质量标准:见盐酸林可霉素注射液(成品)内控质量标准
操作内容:
【性状】本品为无色的澄明液体。
【鉴别】(1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品显氯化物的鉴别反应。
【检查】 PH值取本品,加水制成每1ml中含0.1g的溶液,依法测定,PH值应为3.1~5.0。
颜色本品应无色;如显色,与黄色或绿色2号标准比色液比较,不得更深。
无菌取本品,转移至不少于500ml的0.9%无菌氯化钠溶液中,用
薄膜过滤法处理后,依法检查,应符合规定。
细菌内毒素照盐酸林可霉素项下的方法检查,应符合规定。
林可霉素B 取本品适量,加流动相定量稀释成每1ml中含2mg的溶液,照盐酸林可霉素项下的方法检查,林可霉素B的峰面积不得过林可霉素与林可霉素B峰面积之和的5.0%。
其他应符合注射剂项下有关的各项规定。
【含量测定】照高效液相色谱法测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以0.05mol/l硼砂溶液(用85%磷酸溶液调节PH值至5.0)-甲醇-乙腈(6.:36:4)为流动相;检测波长为214nm。
理论板数按林可霉素峰计算不低于1600。
测定法精密量取本品适量,用流动相稀释成每1ml中含林可霉素2mg的溶液,摇匀,精密量取10ul,注入液相色谱仪,记录色谱图;另取林可霉素对照品适量,同法测定,按外标法以峰面积计算供试品中C18H34N2O6S的含量。
