九年级化学常见离子对
初中化学常见离子符号

初中化学常见的离子符号常见的金属离子:锂离子:Li+ 钾离子:K+ 钠离子:Na+ 钙离子:Ca2+ 镁离子:Mg2+ 钡离子:Ba2+ 铝离子:Al3+ 锌离子:Zn2+ 铁离子:Fe3+ 亚铁离子:Fe2+ 铜离子:Cu2+ 亚铜离子:Cu+ 银离子:Ag+常见的非金属离子:氟离子:F—氯离子:Cl—溴离子:Br—碘离子:I—硫离子:S2—氧离子O2—氢离子:H+常见的离子团:碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32—硝酸根离子:NO3—氢氧根离子:OH—氯酸根离子ClO3—磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4—锰酸根离子:MnO42—铵根离子:NH4+说明:1、离子不可单独存在,有阴离子存在必然有阳离子,由阴阳离子构成的物质是离子化合物。
2、离子所带的电荷数与其在化合物中元素表现的化合价数值和正负均一致。
例如,硫离子S2—中S 的化合价为—2 3、离子团所带的电荷数与其整体表现化合价数值和正负一致,其整体化合价是其组成元素所表现化合价的代数和。
例如,铵根离子NH4+的整体化合价是+1,这是由于其中N显—3价,H显+1价决定的。
常用化合价口诀:一价氢氯(-1)钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零。
负一硝酸氢氧根,负二硫酸碳酸根,负三只有磷酸根,正一价的是铵根。
一、默写。
(每空1分,共15分)1、关关雎鸠,在河之洲。
,。
2、求之不得,。
悠哉悠哉。
3、,。
所谓伊人,在水一方。
4、溯洄从之,。
,宛在水中坻。
5、李贺《雁门太守行》一诗中分别从听觉和视觉两方面铺写阴寒惨烈的战地气氛的两句是,。
6、,受上赏;,受中赏;,,受下赏。
二、课内文言文阅读(70分)(一)生于忧患,死于安乐(16分)舜发于畎亩之中,傅说举于版筑之中,胶鬲举于鱼盐之中,管夷吾举于士,孙叔敖举于海,百里奚举于市。
中考化学专题复习:常见的十对离子反应和两类反应:

如:NH4Cl+NaOH=NaCl+ H2O+ NH3↑;NH4NO3+KOH=KNO3+ H2O+ NH3↑
生成水:
(9)H++ OH-→H2O
如:HCl + NaOH = NaCl +H2OH2SO4+ 2KOH = K2SO4+2H2O
(10)非金属氧化物+碱→盐+水
CO2+Ca(OH)2==CaCO3↓+H2O、2NaOH + CO2=Na2CO3+ H2O
(11)金属氧化物+酸→盐+水
Fe2O3+6HCl==2FeCl3+3H2O、CuO + H2SO4=CuSO4+ H2O
常见离子鉴别:
①Cl-检验:用试剂硝酸银溶液、稀硝酸):加入硝酸银溶液(AgNO3),产生白色沉淀,再滴加稀HNO3,白色沉淀不溶解,则证明含有Cl-。例HCl + AgNO3=AgCl↓+ HNO3
②CO32-检验:试剂(稀盐酸、澄清灰水):加入稀盐酸(HCl),产生气泡,把气体通入澄清石灰水,石灰水变浑浊,则证明含有CO32-。例Na2CO3+ 2HCl=2NaCl + H2O + CO2↑
③SO42-检验:试剂(硝酸钡溶液、稀硝酸):先加入Ba(NO3)2溶液,产生白色沉淀,再滴加稀HNO3,沉淀不溶解,则证明含有SO42-。例Na2SO4+ BaCl2=BaSO4↓+ 2NaCl,也可用一种碱氢氧化钡或一种盐氯化钡代替硝酸钡溶液。(最好用Ba(NO3)2溶液)。
复分解反应中离子对的综合运用

例2、下列离子能在pH=11的溶液中大量共存的是 ( )
A K+ NO3- Na+ OH-
B CO3- K+ Cl- Ca2+
C H+ Ba2+ Cl- SO42-
D K+ OH- SO42- Cu2+
练习1:下列各组离子能同时存在于同一溶液的是 ( )
A Ba2+ K+ NO3- CO32- H+ B K+ NO3- H+ Cl- SO42C Fe3+ SO42- Na+ OH- Cu2+ D NO3- Cl- K+ Ba2+ Ag+
复分解反应实质的微观分析
H+ Cl-
混合后
Na+
OH-
Cl-
H2O
Na+
忽略溶液中原有的水分子,假设NaOH和HCl恰好完全反应。
复分解反应实质的微观分析
Ba+ Cl-
混合后
Cl-
Na+ Na+BaSO4
CCl-l-
忽略溶液中原有的水分子,假设Na2SO4和BaCl2恰好完全反
练习4:除去食盐水中的可溶性杂质CaCl2 和Na2SO4的操作
有:①加过量BaCl2溶液;②过滤;③加过量Na2CO3溶液;
④蒸发结晶;⑤加适量盐酸。下列操作顺序正确的是(提
示:BaSO4、BaCO3难溶于水) A.③①②⑤④ B.①⑤③②④ C.①③⑤④②
D. ①③②⑤④
(一) 判断反应发生
例3、下列各组溶液,不能发生复分解反应的是 ( )
A HCl 和 Ca(OH)2
B Na2CO3 和H2SO4
九年级化学离子基础知识点

九年级化学离子基础知识点离子是指带电的原子或分子。
在化学中,离子是非常重要的概念和基础知识点。
本文将介绍九年级化学中的离子基础知识点,包括离子的定义、离子的命名和离子的性质。
一、离子的定义离子是指带有电荷的原子或分子。
当原子或分子失去或获得电子时,就会形成带正电荷或负电荷的离子。
失去电子的离子称为阳离子,带正电荷;获得电子的离子称为阴离子,带负电荷。
二、离子的命名离子的命名遵循一定的规则。
通常,阳离子的名称与元素名称相同,而阴离子的名称在元素名称后面加上-ide。
例如,氯离子的化学式是Cl-,它的名称是氯化物离子。
有些离子名称需特别记忆,如:氧化氢离子(H+)叫做氢离子,氧化物离子(O2-)叫氧离子,氢氧根离子(OH-)叫氢氧根离子等。
三、离子的性质离子具有许多特性和性质,下面将介绍几个重要的性质:1. 电荷离子的最显著的性质是电荷。
阳离子带正电荷,阴离子带负电荷。
通常情况下,离子在化学反应中会与其他离子或非离子发生相互作用。
2. 溶解性离子是溶解在水或其他溶剂中的。
有些离子易于溶解,如氯离子(Cl-)和钠离子(Na+),而有些离子不易溶解,如银离子(Ag+)和铅离子(Pb2+)。
溶解性是离子在化学反应和溶液中运动的重要特性。
3. 离子反应离子在化学反应中起着重要的作用。
离子可以与其他离子或非离子发生反应,例如,阴离子和阳离子可以结合形成化合物。
离子反应是化学反应中的重要反应类型之一。
4. 离子的结构离子通常以晶体的形式存在。
晶体是由阳离子和阴离子组成的定序排列结构。
晶体的结构和排列方式决定了离子的性质和行为。
5. 离子的质量离子的质量等于其原子或分子的质量。
阳离子和阴离子的质量可以通过化学实验测定。
综上所述,离子是带有电荷的原子或分子。
离子的命名遵循一定的规则,阳离子和阴离子分别带有正电荷和负电荷。
离子具有电荷、溶解性、离子反应、结构和质量等特性。
理解和掌握这些基础知识点,对于学习化学的进一步深入是非常重要的。
九年级上化学式及化学方程式整理

九年级上化学式及化学⽅程式整理⼆、离⼦及化合价:带电的原⼦或原⼦团,离⼦的带电量与原⼦的最外层电⼦数紧密相关。
1、氢离⼦:H+ 锂离⼦:Li+钠离⼦:Na+钾离⼦:K+银离⼦:Ag+(这⼏种元素的原⼦最外层电⼦数均为1,化合价均为+1价)2、铍离⼦:Be2+镁离⼦:Mg2+钙离⼦:Ca2+钡离⼦:Ba2+锌离⼦:Zn2+亚铁离⼦:Fe2+(这⼏种元素的原⼦最外层电⼦数均为2(除Fe外),化合价均为+2价)3、铝离⼦:Al3+铁离⼦:Fe3+(与其他物质化合时显+3价)4、硅离⼦:Si4+ (最外层4个电⼦,显+4价)5、硫离⼦:S2- 氯离⼦:Cl-6、氢氧根:OH-(-1价)硝酸根:NO3-(-1价)硫酸根:SO42- (-2价)碳酸根:CO32- (-2价)铵根:NH4+ (+1价)O通常显-2价,Cl通常显-1价,其他化合价需根据具体化学式进⾏推导。
在化合物⾥,正负化合价的代数和为零三、化学式:正价的写左边,负价写右边,⾦属⼀般显正价,⾮⾦属⼀般显负价。
1、⽓体类:氧⽓:O2氮⽓:N2 氢⽓:H2 ⼆氧化碳:CO2 ⼀氧化碳:CO⼆氧化硫:SO2 ⼆氧化氮:NO2 甲烷:CH4 氨⽓:NH32、液体类:⽔:H2O 双氧⽔:H2O2稀盐酸:HCl 稀硫酸:H2SO4碳酸:H2CO3 硝酸:HNO33、固体类:铁:Fe 铝:Al 铜:Cu 锌:Zn碳:C ⽩磷/红磷:P 硫磺:S 五氧化⼆磷:P2O5氧化铁:Fe2O3 四氧化三铁:Fe3O4⼆氧化锰:MnO2氧化镁:MgO 氧化铜:CuO 氧化汞:HgO ⾼锰酸钾:KMnO4锰酸钾:K2MnO4氯酸钾:KClO34、含氯离⼦的物质的化学式(注意找规律)氯化氢:HCl 氯化钠:NaCl 氯化钾:KCl 氯化锂:LiCl 氯化铵:NH4Cl 氯化银:AgCl氯化镁:MgCl2氯化钙:CaCl2氯化钡:BaCl2 氯化锌:ZnCl2氯化铜:CuCl2 氯化亚铁:FeCl2 氯化铁:FeCl3氯化铝:AlCl35、含氢氧根离⼦的物质的化学式氢氧化钠:NaOH 氢氧化钾:KOH 氢氧化银:AgOH氢氧化镁:Mg(OH)2氢氧化钙:Ca(OH)2氢氧化铜:Cu(OH)2氢氧化锌:Zn(OH)2氢氧化钡:Ba(OH)2氢氧化铝:Al(OH)3氢氧化铁:Fe(OH)36、含铵根离⼦的物质的化学式氯化铵:NH 4Cl 溴化铵:NH 4Br 硫酸铵:(NH 4)2SO 4 碳酸铵:(NH 4)2CO 3 7、含碳酸根离⼦的物质的化学式碳酸钠:Na 2CO 3 碳酸钾: K 2CO 3 碳酸银:Ag 2CO 3碳酸镁:MgCO 3 碳酸钙:CaCO 3 碳酸铜:CuCO 3 碳酸钡:BaCO 3 碳酸锌:ZnCO 3 8、含硝酸根离⼦的物质的化学式硝酸镁:Mg(NO 3)2 硝酸钙:Ca(NO 3)2 硝酸铜:Cu(NO 3)2 硝酸钡:Zn(NO 3)2 9、含硫酸根离⼦的物质的化学式硫酸钠:Na 2SO 4 硫酸钾:K 2SO 4 硫酸银:Ag 2SO 4硫酸镁:MgSO 4 硫酸钙:CaSO 4 硫酸铜:CuSO 4 硫酸锌:ZnSO 4 硫酸钡:BaSO 4 硫酸亚铁:FeSO 4 硫酸铁:Fe 2(SO 4)3 硫酸铝:Al 2(SO 4)3 四、化学⽅程式 1、燃烧类:碳燃烧:(1) C + O 2CO 2点燃(充分燃烧)(2) 2C + O 22CO 点燃(不充分燃烧)(3)磷燃烧:4P + 5O 22P 2O 5点燃(4)硫燃烧:S+ O 2SO 2点燃(5)铁燃烧:3Fe +2O 2Fe 3O 4点燃(6)镁燃烧:2Mg +O 22MgO 点燃(7)氢⽓燃烧:2H 2 +O 22H 2O 点燃(8)⼀氧化碳燃烧:2CO +O 22CO 2点燃(9)甲烷燃烧:CH 4 + 2O 2CO 2 + 2H 2O 点燃(10)酒精燃烧:C 2H 5OH + 3O 22CO 2 + 3H 2O 点燃2、实验室制取氧⽓:①加热⾼锰酸钾:2KMnO 4K 2MnO 4 + MnO 2 +O 2②分解过氧化氢:2H 2O 2MnO 2③加热氯酸钾:2KClO 3MnO 22KCl + 3O 23、电解⽔:2H 2O 2H 2 + O 2通电4、铁和硫酸铜反应:Cu + FeSO 4Fe + CuSO 45、硫酸铜和氢氧化钠反应:Na 2SO 4 + Cu(OH)2 CuSO 4 + 2NaOH还原性:6、单质碳的还原性:①还原氧化铜:2CuO +C2Cu + CO 2⾼温②还原氧化铁:2Fe 2O 3 + 3C⾼温4Fe + 3CO 2③还原⼆氧化碳:CO 2 + C⾼温2CO7、⼀氧化碳的还原性:①还原氧化铜:CuO + COCu + CO 2②还原氧化铁: Fe 2O 3+ 3CO ⾼温2Fe + 3CO 2③还原四氧化三铁:3Fe + 4CO 2⾼温8、氢⽓还原氧化铜:CuO + H 2Cu + H 2O9、实验室制取⼆氧化碳原理:CaCO 3 + 2HCl CaCl 2 + CO 2 + H 2O10、⼯业制取⼆氧化碳:CaO + CO 2CaCO 3煅烧11、检验⼆氧化碳原理:CO 2 + Ca(OH)2CaCO 3 + H 2O (使澄清⽯灰⽔变浑浊)12、⼆氧化碳与⽔反应:CO 2 + H 2OH 2CO 313、碳酸分解:CO 2 + H 2O H 2CO 314、⽣⽯灰与⽔反应⽣成熟⽯灰:CaO + H 2OCa(OH)2 (此反应放出⼤量的热)15、实验室制取氢⽓:Zn + H 2SO 4ZnSO 4 + H 2九年级下册:⾦属和⾦属材料16、铝被氧化:4Al + 3O22Al2O317、镁、锌、铁与盐酸(或稀硫酸)反应制取氢⽓①镁Mg + 2HCl MgCl2 + H2②锌Zn + 2HCl ZnCl2 + H2③铁Fe + 2HCl FeCl2 + H2⾦属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au⾦属活动性由强逐渐减弱9、⼆氧化碳通过灼热碳层: C+CO22CO10、⼀氧化碳燃烧:2CO+O22CO211、⼆氧化碳和⽔反应(⼆氧化碳通⼊紫⾊⽯蕊试液):CO2+H2O==H2CO3(溶液变红)12、⽣⽯灰溶于⽔:CaO+H2O==Ca(OH)213、⽆⽔硫酸铜作⼲燥剂:CuSO4+5H2O==CuSO4·5H2O16、⽔在直流电的作⽤下分解:2H2O 2H2↑+O2↑17、碳酸不稳定⽽分解:H2CO3==H2O+CO2↑18、⾼温煅烧⽯灰⽯(⼆氧化碳⼯业制法):CaCO3 CaO+CO2↑19、铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu(湿法炼铜的反应原理)20、锌和稀硫酸反应(实验室制氢⽓):Zn+H2SO4==ZnSO4+H2↑21、镁和稀盐酸反应:Mg+2HCl==MgCl2+H2↑22、氢⽓还原氧化铜:H2+CuO Cu2Cu+CO2↑24、⽔蒸⽓通过灼热碳层:H2O+C H2+CO(⽔煤⽓)25、焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑26、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4(蓝⾊沉淀)27、甲烷在空⽓中燃烧:CH4+2O2 CO2+2H2O (蓝⾊⽕焰)28、酒精在空⽓中燃烧:C2H5OH+3O2 2CO2+3H2O31、⼆氧化碳通过澄清⽯灰⽔(检验⼆氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O(变浑浊)32、氢氧化钠和⼆氧化碳反应(除去⼆氧化碳):2NaOH+CO2==Na2CO3+H2O 有机物:甲烷CH4、⼄醇(俗名酒精)C2H5OH。
九年级常见化学用语和化学方程式

九年级常见化学用语和化学方程式五、课本中的化学方程式:第二单元:1、红磷在氧气中燃烧4 P + 5 O2 2 P2O52、碳在氧气中燃烧 C + O2CO23、硫在氧气中燃烧S + O2 SO24、铁在氧气中燃烧 3 Fe + 2 O2Fe3O45、铝在氧气中燃烧 4 Al + 3 O2 2 Al2O36、用过氧化氢制氧气 2 H2O2 2 H2O + O2↑7、用高锰酸钾制氧气2KMnO4K2MnO4+ MnO2+ O2↑8、用氯酸钾和二氧化锰的混合物制氧气 2 KClO3 2 KCl + 3 O2↑第三单元:9、水通电分解(电解水) 2 H2O 2 H2↑+ O2↑10、汞受热2Hg+O22HgO11、氧化汞受热分解2HgO2Hg+O2↑12、氢气在空气中燃烧 2 H2 + O2 2 H2O13、氢气还原氧化铜H2 + CuO Cu + H2O第四单元:第五单元:14、铁和硫酸铜溶液反应Fe + CuSO 4FeSO4 + Cu15、碳酸钠和盐酸反应Na 2CO3+2HCl2NaCl+H2O+CO2↑16、镁条在空气中燃烧 2 Mg + O2 2 MgO17、高温煅烧石灰石(二氧化碳的工业制法)CaCO3CaO + CO2↑第六单元:2 CO18、碳在氧气中不充分燃烧 2 C + O2 (不足)19、碳跟氧化铜反应 C + 2 CuO 2 Cu + CO2↑20、碳跟氧化铁反应 3 C + 2 Fe2O3 4 Fe + 3 CO2 ↑21、碳跟二氧化碳反应C+CO22CO+ 2HCl CaCl2 + CO2↑+ H2O22、实验室制取二氧化碳CaCO23、二氧化碳与水反应CO 2 + H2O H2CO324、碳酸分解H 2CO3CO2 ↑+ H2O25、二氧化碳与氢氧化钙溶液反应(二氧化碳的检验方法)CO 2 + Ca(OH)2CaCO3↓+ H2O26、一氧化碳燃烧 2 CO + O2 2 CO227、一氧化碳还原氧化铜CO +CuO Cu + CO228、一氧化碳还原氧化铁 3 CO +Fe2O3 2 Fe + 3 CO2第七单元:29、甲烷燃烧CH4 + 2 O2CO2 + 2 H2O30、酒精燃烧C2H5OH + 3 O2 2 CO2 + 3 H2O第八单元:31、镁和稀盐酸反应镁和稀硫酸反应Mg + 2 HCl MgCl+ H2↑Mg + H2SO4MgSO4 + H2↑32、锌和稀盐酸反应锌和稀硫酸反应(实验室制取氢气)Zn + 2 HCl ZnCl+ H2↑Zn + H2SO4ZnSO4 + H2↑33、铁和稀盐酸反应铁和稀硫酸反应+ H2↑Fe + H2SO4FeSO4 + H2↑Fe + 2 HCl FeCl34、铝和稀盐酸反应铝和稀硫酸反应+3H2↑2Al+ 3H2SO4Al2(SO4)3 +3 H2↑2Al+6HCl2AlCl35、铝和硫酸铜溶液反应 2 A l + 3 CuSO 4Al2(SO4)3 + 3CuCu(NO3)2 + 2 Ag36、铜和硝酸银溶液反应Cu + 2 AgNO第十单元:37、铁锈与稀盐酸反应铁锈与稀硫酸反应FeO3+6HCl2FeCl3+3H2O Fe2O3+3H2SO4Fe2(SO4)3+3H2O38、氧化铜与稀硫酸反应H2SO4+ CuO Cu SO4+ H2O39、氧化钙与水的反应CaO+HO Ca(OH)240、氢氧化钠溶液与二氧化碳反应2NaOH+CO 2Na2CO3+H2O41、二氧化硫与氢氧化钠溶液反应2NaOH+SO 2Na2SO3+H2O42、三氧化硫与氢氧化钠溶液反应2NaOH+SO 3Na2SO4+H2O43、氢氧化钠与盐酸反应氢氧化钠与硫酸反应NaOH+HCl NaCl+H 2O 2NaOH+H2SO4Na2SO4+H2O44、氢氧化钙与盐酸反应氢氧化钙与硫酸反应+2HCl CaCl2+2H2O Ca(OH)2+H2SO4CaSO4+2H2OCa(OH)第十一单元:45、碳酸氢钠与盐酸反应NaHCO 3+HCl NaCl+H2O+CO2↑CO3+Ca(OH)2CaCO3↓+2NaOH46、碳酸钠溶液与氢氧化钙溶液反应Na初中化学常见物质的颜色(后面是物质化学式或物质名称,前面是颜色)1. 常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
初中常见离子

初中常见离子
1.金属离子
金属离子是指在化学反应中失去一个或多个电子的金属原子形成的带正电荷的离子。
在化学反应中,金属原子通常会失去它们的外层电子,形成正离子。
比如,钠原子通常会失去一个电子,形成Na+离子;铝原子通常会失去三个电子,形成Al3+离子。
2.非金属离子
非金属离子是指在化学反应中获得一个或多个电子的非金属原子形成的带负电荷的离子。
在化学反应中,非金属原子通常会获得外层电子,形成负离子。
比如,氯原子通常会获得一个电子,形成Cl-离子;氧原子通常会获得两个电子,形成O2-离子。
3.酸性离子
酸性离子是指在溶液中具有酸性的离子。
比如,硫酸根离子SO4^2-、硫代硫酸根离子S2O3^2-等都是常见的酸性离子。
4.碱性离子
碱性离子是指在溶液中具有碱性的离子。
比如,氢氧根离子OH-、氧化铁根离子FeO4^2-等都是常见的碱性离子。
5.盐类离子
盐类离子是指在化学反应中形成的带正或负电荷的离子。
比如,氯化钠NaCl、硫酸钠Na2SO4等都是常见的盐类离子。
试卷题目:
1.请简要介绍金属离子和非金属离子的定义及例子。
2.请列举两种酸性离子和两种碱性离子的例子。
3.请用化学式表示氯化钠和硫酸钠的离子形式。
常见物质化学式及离子符号
碳酸钠
氨水
Al(OH)3 碳酸钙 NH3˙H2O 碳酸锌 硝酸银 硝酸钠
亚硝酸钠
氯化铵 硝酸铵 硫酸铵
碳酸氢铵
氯酸钾
硝酸钙
硝酸亚铁
Ca(NO3)2 高锰酸钾 KMnO4 Fe(NO3)2 锰酸钾 Fe(NO3)3 碳酸氢钠 NaHCO3
硝酸铁
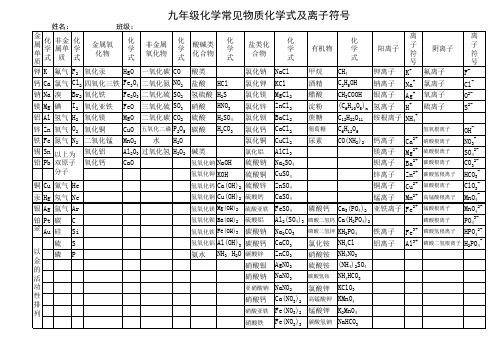
九年级化学常见物质化学式及离子符号
姓名: 金 属 单 质 钾 钙 钠 镁 铝 锌 铁 锡 铅 铜 汞 银 铂 金 氦气 氖气 氩气 碳 硅 硫 磷 非金 化 属单 学 质 式 氟气 氯气 溴 碘 氢气 氧气 氮气 金属氧 化物 氧化汞 四氧化三铁 氧化铁 氧化亚铁 氧化镁 氧化铜 二氧化锰 氧化铝 氧化钙 班级: 化 学 式 非金属 氧化物 一氧化碳 二氧化氮 二氧化硫 三氧化硫 二氧化碳
九年级化学常见物质化学式及离子符号
姓名: 金 属 单 质 钾 化 非金 化 学 属单 学 式 质 式 K 金属氧 化物 班级: 化 学 式 HgO 非金属 氧化物 化 学 式 酸碱类 化合物 酸类 盐酸 硝酸 硫酸 HCl HNO3 H2SO4 H2CO3 氢硫酸 H2S 化 学 式 盐类化 合物 氯化钠 氯化钾 氯化镁 氯化锌 氯化钡 氯化钙 氯化铜
五氧化二磷
化 学 式
酸碱类 化合物 酸类 盐酸 氢硫酸 硝酸 硫酸 碳酸 碱类
氢氧化钠 氢氧化钾 氢氧化钙 氢氧化铜 氢 氧 化 镁 氢 氧 化 钡 氢 氧 化 铁 氢氧化铝
化 学 式
盐类化 合物 氯化钠 氯化钾 氯化镁 氯化锌 氯化钡 氯化钙 氯化铜
氯化铝
化 学 式
有机物 甲烷 酒精 醋酸 淀粉 蔗糖
一氧化碳 CO
钙 Ca 氯气 Cl2 四氧化三铁 Fe3O4 二氧化氮 NO2 钠 Na 溴 镁 Mg 碘 Fe2O3 二氧化硫 SO2 FeO MgO CuO MnO2 CaO 三氧化硫 SO3 二氧化碳 CO2 水 H2O
初中化学常见离子表

初中化学常见离子表《初中化学常见离子表》同学们,今天咱们来好好聊聊化学式这个有趣的化学内容。
化学式就像是化学世界里的密码,它能告诉我们很多关于物质的信息呢。
咱们先来说说化学键,这个概念听起来有点复杂,但是咱们可以把它类比成原子之间的小钩子。
你看,原子们要组合在一起形成物质,就靠这些小钩子连接。
比如说离子键,这就像是带正电和带负电的原子像超强磁铁一样吸在一起。
就好比咱们生活中的小磁铁,正极和负极一下子就吸住了。
像氯化钠(NaCl),钠原子(Na)失去一个电子带正电,氯原子(Cl)得到这个电子带负电,然后它们就通过离子键紧紧地结合在一起了。
再说说共价键,这就是原子们共用小钩子连接起来的情况。
就像几个小伙伴一起分享玩具一样,原子们也会共用电子。
比如说氢气(H₂),两个氢原子各自拿出一个电子来共用,就像两个人牵着手,这样就形成了共价键。
化学平衡呢,就像一场拔河比赛。
反应物和生成物就像是两队人。
在反应开始的时候,反应物这边力量比较大,就像拔河比赛刚开始,一方人多力量大,就会把绳子往自己这边拉。
但是随着反应的进行,生成物那边也慢慢有了力量,到最后达到一种状态,就是正反应的速率和逆反应的速率相等了,就像拔河双方都拉不动绳子了,而且两边的人数(浓度)也不再变化了。
分子的极性也很有意思。
咱们可以把它想象成小磁针。
比如说水(H₂O)是极性分子,就像一个小磁针,氧原子那一端呢,就像磁针的南极,带负电,氢原子那一端就像北极,带正电。
而二氧化碳(CO₂)是直线对称的,它就像一个两边完全一样的东西,是非极性分子,就不存在像小磁针那样一端带正电一端带负电的情况。
还有配位化合物,这里面中心离子就像是聚会的主角,配体就像是提供孤对电子共享的小伙伴。
比如说在[Cu(NH₃)₄]²⁺这个配位离子中,铜离子(Cu²⁺)就是主角,氨分子(NH₃)就是那些带着孤对电子来和铜离子共享的小伙伴,大家凑在一起就形成了配位化合物。
初中常见的酸根离子(带化学式)_概述说明以及解释

初中常见的酸根离子(带化学式) 概述说明以及解释1. 引言1.1 概述酸根离子是化学中一种常见的离子形式,它是通过在酸分子中失去一个或多个质子而产生的带电粒子。
这些带负电荷的离子在溶液中起着重要的化学作用。
初中阶段,学生需要了解一些常见的酸根离子及其化学式,并理解它们在化学反应和实验中的应用。
1.2 目的本文旨在概述并解释一些初中阶段常见的酸根离子,包括硫酸根离子(SO4^2-)、氯根离子(Cl-)和亚硝酸根离子(NO2-)等。
我们将探讨它们的性质、存在形式以及对化学反应和实验结果的影响。
1.3 结构本文将分为五个部分进行讨论和说明。
首先是引言部分,在这里我们简要介绍了文章的背景和目标。
接下来是常见酸根离子一览部分,我们将逐个介绍硫酸根离子、氯根离子和亚硝酸根离子,并提供其化学式以及相关特点。
然后,我们将在解释与应用部分深入探讨这些酸根离子的性质、化学反应特点以及在实际应用中的应用场景。
随后是实验案例分析部分,我们将介绍酸根离子共存实验说明、酸根离子检测实验步骤与结果解读,并总结实验过程中可能遇到的问题以及相应的解决方案。
最后,在结论与展望部分,我们将总结常见酸根离子的特点和重要性,并对未来该领域研究的发展方向进行展望。
通过本文的阅读,读者将能够全面了解初中常见的酸根离子及其化学式,理解它们的特性、性质和应用,并为进一步学习和研究提供基础知识。
2. 常见酸根离子一览:2.1 硫酸根离子(SO4^2-):硫酸根离子是最常见的酸根离子之一,它由一个硫原子和四个氧原子组成。
在化学式中,硫酸根离子上有两个负电荷,这使得它具有很强的稳定性和反应活性。
硫酸根离子广泛存在于我们日常生活和工业生产中的许多物质中。
例如,硫酸根离子是硫酸的主要成分之一,而硫酸被广泛用于肥料、清洁剂、制药工业和冶金工业等领域。
此外,在环境中也可以找到硫酸根离子的存在,在自然界中产生的雨水或土壤中都可能含有硫酸根离子。
2.2 氯根离子(Cl-):氯根离子是指只含有一个氯原子的阴离子。
初中化学13对离子口诀

初中化学13对离子口诀常见元素的主要化合价:氟氯溴碘负一价;正一氢银与钾钠。
氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
有负二正四六;边记边用就会熟。
1、基本反应类型:化合反应:多变一分解反应:一变多置换反应:一单换一单复分解反应:互换离子2、常见元素的化合价(正价):一价钾钠氢与银,二价钙镁钡与锌,三价金属元素铝;一五七变价氯,二四五氮,硫四六,三五有磷,二四碳一二铜,二三铁,二四六七锰特别。
3、实验室制取氧气的步骤:“茶(查)、庄(装)、定、点、收、利(离)、息(熄)”“查”检查装置的气密性“装”盛装药品,连好装置“定”试管固定在铁架台“点”点燃酒精灯进行加热“收”收集气体“离”导管移离水面“熄”熄灭酒精灯,停止加热。
4、用CO还原氧化铜的实验步骤:“一通、二点、三灭、四停、五处理”:“一通”先通氢气,“二点”后点燃酒精灯进行加热;“三灭”实验完毕后,先熄灭酒精灯,“四停”等到室温时再停止通氢气;“五处理”处理尾气,防止CO污染环境。
5、电解水的实验现象:“氧正氢负,氧一氢二”:正极放出氧气,负极放出氢气;氧气与氢气的体积比为1:2。
6、组成地壳的元素:养闺女(氧、硅、铝)7、原子最外层与离子及化合价形成的关系:“失阳正,得阴负,值不变”:原子最外层失电子后形成阳离子,元素的化合价为正价;原子最外层得电子后形成阴离子,元素的化合价为负价;得或失电子数二电荷数二化合价数值。
&化学实验基本操作口诀:固体需匙或纸槽,一送二竖三弹弹;块固还是镊子好,一横二放三慢竖。
液体应盛细口瓶,手贴标签再倾倒。
读数要与切面平,仰视偏低俯视高。
滴管滴加捏胶头,垂直悬空不玷污,不平不倒不乱放,用完清洗莫忘记托盘天平须放平,游码旋螺针对中;左放物来右放码,镊子夹大后夹小;试纸测液先剪小,玻棒沾液测最好。
九年级化学的离子知识点

九年级化学的离子知识点离子是指带有正电荷或负电荷的原子或原子团。
在化学中,离子是物质起到重要作用的基本单位之一。
对于九年级化学学生来说,了解离子的性质和组成是十分关键的知识点。
本文将介绍九年级化学中的离子知识,包括离子的定义、离子的形成、离子的命名以及离子的化学性质等。
一、离子的定义离子是指原子或原子团失去或获得电子后带有正电荷或负电荷的化学粒子。
原子失去电子后变为正离子,称之为阳离子;原子获得电子后变为负离子,称之为阴离子。
离子的生成是由电离过程引起的。
电离过程是指物质在溶剂或高温等条件下,通过失去或获得电子而产生正负电荷的现象。
二、离子的形成离子的形成是通过原子失去或获得电子来完成的。
当一个原子失去一个或多个电子时,它将变为正离子。
以钠原子(Na)为例,它有一个外层电子,当它失去这个电子后,就成为单价阳离子Na+。
同样的道理,当一个原子获得一个或多个电子时,它将变为负离子。
以氯原子(Cl)为例,它缺少一个外层电子,当它获得一个电子后,就成为氯离子Cl-。
三、离子的命名离子的命名依据元素周期表和离子的绝对电荷来确定。
正离子的命名为:元素名称+ion(如钠离子为Na+),而负离子的命名为:元素名称+ide+ion(如氯离子为Cl-)。
需要注意的是,有些元素的离子命名会有特殊规定,如氢离子(H+)称为氢离子,氧离子(O2-)称为氧化物离子等。
四、离子的化学性质离子的化学性质在化学反应中起到重要作用。
离子能够在溶剂中产生电解质的作用,使得溶液具有导电性。
离子的电荷主要决定了其在溶液中的溶解度和反应性质。
比如,溶于水中的钠离子(Na+)和氯离子(Cl-)会形成盐类晶体纳盐,而这种纳盐能够在水中完全离解成钠离子和氯离子。
此外,离子还参与化学反应中的酸碱中和反应、还原反应以及络合反应等。
离子的性质和活动性能够通过溶液中的pH值、电导率以及溶解度等物理性质进行检测。
结论九年级化学中的离子知识点包括离子的定义、形成、命名和化学性质等。
(九年级化学教案)初三上册化学复习要点:常见的酸根或离子

常见的酸根或离子
九年级化学教案
so42-(硫酸根)、no3-(硝酸根)、co32-(碳酸根)、clo3-(氯酸)、
mno4-(高锰酸根)、mno42-(锰酸根)、po43-(磷酸根)、cl-(氯离子)、
hco3-(碳酸氢根)、hso4-(硫酸氢根)、hpo42-(磷酸氢根)、
h2po4-(磷酸二氢根)、oh-(氢氧根)、hs-(硫氢根)、s2-(硫离子)、
nh4+(铵根或铵离子)、k+(钾离子)、ca2+(钙离子)、na+(钠离子)、
mg2+(镁离子)、al3+(铝离子)、zn2+(锌离子)、fe2+(亚铁离子)、
fe3+(铁离子)、cu2+(铜离子)、ag+(银离子)、ba2+(钡离子)
各元素或原子团的化合价与上面离子的电荷数相对应:课本p80
一价钾钠氢和银,二价钙镁钡和锌;
一二铜汞二三铁,三价铝来四价硅。
(氧-2,氯化物中的氯为-1,氟-1,溴为-1)
(单质中,元素的化合价为0 ;在化合物里,各元素的化合价的代数和为0) 只要这样踏踏实实完成每天的计划和小目标,就可以自如地应对新学习,达到长远目标。
什么是离子它们对化学反应有什么影响

什么是离子它们对化学反应有什么影响什么是离子?它们对化学反应有什么影响离子是指在化学反应中带有电荷的原子、分子或者离子复合物。
它们的存在与性质对化学反应起着重要的影响。
离子的形成和转移是许多化学反应中的关键步骤,它们能够影响反应速率、方向性以及产物的性质。
本文将详细介绍离子的定义、分类和其在化学反应中的影响。
一、离子的定义和分类离子是带有电荷的原子、分子或者离子复合物。
电荷可以为正电荷(阳离子)或者负电荷(阴离子)。
离子的电荷来源于其成员的原子结构中的电子的净损失或者获得。
1. 阳离子:阳离子是带有正电荷的离子,其形成通常涉及原子净损失一个或多个电子。
例如,氢离子(H+)是最简单的阳离子,它失去了一个电子,成为单个质子。
金属离子也通常是阳离子,当金属原子失去一个或多个电子时形成。
2. 阴离子:阴离子是带有负电荷的离子,其形成涉及原子净获得一个或多个电子。
例如,氯离子(Cl-)是最常见的阴离子,因为氯原子接受了一个额外的电子而形成。
离子在溶液中能够以游离态存在,也可作为离子团或者离子束存在。
离子还可以组成离子化合物,如盐类、酸、碱等。
二、离子对化学反应的影响离子在化学反应中起着重要的作用。
它们能够影响反应速率、方向性和产物的性质。
1. 影响反应速率:离子在溶液中的动态行为使得它们更容易与其他物质发生反应。
由于带电性质,离子与反应物之间的吸引力和相互作用更强,从而促进了反应的进行。
例如,在氢氧化钠和盐酸的中和反应中,氢氧化钠中的氢氧根离子和盐酸中的氯离子会迅速结合形成水和盐。
离子的存在加速了反应的进行。
2. 影响反应方向性:离子可以影响反应的方向性,尤其是在酸碱反应和沉淀反应中。
在酸碱中和反应中,阳离子和阴离子的组合会形成中性物质,并推动反应向前进行。
例如,氢氧根离子与氧气结合形成氢氧化物,促进了碱的性质。
在沉淀反应中,离子的结合形成沉淀固体,会导致反应向前进行。
3. 影响产物性质:离子的存在会影响产物的性质。
初中离子知识点总结

初中离子知识点总结初中离子知识点总结「篇一」Cl—(在溶液中)———在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
SO42—(在溶液中)———在被测溶液中加入氯化钡(或硝酸钡、或氢氧化钡)溶液,如果生成不溶于硝酸(或盐酸)的白色沉淀,则原被测液中含硫酸根离子。
CO32—:(1)(固体或溶液)———在被测物质中加入稀酸溶液,如果产生能使澄清石灰水变浑浊的气体,则原被测物质中含碳酸根离子。
(2)(在溶液中)———在被测溶液中加入氯化钡或硝酸银溶液,如果产生能溶于硝酸的白色沉淀,且同时生成能使澄清的石灰水变浑浊的气体,则原被测溶液中含碳酸根离子。
注1、在鉴别Cl—和SO42—时,用氯化钡溶液,不要用硝酸银溶液,这是因为硫酸银为微溶性物质,使鉴别现象不明显;2、在一未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含银离子也可能含硫酸根离子。
化学的学习方法及技巧勤于预习、善于听课做笔记。
要想学好化学,必须先了解这门课程。
课前一定要预习,在预习时,除了要把新课内容仔细读一遍外,还应在不懂处作上记号,并试着做一做课本上的练习。
这样带着疑问、难点,听课的效率就会大大地提高。
初中化学内容比较多,知识比较零散,老师在讲课时,着重围绕重点内容进行讲授。
因此大家要仔细听课?认真做笔记,这不仅有利于进行课后复习,掌握重点,而且还可以有效地预防上课时“走神”。
不过在记笔记时,要在听清楚老师所讲内容的基础上,记重点、难点、疑点和课本上没有的内容。
逐渐的培养对化学的兴趣学习任何一门学科,兴趣都是必不可少的。
所以,为了高效地学习化学,学生要努力培养对化学的“好感”。
首先,对化学课堂中的.实验课,一定要认真看、认真学习,课下勤于思考,可以自己动手做一些家庭小实验,还可以主动搜集一些与课本相关的化学小故事,通过这些方式逐渐建立起对化学的兴趣。
例如,在学习人教版九年级上册化学第四单元《水的净化》这部分内容时,课本中涉及了一个自制简易净水器的小实验,学生完全可以在家制作这个小装置:找一个空饮料瓶,瓶口用一个单孔胶塞塞住,然后将瓶子倒立过来,瓶子里放一些纱布、活性炭等,制作好后测试它的净化效果。
