九年级化学离子.ppt
合集下载
人教版九年级化学上册《离子(1)》课件.pptx

二、离子的形成
1.离子的概念:带电荷的原子。 2.阴离子、阳离子。 3.离子符号的书写。
【能力提高】
某离子带3个单位的正电荷,质子数为13, 该离子的核外电子数为_____1,0 该离子的 名称是_____铝_,离符子号是____,Al该3+ 离子的 结构示意图是:
+13 2 8
Mg2+ 符号的含义: 镁离子
Na
Mg
S
Cl
+11 2 8 1
+12 2 8 2
+16 2 8 6
+17 2 8 7
原子:核电荷数=核外电子数
Na+ +11 2 8
Mg2+ +12 2 8
S2- +16 2 8 8
Cl- +17 2 8 8
离子:核电荷数≠核外电子数
阳离子
阴离子
空白演示
在此输入您的封面副标题
非金属 一般等于或多 元素 于4个
易得到电子而达稳定结构
稀有气 体元素
8个(氦为2个) 不易失去也不易得到电子
元素的化学性质与有密切关系。 结构 决定 性质
二、离子的形成
1.离子的概念:带电荷的原子叫做离子。 2.离子的表示方法:离子符号
阴离子:带负电荷的原子。如: Cl-
阳离子:带正电荷的原子。 如: Na+
第二电子层
下面是1—18号元素的原子结构示意图, 从中你可以获取哪些信息,发现电子排布
的哪些规律?
1.第一层最多有2个电子,第二 层最多有8个电子,最外层最多 有8个电子。2.按序排满。
氩原子结构示意图
氪原子结构示意图
+36 2 8 18 8
+54 2 8 18 18 8
1.离子的概念:带电荷的原子。 2.阴离子、阳离子。 3.离子符号的书写。
【能力提高】
某离子带3个单位的正电荷,质子数为13, 该离子的核外电子数为_____1,0 该离子的 名称是_____铝_,离符子号是____,Al该3+ 离子的 结构示意图是:
+13 2 8
Mg2+ 符号的含义: 镁离子
Na
Mg
S
Cl
+11 2 8 1
+12 2 8 2
+16 2 8 6
+17 2 8 7
原子:核电荷数=核外电子数
Na+ +11 2 8
Mg2+ +12 2 8
S2- +16 2 8 8
Cl- +17 2 8 8
离子:核电荷数≠核外电子数
阳离子
阴离子
空白演示
在此输入您的封面副标题
非金属 一般等于或多 元素 于4个
易得到电子而达稳定结构
稀有气 体元素
8个(氦为2个) 不易失去也不易得到电子
元素的化学性质与有密切关系。 结构 决定 性质
二、离子的形成
1.离子的概念:带电荷的原子叫做离子。 2.离子的表示方法:离子符号
阴离子:带负电荷的原子。如: Cl-
阳离子:带正电荷的原子。 如: Na+
第二电子层
下面是1—18号元素的原子结构示意图, 从中你可以获取哪些信息,发现电子排布
的哪些规律?
1.第一层最多有2个电子,第二 层最多有8个电子,最外层最多 有8个电子。2.按序排满。
氩原子结构示意图
氪原子结构示意图
+36 2 8 18 8
+54 2 8 18 18 8
3.1构成物质的基本微粒第4课时离子同步PPT九年级化学沪教版上册精品课件

281 282 283 284 285 286 287 288 1混2合.+配气1制1体0.的1m摩o尔l•L质﹣+量1的1为2N:aMO(H溶混液),=+下=1=列33操4.9作g会/m导ol,致所+配1的4溶液浓度偏+高1的5是
+16
+17
+18
D. 化学反应的限度不可以通过改变条件而改变
Na Mg Al Si P S Cl Ar 故答案为:2:1;1:1;30.4%;
分子(如O2、H2、H2O)、 原子(如汞、金刚石等)、 离子(氯化钠:Cl-、Na+等) 构成的。
宏观描述
微观描述
分子
元素
组成物质成构构成构成原分成子构成
原子核构成中子 质子
得 失 核外电子
失
成电
得 电
构 子 子分成 阴离子
离子 阳离子
反思悟学:离子的形成
1、定义:带电的原子(或原子团)叫做离子。 2、离子的分类: (1)阳离子:带正电的离子叫阳离子 (2)阴离子:带负电的离子叫阴离子 3、离子符号的意义: 1)表示一个某离子
红磷温度没有达到着火点,可得出燃烧需要与氧气接触,且温度达到着火点;图示烧杯中的蜡烛一段时间后熄灭,放在空气中的蜡烛正常燃
Na+ 烧,说明燃烧需要氧气。
25 g×16% x (3)H2O、Na+、Cl-、OH-
Cl-
NaCl
钠与氯气反应
氯化钠由___氯___离____子___和___钠离子
构成.
+12
检测促学
• 写出下列符号。
• 1、钠离子 2、氯离子 4、硫离子 5、铵根离子
• 答:1、 Na+ ;
人教版九年级化学课件:3.2 原子的结构——离子 (共17张PPT)

• 3 、一种原子与另一种原子的根本区别是
•
( A
、C相对)原子质量不同
B 、中子数不同
• C 、核电荷数不同 D 、电子数不同
• 4、在分子、原子、原子核、质子、中子、电子、 离子等微粒中,找出符合下列条件的微粒,填 在相应的横线上:
• (1)能直接构成物质的是_分_子_、_原_子_、离_子_.
联系
1.都很小;2.都不停地运动;3.微粒间都有
一定的间隔;4.都能直接构成物质
分裂
失去或得到电子
分子
结合
原子
离子
得到或失去电子
敞口放置食盐。氯化钠是由钠离子和氯离子相互
作用而构成的,试推测氯化钙是由什么构成的, 氯化镁由什么构成的? 钙离子和氯离子
镁离子和氯离子
总结三者区别与关系
分子
原子
离子
构成 主要 区别
由原子构成
在化学变 化中可分
由质子、中子、由原子得失 核外电子构成 电子构成
在化学变化 带电的微粒 中不可分
相同 处
静电作用
+17 2 8 8
NaCl
氯离子Cl-
形成离子的目的是 最外层达到8(He 为2)电子稳定结构
物质(离子构成)
• 1、“手和脑在一块干是创造教育的开始,手脑双全是创造教育的目的。” • 2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 • 3、反思自我时展示了勇气,自我反思是一切思想的源泉。 • 4、好的教师是让学生发现真理,而不只是传授知识。 • 5、数学教学要“淡化形式,注重实质.
6、“教学的艺术不在于传授本领,而在于激励、唤醒、鼓舞”。2021年11月上午7时52分21.11.1607:52November 16, 2021
2024年人教版九年级化学上册〈离子〉课件-优课件

绩 ,
joy!
八 分
方
法
。
愿
全
天
下
所
有
父
母
我们,还在路上……
下列金属元素的原子要怎样才能达到稳定结构?
失去2个电子
金属元素的原子 一般通过失去最外层电子, 使次外层成为最外层, 来达到稳定结构
下列非金属元素的原子要怎样才能达到稳定结构?
非金属元素的原子, 一般通过最外层得到电子 来达到稳定结构
元素分类 原子的
最外层电子数
稀有气体 元素
8个(He为2个)
2.元素周期表是学习和研究化学的重要工具,它的内容十分丰富。 下表是依据元素周期表画出的1~18号元素的原子结构示意图。 请对它进行研究:
(1)上图中硫元素的核电荷数z=__1_6__;氯元素的原子最外层 电子数y=___7__,与氯元素化学性质最相似的元素是_氟____。
(2)上图的元素排列具有一定的规律: ①同一纵行中各元素的原子在结构上的相同点是最__外_层__电_子数相_同_,
3、1911年,卢瑟福(是汤姆生的学生) 在有核模型的基础上,提出原子轨道
提出有核原子模型(或叫原子太阳系模 模型,认为当原子只有一个电子时,
型),认为原子的质量几乎全部集中在 电子沿特定球形轨道运行;当原子有
直径很小的核心区域,叫原子核,电子 多个电子时,电子将分层排布,在不
绕着原子核的中心运动,就像太阳系的 同的轨道上运行,按能量高低而距核
行星绕着太阳运行一样。
远近不同。
原子结构示意图 各部分的含义
表示电子层 表示原子核
+M a b c
表示核电荷数 或核内质子数
核外电子分层排布示意图
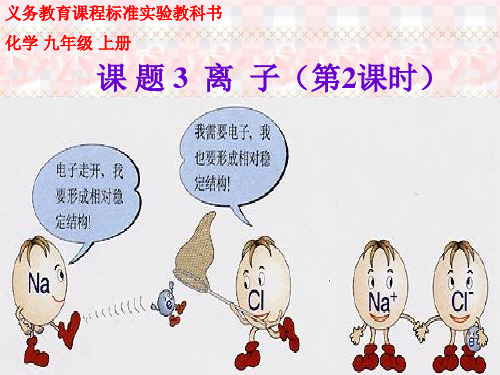
九年级化学《离子(2)》课件

(2)由分子构成的物质:如:氢气(qīnɡ 、 qì) 氧气、水、二氧化碳等
(3)由离子构成的物质:含有金属元素的
化合物。如:NaCl
Na+
第八页,共十八页。
Cl-
1.构成(gòuchéng)物质的粒子分有子 原、子 离和子
。
如:
五氧化二磷由 五氧化二磷分子(fēn构zǐ) 成,
金由
金原子构成, (yuánzǐ)
Na
Cl
+11 2 81
+17 2 87
Na+
+11 2 8
阳离子
NaCl
Na+ Cl -
第三页,共十八页。
阴离子
Cl -
+17 28 8
二、离子(lízǐ)的形成
+11 2 8 1 失去1个电子
+11 2 8
钠原子 (Na)
原子核 (yuánzǐ)
质子数
中子数
相对原子质量
元素种类
电子层数 最外层电子数 粒子化学性质
举例 物质,元素(yuán sù),原子,离子,分子 间的关系图。 (jǔ
lì)
结合
单 同种元
质 素组成
原
铁,铝等
化 不同种元 合 物 素组成
元 具有相同核电荷
素
数的一类原子
结合 分 聚集 水
子
氢气
破裂
子
等
得失 离 结合
子
氯化纳等
电子
二氧化碳是由碳原子和氧原子构成。
第十一页,共十八页。
1、二氧化碳 由 (èr yǎng氧(yhuuá元àn stù素à)n)(yuán sù)、碳元素
人教九年级化学生活中常见的盐常见离子的检验PPTppt文档

(1)实验操作A的名称是 ——过—滤—,该操作的目的是—除—去—难—溶—性—杂—质
(2)写出步骤③中发生反应的主要化学方程式 ————M—gC—l2+—2N—a—OH—═—M—g(—O—H—)—2↓—+2—NaCl
步骤⑥的作用是__除__去__过__量__的__氢__氧__化_ 钠和碳酸钠
• (3)小刚同学认为该方案实际得到的氯化钠 可能比粗盐中含有的氯化钠要多,请你为他找 出理由: _因__为_在__实_验__过_程__中_有__氯_化__钠_生__成__.
如:NaOH+NH4Cl= H2O+NaCl+ NH3 ↑
5、H+检验:
(1)PH试纸 (2)紫色石蕊 (3)活泼金属Mg、Zn (4)金属氧化物CuO Fe2O3
(5)碳酸盐:Na2CO3 CaCO3
6、OH_检验 (1)PH试纸 (2)石蕊、酚酞 (3)CO2检验Ca(OH)2
(4)盐Cu2+ Mg2+ Fe3+ Al3+ 等 (5)NH4+
⑵由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质, 不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外, 它还有一个作用是_B_a_C_l2_+__N_a_2C_O_3_=__B_aC_O__3↓__+_2_NaCl (用化学方程式表示)。 ②通过操作Ⅲ所得滤液中的溶质有 N_a_2C__O_3_、_ _N_a_C_l_、__N_a_O_H (用化学式表示)。
称量精盐并计算产率。
(4 )操作④中,当观察到 出现较多固体
时,停止加热。
实验二:用提纯得到的精盐配制了 50 g 5%的氯化钠溶液。
(2)写出步骤③中发生反应的主要化学方程式 ————M—gC—l2+—2N—a—OH—═—M—g(—O—H—)—2↓—+2—NaCl
步骤⑥的作用是__除__去__过__量__的__氢__氧__化_ 钠和碳酸钠
• (3)小刚同学认为该方案实际得到的氯化钠 可能比粗盐中含有的氯化钠要多,请你为他找 出理由: _因__为_在__实_验__过_程__中_有__氯_化__钠_生__成__.
如:NaOH+NH4Cl= H2O+NaCl+ NH3 ↑
5、H+检验:
(1)PH试纸 (2)紫色石蕊 (3)活泼金属Mg、Zn (4)金属氧化物CuO Fe2O3
(5)碳酸盐:Na2CO3 CaCO3
6、OH_检验 (1)PH试纸 (2)石蕊、酚酞 (3)CO2检验Ca(OH)2
(4)盐Cu2+ Mg2+ Fe3+ Al3+ 等 (5)NH4+
⑵由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质, 不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外, 它还有一个作用是_B_a_C_l2_+__N_a_2C_O_3_=__B_aC_O__3↓__+_2_NaCl (用化学方程式表示)。 ②通过操作Ⅲ所得滤液中的溶质有 N_a_2C__O_3_、_ _N_a_C_l_、__N_a_O_H (用化学式表示)。
称量精盐并计算产率。
(4 )操作④中,当观察到 出现较多固体
时,停止加热。
实验二:用提纯得到的精盐配制了 50 g 5%的氯化钠溶液。
3.2原子结构(第2课时原子核外电子的排布离子)课件九年级化学人教版(2024)上册

硫离子 得2个电子,
带负电
氯离子 得1个电子,
带负电
探究新知
书写
1.右上角“+” “-”表电性; 2.有数字的, 数字在前,正 负号在后; 3.若只带1个 单位电荷,“1” 省略不写。
Mg2+ 2 Cl-
一个镁离子 数字“2” 表示每个镁离子带2个 单位的正电荷。
一两个氯离子 表示每个氯离子带1个单位的负 电荷。
电子层 一 二 三 四 五 六 七
离核远近: 近
远
能量高低: 低
高
离核近的电子能量较低, 离核越远,电子的能量越高。
探究新知
➢ 核外电子运动经常出现的区域叫电子层。 ➢ 核外电子运动的特点:分层、无规则、高速。
电子在不同的区域内运动的现象叫做核外电子的分层 排布。如何形象地把核外电子排布情况表述出来呢?
1个
3个
Cl +17 2 8 7 ①
Cl +17 2 8 7 ②
Cl +17 2 8 7 ③
探究新知
Na +11 2 8 1
失去 1个电子
Na+ +11 2 8
Cl +17 2 8 7
得到 1个电子
Cl- +17 2 8 8
Na+ Cl-
课题活动
学以致用
Mg +12 2 8 2
失去 2个电子
Mg2+ +12 2 8
探究新知
元素最外层电子数与原子性质的关系
最外层电子数一般小于4; 最外层电子数为8(He为2);
化学反应中易失电子。
相对稳定。
探究新知
元素最外层电子数与原子性质的关系
最外层电子数一般大于4; 化学反应中易得电子。
常见的离子符号,化学式[优质PPT]
![常见的离子符号,化学式[优质PPT]](https://img.taocdn.com/s3/m/10046b52dd36a32d7275812a.png)
常见的离子符号
氢离子、钠离子、钾离子、镁离子、钙离子、铝离子 H+Na+K+Mg2+Ca2+Al3+ 铁离子.亚铁离子.氯离子.氧离子.硫离子.
Fe3+、Fe2+Cl-、O2-、S2-、 钡离子铜离子银离子锌离子碳酸根离子
Ba2+Cu2+Ag+Zn2+CO32-
氢氧根离子硫酸根离子、硝酸根离子铵根离子 OH-SO42-、NO3-、NH4+
2.酸: 盐酸HCl 硫酸 H2SO4 硝酸 HNO3 碳酸 H2CO3 亚硫酸 H2SO3 醋酸 CH3COOH 3.碱
氢氧化钠 氢氧化钙 氢氧化铜 氢氧化铁
NaOH Ca(OH)2 Cu(OH)2
Fe(OH)3
氢氧化钾 氢氧化钡 氢氧化镁
KOH
Ba(OH)2
Mg(OH)2
4.盐
a.ቤተ መጻሕፍቲ ባይዱ酸盐
硫酸亚铁 硫酸铁 硫酸铝 硫酸钾 硫酸铵
FeSO4 Fe2(SO4)3 Al2(SO4)3 K2SO4 (NH4)2SO4 硫酸钠 硫酸锌 硫酸镁 硫酸铜 硫酸钡 Na2SO4 ZnSO4 MgSO4 CuSO4 BaSO4
b.盐酸盐(氯化物)
氯化钾 氯化钠 氯化镁 氯化银 氯化铜
KCl NaCl MgCl2 AgCl
CuCl2
氯化钙 氯化锌 氯化铁 氯化钡 氯化亚 铁
常见物质的化学式
一.单质 1.金属单质: 钾 K 钙 Ca 钠 Na 镁 Mg 铝Al 锌 Zn 铁Fe 锡 Sn
铅 Pb 铜 Cu 汞Hg 银 Ag 铂 Pt 金Au 2、稀有气体:氦气 He 氖气 Ne 氩气Ar 3、固态非金属单质: 碳 C 硅 Si 硫 S 磷
氢离子、钠离子、钾离子、镁离子、钙离子、铝离子 H+Na+K+Mg2+Ca2+Al3+ 铁离子.亚铁离子.氯离子.氧离子.硫离子.
Fe3+、Fe2+Cl-、O2-、S2-、 钡离子铜离子银离子锌离子碳酸根离子
Ba2+Cu2+Ag+Zn2+CO32-
氢氧根离子硫酸根离子、硝酸根离子铵根离子 OH-SO42-、NO3-、NH4+
2.酸: 盐酸HCl 硫酸 H2SO4 硝酸 HNO3 碳酸 H2CO3 亚硫酸 H2SO3 醋酸 CH3COOH 3.碱
氢氧化钠 氢氧化钙 氢氧化铜 氢氧化铁
NaOH Ca(OH)2 Cu(OH)2
Fe(OH)3
氢氧化钾 氢氧化钡 氢氧化镁
KOH
Ba(OH)2
Mg(OH)2
4.盐
a.ቤተ መጻሕፍቲ ባይዱ酸盐
硫酸亚铁 硫酸铁 硫酸铝 硫酸钾 硫酸铵
FeSO4 Fe2(SO4)3 Al2(SO4)3 K2SO4 (NH4)2SO4 硫酸钠 硫酸锌 硫酸镁 硫酸铜 硫酸钡 Na2SO4 ZnSO4 MgSO4 CuSO4 BaSO4
b.盐酸盐(氯化物)
氯化钾 氯化钠 氯化镁 氯化银 氯化铜
KCl NaCl MgCl2 AgCl
CuCl2
氯化钙 氯化锌 氯化铁 氯化钡 氯化亚 铁
常见物质的化学式
一.单质 1.金属单质: 钾 K 钙 Ca 钠 Na 镁 Mg 铝Al 锌 Zn 铁Fe 锡 Sn
铅 Pb 铜 Cu 汞Hg 银 Ag 铂 Pt 金Au 2、稀有气体:氦气 He 氖气 Ne 氩气Ar 3、固态非金属单质: 碳 C 硅 Si 硫 S 磷
《九年级化学离子》课件

氧离子(O2-)
氧离子是负离子,它是氧原子获 得两个电子形成的。
硫离子(S2-)
硫离子是负离子,它是硫原子获 得两个电子形成的。
离子的化合物命名示例
1
硫酸(H2SO4)
2
两个氢离子和一个硫酸根离子结合而成。
3
氯化钠(NaCl)
一个氯离子和一个钠离子结合而成。
碳酸钙(CaCO3)
一个钙离子和一个碳酸根离子结合而成。
《九年级化学离子》PPT 课件
欢迎来到《九年级化学离子》的PPT课件!本课程将带您深入了解离子的定义、 命名规则以及化合物的命名示例。还将介绍离子合成反应和离子溶解反应。 让我们一起开始学习吧!
离子的定义
离子是具有正电荷和负电荷的原子或分子,它们形成了高度稳定的化学结构。 正离子带有正电荷,而负离子带有负电荷。
离子名的命名规则
离子名的命名规则基于元素的化学符号以及其带电状态。例如,钠离子的化学符号是Na+,氯离示例
氢离子(H+)
常用名称:质子
铵离子(NH4+)
常用名称:铵
铵离子(NH4+)
常用名称:铵
铵离子(NH4+)
常用名称:铵
负离子的命名示例
氯离子(Cl-)
氯离子是负离子,它是氯原子获 得电子形成的。
离子合成反应的简介
离子合成反应是通过离子之间的化学反应来生成新的化合物。这些反应通常涉及正离子和负离子之间的结合。
离子溶解反应的简介
离子溶解反应是指离子化合物在溶液中分解成离子。这些反应是通过离子与 水分子之间的相互作用来进行的。
人教版初中化学九年级上册《课题3离子:离子的形成》说课设计PPT
表示方法 联 系 相互转化 关系
第四单元课题3 离子
(三)联想反思、形成体系
单质
同种元 素组成
结合
金刚石、 汞等 氧气、 氢气、 水等 氯化钠 等
元素
具有相同核 电荷数的一 子 类原子
原
结合
分解
分子 聚集
化合物 不同种
元素组 成
得到或 失去电子
离子
结合
宏观组成 只讲种类,不讲个数。
微观构成 既讲种类,又讲个数。
第四单元课题3 离子
一、教 材 分 析
1、教材的地位、特点与作用 2、教学目标
(1)知识与技能目标:要求学生在了解原子最外层电子数与 元素化学性质的关系的基础上进一步了解离子形成的过程,认 识离子也是构成物质的一种微粒。从而培养学生从微观的角度 探究宏观物质变化的能力。 (2)方法与过程目标:要求学生学会“猜想交流、探究新知” 的学习方式。能在创设情景下,积极主动的从事各种化学活动 且探究新知,经历知识形成的全过程。 (3)情感与态度目标:通过创设情景,激发学生对微观世界 的学习兴趣,培养学生积极探索、勇于探究的学习精神;唤起 对科学的好奇与向往。初步体会物质构成的奥秘,树立“结构 决定性质”“物质的微粒性”等辨证唯物主义观点。
第四单元课题3 离子
二、教 法 学 法
1、学 情 分 析
2、教 法
依据新的教育理念我认真分析本课 教材特点和学生认知情况后,本着体现新 的教育方向和最大限度地完成教学目标的 原则,我对本课教学的采取了如下方法: 利用课件优势,充分展示NaCl的形成过 程,了解离子形成 的过程,认识离子也 是构成物质的一种微粒。
第四单元课题3 离子
二、教 法 学 法
1、学 情 分 析
九年级化学-离子反应课件

一、几组概念
课 堂 小 结
二、离子方程式的书写
三、离子共存
三、离子共存
凡是能发生反应的离子之间或在水溶液中 水解相互促进的离子之间不能大量共存(注意 不是完全不能共存,而是不能大量共存)离子 不能共存有如下几种情况:
1、由于发生复分解反应,离子不能大量共存
(1)有气体产生。 • 如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不 能大量共存。 (2)有沉淀生成。 • ①如Ba2+、Ca2+、Mg2+、Ag+等不能与SO32-、SO42- -、 CO32-等大量共存; • ②Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存; • ③Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。 (3)有弱电解质生成。 • ①如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、 CN-、C17H35COO-、 C6H5O-、等与 H+ 不能大量共存; • ② 一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4 -、HSO3-不能与OH大量共存;③NH4+与OH-不能大量共存; • ③ 弱碱的简单阳离子(比如:Cu2+、Al3+、Fe3+、Fe2+、Mg2+等等)不能 与OH-大量共存
• 2.铜片插入硝酸银溶液: Cu + Ag+ = Cu2+ + Ag • 3.碳酸钙加入醋酸溶液中:
CO32- + 2CH3COOH = CO2↑+ 2CH3COO- +H2O
九年级化学上册 第四单元《离子》课件

课题 3 离子 (kètí)
第一页,共十七页。
核外电子(héwài diàn zǐ)分层排布示 意图
第二页,共十七页。
一、核外电子 的排布 (hé wài diàn zǐ)
1、核外电子(hé wài diàn zǐ)是分层排布的
电子层:1 2 3 4 5 6 7
离 核:近
远
能 量:低
高
能量低的在离核近的区域运动.
No 原子叫阴离子。(1)书写在元素符号的右上角标明离子所带的电荷。(数字在前,符号在后)。如NaCl、MgO、NaF
等
Image
12/10/2021
第十七页,共十七页。
非金属元 一般多于等于 易得电子,形成 不稳定
素
4个
阴离子
决定元素化学性质的是:最外层(wài 电子 cénɡ) 数
第七页,共十七页。
相对(xiāngduì)稳定结构:最外层有8个电子 (第一层为最外层有2个电子)的结构 稀有气体元素的原子最外层达到稳定结构(jiégòu), 性质稳定。
金属元素的原子(yuánzǐ)的最外层电子数一般少于4
点燃(化
qì)
钠与氯气反应(fǎnyìng)形成氯化钠
由原子变成离子或由离子变成原子的变化是化学变化
第十四页,共十七页。
离子与原子的区别(qūbié)和联系
第十五页,共十七页。
物质(wùzhì)与其构成粒子间的关系
第十六页,共十七页。
内容(nèiróng)总结
课题3 离子。课题3 离子。最外层最多容纳8个电子。(2)排布时能量低离核近,能量高离核远。质子数(核 电荷数)。3、元素性质与元素最外层电子数的关系。8个(He为2个)。稀有气体元素的原子最外层达到稳定结构,性 质稳定。1、离子:带电(dài diàn)的原子或原子团叫离子。阳离子:带正电荷的原子叫阳离子。阴离子:带负电荷的
第一页,共十七页。
核外电子(héwài diàn zǐ)分层排布示 意图
第二页,共十七页。
一、核外电子 的排布 (hé wài diàn zǐ)
1、核外电子(hé wài diàn zǐ)是分层排布的
电子层:1 2 3 4 5 6 7
离 核:近
远
能 量:低
高
能量低的在离核近的区域运动.
No 原子叫阴离子。(1)书写在元素符号的右上角标明离子所带的电荷。(数字在前,符号在后)。如NaCl、MgO、NaF
等
Image
12/10/2021
第十七页,共十七页。
非金属元 一般多于等于 易得电子,形成 不稳定
素
4个
阴离子
决定元素化学性质的是:最外层(wài 电子 cénɡ) 数
第七页,共十七页。
相对(xiāngduì)稳定结构:最外层有8个电子 (第一层为最外层有2个电子)的结构 稀有气体元素的原子最外层达到稳定结构(jiégòu), 性质稳定。
金属元素的原子(yuánzǐ)的最外层电子数一般少于4
点燃(化
qì)
钠与氯气反应(fǎnyìng)形成氯化钠
由原子变成离子或由离子变成原子的变化是化学变化
第十四页,共十七页。
离子与原子的区别(qūbié)和联系
第十五页,共十七页。
物质(wùzhì)与其构成粒子间的关系
第十六页,共十七页。
内容(nèiróng)总结
课题3 离子。课题3 离子。最外层最多容纳8个电子。(2)排布时能量低离核近,能量高离核远。质子数(核 电荷数)。3、元素性质与元素最外层电子数的关系。8个(He为2个)。稀有气体元素的原子最外层达到稳定结构,性 质稳定。1、离子:带电(dài diàn)的原子或原子团叫离子。阳离子:带正电荷的原子叫阳离子。阴离子:带负电荷的
2.3构成物质的微粒(Ⅱ)——原子和离子PPT九年级化学科粤版上册精品课件

作为标准,把其他原子的质量跟这个标准相比较所得到 的比值,叫做这种原子的相对原子质量。相对原子质量 是通过比较得出的比值,单位为“1”。
一个原子的质量 2.公式:相对原子质量=(一个C-12原子的质量)×112。
原子中质子和中子的质量接近一个 C-12 原子质量的 112,而电子的质量约为质子质量的1 8136,可 以 忽 略 不 计,所以原子的质量集中在原子核上,即相对原子质
量≈质子数+中子数。(例如钠原子的相对原子质量为 23=11+12)
【易错提示】 相对原子质量不是原子的实际质量,它只是一个比
值,在国际单位制中的单位为“1”,通常省略不写。
四、原子核外电子的排布 在含有多个电子的原子里,核外电子具有不同的运动
状态,离核近的电子能量较低,离核越远,电子的能量越 高。离核最近的电子层为第一层,次之为第二层,依次类 推为三、四、五、六、七层,离核最远的也叫最外层。核 外电子的这种分层运动又叫做分层排布。
七、离子
1. 概念:带电的原子或原子团叫作离子。
2. 分类:带正电荷的原子或原子团叫作阳离子;带负电 (63)硫酸钠溶液和硝酸钡溶液:Na2SO4+Ba(NO3)2 BaSO4↓+2NaNO3(生成不溶于稀硝酸的白色沉淀;其他可溶性硫酸盐与硝酸钡溶液也
有类似反应,可用于检验硫酸根离子)
(2)G 氢气不易溶于水且不与水发生反应(或F 氢气的密度比空气的小且不与空气的成分发生反应)
为8(He为2),不易得失电子。 (2)降低温度到可燃物的着火点以下
(72)绿色植物的光合作用:6CO2+6H2O C6H12O6+6O2
(2)①SO2+H2O H2SO3 ②2H2SO3+O2 2H2SO4
一个原子的质量 2.公式:相对原子质量=(一个C-12原子的质量)×112。
原子中质子和中子的质量接近一个 C-12 原子质量的 112,而电子的质量约为质子质量的1 8136,可 以 忽 略 不 计,所以原子的质量集中在原子核上,即相对原子质
量≈质子数+中子数。(例如钠原子的相对原子质量为 23=11+12)
【易错提示】 相对原子质量不是原子的实际质量,它只是一个比
值,在国际单位制中的单位为“1”,通常省略不写。
四、原子核外电子的排布 在含有多个电子的原子里,核外电子具有不同的运动
状态,离核近的电子能量较低,离核越远,电子的能量越 高。离核最近的电子层为第一层,次之为第二层,依次类 推为三、四、五、六、七层,离核最远的也叫最外层。核 外电子的这种分层运动又叫做分层排布。
七、离子
1. 概念:带电的原子或原子团叫作离子。
2. 分类:带正电荷的原子或原子团叫作阳离子;带负电 (63)硫酸钠溶液和硝酸钡溶液:Na2SO4+Ba(NO3)2 BaSO4↓+2NaNO3(生成不溶于稀硝酸的白色沉淀;其他可溶性硫酸盐与硝酸钡溶液也
有类似反应,可用于检验硫酸根离子)
(2)G 氢气不易溶于水且不与水发生反应(或F 氢气的密度比空气的小且不与空气的成分发生反应)
为8(He为2),不易得失电子。 (2)降低温度到可燃物的着火点以下
(72)绿色植物的光合作用:6CO2+6H2O C6H12O6+6O2
(2)①SO2+H2O H2SO3 ②2H2SO3+O2 2H2SO4
沪教版九年级化学全册(全国版)《离子》课件(共27张PPT)

表示2个镁离子
练习:说出下符号的意义
一个硫离子
S2- 一个硫离子带了2个负电荷 3S2- 表示3个硫离子
练习:下列离子符号的意义
Na+
Mg2+
3Al3+
O2-
F-
3Ca2+
原子中: 核电荷数 =质子数 核=外电子数 阳离子: 核电荷数 =质子数 核>外电子数 阴离子: 核电荷数 =质子数 核<外电子数
二、离子的形成小结
1.离子的概念:带电荷的原子(或原子团)
2.阴离子:带负电荷的原子叫做阴离子。 如: O2- 、S2-、 F- 、Cl-、 阳离子:带正电荷的原子叫做阳离子。 如: H+ 、Na+、 Mg2+ 、Al3+
3.离子符号的书写:先写元素或原子团,再 把带电量标到右上角(数前号后1不写)例 :氢离子 硅离子 碳酸根离子 3个硫酸根 离子 4.离子所带电荷数由该元素原子的最外层电 子数决定。
离子——带电荷的原子或原子团
阳离子——带正电荷的原子或原子团
Na+ Ca2+ Mg2+ Al3+ H+ NH4+
阴离子——带负电荷的原子或原子团
Cl- O2- F- OH- SO42- NO3- CO32-
常见的离子
请思考如下问题
Na变成Na+有哪些变化?Cl变成Cl? 1、最外层电子数一定改变 。
A 、①② B、②③ C、①②④ D、②③④
28
B
+9 2 8
4、写出下列微粒的质子数和电子数
项目 Na 质子数 11
电子数 11
Na+ S2- Ne H2O NH4+ OH-
练习:说出下符号的意义
一个硫离子
S2- 一个硫离子带了2个负电荷 3S2- 表示3个硫离子
练习:下列离子符号的意义
Na+
Mg2+
3Al3+
O2-
F-
3Ca2+
原子中: 核电荷数 =质子数 核=外电子数 阳离子: 核电荷数 =质子数 核>外电子数 阴离子: 核电荷数 =质子数 核<外电子数
二、离子的形成小结
1.离子的概念:带电荷的原子(或原子团)
2.阴离子:带负电荷的原子叫做阴离子。 如: O2- 、S2-、 F- 、Cl-、 阳离子:带正电荷的原子叫做阳离子。 如: H+ 、Na+、 Mg2+ 、Al3+
3.离子符号的书写:先写元素或原子团,再 把带电量标到右上角(数前号后1不写)例 :氢离子 硅离子 碳酸根离子 3个硫酸根 离子 4.离子所带电荷数由该元素原子的最外层电 子数决定。
离子——带电荷的原子或原子团
阳离子——带正电荷的原子或原子团
Na+ Ca2+ Mg2+ Al3+ H+ NH4+
阴离子——带负电荷的原子或原子团
Cl- O2- F- OH- SO42- NO3- CO32-
常见的离子
请思考如下问题
Na变成Na+有哪些变化?Cl变成Cl? 1、最外层电子数一定改变 。
A 、①② B、②③ C、①②④ D、②③④
28
B
+9 2 8
4、写出下列微粒的质子数和电子数
项目 Na 质子数 11
电子数 11
Na+ S2- Ne H2O NH4+ OH-
人教版九年级化学课件:3.2 原子的结构——离子 (共23张PPT)

数为13,该离子的核外电子数为
_1_0___,该离子的名称是铝__离__子__,
符号是_A_l_3_+ ,该离子的结构示意图
是:
+13 2 8
• 根据右边的结构图回答:
• 如果该图表示的是原子,X值为___,
该10原子的符号是____。Ne
• 如果该图表示的是带两个单位正电
荷的阳离子,X值为_1_2_,符号是 _Mg_2_+_。
书写离子的方法
Mg2+ Cl-
镁离子
氯离子
离子用离子符号表示:
在元素符号的右上角标出离子所带的电荷的多少及电 荷的正负,当离子所带电荷数为1时,1可以不写。
离子符号的意义: Mg2+上的2表示每个镁离子带2个单位的正电荷 O2-上的2表示每个氧离子带2个单位的负电荷
每个铝离子
3个 铝离
3Al 3+
带三个单位 正电荷
子
铝离子或 一个铝离 子
指出下列符号中数字“2 ”
的意义
2Mg2+ 、2 S2-
离子符号前面的系数只表示 离子的个数。
构成物质的粒子:原子、分子、离子
某些单质由原子直接构成。如:金属 另一些单质由分子构成。如:气态非金属
化合物由分子或离子构成。 一般情况下,有金属阳离子(或铵 根离子NH4+ )的化合物由离子构成, 否则由分子构成。
原子结构 示意图
电子层
S +16 2 8 6
核内质子数
电子层上 的电子数
+1 1
氢H
+2 2
氦He
+3 2 1 +4 2 2 +5 2 3 +6 2 4 +7 2 5 +8 2 6 +9 2 7 +10 2 8
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、这些元素的原子的核外电子的是怎样排布的? 3、每一层各排布了多少个电子? 4、用什么形式来表现原子核外电子的
排布示意图? 5、原子结构示意图各有什么意义? 6、你发现了核外电子排布的什么规律? 7、元素的化学性质是由什么微粒来决定?
为什么?
一、核外电子的 排布:
1、分层排布(高速运动) 电子层数 :一 二 三 四 五 六 七 电子能量 : 逐 渐 升 高 离核距离 : 逐 渐 增 大
2、原子结构示意图的意义: 以O原子结构示意为例
⑴ 弧线表示电子层, ⑵ “2” 表示第一层上排有两个电子。 ⑶ “6” 表示第二层上排有6个电子。 ⑷ +8表示原子核内有8个质子 。
3、核外电子的排布规律 :
⑴ 先排满内层, 后排外层。 ⑵ 第一 层上最多排2个电子。 ⑶ 第二层上最多排8个电子。 ⑷ 最外层上最多排8个电子 。
6、稀有气体元素的原子最外电子层有__个电子(氦有
__个电子),化学性质比较__ ,一般情况下不跟其它
物质,核外共有____个电
子最外层有___个电子,在化学反应中易___个电子。
8、金属元素在化学反应中 ( )
A.不易得失电子 B.易得电子
C.易失电子
D.易导电
9、钠原子失去一个电子后发生变化的是 ( )
由阴、阳离子相互作用构成的化合物 例:钠+氯气→氯化钠
离子化合物由离子构成
四、共价化合物
以共用电子对形成分子化合物
例:氢气+氯气→氯化氢
(1)共价化合物由分子构成(2)共用电子对 虽被双方原子所共用,但它会偏向于得电子能 力强的一方,使这一方略显负电性,另一方略 显正电性,但整个分子不显电性。
1. 在化学反应里,元素的原子结构 发生变化的 是( )
1、定义:带电的原子(或原子团)叫做离子
思考:阳离子中,质子数大还是电子数大?为 什么?阴离子呢?它们与其所带的电荷有什么 关系?
2、离子的分类:
(1)阳离子:带正电的离子叫阳离子不清 (2)阴离子:带负电的离子叫阴离子
3、离子符号的意义:2 Mg2+
4、离子的结构特点:最外层均为稳定结构, 且质子数与电子数不相等。
sunbet官方网 sunbet下载 sunbet官方网 sunbet下载 ory75msq
武说:“武儿,过来扶你义父上车吧!路途遥远,你可要多加小心啊!”大家流着眼泪挥手道别,互致保重……尚武稳稳地坐在驾车位置 上,长鞭一甩:“驾—”棕色大骡驾起大平车,一路向着西北方向的鄱阳湖疾行而去了……38第百零四回 转道西路返故乡|(踏上乡土皆 乡音,耿英换回女儿装;替老乡上坟祭先人,转道西路返故乡。)且说大白骡精神抖擞地驾起大平车顺着大道一路疾走,赶到天儿擦黑的 时候,终于来到了大路边上坐东向西的小客栈门前,耿正“兄弟”三人终于松了一口气。通人性的大白骡不等耿正召唤,就在小客栈的门 口自动停了下来。“兄弟”三人下车脱去孝服,拔了招魂幡,蒙好红篷布。耿直提起软皮箱,耿正牵起大白骡,连人带车缓步进了小客栈。 一个年轻的伙计迎上来帮着卸了骡车。看到红篷布蒙车,伙计心下已经明白七八分了,所以并不多问什么。耿正嘱咐他说:“大白骡今儿 个赶路非常辛苦,麻烦您一定要照顾好它!”这位机灵的年轻伙计和善地笑笑,非常爽快地说:“请几位客官放心,俺一定会照顾好它 的!”耿正说:“您叫老乡兄弟就行了,俺们回到了本乡本土,不用客气的!”伙计很高兴,说:“那就请老乡兄弟们放心!大白骡交给 俺了!看你们几位也累了,快去吃饭歇息哇!”“兄弟”三人谢过伙计,简单地去伙房吃了点儿晚饭,就去客房歇息了。这一晚,他们在 陌生的小客栈里睡得很香甜。次日早上起床后,“兄弟”三人都已经不再感到疲乏了。于是,简单洗漱完毕吃罢早饭结算了住宿费用,再 顺便打探清楚了去稷山县城的路线之后,就重新套上骡车出发了。三日后的黄昏时分,他们乘坐骡车来到了稷山县城。入住了县城靠北的 一个客栈以后,耿正对妹妹说:“英子,现在到处都是乡音了,加之眼下春耕春种逐渐开始,大道上已经不再荒凉。你老是戴着个帽子怪 热的,还是换回女装得了。”耿直也说:“是哩,咱哥说得对,姐你快变回女人哇,别再拿拿捏捏的了,怪累人的!”耿英说:“好啊, 俺也不想再做‘男人’了,真得很累人呢!再者说了,俺这脑袋瓜子本来就很怕热呢,打小儿就不喜欢用头巾什么的!这样哇,等明儿个 出了县城以后,俺在路上再换回女装来。今儿个俺是男装入住的,明儿个俺还男装走!”耿正说:“这样更好!”耿直也说:“还是姐姐 想得周到!”次日早饭后,“兄弟”三人与客栈结算清后,早早就套上骡车出发往李家庄的方向赶去了。出了县城以后,耿英依然还是在 大骡车行进中换回了女装。说起来,换回女装其实非常简单:先是摘掉帽子,然后脱掉套在最外面的孝服,将男装外衣也脱掉,换穿上原 先的女装外衣,再重新套上孝服就得了。最后,把换下来的男装外衣和帽子卷把起来塞在寿棺后面。如此,这持续了
A.电子层数 B.原子量 C.质子数 D.中子数
10、有三种微粒,x元素 的原子核电荷数
为12,y元素 的阴离子带一个单位负电荷,
核外电子排布与z元素的原子一样,z元
素 的原子核外有三个电子层,最外层有8
个电子
(1)画出三种元素 的原子结构示意图
x、
y、
z、
。
(2)上述三种元素中相形成化合物的元
素是 和 该化合物的化学式是
4、写出下列微粒的质子数和电子数
项目 Na 质子数 11
电子数 11
Na+ S2- Ne H2O NH4+ OH-
11 16 10 10
11
9
10 18 10 10
10 10
5、某元素的原子结构示意图
,其中 表示
__________,弧线表示___,最外电子层有___个电子,
在化学反应中,这种原子容易____电子。
4、 各元素原子最外电子数目的特点:
元素
最外层电 原子结构 子数
稀有气体
8
稳定结构
元素
(He为2个)
金 属 元 素 一 般﹤ 4 不稳定结构
非金属元 一 般﹥4 不稳定结构 素
变化 趋势
稳定
化学 性质
稳定
易失去 活 泼 电子
易获得 活 泼 电子
最外层电子数决定了元素的化学性质
二、离子的形成
思考:为什么会形成离子
A 、质子数
B 、最外层电子数
C 、中子数
D、核电荷数
2. 某微粒的结构示意图 +13 说法中不正确的是 ( )
2 8 下列有关
A、该元素 原子的核外有2个电子层
B、该 元素 是一种金属元素
C、该微粒 是阳离子
D、该微粒 最外层具有稳定结构
3、对结构示意图为+10 2 8和 +9 2 8的
两种微粒,有下列说法 ①属于同一元素 ②都具有稳定结构 ③核外电子排布相同④都不带电荷 其中说法正确的是( ) A 、①② B、②③ C、①②④ D、②③ ④
课题3 离子
思考:物质由哪些微粒构成?
仅仅是只由分子原子构成的吗?有没有其它的
微粒?
质子(+)
原子核
原子 (+) 中子
核外电子(–)
H、C、O、Na、S这五种元素的原子核外各有几
个电子?这些电子的是怎样运动的?
阅读课本P76-78 回答以下几个问题?
1、H、O、Ne、Na、Cl 这五种元素的原子 核外各有几个电子?
名称 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙
符号 Na Mg Al Si P S Cl Ar K Ca
原子结 构示意 图
+11 2 8 1
+12 2 8 2
+14 2 8 4
+17 2 8 7
+20 2 8 8 2 6
+15 2 8 5
+18 2 8 8
+13 2 8 3
+16 2 8 6
+19 2 8 8 1
。
序 1 2 3 4 5 6 7 8 9 10
号
名 氢 氦锂 铍硼 碳氮氧氟 氖
称
符 H He Li Be B C N O F Ne
号
原 子 结 构 示 意
+3 2 1 +4 2 2
+6 2 4 +7 2 5
+9 2 7 +10 2 8
+5 2 3
+8 2 6
序号 11 12 13 14 15 16 17 18 19 20
3. 离子符号的意义(数字2的意义)
表示每个镁离子带两个单位 的正电荷
2Mg2+
表示两个镁离子
四. 物质与粒子的关系
具
结合
单质
同种 元素
有
元
原 相
同
核
结合
化 不同种 合 元素
素
电
子 荷
数 的
分解
同
物
一
得或失电
烃 原
子
子
分聚 子集 离结 子合
金刚石、 铁、汞
H2、O2、 H2O
氯 化钠 NaCl
三、离子化合物:
排布示意图? 5、原子结构示意图各有什么意义? 6、你发现了核外电子排布的什么规律? 7、元素的化学性质是由什么微粒来决定?
为什么?
一、核外电子的 排布:
1、分层排布(高速运动) 电子层数 :一 二 三 四 五 六 七 电子能量 : 逐 渐 升 高 离核距离 : 逐 渐 增 大
2、原子结构示意图的意义: 以O原子结构示意为例
⑴ 弧线表示电子层, ⑵ “2” 表示第一层上排有两个电子。 ⑶ “6” 表示第二层上排有6个电子。 ⑷ +8表示原子核内有8个质子 。
3、核外电子的排布规律 :
⑴ 先排满内层, 后排外层。 ⑵ 第一 层上最多排2个电子。 ⑶ 第二层上最多排8个电子。 ⑷ 最外层上最多排8个电子 。
6、稀有气体元素的原子最外电子层有__个电子(氦有
__个电子),化学性质比较__ ,一般情况下不跟其它
物质,核外共有____个电
子最外层有___个电子,在化学反应中易___个电子。
8、金属元素在化学反应中 ( )
A.不易得失电子 B.易得电子
C.易失电子
D.易导电
9、钠原子失去一个电子后发生变化的是 ( )
由阴、阳离子相互作用构成的化合物 例:钠+氯气→氯化钠
离子化合物由离子构成
四、共价化合物
以共用电子对形成分子化合物
例:氢气+氯气→氯化氢
(1)共价化合物由分子构成(2)共用电子对 虽被双方原子所共用,但它会偏向于得电子能 力强的一方,使这一方略显负电性,另一方略 显正电性,但整个分子不显电性。
1. 在化学反应里,元素的原子结构 发生变化的 是( )
1、定义:带电的原子(或原子团)叫做离子
思考:阳离子中,质子数大还是电子数大?为 什么?阴离子呢?它们与其所带的电荷有什么 关系?
2、离子的分类:
(1)阳离子:带正电的离子叫阳离子不清 (2)阴离子:带负电的离子叫阴离子
3、离子符号的意义:2 Mg2+
4、离子的结构特点:最外层均为稳定结构, 且质子数与电子数不相等。
sunbet官方网 sunbet下载 sunbet官方网 sunbet下载 ory75msq
武说:“武儿,过来扶你义父上车吧!路途遥远,你可要多加小心啊!”大家流着眼泪挥手道别,互致保重……尚武稳稳地坐在驾车位置 上,长鞭一甩:“驾—”棕色大骡驾起大平车,一路向着西北方向的鄱阳湖疾行而去了……38第百零四回 转道西路返故乡|(踏上乡土皆 乡音,耿英换回女儿装;替老乡上坟祭先人,转道西路返故乡。)且说大白骡精神抖擞地驾起大平车顺着大道一路疾走,赶到天儿擦黑的 时候,终于来到了大路边上坐东向西的小客栈门前,耿正“兄弟”三人终于松了一口气。通人性的大白骡不等耿正召唤,就在小客栈的门 口自动停了下来。“兄弟”三人下车脱去孝服,拔了招魂幡,蒙好红篷布。耿直提起软皮箱,耿正牵起大白骡,连人带车缓步进了小客栈。 一个年轻的伙计迎上来帮着卸了骡车。看到红篷布蒙车,伙计心下已经明白七八分了,所以并不多问什么。耿正嘱咐他说:“大白骡今儿 个赶路非常辛苦,麻烦您一定要照顾好它!”这位机灵的年轻伙计和善地笑笑,非常爽快地说:“请几位客官放心,俺一定会照顾好它 的!”耿正说:“您叫老乡兄弟就行了,俺们回到了本乡本土,不用客气的!”伙计很高兴,说:“那就请老乡兄弟们放心!大白骡交给 俺了!看你们几位也累了,快去吃饭歇息哇!”“兄弟”三人谢过伙计,简单地去伙房吃了点儿晚饭,就去客房歇息了。这一晚,他们在 陌生的小客栈里睡得很香甜。次日早上起床后,“兄弟”三人都已经不再感到疲乏了。于是,简单洗漱完毕吃罢早饭结算了住宿费用,再 顺便打探清楚了去稷山县城的路线之后,就重新套上骡车出发了。三日后的黄昏时分,他们乘坐骡车来到了稷山县城。入住了县城靠北的 一个客栈以后,耿正对妹妹说:“英子,现在到处都是乡音了,加之眼下春耕春种逐渐开始,大道上已经不再荒凉。你老是戴着个帽子怪 热的,还是换回女装得了。”耿直也说:“是哩,咱哥说得对,姐你快变回女人哇,别再拿拿捏捏的了,怪累人的!”耿英说:“好啊, 俺也不想再做‘男人’了,真得很累人呢!再者说了,俺这脑袋瓜子本来就很怕热呢,打小儿就不喜欢用头巾什么的!这样哇,等明儿个 出了县城以后,俺在路上再换回女装来。今儿个俺是男装入住的,明儿个俺还男装走!”耿正说:“这样更好!”耿直也说:“还是姐姐 想得周到!”次日早饭后,“兄弟”三人与客栈结算清后,早早就套上骡车出发往李家庄的方向赶去了。出了县城以后,耿英依然还是在 大骡车行进中换回了女装。说起来,换回女装其实非常简单:先是摘掉帽子,然后脱掉套在最外面的孝服,将男装外衣也脱掉,换穿上原 先的女装外衣,再重新套上孝服就得了。最后,把换下来的男装外衣和帽子卷把起来塞在寿棺后面。如此,这持续了
A.电子层数 B.原子量 C.质子数 D.中子数
10、有三种微粒,x元素 的原子核电荷数
为12,y元素 的阴离子带一个单位负电荷,
核外电子排布与z元素的原子一样,z元
素 的原子核外有三个电子层,最外层有8
个电子
(1)画出三种元素 的原子结构示意图
x、
y、
z、
。
(2)上述三种元素中相形成化合物的元
素是 和 该化合物的化学式是
4、写出下列微粒的质子数和电子数
项目 Na 质子数 11
电子数 11
Na+ S2- Ne H2O NH4+ OH-
11 16 10 10
11
9
10 18 10 10
10 10
5、某元素的原子结构示意图
,其中 表示
__________,弧线表示___,最外电子层有___个电子,
在化学反应中,这种原子容易____电子。
4、 各元素原子最外电子数目的特点:
元素
最外层电 原子结构 子数
稀有气体
8
稳定结构
元素
(He为2个)
金 属 元 素 一 般﹤ 4 不稳定结构
非金属元 一 般﹥4 不稳定结构 素
变化 趋势
稳定
化学 性质
稳定
易失去 活 泼 电子
易获得 活 泼 电子
最外层电子数决定了元素的化学性质
二、离子的形成
思考:为什么会形成离子
A 、质子数
B 、最外层电子数
C 、中子数
D、核电荷数
2. 某微粒的结构示意图 +13 说法中不正确的是 ( )
2 8 下列有关
A、该元素 原子的核外有2个电子层
B、该 元素 是一种金属元素
C、该微粒 是阳离子
D、该微粒 最外层具有稳定结构
3、对结构示意图为+10 2 8和 +9 2 8的
两种微粒,有下列说法 ①属于同一元素 ②都具有稳定结构 ③核外电子排布相同④都不带电荷 其中说法正确的是( ) A 、①② B、②③ C、①②④ D、②③ ④
课题3 离子
思考:物质由哪些微粒构成?
仅仅是只由分子原子构成的吗?有没有其它的
微粒?
质子(+)
原子核
原子 (+) 中子
核外电子(–)
H、C、O、Na、S这五种元素的原子核外各有几
个电子?这些电子的是怎样运动的?
阅读课本P76-78 回答以下几个问题?
1、H、O、Ne、Na、Cl 这五种元素的原子 核外各有几个电子?
名称 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙
符号 Na Mg Al Si P S Cl Ar K Ca
原子结 构示意 图
+11 2 8 1
+12 2 8 2
+14 2 8 4
+17 2 8 7
+20 2 8 8 2 6
+15 2 8 5
+18 2 8 8
+13 2 8 3
+16 2 8 6
+19 2 8 8 1
。
序 1 2 3 4 5 6 7 8 9 10
号
名 氢 氦锂 铍硼 碳氮氧氟 氖
称
符 H He Li Be B C N O F Ne
号
原 子 结 构 示 意
+3 2 1 +4 2 2
+6 2 4 +7 2 5
+9 2 7 +10 2 8
+5 2 3
+8 2 6
序号 11 12 13 14 15 16 17 18 19 20
3. 离子符号的意义(数字2的意义)
表示每个镁离子带两个单位 的正电荷
2Mg2+
表示两个镁离子
四. 物质与粒子的关系
具
结合
单质
同种 元素
有
元
原 相
同
核
结合
化 不同种 合 元素
素
电
子 荷
数 的
分解
同
物
一
得或失电
烃 原
子
子
分聚 子集 离结 子合
金刚石、 铁、汞
H2、O2、 H2O
氯 化钠 NaCl
三、离子化合物:
