常见气体的实验室制取精品PPT课件
合集下载
《常见气体的制备 》课件

和处置。
对于有害废弃物,应按照相关 规定进行无害化处理,确保不
污染环境。
实验过程中产生的废气、废液 应经过处理后排放,减少对环
境的负担。
实验结束后应及时清理现场, 确保实验室整洁卫生。
实验环保措施
优先选择环保型的实验方法和试剂, 减少对环境的污染。
推广使用环保型的实验器材和设备, 如低流量气体输送管、低噪音设备等 。
根据实验需求选择合适的仪器搭建气体发生 装置,确保装置的气密性良好。
反应条件控制
根据气体发生的化学反应需求,控制反应温 度、压力等条件。
试剂添加
按照实验要求,准确称量并添加所需的化学 试剂。
气体收集与处理
对制备出的气体进行收集,并进行必要的气 体处理,如除杂、干燥等。
实验操作技巧
01
02
03
04
快速操作
在气体制备过程中,尽量减少 不必要的等待时间,提高实验
效率。
精确控制
对实验条件进行精确控制,确 保气体制备的质量和纯度。
仪器维护
定期对气体发生装置进行维护 和保养,延长仪器的使用寿命
。
数据记录与分析
在实验过程中,及时记录数据 并进行分析,以便更好地理解
实验结果和气体性质。
04
气体制备实验结果分析
实验结果分析方法
提倡使用可再生资源和能源,减少对 自然资源的消耗。
加强实验室的通风换气,保持空气清 新,减少室内空气污染。
THANKS
03
气体制备实验操作
实验操作注意事项
安全注意事项
确保实验操作符合安全规 定,避免使用不适当的操 作方法,遵循实验室安全 准则。
实验环境
确保实验环境整洁、干燥 、无尘,避免气体制备过 程中受到环境因素的干扰 。
对于有害废弃物,应按照相关 规定进行无害化处理,确保不
污染环境。
实验过程中产生的废气、废液 应经过处理后排放,减少对环
境的负担。
实验结束后应及时清理现场, 确保实验室整洁卫生。
实验环保措施
优先选择环保型的实验方法和试剂, 减少对环境的污染。
推广使用环保型的实验器材和设备, 如低流量气体输送管、低噪音设备等 。
根据实验需求选择合适的仪器搭建气体发生 装置,确保装置的气密性良好。
反应条件控制
根据气体发生的化学反应需求,控制反应温 度、压力等条件。
试剂添加
按照实验要求,准确称量并添加所需的化学 试剂。
气体收集与处理
对制备出的气体进行收集,并进行必要的气 体处理,如除杂、干燥等。
实验操作技巧
01
02
03
04
快速操作
在气体制备过程中,尽量减少 不必要的等待时间,提高实验
效率。
精确控制
对实验条件进行精确控制,确 保气体制备的质量和纯度。
仪器维护
定期对气体发生装置进行维护 和保养,延长仪器的使用寿命
。
数据记录与分析
在实验过程中,及时记录数据 并进行分析,以便更好地理解
实验结果和气体性质。
04
气体制备实验结果分析
实验结果分析方法
提倡使用可再生资源和能源,减少对 自然资源的消耗。
加强实验室的通风换气,保持空气清 新,减少室内空气污染。
THANKS
03
气体制备实验操作
实验操作注意事项
安全注意事项
确保实验操作符合安全规 定,避免使用不适当的操 作方法,遵循实验室安全 准则。
实验环境
确保实验环境整洁、干燥 、无尘,避免气体制备过 程中受到环境因素的干扰 。
常见气体的制取 ppt课件

ppt课件
3
A、固--固加热装置
注意事项: (1)试管口应略向下倾斜 (2)试管夹夹在距试管口1/3处(3) 药品应平铺于试管底部 (4)导管不宜伸入试管内过长,粉 末状固体,应在试管口堵一团棉花。 (5)实验开始时先检验装置的 气密性 (6)加热时,先预热且外焰加热
ppt课件
4
该装置可用于制备O2 和 NH3
A
B
C
D
X
SO2
H2S
CO2
Cl2
Y
饱和 NaHCO3
浓硫酸
ppt课件
Na2SO3溶 液
Na2CO3溶
液
27
5、下图所示为制取氯气的实验装置:
烧瓶中盛放的固体是MnO2和NaCl。
(1)盛放药品前,怎样检验此装置的气密性
。
(2)分液漏斗中盛放的液体是
,打开活塞K,
将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活
②强碱溶液:如NaOH溶液可吸收酸性的 气体。
③饱和的酸式盐溶液,可将杂质气体吸 收并转化,如:
CO2(HCl、SO2)----饱和NaHCO3溶液 SO2(HCl、SO3)ppt课-件---饱和NaHSO3溶12 液
④酸性KMnO4溶液:利用它的强氧化性, 可以除去具有还原性的气体, 如除去混在CO2气体中的SO2、H2S等。
先拆主体,后拆部件。
ppt课件
23
练习:
1.利用下列各组中的物质作用制备和收集 相应气体,能采用右图实验装置的是( B )
①浓氨水与固体NaOH ②电石与水反应
③过氧化氢溶液与二氧化锰
④稀硝酸与铜片
⑤镁条与稀硫酸
A.仅①②③ B.仅③ C.仅①②③ D.全部
常见气体的实验室制法PPT课件
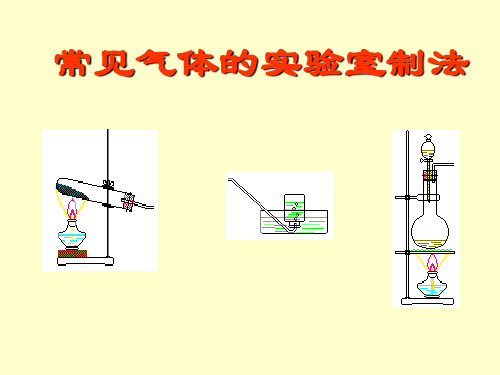
气体 C2H4 Cl2 NH3 NO
a 乙醇 浓盐酸 饱和NH4Cl溶液 稀HNO3
b 浓H2SO4
MnO2 消石灰
铜屑
c NaOH溶液 NaOH溶液
H2O H2O
d 浓H2SO4 浓H2SO4 固体NaOH
P2O5
(1)上述方法中可以得到干燥、纯净的气
体是
NO 。
(2)指出不能用上述方法制取的气体,并
CaC2 + 2H2O → Ca(OH)2 + CH≡CH↑
气体制备流程图
发生 装置
净化 装置
干燥 装置
收集 装置
吸收 装置
及反 反应 应物 条状 件态
的气 性体 质及
杂 质
选气 择体 干的 燥性 剂质
及气 密体 度水溶 性ຫໍສະໝຸດ 选气 择体 吸的 收毒 剂性
二、气体发生装置:
1、固、固加热:即:固+固→气
P2O5可以干燥除氨气以外的其它气体。
四、气体的收集
收集方法 排水法 向上排气法 向下排气法
装置示意图
气体性质 实例
难溶或微溶 于水的气体
密度大于空 密度小于空 气的气体 气的气体
H2、CH4、NO O2、N2、C2H2
CO2、Cl2、HCl
H2、NH3、CH4
五、尾气的吸收
1、依据气体的性质选取适当的吸收试剂 2、防倒吸
常见气体的实验室制法
一、常见气体的制备原理:
H2: Zn + H2SO4(稀) = ZnSO4 + H2↑
O2:
M n O 2
2 K C lO 3
2 K C l + 3 O 2
或: 2 K M n O 4 K 2 M n O 4 + M n O 2 + O 2
初中常见气体的实验室制法PPT课件
是
。
控制氧气产生的快慢和量的多少
第17页/共28页
下图所示为实验室中常见的气体制备和收集装置。
(3)欲使用装置E用排空气法收集二氧化碳,则气体应
从 a (填“a”或“b”)端通入;欲使用装置E用排水法 收集氧气,先将瓶中装满水,再将气体从b (填“a”或
“b”)端通入。
第18页/共28页
下图所示为实验室中常见的气体制备和收集装置。
(2)实验完毕,停止加热前应该
先
,再
。
(3)若用右图装置采用排水法收集O2,请 简述操作步骤。 先将集气瓶装满水,再将O2从b口通入。
第21页/共28页
铁夹夹在试管 中上部
(1)制氧气注意要点:
导管只需突 出胶塞少许
用外焰 对准药 品加热
导管口只能 插在集气瓶
口附近
检查有无 灯芯和酒
精
试管口要略 向下倾斜
固体(+固体) 加热 气体
第4页/共28页
把导管的一端浸入水中,用双手紧握试管或烧 瓶外壁,如果导管口有气泡冒出,说明装置的 气密性良好。
如气密性良好,把手移开会有什么现象?
第5页/共28页
《考试说明》 第65页例题2⑶
向长颈漏斗中注入水至长颈漏斗下端管口浸 没液面以下,用弹簧夹夹紧橡皮管,继续加 水,如果观察长颈漏斗中的液面不下降,则 说明气密性好。 第6页/共28页
A
吸收HCl :NaHCO3溶液
证明HCl存在:AgNO3 溶液 第11页/共28页
B 浓硫酸
第12页/共28页
能用这套装置收集气体吗?
a
b 1.若用来收集氧气, 氧气应从_a__端进;
2.当气体从b端通入时,能收集到的 气体可以是密度比空气小的气体如. H2
常见气体的实验室制法中小学PPT教学课件

2.(2011·湖南四市九校联考)下图中a、b、c表示相应仪器中 加入的试剂,可用下图装置制取、净化、收集的气体是 ()
编号 A B C D
气体 NH3 CO2 NO NO2
a 浓氨水 盐酸 稀硝酸 浓硝酸
b 生石灰 碳酸钙 铜屑 铜屑
c 碱石灰 饱和NaHCO3
H2O NaOH溶液
[解题指导] 选 B A中干燥氨气的碱石灰为固态,应装于 干燥管中,不可用洗气瓶,用氨气不可用向上排空气法收 集,故A错误;B中饱和NaHCO3溶液的作用是除去挥发出 来的HCl气体,B正确;C中生成的NO能与空气中的氧气 反应,不能用排空气法收集,故C错误;D中NaOH溶液能 与NO2反应,致使收集不到NO2,故D错误.
3.(2011·大连测试)下图装置可用于收集气体X并验证其某
些化学性质,你认为正确的是
()
选项 气体
试剂
现象
结论
A
SO2
酸性KMnO4 溶液
溶液褪色
SO2有氧化性
B C2H4
溴水
溶液褪色
能发生加成反 应
C X 澄清石灰水 溶液变浑浊 X不一定是CO2
D
Cl2
溶液先变红后 紫色石蕊试液
褪色
Cl2有酸性和漂 白性
(2)收集方法 向上排空气
用
或
排饱和食盐水 法.
5.氨气的制备 (1)反应原理
化学方程式:
. (2)收集方2N法H4Cl+Ca(OH)2==△===CaCl2+2NH3↑+2H2O
用
法.
向下排空气
实验室制取氨气还可用哪些方法? 提示:实验室制取氨气,除用氯化铵和消石灰加热外, 还可用浓氨水制取:①可以加热浓氨水使NH3挥发出 来,②可用浓氨水和生石灰混合,生石灰与水反应, 使NH3挥发出来.
化学常见气体的制备方法总结(超经典)[优质ppt]
![化学常见气体的制备方法总结(超经典)[优质ppt]](https://img.taocdn.com/s3/m/af698650a45177232f60a279.png)
反应装置
-----常用装置
1、气体发生装置
思 考:
气体制备的发生装置有几种类型?如何选择气 体的发生装置? 气体发生装置的基本类型:
A、固体反应物(加热)
B、固液反应物(不加热) C、固(液)液反应物(加热)
气体发生装置的设计原则:
根据反应原理、反应物状态和反应所需条 件等因素来选择反应装置。
A、固体反应物(加热) 注意事项:
气体溶于水,内部气压变小,水在
大气作用下被吸入漏斗,使得液面与漏斗口脱离,水又回到烧杯
6、实验室里可按下图所示的装置干燥、储存气体R, 多余的气体可用水吸收,则R是 D A.NO2 B.HCl
C.CH4 D.NH3
7、分别由下列四组物质制取气体。①浓盐酸和
MnO2②(NH4)2Cl和Ca(OH)2 ③NaCl和H2SO4(浓)
CO2,Cl2,HCl
H2,NH3
下面是课外兴趣小组的同学设计的各种尾气吸收装置:
a b c d
e
f
I
g
h
从实验安全和环境保护的角度考虑,若用于吸收HCl气体(装置中的液体为水,
固体为碱石灰),应选用的装置是________a_____d_____ e h
4、常见除尾气装置
A、 燃烧法 如CH4、C2H4、C2H2、H2、CO等。
试管 酒精灯
(1)试管口应略向下倾斜 (2)试管夹夹在试管的中上部
导管 (3)药品应平铺于试管底部
(4)导管不宜伸入试管过长
(5)实验开始时先检验装置的气密性
铁架台 (6)加热时,先预热且应用外焰加热
该装置可用于制备 O2、NH3和CH4
2KM 4K n2M O4n M O2n O O 2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cl2
HCl 等
①烧瓶加热时 要垫石棉网
②要正确使用 分液漏斗。
③反应物均为 液体时,烧瓶 内要加碎瓷片
2、净化装置
如何判断制取的气体中混有哪些杂质 思考感悟:
(1)看反应物的状态: 若反应物中有水溶液,则制取的气体中一定含有水蒸气, 若反应物中有气体,则制取的气体中一定含有原来的气体, (2)看反应物的性质: 如用盐酸制取的气体中含有HCl气体; (3)看生成物的成分:如用氯化铵和消石灰制取的氨气中含有水蒸气
H2、NH3
如何用下图装置收集常见气体?
5、除尾气装置
(1)吸收原则: ①能充分吸收气体。②不能倒吸。 (2)尾气的处理方法:
直接排放、燃烧处理、 直接吸收(防倒吸)、袋装处理
A、 燃烧法
思考:用燃烧法可以处 理哪些尾气?
如处理CH4、H2、CO等。
B、 水溶解法 思考:用水溶解法可以 处理哪些尾气? 如处理HCl、NH3等。
一、常见气体实验装置的设计思路
1、操作顺序: 组装连接仪器 检查气密性
2、安装顺序:由下向上,由左向右。
3、装置连接顺序:
装药品
发生 装置
净化 装置
干燥 装置
收集 装置
吸收 装置
二、各装置的设计原则
1. 发生装置
(1)设计原则:
根据反应原理、反应物状态和反应所需条件等 因素来组装反应装置。
(2)反应装置类型:
c、碱液反应法
思考:用碱液反应法可以处理哪些尾气? 如处理Cl2、H2S、CO2、SO2、NO2、NO等。
(1)尾气处理装置应与大气相通, 如图就不能作为尾气处理装置。
(2)有些制得的物质需要 防潮处理(如FeCl3、AlCl3 等),这时尾气处理必须用 干燥管,以防止空气中水蒸 气进入,如图:
1.有如下几种制备气体的方案:①用稀硝酸与Zn 粉反应制氢气;②用水与过氧化钠固体反应制氧 气;③用稀硫酸和大理石制备二氧化碳;④氧化 钙与浓氨水反应制氨气;⑤NaI固体和浓硫酸混 合共热制碘化氢。不宜采用的方案有
①若采用溶液除杂:一般是先除杂再干燥。 ②若采用加热除杂:则一般是先干燥再除杂。
4、收集装置
(1)设计原则:根据气体的密度、水溶性及是否与水 或空气中的O2发生反应来确定气体的收集方法。
(2)装置基本类型:
收集 排水法
方法
向上排空气法
向下排空气法
收集 装置
适用的 H2、O2、 气体 NO、
Cl2、CO2、 NO2、SO2
反应装置图
适用气 体
操作注意事项
①使用长颈漏斗时,
漏斗下端管口插入液
H2、 面以下。
CO2、 H2S 、 NO、
NO2
②使用分液漏斗既可 以增强气密性,又可 控制液体流速。
O2、 ③启普发生器只适用
NH3
于块状固体和液体反 应,且气体不溶于水。
反应装 置类型
固液 加热型
反应装置图
适用 气体
操作注 意事项
A.仅①③⑤
B.仅①②③
C.仅③④
D.全部
• 解析 ①中Zn和稀HNO3反应生成NO而不生成H2;③中 稀硫酸和大理石生成的CaSO4覆盖在CaCO3表面,反应不 能持续进行;⑤中NaI固体被浓硫酸氧化生成I2。
• 答案 A
2、(2011·上海高考)草酸晶体(H2C2O4·2H2O)100℃开始 失水,101.5℃熔化,150℃左右分解产生H2O、CO 和CO2。用加热草酸晶体的方法获取某些气体,应该 选择的气体发生装置是(图中加热装置已略去) ( ) 答案:D
备考导航
让我 看一看? 想一想?
考纲要求
(1)掌握常见气体的实验 室制法(包括所用试剂、 仪器、反应原理、除杂 以及收集方法) (2)能识别或绘制简单的 实验仪器装置图
考点关注
常见气体的实验室制法常与 实验基本操作、实验安全、 新物质的制备、性质探究、 气体的性质、环境保护等等 相结合,考查学生综合应用 知识的能力。
解析:草酸晶体加热过程中有水生成,不能利用A、B, 否则生成的水冷凝后令仪器炸裂;因草酸晶体在101.5℃ 熔化,在试管中流到管口,而发生堵塞,C错误。
3、下图的实验装置用来分离CO2和CO气体并干燥。图中a为止 水解夹析,:b由为图分示液可漏知斗,的甲活中塞所,盛通试过剂Y用型于管吸和收止混水合夹气分体别中接的c、CdO两2, 球可胆排,除现A、装D置项内;的丙空中气所已盛排试尽剂。用为于使干实燥验C成O功和,CO甲2气、体乙,、排丙除中 盛B项放。的溶液分别是
1
O2
2 NH3 3 H2 4 CO2 5 Cl2 6 H2S 7 NO 8 NO2 9 SO2 10 HCl
2KClO3
MnO 2
2KCl+3O2 ↑
2KMnO4 K2MnO4+MnO2+O2↑
2H2O2 MnO2 2H2O +O2 ↑
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
(2)反应装置类型:
反应 装置 反应装置图 类型
固固 加热
型
适用 气体
操作注意事项
O2、
NH3 等
1、试管口应略向下倾斜 2、试管夹夹在试管的中上部; 3、药品应平铺于试管底部 4、导管不宜伸入试管过长 5、实验开始时先检验装置的 气密性 6、加热时,先预热且应用外 焰加热
反应 装置 类型
固液 不加 热型
Zn+H2SO4(稀)===ZnSO4+H2↑
CaCO3+2HCl(稀)===CaCl2+H2O+CO2↑
MnO2+4HCl(浓) ==△===MnCl2+Cl2↑+2H2O
FeS+u+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O Na2SO3+H2SO4(较浓)==Na2SO4+SO2↑+H2O NaCl(固)+H2SO4(浓) NaHSO4+HCl↑
(1)净化原则: 所选用的除杂试剂只能吸收气体中的杂质反应,而 不能与被提纯的气体反应。操作简便,易于分离。
(2)装置基本类型:
液体除杂剂(不加热) 固体除杂剂(不加热) 固体除杂剂(加热)
想一想
如何除去下列气体中括号内的杂质?
1、H2(HCl)、NO(NO2) 2、CO(CO2)、 O2(SO2) 3、CO2(CO) 、CO2(SO2) 4、CO2(O2) 、N2(O2)
探规寻律:选择除杂试剂的关键是找出主体气体 和杂质气体在性质的差异,如溶解性、酸碱性、 氧化性、还原性、可燃性等。
3、干燥装置
常见干燥剂及使用原则
常见 干燥剂
液态干燥剂 浓硫酸
(酸性、强氧化性)
固态干燥剂
无水氯化钙
(中性)
碱石灰
(碱性)
装 置
不可干燥
气体 NH3,H2S,HBr,HI
NH3
HX,H2S,SO2, CO2,NO2, Cl2
