微生物蛋白酶的分
微生物金属蛋白酶

微生物金属蛋白酶(Microbial Metalloproteases)是一类由微生物(包括细菌、真菌、古菌等)产生的含金属离子作为辅因子的蛋白酶。
这类酶在催化反应中,金属离子(如锌、铁、铜等)在活性中心发挥关键作用,参与底物的识别、结合以及催化水解过程。
微生物金属蛋白酶在自然界中广泛存在,它们在生物降解、营养吸收、免疫反应、信号传导等多种生物过程中发挥重要作用,同时也与多种人类疾病的发生和发展密切相关。
微生物金属蛋白酶的种类繁多,包括但不限于金属内肽酶(Metalloendopeptidases)、金属羧肽酶(Metalloexopeptidases)、金属丝氨酸蛋白酶
(Metallo-serine proteases)等。
它们能够降解多种生物大分子,如蛋白质、多肽、脂质等,有些还能降解环境中的有机污染物。
在工业应用上,微生物金属蛋白酶由于其独特高效的催化性能,被广泛应用于生物医药、洗涤剂、皮革处理、纺织品处理、饲料添加剂、环境保护等诸多领域。
同时,某些微生物金属蛋白酶也可能作为病原体的毒力因子,如肺炎克雷伯菌的金属蛋白酶可以协助细菌侵袭宿主细胞,因此也成为抗菌药物研发的靶点之一。
微生物酶的知识点总结

微生物酶的知识点总结微生物酶是指由微生物生产的蛋白质,具有生物催化作用的一种生物催化剂。
微生物酶在生物科技领域具有重要的应用价值,广泛应用于工业生产、医药健康、环境保护等领域。
下面将从微生物酶的分类、作用机制、生产和应用等方面对微生物酶进行详细的知识点总结。
一、微生物酶的分类微生物酶可按其作用特点和产生微生物的分类进行分类。
1. 按作用特点分类(1)氧化酶:如过氧化氢酶、氧化还原酶等。
(2)水解酶:如淀粉酶、脂肪酶、蛋白酶等。
(3)转移酶:如转氨酶、糖基转移酶等。
(4)缩合酶:如聚合酶、合成酶等。
2. 按产生微生物分类(1)真菌酶:由真菌生产的酶,如木质纤维降解酶、纤维素酶等。
(2)细菌酶:由细菌生产的酶,如乳酸菌产生的乳酸酶、α-淀粉酶等。
(3)酵母酶:由酵母生产的酶,如酒精酶、脱氢酶等。
二、微生物酶的作用机制微生物酶的作用机制主要涉及酶的催化作用和酶的作用方式。
1. 酶的催化作用酶是一种生物催化剂,其作用原理是通过降低反应活化能,加速化学反应的进行。
酶能够与特定的底物结合,形成酶-底物复合物,从而在酶活性中心发挥催化作用,使化学反应更容易进行。
2. 酶的作用方式酶的作用方式主要包括亚基、辅助因子、底物亲和性、催化机制等方面。
亚基是酶活性的重要组成部分,能够在反应中转移化学基团,促进反应的进行。
辅助因子是酶催化作用所必需的辅助物质,如金属离子、辅酶等,能够增强酶的催化能力。
底物亲和性指酶与底物之间的亲和力,亲和力强的酶能够更快结合底物,进行催化作用。
催化机制是酶促反应过程中的催化步骤,其方式主要包括酶-底物结合、底物转变、产物释放等步骤。
三、微生物酶的生产微生物酶的生产主要包括微生物菌种选育、酶生产培养、酶提取纯化等步骤。
1. 微生物菌种选育微生物菌种选育是酶生产的首要步骤,关系到酶产量和酶活性等关键指标。
一般通过对自然界中分离的微生物菌种进行筛选和改良,培育出高产、高效的酶源菌株。
2. 酶生产培养酶生产培养是指将选育好的菌株进行大规模培养,促使其产生目标酶。
蛋白酶的工厂设计

年产1500m³蛋白酶的工厂设计摘要蛋白酶是催化肽键水解的一类酶,它可迅速水解蛋白质为胨、肽类,广泛存在于动物内脏、植物茎叶、果实和微生物中。
同时大多数微生物蛋白酶都是胞外酶。
微生物蛋白酶按其作用的最适pH可分为酸性蛋白酶、中性蛋白酶、碱性蛋白酶三类。
酸性蛋白酶是一种羧基蛋白酶,它的分子质量为30-40kD,等电点(pH3.0-5.0)酸性蛋白酶现已广泛应用于食品、饲料、酿造、毛皮与皮革、医药、胶原纤维等各个行业之中。
本设计采用豆饼粉、玉米粉、淀粉为主要的培养基原料,并选用黑曲霉(Aspergillus niger )3.350菌种发酵。
其中豆饼粉3.75%,玉米粉0.625%,鱼粉0.625%,氯化铵1%,氯化钙0.5%,磷酸氢二钠0.2%。
本设计利用通风搅拌式发酵罐进行发酵,同时利用离子交换树脂对母液进行提取,提高了酸性蛋白酶的生产效率,减少了生产成本。
设计还包括发酵罐,全厂平面图,车间平面布置图,工艺流程图。
关键词:酸性蛋白酶发酵工厂设计The Process Design of the Protease used forSection with the Capacity of 1500m³ AnnuallyAbstractprotease is a kind of Peptone and peptide. It has been discover across in animal giblets ,the stem of plant,fruit , microbial and so on.Most of the Microbial protease are ectoenzyme .According to its best Optimum pH function ,Microbial protease Can be divided into Acid protease ,Neutral protease and alkaline protease .Acid protease is a kind of Carboxyl protease , Its molecular weight is 30-40 kd, lower isoelectric point (pH3.0-5.0)Acid protease in food, medicine, textile, leather, feed, cosmetics, washing industries have applications, natural health, avirulent and harmless, quite safe. So in this paper the basic content of more acid protease, production process and application development were introduced. This design USES the bean cake powder, corn flour, starch as the main medium of raw materials, and selects the Aspergillus Niger, Aspergillus Niger) 3.350 bacterial fermentation. With bean cake powder 3.75%, corn flour 3.75%, 0.625% fish meal, 1% ammonium chloride, calcium chloride 0.5%, disodium hydrogen phosphate 0.2%.This design using the ventilation agitator in fermentor, using ion exchange resin in mother liquid was extracted at the same time, improve the efficiency of the acid protease production, reduce the production cost. The design also includes Fermentor, The factory plan, Shop floor plan, Flow Chart.Key Words: Acid protease ; fermentation; plant-design;前言酸性蛋白酶是一类最适pH值为2.5〜5.0的天冬氨酸蛋白酶,相对分子质量为KD30 。
蛋白酶抑制剂

巯基白酶抑制剂
巯基蛋白酶抑制剂和豇豆胰蛋白酶抑制剂的抗虫谱具有 互补性。在一些丝氨酸蛋白酶抑制剂含量甚丰的植物器官 ,如豇豆的种子,也会被豇豆象所摄食,它就是用巯基蛋 白酶来完成消化的,因此CpTI对它不起作用。
基质金属蛋白酶
• 基质金属蛋白酶是一个大家族,因其需要Ca++ 、Zn++等金属离子作为辅助因子而得名,其家族 成员具有相似的结构,一般由5个功能不同的结构 域组成 :(1)疏水信号肽序列;(2)前肽区,主 要作用是保持酶原的稳定。当该区域被外源性酶 切断后,MMPs酶原被激活;(3)催化活性区,有 锌离子结合位点,对酶催化作用的发挥至关重要; (4)富含脯氨酸的铰链区;(5)羧基末端区,与 酶的底物特异性有关。其中酶催化活性区和前肽 区具有高度保守性。MMPs成员上述结构的基础上 各有特点。各种MMP间具有一定的底物特异性, 但不是绝对的。同一种MMP可降解多种细胞外基 质成份,而某一种细胞外基质成分又可被多种 MMP降解,但不同酶的降解效率可不同。
Kunitz家族
Kunitz家族酶抑制剂是丝氨酸蛋白酶抑制剂的另外一个 主要类型,它主要存在于豆类的种子中。从分子的一级结 构来看,约有180个氨基酸,分子量在20KD左右,分子内 只有两对二硫键和一个与酶作用的活性位点。
PI-Ⅰ和PI-Ⅱ家族
蛋白酶抑制剂是一类创伤诱导型表达的蛋白酶抑制剂。 其中PI-Ⅰ家族包括马铃薯蛋白酶抑制剂Ⅰ和番茄蛋白酶抑 制剂Ⅰ,成熟肽的分子量8.1kD,只有一个活性中心,主 要抑制胰凝乳蛋白酶,对胰蛋白酶的抑制作用较弱。其中 PI-Ⅱ家族包括马铃薯蛋白酶抑制剂Ⅱ和番茄蛋白酶抑制剂 Ⅱ,成熟肽的分子量12.3kD,有两个活性中心,可同时抑 制胰蛋白酶和胰凝乳蛋白酶。
微生物发酵生产蛋白酶

妥善保存,才能保证其产酶特性不变异、不死亡、
不被杂菌污染。
❖ 2)菌种活化:产酶菌种在使用钱必须接种于斜
面培养基上,在一定条件下,进行培养,以恢复
细胞的生命活动能力。
❖ 3)扩大培养:活化了的菌种,一般还要经一级 至数级的扩大培养。
❖ 4)分离纯化:发酵结束后得到的酶可能含有一些杂
❖ 蛋白酶广泛存在于动物内脏、植物茎叶、果 实和微生物中。微生物蛋白酶,主要由霉菌、 细菌,其次由酵母、放线菌生产。
二、酶发酵的方式
❖ 1、固体培养发酵 ❖ 2、液体深层发酵 ❖ 3、固定化细胞或固定化原生质体发酵
三、各种发酵方式发酵模式:
❖1、固定培养发酵:
❖ 以麸皮、米糠等为培养基的主要原料,加入 其它必需的营养成分而制成的固体或半固体 的麦曲,经灭菌、冷却后,接入产酶菌株, 在一定条件下,发酵产酶。
❖ 1、从菌种保存机构和有关研究部门获得 ❖ 2、通过筛选获得
五、培养基的配制
❖ 枯草杆菌ASL.398中性蛋白酶发酵培养基:
❖ 玉米粉8%,豆饼粉4%,麸皮3.2%,米 糠1%,磷酸氢二钠0.4%,磷酸二氢钠 0.03%.
六、发酵工艺流程
保藏菌种 菌种活化 种子扩大培养
发酵 分离纯化
酶
七、剖析:
质,所以需要进一步分离杂质,纯化目标酶。
八、蛋白酶的应用
❖ 蛋白酶已广泛应用在皮革、毛皮、丝绸、医药、食 品、酿造等方面 。eg:皮革工业的脱毛和软化已大 量利用蛋白酶,既节省时间,又改善劳动卫生条件。 蛋白酶还可用于蚕丝脱胶、肉类嫩化、酒类澄清。 临床上可作药用,如用胃蛋白酶治疗消化不良,用 酸性蛋白酶治疗支气管炎,用惮性蛋白酶治疗脉管 炎以及用胰蛋白酶、胰凝乳蛋白酶对外科化脓性创 口的净化及胸腔间浆膜粘连的治疗。加酶洗衣粉是 洗涤剂中的新产品,含碱性蛋白酶,能去除衣物上 的血渍和蛋白污物,但使用时注意不要接触皮肤, 以免损伤皮肤表面的蛋白质,引起皮疹、湿疹等过 敏现象。
酶学-蛋白酶

蛋白酶
成员:杨超越 李星宇 舒皓钰 王睿飞 徐也甜 李锐涛
蛋白酶
蛋白酶是水解蛋白质肽链的一类酶的总称。到本
世纪初,已经报导的微生物蛋白酶估计超过900
种,生物体的生理活动和疾病的发生,如食物之
消化吸收、血液之凝固、溶血作用、炎症、血压
调节、细胞分化自溶、机体衰老、癌症转移、生
蛋白酶的应用
蛋白酶在烘焙中的应用
蛋白酶的作用机理
蛋白酶能作用于蛋白质和多肽形成多肽 和氨基酸。完好的面粉中蛋白酶活力很 低,制作面包时添加蛋白酶会使面团中 多肽和氨基酸含量增加,氨基酸是形成 香味物质的中间产物,多肽则是潜在的 滋味增强剂、氧化剂、甜味剂或苦味剂。 蛋白酶种类不同,产生的羰基化合物也 不同,若蛋白酶中不含产生异味的脂酶, 适量添加有利于改替面包的香气。
2009年 以色列 用了4500磅的原料 在特拉维夫做了世界最大的鹰嘴豆泥 昭示自己正宗
黎巴嫩人表示不服, 2010年300大厨做了两倍的量 许多人围着大盘载歌载舞
2015年以色列本来打算做一个15吨的 后来因为安全问题而作罢。。。。。。。。
赋予我们食物想象的豆类 粉身碎骨后带来了更多的惊喜
老祖先赠予人类的实惠食物 滋养了中东地区来来去去的民族 文明的兴盛和交流让其传遍地中海各个领域 融入了中东各国人民的血液 在交错分裂的历史和政治图景中 又成为了各自民族想象和身份认同的一部分
内源蛋白酶对肉类食品滋味的影响
滋味是肉制品的重要感官特性之一,公认的基本味 觉有酸、甜、苦、咸和鲜。肉类食品的滋味物质主要有 游离氨基酸、肽、核苷酸和无机盐。 蛋白质的降解是氨基酸和肽形成的重要途径之一, 不同的肽与氨基酸具有不同的呈味特性,从而使肉呈现 不同的滋味。
16种微生物蛋白酶的生物信息学分析

16种微生物蛋白酶的生物信息学分析作者:富玉竹李欣李晔王斯德金丽华于然来源:《江苏农业科学》2020年第04期摘要:蛋白酶(protease)是以降解蛋白质为主的糖苷酶,具有丰富的多样性,在生物有机体中发挥着重要而又广泛的作用,具有广泛的研究和应用价值。
本研究采用ProtParam、ProtScale、SignalP 4.1 server和NPSA serve等生物信息学软件,对天蓝色链霉菌、普通拟杆菌、金黄色葡萄球菌、枯草杆菌等16种微生物蛋白酶的理化性质、蛋白结构、系统发生树和功能域等进行了分析。
结果表明:通过分析16种微生物蛋白酶的稳定性发现,金黄色葡萄球菌、唾液链球菌、短小芽孢杆菌、绿脓杆菌为不稳定蛋白;二级结构由α螺旋、β转角、无规则卷曲和延伸链等结构元件组成;除了节杆菌属、无乳链霉菌、普通拟杆菌、肠杆菌属具有信号肽,其余蛋白酶氨基酸序列不具有信号肽的特点。
可以推测出蛋白酶为非分泌性蛋白;只有绿脓杆菌和猪链球菌有跨膜结构,剩下其余几种微生物均没有跨膜结构。
具有2个蛋白功能域,分别为Peptidase S8 familyi、Fn3_5like domain。
关键词:微生物;蛋白酶;序列分析;生物信息学;理化性质;蛋白结构;信号肽中图分类号: S188+.3文献标志码: A文章编号:1002-1302(2020)04-0065-08基金项目:北京市自然科学基金(编号:2182019);北京市教育委员会项目(编号:1-PXM2018-014306-000057/7);国家自然科学基金青年科学基金(编号:51708005);北京电子科技职业学院重点课题(编号:2019-KXZ);北京市优秀人才资助(拔尖自然科学)(编号:2020Z002-002-KWT)。
作者简介:富玉竹(2000—),女,北京人,研究方向为酶与基因重组,E-mail:1002967685@;共同第一作者:李欣(1998—),女,北京人,研究方向为生物技术,E-mail:1217436404@。
蛋白酶

二、蛋白酶的用途
1、 用于食品发酵工业 酱油的酿造就是利用米曲霉分泌的蛋白酶分解原 料中的蛋白质,使其降解为胨、多肽、氨基酸, 生成色、香、味于一体的产品。也有直接用蛋白 酶制剂酿造酱油,但风味欠佳。啤酒酿造中,当 麦芽糖用量减少辅料增加时,常需要补充蛋白酶, 使蛋白质充分降解,霉菌和细菌蛋白酶适合这一 用途。微生物酸性蛋白酶还是有效的啤酒澄清剂。 鱼露是鲜鱼加 25%-30%食盐自然发酵 6-12 个月 而成,若添加少许霉菌蛋白酶可缩短发酵时间, 提高风味。
2 用于制革生产 制革的原料皮中纤维蛋白是皮革的有用成分,此 外还有不少非纤维状的蛋白存在于纤维间隙和表皮中, 这些蛋白含量虽少,若不去除,成品皮革僵硬而脆。 蛋白酶不能分解天然胶原,而只能分解间质蛋白,因 而可用于制革工艺,国内生产的中性和碱性蛋白酶制 剂均可用于酶法脱毛。
3 制造明胶和可溶性胶原纤维 工业上用石灰水浸去皮、骨等原料中 的油脂与杂蛋白等,此工艺耗时长达 数月,劳动强度大,出胶率低而且能 耗大,用蛋白酶净化胶原,明胶纯度 高,质量好,相对分子质量均匀,分 子排列整齐,生产周期短,明胶收率 高,几乎达 100%。
●按酶的来源可以分为:
动物蛋白酶、植物蛋白酶、微生物蛋白酶 微生物蛋白酶又可分为细菌蛋白酶、霉菌蛋白酶、 酵母蛋白酶和放线菌蛋白酶。 ●按蛋白酶作用的最适 pH 可以分为 pH2.5-5.0 的酸 性蛋白酶、pH9.5-10.5 的碱性蛋白酶、pH7-8 的中 性蛋白酶。 ●为了方便起见,微生物蛋白酶常用这种分类方法; 根据蛋白酶的活性中心和最适反应 pH 可以分为丝氨 酸蛋白酶、巯基蛋白酶、金属蛋白酶和活性中心有 两个羧基的酸性蛋白酶。
4 预处理羊毛低温染色
羊毛用高温染色,会使毛的强度受到 损害,且易造成纤维毡化收缩和毛体竖 起,用蛋白酶处理后的羊毛,在沸点下 染色,2min 的上色率可达100%,成品 色泽鲜艳,手感丰满,废水中燃料含量 大大降低。
微生物酶分类

1 微生物酶的分类、作用机理及来源1.1淀粉酶。
淀粉酶是能够分解淀粉糖苷键的一类酶的总称,包括α-淀粉酶、β-淀粉酶、糖化酶和异淀粉酶。
α-淀粉酶又称淀粉1,4-糊精酶,能够切开淀粉链内部的α-1,4-糖苷键,将淀粉水解为麦芽糖、含有6个葡萄糖单位的寡糖和带有支链的寡糖。
生产此酶的微生物主要有枯草杆菌、黑曲霉、米曲霉和根霉。
β-淀粉酶又称淀粉1,4-麦芽糖苷酶,能够从淀粉分子非还原性末端切开1,4-糖苷键,生成麦芽糖。
此酶作用于淀粉的产物是麦芽糖与极限糊精。
此酶主要由曲霉、根霉和内孢霉产生。
糖化酶又称淀粉α-1,4-葡萄糖苷酶,此酶作用于淀粉分子的非还原性末端,以葡萄糖为单位,依次作用于淀粉分子中的α-1,4-糖苷键,生成葡萄糖。
此酶作用于支链淀粉后的产物有葡萄糖和带有α-1,6-糖苷键的寡糖;作用于直链淀粉后的产物几乎全部是葡萄糖。
此酶产生菌主要是黑曲霉(左美曲霉、泡盛曲霉)、根霉(雪白根酶、德氏根霉)、拟内孢霉、红曲霉。
异淀粉酶又称淀粉α-1,6-葡萄糖苷酶、分枝酶,此酶作用于枝链淀粉分子分枝点处的α-1,6-糖苷键,将枝链淀粉的整个侧链切下变成直链淀粉。
此酶产生菌主要是嫌气杆菌、芽孢杆菌及某些假单孢杆菌等细菌。
1.2蛋白酶。
蛋白酶系催化分解蛋白质肽键的一群酶的总称,它作用于蛋白质,将其分解为蛋白胨、多肽及游离氨基酸。
此酶种类繁多,广泛存在于所有生物体内,按其来源可分为植物蛋白酶、动物蛋白酶、微生物蛋白酶(又可分为细菌蛋白酶、放线菌蛋白酶、霉菌蛋白酶等);按其作用形式可分为肽链内切酶、肽链外切酶;按所产蛋白酶性能分为酸性蛋白酶、霉菌蛋白酶酶、中性蛋白酶、碱性蛋白酶。
酸性蛋白酶(最适pH=2~5)产生菌主要是黑曲霉、米曲霉、根霉、微小毛霉、似青霉、青霉、血红色螺孔菌等的某些种;中性蛋白酶(最适pH=7~8)产生菌主要是枯草杆菌、巨大芽孢杆菌、腊状芽孢杆菌、米曲霉、栖土曲霉、灰色链霉菌、微白色链霉菌、耐热性解蛋白质杆菌等;碱性蛋白酶(最适pH=9~11)主要产生菌为枯草杆菌、腊状芽孢杆菌、米曲霉、栖土曲霉、灰色链霉菌、镰刀菌等。
蛋白酶整理

一、蛋白酶的分类、主要用途及作用二、产蛋白酶菌株的筛选三、产酶发酵四、蛋白酶活性测定的方法蛋白酶的分类、主要用途及作用酶:酶是具有生物催化功能的生物大分子。
蛋白酶:水解蛋白质肽键的一类酶的总称蛋白酶分类:1据水解多肽的方式分为内肽酶和外肽酶2据反应的最适pH值分为酸性,碱性,中性蛋白酶蛋白酶简介:广泛存在于动物内脏、植物茎叶、果实和微生物中。
微生物蛋白酶,主要由霉菌、细菌,其次由酵母、放线菌生产。
催化蛋白质水解的酶种类很多,重要的有胃蛋白酶、胰蛋白酶、组织蛋白酶、木瓜蛋白酶和枯草杆菌蛋白酶等。
蛋白酶对所作用的底物有严格的选择性,一种蛋白酶只能作用于蛋白质分子中一定的肽键,如胰蛋白酶催化水解碱性氨基酸所形成的肽键。
蛋白酶分布广泛,主要存在于人和动物消化道中,在植物和微生物中含量丰富,由于动植物资源有限,工业生产上生产蛋白酶制剂主要利用枯草杆菌等微生物发酵设备。
一、酸性蛋白酶定义:酸性蛋白酶是一种能在酸性环境下水解蛋白质的酶类注:酸性蛋白酶是指蛋白酶具有较低的最适pH,不是指酸性基团存在于酶的活性部位.简介:主要来源于动物的脏器和微生物分泌物,包括胃蛋白酶、凝乳酶和一些微生物蛋白酶。
根据其产菌的不同,微生物酸性蛋白酶可以分为霉菌酸性蛋白酶、酵母菌酸性蛋白酶和担子菌酸性蛋白酶,根据作用方式可以分为两类:一类是与胃蛋白酶相似,主要的产酶微生物是曲霉、青霉和根酶等;另一类是与凝乳酶相似,主要产酶微生物是毛酶和栗疫酶等,从酶的活力-PH曲线分析,在酶的活性部位中含有一个或更多的羧基,这一类蛋白酶中研究最彻底的是胃蛋白酶。
酸性蛋白酶具有较好的耐酸性,目前用于工业化生产的酸性蛋白酶大多为霉菌酸性蛋白酶,此类酶的最适作用pH值为3.0左右,当pH值升高时,酸性蛋白酶的酶活会明显降低,且此类酶不耐热,当温度达到50℃以上时很不稳定,从而限制了酸性蛋白酶的应用范围。
基本性质酸性蛋白酶的最适PH从2左右(胃蛋白酶)到4左右应用1酿酒:酸性蛋白酶在酿酒的过程中起协同作用,具有溶解发酵原料,促进微生物繁殖,降解酵母菌体蛋白等多种功能。
国家食品级蛋白酶名录

国家食品级蛋白酶名录国家食品级蛋白酶名录是一个有关于食品级蛋白酶的清单,其中列出了一些被允许在食品加工过程中使用的蛋白酶。
这些酶可以用于改善食品的质量、品质、口感和营养价值,在食品行业中具有重要的应用价值。
国家食品级蛋白酶名录中列出的蛋白酶主要分为两类:动物源蛋白酶和微生物源蛋白酶。
下面是一些常见的国家食品级蛋白酶名录中的酶。
1. 动物源蛋白酶:1.1 胃蛋白酶:胃蛋白酶是从动物的胃腺中提取得到的酶,可以在食品加工中用于催化蛋白质的降解和水解。
它对肉类、乳制品、蛋制品等食品的加工具有重要的意义。
1.2 胰蛋白酶:胰蛋白酶是从动物胰腺中提取得到的酶,可以用于面粉、淀粉、肉制品等食品的加工中,有助于改善食品的纹理、口感和营养价值。
2. 微生物源蛋白酶:2.1 纤维素酶:纤维素酶是一类用于降解纤维素的酶,可以用于果汁、蔬菜汁等食品加工中,可以帮助提高果汁的浓度、口感和品质。
2.2 蛋白酶:蛋白酶是一类具有蛋白质降解活性的酶,可以用于乳制品、酱料、肉制品等食品的加工中,可以改善食品的质地、溶解性和口感。
这些蛋白酶在食品加工过程中起到促进反应、改善食品质量和口感的作用。
它们可以促进蛋白质的降解和水解,使得食品更容易被消化吸收,提高食品的营养价值。
同时,它们也可以改变食品的纹理、质地和口感,增加食品的口感和风味。
然而,尽管国家食品级蛋白酶名录中列出了一些被允许在食品加工中使用的酶,但仍然需要严格控制其使用的剂量和使用条件。
因为过量使用蛋白酶可能会破坏食品的结构和品质,造成食品变质或安全问题。
总之,国家食品级蛋白酶名录是一个列出了在食品加工过程中允许使用的蛋白酶清单。
这些蛋白酶可以帮助改善食品的质量、品质、口感和营养价值。
但是,在使用蛋白酶时需要遵循严格的使用剂量和使用条件,以确保食品的安全性和品质。
62蛋白酶

大豆肽已广泛使用于饮料、点心、及各种食品中。 推荐摄取量是每日4000mg。
1.大豆多肽的理化性质
(1) 溶解性
2) 黏度
大豆蛋白质的黏度是随着浓度的增加而增加,而大豆肽即使在很 高的浓度状态下,仍可以保持较低的黏度。
中性蛋白酶
生产菌种
枯草杆菌、耐热解蛋白芽孢杆菌、灰色链霉菌、寄生曲霉、米曲 霉
性质
(1)大多数微生物中性蛋白酶是金属酶,一部分酶蛋白总含有一 个锌离子,相对分子质量3500~40000,等电点在pH8~9 ,是微 生物蛋白酶中最不稳定的酶,很易自溶,即使在低温冰冻干燥的条 件下,也会造成相对分子质量的明显减少。
—CHR′—COO- + +NH3—CHR″—
C. 氨基的滴定 +NH3—CHR″— + OH-
NH2—CHR″— + H2O
蛋白质水解度测定原理
当肽键被水解裂开后,紧接着在羧基和α–氨基之间产生 质子交换作用。当蛋白质酶解过程在pH6.5以上进行时, 质子化的氨基酸将离解。
如果要保持反应体系pH不变,就必须加入碱液。
加蛋白酶 水解 氨基酸产品
氨基
• 前处理
一般采用热处理的方法,也可采取生化分离技术将 蛋白质先提取出来,再进行酶解。
2、明胶的生产
原料 动物的皮或骨 生产方法
酸法或碱法,也可用蛋白酶水解法生产。 酶法生产明胶的工艺流程如下:
原料 切割、捣碎 水洗 加酶水解 除酶 炭处理 过滤 干燥 明胶产品
溶解性、乳化性、起泡性、粘度、风味等 应用广泛
蛋白酶的作用及种类都有哪些

蛋⽩酶的作⽤及种类都有哪些 蛋⽩酶存在于动物的肝脏,植物的茎叶和果实等等,蛋⽩酶的作⽤是很多的,下⾯是店铺为⼤家带来的蛋⽩酶的作⽤及种类,欢迎阅读。
蛋⽩酶的作⽤ 蛋⽩酶是⽔解蛋⽩质肽链的⼀类酶的总称。
按其降解多肽的⽅式分成内肽酶和端肽酶两类。
前者可把⼤分⼦量的多肽链从中间切断,形成分⼦量较⼩的朊和胨;后者⼜可分为羧肽酶和氨肽酶,它们分别从多肽的游离羧基末端或游离氨基末端逐⼀将肽链⽔解⽣成氨基酸 蛋⽩酶的种类 ⽊⽠蛋⽩酶 ⽊⽠蛋⽩酶,是⼀种蛋⽩⽔解酶,可将抗体分⼦⽔解为3个⽚段。
是番⽊⽠中含有的⼀种低特异性蛋⽩⽔解酶,活性中⼼含半胱氨酸,属巯基蛋⽩酶,应⽤于啤酒及⾷品⼯业。
⽊⽠蛋⽩酶是⼀种巯基蛋⽩酶,具有⼴泛的底物特异性蛋⽩质精氨酸的作⽤,L-赖氨酸精氨酸、⽢氨酸、L-⽠氨酸残基的羧基参与形成的肽键。
这种酶属内肽酶,能把整个鸡蛋的蛋⽩多肽分⼦肽-NH-分⼦量较⼩的代。
⽊⽠蛋⽩酶是⼀种在酸性、中性、碱性环境下均能分解蛋⽩质的蛋⽩酶。
它的外观为⽩⾊⾄浅黄⾊的粉末,微有吸湿性。
⽊⽠蛋⽩酶(Papain)简称⽊⽠酶,⼜称为⽊⽠酵素。
是利⽤未成熟的番⽊⽠(Carica papaya)果实中的乳汁,采⽤现代⽣物⼯程技术提炼⽽成的纯天然⽣物酶制品。
它是⼀种含疏基(-SH)肽链内切酶,具有蛋⽩酶和酯酶的活性,有较⼴泛的特异性,对动植物蛋⽩、多肽、酯、酰胺等有较强的⽔解能⼒,同时,还具有合成功能,能把蛋⽩⽔解物合成为类蛋⽩质。
溶于⽔和⽢油,⽔溶液⽆⾊或淡黄⾊,有时呈乳⽩⾊;⼏乎不溶于⼄醇、氯仿和⼄醚等有机溶剂。
最适合PH值6~7(⼀般3~9.5皆可),在中性或偏酸性时亦有作⽤,等电点(pI)为8.75;最适合温度55~65℃(⼀般10~85℃皆可),耐热性强,在90℃时也不会完全失活;受氧化剂抑制,还原性物质激活。
胃蛋⽩酶 胃蛋⽩酶是⼀种消化酶,在细胞的主要功能是胃粘膜的胃分泌的⾷物中的蛋⽩质分解为⼩肽⽚段。
酶制剂复习题

1、酶的比活力答:每毫克(毫升)酶蛋白中含有的酶活力单位数(U/mg)/(U/ml)。
2、提取分离法(产酶技术)答:提取分离法是采用各种提取、分离、纯化技术从天然的动植物的组织、器官、细胞或微生物细胞中将酶提取出来,再进行分离纯化的过程。
3、酶的抽提答:指在一定的条件下,用适当的溶剂或溶液处理含酶原料,使酶充分溶解到溶剂或溶液中的过程,也称为酶的提取。
4、原生质体答:即脱去细胞壁的细胞,指在人工条件下用溶菌酶除尽原有细胞壁或用青霉素抑制细胞壁的合成后,所留下的仅由细胞膜裹着的圆球状渗透敏感细胞。
5、菌种活化答:保藏的菌种处于休眠状态,使用之前必须接种于新鲜的斜面培养基上,在一定的条件下进行培养以恢复细胞的生命活动。
6、酶的膜分离技术答:指借助一定孔径的高分子薄膜,将不同大小、不同形状和不同特性的多组分的溶质或溶剂进行分离或浓缩的技术。
7、酶的固定化答:指借助物理或者化学的方法将酶固定于特殊的相,使得酶与整体流体分开,但是仍然能够进行底物和效应物分子交换并发挥其催化效能的一种技术。
8、电泳答:带电粒子在电场中向着与其本身所带电荷相反的电极移动的过程。
9、酶的修饰答:通过各种方法使酶分子的结构发生某些改变,从而改变酶的某些特性和功能的技术过程。
10、酶的保鲜技术答:利用酶的催化作用,防止或消除各种外界因素对食品产生的不良影响,从而保持食品原有的优良品质和风味特色的技术。
11、酶的浓缩答:经发酵或细胞破碎、抽提等步骤后,所得发酵液或提取液中酶蛋白浓度很低,须进一步从低浓度的酶溶液中除去部分的水或其他有机溶剂而成为高浓度溶液的过程。
12、酶的层析分离技术答:也叫色谱分离,是利用混合物中各组分的物理化学性质(分子的大小、形状、分子极性、吸附力、分子亲和力和分配系数等)的不同使各组分在两相(固定相与流动相)中的分布程度不同而使各组分得以分离的方法。
1、具有酶催化活性的蛋白质按其组成可分为和两类。
单纯蛋白质、结合蛋白质2、根据酶催化的化学反应性质,分为六大类:氧化还原酶、、、、、。
蛋白酶的生产和应用
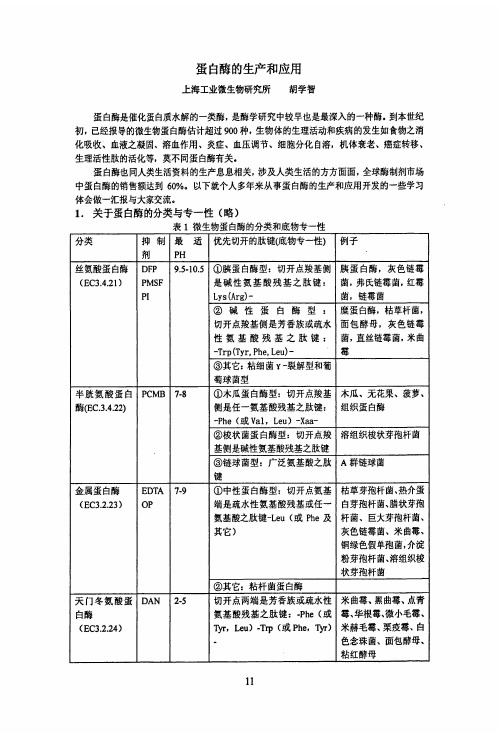
注:PFP.二异丙基磷酰氟 甲基磺酰氟 Ph 马铃薯蛋白酶抑制剂 EDTA:乙二胺四乙酸
PCMB:对氯汞苯甲酸 PMSF."苯 DAN:重氮乙酰正.DL.亮氨酸甲酯 OP:郯二氮杂菲)(菲绕啉)
2.关于微生物蛋白酶的生产
蛋白酶是用途最广泛的酶制剂之一,主要用于洗涤剂,制革、毛皮、蛋白水解物、酿酒、 酱油,以及纺织、医药品、化妆品等的生产上。全球蛋白酶的销售额占酶制剂市场的60%, 我国2005 年全国(外资合资企业不计)微生物酶制剂产量约48 万吨,总销售额约20 亿 人 民币,其中蛋白酶约10 万吨,销售额近9 亿人民币。
食品、饲料加工
蛋白质水解、脱苦、调味液
食品饲料加工
动植物蛋白水解、面包、发酵食品
面包制造
。·
动植物蛋白水解、调味液
弱碱性蛋白酶、调味液
水解蛋白质
Actinase(科研医药)
灰色链霉菌
试剂、食品加工、医药
13
Pantiase NP-2(Yokult)
酸性蛋白酶: SumizymeAP(新日本) Sumizyme RP(新日本) Molsin(Seishin 制药) Neulase F(天野)
奶酪制造
3.蛋白酶的利用 蛋白酶的用途非常广泛(表3),最大的用户是洗涤剂,其次用于饲料、食品工业、酿
酒酿造,以及制革工业和医药。
用途
说明
表3 蛋白酶的用途
干酪制造
凝固酪蛋白,缩短成熟时间 酱油酿造
预处理大豆,提高蛋白质利用率 天然调
味液制造
水解蛋白质,增强风昧,制HVP、HAP
酒精,酿酒
水解蛋白质,促进酵母发酵
啤酒澄清 酿醋
分解啤酒单宁蛋白沉淀,延长保质期 缩短酿醋周期,增加食醋得率
微生物发酵生产蛋白酶

妥善保存,才能保证其产酶特性不异、不死亡、
不被杂菌污染。
❖ 2)菌种活化:产酶菌种在使用钱必须接种于斜
面培养基上,在一定条件下,进行培养,以恢复
细胞的生命活动能力。
❖ 3)扩大培养:活化了的菌种,一般还要经一级 至数级的扩大培养。
❖ 4)分离纯化:发酵结束后得到的酶可能含有一些杂
微生物发酵生产 蛋白酶
一、蛋白酶
❖ 定义:催化蛋白质中肽键水解的酶。根据酶 的活性中心起催化作用的基团属性,可分为: 丝氨酸/苏氨酸蛋白酶(编号:EC 3.4.21.-/EC 3.4.25.-)、巯基蛋白酶(编号:EC 3.4.22.-).、金 属蛋白酶(编号:EC 3.4.24.-)和天冬氨酸蛋白酶 (编号 :EC 3.4.23.-)等。
❖ 1、从菌种保存机构和有关研究部门获得 ❖ 2、通过筛选获得
五、培养基的配制
❖ 枯草杆菌ASL.398中性蛋白酶发酵培养基:
❖ 玉米粉8%,豆饼粉4%,麸皮3.2%,米 糠1%,磷酸氢二钠0.4%,磷酸二氢钠 0.03%.
六、发酵工艺流程
保藏菌种 菌种活化 种子扩大培养
发酵 分离纯化
酶
七、剖析:
❖ 蛋白酶广泛存在于动物内脏、植物茎叶、果 实和微生物中。微生物蛋白酶,主要由霉菌、 细菌,其次由酵母、放线菌生产。
二、酶发酵的方式
❖ 1、固体培养发酵 ❖ 2、液体深层发酵 ❖ 3、固定化细胞或固定化原生质体发酵
三、各种发酵方式发酵模式:
❖1、固定培养发酵:
❖ 以麸皮、米糠等为培养基的主要原料,加入 其它必需的营养成分而制成的固体或半固体 的麦曲,经灭菌、冷却后,接入产酶菌株, 在一定条件下,发酵产酶。
蛋白酶的分类及作用位点

蛋白酶的分类及作用位点蛋白酶是一类催化剂,能够降低化学反应的活化能,从而加速蛋白质的降解或转化过程。
根据催化反应的机制和作用位点的不同,蛋白酶可以分为多个分类。
1.依据催化反应机制的分类:- 氨基酸酶(proteases):通过水解蛋白质的肽连接,一般会将酸、碱或巯基作为催化剂。
- 氧化还原酶(redox enzymes):通过氧化还原反应来降解蛋白质,例如谷胱甘肽过氧化物酶(glutathione peroxidase)。
- 转移酶(transferases):通过将化学团转移到底物上来改变其性质,例如激酶(kinases)和磷酸酶(phosphatases)。
- 合成酶(ligases):通过将底物合并成一个新的化学物质来催化反应,例如DNA连接酶(DNA ligase)。
2.依据作用位点的分类:- 内切酶(endonucleases):在蛋白质内部剪切多肽链,例如胰蛋白酶(trypsin)和胃蛋白酶(pepsin)。
- 外切酶(exonucleases):从蛋白质的末端剪切多肽链,例如组氨酸蛋白酶(histidine protease)。
- 脂联素酶(lipase):水解脂肪酸酯,例如胃脂肪酶(gastric lipase)和胰脂肪酶(pancreatic lipase)。
- 软酶(soft enzyme):对底物没有特定位点要求,例如粗蛋白酶(pepsin)。
除了以上的分类,蛋白酶还可以按照其发现地点或用途进行分类:- 溶酶体蛋白酶(lysosomal protease):位于细胞溶酶体内,用于内吞体的降解。
- 细胞质蛋白酶(cytoplasmic protease):位于细胞质内,参与细胞内的蛋白质合成和降解过程。
- 胰蛋白酶(pancreatic protease):主要存在于胰腺内,用于分解摄入的蛋白质,促进消化和吸收。
- 血浆蛋白酶(plasma protease):存在于血浆中,参与血液凝固和炎症反应等生理过程。
微生物酶制剂种类

微生物酶制剂种类微生物酶制剂是一种利用微生物产生的酶来进行工业生产的一种方法。
它由微生物菌种培养和酶的提取工艺组成,常用于食品、医药、环境保护等领域。
根据不同的酶种类和应用领域的需求,微生物酶制剂可以分为多种类型。
1. 淀粉酶制剂淀粉酶制剂是一种常见的微生物酶制剂,它可以将淀粉分解为糖类物质,进一步用于酿酒、发酵等工艺中。
常见的淀粉酶制剂包括α-淀粉酶、β-淀粉酶、γ-淀粉酶等。
2. 蛋白酶制剂蛋白酶制剂是一种能够分解蛋白质的酶制剂,常用于食品加工、洗涤剂、皮革加工等领域。
蛋白酶制剂可以将蛋白质分解为氨基酸,从而改善产品的质地和口感,提高产品的降解性能。
3. 脂肪酶制剂脂肪酶制剂是一种能够分解脂肪的酶制剂,常用于食品加工、清洁剂、生物柴油等领域。
脂肪酶制剂可以将脂肪分解为甘油和脂肪酸,从而提高产品的溶解性和降解性能。
4. 纤维素酶制剂纤维素酶制剂是一种能够分解纤维素的酶制剂,常用于纺织品、造纸、生物质能源等领域。
纤维素酶制剂可以将纤维素分解为葡萄糖和纤维素醇,从而提高纤维素的可利用性和降解性能。
5. 聚糖酶制剂聚糖酶制剂是一种能够分解多糖类物质的酶制剂,常用于食品加工、医药、化妆品等领域。
聚糖酶制剂可以将多糖类物质分解为单糖,从而提高产品的溶解性和降解性能。
6. 果胶酶制剂果胶酶制剂是一种能够分解果胶的酶制剂,常用于果汁饮料、果酱、果冻等食品加工领域。
果胶酶制剂可以将果胶分解为果胶酸和低聚果胶,从而提高产品的质地和口感。
7. 木聚糖酶制剂木聚糖酶制剂是一种能够分解木聚糖的酶制剂,常用于纸浆、造纸、纺织品等领域。
木聚糖酶制剂可以将木聚糖分解为木糖和低聚木糖,从而提高木质纤维的可利用性和降解性能。
8. 脱氢酶制剂脱氢酶制剂是一种能够催化氧化还原反应的酶制剂,常用于生物化学合成、制药工艺等领域。
脱氢酶制剂可以将底物氧化或还原,从而实现特定化学反应的进行。
总结起来,微生物酶制剂种类繁多,根据不同的酶种类和应用领域的需求,可以选择适合的酶制剂来提高产品的性能和降解性能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6)蛋白酶的IgA家族:核酸序列分析表明酶以大的前体 形式存在,它有三个结构域,即N末端前肽,蛋白酶, 和C末端”协助“肽。这些酶前体的前肽部分(信号肽) 作用是帮助酶的跨膜转运。
2.真菌:
丝状真菌 1)酸性蛋白酶:毛霉属和根霉属大量分 泌asp蛋白酶。2)碱性蛋白酶 :曲霉菌属,支顶胞 属,镰刀菌属 分泌碱性蛋白酶。3)丝氨酸蛋白酶: 蛋白酶K是真菌分泌的丝氨酸外肽酶。4)金属蛋白 酶: 酵母:1)酸性蛋白酶:酿酒酵母的PEP4基因编码 一种asp蛋白酶,是一种翻译后调控的酵母液泡水解 酶。2)碱性蛋白酶 3)丝氨酸蛋白酶
三. 蛋白酶的应用
Proteases have a large variety of applications, mainly in the detergent and food industries. In view of the recent trend of developing environmentally friendly technologies, proteases are envisaged to have extensive applications in leather treatment and in several bioremediation processes.
1.蛋白更新:例如大肠杆菌中,ATP依赖性蛋白 酶负责非正常蛋白的水解。真核生物胞内蛋白酶 的更新也受到ATP依赖性蛋白酶的影响。
2.芽孢和孢子释放:用蛋白酶抑制剂证实芽孢形成需 要蛋白酶。提高蛋白酶A的活性与酵母二倍体子囊孢 子的形成有关。 3.休眠孢子的萌发:休眠孢子中,丝氨酸内肽酶降解 蛋白质生成的氨基酸和氮为新蛋白质和核苷酸类的生 物合成提供原料。
外肽酶分Aminopeptidase和carboxypeptidase。 氨肽酶多为胞内酶,广泛存在于细菌和真菌 中。它从多肽链N端水解下一个氨基酸残基, 二肽或是三肽。 羧肽酶作用于多肽链的C端,水解下一个氨 基酸或是二肽。据酶活性位点氨基酸残基的 特点,可将羧肽酶分为:丝氨酸羧肽酶,金属 羧肽酶,半胱氨酸羧肽酶。
八. 蛋白酶的序列同源性及进化关系
• 测定蛋白酶核苷酸和氨基酸序列—对比– 阐明结
构和功能关系。 例如在四种中性蛋白酶中,17个残基的氨基酸序 列(包括活性位点his)高度保守,表明其活性位 点有共同的三维结构。 活性部位等。
•
• 同源性与许多因素有关,如结构,功能,来源,
• 序列同源性越高,表明进化关系越近。
Plant Proteases
Animal Proteases
胰蛋白酶 Trypsin (丝氨酸蛋白酶,水解lys, arg羧基形成的肽键) 糜蛋白酶 Chymotrypsin (水解 phe,try,
tyr 羧基形成的肽键)
木瓜蛋白酶 Papain (最适pH5~9)
菠萝蛋白酶 Bromelain ( 最适pH5~9)
2.天冬氨酸蛋白酶:通过晶体结构分析可得出催 化特异性。酸碱催化分析得出活性位点有Asp-ThrGly基团。
3. 金属蛋白酶:X射线晶体结构分析得出,其活性依 赖于一个二价金属离子(通常是锌离子)结合到HisGlu-Xaa-Xaa-His基团。金属蛋白酶活性可因透析或加 入螯合物而失掉。
4. 半胱氨酸蛋白酶:植物中木瓜蛋白酶被认为是半胱 氨酸蛋白酶的原始类型和这类酶的很好例子。它们催 化肽,巯基酯和硫羰基酯键的水解。水解机制与丝氨 酸蛋白酶非常相似。
• 酸性蛋白酶最佳pH4~4.5,用于奶酪制作行业。
• 中性蛋白酶是金属蛋白酶,在pH为7时有活性,可 被螯合物抑制。用于食品行业中蛋白脱苦。
• 碱性蛋白酶也用于食品中蛋白的改造。
病毒蛋白酶
• 已经发现多种病毒中含ser,asp,cys蛋白酶。主 要用于病毒自身蛋白的加工。所有病毒编码的都 是内肽酶,无金属蛋白酶。
4)假单胞菌属 :P. aeruginosa分泌两种蛋白酶,一种 碱性蛋白酶和弹性蛋白酶。菌株PAO1的编码碱性蛋白 酶基因片段在启动子tac控制下可在大肠杆菌中表达。
5)大肠杆菌:1>膜蛋白酶:跨膜蛋白酶以一个大的前 体形式存在,它的氨基末端有信号肽。前体的加工包括 两个连续的过程,一是通过内切将信号肽去掉。二是消 化切去的信号肽。2>ATP依赖的蛋白酶:大肠杆菌中有三 个家族,细胞提取物的体外分析表明主要的ATP依赖活 性是lon蛋白酶。
五.蛋白酶的生理学功能
In general, extracellular proteases catalyze the hydrolysis of large proteins to smaller molecules for sub-sequent absorption by the cell whereas intracellular proteases play a critical role in the regulation of metabolism.
• 中性蛋白酶最适pH5~8,耐热性相对较低。一些 中性蛋白酶是金属蛋白酶,其活性需金属二价离 子;而一些是丝氨酸蛋白酶,不受螯合物影响。
• 碱性蛋白酶最适pH为碱性,有很宽的底物特异性。 广泛用于洗涤工业。
真菌蛋白酶
• 真菌产蛋白酶多于细菌。eg: Aspergillus oryzae (米曲霉)产生酸性,中性,碱性蛋白酶。但是真 菌蛋白酶的反应速率和耐热性都低于细菌。
胃蛋白酶激活或自我催化 凝乳酶原——————————————凝乳酶
5.细胞营养:蛋白酶水解较大肽链为小肽和氨基酸, 有助于被细胞吸收。胞外酶由于脱聚合化活性在细 胞营养中占重要作用。
6.基因表达调控:ATP依赖性蛋白酶有新的生理学 功能,可作为蛋白分子伴侣,介导蛋白水解,蛋白 络合物的分解和聚合化。此外,蛋白酶还介导许多 调节蛋白的分解。
微生物蛋白酶的分子和生 物技术方面的概述
Molecular and Biotechnological Aspects of Microbial Proteases
汇报人:马纳纳
2012年9月20日
PROTEASES
1.来源 1.动力学机制
2.分类
2.生理学功能 3.应用
1. 基 因 改 造 2.蛋白质工程 3.序列同源性 及进化关系
角蛋白酶 Keratinases (降解毛发等)
胃蛋白酶
Pepsin
(最适 pH1~2,水解位点 在两个疏水 氨基酸之间)
凝乳酶
Rennin
(类似胃蛋白酶,特异
切割k-酪蛋白的单一肽键)
Microbial Proteases
细菌蛋白酶
真菌蛋白酶
病毒蛋白酶
细菌蛋白酶
• 主要为芽蛋白酶的来源
• 蛋白酶来源广,数量多,用途广。 • 蛋白酶是重要工业酶之一,约占世界范围酶总量的 60%。
• 根据蛋白酶来源,可将其分为植物蛋白 酶(Plant Proteases),动物蛋白酶 (Animal Proteases),微生物蛋白酶 (Microbial Proteases)。
• 研究最多的是逆转录病毒的天冬氨酰蛋白酶。它 是病毒组装和复制必须的,是病毒多聚蛋白前体 的一部分。前体经过自我催化成为成熟的蛋白酶。
二. 蛋白酶的分类
1.按作用部位分为
﹛
外肽酶 内肽酶
2.按活性部位的 功能基分为
丝氨酸蛋白酶 天冬氨酸蛋白酶 半胱氨酸蛋白酶 金属蛋白酶
外肽酶
3.病毒:研究最多的是逆转录病毒。基因有长末端
重复序列。
小结
研究目的
1. 有效提高蛋 白酶表达量 2. 研究某一基 因的表达调控 3. 某一基因的 同源性分析 4. 某一基因的 定位和定向
采用相应的策略
更换相应蛋白酶的强启动子。 克隆具高度同源性的基因,用基 因敲除和基因突变技术。 克隆和测定DNA序列,同源性分 析可找到共同祖先。 可通过基因敲除分析技术确定。
七. 蛋白质工程
• 快速发展归功于重组DNA技术和定点突变技
术。 • 两大主要任务:基因鉴定和蛋白三维结构分 析。 • 细菌中以枯草杆菌蛋白酶为例,二硫键的 引入增强了其热稳定性。 • 真菌中以天冬氨酸蛋白酶为例,用定点突 变技术对其活性部位asp76突变为ser,确定 此此酶的底物结合位点特异性。
4.酶的修饰:许多蛋白酶是以酶原的形式存在。 Kex-2蛋白酶是真核酶前体加工处理的典型。通过 特异性裂解羧基末端残基对,催化激素原和分泌途径 的完整膜蛋白的水解。
胰蛋白酶原
肠激酶 ———————— 胰蛋白酶
胰蛋白酶 胰凝乳蛋白酶原—————胰凝乳蛋白酶
疏水氨基酸存在下 胃蛋白酶原——————————自我催化为胃蛋白 酶
十. 蛋白酶未来发展前景
• 1.重组DNA快速测序技术使人们了解到更多的蛋 白酶序列信息。 • 2.更多的嗜极微生物蛋白酶得到关注。 • 3.更多关注聚集在蛋白酶对癌症,疟疾,AIDS等 人类致命疾病的治疗方面。
内肽酶
据催化机制可分为ser蛋白酶,asp蛋白酶, cys蛋白酶和金属蛋白酶。
1.Ser蛋白酶:其四个家族(糜蛋白酶简写SA,
枯草杆菌蛋白酶简写SB,羧肽酶C简写SC, 大肠杆菌D-Ala– D-Ala 肽酶A简写SE)基本 结构完全不相关,表明ser蛋白酶至少有四 个独立的进化来源。 Ser蛋白酶第一大亚类是ser碱性蛋白酶,底 物特异性与糜蛋白酶类似但没它严格。第二 大亚类是枯草杆菌蛋白酶,已发现两种,有 共同活性位点ser221,his64,asp32。
九.现存问题和解决方案
1.增强热稳定性:位点特异性突变技术引入 二硫键;用疏水氨基酸替换极性氨基酸。 2.防止蛋白自我水解:使自溶位点氨基酸产 生突变。 3.改变最佳pH:改变蛋白表面的总电荷量。 4.改变底物特异性:用位点特异性突变或重 组随机突变技术。 5.提高酶产量:用传统突变或重组DNA技 术筛选高产菌株;优化培养条件。
