猪瘟病毒蛋白与功能
非洲猪瘟病毒p30蛋白在杆状病毒表达系统中的表达与免疫检测

·研究论文·Chinese Journal of Animal Infectious Diseases中国动物传染病学报非洲猪瘟病毒p30蛋白在杆状病毒表达系统中的表达与免疫检测摘 要:p30蛋白是非洲猪瘟病毒(ASFV )免疫原性最强的结构蛋白之一,由CP204L 基因编码。
本研究利用Bac-to-Bac 昆虫杆状病毒真核表达系统将ASFV 中CP204L 插入pFastBac1载体下游,将形成的重组质粒pFastBac-p30以转座子的形式插入到DH10Bac 中的杆状病毒穿梭质粒(Bacmid )中,筛选出重组Bacmid-p30后,将Bacmid-p30转染Sf9细胞,并继续传代3次,获得重组杆状病毒,命名为rBac-p30。
分别通过间接免疫荧光(IFA )和免疫印迹(Western blot )鉴定了ASFV 阳性血清可特异性识别Sf9细胞中表达的p30。
以此真核表达p30蛋白包被ELISA 板,可区分ASFV 阴阳性血清。
以上结果表明,本研究初步建立了检测ASFV 血清抗体的间接ELISA 方法,为后续建立非洲猪瘟抗体检测方法和p30亚单位疫苗研究奠定基础。
关键词:非洲猪瘟病毒;p30蛋白;杆状病毒表达系统中图分类号:S852.65文献标志码:A文章编号:1674-6422(2023)04-0170-06Production and Immunological Detection of African Swine Fever Virus p30 byBaculovirus Expression SystemLIAO Xinxin 1,2, ZHONG Qiuping 2, SHI Xinjin 2, WEI Changqing 2, SUN Haiwei 2, LIU Yingnan 2,AO Qingying 2, XIE Zhenhua 2, WU Jing 1, CHEN Hongjun 2(1. Hunan Engineering Research Center of Livestock and Poultry Health Care, Colleges of V eterinary Medicine, Hunan Agricultural University,Changsha 410128, China; 2. Shanghai V eterinary Research Institute, CAAS, Shanghai 200241, China)收稿日期:2021-11-01基金项目:十三五国家重点研发专项资助项目(2018YFC08400400,2017YFD0502300);自然科学基金联合基金项目重点支持项目-区域创新发展联合基金项目(U19A2039)作者简介:廖欣欣,女,硕士研究生,临床兽医学专业通信作者:邬静,E-mail:****************.cn;陈鸿军,E-mail:***************.cn Abstract: The p30 protein encoded by CP204L gene is one of the most immunogenic structural proteins of African swine fever virus (ASFV). In this study, the Bac-to-Bac insect baculovirus eukaryotic expression system was used to insert CP204L in ASFV into the downstream of pFastBac1 vector, and the resulting recombinant plasmid pFastBac-p30 was inserted into Baculovirus shuttle plasmid (Bacmid) in DH10Bac as a transposon. After screening the recombinant Bacmid-P30 was transfected into Sf9 cells, and the recombinant Baculovirus rBac-p30 was obtained expression of p30 protein. Indirect immunofl uorescence (IFA) and Western blot were used to identify p30 expression in Sf9 cells by ASFV positive serum specifi city. The recombinant p30 protein was used to coat ELISA plates to distinguish positive and negative serum samples of ASFV . The development of an indirect ELISA method laid the foundation for further establishment of an ASFV antibody detection method and p30 subunit vaccine research.Key words: African Swine fever virus; p30 protein; baculovirus expression system2023,31(4):170-175廖欣欣1,2,钟秋萍2,史馨瑾2,魏常青2,孙海伟2,刘英楠2,敖清莹2,谢振华2,邬 静1,陈鸿军2(1.湖南农业大学动物医学院 畜禽保健湖南省工程研究中心,长沙410128;2.中国农业科学院上海兽医研究所,上海200241· 171 ·廖欣欣等:非洲猪瘟病毒p30蛋白在杆状病毒表达系统中的表达与免疫检测第31卷第4期非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的猪的一种热性、急性、高度接触性传染病[1]。
非洲猪瘟流行特点及临床检测

48 | 2020年第40卷第12期 总第287期 |非洲猪瘟流行特点及临床检测顾永远1,钱忠辉2,张华弟2,王瑞阳2,张春玲2*(1.上海市闵行区三农综合服务中心,上海 201109;2. 上海佳牧生物制品有限公司,上海201403)非洲猪瘟(Africa Swine Fever,ASF)是由非洲猪瘟病毒(Africa Swine Fever Virus,ASFV)引起的一种急性、出血性、烈性、高度接触性传染病,发病率高,死亡率高,可达100%,世界动物卫生组织将其列为必须报告的动物疫病,我国将该病列为一类动物疫病。
非洲猪瘟于1921年首次在非洲东部的肯尼亚地区暴发,之后在非洲大部分国家和地区流行。
在最初的几十年中,非洲猪瘟一直在非洲暴发,并未传播到其他洲。
直到1957年,非洲猪瘟在欧洲的葡萄牙被发现,之后开始在欧洲其他国家流行。
2007年,非洲猪瘟传入格鲁尼亚,很快侵入俄罗斯。
2018年8月,我国首例非洲猪瘟在辽宁省沈阳市暴发,之后在短短的一年时间内各个地区相继暴发,给养猪业带来了极大的经济损失,由此导致猪肉价格的持续上涨,严重破坏了市场交易秩序。
目前,中国养猪业进入后非洲猪瘟时代,清楚地了解非洲猪瘟的流行特点,认真严谨地做好临床检测对确保养猪生产正常进行至关重要。
1 非洲猪瘟病毒1.1 病毒的形态和结构ASFV 是一种单分子线状双链DNA 病毒,是非洲猪瘟病毒科非洲猪瘟病毒属唯一的成员,也是迄今发现的唯一的DNA 虫媒病毒。
ASFV 呈二十面体对称,在胞浆内复制,病毒直径为175 nm ~215 nm,病毒粒子由内到外依次为核质体、核衣壳、囊膜,囊膜又分为内层和外层。
国际病毒分类委员会在第六次报告中将ASFV 列入“类非洲猪瘟病毒属”,1998年正式将其列入非洲猪瘟病毒科,2005年最终将其列为非洲猪瘟病毒属。
ASFV 的DNA 核心位于病毒中间,二十面体衣壳与含类脂的囊膜形成病毒外周。
病毒粒子的结构蛋白有很多种,其中p72蛋白位于病毒衣壳的表面,是二十面体衣壳的重要组成部分,具有良好的反应原性和抗原性。
猪瘟病毒主要抗原蛋白研究进展

抑制试验表明 ,猪瘟病毒最初结合到细胞上是通过 E 0蛋 白
介导 的 , 试验还证 实 , E 0 C端的肽段( 4 8 0 一 K K L E N K S K 一 4 8 7 ) 是相互作用所必须的。
2 . 2 E 2蛋 白
C S F V的基 因组大小约 1 2 . 3 k b , 由5 ’ 端非编码 区, 开放阅 读框和 以及 3 。 端非编码 区三部分组成 。 开放阅读框编码 一个
病毒表达 了 C S F V E 2( 不包 括跨膜 区) ,E 2的 A区及 E 2的
M 或E D T A的影 响 ,但 能够被 z n “离 子抑 制。E 0对 D N A 没有活性 ,只作用于 R N A,对富含 U序列活性最高 。E 0的
R N a s e活性 能够影 响宿主细胞 中病 毒 R N A的复制 ,并且对
专 论 与 综 述
猪瘟病 毒主 要 抗 原 蛋 白研 究进 展
余 姣
( 西南 大学 动物 科技 学 院 ,重庆 4 0 0 7 1 5)
摘 要: 猪 瘟病毒是黄病毒科瘟病毒属成 员, 能引起各种年龄段猪 的急性 、 热性和 高度致死性的传染病。本文就猪 瘟
病毒 的分类 、 形态及及病毒 的基 因组 结构进行 了综述 , 并 对其 编码的几种 主要 抗原蛋 白 E 0 、 E 2 、 NS 3的功 能等进行
E 0是一种尿 嘧啶特异的有神经毒性 、 抗蠕虫和免疫抑制活性 , 其活
性在 p H 4 . 5 ~ 6 . 5时最高 , 最适温度为 5 5 ℃, 酶活性不受 c a 、
助于从疫 苗接种猪群 中筛查 出野毒感染猪。V a n等利用杆状
了 简要 介 绍 。
关键词 : C S F V; E 0 ; E 2 ; NS 3 DO l : 1 0 . 3 9 6 9 / J . I SSN. 1 6 71 — 6 0 2 7 . 2 0 1 3 . 0 4 . 0 0 5
猪瘟(CSF)

2.新型疫苗
• 猪瘟病毒基因缺失型弱毒疫苗 • 猪瘟病毒亚单位疫苗 • 猪瘟病毒活载体疫苗 • 猪瘟病毒核酸疫苗 • 猪瘟病毒全长感染性cDNA标记疫苗
①猪瘟病毒基因缺失型弱毒疫苗
• 当某些与病毒复制无关的毒力基因缺失突变后, 病毒毒力丧失或明显减弱,但病毒复制能力并不 丧失,同时还保持着良好的免疫原性
七、疫苗研究进展
• 近年来国内外应用单克隆抗体对C株检测时发现有不同的 反应模式,猪瘟兔化弱毒疫苗免疫失败也有报道,提示随 着传代次数的增加和对不同细胞的适应性繁殖,疫苗毒株 可能发生异质性或抗原漂移 • 加之数十年来猪瘟病毒在大规模免疫接种压力下出现抗原 变异,现有的传统疫苗己不能完全适应新形势的需要 • 研究和开发新型猪瘟疫苗已成大势所趋,而分了生物学技 术的发展,为新型猪瘟疫苗的研究和开发奠定了基础
患猪肾脏肿大、点状出血
患猪肾脏皮质出血、髓质水肿
左:肾脏小点出血 右:肾皮质区域小点出血,肾盂粘膜出血斑块
患猪扁桃体出血
患猪喉头点状出血
患猪喉头坏死
患猪肺脏点状出血
患猪胃粘膜斑点状出血
左:肺散在出血斑点 右:胃粘膜有出血斑点
混合型猪瘟,肺大理石样变化
左:心外膜出血 右:心内膜出血
患猪肠浆膜点状出血、胶样渗出
结肠粘膜上的单个“纽扣状肿”
盲、结肠粘膜上单个及融合溃疡
肠道粘膜出血
盲结肠扣状肿
患猪膀胱粘膜点状出血
患猪脑水肿、脑脊液增多
脾出血性梗死,脾脏边缘呈紫黑色,边界清楚的隆起斑块
诊断
• 尸体剖检中,诊断性的病理变化为淋巴结、肾脏 和其它器官的出血以及脾脏梗死 • 实验室诊断方法包括:血清学诊断、分子生物学 诊断
猪瘟(CSF)
2025届高中生物学一轮复习检测案43 基因工程及生物技术的安全性与伦理问题(含解析)

检测案43基因工程及生物技术的安全性与伦理问题[基础巩固练]1.下列关于基因工程的叙述,错误的是()A.目的基因和受体细胞均可来自动、植物或微生物B.限制性内切核酸酶和DNA连接酶是两类常用的工具酶C.人胰岛素原基因在大肠杆菌中表达的胰岛素原无生物活性D.载体上的抗性基因有利于筛选含重组DNA的细胞和促进目的基因的表达2.[2024·九省联考·安徽]依据《中华人民共和国生物安全法》,生物安全是指国家有效防范和应对危险生物因子及相关因素威胁,生物技术能够稳定健康发展,人民生命健康和生态系统相对处于没有危险和不受威胁的状态,生物领域具备维护国家安全和持续发展的能力。
下列叙述错误的是()A.高致病性微生物须在高等级生物安全实验室中开展实验活动B.生物技术可广泛应用在人类自身基因组改造和新物种创造中C.外来入侵物种可能增加本土食物来源却给自然生态造成破坏D.动物饲料中的抗生素会通过食物链使人体微生物耐药性增强3.下列有关生物技术安全性和伦理问题的观点,不合理的是()A.对于转基因技术,我们应该趋利避害,理性看待B.我国禁止生殖性克隆和治疗性克隆C.我国不发展、不生产、不储存生物武器,并反对其扩散D.对于基因检测应该保护个人遗传信息隐私权[提能强化练]4.[2024·九省联考·江西]萤火虫的荧光素酶能催化ATP激活的荧光素氧化发光,这一现象在生物检测和成像方面有重要的应用价值。
为了解决天然荧光素酶不能高效催化人工合成的荧光素DTZ发光的问题,研究人员采用蛋白质工程(又称为第二代基因工程)对它进行了改造。
下列关于蛋白质工程改造天然荧光素酶的叙述,正确的是()A.通过化学诱变剂可定向改造天然荧光素酶的基因序列B.改造天然荧光素酶所用的基因表达载体不需要启动子和终止子C.可用PCR方法检测突变的荧光素酶基因是否翻译成蛋白质D.改造后的荧光素酶在一定条件下催化DTZ发光是将化学能转化为光能5.[2024·九省联考·甘肃]胰岛素可用于治疗糖尿病,我国科学家打破国外技术垄断,研发了拥有自主知识产权的重组人胰岛素药物,下列叙述错误的是()A.用PCR技术扩增人胰岛素基因时,每次循环包括变性、复性、延伸三步B.构建人胰岛素基因表达载体时,需使用限制性内切核酸酶和DNA连接酶C.大肠杆菌细胞经Ca2+处理后,更容易吸收重组的人胰岛素基因表达载体D.抗原—抗体杂交法能检测人胰岛素基因表达载体是否导入大肠杆菌细胞6.(不定项)人染色体DNA中存在串联重复序列,对这些序列进行体外扩增、电泳分离后可得到个体的DNA指纹图谱。
猪瘟病毒 E0蛋白的原核表达及多克隆抗体的制备

猪瘟病毒 E0蛋白的原核表达及多克隆抗体的制备贾俊杰;张必凯;张莉;谢金鑫;郭焕成;龚文杰;涂长春【摘要】为表达猪瘟病毒 E0蛋白并制备其多克隆抗体,本研究构建 E0蛋白的原核表达载体,转化至BL21(DE3)菌株,IPTG 诱导表达,亲和层析及切胶回收纯化重组蛋白。
SDS-PAGE 和 Western blot 分析显示 E0重组蛋白主要以包涵体形式表达,亲和层析纯化获得了 E0重组蛋白,用其免疫 Balb/c 小鼠4次制备E0重组蛋白的多克隆抗体。
间接 ELISA 显示,免疫小鼠血清中 E0蛋白抗体效价为1∶50000。
获得的 E0蛋白多抗能与病毒感染细胞及 E0-EGFP 融合表达细胞中天然结构的 E0蛋白发生特异性反应。
本研究制备的 E0重组蛋白及其多克隆抗体为进一步研究 E0蛋白的功能和免疫原性奠定了基础。
%To express E0 protein of CSFV and prepare its polyclonal antibodies (pAb),the recombinant E0 protein of CSFV Shimen strain was expressed in E.coli BL21(DE3)with IPTG induction and successively purified by affinity chromatography and gel slice.Balb/c mice were immunized four times with the purified recombinant E0 protein.SDS-PAGE and Western blot analysis showed that recombinant protein was ex-pressed mainly in the inclusion body.The indirect ELISA showed that the antibody titers in the serum of immunized mice was at 1:50000.Moreover,the obtained anti-E0 pAb can specifically react with the E0 pro-tein expressed in virus-infected cells and E0-EGFP-expressing cells.The obtained E0 protein and its poly-clonal antibodies in this study will be useful for future studies on the function and immunogenicity of CSFV E0 protein.【期刊名称】《动物医学进展》【年(卷),期】2016(037)005【总页数】6页(P5-9,10)【关键词】猪瘟病毒;E0蛋白;原核表达;多克隆抗体【作者】贾俊杰;张必凯;张莉;谢金鑫;郭焕成;龚文杰;涂长春【作者单位】军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,吉林长春 130122;军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,吉林长春 130122;军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,吉林长春 130122;军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,吉林长春 130122;军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,吉林长春 130122;军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,吉林长春 130122;军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,吉林长春 130122【正文语种】中文【中图分类】S852.651猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的以免疫抑制和高病死率为主要特征的急性热性传染病。
古典猪瘟病毒基因组及ORF编码蛋白的结构和功能

古典猪瘟病毒基因组及ORF编码蛋白的结构和功能朱小甫;吴旭锦;徐德乾;杨萍【摘要】Classical swine fever was a serious disease hazard pig industry, studying classical swine fever virus of molecular biology could reveal viral replication and pathogenesis, find key sites of immune protection, and lay the foundation for the development of new vaccines. This paper summarized recent classical swine fever virus genome research and related proteins, ma-ded for future research prospects.%古典猪瘟是严重危害养猪业发展的重要疫病之一,对古典猪瘟病毒的分子生物学研究能揭示病毒复制和致病机理,寻找免疫保护关键位点,为新型疫苗开发奠定基础.文章综述了近年对古典猪瘟病毒基因组和相关蛋白的研究成果,对以后的研究方向作了展望.【期刊名称】《中国畜牧兽医》【年(卷),期】2012(039)005【总页数】5页(P183-187)【关键词】古典猪瘟;基因组;蛋白;分子流行病学【作者】朱小甫;吴旭锦;徐德乾;杨萍【作者单位】咸阳职业技术学院生物科技系,动物疫病分子生物学诊断实验室,陕西咸阳712000;咸阳职业技术学院生物科技系,动物疫病分子生物学诊断实验室,陕西咸阳712000;咸阳职业技术学院生物科技系,动物疫病分子生物学诊断实验室,陕西咸阳712000;咸阳市动物疫病预防控制中心,陕西咸阳712000【正文语种】中文【中图分类】S852.65+1古典猪瘟(classical swine fever,CSF)是由古典猪瘟病毒(classical swine fever virus,CSFV)引起的一种高度接触性传染病,迄今仍是中国最重要的猪传染病之一,每年引起猪发病死亡的损失巨大,因此中国农业部将其列为一类传染病。
猪瘟病毒基因组蛋白结构及蛋白表达技术的研究进展

种 功 能 蛋 白 ,对 病 毒 的免 疫 、识 别 、吸 附 和 进 入 宿 主 细 胞
十 分 重 要 。 它 可诱 导机 体 产 生 中 和 抗 体 ,用 其 免 疫 猪 可 诱 导
产 生 对 致 死 剂 量 的 保 护 性 免 疫 反 应 .也 是 病 毒 粒 子 吸 附 进 入
pl A oy()尾 巴结 构 ,在 所 有 瘟 病 毒 中 高 度 保 守 ,其 参 与 病 毒 基 因组 的复 制 、 多 聚蛋 白 的 翻译 和 病 毒 粒 子 的装 配 。猪 瘟 病 毒 的 O F翻 译 一 个 3 9 R 8 8个 氨 基 酸 的 多 聚 蛋 白 。 该 蛋 白在 细 胞 内 蛋 白 酶 和病 毒特 异 性 的 蛋 白酶 作 用 下 裂 解 成 各 种 成 熟 的
和 性 .N 2 3蛋 白为 双 功 能 蛋 白 ,具 有 丝 氨 酸 蛋 白酶 活 性 、 S—
核苷 i磷酸酶活性及 解旋酶 活性 ,其解旋作用 依赖于 C F SV
特 异 的单 链 R A,该 蛋 白在 病 毒 的 生 命 周期 中 至关 重 要 。还 N 有 其 他 一 些 非 结 构 蛋 白 ,比如 N 4 和 N 4 、N 5 SA SB S A和 N 5 SB 这 些非 结 构蛋 白的研 究还 不 多 ,其 中 N 5 S B也 与病 毒 复制 有关 。 2 猪瘟 病 毒 蛋 白表 达 技 术 21 原核 表 达 . 在 各 种 表 达 系 统 中 ,最 早 被 采 用 进 行 研 究 的 是 原 核 表 达 系 统 .这 也 是 目前 掌 握 最 为 成熟 的 表 达 系 统 。该 项 技 术 的 主 要 方 法 是 将 已 克 隆 人 目的 基 因 D A 片 段 的 载 体 ( 般 为 质 N 一
非洲猪瘟(ASF)

• ASFV能抵抗温度和酸性pH等环境因素的改变, 能从室温放置18个月的血液和血清中分离到病毒 • ASFV能在冰冻或未煮熟的肉中存活几周或几个月
• 病毒经60℃30分钟可被灭活 • 许多脂溶剂能使ASFV灭活
• 感染ASFV的野猪的组织中含有少量的病毒,即使 很少的病毒也足以通过软蜱传播给家猪 • 一旦ASFV感染家猪,ASFV带毒猪将是随后病毒 传播的重要来源
• 自然感染的潜伏期从4天到19天不等,实验室感 染潜伏期较短,一般2-5天
耳、背部严重瘀血
病猪精神沉郁,病机理
• 一般情况下,ASFV在家猪经口或鼻腔传播
• 也可通过蜱叮咬、皮肤划痕和注射感染ASFV • ASFV的感染从扁桃体和下颌淋巴结的单核巨嗜细 胞开始,随淋巴液和血液达到靶器官 • 感染ASFV后6-8天开始出现病毒血症,病毒血症 将存在很长时间
临床症状
• 临床症状随ASFV的毒力、感染剂量和感染途径不 同而不同 • 急性病例表现为食欲减退,高温(40-41℃),内 脏器官出血,皮肤出血(尤其是耳部和腹肋部皮 肤),白细胞减少和高死亡率
• 亚急性病例表现为暂时性的血小板和白细胞减少, 并可见大量的出血灶 • 慢性病例表现为呼吸改变、流产和低死亡率
• ASF大体病变出现于脾、淋巴结、肾和心脏
• 脾脏呈红黑色,肿大,梗死,变脆 • 淋巴结水肿,出血,变脆,有时像黑红色的血肿, 切面呈现大理石样外观 • 肾脏皮质切面有点状出血,肾盂切面呈点状出血
• 心内膜或心外膜有出血点或出血斑
• 膀胱粘膜出血,肺脏水肿 • 慢性ASF主要引起呼吸道变化,病变为纤维素性 胸膜炎,胸膜粘连,干酪样肺炎和淋巴组织增生 • 纤维素性心包炎和坏死性皮肤病变也常见
• 急性病例的出血机理是病毒在血管内皮细胞中复 制,使内皮细胞的吞噬活性加强引起的
猪瘟病毒E0和E2蛋白融合表达的重组腺病毒构建及免疫保护性研究

第3 2卷 第 6 期
2 0 年 01 6 月
中
国 预
防 兽
医 学 报
Vo1 3 NO. . 2. 6 J . 2 O un 01
Ch n s o r a fPr v n ie V ee i r M e i ie i e e J u n lo e 蛋 白融 合 表 达 的重 组 腺 病 毒 构 建 及 免 疫 保 护 性 研 究
杨 玉艾 ,初 晓辉 ,毕 保 良 ,杨 亮 宇 ,吴 翱 ,邱 春 富 ,孙 永科
( 南农业 大学 动 物科学 技术 学院 ,云南 昆明 600) 云 52 1
摘
要 : 为评 价 重组 腺 病 毒 融合 表 达 猪 瘟 病毒 ( S V) 0和 E CF E 2蛋 白的 免 疫 保 护 效 果 ,本 研 究 以 C F 基 因 SV
p d ayE 一 2 A E s—0E ,经 P cI 切 线性 化后 转 染人 胚 胎 肾细, H K 9 ) a 酶  ̄ E 2 3 ,成 功 包装 出重 组腺 病毒 ( — 0E ) C g( r E 一2 ,P R和 Ad wetr l 捡 测 表 明 ,E 一2基 因 已重 组 于昧 病毒 基 因组 中并 获得 表 达 将 r dE 一 2接 种 于小 鼠 和 猪 ,并 通过 s nbo e t 0E A —0E
中 图 分 类 号 : ¥ 5 .5 8 26 l 文 献 标 识 码 :A 文 章 编 号 : 10 —5 92 1 )60 1—5 0 80 8 (0 0 0 —4 90
非洲猪瘟的流行病学、临床症状及防控措施

2021.5作者简介:安冬(1991.12-),女,内蒙古呼伦贝尔市人,硕士,助理兽医师,主要从事动物疫病预防控制与化验工作。
非洲猪瘟的流行病学、临床症状及防控措施安冬1包雨鑫2(1,内蒙古呼伦贝尔市海拉尔区动物疫病预防控制中心021000;2,通辽市畜牧兽医科学研究所028000)摘要:非洲猪瘟是一种急性、热性、高致死性的传染病,其病原为非洲猪瘟病毒,可以通过患病猪、带毒猪及其产品以及易感媒介直接或间接传播,该病已经严重威胁生猪养殖行业的健康发展。
本文介绍非洲猪瘟的病原学、流行病学、临床症状、诊断方法及防控措施,以供参考。
关键词:非洲猪瘟;流行病学;防控措施猪口蹄疫疾病的疫苗接种可以有效避免疾病的爆发,对于出现过口蹄疫疾病的生猪养殖地区,需要进行强制的疫苗接种。
建议每年定期给生猪进行1次疫苗接种,时间推荐选择在秋季。
在出现大面积口蹄疫感染的养殖地区,需要对猪群进行捕杀,立即通报有关部门,相关部门需要及时对疫情区域进行划定,进行强制封锁,避免疫情进一步蔓延。
对于捕杀的患病猪只需要及时进行无公害化处理,患病猪只尸体过多时可以在尸体上加入氢氧化钠后进行深埋处理。
4猪口蹄疫疾病的治疗措施现阶段,对生猪口蹄疫疾病的治疗还没有特效药物,主要依赖于部分药物缓解口蹄疫疾病症状,避免疾病进一步恶化和并发症的出现。
首先我们可以通过使用有效浓度为3g/L 的三氯异氰尿酸钠粉对患病猪只病变部位进行喷涂消毒,随后使用含有冰片、明矾、黄连、地榆、青黛、黄檗、儿茶等中草药混合制作的粉末对患病猪只病变部位进行涂抹。
患病猪只的蹄部还可以通过使用3%浓度的来苏水溶液清洗,清洗干净后对口部和鼻部出现病变的部位可以使用碘甘油涂抹杀菌消毒。
生产中还可以通过使用0.1%浓度的高锰酸钾溶液对病变部位进行清洗,连续清洗消毒3~5d 即可获得良好的治疗效果。
5结束语生猪养殖中,口蹄疫疾病的出现将显著降低猪只生产性能和机体健康状况,通过早期生猪养殖对疾病的科学预防,在出现疾病后及时进行诊断治疗可以有效避免口蹄疫在猪群中的爆发,促进生猪养殖产业的科学发展。
2024版412兽医传染病学非洲猪瘟课件

• ASFV可以通过多种途径传播,包括直接接触传播、间接接触传播和空 气传播等。
• 直接接触传播是指健康猪与患病猪或其排泄物、分泌物直接接触而感染; 间接接触传播是指健康猪接触了被病毒污染的饲料、水源、器具等而感 染;空气传播是指病毒通过气溶胶形式在空气中扩散,健康猪吸入后感 染。
05
非洲猪瘟预防与控制措施
预防措施建议
加强生物安全
严格控制人员和物品的流 动,防止病毒传入猪场; 定期对猪场进行消毒,保 持环境清洁卫生。
提高猪群免疫力
合理配制饲料,保证猪群 获得充足的营养;适当添 加维生素和矿物质,提高 猪群的抵抗力。
疫情监测与报告
建立疫情监测制度,及时 掌握疫情动态;发现异常 情况及时报告,以便采取 相应措施。
案例二
某地区成功防控非洲猪瘟疫情该地区在非洲猪瘟疫情发生后,迅速启动应急预案,加强疫情监测和排查, 严格封锁疫区,强化生猪调运监管和屠宰管理,最终成功控制了疫情扩散。该案例的成功经验表明,及时 发现、快速响应和科学防控是控制非洲猪瘟疫情的关键。
成功经验总结
完善防疫设施 建立健全养殖场生物安全体系,完善消 毒设施、隔离设施等防疫设施,确保生
• ASFV在环境中的存活能力较强,可以在污染的圈舍、用具、衣物等上 存活数周至数月,成为潜在的传染源。
03
非洲猪瘟流行病学
易感动物与传染源
易感动物
家猪和野猪均易感,各年龄段猪均 可感染,以中大猪和母猪为主。
传染源
主要为发病猪和带毒猪,包括病死 猪、康复猪和隐性感染猪。病毒可 长期存在于感染猪的血液、组织液、 内脏及其他排泄物中。
非洲猪瘟生物学特性及防控措施

上海农业科技谢春芳,等:非洲猪瘟生物学特性及防控措施2020(5):72-75•养殖业•非洲猪瘟生物学特性及防控措施谢春芳李震"(上海市农业科学院畜牧兽医研究所,上海市农业遗传育种重点实验室动物遗传工程研究室,上海市闵行区201106)摘要:非洲猪瘟是目前全球养殖业及公共卫生部门面临的广泛性传播的动物性疾病,其流行和爆发不仅给养猪业造成了毁灭性的损失,也给猪肉食品安全带来了巨大威胁,给人类的健康安全埋下了巨大的安全隐患。
非洲猪瘟病毒分子量大且容易变异,病毒结构较为复杂,可在自然环境中长期存在,这给非洲猪瘟的预防控制带来了难度。
现就非洲猪瘟生物学特性的国内外研究近况进行综述,包括传播、病毒结构特征和分型、对人的危害、感染猪的临床症状、诊断以及防控措施等,以期更好地防控非洲猪瘟。
关键词:非洲猪瘟;生物学特性;复杂性;多变性;免疫防控中图分类号:S85非洲猪瘟(African swine fever,ASF)于1921年在肯尼亚首次报道,最初称之为“东非猪瘟”(East African Swine Fever),1935—1939年在南非发生大规模流行,1957年在撒哈拉以南的大部分国家流行,然后通过葡萄牙传到欧洲及周边国家“3,, 2007年在格鲁吉亚、亚美尼亚、俄罗斯、伊朗、乌克兰、白俄罗斯、波罗的海国家、波兰、捷克、罗马尼亚、马尔代夫、拉脱维亚和匈牙利传播流行⑷,2018年我国辽宁省首次发现非洲猪瘟感染猪,其后,蒙古、越南等亚洲国家报道有非洲猪瘟发生卜叫非洲猪瘟在全球范围迅速传播蔓延,不仅给养猪业造成毁灭性的损失,也给猪肉食品安全带来巨大威胁。
非洲猪瘟病毒在被感染细胞内能产生100多种蛋白切,这些病毒蛋白大量存在于感染非洲猪瘟的病猪体内,会给人类的健康带来巨大的安全隐患。
为更好地防控非洲猪瘟,笔者拟对非洲猪瘟生物学特性的国内外研究近况进行综述,以供参考。
1非洲猪瘟的传播非洲猪瘟病毒只感染猪,家猪、野猪和软婢是非洲猪瘟病毒的主要宿主(非洲猪瘟病毒可在婢体内存活数年且保持病毒感染活性)。
非洲猪瘟病毒P72蛋白合成肽疫苗的构建及其免疫效力评估

中国畜牧兽医 2022,49(8):3083-3090C h i n aA n i m a lH u s b a n d r y &V e t e r i n a r y Me d i c i ne 非洲猪瘟病毒P 72蛋白合成肽疫苗的构建及其免疫效力评估徐娅玲1,2,张霁辉1,2,牛 熙1,2,李 升1,2,黄世会3,冉雪琴3,王嘉福2(1.贵州大学生命科学学院,贵阳550025;2.贵州大学农业生物工程研究院,贵阳550025;3.贵州大学动物科学学院,贵阳550025)摘 要:ʌ目的ɔ构建非洲猪瘟病毒C A S 19-01/2019株(G e n B a n k 登录号:MN 172368.1)结构蛋白P 72的合成肽疫苗,通过免疫小鼠评估合成肽疫苗的免疫效力㊂ʌ方法ɔ利用P r o t P a r a m ㊁S O P MA 等软件分析P 72蛋白的理化性质与结构信息,通过A B C p r e d ㊁S VM t r i p ㊁I E D B 预测P 72蛋白的T 细胞与B 细胞抗原表位,筛选出显著的表位多肽区域,合成多肽辅以弗氏佐剂腹腔注射免疫小鼠,检测免疫组小鼠产生的特异性抗体㊁T 淋巴细胞亚群㊁脾脏淋巴细胞增殖㊁细胞因子白介素4(I L -4)㊁I L -2㊁γ干扰素(I F N -γ)㊁免疫球蛋白(I g G ),从体液免疫与细胞免疫角度评估合成肽的免疫效力㊂ʌ结果ɔ综合分析得出P 72蛋白是稳定性亲水蛋白,二级结构中α-螺旋㊁β-转角㊁延伸链㊁无规则卷曲分别占19.35%㊁5.42%㊁25.08%和50.15%㊂筛选出了P 72蛋白的8个优势抗原表位,626-634㊁520-528㊁298-306㊁203-211位氨基酸处为T 细胞抗原表位,587-606㊁232-251㊁110-129㊁39-58位氨基酸处为B 细胞抗原表位㊂整合优势表位合成2个多肽P 72-1与P 72-2,首次免疫小鼠14d 时可检测到P 72-1与P 72-2的特异性抗体,首免后28d 达到最高值,其最高抗体效价分别为1ʒ25600与1ʒ12800;免疫后小鼠T 淋巴细胞亚群C D 4+/C D 8+显著上升(P <0.05);脾脏淋巴细胞增殖试验结果显示,免疫组淋巴细胞数量均极显著升高(P <0.01);细胞因子I L -4㊁I L -2㊁I F N -γ含量均极显著增加(P <0.01)㊂ʌ结论ɔ本研究成功研制2种合成肽疫苗,在免疫效力上P 72-2高于P 72-1,二者都能产生高水平的特异性抗体,刺激脾脏淋巴细胞增殖,诱导产生细胞因子I L -4㊁I L -2㊁I F N -γ,本研究为非洲猪瘟合成肽疫苗研制奠定技术基础㊂关键词:非洲猪瘟病毒(A S F V );P 72蛋白;抗原表位;合成肽疫苗中图分类号:S 852.65+1文献标识码:AD o i :10.16431/j.c n k i .1671-7236.2022.08.024 开放科学(资源服务)标识码(O S I D ):收稿日期:2022-02-08基金项目:国家自然科学基金(31960641);贵州省科技创新人才团队项目(黔科合平台人才[2019]5615);贵州省 百 层次创新型人才培养项目(黔科合人才[2016]4012);贵州省科技支撑计划(黔科合支撑[2017]2585㊁黔科合支撑[2017]2587)联系方式:徐娅玲,E -m a i l :1782417907@q q .c o m ㊂通信作者王嘉福,E -m a i l :j f w a n g@g z u .e d u .c n C o n s t r u c t i o no f S y n t h e t i cP e p t i d eV a c c i n e o fA f r i c a nC l a s s i c a l S w i n e F e v e rV i r u s P 72P r o t e i na n dE v a l u a t i o no f I t s I m m u n eE f f i c a c yX U Y a l i n g 1,2,Z H A N GJ i h u i 1,2,N I U X i 1,2,L I S h e n g 1,2,HU A N GSh i h u i 3,R A N X u e qi n 3,WA N GJ i a f u 2(1.C o l l e g e o f L i f eS c i e n c e s ,G u i z h o uU n i v e r s i t y ,G u i y a n g 550025,C h i n a ;2.I n s t i t u t e o f A g r o -b i o e n g i n e e r i n g ,G u i z h o uU n i v e r s i t y ,G u i y a n g 550025,C h i n a ;3.C o l l e g e o f A n i m a lS c i e n c e ,G u i z h o uU n i v e r s i t y ,G u i y a n g 550025,C h i n a )A b s t r a c t :ʌO b j e c t i v e ɔT h e a i mo f t h i s s t u d y w a s t o c o n s t r u c t a s y n t h e t i c p e pt i d e v a c c i n e b a s e d o n pr o t e i nP 72i nA f r i c a n s w i n e f e v e r v i r u s (A S F V )s t r a i nC A S 19-01/2019(G e n B a n k a c c e s s i o nN o .:M I N 172368.1),a n d e v a l u a t e i t s i m m u n e e f f i c i e n c y b y i m m u n i z i n g mi c e .ʌM e t h o d ɔT h e p h y s i c o c h e m i c a l p r o p e r t i e s a n d s t r u c t u r a l i n f o r m a t i o no fP 72p r o t e i nw e r e a n a l y z e db yp r o gr a m s中国畜牧兽医49卷o fP r o t P a r a ma n dS O P MA.T h es i g n i f i c a n te p i t o p e s i n Ta n dBl y m p h o c y t e sw e r es c r e e n e db y A B C p r e d,S VM t r i p a n d I E D C B.T h e s y n t h e s i z e d p e p t i d e sw e r e i n j e c t e d i n t r a m u s c u l a r l y i n t om i c e w i t hF r e u n d sa d j u v a n t.A n t i b o d i e sa g a i n s tt h es y n t h e s i z e d p e p t i d e s,T l y m p h o c y t es u b s e t s, l y m p h o c y t e p r o l i f e r a t i o n,c y t o k i n e sc o n t e n t so f i n t e r l e u k i n4(I L-4),I L-2,i n t e r f e r o n-γ(I F N-γ) a n d i m m u n o g l o b u l i n(I g G)w e r e d e t e c t e du s i n g s e r u ma n d o t h e r t i s s u e f r o mt h e i m m u n i z e dm i c e, a n d t h e i m m u n e e f f i c a c y o f t h e s y n t h e t i c p e p t i d ew a s e v a l u a t e d f r o mt h e p e r s p e c t i v e s o f h u m o r a l i m m u n i t y a n d c e l l u l a r i m m u n i t y.ʌR e s u l tɔC o m p r e h e n s i v e a n a l y s i s s h o w e d t h a t P72p r o t e i nw a s a s t a b l eh y d r o p h i l i c p r o t e i n.I ns e c o n d a r y s t r u c t u r e,a l p h ah e l i x,b e t at u r n,e x t e n d e ds t r a n da n d r a n d o mc o i la c c o u n t e df o r19.35%,5.42%,25.08%a n d50.15%,r e s p e c t i v e l y.E i g h td o m i n a n t e p i t o p e s o f p r o t e i n P72w e r es e l e c t e d b y c o m p r e h e n s i v es o f t w a r ea n a l y s i s,i n c l u d i n g T c e l l e p i t o p e s626-634,520-528,298-306,203-211a m i n oa c i d s,a n dBc e l le p i t o p e s587-606,232-251, 110-129,39-58a m i n o a c i d s.T w o p e p t i d e s n a m e dP72-1a n dP72-2w e r e s y n t h e s i z e d b y i n t e g r a t i n g t h ed o m i n a n t e p i t o p e s t o g e t h e r.T h e s p e c i f i c a n t i b o d i e s a g a i n s t t h e s y n t h e s i z e d p e p t i d e s P72-1a n d P72-2w e r ed e t e r m i n e di ns e r u m o f m i c ea f t e r14d a y so ft h ef i r s t i m m u n i z a t i o n,r e a c h e dt h e h i g h e s t v a l u e o n t h e28t hd a y a f t e r t h e f i r s t i m m u n i z a t i o n,a n dh i g h e s t a n t i b o d y t i t e r sw e r e1ʒ25600 a n d1ʒ12800,r e s p e c t i v e l y.T h e v a l u e o f C D4+/C D8+o fT l y m p h o c y t e s u b s e t s i n i m m u n i z e dm i c e w e r e s i g n i f i c a n t l y i n c r e a s e d(P<0.05).T h e s p l e e n l y m p h o c y t e p r o l i f e r a t i o n t e s t s h o w e d t h a t t h e n u m b e r o f l y m p h o c y t e sw a s e n h a n c e d i nb o t h g r o u p s(P<0.01).C y t o k i n e s c o n t e n t s o f I L-4,I L-2 a n d I F N-γw e r ee x t r e m e l y s i g n i f i c a n t l y i m p r o v e d(P<0.01).ʌC o n c l u s i o nɔI nt h i ss t u d y,t w o s y n t h e t i c p e p t i d ev a c c i n e sw e r es u c c e s s f u l l y d e v e l o p e d.P72-2w a sh i g h e r t h a nP72-1i n i m m u n e e f f i c a c y,a n db o t hc o u l d p r o d u c eh i g hl e v e lo fs p e c i f i ca n t i b o d i e s,s t i m u l a t et h e p r o l i f e r a t i o no f l y m p h o c y t e s,i n d u c e t h e p r o d u c t i o no f c y t o k i n e s I L-4,I L-2a n d I F N-γ.T h i s s t u d y l a i da t e c h n i c a l f o u n d a t i o n f o r t h e d e v e l o p m e n t o fA f r i c a n s w i n e f e v e r v a c c i n e.K e y w o r d s:A f r i c a ns w i n ef e v e rv i r u s(A S F V);P72p r o t e i n;a n t i g e ne p i t o p e s;s y n t h e t i c p e p t i d e v a c c i n e非洲猪瘟(A f r i c a ns w i n e f e v e r,A S F)是由非洲猪瘟病毒(A f r i c a n s w i n e f e v e r v i r u s,A S F V)引起家猪㊁疣猪㊁欧洲野猪和美洲野猪等不同品种猪发病的急性㊁烈性传染病[1],主要症状为肺水肿㊁严重抑郁㊁高热㊁发绀㊁无食欲㊁多器官广泛出血等[2],对环境有极强的抵抗能力,在-20ħ112d后仍具有感染能力[3],中国动物病原微生物名录中将其列为一类动物疫病,该病首次发现于肯尼亚[4],后传播到西班牙㊁意大利㊁法国㊁格鲁吉亚㊁俄罗斯等国家[5-6],2018年初在中国辽宁省沈阳市首次暴发,由于其高致死性,对中国生猪养殖业造成巨大经济损失[7],但目前仍无有效疫苗预防,一旦发现,只能采取捕杀方式,因此对于A S F疫苗的研究尤为重要㊂目前,A S F的疫苗研发中病毒载体疫苗与减毒活疫苗免疫原性较强[8-9]㊂但病毒载体疫苗安全性尚不能完全确定,易突变为强毒株[10],减毒活疫苗可能会导致猪产生高热㊁食欲不振㊁轻微神经衰弱症状,部分猪甚至因感染而急性死亡[11]㊂因此,安全性更高的疫苗对于A S F至关重要㊂以抗原表位为基础设计的合成肽疫苗能诱导机体产生对特定表位的免疫反应,并避免其他可能导致过敏性反应的无关表位的潜在影响,具有极高的安全性[12]㊂P72蛋白作为A S F V主要的衣壳蛋白,有较多的抗原表位[13],2014年P h i l l i p s[14]通过基因定位发现该蛋白存在多个抗原反应区域㊂郭晶等[15]也通过P72多表位融合蛋白诱导机体产生了特异性抗体及其良好的免疫原性㊂有效的B细胞和T细胞表位可通过免疫信息学分析确定,但表位的免疫原性必须通过试验验证㊂因此,本研究通过生物信息学的方法评估和选择P72蛋白中能诱导B细胞和T细胞应答的抗原表位,制备合成肽疫苗,免疫小鼠,评估合成肽的免疫效力,以期为A S F合成肽疫苗研究提供理论依据㊂1材料与方法1.1氨基酸序列、试验动物A S F V C A S19-01/2019株(G e nB a n k登录号:48038期徐娅玲等:非洲猪瘟病毒P72蛋白合成肽疫苗的构建及其免疫效力评估MN172368.1)P72蛋白氨基酸序列(G e n B a n k登录号:Q G J83444.1);3~5周龄S P F级雌性健康B A L B/c小鼠(许可编号:E A E-G Z U-2021-P014)购自重庆腾鑫生物技术有限公司㊂1.2主要试剂弗氏完全与不完全佐剂(S i g m a公司);牛血清白蛋白(B S A)㊁E L I S A包被液㊁E L I S A终止液㊁T M B显色液㊁红细胞裂解液㊁小鼠脾脏细胞分离试剂盒(S o l a r b i o公司);R P M I-1640细胞培养基㊁100目与200目细胞筛㊁P B S㊁小鼠白细胞介素2(I L-2) E L I S A试剂盒㊁I L-4E L I S A试剂盒㊁小鼠免疫球蛋白G(I g G)E L I S A试剂盒㊁小鼠γ干扰素(I F N-γ) E L I S A试剂盒(湖南艾方生物科技有限公司);抗体C D3+㊁C D8+㊁C D4+(杭州联科生物技术股份有限公司);辣根过氧化物酶(H R P)标记的山羊抗小鼠I g G(G o a tA n t i-M o u s e I g G-H R P)(上海艾比玛特医药科技有限公司)㊂1.3方法1.3.1抗原表位分析利用E x P A S y在线分析工具P r o t P a r a m(h t t p s:ʊw e b.e x p a s y.o r g/ p r o t p a r a m/)预测P72蛋白分子质量㊁等电点㊁不稳定系数和半衰期;利用N e t p h o s在线软件(h t t p s:ʊs e r v i c e s.h e a l t h t e c h.d t u.d k/s e r v i c e.p h p N e t P h o s-3.1)预测其磷酸化位点;S O P MA(h t t p s:ʊn p s a-p r a b i.i b c p.f r/c g i-b i n/n p s a_a u t o m a t.p l?p a g e=n p s a _s o p m a.h t m l)预测其蛋白二级结构;利用I E D B在线软件(h t t p:ʊt o o l s.i m m u n e e p i t o p e.o r g/m a i n/)预测其T细胞抗原表位㊁表面可及性㊁可塑性㊁抗原及亲水性;利用A B C p r e d(h t t p s:ʊw e b s.i i i t d.e d u.i n/ r a g h a v a/a b c p r e d/)㊁S V M t r i p(h t t p:ʊs y s b i o.u n l.e d u/ S V M T r i P/)在线软件预测其B细胞抗原表位㊂1.3.2合成肽疫苗的构建根据预测的结果,将筛选的T细胞抗原表位与B细胞抗原表位以随机组合的方式进行整合,整合的肽段由南京金斯瑞生物科技有限公司偶联K L H蛋白合成多肽P72-1与P72-2㊂1.3.3小鼠免疫 3~5周龄S P F级B A L B/c 雌性小鼠30只,随机分为3组:P72-1㊁P72-2和P B S组每组10只㊂P72-1和P72-2组分别腹腔注射免疫合成肽疫苗P72-1和P72-2,P B S组腹腔注射免疫P B S作为阴性对照,共免疫3次,每隔14d 免疫一次,剂量50μg/只,首免佐剂为弗氏完全佐剂,二㊁三免佐剂为弗氏不完全佐剂㊂1.4免疫效果评估1.4.1特异性抗体检测采用E L I S A方法检测免疫后P72-1与P72-2特异性抗体,分别用10μg/m L 的P72-1与P72-2蛋白包被E L I S A板,经封闭液封闭后,加入以1ʒ10稀释于P B S中的免疫动物血清,37ħ孵育1h,P B S T洗3次,加入100μL H R P 标记的山羊抗小鼠I g G(1ʒ10000)37ħ孵育1h, P B S T洗3次,加入T M B显色液常温避光反应15m i n,加入100μL E L I S A终止液,酶标仪测定D450n m值,根据P/N(阳性D450n m值/阴性D450n m值)计算是否产生特异性抗体及其抗体效价,免疫组(P)/P B S组(N)>2.1即视为检测到特异性抗体㊂1.4.2脾脏淋巴细胞增殖试验每组随机取3只小鼠,断颈处死后浸泡于75%乙醇中10m i n,于超净工作台分离淋巴细胞,100μL/孔加到96孔细胞板中,用终浓度为10μg/m L的P72-1㊁P72-2刺激淋巴细胞,无抗原组为对照,37ħ㊁5%C O2条件下培养68h后每孔添加10μLC C K-8,37ħ放置1h,测定D490n m值,根据测量的吸光度,按照下式计算刺激指数(S I):S I=(特异性抗原刺激孔平均D490n m值-本底D490n m值)/(无抗原刺激孔平均D490n m值-本底D490n m值)㊂1.4.3流式细胞术检测T淋巴细胞亚群抽取首免56d后小鼠外周血于抗凝管内,加入20μL荧光标记流式抗体C D3+㊁C D4+㊁C D8+,混匀,室温避光放置20m i n后加入450μL溶血素,混匀,室温避光放置20m i n,流式细胞术检测外周血淋巴细胞亚群精准计数㊂1.4.4细胞因子检测采集P72-1㊁P72-2及P B S组小鼠首免后14㊁28和42d的血清100μL,根据试剂盒说明书检测细胞因子I L-2㊁I L-4和I F N-γ含量㊂1.4.5统计分析试验数据均用G r a p h P a d P r i s m 8.0软件进行分析,所有试验设置3个重复样品,用t检验进行差异显著性分析㊂试验结果以平均值ʃ标准差表示㊂P<0.05表示差异显著;P<0.01表示差异极显著㊂2结果2.1抗原表位分析结果P72蛋白的分子式为C3303H5036N904O948S18,分子质量为73154.89u,由646个氨基酸组成,平均亲水系数为-0.392,不稳定系数为38.30,是稳定性亲水蛋白,在哺乳动物中的半衰期为30h;其蛋白结构中含有88个磷酸化位点:31个丝氨酸(S e r)位点㊁7个苏氨酸(T h r)位点㊁50个酪氨酸(T y r)位点;5803中国畜牧兽医49卷二级结构中α-螺旋㊁β-转角㊁延伸链和无规则卷曲分别占19.35%㊁5.42%㊁25.08%和50.15%㊂通过I E D B㊁A B C p r e d㊁S VM t r i p在线软件预测B细胞与T细胞抗原表位,结果见表1㊁2,综合各项分析结果,最终确定P72-1由4条多肽组成,多肽序列位置587-606㊁520-528㊁203-211㊁39-58位氨基酸处;P72-2由4条多肽组成,多肽序列位置为626-634㊁298-306㊁232-251㊁110-129位氨基酸处㊂表1P72蛋白B细胞表位分析T a b l e1Bc e l l e p i t o p e s o fP72p r o t e i n编号N o.序列S e q u e n c e s位置P o s i t i o n分值S c o r e 1K P R E E Y Q P S G H I N V S R A R E F587-6060.93 2YM F I G L K P TWN I S D Q N P HQ P465-4840.92 3V S V E G T S G P L L C N I H D L H K P232-2510.94 4E R L Y E N V R F D V N G N S L D E Y S185-2040.90 5S QMG A H G Q L Q T F P R N G Y DWD126-1450.92 6L G A C H S S WQ D A P I Q G T S QMG110-1290.85 7S Y G K P D P E P T L S Q I E E T H L V39-580.84表2P72蛋白T细胞表位分析T a b l e2Tc e l l e p i t o p e s o fP72p r o t e i n编号N o.序列S e q u e n c e s位置P o s i t i o n分值S c o r e 1S A S A I N F L L626-6340.3 2S S I S D I S P V520-5280.3 3I T D A T Y L D I298-3060.3 4Y S S D V T T L V203-2110.3 2.2特异性抗体水平检测采用E L I S A方法分析每次免疫后小鼠血清中特异性抗体效价,合成肽疫苗免疫组小鼠接种后分别能检测到针对P72-1与P72-2的特异性抗体反应,且抗体水平明显高于P B S组,最高抗体水平出现在一免后28d,P72-1最高效价为1ʒ25600, P72-2最高效价为1ʒ12800,P B S组小鼠血清中未检测到特异性抗体(图1)㊂2.3脾脏淋巴细胞增殖试验由图2可知,合成肽疫苗免疫组的刺激指数均极显著高于P B S组(P<0.01);P72-1组高于P72-2组,但无显著性差异(P>0.05),表明P72-1㊁P72-2合成肽疫苗能诱导机体的特异性脾脏淋巴细胞增殖㊂图1免疫小鼠特异性抗体检测F i g.1D e t e c t i o no f s p e c i f i c a n t i b o d i e s i n i m m u n i z e dm i ce*,差异显著(P<0.05);**,差异极显著(P<0.01);无*,差异不显著(P>0.05)㊂下同*,S i g n i f i c a n t d i f f e r e n c e(P<0.05);**,E x t r e m e l y s i g n i f i c a n td i f f e r e n c e(P<0.01);N o*,N o s i g n i f i c a n t d i f f e r e n c e(P>0.05).T h e s a m e a sb l o w图2合成肽引起的脾脏淋巴细胞增殖F i g.2S p l e e n l y m p h o c y t e p r o l i f e r a t i o n i n d u c e d b y s y n t h e t i c p e p t i d e s2.4T细胞亚群检测小鼠分别免疫P72-1㊁P72-2㊁P B S制备的合成肽疫苗56d后,取外周血对T淋巴细胞亚群表达水平情况进行比较,结果见图3㊂由图3可知,P72-2组的C D4+T淋巴细胞的比例最高,达到77.0%,其次是P72-1组占比75.9%,P B S组为70.6%㊂C D8+T淋巴细胞的比例最高的是P B S组,为27.8%,P72-1与P72-2占比分别为22.6%和21.6%㊂将合成肽疫苗组与P B S组的C D4+/C D8+比值进行分析,结果见图4㊂由图4可知,合成肽疫苗组的C D4+/C D8+比值显著高于P B S组(P< 0.05),且P72-2显著高于P72-1(P<0.05),表明P72-1㊁P72-2能显著诱导体液免疫与细胞免疫, P72-2诱导能力更强㊂68038期徐娅玲等:非洲猪瘟病毒P 72蛋白合成肽疫苗的构建及其免疫效力评估图3 T 细胞亚群检测结果F i g.3 D e t e c t i o n r e s u l t s o fTc e l l s u b s e ts 图4 T 细胞亚群C D 4+/C D 8+比值F i g.4 C D 4+/C D 8+r a t i o o fTc e l l s u b s e t s 2.5 细胞因子检测取免疫后42d 小鼠血清,通过E L I S A 方法检测小鼠外周血中细胞因子I F N -γ㊁I L -2㊁I L -4的含量㊂由图5可知,与P B S 组相比,P 72-1和P 72-2组的I F N -γ㊁I L -2㊁I L -4含量均升高,其中P 72-1和P 72-2组的I L -4㊁I L -2含量在免疫后42d 时极显著升高(P <0.01),在免疫后28d 时,除P 72-1组I L -2含量显著升高外(P <0.05),其合成肽疫苗组检测值均极显著升高(P <0.01);在免疫后14d 时,P 72-2组I F N -γ与I L -4含量均显著升高(P <0.05),P 72-1组I L -4含量极显著升高(P <0.01);P 72-1与P 72-2组细胞因子I L -4㊁I L -2㊁I F N -γ各个检测值之间均存在差异,但只在I L -2上存在显著性差异,表现为P 72-2组显著或极显著高于P 72-1组(P <0.05;P <0.01)㊂A ,I L -2;B ,I F N -γ;C ,I L -4图5 合成肽引起的细胞因子变化F i g .5 C y t o k i n e c h a n g e s i n d u c e db y s y n t h e t i c p e pt i d e s 7803中国畜牧兽医49卷3讨论非洲猪瘟是一种高度传染的出血性疾病,病死率接近100%[16],近年来在非洲㊁欧洲㊁亚洲等地频繁暴发,严重影响了区域间的生猪及猪肉副产品的贸易流通,对全球养猪业造成灾难性的打击[17],但其病原体A S F V结构复杂且缺乏负责诱导保护性免疫抗原的知识,尚未研发出有效的非洲猪瘟疫苗㊂P72是A S F V的主要结构蛋白,基因序列高度保守,在病毒感染后期表达,对病毒衣壳的形成具有重要意义[18],已有许多研究利用P72蛋白作为候选抗原研制疫苗㊂谢灵志[19]利用P72蛋白制备重组腺病毒载体疫苗注射小鼠后,引起了小鼠淋巴细胞的增殖及细胞因子分泌,显著增强了机体的细胞免疫应答水平;C h e n等[20]通过反向遗传学方法表达P72蛋白构建的新城疫病毒r N D V/P72,不仅在小鼠模型中产生了高水平的特异性I g G抗体,还促进了T淋巴细胞的增殖,提升了机体的免疫应答水平;但目前对于P72蛋白优势抗原表位的免疫效力研究还鲜有报道,因此,本研究利用P72蛋白的优势抗原表位制备了合成肽疫苗P72-1与P72-2,并对其免疫效力进行评估㊂利用生物信息学方法预测㊁筛选蛋白抗原表位已成为表位疫苗研究的首选方法,不仅能提升疫苗的安全性,同时能保留较强的抗原性[21]㊂本试验利用生物信息学方法对P72蛋白抗原表位进行分析预测,经筛选得到8个优势抗原表位,与传统表位筛选过程比,此方法有工作量小㊁准确性高等优点,并已成功应用在猪O型口蹄疫病毒合成肽疫苗的研究中[22]㊂本研究制备的合成肽疫苗P72-1与P72-2包含的优势B细胞与T细胞抗原表位在机体内引起了良好的免疫反应,间接E L I S A结果表明,免疫小鼠在首免14d后就产生了高效价特异性抗体,这与E V-D68病毒的合成肽疫苗引起的特异性抗体效果一致[23],证明筛选的抗原表位具有良好的免疫原性㊂本研究通过对免疫组小鼠外周血及血清检测发现免疫组小鼠的T细胞亚群指数与细胞因子增殖情况显著高于对照组,表明疫苗显著提高了机体的免疫应答水平㊂此外,淋巴细胞的增殖试验作为反映机体淋巴细胞增殖的一种方法,能有效评价机体的免疫功能[24],本试验结果显示免疫后脾脏淋巴细胞显著增殖情况,表明疫苗显著提高了机体的细胞免疫应答水平㊂唐华[22]构建的A型口蹄疫病毒合成肽疫苗在小鼠体内导致T细胞亚群显著变化;孟媛等[25]制备的塞尼卡病毒V P1蛋白的亚单位疫苗在小鼠模型中引发了显著的细胞因子变化;魏冰[26]在研究T h表位合成肽对O型口蹄疫病毒合成肽疫苗的增效作用中发现小鼠T淋巴细胞的转化率显著上升㊂这些研究都表明了具有良好免疫效力的疫苗能显著激活机体的免疫应答,本研究基于优势抗原表位设计的合成肽疫苗P72-1与P72-2具有良好的免疫效力㊂尽管本试验制备的合成肽疫苗免疫小鼠后在小鼠体内有较好的免疫反应,但A S F V的感染机制尚未完全明确,且未进行猪的免疫效力评价及攻毒保护试验,后续研究中还需继续筛选更多抗原的优势表位来优化疫苗的设计,以期能获得更好的免疫保护效果㊂4结论本研究初步探索了A S F V P72蛋白合成肽疫苗的免疫效力,通过分析P72蛋白的结构和预测其抗原表位,成功构建了多肽疫苗P72-1与P72-2,通过免疫小鼠,表明该疫苗具有良好的免疫原性,为A S F V多肽疫苗的研制奠定技术基础㊂参考文献(R e f e r e n c e s):[1] WA N G N,Z HA O D,WA N GJ,e t a l.A r c h i t e c t u r eo fA f r i c a ns w i n ef e v e rv i r u sa n di m p l i c a t i o n sf o rv i r a la s s e mb l y[J].Sc i e n c e,2019,366(6465):640-644.[2] R E V I L L A Y,PÉR E Z-NÚÑE Z D,R I C H T J A.A f r i c a n s w i n e f e v e r v i r u s b i o l o g y a n d v a c c i n ea p p r o a c h e s[J].A d v a n c e si n V i r u s R e s e a r c h,2018,100:41-74.[3]刘海余.浅谈非洲猪瘟[J].猪业科学,2018,35(10):127.L I U H Y.D i s c u s s i o n o n A f r i c a n s w i n ef e v e r[J].S w i n e I n d u s t r y S c i e n c e,2018,35(10):127.(i nC h i n e s e)[4] A T UHA I R ED K,A F A Y O A M,O C HWO S,e ta l.M o l e c u l a r c h a r a c t e r i z a t i o na n d p h y l o g e n e t i cs t u d y o fA f r i c a n s w i n e f e v e r v i r u s i s o l a t e s f r o m r e c e n to u t b r e a k si n U g a n d a(2010-2013)[J].V i r o l o g yJ o u r n a l,2013,10:247.88038期徐娅玲等:非洲猪瘟病毒P72蛋白合成肽疫苗的构建及其免疫效力评估[5] D I X O NLK,S T A H LK,J O R IF,e t a l.A f r i c a ns w i n ef e v e r e p i d e m i o l og y a n d c o n t r o l[J].A n n u a l R e v i e wo fA n i m a lB i o s c i e n c e s,2020,8:221-246.[6] O N E I L L X,WH I T E A,R U I Z-F O N S F,e t a l.M o d e l l i n g t h e t r a n s m i s s i o n a n d p e r s i s t e n c e o fA f r i c a ns w i n ef e v e ri n w i l d b o a ri n c o n t r a s t i n g E u r o p e a ns c e n a r i o s[J].S c i e n t i f i c R e p o r t s,2020,10(1):5895.[7]王华,王君玮,徐天刚,等.非洲猪瘟的疫情分布和传播及其控制[J].中国兽医科学,201040(4):438-440.WA N G H,WA N GJ W,X U T G,e ta l.R e v i e w o ns p r e a d,t r a n s m i s s i o n a n d c o n t r o lo f A f r i c a n s w i n ef e v e r[J].C h i n e s eV e t e r i n a r y S c i e n c e,2010,40(4):438-440.(i nC h i n e s e)[8] L I U L,WA N G X,MA O R,e ta l.R e s e a r c h p r o g r e s so n l i v e a t t e n u a t e dv a c c i n e a g a i n s tA f r i c a ns w i n e f e v e rv i r u s[J].M i c r o b i a l P a t h o g e n e s i s,2021,158:105024.[9] S C A D E N A-F E R NÁN D E ZE,SÁN C H E Z-V I Z C AÍN OJM,V A N D E NB O R N E,e t a l.H i g hd o s e so f i n a c t i v a t e dA f r i c a n s w i n e f e v e rv i r u sa r es a f e,b u td on o t c o n f e rp r o t e c t i o na g a i n s tav i r u l e n tc h a l l e n g e[J].V a c c i n e s,2021,9(3):242.[10] WU K,L I UJ,WA N GL,e t a l.C u r r e n t s t a t e o f g l o b a lA f r i c a ns w i n ef e v e rv a c c i n ed e v e l o p m e n tu n d e rt h ep r e v a l e n c ea n d t r a n s m i s s i o n o f A S F i n C h i n a[J].V a c c i n e s,2020,8(3):531.[11] WA N G F,Z HA N G H,H O U L,e ta l.A d v a n c eo fA f r i c a n s w i n e f e v e r v i r u s i n r e c e n t y e a r s[J].R e s e a r c hi nV e t e r i n a r y S c i e n c e,2021,136:535-539.[12] L I M H X,L I M J,P O H C L.I d e n t i f i c a t i o n a n ds e l e c t i o n o f i m m u n o d o m i n a n t B a n dTc e l l e p i t o p e s f o rd e n g u e m u l t i-e p i t o p e-b a s e d v a c c i n e[J].M e d i c a lM i c r o b i o l o g y a n dI m m u n o l o g y,2021,210(1):1-11.[13]高瞻,邵军军,常艳燕,等.非洲猪瘟病毒p72蛋白抗原表位预测分析及多表位疫苗的构建[J].中国兽医杂志,2020,56(1):13-17.G A O Z,S HA O JJ,C HA N G Y Y,e ta l.E p i t o p ep r e d i c t i o na n a l y s i so fA f r i c a ns w i n ef e v e rv i r u s p72p r o t e i na n dc o n s t r u c t i o no fm u l t i-e p i t o p ev a c c i n e[J].C h i n e s e J o u r n a l o f V e t e r i n a r y M e d i c i n e,2020,56(1):13-17.(i nC h i n e s e)[14] P H I L L I P S M E.E p i t o p e m a p p i n g o fA f r i c a ns w i n ef e v e r v i r u s p72c a p s i d p r o t e i nu s i n gp o l y c l o n a l.s w i n es e r aa n d m o n o c l o n a la n t i b o d i e s[D].K a n s a s:K a n s a sS t a t eU n i v e r s i t y,2016.[15]郭晶,李重阳,孟庆玲,等.非洲猪瘟病毒多表位融合蛋白P72的构建㊁表达及免疫学特性研究[J].家畜生态学报,2019,40(6):60-65.G U O J,L I C Y,M E N G Q L,e t a l.R e s e a r c h o nc o n s t r u c t i o n,e x p r e s s i o n a nd i m m u n o l o g i c a l c h a r a c te r i s t i c so fm u l t i-e p i t o p e f u s i o na n t i g e nP72o fA f r i c a ns w i n ef e v e r v i r u s[J].J o u r n a l o f D o m e s t i c A n i m a lE c o l o g y,2019,40(6):60-65.(i nC h i n e s e)[16] G A L I N D OI,A L O N S OC.A f r i c a ns w i n e f e v e r v i r u s:Ar e v i e w[J].V i r u s e s,2017,9(5):103. [17]刘雪婷,王召阳,鑫婷,等.非洲猪瘟病毒B438L蛋白的原核表达及其多克隆抗体的制备与鉴定[J].中国畜牧兽医,2021,48(3):991-1000.L I U X T,WA N G Z Y,X I N T,e ta l.P r o k a r y o t i ce x p r e s s i o na n d p o l y c l o n a la n t i b o d i e s p r e p a r a t i o na n di d e n t i f i c a t i o n o f A f r i c a n s w i n e f e v e r v i r u s B438Lp r o t e i n[J].C h i n aA n i m a l H u s b a n d r y&V e t e r i n a r yM e d i c i n e,2021,13(3):991-1000.(i nC h i n e s e)[18] B O R C A M V,I R U S T A P,C A R R I L L O C,e ta l.A f r i c a n s w i n e f e v e r v i r u s s t r u c t u r a l p r o t e i n p72c o n t a i n s a c o n f o r m a t i o n a l n e u t r a l i z i n g e p i t o p e[J].V i r o l o g y,1994,201(2):413-418.[19]谢灵志.表达A S F V保护性抗原重组腺病毒载体疫苗的初步研制[D].扬州:扬州大学,2019.X I E L Z.P r e l i m i n a r y s t u d y o fr e c o m b i n a n ta d e n o v i r a lv e c t o r v a c c i n ee x p r e s s i n g A S F V p r o t e c t i v ea n t i g e n[D].Y a n g z h o u:Y a n g z h o uU n i v e r s i t y,2019.(i nC h i n e s e) [20] C H E N X,Y A N G J,J I Y,e t a l.R e c o m b i n a n tN e w c a s t l e d i s e a s e v i r u s e x p r e s s i n g A f r i c a n s w i n ef e v e rv i r u s p r o t e i n72i ss a f ea n di m m u n og e n i ci nm i c e[J].V i r o l o g i c aS i n i c a,2016,31(2):150-159.[21] G E R S H O N I J M,R O I T B U R D-B E R MA N A,S I MA N-T O V D D,e t a l.E p i t o p e m a p p i n g[J].B i o D r u g s,2007,21(3):145-156.[22]唐华.A型口蹄疫病毒A F72株合成肽疫苗的研究及其免疫效力的评估[D].北京:中国农业科学院,2013.T A N G H.S t u d y a n d i m m u n i t y a s s e s s m e n t o fs y n t h e t i c p e p t i d e v a c c i n e s a g a i n s t A F72s t r a i n o fF o o t-a n d-m o u t h d i s e a s e v i r u s t y p e A[D].B e i j i n g:C h i n e s eA c a d e m y o fA g r i c u l t u r a lS c i e n c e s,2013.(i nC h i n e s e)[23]陈俊伊.E V-D68V P1亚单位疫苗和多肽疫苗的免疫原性及保护性研究[D].重庆:重庆医科大学,2020.C H E NJ Y.I m m u n o g e n i c i t y a n d p r o t e c t i o no fE V-9803中国畜牧兽医49卷D68V P1s u b u n i tv a c c i n ea n d p e p t i d e v a c c i n e[D].C h o n g q i n g:C h o n g q i n g M e d i c a lU n i v e r s i t y,2020.(i nC h i n e s e)[24]闫宗斌,伍生军,杨静,等.猪附红细胞体e n o基因重组蛋白的制备及免疫效果研究[J].中国畜牧兽医,2020,47(7):2231-2238.Y A N Z B,WU SJ,Y A N G J,e ta l.P r e p a r a t i o no fr e c o m b i n a n t p r o t e i n o f M y c o p l a s m a s u i s e n o g e n e a n di t s i m m u n i t y e f f e c t[J].C h i n aA n i m a l H u s b a n d r y&V e t e r i n a r y M e d i c i n e,2020,47(7):2231-2238.(i nC h i n e s e)[25]孟媛,曾嘉庆,于成东,等.塞尼卡病毒V P1蛋白亚单位候选疫苗小鼠免疫评价[J].中国兽医学报,2021,41(11):2085-2090.M E N G Y,Z E N G J Q,Y U C D,e t a l.I m m u n ee v a l u a t i o n of c a n d i d a t e S e n e c a v i r u s V P1p r o t e i ns u b u n i t v a c c i n e i n m i c e[J].C h i n e s e J o u r n a l o fV e t e r i n a r y,2021,41(11):2085-2090.(i nC h i n e s e) [26]魏冰.两种T h表位合成肽对O型口蹄疫病毒合成肽疫苗免疫增效作用的研究[D].天津:天津农学院,2016.W E I B.S t u d y o n s y n e r g i s t i c e f f e c t o f t w oT h e p i t o p e ss y n t h e t i c p e p t i d e so nO-t y p eF o o t-a n d-m o u t hd i s e a s ev i r u ss y n t h e t i c p e p t i d e v a c c i n e[D].T i a n j i n:T i a n j i nA g r i c u l t u r a lU n i v e r s i t y,2016.(i nC h i n e s e)(责任编辑董晓云)0903。
非洲猪瘟病毒p72蛋白的真核表达及反应原性鉴定

非洲猪瘟病毒p72蛋白的真核表达及反应原性鉴定梁云浩;曹琛福;叶奕优;花群义;张彩虹;曾少灵;陶虹;廖立珊;刘建利【摘要】将p72基因克隆到载体pFast Bac/ NT-TOPO上,转化大肠埃希菌DH5α.将获得的重组载体pFastBac/NT-TOPO-p72,转化大肠埃希菌DH10 Bac,获得重组杆状病毒质粒bacmid-p72.通过脂质体介导,将bacmid-p72转染sf9细胞,获得重组杆状病毒.用重组杆状病毒感染正常生长的sf9细胞,72 h后收集细胞,超声破碎后取上清进行SDS-PAGE和Western blot分析.结果显示,重组蛋白大小约78 ku,且重组蛋白可以与非洲猪瘟标准阳性血清反应.说明表达的重组蛋白为可溶性的,并具有良好的反应原性.【期刊名称】《动物医学进展》【年(卷),期】2015(036)006【总页数】5页(P29-33)【关键词】非洲猪瘟病毒;p72蛋白;脂质体介导;重组杆状病毒【作者】梁云浩;曹琛福;叶奕优;花群义;张彩虹;曾少灵;陶虹;廖立珊;刘建利【作者单位】深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045;暨南大学广东省分子免疫与抗体工程重点实验室,广东广州510632;深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045;深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045;深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045;深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045;深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045;深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045;深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045;深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045【正文语种】中文【中图分类】S852.651非洲猪瘟(African swine fever,ASF)是一种猪的急性传染病,因猪感染非洲猪瘟病毒(African swine fever virus,ASFV)引起。
非洲猪瘟病毒p72蛋白的原核表达和多克隆抗体制备

2021,43(1)DOI :10.13836/j.jjau.2021017江西农业大学学报Acta Agriculturae Universitatis Jiangxiensishttp :// 非洲猪瘟病毒p72蛋白的原核表达和多克隆抗体制备陈金凤,乐伟,何永,吴丽琴,贾宝玉,邓小淇,胡睿铭,黄冬艳,宋德平,邬向东,吴琼,唐玉新,丁珍*(江西农业大学动物科学技术学院,江西南昌330045)摘要:【目的】非洲猪瘟(african swine fever ,ASF )是一种以猪急性发病、高死亡率为典型特征的病毒病,其病原非洲猪瘟病毒(ASF virus ,ASFV )在中国的暴发给中国养猪业造成重大损失。
p72蛋白是ASFV 的主要衣壳蛋白,能够有效诱导机体产生特异性抗体,常被利用于检测试剂盒的备成。
【方法】构建了p72全长(pET-28a-ASFV-p72)及1-171aa 截短突变体(pET-28a-ASFV-p72-(1-171))原核表达质粒,通过E.coli 原核表达系统表达并纯化了p72全长及1-171aa 融合蛋白。
该2种蛋白经过4次免疫日本大耳白Balb/C 兔后,获得效价皆为大于1∶819200的多抗血清。
【结果】通过间接免疫荧光实验和Western blot 检测2种多抗均能与真核表达的p72蛋白发生特异性反应。
【结论】制备的针对p72多克隆抗体为后续诊断试剂盒的研发提供依据。
关键词:非洲猪瘟病毒;p72;原核表达;多克隆抗体中图分类号:S852.65+1文献标志码:A 文章编号:1000-2286(2021)01-0153-08Prokaryotic Expression of African Swine Fever Virusp72Proteinand Preparation of Polyclonal AntibodiesCHEN Jinfeng ,LE Wei ,HE Yong ,WU Liqin ,JIA Baoyu ,DENG Xiaoqi ,HU Ruiming ,HUANG Dongyan ,SONG Deping ,WU Xiangdong ,WU Qiong ,TANG Yuxin ,DING Zhen *(College of Animal Science &Technology ,Jiangxi Agriculturual University ,Nanchang 330045,China )Abstract :[Objective ]African swine fever (ASF )is a swine viral disease characterized with hemorrhagic fever and high mortality.The outbreak of African swine fever virus (ASFV )in China ,has caused huge damage to the swine industry.p72is the capsid protein of ASFV ,which can effectively induce specific antibodies ,and is always used in detect kit development.[Method ]In this study ,the p72full-length (pET-28a-ASFV-p72)收稿日期:2020‑09‑16修回日期:2020‑11‑02基金项目:江西省重点研发计划重点项目(20201BBF61004)和江西省自然科学基金面上项目(20202BAB205004)Project supported by the Key Research and Development Program of Jiangxi Province (20201BBF61004)and the Natural Science Foundation of Jiangxi Province (20202BAB205004)作者简介:陈金凤,/0000-0001-6862-677X ,*****************;*通信作者:丁珍,讲师,博士,主要从事冠状病毒研究,/0000-0002-5002,********************.cn 。
非洲猪瘟病毒的形态结构特征
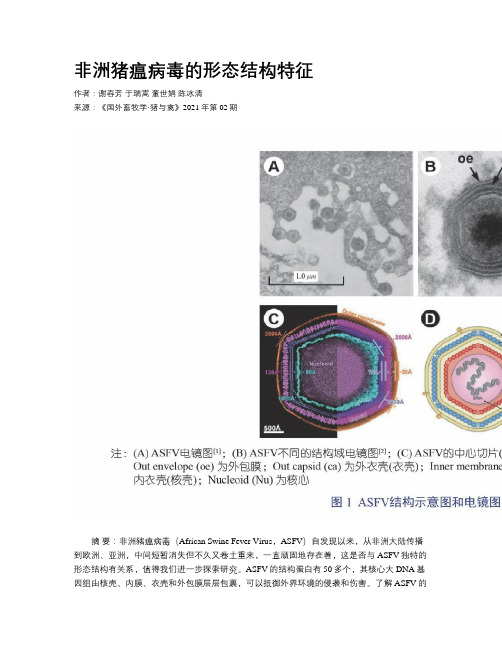
非洲猪瘟病毒的形态结构特征作者:谢春芳于瑞嵩董世娟陈冰清来源:《国外畜牧学·猪与禽》2021年第02期摘要:非洲豬瘟病毒(African Swine Fever Virus,ASFV)自发现以来,从非洲大陆传播到欧洲、亚洲,中间短暂消失但不久又卷土重来,一直顽固地存在着,这是否与ASFV独特的形态结构有关系,值得我们进一步探索研究。
ASFV的结构蛋白有50多个,其核心大DNA基因组由核壳、内膜、衣壳和外包膜层层包裹,可以抵御外界环境的侵袭和伤害。
了解ASFV的结构形态及组装机制,有助于深入解析ASFV的降解切入点,从而控制ASFV的复制,瓦解成熟的病毒粒子,让ASFV彻底从猪群、传播媒介中消失。
关键词:非洲猪瘟病毒;大DNA病毒;形态结构中图分类号:S855 文献标志码:C 文章编号:1001-0769(2021)02-0037-05非洲猪瘟病毒(African Swine Fever Virus,ASFV)是一种双链大DNA病毒,目前是非洲猪瘟病毒科(Asfarviridae)唯一的成员。
非洲猪瘟病毒粒子直径为250 nm~ 300 nm,基因组长度为170 kb~194 kb;细胞内ASFV粒子直径约200 nm,病毒基因组与核蛋白聚集成病毒核心,核心外包裹有蛋白核壳,核壳外包裹着脂质内膜,脂质内膜外是二十面体蛋白衣壳,最后通过出胞获得病毒外膜,成为一个成熟完整的ASFV粒子[1-5](图1)。
ASFV在环境中非常稳定,在4 ℃血液中可保存一年以上,在肉制品中可保存数周。
ASFV可在蜱类和猪中高效复制,并在两者之间循环传播[6]。
ASFV通过脱壳侵入细胞,病毒脱壳需要酸性环境破坏病毒的外膜和蛋白衣壳。
在细胞的内泡小体内,病毒的外膜和二十面体蛋白衣壳被破坏,暴露出病毒内膜,病毒内膜与细胞膜融合,病毒核质得以进入细胞质内,感染宿主细胞。
ASFV感染细胞后,在细胞质内质网附近的“病毒工厂(Viral Factories,VFs)”中进行复制[7]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有待进一步发现其他非结构蛋白对病毒毒力的影响
诱导免疫应答相关蛋白-结构蛋白E2
• CSFV糖蛋白中E2是最主要的免疫原性蛋白,其能够诱导机体 产生中和抗体并且能够保护CSFV强毒的攻击。 • E2的抗原位点主要分布在N 端690-866 位氨基酸残基上,分为 4 个抗原区:A、B、C 和D 区,分别位于766-865、690-799、 690-799和775-788位氨基酸残基之间。 • 693-716肽段可提供免疫保护(Dong et al,2006)。 • 目前报道的E2蛋白抗原表位主要位于775-865和775-812。 • E2单克隆抗体WH303识别一个在CSFV 中高度保守的表位, 其表位829TAVSPTTLR837(Lin et al,2000)。 • 我们小组鉴定771LLFDGTNP778为一保守的线性抗原表位 (Peng et al,2008)。
病毒复制相关蛋白
• CSFV NS5B蛋白具有RNA依赖的RNA聚合酶活性(RdRp) (Xiao et al,2002)。 • CSFV的复制起始于NS5B蛋白结合病毒的3-NCR,从而起始 病毒RNA的复制(Steffens et al,1999)。 • NS5A以及NS4B与NS5B蛋白能形成高度有序的复制酶复合体, 共同对CSFV的复制起作用(Sheng et al,2010)。 • NS3蛋白的RNA解旋酶活性能够提高病毒的翻译(Xiao et al,
2008)。
病毒复制相关蛋白-假说A
Moulin et al, 2007
• NS2通过与细胞的辅助因子Jiv的作用,将NS2-3蛋白剪切 成NS2、NS3蛋白,其中NS3蛋白与NS4A、NS4B、NS5A、 NS5B形成蛋白复制复合体,起始病毒的复制。
病毒复制相关蛋白-假说B
Moulin et al, 2007 • 非剪切的NS2-3蛋白与NS4A、NS4B、NS5A、NS5B形成蛋 白复制复合体,起始病毒的复制。非剪切的NS2-3蛋白与 NS4A形成的复合物有利于感染性病毒粒子形成。
问题和展望
• CSFV与宿主相互作用的机制仍有待阐清,特别 是在对宿主细胞的调控上,CSFV是如何通过自 身蛋白与宿主蛋白发生相互作用,从而帮助病毒 在细胞内进行复制和增殖。 • 目前对于CSFV细胞受体方面的研究较少,CSFV 在细胞中的复制和增殖需要多个受体的参与,进 一步鉴定CSFV的受体将为深入了解病毒提供帮 助。 • 通过研究CSFV与宿主细胞相互作用蛋白和通路, 能为进一步研究CSFV致病机理提供线索,为猪 瘟的防控寻找到新的途径。
病毒复制相关Leabharlann 白• 目前关于CSFV的复制过程仍不清晰,参与病毒复制的蛋 白及其在病毒复制过程中的作用仍需要进一步深入研究。
宿主细胞嗜性相关蛋白
• 有研究者用CSFV的E2基因替换BVDV的E2基因, 拯救的嵌合BVDV能够感染PK-15细胞,并且在 PK-15细胞中培养病毒能够达到较高滴度 (Reimann et al,2004)。因此,E2蛋白可能是 CSFV细胞嗜性的主要决定因素。
Brescia强毒685-686插入19个aa(RB-C22v弱毒),毒力减弱(Risatti et al, 2005) 糖基化位点806N和875N突变成A,每一个位点突变均导致毒力减弱(Risatti et al, 2007) E2
690 1062
829TAVSPTTLR837(WH303识别位点)对病毒毒力减弱起到重要作用(Risatti
猪瘟病毒
• 猪瘟病毒(classical swine fever virus, CSFV) 属于黄病毒科(Flaviviridae)瘟病毒属 (Pestivirus)成员。 • 单股正链RNA病毒。 • 与BVDV和BDV有血清学交叉反应性。
猪瘟病毒
• 病毒核酸为RNA,含 有唯一ORF,编码一 多聚蛋白。 • 二十面体对称,有囊膜, 直径34-35 nm。 • 病毒抵抗力不强,一般 5-10%石灰乳、2-3% 氢氧化钠、5%漂白粉 可杀死病毒。
NS4A
NS4B NS5A NS5B
参与病毒穿入和吸附的蛋白 及其细胞受体
• 猪瘟病毒感染细胞是通过外膜糖蛋白Erns和E2与细 胞表面蛋白的相互作用介导的。 • Erns与细胞表面受体硫酸乙酰肝素(HS)作用, 帮助病毒吸附细胞表面(Hulst et al, 2009)。 • 猪瘟病毒的E2受体未见报道,我们小组初步证明 宿主细胞蛋白CDx与E2蛋白之间存在相互作用, 可能是E2的一个受体。 • CSFV 病毒蛋白受体将是CSFV研究的一个热点。
猪瘟病毒蛋白的结构与功能
主要内容
• • • • • • • • • 猪瘟和猪瘟病毒 猪瘟病毒的结构蛋白和非结构蛋白 参与病毒穿入和吸附的蛋白及其细胞受体 病毒复制相关蛋白 宿主细胞嗜性相关蛋白 病毒毒力相关蛋白 免疫应答相关蛋白 与宿主相互作用的病毒蛋白 问题和展望
猪瘟
• 猪瘟(classical swine fever, CSF)是猪瘟病 毒引起的急性、发热性、出血性、高度致 死性传染病,死亡率高达80-90%。 • 世界动物卫生组织(OIE)将猪瘟列入须申 报动物疫病名录( OIE-listed, notifiable disease),我国将其列为一类传染病。 • 可呈急性、亚急性或慢性经过。
E1
E2
猪瘟病毒非结构蛋白
Npro
p7 NS2-3 非结构蛋白
第一个非结构蛋白,抑制IRF3转录,拮抗IFN-/产生
含70个氨基酸残基,分子量为6-7 kDa,参与离子通道? 进一步加工成NS2和NS3蛋白。存在3种形式,即NS2-3、 NS2和NS3,可能参与CSFV的致细胞病变作用 NS4A是由NS3的蛋白水解酶活性水解多聚蛋白产生的非 结构蛋白,由64个氨基酸残基组成 NS4B含有347个氨基酸残基,NS5A含有496个氨基酸残 基,NS4B和NS5A是病毒复制酶的组成成份 NS5B含有718个氨基酸残基,是病毒复制酶,具有RNA 依赖的RNA酶活性,NS5B识别并起始病毒基因组复制
诱导免疫应答相关蛋白-结构蛋白Erns
• Erns蛋白也可诱导中和抗体,针对Erns蛋白的抗体能够提供对猪 瘟的部分保护作用。 • 研究表明,Erns的抗原位点位于332-412位、351-427位和376487位氨基酸残基中(Lin et al, 2004)。 • 研究发现,Erns 376-412位和376-427 位氨基酸残基为构像依赖 型表位,可识别CSFV感染后所出现的抗体(Lin et al, 2005)。
• CSFV Npro蛋白能够通过抑制IRF3的转录,拮抗I 型干扰素的产生,从而逃避宿主的先天性免疫 (La Rocca et al, 2005)。
• 非结构蛋白在抑制宿主免疫中可能扮演着重要的 作用,尤其是抑制宿主的先天性免疫中。
与宿主相互作用的病毒蛋白
• CSFV引起一系列蛋白表达水平的变化。 • 膜联蛋白(Annexin 2,Ca2+-dependent cytosolic proteins binding to cellular membranes)HO-1(Heme oxygenase-1, 血红素加氧酶-1 )表达上调;Annexin 2与 E2蛋白存在相互作用(Tu et al, in press)。 • C蛋白与波形蛋白(Vimemtin)存在相互作 用(Qiu et al, unpublished)。
et al, 2006)
CSFV的糖蛋白Erns、E1和E2对病毒的毒力均有影响
病毒毒力相关蛋白-非结构蛋白
Npro基因缺失导致CSFV毒力的减弱 (Mayer et al,2004)
Npro
1
168
NS4B的2566VGI2568位点突变成AAA之后,CSFV毒力明显减弱 (Sainz et al,2010) NS4B
• 用随机肽库技术在Erns鉴定了中和性抗原表位,分别位于384386及322-323位、380-386 位氨基酸区域(Zhang et al, 2006)。
诱导免疫应答相关蛋白-非结构蛋白
• 非结构蛋白NS2-3能够诱导抗体的产生,具 有CSFV特异性B细胞表位。 • NS2-3还存在T细胞表位 1446KHKVRNEVMVHWFDD1460(Armengol, et al, 2002)。 • 在NS4A上鉴定出的一个T细胞表位 (2276ENALLVALF2284)(Armengol, et al, 2002)。
多聚蛋白
猪瘟病毒结构蛋白
衣壳蛋白C 第一个结构蛋白,分子量14 kDa, 能够调控病毒基因表达 Erns 囊膜糖蛋白 高度糖基化蛋白,具有内切核酸酶 活性,能够诱导机体产生中和抗体 包埋于病毒囊膜内,不诱导机体产 生中和抗体 主要的诱导机体产生中和抗体的糖 基化蛋白,大小在51-55 kDa
结构蛋白
猪瘟病毒编码蛋白
• 多聚蛋白裂解为4个结构蛋白和7个非结构蛋白。 • 结构蛋白(C、Erns、E1、E2)。 • 非结构蛋白(Npro、p7、NS2-3、NS4A、NS4B、 NS5A、NS5B)。
5-NCR Npro C Erns E1 E2 p7 NS2 NS3 4A NS4B NS5A NS5B 3-NCR
• 糖基化蛋白Erns和E1是否对CSFV的细胞嗜性有影 响有待研究。
病毒毒力相关蛋白-结构蛋白
糖基化位点269N突变成丙氨酸A或谷氨酰胺Q,毒力减弱(Sainz et al, 2008) Erns
268 494
糖基化位点594N突变成A,毒力减弱(Sainz et al, 2009)
E1
495 689
谢谢大家!
已经鉴定的抗原表位定位
384DKN386
Erns
268
771LLFDGTNP778 829TAVSPTTLR837
494
995YYEP998
