《第6讲 水解反应原理的应用》训练
盐类的水解及应用训练题

盐类的水解及应用训练题1.常温下,稀释0.1 mol·L-1 NH4Cl溶液,如图中的横坐标表示加水的量,则纵坐标可以表示的是( )A.NH+4水解的平衡常数B.溶液的pHC.溶液中NH+4数D.溶液中c(NH+4)解析:选B 温度不变,NH+4水解的平衡常数不变,故A项不符合题意;NH4Cl水解呈酸性,加水稀释,水解程度增大,但酸性减弱,溶液的pH将增大,溶液中NH+4数将减少,c(NH+4)也减小,故B项符合题意,C、D项不符合题意。
2.在一定条件下,Na2S溶液中存在水解平衡:S2-+H2-+OH-。
下列说法正确的是( )A.稀释溶液,水解平衡常数增大B.加入CuSO4固体,HS-浓度减小C.升高温度,c(HS-)/c(S2-)减小D.加入NaOH固体,溶液pH减小解析:选B 稀释溶液,水解平衡向正反应方向移动,但水解平衡常数只与温度有关,温度不变,水解平衡常数保持不变,A项错误;加入CuSO4固体,发生沉淀反应:Cu2++S2-===CuS↓,c(S2-)减小,S2-的水解平衡向逆反应方向移动,HS-浓度减小,B项正确;水解过程吸热,升高温度,水解平衡向正反应方向移动,c(HS-)增大,c(S2-)减小,c(HS-)/c(S2-)增大,C项错误;加入NaOH固体,c(OH-)增大,pH增大,D项错误。
3.相同温度、相同浓度下的八种溶液,其pH由小到大的顺序如图所示,图中①②③④⑤代表的物质可能分别为( )A.NH4Cl (NH4)2SO4CH3COONa NaHCO3 NaOHB.(NH4)2SO4NH4Cl CH3COONa NaHCO3 NaOHC.(NH4)2SO4NH4Cl NaOH CH3COONa NaHCO3D.CH3COONa NH4Cl (NH4)2SO4NaHCO3NaOH解析:选B 相同温度、相同浓度下的溶液,其pH从小到大的顺序为电离呈酸性<水解呈酸性<中性<水解呈碱性<电离呈碱性。
鲁科版高中化学选修四高二化学同步测试:3.2.3水解原理的应用.docx

高中化学学习材料唐玲出品第3章第2节第3课时(45分钟100分)一、选择题(本题包括10小题,每小题5分,共50分)1.(2011·清远高二质检)人们把NaHCO3作为发酵粉使用,往往加入少量的明矾,这样做的目的是( )A.明矾能起催化剂作用B.碳酸氢钾比碳酸氢钠更易分解C.明矾受热分解放出气体 D.铝盐在水中能起到酸的作用解析:明矾是KAl(SO4)2·12H2O,它在水中能发生水解反应:Al3++3H2OAl(OH)3+3H+,使其水溶液显酸性;水解产生的酸和碳酸氢钠反应生成二氧化碳气体,使面团疏松多孔。
答案: D2.实验室有下列试剂,其中必须用带橡胶塞的试剂瓶保存的是( )①NaOH溶液②水玻璃③Na2S溶液④Na2CO3溶液⑤NH4Cl溶液⑥澄清的石灰水⑦浓硫酸A.只有①⑥B.只有①②③④⑥C.只有①②③⑥D.只有①②③④解析:带玻璃塞的试剂瓶不能贮存碱液[如NaOH、Ca(OH)2溶液]、水解呈碱性的盐溶液(如Na2S、Na2CO3溶液)及具有黏性的溶液(如Na2SiO3溶液),这些物质必须用带橡胶塞的试剂瓶保存。
答案: B3.为了同时对某农作物施用分别含有N、P、K三种元素的化肥,对于给定的化肥:①K2CO3 ②KCl ③Ca(H2PO4)2 ④(NH4)2SO4 ⑤氨水最适合的组合是( )A.①③④ B.②③④C.①③⑤ D.②③⑤解析:K2CO3水解显碱性,Ca(H2PO4)2水解显酸性,(NH4)2SO4水解显酸性。
因此①不能和③、④搭配,⑤不能和③搭配。
答案: B4.在蒸发皿中加热蒸干并灼烧(<400 ℃)下列物质的溶液,可以得到该物质的固体的是( )A.AlCl3 B.NaHCO3C.MgSO4 D.Ca(HCO3)2解析:AlCl3发生水解,AlCl3+3H2O Al(OH)3+3HCl,加热时生成的HCl不断挥发,使上述平衡向右移动,致使不断生成Al(OH)3沉淀,最终经灼烧得到Al2O3固体。
高中化学盐类水解反应的应用(提高)巩固练习新人教版选修4(2021年整理)

高中化学盐类水解反应的应用(提高)巩固练习新人教版选修4编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学盐类水解反应的应用(提高)巩固练习新人教版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学盐类水解反应的应用(提高)巩固练习新人教版选修4的全部内容。
盐类水解反应的应用【巩固练习】一、选择题1.下列溶液中有关粒子的物质的量浓度关系正确的是()。
A.氯水中2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO)B.25℃时,pH=12的NaOH溶液与pH=12的氨水中c(Na+)=c(NH4+)C.pH=4的0.1 moL/L的NaHA溶液中c(HA-)>c(H+)>c(H2A)>c(A2-)D.等物质的量的Na2CO3、NaHCO3的混合溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+c(H2CO3)+2c (H+)2.0。
02 mol·L-1的HCN溶液与0。
02 mol·L-1的NaCN溶液等体积混合,测得溶液中的c(CN -)<c(Na+),则下列关系中不正确的是()A.c(Na+)>c(CN-)>c(OH-)>c(H+)B.c(HCN)+c(CN-)=0。
02 mol·L-1C.c(CN-)>c(HCN)D.c(Na+)+ c(H+)=c(CN-)+c(OH-)3.某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是( )A.①③ B.②③ C.①④ D.②④4.将标准状况下体积为2。
24 L的H2S缓慢通入100 mL 1.5 mol·L-1 NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系错误的是( )A.c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)B.c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-)C.c(Na+)>c(HS-)+c(S2-)+c(H2S)D.c(HS-)+c(S2-)+c(H2S)=1。
鲁科版高中化学选修4同步课时作业3.2.3水解平衡的移动和水解原理的应用

3.2.3水解平衡的移动和水解原理的应用一、单选题1.—定条件下,CH 3COONa 溶液中存在水解平衡:CH 3COO -+H 2O CH 3COOH+OH -。
下列说法正确的是( )A.加入少量NaOH 固体,c (CH 3COO -)减小B.升高温度,溶液的pH 增大C.稀释溶液,溶液的pH 增大D.通入少量HCl 气体,水解平衡常数减小2.为使Na 2S 溶液中c(Na +)/c(S 2-)的值减小,可加入的物质是( ) ①盐酸 ②适量的NaOH 溶液 ③适量的KOH 溶液 ④适量的KHS 溶液 A .①②B .②③C .③④D .①④3.下列关于盐类水解反应的应用说法正确的是( ) A.可以把FeCl 3固体直接溶于水制FeCl 3溶液 B.热的纯碱溶液去油污效果好C.Al(NO 3)3溶液与K 2S 溶液混合后无明显现象D.Mg 粉投入到饱和NH 4Cl 溶液中无明显现象4.对于等物质的量浓度的Na 2CO 3溶液和NaHCO 3溶液,下列说法不正确的是( ) A.升高温度,两种溶液的pH 均减小B.相同温度下两种溶液的pH:Na 2CO 3溶液>NaHCO 3溶液C.分别加入少量NaOH,两溶液中()2-3CO c 均增大D.两溶液中均存在++--2-33Na +H =OH +HCO +2CO ⎡⎤⎡⎤⎡⎤⎡⎤⎡⎤⎣⎦⎣⎦⎣⎦⎣⎦⎣⎦ 5.在一定条件下,Na 2CO 3溶液中存在水解平衡: 2-32CO +H O -3HCO +OH -.下列说法正确的是( )A.稀释溶液,水解平衡常数增大B.通入CO 2,水解平衡向正反应方向移动C.升高温度,()()-32-3HCO COc c 减小D.加入NaOH 固体,溶液的pH 减小6.现需同时对某农作物施用分别含有N 、P 、K 三种元素的化肥,已知给定的化肥有①K 2CO 3 ②KCl ③Ca(H 2PO 4)2 ④(NH 4)2SO 4 ⑤氨水,最合适的组合是( ) A.①③④ B.②③④ C.①③⑤ D.②③⑤7.下列有关说法与盐类的水解有关的是( ) ①NH 4Cl 溶液与ZnCl 2溶液可作焊接金属除锈剂②NaHCO 3与Al 2(SO 4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞 ⑤加热蒸干AlCl 3溶液得到Al(OH)3固体 A.仅①②③B.仅②③④C.仅①④⑤D.①②③④⑤8.下列关于盐类水解的应用的说法正确的是( )A.加热蒸干Na 2CO 3溶液,最后可以得到NaOH 和Na 2CO 3的混合固体B.除去MgCl 2溶液中的Fe 3+,可以加入NaOH 固体C.明矾净水过程中发生的反应:Al 3++3H 2OAl(OH)3(胶体)+3H +D.加热蒸干KCl 溶液,最后得到KOH 固体(不考虑CO 2的反应)9.已知同温度同浓度时,下列微粒的电离程度由大到小的顺序是H 2CO 3>H 2S >-3HCO >HS -,则下列说法正确的是( )A.反应Na 2CO 3+H 2S=NaHCO 3+NaHS 能够发生B. -23CO 结合H +的能力强于S 2-C.相同条件下,氢硫酸的酸性强于碳酸D.同温度下,同浓度的溶液中NaHS 的水解程度大于Na 2S10.25℃时,a mol ·L -1一元酸HA 溶液与b mol ·L -1 NaOH 溶液等体积混合后,pH 为7,则下列关系一定正确的是( ) A.a =b B.a >bC.反应后的溶液中:[A -]=[Na +]D.反应后的溶液中:[A -]<[Na +] 11.下列叙述不正确的是( )A.相同物质的量浓度的①CH 3COONa 溶液、②NaNO 3溶液、③NH 4Cl 溶液、④NaOH 溶液,pH 的大小顺序是④>①>②>③B.在Na 2SO 3和NaHSO 3的混合液中:c (Na +)+c (H +)=c (3HSO -)+c (OH -)+2c (2-3SO )C.相同条件下,pH=10的CH 3COONa 溶液和氨水中,由水电离出的c (OH -)前者大于后者D.某溶液中只含Na +、CH 3COO -、H +、OH -四种离子,则溶液一定显碱性 12.已知在常温下测得浓度均为0.1mol ·L -1的三种溶液的pH 如下:溶质NaHCO 3 Na 2CO 3NaCNA.其溶液中阳离子的物质的量浓度之和:Na 2CO 3>NaCN>NaHCO 3B.相同条件下的酸性:H 2CO 3<HCNC.三种溶液中均存在电离平衡和水解平衡D.升高23Na CO 溶液的温度,()()-32-3HCO COc c 减小13.下列有关问题,与盐的水解有关的是( ) ①4NH Cl 与2ZnCl 溶液可作焊接金属中的除锈剂 ②用3NaHCO 与243Al (SO )两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用④实验室盛放23Na CO 溶液的试剂瓶不能用磨口玻璃塞 ⑤加热蒸干3AlCl 溶液得到3Al(OH)固体A.①②③B.②③④C.①④⑤D.①②③④⑤ 二、填空题14.完成下列与水解有关的问题:1.要求设计实验证明盐类水解是吸热过程,有四位学生分别做了以下实验,其中根据实验现象得出的结论正确的是( )A.甲学生:在醋酸钠溶液中滴入酚酞试液,加热后溶液红色加深,说明盐类水解是吸热的B.乙学生:将硝酸铵晶体溶于水,水温下降,说明硝酸铵水解是吸热的C.丙学生:在盐酸中加入同温度的氨水,混合液的温度下降,说明盐类水解是吸热的D.丁学生:在醋酸钠溶液中加入醋酸钠晶体,溶液温度下降,说明盐类水解是吸热的2.在浓NH 4Cl 溶液中加入镁单质会产生气体,气体的成分是__________,用离子方程式表示产生上述现象的原因:__________。
化学反应原理-盐类水解原理的应用

6.判断溶液中离子能否共存 例如:Al3+、Fe3+与CO、HCO因为能发 生水解相互促进反应,在溶液中不能大量共 存。
7.判断盐溶液中离子种类 7.判断盐溶液中离子种类 + - 3- 2- 如 Na3PO4 溶液中存在 Na+ 、 3- 、 PO4 HPO2- 、 2PO- 、 H 4 4 如+Na3PO4 溶液中存在 Na 、 4 、 PO HPO4 、 2PO4 、 H - H+ 、OH- 离子。 H 、OH 离子。 8.采用加热的方法来促进溶液中某些盐的水解, 8.采用加热的方法来促进溶液中某些盐的水解, 使之生成氢氧化物沉淀, 以除去溶液中某些金属离 使之生成氢氧化物沉淀, 以除去溶液中某些金属离 子 子 3+ 例如: 不纯的 KNO3 溶液中常含有杂质 Fe3+ , 可用 例如: 不纯的 KNO3 溶液中常含有杂质 Fe , 可用 + 3 加热的方法来除去 KNO3 溶液中所含的 Fe3+ 。 加热的方法来除去 KNO3 溶液中所含的 Fe 。
第三节
盐类的水解反应
课时2 盐类水解原理的应用
1.用纯碱溶液清洗油污 加热 用纯碱溶液清洗油污时,____可增强去污能力。
2.化肥的施用 例如:草木灰与铵态氮肥不能混合施用,否 则会使肥效损耗,这是两种盐发生水解相互 促进反应放出氨气的缘故。
3.盐溶液的配制 例如:配制FeCl3溶液时常将FeCl3先溶于盐酸,再 加水稀释,目的是______________;配制Na2S溶 抑制Fe3+的水解 NaOH 液时需滴入几滴_______溶液。
4.用盐作净水剂 例如:利用FeCl3、明矾在水溶液中发生水 解产生的胶体,能吸附水eCl3饱和溶液,并加热至沸 腾以________________,从而制备Fe(OH)3 促进铁离子的水解 胶体。
鲁科版化学选修四《3.2.3 水解原理的应用》随堂练习(含答案)

1.(对应考点二)下列过程或现象与盐类水解无关的是 ( )A .纯碱溶液去油污B .加热稀醋酸溶液其pH 稍有减小C .NH 4Cl 与ZnCl 2溶液可作焊接中的除锈剂D .浓的硫化钠溶液有臭味解析:A 项,CO 2-3+H 2OHCO -3+OH -,OH -促进油脂水解;B 项,CH 3COOH CH 3COO -+H +,加热使电离平衡正向移动,c(H +)增大,pH 减小;C 项,NH +4、Zn 2+水解呈酸性,从而可以除锈;D 项,S 2-+H 2OHS -+OH -,HS -+H 2OH 2S +OH -,水解产生臭味的H 2S 。
答案:B 2.(对应考点三)在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )A .氯化铝B .碳酸氢钠C .硫酸镁D .氯化铵解析:氯化铝水解产生氢氧化铝,灼烧得氧化铝;氯化氨和碳酸氢钠受热分解。
答案:C3.(对应考点一)(2019·淄博高二检测)已知同浓度的HF 的酸性比H 2SO 3的酸性弱,判断在等浓度的NaF 、NaHSO 3混合溶液中,各种离子浓度关系正确的是 ( )A .c(HSO -3)>c(F -)>c(OH -)B .c(F -)>c(HSO -3)>c(H +)C .c(HF)+c(F -)=c(HSO -3)+c(H 2SO 3)D .c(Na +)+c(H +)=c(HSO -3)+c(F -)+c(OH -)解析:根据酸性强弱关系可知:酸根的水解程度F ->SO 2-3>HSO -3,所以A 项正确,B 项错误;溶液中的物料守恒关系为:c(HF)+c(F -)=c(HSO -3)+c(H 2SO 3)+c(SO 2-3),C 项遗漏了SO 2-3;溶液中的电荷守恒关系为:c(Na +)+c(H +)=c(HSO -3)+c(F -)+c(OH -)+2c(SO 2-3),D 项错误。
3.3盐类的水解课时2盐类水解原理的应用每课一练(苏教版选修4)

3.3 盐类的水解课时2 盐类水解原理的应用每课一练(苏教版选修4)1.(2009年高考全国卷Ⅰ)用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不.可能出现的结果是()A.c(NH+4)>c(Cl-),c(OH-)>c(H+)B.c(NH+4)=c(Cl-),c(OH-)=c(H+)C.c(Cl-)>c(NH+4),c(OH-)>c(H+)D.c(Cl-)>c(NH+4),c(H+)>c(OH-)解析:选C。
溶液中不可能出现阴离子均大于阳离子的情况,不遵循电荷守恒,故C 项错,A项为氨水过量较多的情况,B项为氨水适当过量,D项为氨水不足或恰好中和。
2.(2010年高考广东卷)HA为酸性略强于醋酸的一元弱酸。
在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是()A.c(Na+)>c(A-)>c(H+)>c(OH-)B.c(Na+)>c(OH-)>c(A-)>c(H+)C.c(Na+)+c(OH-)=c(A-)+c(H+)D.c(Na+)+c(H+)=c(A-)+c(OH-)解析:选D。
本题考查离子浓度的大小比较,意在考查考生对溶液中离子水解平衡的理解和分析能力。
HA为一元弱酸,则NaA为强碱弱酸盐,溶液由于A-的水解显碱性,离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+),A项错误,B项错误;根据溶液中电荷守恒,则c(Na+)+c(H+)=c(A-)+c(OH-),C项错误,D项正确。
3.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol/L的NaA和NaB 混合溶液中,下列排序正确的是()A.c(OH-)>c(HA)>c(HB)>c(H+)B.c(OH-)>c(A-)>c(B-)>c(H+)C.c(OH-)>c(B-)>c(A-)>c(H+)D.c(OH-)>c(HB)>c(HA)>c(H+)解析:选A。
水解平衡及其移动和强化练习
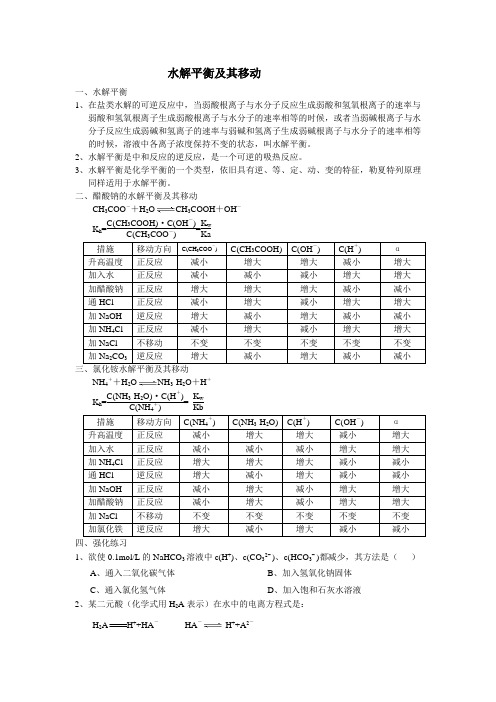
水解平衡及其移动一、水解平衡1、在盐类水解的可逆反应中,当弱酸根离子与水分子反应生成弱酸和氢氧根离子的速率与弱酸和氢氧根离子生成弱酸根离子与水分子的速率相等的时候,或者当弱碱根离子与水分子反应生成弱碱和氢离子的速率与弱碱和氢离子生成弱碱根离子与水分子的速率相等的时候,溶液中各离子浓度保持不变的状态,叫水解平衡。
2、水解平衡是中和反应的逆反应,是一个可逆的吸热反应。
3、水解平衡是化学平衡的一个类型,依旧具有逆、等、定、动、变的特征,勒夏特列原理同样适用于水解平衡。
二、醋酸钠的水解平衡及其移动CH3COO-+H2O CH3COOH+OH-K h=C(CH3COOH)·C(OH-)C(CH COO-)=K wKaNH4++H2O NH3·H2O+H+K h=C(NH3·H2O)·C(H+)C(NH+)=K wKb四、强化练习1、欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32¯)、c(HCO3¯)都减少,其方法是()A、通入二氧化碳气体B、加入氢氧化钠固体C、通入氯化氢气体D、加入饱和石灰水溶液2、某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A H++HA-HA-H++A2-回答下列问题:(1)Na2A溶液显____________(填“酸性”,“中性”,或“碱性”)。
理由是____________________________________________(用离子方程式表示)(2)在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________A、c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1B、c(OH-)=c(H+) +c( HA-)C、c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-)D、c(Na+ )= 2c(A2-) +2c( HA-)(3)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度可能是_______0.11 mol·L-1(填“<”,“>”,或“=”),理由是:____________________________________________________________(4)0.1mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是:___________________________________________________________3、已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是()A、在Na2A、NaHA两溶液中,离子种类不相同B、在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等C、在NaHA溶液中一定有:C(Na+)+C(H+)=C(HA-)+C(OH-)+2C(A2-)D、在Na2A溶液中一定有:C(Na+)>C(A2-)> C(H+)>C(OH-)4、将标准状况下的2.24L CO2通入150mL1mol/LNaOH溶液中,下列说法正确的是A、c(HCO3-)略大于c(CO32—)B、能使酸性高锰酸钾溶液褪色C、c(Na+)等于c(CO32—)与c(HCO3—)之和D、c(HCO3—)略小于c(CO32—)5、草酸是二元弱酸,草酸氢钾溶液呈酸性。
高二《化学反应原理》3.2 第3课时 水解原理的应用 课时提升进阶 (答案+解析)

课时提升作业十六水解原理的应用(40分钟·70分)一、选择题(本题包括12小题,每小题4分,共48分)1.化学与生活密切相关,下列与盐类水解无关的是( )A.纯碱去油污B.食醋除水垢C.明矾净化水D.NH4Cl除铁锈【解析】选B。
纯碱是碳酸钠,碳酸钠水解溶液显碱性,可以与油污发生皂化反应达到去除油污的目的,A与水解有关;食醋(醋酸)与水垢(碳酸钙)反应,实际是利用醋酸的酸性,B与水解无关;明矾净水,是利用铝离子水解得到的氢氧化铝胶体的吸附能力,C与水解有关;氯化铵水解显酸性,可以与氧化铁反应,D与水解有关。
2.下列过程或现象与盐类水解无关的是( )A.纯碱溶液去油污B.加热稀醋酸溶液其pH稍有减小C.NH4Cl与ZnCl2溶液可作焊接中的除锈剂D.浓的硫化钠溶液有臭味【解析】选B。
加热稀醋酸pH减小,是弱酸的电离,不是盐类的水解。
3.下列现象或过程与水解无关的是( )A.配制FeCl2溶液时常常要在溶液中加入少量铁粉B.K2FeO4具有杀菌、消毒作用,并且是良好的净水剂C.向NH4Cl溶液中加入镁粉,产生可燃性气体D.向肥皂水中滴入酚酞试剂变红色【解析】选A。
A项,配制FeCl2加入铁粉的目的是防止Fe2+被氧化,与水解无关;B 项,K2FeO4中铁元素为+6价,具有强氧化性,其还原产物Fe3+水解:Fe3++3H 2O Fe(OH)3(胶体)+3H+,Fe(OH)3胶体能净水;C项,N+H 2O NH3·H2O+H+、2H++Mg Mg2++H2↑;肥皂的主要成分是高级脂肪酸钠,水解使溶液显碱性。
4.将下列固体物质溶于水,再将其溶液加热,蒸发结晶,再灼烧,得到化学组成与原固体物质相同的是( )①胆矾②氯化铝③硫酸铝④氯化铜A.③B.①④C.①②③④D.全部【解析】选A。
胆矾CuSO4·5H2O溶于水得CuSO4溶液,因硫酸难挥发、蒸发结晶再灼烧得CuSO 4;AlCl3、CuCl2发生水解,AlCl3+3H2O Al(OH)3+3HCl,CuCl2+2H2O加热时HCl不断挥发,平衡右移,不断生成Al(OH)3、Cu(OH)2沉Cu(OH)淀,灼烧得Al 2O3、CuO;Al2(SO4)3+6H2O2Al(OH)3+3H2SO4,硫酸难挥发,最终仍得Al2(SO4)3。
2021年高中化学 3.2.3水解原理的应用每课一练(含解析)鲁科版选修4

2021年高中化学 3.2.3水解原理的应用每课一练(含解析)鲁科版选修4一、选择题(本题包括7小题,每小题3分,共21分)1.下列现象或过程与水解无关的是联单 ( )A.Na2CO3溶液不能用带磨口玻璃塞试剂瓶存放B.K2FeO4具有杀菌、消毒作用,并且是良好的净水剂C.向NH4Cl溶液中加入镁粉,产生可燃性气体D.向稀H2SO4中滴入石蕊试剂变红色解析:A项,Na2CO3中CO2-3水解显碱性,与玻璃的成分SiO2反应,日久瓶塞与瓶口粘结;B项,K2FeO4中铁元素为+6价,具有强氧化性,其还原产物Fe3+水解:Fe3++3H2OFe(OH)3(胶体)+3H+,Fe(OH)3胶体净水;C项,NH+4+H2ONH3·H2O+H+、2H++Mg===Mg2++H2。
答案:D2.(xx·唐山高二检测)实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是( )A.防止硫酸铁分解B.抑制硫酸铁水解C.促进硫酸铁溶解D.提高溶液的pH解析:加入稀H2SO4的目的是为抑制Fe3+的水解。
答案:B3.下列盐的溶液蒸干时,能得到原物质的是( )A.Na2SO3B.FeCl2C.KNO3D.NH4HCO3解析:A项,2Na2SO3+O2===2Na2SO4;B项,Fe2++2H2OFe(OH)2+2H+,4Fe(OH)2+O2+2H2O===4Fe(OH)3;C项,KNO3中无水解离子;D项,NH4HCO3=====△NH3+CO2+H2O。
答案:C4.下列根据反应原理设计的应用,不.正确的是( )A.CO2-3+H2OHCO-3+OH-热的纯碱溶液清洗油污B.Al3++3H2OAl(OH)3+3H+明矾净水C.TiCl4+(x+2)H2O(过量) TiO2·x H2O+4HCl用TiCl4制备TiO2D.SnCl2+H2OSn(OH)Cl+HCl 配制氯化亚锡溶液时加入氢氧化钠解析:A项,加热使平衡向右移动,溶液碱性增强,有利于除油污;D项,根据平衡移动原理可知,向溶液中加入氢氧化钠,平衡向氯化亚锡水解的方向移动,所以D错。
盐类水解的应用(同步练习) 高二化学同步精品课堂(人教版2019选择性必修1)(原卷版)

第三章水溶液中的离子反应与平衡第三节盐类的水解第3课时盐类水解的应用一.选择题1.现需同时对某农作物施用分别含有N、P、K三种元素的化肥,已知给定的化肥有①K2CO3②KCl③Ca(H2PO4)2④(NH4)2SO4⑤氨水,最合适的组合是( )A.①③④B.②③④C.①③⑤D.②③⑤2. 下列关于FeCl3水解的说法错误的是( )A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均向右移动B.浓度为5 mol⋅L−1和0.5 mol⋅L−1的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者小于后者C.其他条件相同时,同浓度的FeCl3溶液在50 ℃和20 ℃时发生水解,50 ℃时Fe3+的水解程度比20 ℃时的小D.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸3.将下列固体物质溶于水,再将其溶液加热,蒸发结晶再灼烧,得到化学组成与原固体物质相同的是( )①胆矾②氯化铝③硫酸铝④氯化铜A.③B.①④C.①②③D.全部4.下列关于盐类水解反应的应用的说法正确的是( )A.可以把FeCl3固体直接溶于水制FeCl3溶液B.热的纯碱溶液去油污效果好C.AlCl3溶液与K2S溶液混合后无明显现象D.将Mg粉投入饱和NH4Cl溶液中无明显现象5.对滴有酚酞的不同溶液,下列操作后颜色变深的是( )A.明矾溶液加热B.CH3COONa溶液加热C.氨水中加入少量NH4Cl固体D.小苏打溶液中加入少量NaCl固体6. 下表是Fe2+、Fe3+、Zn2+被OH−完全沉淀时溶液的pH。
某硫酸锌酸性溶液中含有少量Fe2+、Fe3+杂质,为制得纯净的ZnSO4,应加入的试剂是( )金属离子Fe2+Fe3+Zn2+完全沉淀时的pH7.7 4.5 6.5A.H2O2、ZnOB.氨水C.KMnO4、ZnCO3D.NaOH溶液7. 为了得到比较纯净的物质,使用的方法恰当的是( )A.向Na2CO3饱和溶液中通入过量的CO2后,在加压、加热的条件下,蒸发得到NaHCO3晶体B.加热蒸发AlCl3饱和溶液可得到纯净的AlCl3晶体C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体D.向FeCl3溶液中加入足量的NaOH溶液,经过滤、洗涤沉淀,再充分灼烧得到Fe2O38.(不定项)《本草纲目》中对白矾之用有如下叙述:“吐利风热之痰涎,取其酸苦涌泄也;治诸血痛,脱肛……取其酸涩而收也”。
高中化学第三章物质在水溶液中的行为第2节第3课时水解原理的应用学案鲁科版选修

第3课时水解原理的应用1.了解盐类水解在生产生活中的应用。
2.会比较溶液中粒子浓度的大小。
(重点)3.通过了解盐类水解的应用,进一步体会化学对社会发展的作用.授课提示:对应学生用书第55页知识点盐类水解的应用1.通过促进盐类的水解应用其产物(1)热碱水去油污:纯碱水解的离子方程式为CO错误!+H2O HCO错误!+OH-,加热促进CO错误!的水解,溶液碱性增强,去污能力增强。
(2)泡沫灭火器的原理:泡沫灭火器中的Al2(SO4)3和NaHCO3发生水解相互促进的反应,离子方程式为Al3++3HCO错误!===Al(OH)3↓+3CO2↑。
(3)盐类作净水剂:铝盐、铁盐等部分盐类水解生成胶体,有较强的吸附作用,常用作净水剂。
明矾净水原理为Al3+水解生成的Al(OH)3胶体吸附水中的悬浮物,加速悬浮物的沉降,达到净水的作用,水解的离子方程式为Al3++3H2O Al(OH)3+3H+。
2.通过抑制盐类的水解保证所需物质的存在实验室中配制、保存SnCl2和FeCl3等易水解的盐溶液时为防止Sn2+、Fe3+的水解,通常加入适量盐酸。
SnCl2在水溶液中水解生成沉淀的化学方程式为SnCl2+H2O===Sn(OH)Cl↓+HCl。
[自我诊断](1)同浓度纯碱溶液比小苏打溶液的去污能力强。
(√)(2)配制FeCl3溶液时,为防止Fe3+的水解,可加入适量盐酸或硫酸、硝酸。
(×)(3)实验室保存Na2S溶液时必须用带橡胶塞的试剂瓶。
(√)授课提示:对应学生用书第55页要点一盐类水解的综合应用[典例1] 下列有关问题,与盐的水解有关的是()①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞⑤Na2S溶液呈碱性A.①②③B.②③④C.①④⑤ D.①②③④⑤解析:①中NH4Cl与ZnCl2溶液水解均显酸性,可以除去金属表面的锈;②用HCO错误!与Al3+两种离子水解相互促进,产生二氧化碳,可作灭火剂;③草木灰主要成分为碳酸钾,水解显碱性,而铵态氮肥水解显酸性,因而不能混合施用;④碳酸钠溶液水解显碱性,而磨口玻璃塞中的二氧化硅会与碱反应生成硅酸钠将瓶塞与瓶口黏合而打不开,因此实验室盛放碳酸钠的试剂瓶应用橡胶塞;⑤Na2S溶液水解生成碱Na2S+H2O NaOH+NaHS,故其溶液呈碱性。
2020-2021学年高中化学 第三章 物质在水溶液中的行为 第2节 第3课时 水解原理的应用作

第3课时水解原理的应用一、选择题1.25 ℃时,将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,下列关系式正确的是( ) A.[NH+4]=[SO2-4]B.[NH+4]>[SO2-4]C.[NH+4]<[SO2-4]D.[OH-]+[SO2-4]=[H+]+[NH+4]解析:25 ℃时,由于溶液的pH=7,故溶液呈中性,即[H+]=[OH-]。
由电荷守恒得,[NH+4]+[H+]=[OH-]+2[SO2-4],则D项错误;由上述两个等式得,[NH+4]=2[SO2-4],则A、C项错误,B项正确。
答案:B2.实验室有下列试剂,其中必须用带橡胶塞的试剂瓶保存的是( )①NaOH溶液②水玻璃③Na2S溶液④Na2CO3溶液⑤NH4Cl溶液⑥澄清的石灰水⑦浓硫酸A.只有①⑥B.只有①②③④⑥C.只有①②③⑥ D.只有①②③④解析:带玻璃塞的试剂瓶不能贮存碱液。
[如NaOH、Ca(OH)2溶液],水解呈碱性的盐溶液(如Na2S、Na2CO3溶液)及具有黏性的溶液(如Na2SiO3溶液),这些物质必须用带橡胶塞的试剂瓶保存。
答案:B3.硫化氢的水溶液中存在动态平衡:H2S H++HS-;HS-H++S2-;H2O H++OH-。
在物质的量浓度为0.1 mol·L-1的H2S溶液中,下列各离子浓度的关系正确的是( ) A.[H+]=[HS-]+2[S2-]+[OH-]B.2[H+]=2[HS-]+[S2-]+2[OH-]C.[H+]=[HS-]+2[S2-]D.[H+]=2[S2-]+[OH-]解析:解本题的关键是先要分析清楚硫化氢的水溶液中存在哪些离子,再从守恒的角度分析题目。
H2S为二元弱酸,所以其在水溶液中不能完全电离。
由电荷守恒得,[H+]=[HS-]+2[S2-]+[OH-]。
本题选A。
答案:A4.分别将下列物质:①CuSO4、②Na2O2、③NaCl、④Ca(HCO3)2、⑤FeCl3投入水中,对其溶液加热蒸干,仍能得到原物质的是( )A.①②③ B.①③C.③④ D.③解析:Na2O2与水反应生成NaOH,Ca(HCO3)2受热分解生成CaCO3,FeCl3水解生成的HCl受热挥发,加热蒸干时得到Fe(OH)3固体。
水解反应专题练习

水解反应专题练习水解反应是化学反应中的一种非常重要的类型,本文将给出一些常见的水解反应练题以及解题思路,帮助读者加深对水解反应的理解。
问题一某钠盐A 的化学式为 Na2A,已知它在水中水解,生成NaOH 和 HA 两种物质,其中 HA 的化学式为 HxAOy。
试写出物质 HA 的化学式。
解答根据题意可得下列化学方程式:Na2A + H2O → NaOH + HA根据化学方程式可知,生成的 HA 分子中含有 x 个 H 原子和 y 个 O 原子。
另外,当生成的A2− 离子数量增多时,HA 分子所含的H 原子、O 原子数量也会逐渐增多。
因此,HA 分子的化学式应为HxAOy。
问题二某物质 B 在水中水解,生成 HNO2 和 HBrO。
试写出物质 B 的化学式。
解答根据化学方程式可得下列化学方程式:B + H2O → HNO2 + HBrO可以看出,水解生成的 HNO2 分子中含有一个 N 原子和两个O 原子,而 HBrO 分子中含有一个 Br 原子和一个 O 原子。
因此可以推断,B 分子应该是一种含有 N 和 Br 元素的单质,即化学式为BrN。
问题三某物质 C 在水中水解,生成 NaOH 和 CH3COOH。
试写出物质C 的化学式。
解答根据化学方程式可得下列化学方程式:C + H2O → NaOH + CH3COOH可以看出,水解生成的 CH3COOH 分子中含有 2 个 C 原子、4 个 H 原子和 2 个 O 原子,而 NaOH 分子中含有一个 Na 原子和一个O 原子。
因此可以推断,C 分子应该是一种含有 2 个 C 原子和 1 个Na 原子的有机盐,即化学式为 NaC2H3O2。
高二化学 水解原理的应用

Al3++3OH- Al(OH)3(Ⅲ)
在上述混合溶液中发生的(Ⅰ)、(Ⅱ)、(Ⅲ) 反应,都可以降低[H+]和[OH-],使Al3+的 水解平衡和HCO3-的水解平衡均向右移动, 最终生成Al(OH)3沉淀和CO2气体。
1.下列过程或现象与盐类水解无关的是( ) A.纯碱溶液去油污 B.铁在潮湿的环境下生锈 C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭鸡蛋味 解析: 碳酸钠水解显碱性,可以去油污,加
(2)彻底的双水解反应:若相互促进程度很大, 能使双方水解反应进行彻底的双水解反应,中 学阶段常见的此类反应有:
连线的阴、阳离子在水溶液中均发生彻底的双 水解反应。
(3)判断双水解反应是否彻底的方法:若双水 解反应的逆反应不能发生,则该双水解反应为 彻底的双水解反应,否则为不彻底的双水解反 应。如Al3++3HCO3-===Al(OH)3↓+3CO2↑, 该反应的逆反应不能发生,故为彻底的双水解 反应。
(2)配制强碱弱酸盐的水溶液:应加入少量强 碱,抑制弱酸根水解。如配制硫化钠的水溶液 时,应先滴入几滴氢氧化钠溶液,再加水冲稀 至所需浓度。
2.试剂的保存
某些实验试剂贮存时要考虑到盐的水解。如 Na2CO3溶液因水解使溶液呈碱性,OH-与玻 璃的主要成分SiO2反应生成硅酸盐,使试剂瓶 颈与瓶塞粘结,因而不能用带磨口玻璃塞的试 剂瓶贮存,可用带橡胶塞或软木塞的试剂瓶保 存。
第3课时 水解原理的应用
1.了解盐类水解在生产生活中 的应用。
2.通过了解盐类水解的应用, 进一步体会化学对社会发展的作 用。
盐类水解在生产生活中的应用 1.硫酸铝钾或硫酸铝净水 离子方程式为:Al3++3H2O Al(OH)3+3H+。 2.热碱水去油污 离子方程式为:CO32-+H2O HCO3-+OH-。加热促 进 CO32-水解碱性增强,去污能力增强。
高二化学必修同步练习水解

2019年高二化学必修同步练习水解大家把理论知识复习好的同时,也应该要多做题,从题中找到自己的不足,及时学懂,下面是查字典化学网小编为大家整理的2019年高二化学必修同步练习,希望对大家有帮助。
取一定量饱和FeCl3(aq),进行如下实验:(1)加入少量NaOH(s),FeCl3的水解程度______________(填增强减弱或不变)。
(2)将溶液加热蒸干,并灼热,最后得到的固体是______________(写化学式)。
(3)FeCl3(aq)中通入HCl(g),溶液的pH______________(填增大减小或不变),FeCl3的水解程度______________(填增强减弱或不变)。
(4)向FeCl3(aq)中滴加石蕊试液,现象是______________。
(5)向FeCl3(aq)中加入过量的Mg片,现象是______________。
解析:(1)Fe3++3H2O Fe(OH)3+3H+加碱FeCl3水解程度增大。
(2)FeCl3+3H2O Fe(OH)3+3HCl 加热HCl挥发,灼烧Fe(OH)3时,2Fe(OH)3 Fe2O3+3H2O。
(3)FeCl3中加入HCl(g),pH升高,水解程度减小,抑制其水解。
(4)由于FeCl3水解溶液显酸性,加入石蕊变红。
(5)由于FeCl3水解显酸性,加入Mg后Mg+2H+====Mg2++H2。
答案:( 1)增强Q,Fe2O3(3)增大减弱(4)变红(5)有气体冒出拓展探究14.常温下,将0.01 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L 混合溶液。
判断:(1)溶液中共有______________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01 mol,它们是______________和______________。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=______________mol。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《第6讲水解反应原理的应用》训练1.(2012·江苏·5)下列有关物质的性质与应用不相对应的是()A.明矾能水解生成Al(OH)3胶体,可用作净水剂B.FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路C.SO2具有氧化性,可用于漂白纸浆D.Zn 具有还原性和导电性,可用作锌锰干电池的负极材料【答案】C【解析】A.KAl(SO4)2·12H2O = K++Al3++2SO42-+12H2OAl3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3(胶体)具有吸附性,A正确;B.2FeCl3 +Cu=2FeCl2+CuCl2,可用于蚀刻印刷电路,B正确;C.SO2能与有色物质化合生成不稳定的无色物质,加热后颜色恢复,不是因为具有氧化性,C错误;D.Zn 具有还原性和导电性,可用作锌锰干电池的负极材料,失去电子,D正确。
2.(2007·上海·6)下列过程或现象与盐类水解无关的是()A.纯碱溶液去油污B.铁在潮湿的环境下生锈C.加热氯化铁溶液颜色变深D.浓硫化钠溶液有臭味【答案】B【解析】A.纯碱水解显碱性,促进油脂水解去油污,有关;B.铁在潮湿的环境下生锈,因为形成原电池,无关;C.加热促进Fe3+水解,生成更多Fe(OH)3,颜色变深,有关;D.S2-+H2O HS-+OH-,HS-+H2O H2S+OH-,有关。
3.(2007·上海·13)下列关于盐酸与醋酸两种稀溶液的说法正确的是()A.相同浓度的两溶液中c(H+)相同B.100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠C.pH=3的两溶液稀释100倍,pH都为5D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小【答案】B【解析】A.盐酸是强酸,醋酸是弱酸,相同浓度的两溶液中盐酸中c(H+)大,A错误;B.盐酸与醋酸都是一元酸,HCl+NaOH=NaCl+H2O,CH3COOH+NaOH=CH3COONa+H2O,等物质的量的两溶液能中和等物质的量的氢氧化钠,B正确;C.pH=3的两溶液稀释100倍,盐酸pH为5,醋酸是弱酸,稀释后电离程度增大,pH>5,C错误;D.NaCl是强酸强碱盐,不水解,不影响c(H+),CH3COONa是弱酸强碱盐,CH3COO -结合H+使c(H+)明显减小,D错误。
4.(2012·北京理综·25)直接排放含SO2的烟气会形成酸雨,危害环境。
利用钠碱循环法可脱除烟气中的SO2,(3)吸收液吸收SO2的过程中,pH随n(SO32-) : n(HSO3-)变化关系如下表:n(SO32-) : n(HSO3-) 91 : 9 1 : 1 1 : 91pH 8.2 7.2 6.2①上表NaHSO3溶液显性,用化学平衡原理解释:。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):。
a.c(Na+)=2c(SO32-)+c(HSO3-)b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)= c(OH-)c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)【答案】(3)酸;HSO3-存在电离HSO3-= H+ + SO32-和水解HSO3-+H2O = H2SO3+ OH-,HSO3-电离的程度大于水解程度。
ab。
【解析】(3)HSO3-是弱酸根,电离程度很小,n(SO32-) : n(HSO3-)= 1 : 91时,pH=6.2,可判断NaHSO3溶液显酸性;NaHSO3溶液中,NaHSO3=Na++HSO3-,HSO3-H+ + SO32-,HSO3-+H2O H2SO3+ OH-,HSO3-的电离程度大于水解程度,所以显酸性;吸收液呈中性时,c(H+)= c(OH-)a.由电荷守恒c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-),所以c(Na+)=2c(SO32-)+c(HSO3-),a正确,c错误;b.发生水解的离子浓度减小,c(Na+)> c(HSO3-),弱酸电离程度很小,c(HSO3-)>c(SO32-),NaHSO3溶液显酸性,要使溶液呈中性,必须加碱中和H+,会促进SO32-的生成,所以c(SO32-)>c(H+)= c(OH-),b正确;5.(2012·浙江理综·26)(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是。
(用化学方程式表示)。
由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是。
【答案】(2)2CuCl2•2H2O △Cu2(OH)2•CuCl2+2HCl+2H2O;(主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可)在干燥的HCl气流中加热脱水。
【解析】(2)加热会促进Cu2+水解:CuCl2•2H2O△Cu(OH)2+2HCl↑,Cu(OH)2△CuO+H2O,或2CuCl2•2H2O △Cu2(OH)2•CuCl2+2HCl+2H2O;(主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可),为了抑制水解,在干燥的HCl气流中加热脱水。
6.(2011·江苏·4)常温下,下列各组离子在指定溶液中一定能大量共存的是()A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-B.甲基橙红色的溶液:NH4+、Ba2+、AlO2-、Cl-C.pH=12的溶液:K+、Na+、CH3COO-、Br-.D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-【答案】C【解析】1NO3-+4H++3Fe2+=1NO↑+3Fe3++2H2O,A错误;AlO2-是弱酸根,会发生水解:AlO2-+2H2O Al(OH)3+OH-,溶液显碱性,甲基橙红色pH<3.1,矛盾, B 错误;pH=12的溶液中有大量OH -,能共存,C 正确;与铝反应产生大量氢气的溶液,有大量H +(CO 32-不能大量共存,NO 3-存在不产生大量氢气),或者大量OH -,D 错误。
7.(2011·浙江理综·27)某研究小组在实验室探究氨基甲酸铵(NH 2COONH 4)分解反应平衡常数和水解反应速率的测定。
(2)已知:NH 2COONH 4+2H 2O NH 4HCO 3+NH 3·H 2O 。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c (NH 2COO -)随时间变化趋势如图所示。
t(min)210012221.5c (N H 2C O O -)(mol/L)46814161820241.61.71.81.92.02.12.22.32.4●●●●●25℃15℃5℃■■■■■▲▲▲▲▲⑤计算25℃时,0~6min 氨基甲酸铵水解反应的平均速率。
⑥根据图中信息,如何说明水解反应速率随温度升高而增大:。
【答案】(2)⑤v(NH 2COONH 4)= v(NH 2COO -)=min 69.12.211--⋅-⋅L mol L mol =0.05mol·L -1·min -1;⑥标▲与标●的曲线相比,c (初始)小,但同一时间段△c 大(即υ大),说明升温加快反应。
【解析】(2)⑤0.05mol·L -1·min -1;⑥在浓度-时间图像中,说明速率大,要看曲线的斜率变化。
8.(2011·安徽理综·8)室温下,下列各组离子在指定溶液中能大量共存的是( )A .饱和氯水中:Cl -、NO 3-、Na +、SO 32- B .c(H +)=1.0×10-13 mol·L -1的溶液中:C 6H 5O -、K +、SO 42-、Br -C .Na 2S 溶液中:SO 42-、K +、Cl -、Cu 2+D .pH=12的溶液中:NO 3-、I -、Na +、Al 3+【答案】B【解析】A .SO 32-能被Cl 2所氧化,SO 32-+Cl 2+H 2O= SO 42-+2Cl -+2H +,A 不能大量共存;B .苯酚显弱酸性,C 6H 5O -会发生水解:C 6H 5O -+H 2O C 6H 5OH+OH -,溶液显碱性,c(H +)=1.0×10-13 mol·L -1,则c(OH -)=1.0×10-1 mol·L -1,碱性,B 能大量共存;C .S 2-+Cu 2+= CuS ↓,C 不能大量共存;D .pH=12,c(H +)=1.0×10-12 mol·L -1,则c(OH -)=1.0×10-2 mol·L -1,Al 3++3OH -=Al(OH)3↓,D不能大量共存。
9.(2011·广东理综·11)对于0.1mol•L-1 Na2SO3溶液,正确的是()A.升高温度,溶液的pH降低B.c(Na+)=2 c(SO32-)+ c(HSO3-)+ c(H2SO3)C.c(Na+)+c(H+)=2 c(SO32-)+ 2c(HSO3―)+ c(OH-)D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大【答案】B【解析】Na2SO3=2Na++SO32-,SO32-+H2O H SO3-+OH-,H SO3-+H2O H2SO3+OH-,A.水解为吸热,升高温度,溶液的pH升高,A错误;B.根据质量守恒,c(Na+)=2 [c(SO32-)+ c(HSO3-)+ c(H2SO3)],B错误;C.根据电荷守恒,c(Na+)+c(H+)=2 c(SO32-)+ c(HSO3―)+ c(OH-),C错误;D.加入NaOH,增加c(Na+),OH-抑制SO32-水解,使平衡逆向移动,c(SO32-)增大,D正确。
10.(2011·山东理综·12)Al、Fe、Cu都是重要的金属元素。
下列说法正确的是()A.三者对应的氧化物均为碱性氧化物B.三者的单质放置在空气中均只生成氧化物C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al【答案】C【解析】A.Al2O3是两性氧化物,A错误;B.Cu可以形成碱式碳酸铜,B错误;C.Al3+、Fe3+、Cu2+均易水解,且HCl易挥发,制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法,C正确;D.阴极按氧化性氧化性:Fe3+>Cu2+>H+>Fe2+>Al3+顺序放电,D错误。
