骨质疏松动物模型介绍
骨质疏松动物模型特点的综述

骨质疏松动物模型特点的综述骨质疏松是一种以骨量减少,骨组织微细结构破坏,骨脆性增加和易发生骨折为特征的疾病,是老年人的常见病、多发病,日益受到人们的重视。
随着人类寿命的延长和老龄化社会的到来,该病的防治已成为一个迫切的问题。
在骨质疏松症的研究中,模型动物被广泛使用。
正确选择和建立一个理想的骨质疏松实验动物模型,是开展骨质疏松研究工作的基础。
目前可用于骨质疏松实验研究的动物主要有大鼠、小鼠、兔、羊、犬、猪、灵长类动物(除人类外)等。
它们在实验研究中均有各自的优缺点。
兹就目前常用的实验动物模型及其特点综述如下。
1 鼠类骨质疏松动物模型实验用大鼠有远交和近交系两种。
远交系包括Wistar Spraque-Dauley,Long-Evans,Holtzman 等品种,近交系包括ACI,Brown-Norway,Fischer 344,Lewis,Wistar-Furth等品种。
常用Wistar,Holtzzman,Fischer344、SD大鼠来作骨质疏松模型。
大鼠是骨质疏松研究中最常用的模型动物,与大动物相比,大鼠价廉,易于饲养;另外,大鼠能用较短的时间就能在骨建造和骨再建周期变化中达到新的平衡。
大鼠的自然寿命为2~3年,成年雄性大鼠在30个月时骨骺端仍有持续生长。
这种骨状态的不稳定性可能会干扰实验结果,因此大多数学者认为雄性大鼠不适合做各种成人骨骼研究的模型。
而雌性大鼠在6~9个月时就进入骨生长静止期,骨骺开始封闭,10个月达峰值骨量,出现一个骨代谢相对稳定的阶段,与人类相似;切除卵巢的大鼠经给予合适的雌激素进行替代试验时并不增加骨转换和骨丢失,这与绝经后妇女对雌激素替代法的反应相一致[1]。
在建立大鼠骨质疏松模型的方法研究上,有双侧卵巢切除法(去势法)、维甲酸法、糖皮质激素诱导法、营养法、人工法等。
其中双侧卵巢切除法最常用。
成年雌性大鼠有一个规则的发情期,发情期动物体内雌二醇水平处于峰值,每4 d有18 h峰值时间,在15个月后骨折发生较多,并且观察到松质骨有一些骨丢失现象,当不出现雌二醇的峰值时标志“绝经”,松质骨骨丢失发生加快。
实验动物学论文-骨质疏松模型

《实验动物学》结课论文骨质疏松动物模型的研究学院:专业:班级:姓名:学号:骨质疏松动物模型的研究【摘要】:骨质疏松症(osteoporosis,OP)是一种系统性骨病,其特征是骨量下降和骨的微细结构破坏,表现为骨的脆性增加,因而骨折的危险性大为增加,即使是轻微的创伤或无外伤的情况下也容易发生骨折。
随着对骨质疏松症研究的加深,动物模型成为不可或缺的研究材料。
研究人员应根据实验要求和目的,慎重选择合适的动物模型。
【关键词】:骨质疏松;动物模型;骨质疏松症是一种钙质由骨骼往血液净移动的矿物质流失现象,骨质量减少,骨骼内孔隙增大,呈现中空疏松现象,速率取决于破骨细胞和成骨细胞活性的消长。
骨质疏松症的表面症状为骨质流失和骨组织破坏,从而导致骨质变得脆弱,大大增加骨折的可能性。
骨质疏松症主要可分为:原发性骨质疏松症和继发性骨质疏松症。
原发性骨质疏松症又可分为绝经妇女的骨质疏松症(I型)和老年性骨质疏松症(II型)。
虽然骨质疏松症多数情况下并不会直接导致死亡,但骨质疏松症增加骨折机会,从而影响病患者的健康和独立生活能力,更大大增加社会医疗负担。
因此,为了更好地防治骨质疏松症研究出有效的药物,动物模型的应用显得尤为重要。
1 理想动物模型选用原则使用实验动物进行实验的目的是用最少的动物数量达到最大的实验精确度,最好的可重复性和稳定性。
理想的骨质疏松动物模型应该满足以下条件:再现性好,模型与人类骨质疏松症状和组织行为尽可能相似;重复性好,一定的条件下,由不同实验人员或同一实验人员在不同时间进行操作,模型能够很好的被重复出来;动物模型能反映骨质疏松症时骨代谢,微结构的变化;与临床的一致性,模型的处理因素尽可能与临床发病病因相一致;实验动物容易获得,价格低廉,造模周期短,便于操作和取材。
2 常用骨质疏松症模型动物2.1啮齿目动物①大鼠:大鼠是建立OP模型应用最广泛的动物,寿命约2.5~3年,常用于研究的是SD大鼠和Wistar大鼠。
大鼠骨质疏松诊断标准-概述说明以及解释

大鼠骨质疏松诊断标准-概述说明以及解释1.引言1.1 概述概述骨质疏松是一种常见的骨骼疾病,特别容易发生在老年人和骨骼系统疾病患者中。
它主要是由于骨组织的细胞增生不足或吸收增多,导致骨密度减少、骨质变薄和骨质疏松。
大鼠是一种常用的动物模型,可以用来研究骨质疏松的发生机制和评价骨质疏松的治疗效果。
因此,建立大鼠骨质疏松的诊断标准对于相关研究和临床治疗具有重要意义。
本文将系统地介绍大鼠骨质疏松的诊断标准,希望对相关领域的研究工作有所帮助。
1.2 文章结构:本文主要分为引言、正文和结论三个部分。
引言部分将介绍骨质疏松疾病的概念和背景,引出本文关注的重点:大鼠骨质疏松的诊断标准。
正文部分将分为三个部分:骨质疏松概述、大鼠骨质疏松症状和大鼠骨质疏松诊断标准。
其中骨质疏松概述将介绍骨质疏松的定义、发病机制和流行病学特征;大鼠骨质疏松症状将详细描述大鼠出现骨质疏松时可能表现出的症状和体征;大鼠骨质疏松诊断标准将重点讨论目前使用的诊断方法和标准,为进一步研究提供参考和指导。
结论部分将对本文的主要内容进行总结,展望未来可能的研究方向和发展趋势,并提出结论。
1.3 目的本文旨在探讨大鼠骨质疏松的诊断标准,通过系统性地总结相关文献和研究成果,提出一套科学合理的诊断标准,以帮助研究人员和临床医生更准确地诊断大鼠骨质疏松症状,为疾病的早期诊断和治疗提供参考依据。
同时,通过本文的研究,也有助于增进我们对骨质疏松这一疾病的深入理解,为今后的相关研究提供指导和参考。
2.正文2.1 骨质疏松概述:骨质疏松是一种常见的慢性骨病,主要表现为骨密度降低,骨质结构疏松,容易发生骨折。
骨质疏松是一种全身性骨代谢异常的疾病,主要发生在老年人身上,但也会影响到一些中年人和甚至年轻人。
骨质疏松会对患者的生活质量造成严重影响,增加骨折的风险,尤其是髋部、腰椎和桡骺等部位的骨折,严重影响患者的生活能力。
因此,了解骨质疏松的病因、症状和诊断标准对于预防和治疗骨质疏松至关重要。
常用骨质疏松动物模型特点的综述

常用骨质疏松动物模型特点的综述
骨质疏松是一种逐渐发展的症状,它会导致骨组织遭到破坏,严重的话还可能演变成骨折。
由于目前尚无针对骨质疏松的有效治疗手段,研究者采用动物模型研究该疾病。
目前常用的骨质疏松动物模型有野鼠、非人类灵长类动物和豚鼠模型等。
野鼠是使用最广泛的骨质疏松动物模型。
它可以利用雌激素抑制剂(比如雌激素)来建立骨质疏松模型,无需双侧大脑切除。
野鼠模型容易受技术人员操控,能够更加精确地模拟骨质疏松的发生神经机制和肿瘤相关疾病模型。
非人类灵长类动物模型是由大猩猩和小黑猩猩,不同年龄和性别的头脑及周围下颌骨组成,它呈现出快速症状的模型,可以模拟十分类似于人类的情况,能帮助研究者更近地了解骨质疏松的发展情况,探讨其机制等。
豚鼠模型是一种对钙离子水平的敏感的动物模型,它可以帮助骨质疏松的治疗研究,主要是基因敲除和抗细菌药物的影响,也可以用于进行膳食营养学研究,检测不同营养因子对骨组织质量的影响。
总之,野鼠、非人类灵长类动物和豚鼠是目前常用的骨质疏松动物模型,在不同的研究领域中表现出不同的特点,可以帮助研究者更好地了解骨质疏松症发生和发展情况,为对其进行有效治疗提供有用的参考。
二十种常见实验动物模型

二十种常见实验动物模型一、缺铁性贫血动物模型缺铁性贫血(irondeficiencyanemia,IDA)是体内用来合成血红蛋白(HGB)的贮存铁缺乏,HGB合成减少而导致的小细胞低色素性贫血,主要发生于以下情况:(1)铁需求增加而摄入不足,见于饮食中缺铁的婴幼儿、青少年、孕妇和哺乳期妇女。
(2)铁吸收不良,见于胃酸缺乏、小肠粘膜病变、肠道功能紊乱、胃空肠吻合术后以及服用抗酸和H2受体及抗剂等药物等情况。
(3)铁丢失过多,见于反复多次小量失血,如钩虫病、月经量过多等。
IDA是一种多发性疾病,据报道,在多数发展中国家,约2/3的儿童和育龄妇女缺铁,其中1/3患IDA,因此,研究IDA的预防和治疗具有重要的意义。
在这些研究中,缺铁性贫血的动物模型(AnimalmodelofIDA),又是实施研究的基础工具。
常见的IDA动物模型的构建技术如下:实验动物:一般选用SD大鼠,4周龄,雌雄不拘,体重65g左右,HGB$130g/L。
建模方法:低铁饲料加多次少量放血法。
低铁饲料一般参照AOAC 配方配制,采用EDTA浸泡处理以去除饲料中的铁,饲料中的含铁量是诱导SD大鼠形成缺铁性贫血模型的关键,现有研究表明,饲喂含铁量<15.63mg/Kg的饲料35天,SD大鼠出现典型IDA表现,而饲喂含铁40.30mg/Kg的饲料SD大鼠出现缺铁,但并不表现贫血症状。
建模时一般采用去离子水作为动物饮水,以排除饮水中铁离子的影响。
少量多次放血主要用于模拟反复多次小量失血导致的铁丢失,还可以加速贫血的形成。
放血一般在低铁饲料饲喂2周后进行,常用尾静脉放血法,1〜1.5ml/次,2次/周。
模型指标:(1)HGBW100g/L;(2)血象:红细胞体积较正常红细胞偏小,大小不一,中心淡染区扩大,MCV减小、MCHC降低;(3)血清铁(SI)降低,常小于10umol/L,血清总铁结合力(TIBC)增咼,常大于60umol/L。
需要指出的是,以上模型不能用于铁吸收不良相关IDA的防治研究。
骨质疏松动物模型特点的综述

骨质疏松动物模型特点的综述
骨质疏松是一种通常影响老年人的骨密度病,它导致骨骼细胞的
活动和功能障碍,并影响骨骼强度和骨抗压能力。
骨质疏松的动物模
型利用不同的方法来模拟人类的病变情况,剖析其发病机制,以及探
究药物治疗效果。
目前,骨质疏松动物模型主要包括:1)腹腔内注射
缺乏维生素D导致的动物模型;2)腹腔内注射可溶性维生素D受体拮
抗剂导致的动物模型;3)熟化维生素D或维生素D受体突变导致的动
物模型;4)加糖血病患者血清导入非人类磷酸酶导致的动物模型;5)补充各种外源因素导致的动物模型;另外还有一些使用大鼠进行造模
的骨质疏松动物模型。
上述模型可以用于研究骨质疏松的基础发病机
制和创新骨质疏松治疗方法。
老年小鼠骨质疏松模型简称

老年小鼠骨质疏松模型简称哎呀,今天咱们聊聊老年小鼠骨质疏松模型这事儿。
听起来挺复杂,但其实也没那么难懂。
咱们都知道,随着年龄的增长,骨头会变得越来越脆弱。
就像老爷爷的牙齿,一咬就掉,真是让人心疼。
小鼠们也是一样,到了年纪大了,就开始面临这个问题。
这时候,科学家们就想,嘿,为什么不做个小实验,让小鼠们提前体验一下骨质疏松呢?想象一下,实验室里有一群小鼠,个个活泼可爱,吃吃喝喝,过着无忧无虑的日子。
突然,有一天,科学家们决定给它们“升级”一下,开始喂它们一些特殊的食物,像是低钙饮食或者是激素类的药物。
哎呀,这就像是人类的减肥计划一样,开始的时候小鼠们也许觉得没啥,反正美食在前,谁在乎这些。
可是时间一长,事情可就不一样了。
小鼠们的骨骼开始变得脆弱,走路都小心翼翼,生怕摔一跤。
这种变化真是让人心疼,尤其是那些一开始活蹦乱跳的小家伙们。
它们的骨密度逐渐下降,活动能力也大大减弱,感觉就像是从“猛鼠”变成了“老鼠”。
这时候,科学家们开始观察它们的行为,看小鼠们如何应对这种变化。
就像人类遇到难题一样,有的小鼠变得更加谨慎,有的小鼠则还是我行我素,真是各有各的态度。
老年小鼠骨质疏松模型不仅仅是为了看小鼠们的反应,更是为了给人类提供一些重要的线索。
科学家们通过观察小鼠的骨头变化,研究出一些有助于治疗骨质疏松的新方法。
这就像是打基础,先从小鼠身上找到解决问题的钥匙,然后再慢慢应用到人类身上。
谁知道呢,或许未来的我们也能因此受益,保持健康的骨骼。
在这个过程中,科学家们还会进行一些检测,像是X光、CT扫描,看看小鼠的骨头到底有多脆弱。
就好比我们去医院拍个片,医生看看我们的骨头状况。
结果出来后,大家都瞪大了眼睛,哎呀,真是惊心动魄。
小鼠们的骨质情况各不相同,有的轻微,有的严重,真是五花八门,各有各的故事。
老年小鼠骨质疏松模型这个研究,不仅帮助科学家们更深入地了解骨质疏松的机理,也为未来的治疗方案打下了基础。
正所谓“千里之行,始于足下”,小鼠们虽然小,但它们的贡献可大着呢!这些可爱的小家伙们在科学家眼中,就像是一扇窗户,透过它,能看到未来的希望。
建立大型犬骨质疏松动物模型的实验研究

曲极 限 载 荷 实 验 组 低 于 对 照 组 ( 0 0 ) 结 论 ቤተ መጻሕፍቲ ባይዱ< .5 。
激 素 注射 联 合 低 钙 饮 食 的方 法 短 期 内 成 功 建 立 了 大 型 犬 骨 质 疏 松 动 物 模 型 ,
该模型具有人类骨质疏松症的临床特性 , 为进 行 外 科 学 实 验 研 究 提 供 了依 据 。
关 键 词 糖 皮 质 激 素 骨 质 疏 松 低 钙 饮 食 动 物 模 型
Su yo sa lh n f ag a ieO to o oi Mo e. Wa gF n Z o in e, a gR a ,e a.De at n fO to e td nE tbi met reC nn sep rs d1 s oL s n a g, h uJa w iZh n u n t 1 p r me t rhp — o dc ,0 si lo L Peig U i ri B n 0 1 1. hn is3 6Hopt f P A. kn nv st e g 1 0 9 C ia a e y, Ab ta t 0b e tv T s bihlrecnn sep rssmo e uc l sn h to f ohh r n ne t n n o a— sr c jcie oet l ag a ieoto oo i d lq ikyu igtemeh do t omo eijci sa dlw c l a s b o
骨质疏松动物模型的研究进展

自 然绝经 , 且哈氏系统重建时间较晚,领 域应用 有待探 索 。 l ,
鸟类 , , 马 牛等动 物 目前 作 为 OP的模 型动 物应
食肉目( a i r)在骨代谢和组织结构方 面 Cr v a : n o 成年狗与人类相似 , 皮质骨有丰富的哈氏系统 , 与松 质骨 比例适 当 , 因而 被 用 于 OP的模 型 研 究 1 , 。 ] J
但 s e J hn 等研 究 表 明 , 巢 切 除 的狗 术后 6个 月 卵 在组织形 态学 、 骨量等方 面无 明显改 变 , 激 素缺 对雌 乏 的反 应差 , 适 于作 研 究松 质 骨 的 OP模 型 。猫 不 在骨 质疏松 模型研究 中尚未被广 泛应用 。 偶蹄 目( ri atl)小型 猪( npg) A tdcya : o Mii s的培育 i 为猪 作为模 型动物开辟 了广阔 的领 域 。猪峰骨 同时 出现在 2 3岁 , - 具有 与人 相当 的皮 质骨及 松质 骨丢 失 与沉 积 的发 生率 , 有板 层 结构 Moeie等研 且 skl d 究表 明 l1卵 巢切 除 的小 型 猪 术后 6个 月 B l, MD 下
、
O P的定义 厦理 论基础
OP是一 种骨代 谢性 疾 病 , 现 为骨 量减 少 , 表 骨 脆性 增加 , 骨折 危 险增 高 。其病 理 改 变 表现 为 骨组 织微 细 结 构 破 坏 , 小 梁 变 细 减 少 , 生微 骨折 。 骨 发
研究中也被广泛应 用。由于其经济 、 有明显 的哈 氏 重建 能 力 、 月左 右骨骼 即发 育成 熟 等优 点 , 而 6个 因 被学者用于卵巢切除后 , 糖皮质激素及肝素等诱 导
小鼠卵巢去势致骨质疏松症模型

小鼠卵巢去势致骨质疏松症模型卵巢是卵子发育和激素产生的器官,其受到下丘脑和垂体促性腺激素的双重调控(卵泡雌激素FSH)和黄体生成素(LH)。
LH是在下丘脑垂体促性腺激素释放激素(GnRH)的作用下以脉冲的方式分泌,在正反馈作用下诱发排卵所需的LH峰。
在卵巢,FSH受抑制素的双重负反馈调节,并受到性激素尤其是雌激素、孕激素的负反馈调节。
雌激素在调节骨代谢及维持内环境的稳定性方面有着重要的作用,雌激素水平低下被认为是导致骨质疏松症的主要原因。
雌性大鼠双侧卵巢摘除是一个较成熟的动物模型,可以成功建立模拟雌激素缺乏而导致的骨质疏松动物模型。
这也为研究雌激素缺乏对人体其他系统的损害奠定了基础。
雌激素是体内重要的激素,它对骨代谢有着重要的作用。
在对小鼠进行去势手术后,机体处于一种低雌激素的微环境,骨转换过程加速,骨代谢加强,成骨细胞量降低,破骨细胞活跃,从而导致机体骨量丢失以及正常生理结构的破换,容易导致骨质疏。
研究显示雌激素缺乏后,小鼠骨髓间充质细胞成骨能力显著降低,这与骨质疏松发生有关;而且雌激素缺乏后,会加重牙周炎的程度,这与雌激素缺乏后降低了牙周膜成纤维细胞的增殖与成骨能力有关。
许多已知的骨代谢相关因子都受到雌激素的调控。
在成骨细胞,雌激素能够促进代谢生长因子IGF-I 的合成与分泌,同时抑制骨吸收相关因子,如白介素-1(IL-1)及白介素-6(IL-6)、前列腺素、肿瘤坏死因子(TNF)等。
雌激素也可以促进骨保护素(OPG)的合成与分泌,而这种激素在抑制破骨细胞的功能方面有着重要的作用。
多方证据表明,在卵巢切除术后或绝经后,由于骨小梁的快速缺失而导致骨质疏松。
1.实验动物SPF级Balb/c小鼠,健康,雌性未孕,4~6W,体重为18g~20g.2.实验分组实验分六组:正常对照组、模型组、阳性药组、受试药组三个剂量组,每组15只动物。
3.实验周期12W4.建模方法1. 小鼠3%戊巴比妥钠40mg/kg腹腔麻醉后仰卧,腹部脱毛。
骨质疏松症动物模型研究现状

第 一军 医 大 学 学报 ( Fr l dU i) J it nv sMiMe
骨质疏松 症 动物模 型研 究现 状
徐洪璋 ・余 斌 :第一军 医大学 ・ , ( 分校 外科教研 室, 广东 广 州 5 0 1 ;珠 江 医院创伤 骨科 , 东 广 州 5 0 8 ) 13 5 广 12 2
骨 质疏松症 是威 胁 中老年人 健康 的一种 常见 病 , 骨量 减少 、 骨组织 显微 结构 改变 和骨折危 险 度增加 为特征 。随着人类 寿命 的延 长和 老龄化社 会 的到来 , 该 病的防治 已成 为一个 迫切 的问题 。 在骨 质 疏松症 的
作骨 代谢 研究 。福 田俊 等口对 雌 、 大 鼠连续 3 雄 O个月
Cur e t t fsud na m a m o l fo t op r ss r ntsa us0 t y o ni l deso se o o i
xu o g z a g , H n - h n YU n Bi
De at n f u gc l a h ga dR s ac , Brn h C mp s f i t itr e i a iest, Gu n z o p rme t ria c i n e e r h oS Te n a c a u Fr la yM dc l o sM i Unv ri y a gh u
50 1. hn;D pr no Or o adc ad ru tlg, hj n Hopt ,it layMe c Unvrt, 13 5C iaZeat tf t peis T ama oyZ ui g sitFr Mitr me h n o a a s i il d a i sy ei
Gu n z o 1 2 2 Ch n a g h u 5 0 8 , ia
骨质疏松动物模型实验技术原理

骨质疏松动物模型实验技术原理
展开全文
骨质疏松模型实验方法:雌性实验大鼠按40mg/kg体重的剂量经腹腔注射2%PN麻醉,无菌下腹部正中切口,钝性分离腹肌腹膜后进腹,丝线结扎卵巢后并摘除。
缝合切口前腹腔内注入万古霉素10万U。
造模后大鼠常规饲养,自由饮水和进食。
骨质疏松模型(卵巢摘除)特点:大鼠去卵巢后其体内雌**分泌减少,使其对破骨细胞的抑制减弱,骨吸收大于骨形成,骨骼呈高转变状态,骨量不能保持平衡,导致骨丢失增加。
镜下病理组织学观察显示,骨组织切片中骨小梁断裂,排列稀疏,形态结构完整性差。
以往研究表明,3-9月龄区间的大鼠适合复制骨质疏松模型,尤其是6月龄大鼠已达峰值骨量。
大鼠年龄过小,机体内因生长期骨量显著增长会掩盖去卵巢的骨量丢失:而12月龄后的大鼠由于开始进入老龄期,机体内会出现老龄型骨量丢失,从而影响实验结果观察。
方法比较:到目前为止,卵巢切除复制的骨质疏松模型是WHO 和美国HDA推荐的研究绝经后骨质疏松症的较佳模型。
此外还有维甲酸骨质疏松模型,维甲酸临床上用于各种皮肤病,同时伴有骨质疏松的副作用。
研究表明,维甲酸能激活机体内破骨细胞促进骨吸收,但对成骨细胞活性无抑制作用,对骨形成及骨基质的矿化过程也无明显影响,终使机体内骨重建处于骨吸收大于骨形成的负平衡状态,从而导致动物出现骨质疏松。
骨质疏松小鼠造模方法

骨质疏松小鼠造模方法骨质疏松是一种常见的骨骼疾病,其特点是骨组织逐渐破坏,骨质变薄,导致骨骼结构、形态发生剧烈的变化,有时会导致骨折的发生。
临床上以吸收骨突出和改变的骨密度,并伴有软骨组织减少,股骨头骨折曲度、增宽、部分骨折等特点。
为了临床快速确定骨质疏松,对骨质疏松病进行调查和分类,现在已有许多研究者通过建立小鼠模型来研究骨质疏松发病的机制和发展趋势。
即通过内侧注入破骨素或是外界暴露于紫外线下,建立小鼠模型,以此研究骨质疏松的形成和发展趋势,从而开展对应的保健和治疗。
通过建立小鼠骨质疏松模型,研究可以达到以下几点目的:1、首先,确定骨质疏松病发病机制,为防治提供科学依据;2、其次,建立小鼠模型,可以检测骨质疏松中各因素及活性物质的变化,如骨重吸收和密度、含水量及半衰期等;3、此外,还可以通过模型研究新药和营养状态对骨质疏松的缓解作用,调整病变细胞的活性;4、最后,可以研究不同的治疗方案和药物,检测其抑制骨质疏松发病的作用,以便合理制定治疗方案,及早发现并辅助治疗骨质疏松病。
建立小鼠骨质疏松模型的途径较多,其中常见的有药物诱导造模和辐射造模两种方式。
药物诱导造模方式,是通过注入破骨素、抗炎类药物及甲状旁腺激素等,使小鼠形成骨质疏松;辐射造模方式,是把小鼠靶向地暴露于高剂量紫外线,照射对的时间与剂量会引起小鼠骨质疏松病。
无论是哪一种方式,处理流程都是:首先繁殖已检测无病原体且性状基本一致的小鼠,然后选择合适体积、重量且无过敏反应小鼠集群作为实验组,其中一部分小鼠为药物处理组或辐射照射组,另一部分小鼠为非处理对照组,在多重因素及实验条件下,通过无创性X线摄影、实验动物呼吸机技术、营养乳汁配方以及解剖学等手段,持续5-7周观察小鼠的生长发育情况,最后作出正确的实验结果,为确诊骨质疏松提供科学依据。
建立小鼠骨质疏松模型是一种综合的技术,一般要经过繁殖、对照处理实验、行政处理实验、骨特征变化实验、骨密度分析实验及数据分析实验等多个步骤,以及正确分析报告,才能有效地检测骨质疏松病发病机制并辅助诊断、治疗。
骨质疏松小鼠造模方法

骨质疏松小鼠造模方法骨质疏松症是一种被广泛认可的普遍存在的疾病,它具有复杂的发病机制,并且不可逆转。
为了理解骨质疏松症,小鼠造模已成为一种实验方法,用于评价病症的数据库,研究疾病的发病机制和潜在的治疗手段。
本文概述了骨质疏松小鼠的造模方法,以及小鼠造模所需要的材料和实验步骤,最后介绍了小鼠造模的优势。
一、骨质疏松小鼠造模方法骨质疏松小鼠造模方法是一种新型的小鼠造模方法,它通过基因治疗和药物干预,可以用来制备复杂的骨质疏松小鼠模型。
与传统的化学或物理方法不同的是,骨质疏松小鼠造模方法可以在体外成功搭建骨质疏松模型。
用于小鼠造模的材料主要是小鼠本身和基因治疗药物。
其中,小鼠本身可以选择离体或死亡,通常在8至10周年龄期间获得较佳的造模效果。
此外,为了制备复杂的模型,模型小鼠应该采用同一种品系,也可以采用有众多品系的杂交小鼠。
除此之外,在小鼠造模过程中还需要用到基因治疗药物,包括细胞因子等。
二、小鼠造模实验步骤实验步骤主要有两个阶段:第一个阶段是小鼠的解剖和石蜡包埋;第二个阶段是实验的精细化操作,包括小鼠的感染、治疗和取样等。
(1)解剖和石蜡包埋首先,小鼠的解剖应该根据实验的要求来进行,一般情况下,小鼠解剖的步骤为腹腔内取出肾脏、肝脏、脾脏等器官,然后洗涤,置于石蜡中,用来进行病理学观察。
(2)感染和治疗感染和治疗是小鼠造模的核心步骤,一般情况下,小鼠感染的疾病可以是细菌性疾病、病毒性疾病,也可以是由基因治疗药物引发的疾病。
有了感染前提之后,小鼠可以进行不同的治疗,可以采用细胞因子、抗生素、抗炎素、肿瘤素等治疗方式,以观察其对疾病症状的改善。
(3)取样在小鼠造模实验中,最后一步是取样,取样时,一般应该取小鼠肝脏、肾脏、脾脏等器官,以观察病理改变情况。
三、小鼠造模的优势(1)小鼠造模能够获得更准确的疾病机制:小鼠模型制备的小鼠模型可以获得更准确的疾病机制,有助于更好地理解疾病发病机理,从而促进诊疗技术的发展。
实验动物模型如何选择?
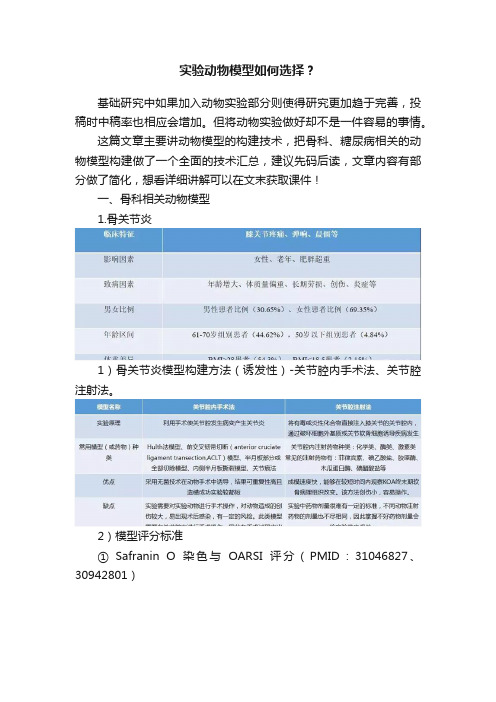
实验动物模型如何选择?基础研究中如果加入动物实验部分则使得研究更加趋于完善,投稿时中稿率也相应会增加。
但将动物实验做好却不是一件容易的事情。
这篇文章主要讲动物模型的构建技术,把骨科、糖尿病相关的动物模型构建做了一个全面的技术汇总,建议先码后读,文章内容有部分做了简化,想看详细讲解可以在文末获取课件!一、骨科相关动物模型1.骨关节炎1)骨关节炎模型构建方法(诱发性)-关节腔内手术法、关节腔注射法。
2)模型评分标准① Safranin O染色与OARSI评分(PMID:31046827、30942801)② HE染色与OARSI评分(PMID:30609097)③ Safranin O染色与Mankin评分(PMID:30609097)2.骨质疏松症1)骨关节炎模型构建方法去趋法模型PMID:31037128实验动物:小鼠方法:在戊巴比妥麻醉下进行双侧卵巢切除术以诱导骨质疏松症,同时对照组小鼠仅进行卵巢外置但未切除。
2)模型检测指标(PMID:31037128)① HE染色② Micro-CT③ TRAcP染色④ Micro-CT相关指标检测3.类风湿性关节炎类风湿性关节炎(RA)是一种慢性自身免疫性疾病状态,其特征是滑膜增生,软骨退化和脊椎关节的骨侵蚀4.强直性脊柱炎1)强直性脊柱炎模型构建方法2)模型检测指标 (PMID:15082495、7561688)① HE染色② 关节侧视图③ PCR鉴定二、糖尿病相关动物模型1.糖尿病动脉粥样硬化1)模型构建(PMID:30826357)使用链佐星(STZ)注射ApoE-/-小鼠,建立糖尿病 ApoE-/-小鼠模型,同时与 ApoE-/-小鼠采用高脂喂养 18 周2)模型检测指标(PMID:29107826、28345659)3)生化指标检测4)超声检测5)主动脉染色检测2.糖尿病心肌病1)诱发性DCM模型模型构建(PMID:29732743)实验动物:大鼠方法:各大鼠一次性腹腔注射链脲佐菌素150 mg·kg-1( STZ用0.1 mol·L-1,pH 4.2柠檬酸-枸橼酸钠溶液稀释,现配现用),并给予高脂饲料进行喂养。
骨质疏松动物模型

适应性喂养1周后,把50只大鼠按随机数字表法分为正常对照组、模型 组及培哚普利2,4,8 mg/(kg•d)3个剂量组,共5组,每组10只。造模前给 每个大鼠作标记,称量并记录各个大鼠的体质量。按每2 g维甲酸粉剂加入3 mL吐温80的比例将维甲酸充分溶解,再加去离子纯净水搅拌混匀配制成维 甲酸溶液。模型组及培哚普利3个剂量组的大鼠均予维甲酸80 mg/kg灌胃, 于早上9点开始灌胃,1次/d,连续14 d,用以制备骨质疏松模型。正常对照 组则灌予等容积的蒸馏水。
维甲酸模型应用
培哚普利对维甲酸所致骨质疏松模型大鼠骨代谢的影响
培哚普利有效控制维甲酸 所致骨质疏松模型大鼠的 骨质丢失,抑制骨吸收, 促进骨形成,改善骨代谢 的负平衡状态,对维甲酸 导致的骨质疏松症具有良 好的防治作用。
动物模型的评价
模型评价
骨密度检测 骨组织形态观察
骨生物力学 生化指标
动物模型的评价-骨密度
科室会
生化指标 生物力学
• 骨形成:I型前胶原前肽、骨源性碱性磷酸酶、骨钙素等; • 骨吸收:I型胶原羧基端交联肽、I型胶原氨基端交联肽、
抗酒石酸酸性磷酸酶等;
• 反映骨强度、硬度、韧性,间接反映 骨矿盐分布,骨小梁空间结构;
模型评价:股骨骨密度检测和病理学观察证实模型构建成功后
糖皮质激素模型应用
云克是人工微量元素锝(99Tc)与亚甲基二膦 酸(MDP)的螫 合物商品名
糖皮质激素模型应用
中药葛藤提取物对糖皮质激素致骨质疏松大鼠的影响
中药葛藤提取物具有 明显的干预和治疗骨 质疏松的药效学研究
维甲酸模型
实验动物:大鼠、小鼠等; 适用范围:药物研究中应用较为普遍,操作简、时间短、成功率高。 原 理:是维甲酸通过激活体内的维甲酸受体相关的孤儿受体进而影响 骨
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
骨质疏松的动物模型骨质疏松症是以骨量减少及骨组织微观结构为特征的一种全身性骨骼疾病,伴有骨的脆性增加、易于发生骨折。
骨质疏松症是目前世界上发病率、死亡率和医疗保健消耗较大的疾病之一。
骨质疏松起病隐袭,一旦发现,多已发展到一定程度。
随年龄增加,骨丢失和骨折发生率明显增加。
骨质疏松性骨折可发生在任何部位,但以椎骨、腕部和髋部多见。
髋部骨折最为严重,多需手术处理,且患者常合并慢性疾病,如高血压、心血管、慢性呼吸道阻塞疾病及糖尿病等,导致医疗费用和死亡率增加,一部分患者日常生活不能完全独立,年平均生活质量下降。
女性由于峰骨量较低及绝经后雌激素水平下降,发病率较男性为高。
近年来随着社会老龄化,人口寿命的延长,女性绝经后生存年限约占一生的1/3,据估计,从1990-2025,欧洲50岁以上妇女将增加30%-40%。
男性预计增加更快,可达50%。
在同一时期内,北美预期将增加83%。
亚非绝对增加数将为更为明显。
在1990年全世界仅髋部骨折达130-170万,预期到2025年为200万,甚至更多[1]。
骨质疏松症已成为全世界范围的严重的社会和经济问题。
骨质疏松症的预防和治疗已成为一个多学科的、当前研究最活跃的课题之一。
建立理想的骨质疏松症的动物模型是对治疗和预防骨质疏松症新药的体内过程、药物代谢动力学、药效学和影响药物作用因素的基础。
随着对骨质疏松症的研究的不断深入,认为骨质疏松症的发生与遗传、营养、生活习惯、激素、运动、机械负荷和多种细胞因子有关。
对骨质疏松症的动物模型提出了严格的(1)方便性(Convenience):要求。
Rodgers等指出理想的动物模型应有三个特点:动物购来容易,价格低廉,实验操作易行。
(2)关联性(Relevance):与人体条件比较相似,得到的信息能转化为人体的规律。
(3)适宜性(Appropriateness):为研究某一特定问题,最好用特定的动物模型模拟人体[2]。
骨质疏松症的动物模型涉及动物的选择和复制的方法等方面,本文就此将国内外的有关进展进行综述。
复制骨质疏松模型的动物选择用于骨质疏松症模型动物模型首先应该考虑的是模型应与人类骨质疏松的临床症状及组织行为相似,但某些动物模型在各个方面完全与人类骨质疏松症的临床表现一致是很困难的,因此动物模型侧重与表现其某一阶段、某些症状或一些病理生理变化,作为观察特定阶段和指征的病理模型。
美国骨质疏松药物研究指南(美国-FDA)认为目前没有一种动物模型能模拟人类骨质疏松的所有特征。
已有报道用小鼠,大鼠、兔、羊、猴等复制骨质疏松模型[3]。
灵长类动物与其他种属相比,有许多优点。
灵长类动物保持经常性的直立体位,生物力学与人类最为相似;体内器官系统包括消化系统、内分泌系统、骨代谢与人类接近;饮食要求相似;更重要的是,有些灵长类动物有与女性类似的周期的动情期和绝经[4]。
但费用昂贵,饲养管理要求高,有携带动物源性的传染病,例Marburg病毒病、Eloda病毒病等。
小鼠作为骨质疏松动物模型的研究报道较少,但有人证实C57/6J的小鼠峰值骨量低,C3H/HeJ小白鼠的峰骨量高,且由于小鼠基因易于调控,可借助分子生物学技术,对其基因进行研究,以便定位决定峰量骨值的基因。
另外,SAM-P/6小鼠有低峰值骨量和中、老年易发生脆性骨折的特点,是唯一证实可随增龄出现脆性骨折的动物[5,6]。
小鼠也存在骨骼太小,可供研究的血清较少,动情期不受下丘脑-垂体轴调节等因素影响。
羊、猪、狗因为体积大、饲养困难、对去卵巢的组织学反应不一等因素,限制其的应用。
大鼠的骨代谢、解剖与人类相似,成年雌鼠由于E2的周期变化,每四天有一个动情期。
1岁后雌鼠可观察到动情期的逐渐减少和松质骨的丢失。
大鼠卵巢切除后,骨转化率增高;初始的快速骨丢失期,随后的缓慢骨丢失期;骨松质较皮质骨骨丢失严重;肠道钙吸收明显降低,与绝经后骨丢失有众多相似之处[7]。
予雌激素替代治疗时无骨转化增加和失骨[8]。
抑制人骨转化的药物如双磷酸盐类和降钙素也可以有相似的骨组织变化[9]。
其次,大鼠来源丰富,费用低廉,易于饲养管理等的优点。
但也有不足之处包括:皮质骨哈佛氏单位重建不明显;12-24月后骨骺方闭合;终身维持活跃的骨塑建(modeling);承载方式与人类不同等。
目前,大鼠已成为骨质疏松症研究中使用最多的动物模型。
选择骨质疏松动物模型应注意的因素1、骨生长期和成年期理想的骨质疏松动物模型应有明确的生长期和成长期。
在骨质疏松研究中生长期的骨积累和成年期的骨峰值是重要的概念。
在骨生长期,以骨塑建(bone modeling)为主,骨发育的代表是长轴骨的生长,骨塑形能力强,骨代谢活性高。
,除了遗传因素,生长期的营养、运动、机械负荷和日照时间等决定峰值骨量。
成年期的骨发育是以骨重建为主。
,松质骨的骨重建活性高于皮质骨。
骨代谢处于相对稳定的状态。
测定峰值骨量和成年后的骨量丢失是骨质疏松研究中的重要的手段。
进行实验时,明确实验动物处于生长期,还是成年期。
如实验目的是研究成年人疾病的过程,应用成年期的动物。
若观察危险因素对骨骼系统生长的影响,应选用生长期的动物。
2、骨塑建与骨重建骨塑建(bone modeling)是骨生长期骨的形状和结构的生长变化,还在成年期期调整骨的构筑和骨量分布而适应外力环境的改变。
骨重建(bone remodeling)是指骨组织中的基本单位新骨取代旧骨的骨吸收与骨重建过程,并无骨形状的改变。
骨质疏松动物模型应可观察到松质骨和皮质骨明确的组织形态学变化。
3、雌激素与绝经大多数妇女经历2-7年的自然绝经期,手术女性因手术而绝经。
体内雌激素水平下降导致多得快速失骨可持续5-8年,逐渐进入一个缓慢失骨期。
这些变化主要发生在松质骨和皮质骨内表面[10]。
雌激素替代疗法可减少骨量的丢失,骨折发生率降低。
骨质疏松模型选择的动物如有周期性的月经或动情期,有自然绝经现象和对雌激素替代疗法有良好的反应,可能是用于骨质疏松研究的最佳模型。
比如,大鼠去势模型是研究绝经后骨质疏松的经典动物模型。
4、其它动物骨骼的形态、骨密度和骨生理与人类不尽相同,而且骨质疏松症的变化往往经历数年或数十年,但动物模型在数周或数月复制出相像的变化,二者是否有差距,有待进一步研究,因此在实验结果判定和外推时需慎重。
复制骨质疏松症的方法骨质疏松动物模型的建立有手术切除卵巢、药物诱导、饮食限制和制动术等几种方法。
也有将卵巢切除与其他方法结合应用以加快失骨的报道。
1、切除卵巢去势法以大鼠为例,大鼠有明显的生长期和成年期,雌性大鼠发情期规律,每四天出现一次持续18小时的雌二醇峰值时间。
当卵巢切除以后,如上所述,出现骨转化率增加,松质骨出现显著的骨丢失,骨小梁变细,单位体积骨小梁骨量降低,骨强度下降;经历约4月的快速骨丢失期,随后为一段较长的缓慢的丢失阶段。
肥胖对骨丢失有一定保护的作用;肠道的钙吸收减少;这种特征较好地复制了女性正常绝经时骨量丢失的情况。
予雌激素替代治疗时无骨转化增加和失骨。
抑制人骨转化的药物如双磷酸盐类和降钙素也可有阻止大鼠的高转化率和骨丢失。
这与绝经后妇女对相同治疗的应用效果一致。
该模型已被反复证实,切除大鼠卵巢,血中雌激素水平显著降低,并出现骨质疏松病理变化,该法已成为制造绝经后骨质疏松症动物模型的有效方法。
雌激素减少后的骨量的减少和骨形成关系如何尚未阐明。
骨骼成熟后,在一生中仍不断进行更新与改造,这就是骨重建。
骨重建过程是旧骨的吸收,新骨的形成的复杂过程。
主要有两种细胞在发生作用:一种是通过分解代谢促使骨质吸收的破骨细胞,一种是通过合成代谢促进骨形成的成骨细胞。
正常的骨再建过程有赖于这两种细胞作用的平衡。
在骨表面同时存在着破骨细胞和各个分化阶段的成骨细胞,无论在组织学上,还是在功能上都做为一个生理单位发生作用,这一系列的细胞群被称为基本的多细胞单位(basic multicelluar unit,BMU)。
任何一种可以改变破骨细胞活性和成骨细胞分泌能力的因素均可对骨的再建产生深刻的影响。
雌激素通过多个环节维持骨吸收和骨形成的平衡。
(1)雌激素增加降钙素的分泌,抑制甲状旁腺激素的活性,从而抑制骨钙溶解、促进钙在肠内的吸收、帮助活性维生素D(1,25-二羟维生素D)在肾脏的合成、促进骨的重建。
(2)而且许多研究发现骨细胞内存在雌激素受体。
实验表明, 在成骨细胞上存在雌激素受体。
雌激素具有刺激骨形成作用,破骨细胞是雌激素的靶细胞[11]。
(3)雌激素通过影响局部的细胞因子如IGF-I、TGF-β、IL-1、TNF、IL-6等而调节成骨细胞与破骨细胞的功能状态,进而影响骨代谢[12]。
2、药物诱导常用诱导骨质疏松动物模型有维甲酸和糖皮质激素。
维甲酸是维生素A的衍生物,临床上作为治疗白血病的药物,对骨代谢有明显的影响,大鼠维甲酸70mg/kg灌胃两周,即出现骨密度降低,骨小梁吸收,断裂,稀疏;骨髓腔增大。
骨矿含量降低,骨板结构破坏及骨骼负重功能损害;骨生成减少而骨吸收增加等。
利用这一特性,可成功复制出骨质疏松动物模型。
在造型过程中,动物会出现厌食,体重减轻,倦怠等表现,且易感染。
此模型的组织形态学改变,及对雌激素治疗的反应与人类有较好相似性[13]。
是大鼠急性骨质疏松的复制方法。
维甲酸诱导大鼠骨质疏松主要是激活破骨细胞的分化、增殖,促进骨吸收作用,而造成骨吸收大于骨形成的负平衡状态,造成骨丢失。
同时文献报道,维甲酸可造成卵巢重量明显减轻,子宫萎缩,维甲酸有损伤卵巢功能的作用,雌激素水平下降[14],体内雌激素减少是导致骨质疏松的主要原因。
柯兴氏综合症或接受皮质类固醇激素治疗的病人,约半数发生骨质疏松,借此,予动物大剂量长期使用皮质类固醇激素可诱导骨质疏松模型,常用强的松或强的松龙,皆可观察到显著的骨丢失。
糖皮质激素直接抑制成骨细胞的功能,减少前成骨细胞向功能性成骨细胞转化,降低前成骨细胞的骨胶原的合成,使骨基质形成减少,破骨细胞间接由于偶联因素及PTH增加的刺激而骨吸收加速[15]。
血钙水平下降,是皮质类固醇抑制小肠钙吸收的结果。
又进而刺激PTH分泌,血清降钙素浓度轻度下降,也是骨吸收活跃的原因。
皮质类固醇可抑制肾小管对钙磷的重吸收[16]。
此模型在一定程度上模拟骨形成减少的变化。
但不够理想,原因在于动物真正的骨生成减少较为少见。
并且与原发性骨质疏松的发病机理与病程不一致,因此不适合用于观察药物对骨吸收抑制作用的研究模型。
3、饮食限制决定和影响骨量的因素可概括为遗传因素和环境因素。
其中环境因素有营养、体力活动和生活习惯等。
营养对骨量的维持有必不可少的作用,特别是其中的蛋白质及钙质。
但只是环境因素之一,对骨量的影响较小。
因其是可控因素,加之骨量的微细变化可致骨折风险大大增加,所以合理的营养在原发性骨质疏松的防治上有一定作用。
