骨质疏松常见模型(1)
实验动物学论文-骨质疏松模型

《实验动物学》结课论文骨质疏松动物模型的研究学院:专业:班级:姓名:学号:骨质疏松动物模型的研究【摘要】:骨质疏松症(osteoporosis,OP)是一种系统性骨病,其特征是骨量下降和骨的微细结构破坏,表现为骨的脆性增加,因而骨折的危险性大为增加,即使是轻微的创伤或无外伤的情况下也容易发生骨折。
随着对骨质疏松症研究的加深,动物模型成为不可或缺的研究材料。
研究人员应根据实验要求和目的,慎重选择合适的动物模型。
【关键词】:骨质疏松;动物模型;骨质疏松症是一种钙质由骨骼往血液净移动的矿物质流失现象,骨质量减少,骨骼内孔隙增大,呈现中空疏松现象,速率取决于破骨细胞和成骨细胞活性的消长。
骨质疏松症的表面症状为骨质流失和骨组织破坏,从而导致骨质变得脆弱,大大增加骨折的可能性。
骨质疏松症主要可分为:原发性骨质疏松症和继发性骨质疏松症。
原发性骨质疏松症又可分为绝经妇女的骨质疏松症(I型)和老年性骨质疏松症(II型)。
虽然骨质疏松症多数情况下并不会直接导致死亡,但骨质疏松症增加骨折机会,从而影响病患者的健康和独立生活能力,更大大增加社会医疗负担。
因此,为了更好地防治骨质疏松症研究出有效的药物,动物模型的应用显得尤为重要。
1 理想动物模型选用原则使用实验动物进行实验的目的是用最少的动物数量达到最大的实验精确度,最好的可重复性和稳定性。
理想的骨质疏松动物模型应该满足以下条件:再现性好,模型与人类骨质疏松症状和组织行为尽可能相似;重复性好,一定的条件下,由不同实验人员或同一实验人员在不同时间进行操作,模型能够很好的被重复出来;动物模型能反映骨质疏松症时骨代谢,微结构的变化;与临床的一致性,模型的处理因素尽可能与临床发病病因相一致;实验动物容易获得,价格低廉,造模周期短,便于操作和取材。
2 常用骨质疏松症模型动物2.1啮齿目动物①大鼠:大鼠是建立OP模型应用最广泛的动物,寿命约2.5~3年,常用于研究的是SD大鼠和Wistar大鼠。
常用骨质疏松动物模型特点的综述

常用骨质疏松动物模型特点的综述
骨质疏松是一种逐渐发展的症状,它会导致骨组织遭到破坏,严重的话还可能演变成骨折。
由于目前尚无针对骨质疏松的有效治疗手段,研究者采用动物模型研究该疾病。
目前常用的骨质疏松动物模型有野鼠、非人类灵长类动物和豚鼠模型等。
野鼠是使用最广泛的骨质疏松动物模型。
它可以利用雌激素抑制剂(比如雌激素)来建立骨质疏松模型,无需双侧大脑切除。
野鼠模型容易受技术人员操控,能够更加精确地模拟骨质疏松的发生神经机制和肿瘤相关疾病模型。
非人类灵长类动物模型是由大猩猩和小黑猩猩,不同年龄和性别的头脑及周围下颌骨组成,它呈现出快速症状的模型,可以模拟十分类似于人类的情况,能帮助研究者更近地了解骨质疏松的发展情况,探讨其机制等。
豚鼠模型是一种对钙离子水平的敏感的动物模型,它可以帮助骨质疏松的治疗研究,主要是基因敲除和抗细菌药物的影响,也可以用于进行膳食营养学研究,检测不同营养因子对骨组织质量的影响。
总之,野鼠、非人类灵长类动物和豚鼠是目前常用的骨质疏松动物模型,在不同的研究领域中表现出不同的特点,可以帮助研究者更好地了解骨质疏松症发生和发展情况,为对其进行有效治疗提供有用的参考。
骨质疏松动物模型特点的综述

骨质疏松动物模型特点的综述骨质疏松是一种以骨量减少,骨组织微细结构破坏,骨脆性增加和易发生骨折为特征的疾病,是老年人的常见病、多发病,日益受到人们的重视。
随着人类寿命的延长和老龄化社会的到来,该病的防治已成为一个迫切的问题。
在骨质疏松症的研究中,模型动物被广泛使用。
正确选择和建立一个理想的骨质疏松实验动物模型,是开展骨质疏松研究工作的基础。
目前可用于骨质疏松实验研究的动物主要有大鼠、小鼠、兔、羊、犬、猪、灵长类动物(除人类外)等。
它们在实验研究中均有各自的优缺点。
兹就目前常用的实验动物模型及其特点综述如下。
1 鼠类骨质疏松动物模型实验用大鼠有远交和近交系两种。
远交系包括Wistar Spraque-Dauley,Long-Evans,Holtzman 等品种,近交系包括ACI,Brown-Norway,Fischer 344,Lewis,Wistar-Furth等品种。
常用Wistar,Holtzzman,Fischer344、SD大鼠来作骨质疏松模型。
大鼠是骨质疏松研究中最常用的模型动物,与大动物相比,大鼠价廉,易于饲养;另外,大鼠能用较短的时间就能在骨建造和骨再建周期变化中达到新的平衡。
大鼠的自然寿命为2~3年,成年雄性大鼠在30个月时骨骺端仍有持续生长。
这种骨状态的不稳定性可能会干扰实验结果,因此大多数学者认为雄性大鼠不适合做各种成人骨骼研究的模型。
而雌性大鼠在6~9个月时就进入骨生长静止期,骨骺开始封闭,10个月达峰值骨量,出现一个骨代谢相对稳定的阶段,与人类相似;切除卵巢的大鼠经给予合适的雌激素进行替代试验时并不增加骨转换和骨丢失,这与绝经后妇女对雌激素替代法的反应相一致[1]。
在建立大鼠骨质疏松模型的方法研究上,有双侧卵巢切除法(去势法)、维甲酸法、糖皮质激素诱导法、营养法、人工法等。
其中双侧卵巢切除法最常用。
成年雌性大鼠有一个规则的发情期,发情期动物体内雌二醇水平处于峰值,每4 d有18 h峰值时间,在15个月后骨折发生较多,并且观察到松质骨有一些骨丢失现象,当不出现雌二醇的峰值时标志“绝经”,松质骨骨丢失发生加快。
骨质疏松动物模型特点的综述

骨质疏松动物模型特点的综述
骨质疏松是一种通常影响老年人的骨密度病,它导致骨骼细胞的
活动和功能障碍,并影响骨骼强度和骨抗压能力。
骨质疏松的动物模
型利用不同的方法来模拟人类的病变情况,剖析其发病机制,以及探
究药物治疗效果。
目前,骨质疏松动物模型主要包括:1)腹腔内注射
缺乏维生素D导致的动物模型;2)腹腔内注射可溶性维生素D受体拮
抗剂导致的动物模型;3)熟化维生素D或维生素D受体突变导致的动
物模型;4)加糖血病患者血清导入非人类磷酸酶导致的动物模型;5)补充各种外源因素导致的动物模型;另外还有一些使用大鼠进行造模
的骨质疏松动物模型。
上述模型可以用于研究骨质疏松的基础发病机
制和创新骨质疏松治疗方法。
骨质疏松模型建立

骨质疏松模型建立随着全球环境温度的升高、污染的加重以及城市人口的增加,越来越多的城市和农村地区的人们受到骨质疏松症的影响。
骨质疏松症的发病率正在大幅增加,伴随着发病率的提高,骨质疏松症的相关研究也越来越多。
针对这类疾病,建立一个合理的骨质疏松模型非常重要。
骨质疏松模型的建立包括三个方面:预防、诊断和治疗。
首先,要建立适合预防骨质疏松的模型方案,关键在于强调终身医学保健的重要性。
无论性别,年龄或家庭条件,都应该注重健康的宣传,加强终身健康的教育,引导人们积极参与体育或者运动锻炼,合理搭配膳食,增加维生素D等营养物质的摄入,以达到预防目标。
其次,要建立合理准确的诊断骨质疏松模型。
从放射性筛查、激素分析、骨质密度检测等多种方式,以确定诊断技术体系,以确保诊断结果的准确和可靠。
最后,应联合临床医生,开发适用于治疗骨质疏松的模型方案。
除了使用传统的药物治疗,还可以使用新型的治疗方案,如血清疗法、激光疗法、外源性骨修复蛋白等,精准治疗患者的骨质疏松。
针对骨质疏松的模型建立,有一些重要的观点必须考虑。
首先,研究和技术的突破,要保证模型的准确有效,可以从多方面来支持其可靠性。
其次,要注重跨学科和多方面的交叉融合,吸收多学科的优点,积极推进模型的科学性。
最后,应注重模型的实用性,使模型可以实施,以解决实际的问题,更好的服务患者的治疗。
回顾过去的研究和实践,建立合理的骨质疏松模型,将为改善骨质疏松症患者的治疗提供重要的参考价值。
另外,当前研究也有待于进一步完善,尤其是从基础研究、临床解决以及实践支撑上,需要不断改进和完善,才能推动模型的建立。
只有继续努力,才能更好的应对骨质疏松病的影响,促进人类健康的发展。
总之,建立一个合理的骨质疏松模型,对于改善骨质疏松症患者的治疗至关重要。
这需要将研究和应用结合起来,注重科学性、准确性、实用性的特点,以改善骨质疏松症患者的实际困境。
人类疾病动物模型

九,神经系统疾病动物模型: (一)脑缺血 1,动物:250-300克SD大鼠. ,动物:250-300克SD大鼠. 2,造模:麻醉,右侧卧位,开 颅,阻断其左侧大脑中动脉,引 起局灶性缺血,出现中风症状.
(二)脑出血 1,动物:成年大鼠. 2,造模:麻醉,俯卧位固定于脑 立体定位仪,并做股动脉插管. 按大鼠脑立体定位图谱确定尾 状核中心坐标,开颅,钻孔,穿刺 针抵达尾状核区域,从股动脉抽血 60l注入尾状核,骨蜡封闭颅骨孔. 60
四,泌尿系统疾病动物模型 (一)肾炎: 1,鸡蛋白诱发肾炎: (1)动物:2-2.5公斤家兔. )动物:2 2.5公斤家兔. (2)致敏:静脉注射不稀释的鸡蛋白1)致敏:静脉注射不稀释的鸡蛋白1 6ml,共4-5次,每次间隔4-5天. ml,共4 次,每次间隔4 (3)诱发过敏:向肾动脉注射1-3ml鸡 )诱发过敏:向肾动脉注射1 3ml鸡 蛋白,用手指压迫肾动脉5 蛋白,用手指压迫肾动脉5-6分钟. (4)判断指标:出现蛋白尿. 2.马血清诱发肾炎: 3.免疫血清诱发肾炎: 2.马血清诱发肾炎: 3.免疫血清诱发肾炎:
三 人类疾病动物模型的分类
1,诱发型动物模型(Experimental animal model) 2, 自发型动物模型( Spontaneous animal model) 3, 抗疾病动物模型(Negative animal model) 抗疾病动物模型(Negative 4, 生物医学动物模型(Biomedical animal model) 生物医学动物模型(Biomedical
二 人类疾病动物模型的意义
1,人类的替难者(避免人体实验造成危害) 2,可按需要取得实验样品 3,缩短研究周期 4,可比性强 5,有助于认识疾病本质 6,药效临床前研究 7,为教学服务
骨质疏松症风险评估模型

Mr.Health(健康医学家薛宝同先生)
骨质疏松症风险评估模型
骨质疏松症是受多因素影响的复杂疾病,对个体进行骨质疏松症风险评估,能为疾病早期防治提供有益帮助。
这里推荐国际骨质疏松基金会(International Osteoporosis Foundation,IOF)骨质疏松风险一分钟测试题和亚洲人骨质疏松自我筛查工具(Osteoporosis
Self-assessment Tool for Asians,OSTA),作为疾病风险的初筛工具。
一、IOF骨质疏松风险一分钟测试题
IOF骨质疏松风险一分钟测试题是根据患者简单病史,从中选择与骨质疏松相关的问题,由患者判断是与否,从而初步筛选出可能具有骨质疏松风险的患者。
该测试题简单快速,易于操作,但仅能作为初步筛查疾病风险,不能用于骨质疏松症的诊断,具体测试题如下:
不可控因素
1、父母曾被诊断有骨质疏松或曾在轻摔后骨折?
2、父母中一人有驼背?
3、实际年龄超过40岁?
4、是否成年后因为轻摔后发生骨折?
以知为本,服务社会。
骨质疏松常见模型(1)

骨质疏松常见模型1.概念:骨质疏松症是一种以骨量降低、骨微细结构破坏、骨强度下降,导致骨脆性增加,易发生骨折(骨折风险性增加)为特征的全身性骨骼疾病.2.临床表现:腰背部疼痛,体长缩短,驼背及发生骨折。
3.按严重程度分:骨质疏松的发生程度包括低骨量、骨质疏松症和骨质疏松性骨折.依次程度增加.4.现代医学将骨质疏松症分为原发性、继发性、特发性骨质疏松症三大类。
原发性骨质疏松症(primary osteoporosis,POP),因年龄所致的体内性激素突然减少及生理性退行性改变所致。
分为Ⅰ型绝经后骨质疏松症(postmenopausal osteoporosis,POMP)和Ⅱ型老年性骨质疏松症。
继发性骨质疏松症,由疾病或药物因素诱发,疾病如内分泌代谢病(糖尿病、甲状腺功能亢进症)、肾脏疾病、肝脏疾病等,药物诱发如长期大剂量的肝素、免疫抑制剂、抗癫痫病药、糖皮质激素的应用。
而特发性骨质疏松症,一般伴有遗传疾病史,女性多见,妇女哺乳期和妊娠期的骨质疏松症往往也列为此类现代医学的研究1.发病机制:主要机制是因为衰老、体内性激素减少、药物和某些疾病等因素导致骨吸收和骨形成平衡失调,骨矿物质和有机质等比例丢失,导致骨量减少和骨质疏松,进而引发骨折,为全身性代谢性骨病。
总的来说,是由遗传、激素、营养、失用、年龄、生活习惯及免疫学等方面多种因素交互影响的结果。
2.诊断与治疗:①诊断:依靠临床表现、骨量的测定、骨密度(bone mineraldensity,BMD)及骨转化生化指标等,其中以骨量测定最为重要。
临床上采用采用BMD测量作为诊断、与测量骨质疏松症骨折风险、监测自然病程以及评价药物干预疗效的最佳定量指标。
临床上测量BMD的方法有双能X线吸收测定法(DXA)、外周双能X线吸收测定法(pDXA)、定量计算机断层照相术(QCT)及定量骨超声(QUS)等,其中DXA测量值是目前国际学术界公认的临床骨质疏松症诊断的“金标准”.②治疗:除了加强锻炼、改变不良生活习惯等,主要还是要依靠药物治疗。
【国家自然科学基金】_骨质疏松模型_基金支持热词逐年推荐_【万方软件创新助手】_20140802
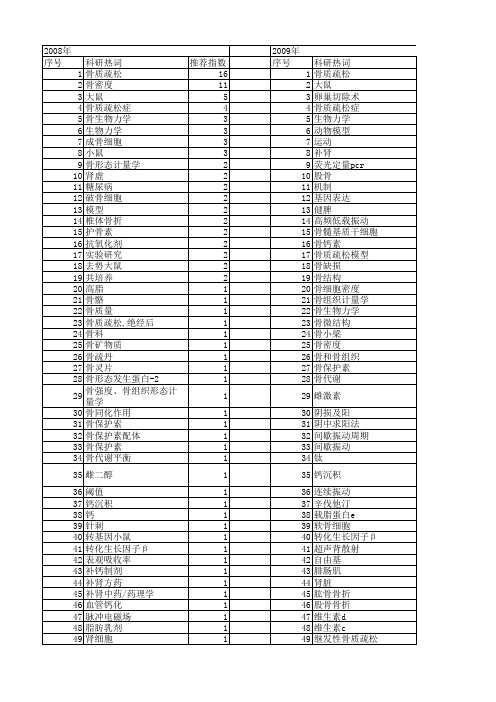
科研热词 推荐指数 骨质疏松 16 骨密度 11 大鼠 5 骨质疏松症 4 骨生物力学 3 生物力学 3 成骨细胞 3 小鼠 3 骨形态计量学 2 肾虚 2 糖尿病 2 破骨细胞 2 模型 2 椎体骨折 2 护骨素 2 抗氧化剂 2 实验研究 2 去势大鼠 2 共培养 2 高脂 1 骨骼 1 骨质量 1 骨质疏松,绝经后 1 骨科 1 骨矿物质 1 骨疏丹 1 骨灵片 1 骨形态发生蛋白-2 1 骨强度、骨组织形态计量学 1 骨同化作用 1 骨保护索 1 骨保护素配体 1 骨保护素 1 骨代谢平衡 1 雌二醇 1 阈值 1 钙沉积 1 钙 1 针刺 1 转基因小鼠 1 转化生长因子β 1 表观吸收率 1 补钙制剂 1 补肾方药 1 补肾中药/药理学 1 血管钙化 1 脉冲电磁场 1 脂肪乳剂 1 肾细胞 1 肾上腺功能低下性骨质疏松 1 股骨 1 肌形态学 1
老年性骨质疏松 羟脯氨酸 羊 维甲酸 维生素d 组织构建 磷 磨损颗粒 磁场强度 碱性调宁蛋白 番茄红素 生物利用率 环磷酰胺 玉米黄质 油茶 椎体成形术 杜仲叶活性部位ⅰ 有限元分析 有限元 显微ct 旋转中心 护骨素配体 抗骨松颗粒 快速老化小鼠samp6 快速老化小鼠p6 微结构 归经 强的松龙 应力,物理 左心室 山茶 复方丹参合剂 基因敲除 同位素技术 双丹口服液 原发性骨质疏松症 动脉粥样硬化 动物模型 前弯力矩 净钙吸收率 依那西普 体层摄影术,x线计算机 低频脉冲电磁场 人甲状旁腺素相关蛋白 人工关节 中药 β -隐黄质 smad泛素调节因子2 smad6 d-半乳半糖 bmp-4 41ca
2010年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52
骨质疏松动物模型及其评价方法的研究进展

骨质疏松动物模型,同其他常用动物模型一样, 既可以避免实验研究对人体的各种伤害,还能在较 短的时间内成功地模拟疾病的病理状态,从而为人 类疾病的病理研究和发展创新药物提供了一种重要 手段。 为了进一步研究骨质疏松的发病机理和治疗 药物,科学家们发展了种类丰富的骨质疏松动物模 型,这些动物涵盖了大鼠、小鼠、家兔、犬和其他灵长 类动物。 本文将从动物模型和评价指标等方面,系 统地总结了近年来骨质疏松模型的研究进展,旨在 为今后对骨质疏松病理研究和抗骨质疏松药物作用 机理研究提供理论和实验依据。
也有研究者用小鼠、犬、羊和猪等动物复制去势动 物模型。 但是这些模型造模时间比较长,一般需要 3 到 4 个月,加上动物的饲养成本也非常高,这也促使研 究者在这些模型基础上开发更加经济合理的模型。 1.1.2 甲状旁腺切除诱发的骨质疏松模型:该模型 操作较为麻烦,易损伤喉返神经。 大鼠一般手术后
图 1 常见的骨质疏松动物模型造模方法 Fig.1 The common types of animal osteoporosis models
基金项目: 国家自然科学基金 资 助 项 目 ( NSFC81273995; NSFC81274140 ) 、 教 育 部 和 国 家 外 专 局 高 等 学 校 学 科 创 新 引 智 计 划 资 助 项 目 ( B07007) ;北京中医药大学自主选题项目(2015-JYB-XSO48)
骨质疏松动物模型介绍

骨质疏松的动物模型骨质疏松症是以骨量减少及骨组织微观结构为特征的一种全身性骨骼疾病,伴有骨的脆性增加、易于发生骨折。
骨质疏松症是目前世界上发病率、死亡率和医疗保健消耗较大的疾病之一。
骨质疏松起病隐袭,一旦发现,多已发展到一定程度。
随年龄增加,骨丢失和骨折发生率明显增加。
骨质疏松性骨折可发生在任何部位,但以椎骨、腕部和髋部多见。
髋部骨折最为严重,多需手术处理,且患者常合并慢性疾病,如高血压、心血管、慢性呼吸道阻塞疾病及糖尿病等,导致医疗费用和死亡率增加,一部分患者日常生活不能完全独立,年平均生活质量下降。
女性由于峰骨量较低及绝经后雌激素水平下降,发病率较男性为高。
近年来随着社会老龄化,人口寿命的延长,女性绝经后生存年限约占一生的1/3,据估计,从1990-2025,欧洲50岁以上妇女将增加30%-40%。
男性预计增加更快,可达50%。
在同一时期内,北美预期将增加83%。
亚非绝对增加数将为更为明显。
在1990年全世界仅髋部骨折达130-170万,预期到2025年为200万,甚至更多[1]。
骨质疏松症已成为全世界范围的严重的社会和经济问题。
骨质疏松症的预防和治疗已成为一个多学科的、当前研究最活跃的课题之一。
建立理想的骨质疏松症的动物模型是对治疗和预防骨质疏松症新药的体内过程、药物代谢动力学、药效学和影响药物作用因素的基础。
随着对骨质疏松症的研究的不断深入,认为骨质疏松症的发生与遗传、营养、生活习惯、激素、运动、机械负荷和多种细胞因子有关。
对骨质疏松症的动物模型提出了严格的(1)方便性(Convenience):要求。
Rodgers等指出理想的动物模型应有三个特点:动物购来容易,价格低廉,实验操作易行。
(2)关联性(Relevance):与人体条件比较相似,得到的信息能转化为人体的规律。
(3)适宜性(Appropriateness):为研究某一特定问题,最好用特定的动物模型模拟人体[2]。
骨质疏松症的动物模型涉及动物的选择和复制的方法等方面,本文就此将国内外的有关进展进行综述。
实验报告骨学

一、实验目的1. 了解骨骼系统的基本结构和功能。
2. 掌握骨骼的形态、大小和连接方式。
3. 学习骨的生理、病理变化及其与疾病的关系。
二、实验材料1. 骨骼模型2. 骨折模型3. 骨质疏松模型4. 骨折愈合模型5. X线片三、实验方法1. 骨骼模型的观察(1)观察骨骼模型的形态、大小和连接方式。
(2)了解骨骼系统的组成,包括颅骨、脊柱、胸廓、骨盆和四肢骨。
2. 骨折模型的观察(1)观察骨折模型,了解骨折的形态和分类。
(2)学习骨折的治疗方法,如复位、固定和康复。
3. 骨质疏松模型的观察(1)观察骨质疏松模型,了解骨质疏松的形态和病因。
(2)学习骨质疏松的治疗方法,如药物治疗、生活方式调整等。
4. 骨折愈合模型的观察(1)观察骨折愈合模型,了解骨折愈合的过程和影响因素。
(2)学习骨折愈合的治疗方法,如药物治疗、康复训练等。
5. X线片的观察(1)观察X线片,了解骨骼的影像学表现。
(2)学习骨骼病变的诊断方法,如骨折、骨质疏松等。
四、实验结果与分析1. 骨骼模型的观察结果通过观察骨骼模型,我们了解了骨骼系统的基本结构和功能。
骨骼系统由骨骼、关节和骨骼肌组成,具有支持、保护和运动等功能。
2. 骨折模型的观察结果通过观察骨折模型,我们了解了骨折的形态和分类。
骨折分为完全骨折和不完全骨折,根据骨折线的方向可分为横断骨折、斜形骨折和螺旋骨折等。
骨折的治疗方法包括复位、固定和康复。
3. 骨质疏松模型的观察结果通过观察骨质疏松模型,我们了解了骨质疏松的形态和病因。
骨质疏松是一种以骨量减少、骨微结构破坏为特征的代谢性骨病。
骨质疏松的治疗方法包括药物治疗、生活方式调整等。
4. 骨折愈合模型的观察结果通过观察骨折愈合模型,我们了解了骨折愈合的过程和影响因素。
骨折愈合分为三个阶段:炎症期、修复期和重塑期。
骨折愈合的治疗方法包括药物治疗、康复训练等。
5. X线片的观察结果通过观察X线片,我们了解了骨骼的影像学表现。
骨折、骨质疏松等骨骼病变在X 线片上具有一定的特征性,有助于疾病的诊断。
骨质疏松性骨折的风险预测模型

骨质疏松性骨折的风险预测模型1. 背景介绍骨质疏松是一种常见的骨骼疾病,主要表现为骨量减少和骨密度降低,从而使骨骼易于发生骨折。
骨质疏松性骨折的发生会给患者的生活带来严重影响,因此准确预测患者患骨质疏松性骨折的风险非常重要。
本文将介绍一种基于风险预测模型的方法来评估骨质疏松性骨折的风险。
2. 数据收集与预处理预测模型的建立需要大量的样本数据。
我们可以从多个渠道收集相关的临床数据,包括患者的基本资料、生活方式、饮食习惯、体重等因素。
此外,还应考虑收集患者的骨密度检查结果、骨代谢指标以及家族病史等信息。
为了保证数据的准确性和可信度,我们需要对数据进行预处理,包括数据清洗、去除异常值和缺失数据的处理等。
3. 特征选择与提取在建立预测模型之前,我们需要对收集到的数据进行特征选择和提取。
特征选择是指从原始数据中挑选出对预测目标具有显著影响的特征变量。
可以使用统计方法、机器学习方法或领域知识来选择特征。
特征提取是指将原始数据转换为更有意义和更具代表性的特征表示,通常涉及特征降维、特征缩放和特征构建等技术。
4. 模型选择与建立选择合适的模型是预测准确性的关键。
常用的预测模型包括逻辑回归、支持向量机、随机森林和神经网络等。
针对骨质疏松性骨折的风险预测问题,我们可以使用分类模型进行建模。
在模型建立过程中,需要将数据集划分为训练集和测试集,利用训练集对模型进行训练,然后使用测试集评估模型的性能。
5. 模型评估与优化模型评估是判断预测模型性能的关键步骤。
常用的评估指标包括准确率、召回率、F1值和ROC曲线等。
在评估模型性能时,还需要考虑到不同的阈值设置对模型性能的影响。
若模型的性能不理想,可以尝试优化模型。
常用的优化方法包括参数调整、特征选择、特征工程和集成学习等。
6. 模型应用与展望通过建立风险预测模型,可以将其应用于临床实践中,进行骨质疏松性骨折风险的评估。
通过预测患者可能发生骨折的风险,可以采取相应的干预措施,预防和管理骨质疏松性骨折的发生。
骨质疏松动物模型实验技术原理

骨质疏松动物模型实验技术原理
展开全文
骨质疏松模型实验方法:雌性实验大鼠按40mg/kg体重的剂量经腹腔注射2%PN麻醉,无菌下腹部正中切口,钝性分离腹肌腹膜后进腹,丝线结扎卵巢后并摘除。
缝合切口前腹腔内注入万古霉素10万U。
造模后大鼠常规饲养,自由饮水和进食。
骨质疏松模型(卵巢摘除)特点:大鼠去卵巢后其体内雌**分泌减少,使其对破骨细胞的抑制减弱,骨吸收大于骨形成,骨骼呈高转变状态,骨量不能保持平衡,导致骨丢失增加。
镜下病理组织学观察显示,骨组织切片中骨小梁断裂,排列稀疏,形态结构完整性差。
以往研究表明,3-9月龄区间的大鼠适合复制骨质疏松模型,尤其是6月龄大鼠已达峰值骨量。
大鼠年龄过小,机体内因生长期骨量显著增长会掩盖去卵巢的骨量丢失:而12月龄后的大鼠由于开始进入老龄期,机体内会出现老龄型骨量丢失,从而影响实验结果观察。
方法比较:到目前为止,卵巢切除复制的骨质疏松模型是WHO 和美国HDA推荐的研究绝经后骨质疏松症的较佳模型。
此外还有维甲酸骨质疏松模型,维甲酸临床上用于各种皮肤病,同时伴有骨质疏松的副作用。
研究表明,维甲酸能激活机体内破骨细胞促进骨吸收,但对成骨细胞活性无抑制作用,对骨形成及骨基质的矿化过程也无明显影响,终使机体内骨重建处于骨吸收大于骨形成的负平衡状态,从而导致动物出现骨质疏松。
小鼠卵巢去势致骨质疏松症模型

小鼠卵巢去势致骨质疏松症模型卵巢是卵子发育和激素产生的器官,其受到下丘脑和垂体促性腺激素的双重调控(卵泡雌激素FSH)和黄体生成素(LH)。
LH是在下丘脑垂体促性腺激素释放激素(GnRH)的作用下以脉冲的方式分泌,在正反馈作用下诱发排卵所需的LH峰。
在卵巢,FSH受抑制素的双重负反馈调节,并受到性激素尤其是雌激素、孕激素的负反馈调节。
雌激素在调节骨代谢及维持内环境的稳定性方面有着重要的作用,雌激素水平低下被认为是导致骨质疏松症的主要原因。
雌性大鼠双侧卵巢摘除是一个较成熟的动物模型,可以成功建立模拟雌激素缺乏而导致的骨质疏松动物模型。
这也为研究雌激素缺乏对人体其他系统的损害奠定了基础。
雌激素是体内重要的激素,它对骨代谢有着重要的作用。
在对小鼠进行去势手术后,机体处于一种低雌激素的微环境,骨转换过程加速,骨代谢加强,成骨细胞量降低,破骨细胞活跃,从而导致机体骨量丢失以及正常生理结构的破换,容易导致骨质疏。
研究显示雌激素缺乏后,小鼠骨髓间充质细胞成骨能力显著降低,这与骨质疏松发生有关;而且雌激素缺乏后,会加重牙周炎的程度,这与雌激素缺乏后降低了牙周膜成纤维细胞的增殖与成骨能力有关。
许多已知的骨代谢相关因子都受到雌激素的调控。
在成骨细胞,雌激素能够促进代谢生长因子IGF-I 的合成与分泌,同时抑制骨吸收相关因子,如白介素-1(IL-1)及白介素-6(IL-6)、前列腺素、肿瘤坏死因子(TNF)等。
雌激素也可以促进骨保护素(OPG)的合成与分泌,而这种激素在抑制破骨细胞的功能方面有着重要的作用。
多方证据表明,在卵巢切除术后或绝经后,由于骨小梁的快速缺失而导致骨质疏松。
1.实验动物SPF级Balb/c小鼠,健康,雌性未孕,4~6W,体重为18g~20g.2.实验分组实验分六组:正常对照组、模型组、阳性药组、受试药组三个剂量组,每组15只动物。
3.实验周期12W4.建模方法1. 小鼠3%戊巴比妥钠40mg/kg腹腔麻醉后仰卧,腹部脱毛。
2024版《骨质疏松》PPT课件

《骨质疏松》PPT课件contents •骨质疏松概述•骨质疏松危险因素及评估•诊断方法与标准•治疗策略与药物选择•非药物治疗方法探讨•并发症预防与处理策略•总结与展望目录01骨质疏松概述定义与发病机制定义骨质疏松是一种以骨量减少、骨组织微结构破坏为特征的全身性骨骼疾病,易导致骨折风险增加。
发病机制涉及遗传、环境、生活方式等多方面因素,导致骨形成与骨吸收失衡,骨密度和骨质量下降。
发病率地域分布危险因素不同地域和种族间存在差异,发达国家发病率较高。
包括年龄、性别、家族史、低钙摄入、缺乏运动等。
0302 01流行病学特点随年龄增长而升高,女性高于男性。
临床表现与分型临床表现疼痛、脊柱变形、骨折等。
分型原发性骨质疏松(包括绝经后骨质疏松和老年性骨质疏松)和继发性骨质疏松。
02骨质疏松危险因素及评估不可控因素随着年龄的增长,骨质疏松的风险逐渐增加。
女性比男性更容易患骨质疏松,尤其是在绝经后。
某些种族,如白人和亚洲人,比其他人更容易患骨质疏松。
有骨质疏松家族史的人患病风险增加。
年龄性别种族家族史饮食习惯缺乏运动吸烟和饮酒药物使用可控因素01020304钙和维生素D 摄入不足是导致骨质疏松的重要因素。
长期缺乏运动会导致骨密度降低。
吸烟和过度饮酒都会对骨骼健康产生负面影响。
某些药物,如激素类药物,长期使用会增加骨质疏松的风险。
通过X 射线或超声波等方法测量骨密度,评估骨质疏松风险。
骨密度检测FRAX 工具QFracture 工具风险评估问卷FRAX 是一种基于临床危险因素的算法,用于预测10年内髋部骨折及任何重要骨质疏松性骨折的概率。
QFracture 是一种基于临床数据和统计模型的算法,用于预测未来骨折的风险。
通过问卷调查的方式收集相关信息,评估个体骨质疏松的风险。
风险评估工具及方法03诊断方法与标准03超声骨密度仪通过测量骨骼对超声波的传导速度和振幅衰减来评估骨密度,具有无创、便携的优点。
01双能X 线吸收法(DXA )通过测量骨骼对两种不同能量X 线的吸收程度来计算骨密度,具有精度高、辐射量低的优点。
骨质疏松动物模型

适应性喂养1周后,把50只大鼠按随机数字表法分为正常对照组、模型 组及培哚普利2,4,8 mg/(kg•d)3个剂量组,共5组,每组10只。造模前给 每个大鼠作标记,称量并记录各个大鼠的体质量。按每2 g维甲酸粉剂加入3 mL吐温80的比例将维甲酸充分溶解,再加去离子纯净水搅拌混匀配制成维 甲酸溶液。模型组及培哚普利3个剂量组的大鼠均予维甲酸80 mg/kg灌胃, 于早上9点开始灌胃,1次/d,连续14 d,用以制备骨质疏松模型。正常对照 组则灌予等容积的蒸馏水。
维甲酸模型应用
培哚普利对维甲酸所致骨质疏松模型大鼠骨代谢的影响
培哚普利有效控制维甲酸 所致骨质疏松模型大鼠的 骨质丢失,抑制骨吸收, 促进骨形成,改善骨代谢 的负平衡状态,对维甲酸 导致的骨质疏松症具有良 好的防治作用。
动物模型的评价
模型评价
骨密度检测 骨组织形态观察
骨生物力学 生化指标
动物模型的评价-骨密度
科室会
生化指标 生物力学
• 骨形成:I型前胶原前肽、骨源性碱性磷酸酶、骨钙素等; • 骨吸收:I型胶原羧基端交联肽、I型胶原氨基端交联肽、
抗酒石酸酸性磷酸酶等;
• 反映骨强度、硬度、韧性,间接反映 骨矿盐分布,骨小梁空间结构;
模型评价:股骨骨密度检测和病理学观察证实模型构建成功后
糖皮质激素模型应用
云克是人工微量元素锝(99Tc)与亚甲基二膦 酸(MDP)的螫 合物商品名
糖皮质激素模型应用
中药葛藤提取物对糖皮质激素致骨质疏松大鼠的影响
中药葛藤提取物具有 明显的干预和治疗骨 质疏松的药效学研究
维甲酸模型
实验动物:大鼠、小鼠等; 适用范围:药物研究中应用较为普遍,操作简、时间短、成功率高。 原 理:是维甲酸通过激活体内的维甲酸受体相关的孤儿受体进而影响 骨
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(四)刘锡仪等曾报道用损毁大鼠弓状核,致使ARC神经细胞明显受损,最终导致骨质疏松,皮下注射10%谷氨酸钠(MSG,4g/kg),可以选择性损伤大鼠下丘脑弓状核神经元,导致内分泌调节功能紊乱,从而建立了谷氨酸单钠(MSG)大鼠骨质疏松模型。被命名为脑源性骨质疏松症。其他脑源性骨质疏松模型:下丘脑-垂体断开术,松果体切除术。更接近于人类骨质疏松的病变过程,也适用于研究中枢神经系统在骨骼系统生长和发育中的作用。
骨质疏松常见模型
1.概念:骨质疏松症是一种以骨量降低、骨微细结构破坏、骨强度下降,导致骨脆性增加,易发生骨折(骨折风险性增加)为特征的全身性骨骼疾病。
2.临床表现:腰背部疼痛,体长缩短,驼背及发生骨折。
3.按严重程度分:骨质疏松的发生程度包括低骨量、骨质疏松症和骨质疏松性骨折。依次程度增加。
4.现代医学将骨质疏松症分为原发性、继发性、特发性骨质疏松症三大类。原发性骨质疏松症(primary osteoporosis,POP),因年龄所致的体内性激素突然减少及生理性退行性改变所致。分为Ⅰ型绝经后骨质疏松症(postmenopausalosteoporosis,POMP)和Ⅱ型老年性骨质疏松症。继发性骨质疏松症,由疾病或药物因素诱发,疾病如内分泌代谢病(糖尿病、甲状腺功能亢进症)、肾脏疾病、肝脏疾病等,药物诱发如长期大剂量的肝素、免疫抑制剂、抗癫痫病药、糖皮质激素的应用。而特发性骨质疏松症,一般伴有遗传疾病史,女性多见,妇女哺乳期和妊娠期的骨质疏松症往往也列为此类
4.骨密度(BMD)测量:可以了解骨吸收与骨形成功能状态。采用定量计算机断层扫面法(QCT)、超声法和双光子吸收测量法(DPA)等测量。
5.骨矿物成分和有机物测定
6.骨代谢的生化指标测定:1.与骨形成有关的生化指标2.与骨吸收有关的生化指标。
常见动物模型
原发性骨质疏松模型
(一)绝经后骨质疏松模型(PMOP)(1969年saville):1.双侧卵巢切除法(俯卧位)2.开腹手术法(仰卧位),一般术后15天骨量开始丢失,3个月后骨量丢失50%以上。此模型应选择6个月以上的成年期大鼠,尽量采用背部双侧卵巢切除术。
4.联合造模法诱发的骨质疏松动物模型:即多因素重叠加作用诱发骨质疏松模型。
骨质疏松细胞学模型
1.OB体外培养模型
2.OC体外培养模型
3.OB-OC体外培养模型
4.骨髓间充质干细胞模型
5.三维模型
1.骨组织形态计量学测定:一:骨组织的体内荧光标记方法。二:骨组织取材方法。三:骨组织形态计量学测量方法。
2.骨的微观结构和三维结构参数测定:采用先进的micro-CT测量技术,从立体结构定量研究药物对骨结构的影响,不仅可以获得对骨量和骨结构的数据,其最大特点是无创性,可动态观察药物的时-效关系。
3.骨生物力学性能测定:生物力学是根据已确立的力学原理来研究生物体中力学问题的一门学科,将物理学及应用数学的概念和方法用到生物体中,评价生命现象。骨生物力学的研究是对骨质量进行评价的一种可靠方法。其具体指标包括一下几种:①结构力学指标:包括最大载荷、弹性载荷、断裂扰度、弹性扰度和最大弯曲能量,反映骨结构力学的变化,其变化主要受骨尺寸和几何形态的影响。②材料力学指标:包括截面惯性矩、弹性弯曲应力、最大完全应力、弹性应变、最大应变、弹性模量和弯曲刚性系数。反映骨的内在质量,不受骨尺寸影响。一般选择皮质骨为主的长骨进行三点弯曲实验,松质骨为主的腰椎骨进行压缩实验来评价骨的生物力学性质。
现代医学的研究
1.发病机制:主要机制是因为衰老、体内性激素减少、药物和某些疾病等因素导致骨吸收和骨形成平衡失调,骨矿物质和有机质等比例丢失,导致骨量减少和骨质疏松,进而引发骨折,为全身性代谢性骨病。总的来说,是由遗传、激素、营养、失用、年龄、生活习惯及免疫学等方面多种因素交互影响的结果。
2.诊断与治疗:①诊断:依靠临床表现、骨量的测定、骨密度(bone mineral density,BMD)及骨转化生化指标等,其中以骨量测定最为重要。临床上采用采用BMD测量作为诊断、与测量骨质疏松症骨折风险、监测自然病程以及评价药物干预疗效的最佳定量指标。临床上测量BMD的方法有双能X线吸收测定法(DXA)、外周双能X线吸收测定法(pDXA)、定量计算机断层照相术(QCT)及定量骨超声(QUS)等,其中DXA测量值是目前国际学术界公认的临床骨质疏松症诊断的“金标准”。②治疗:除了加强锻炼、改变不良生活习惯等,主要还是要依靠药物治疗。药物干预破骨细胞和成骨细胞的功能,防止骨丢失,增加骨量。1.骨吸收抑制剂,常见的有二膦酸盐、雌激素类药物和降钙素等。此类药物对已经丢失骨量的恢复的作用不明显,雌激素类药物有诱发子宫内膜癌的危险。2.骨形成促进剂,常见的有氟化物、甲状旁腺激素、活性维生素D3等。这些药物可刺激成骨细胞分化成熟,促进骨基质分泌和矿化,增加骨量。目前公认的骨形成促进剂是甲状旁腺激素。3.骨矿化促进剂,钙剂和维生素D等,这类药物科促进骨基质矿化,减少矿物质流失。单独使用钙剂是没有治疗骨质疏松症的作用,必须配合骨形成促进剂或骨吸抑制剂。
(五)营养缺陷诱发的骨质疏松模型:①低钙饮食诱发的骨质疏松模型:Agata等研究发现,去势造模和低钙饲料结合,可缩短骨质疏松的造模时间,提高效率。②低钠诱导的骨质疏松模型:6周的SD大鼠每天等渗泵皮下滴注氨加压素(5ng/h),同时每天给付70ml/d(1.0kcal/ml)的溶液和去离子水,连续3个月。
(二)老年性骨质疏松模型(SAM)
1.自然衰老骨质疏松模型:采用24月龄以上的雌性大鼠为老年大鼠模型
2.自发老年性骨质疏松模型:快速老化模型小鼠(SAMP6),是目前仅有的一种能证明增龄性骨脆性骨折的动物。
3.药物致衰老骨质疏松模型:皮下注射D-半乳糖(100mg/(kg·d),给药2个月,呈现骨质疏松表现。
小鼠:小鼠基因组和人类有着较高的相似性,常采用小鼠进行骨代谢遗传因素研究,导入或敲除目的基因,观察其表型特征和病理变化。此外,小鼠也是研究峰值骨量及老龄性骨丢失的遗传因素的天然动物模型。小鼠作为骨质疏松药物筛选模型及药效学的研究较少。
家兔:成年兔具有明显的哈氏重建能力,半年骨骼即发育成熟,骨骺线闭合,因此,兔比鼠更接近人类。可以用作合成代谢促进药物对骨松质及哈氏重建作用的研究,还可以作为糖皮质激素诱导的骨质疏松症模型。
羊:目前已被美国FDA认可为是骨质疏松领域研究较为良好的大动物模型并广泛应用于骨疾病研究中。
此外,猪、羊、鸟类、马、羊等动物也可应用,但目前作为骨质疏松症的模型动物研究极少。
二.观察指标
骨质疏松的药效学指标应体现骨量、骨组织结构、骨矿密度、骨有机物含量、骨的生物力学性能的变化及其骨吸收和骨形成的动态变化。指标如下:
图1.抗骨质疏松症中药药效作用示意图
3.针对骨质疏松症,药效学的研究有以下几方面。1.增加骨量及改善组织微细结构2.对内分泌及免疫系统的调节作用3.调节微量元素平衡4.促进成骨细胞(OB)增殖分化,抑制破骨细胞(OC)增殖分化5.促进骨髓间充质干细胞分化6.改善骨髓微循环
模型研究方法
一.实验动物的选择
研究骨质疏松症的模型动物的选择特别重要。不同的骨质疏松症模型在动物中表现并不一致,不同动物种属与人类骨组织的组织学和生物代谢特征不同,不同年龄、不同性别的动物影响基础骨量的测定。因此,用于研究骨质疏松症模型的动物选择非常严格。
大鼠:大鼠骨代谢与人有许多相似之处:随年龄的增长骨量丢失,具有与人相似的骨松质分布以重建功能、卵巢切除后高的转化率、肠钙吸收下降及对性激素有相似的反应性。大鼠现已经成为研究骨质疏松症使用最多、最成熟的模型动物,但是大鼠皮质重建活性低,不宜于评价促进哈氏重建作用的药物。
成年犬:其骨代谢和骨组织结构方面与人类相似,骨皮质有丰富的哈氏系统,比格犬是评价促进骨合成代谢药物对骨质疏松和哈氏重建的影响的良好模型。缺点是切除卵巢和子宫不会诱发明显的骨丢失,雌激素和耗竭和甲状旁腺素的刺激也不会引发明显的骨量变化。
灵长类:灵长类的内分泌代谢、生殖周期、骨生物力学特性及骨组织变化与人类积为相似。是最适用于因敲除。
2.护骨素(OPG)具有抑制破骨细胞形成、分化、存活并诱导OC凋亡的功能。在OPG基因敲除的小鼠中表现为严重骨质疏松症。
3.连续向大鼠皮下连续28天注射人源性RANKL(175ug/kg/d)后,出现骨质疏松病症,该模型与去势模型大鼠有一定相似性,可以用于抗骨质疏松药物的药效学评价。
继发性骨质疏松模型
(一)糖皮质激素诱导骨质疏松模型(GIOP):以大鼠为主,肌内注射醋酸泼尼松龙液,每次剂量5mg/kg,每周2次,连续3个月科形成骨质疏松模型。
(二)维A酸复制骨质疏松模型:维甲酸是治疗恶性肿瘤的药物,副作用是诱发骨质疏松症。1989年由邵金莺等首创,一般用量在70~105mg/(kg·d)。连续灌胃14天,即可建模成功。后来研究者略有改进,大鼠:维A酸80mg/kg/d(1%纤维素溶液配制)灌胃,每天一次,2周后停用,标准饲养可诱发骨质疏松。小鼠:(10mg/kg/d)。不宜作为原发性骨质疏松模型。
(三)链脲佐菌素诱发的骨质疏松症:给大鼠注射链脲佐菌素(60mg/kg)21天后,ALP活性降低,钙离子含量下降,4周后大鼠骨小梁结构发生改变。
(四)乙醇性骨质疏松模型:60%浓度乙醇溶液按0.1ml/10g灌胃,时间为10天,间隔5天,一个月后可造成骨丢失。
(五)失用性骨质疏松模型:机械固定法是利用石膏、绷带等物品将动物肢体固定于特殊的不负重位置,使被固定肢体处于失用状态而造成骨质疏松。另外,尾部悬吊法、手术切除一侧坐骨神经或一侧膝腱甚至跟腱也可造成失用性骨质疏松模型。
