(完整word版)【原创】九年级化学原子结构示意图、离子结构示意图(Word版可编辑)
合集下载
京改版版九年级化学上册3.2《原子核外电子的排布 离子》课件(共39张PPT)

NH +
钠离子 4钙离子 镁离子
铝离子 氢离子 铵根离子
阴离子——带负电荷
Cl- O2- OH-
NO3- SO42 - CO32-
氯离子 氧离子 氢氧根离子 硝酸根离子 硫酸根离子 碳酸根离子
原子: 质子数=电子数 4、 阳离子: 质子数>电子数
阴离子: 质子数<电子数
练习
1、说出下列微粒的符号和名称:
• You have to believe in yourself. That's the secret of success. 人必须相信自己,这是成功的秘诀。
•
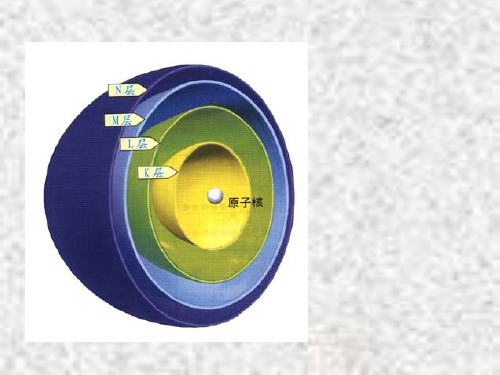
分层的排布
第第第第
第
第
第
一二三四
五
六
七
层层层层
层
层
层
一 核外电子的分层排布
电子层数
一 二 三 四 五六 七
离核距离
近
远
能量高低
低
高
(一)、 原 子 结 构 示 意 图
稀有气体:
最外层已达到8个电子稳定结构(氦,第一层达到2个电子稳定结构),不容易得到 或失去电子。一般不形成离子。
返回
2、书写离子的方法:
(1)离子用离子符号表示:
Mg2+
Cl-
镁离子
氯离子
在元素符号的右上角标出离子所带的电荷的多少及电荷的正负,当离 子所带电荷数为1时,1可以不写。
(2)离子符号的意义: Mg2+上的2表示每个镁离子带2个单位的正电荷 O2-上的2表示每
6
氮
氧
+9 2 7
氟
+10 2 8
氖Ne
+11 2 8 1 +12 2 8 2 +13 2 8 +14 2 8 4 +15 2 8 +16 2 8 +17 2 8 +18 2 8 8
初中化学原子结构示意图和离子ppt课件
Cl- O2- F- OH- SO42- NO3- CO32-
常见的离子
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
一、原子的构成
质子(+)
1、原子 原子核(+) 中子(不带电) (电中性) 核外电子( )
2、原子中:核电荷数=质子数=核外电子数 相对原子质量=质子数+中子数
原子结构示意图说明
原子核
原子核带正电
质子数
第3层 第2层 第1层
电子层
+ 16 2 8 6
电数
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
原子结构示意图说明
各元素原子最外电子数目的特点: 经营者提供商品或者服务有欺诈行为的,应当按照消费者的要求增加赔偿其受到的损失,增加赔偿的金额为消费者购买商品的价款或接受服务的费用
+11 2 8 1 失去1个电子
+11 2 8 带正电
钠原子(Na)
钠离子( Na+ )
+17 2 8 7
得到1个电子 +17 2 8 8
常见的离子
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
一、原子的构成
质子(+)
1、原子 原子核(+) 中子(不带电) (电中性) 核外电子( )
2、原子中:核电荷数=质子数=核外电子数 相对原子质量=质子数+中子数
原子结构示意图说明
原子核
原子核带正电
质子数
第3层 第2层 第1层
电子层
+ 16 2 8 6
电数
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
经营者提供商品或者服务有欺诈行为 的,应 当按照 消费者 的要求 增加赔 偿其受 到的损 失,增 加赔偿 的金额 为消费 者购买 商品的 价款或 接受服 务的费 用
原子结构示意图说明
各元素原子最外电子数目的特点: 经营者提供商品或者服务有欺诈行为的,应当按照消费者的要求增加赔偿其受到的损失,增加赔偿的金额为消费者购买商品的价款或接受服务的费用
+11 2 8 1 失去1个电子
+11 2 8 带正电
钠原子(Na)
钠离子( Na+ )
+17 2 8 7
得到1个电子 +17 2 8 8
沪教版初中化学九上 3.1.4 构成物质的基本微粒-离子 课件(16张PPT)

• 某离子带3个单位的正电荷, 质子数为13,该离子的核外电子数 为___10__,该离子的名称是铝__离__子__, 符号是_A_l_3+_,该离子的结构示意图 是:
+13 2 8
【能力提高】 《作业纸》p62/24
【结论】元素的性质,特别是化学性质与原子最 外层电子有密切关系。 结构 决定 性质
二、离子的形成
Na
失去一个电子 +11 2 8 1
Na+
+11 2 8
质子数 = 核外电子数
质子数 > 核外电子数
Cl
+17 2 8 7
得到一个电子
Cl -
+17 2 8 8
质子数 = 核外电子数
质子数< 核外电子数
1至18号原子结构示意图
为什么稀有气体化学性质稳定呢?
氦(He)
氖(Ne)
氩(Ar)
8电子稳定结构(He为2)
电子层排布特点与元素性质的关系
元素分类 最外层电子数 化学反应中得失电子的情况
金属 元素
一般<4个 易失电子达到稳定结构
非金属 元素
一般≥ 4个 易得电子达到稳定结构
稀有气体 元素 8个(氦为2) 稳定,难发生化学反应
构成物质的基本微粒 离子
一、原子核外电子的排布
特点: 电子分层排布、分层运动
原子结构示意图
例:钠原子
原子核
电子层 该层电子数
核电荷数
请绘制下列原子的原 子结构示意图。
规律: Mg、O、S、Cl、He、Ne
①第一电子层最多容纳2个电子, 第二电子层最多容纳8个电子。
②最外层电子数最多不超过8个。 ③排满时结构稳定。
+13 2 8
【能力提高】 《作业纸》p62/24
【结论】元素的性质,特别是化学性质与原子最 外层电子有密切关系。 结构 决定 性质
二、离子的形成
Na
失去一个电子 +11 2 8 1
Na+
+11 2 8
质子数 = 核外电子数
质子数 > 核外电子数
Cl
+17 2 8 7
得到一个电子
Cl -
+17 2 8 8
质子数 = 核外电子数
质子数< 核外电子数
1至18号原子结构示意图
为什么稀有气体化学性质稳定呢?
氦(He)
氖(Ne)
氩(Ar)
8电子稳定结构(He为2)
电子层排布特点与元素性质的关系
元素分类 最外层电子数 化学反应中得失电子的情况
金属 元素
一般<4个 易失电子达到稳定结构
非金属 元素
一般≥ 4个 易得电子达到稳定结构
稀有气体 元素 8个(氦为2) 稳定,难发生化学反应
构成物质的基本微粒 离子
一、原子核外电子的排布
特点: 电子分层排布、分层运动
原子结构示意图
例:钠原子
原子核
电子层 该层电子数
核电荷数
请绘制下列原子的原 子结构示意图。
规律: Mg、O、S、Cl、He、Ne
①第一电子层最多容纳2个电子, 第二电子层最多容纳8个电子。
②最外层电子数最多不超过8个。 ③排满时结构稳定。
人教版九年级化学课件:3.2 原子的结构——离子 (共17张PPT)

• 3 、一种原子与另一种原子的根本区别是
•
( A
、C相对)原子质量不同
B 、中子数不同
• C 、核电荷数不同 D 、电子数不同
• 4、在分子、原子、原子核、质子、中子、电子、 离子等微粒中,找出符合下列条件的微粒,填 在相应的横线上:
• (1)能直接构成物质的是_分_子_、_原_子_、离_子_.
联系
1.都很小;2.都不停地运动;3.微粒间都有
一定的间隔;4.都能直接构成物质
分裂
失去或得到电子
分子
结合
原子
离子
得到或失去电子
敞口放置食盐。氯化钠是由钠离子和氯离子相互
作用而构成的,试推测氯化钙是由什么构成的, 氯化镁由什么构成的? 钙离子和氯离子
镁离子和氯离子
总结三者区别与关系
分子
原子
离子
构成 主要 区别
由原子构成
在化学变 化中可分
由质子、中子、由原子得失 核外电子构成 电子构成
在化学变化 带电的微粒 中不可分
相同 处
静电作用
+17 2 8 8
NaCl
氯离子Cl-
形成离子的目的是 最外层达到8(He 为2)电子稳定结构
物质(离子构成)
• 1、“手和脑在一块干是创造教育的开始,手脑双全是创造教育的目的。” • 2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 • 3、反思自我时展示了勇气,自我反思是一切思想的源泉。 • 4、好的教师是让学生发现真理,而不只是传授知识。 • 5、数学教学要“淡化形式,注重实质.
6、“教学的艺术不在于传授本领,而在于激励、唤醒、鼓舞”。2021年11月上午7时52分21.11.1607:52November 16, 2021
北京版化学-九年级上册3.2《原子核外电子排布 离子》课件

电子的能量
低→高
电子离核远近
近→远
核内质子数
该
层
+8 2 6
上
的
电
子
原子核
数
电子层
氧原子结构示意图
2.原子结构示意图层 ? 核电荷数 ? 原子核
⑴第一层最多容纳__2_个电子第二层最多容纳_8_个电子
(2)最外层不超过 8 个电子 ⑶电子先排满能量低 的电子层,然后再排能量
第二节 原子核外电子的排布
氖原子平面模型
一.原子核外的电子是分层排布
(又叫分层运动)
1.电子能量的高低与离核远、近的关系:
一二 三 四 五 六七
电子层 二 K L M N O P
近Q
远
离核远近
能量高低 低
高
原子核外电子排布
电子层符号 K L M N O P Q
电子层数(n) 1 2 3 4 5 6 7
一般少于4个 易失电子
元素分类 最外层电子数 元素的化学性质
非金属 一般大于或等于4个 易得电子
3.元素分类、原子结构与元素化学性质的关系
元素分类 最外层电子 结构的稳性 化学性质 数
金属
<4
不稳定结构 易失去最外
层电子
非金属 稀有气体
≧4 不稳定结构
=8 (He为2)
稳定结构
易得到电子
极难发生化 学反应
决定元素化学性质的 最外层电子数
。
决定元素种类的 核电荷数(或质子数)。
稍 高 的电子层
某元素的原子结构示意图为 该元素的核电荷数为 13 个, 核外有 3 个电子层, 第二层上有 8 个电子, 最外电子层上有 3 个电子, 该元素符号为 Al 元素。
初中化学原子结构示意图和离子共16页PPT18页

谢谢!
21、要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根 22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈
23、一切节省,归根到底都归结为时间的节省。——马克思 24、意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚
25、学习是劳动,是充满思想的劳动。——乌申斯基初中化学原子结构示意图和离子 Nhomakorabea16 页
16、人民应该为法律而战斗,就像为 了城墙 而战斗 一样。 ——赫 拉克利 特 17、人类对于不公正的行为加以指责 ,并非 因为他 们愿意 做出这 种行为 ,而是 惟恐自 己会成 为这种 行为的 牺牲者 。—— 柏拉图 18、制定法律法令,就是为了不让强 者做什 么事都 横行霸 道。— —奥维 德 19、法律是社会的习惯和思想的结晶 。—— 托·伍·威尔逊 20、人们嘴上挂着的法律,其真实含 义是财 富。— —爱献 生
21、要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根 22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈
23、一切节省,归根到底都归结为时间的节省。——马克思 24、意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚
25、学习是劳动,是充满思想的劳动。——乌申斯基初中化学原子结构示意图和离子 Nhomakorabea16 页
16、人民应该为法律而战斗,就像为 了城墙 而战斗 一样。 ——赫 拉克利 特 17、人类对于不公正的行为加以指责 ,并非 因为他 们愿意 做出这 种行为 ,而是 惟恐自 己会成 为这种 行为的 牺牲者 。—— 柏拉图 18、制定法律法令,就是为了不让强 者做什 么事都 横行霸 道。— —奥维 德 19、法律是社会的习惯和思想的结晶 。—— 托·伍·威尔逊 20、人们嘴上挂着的法律,其真实含 义是财 富。— —爱献 生
