凝血酶敏感蛋白1及下游分子在类风湿关节炎中的研究进展
LncRNA NEAT1-miR-128-3p-SIRT1通路在类风湿关节炎自噬调控过程中的作用机制

LncRNA NEAT1-miR-128-3p-SIRT1通路在类风湿关节炎自噬调控过程中的作用机制研究摘要:本研究旨在探究LncRNA NEAT1/miR-128-3p/SIRT1通路在类风湿关节炎自噬调控过程中的作用机制。
通过实验分析发现,在类风湿关节炎患者中NEAT1表达水平升高,而miR-128-3p和SIRT1表达水平降低。
此外,研究还发现LncRNA NEAT1可以通过吸附miR-128-3p来抑制miR-128-3p的表达,从而增强SIRT1的表达,促进自噬进程。
实验结果表明,LncRNA NEAT1/miR-128-3p/SIRT1通路在类风湿关节炎自噬调控过程中具有重要的作用。
关键词:LncRNA NEAT1;miR-128-3p;SIRT1;自噬;类风湿关节炎1. 引言类风湿关节炎是一种常见的自身免疫性疾病,其主要表现为关节炎症,严重影响患者的生活质量。
目前,虽然已经有了一些治疗手段,但是其临床治疗效果仍然较为有限。
因此,深入研究类风湿关节炎发生和发展的分子机制,对于制定更加精准的治疗方案具有非常重要的意义。
2. 研究方法本研究收集了类风湿关节炎患者和健康人群的关节组织样本,通过检测NEAT1、miR-128-3p和SIRT1的表达水平,探究其在类风湿关节炎发生和发展中的作用。
此外,研究还采用分子生物学技术,对LncRNA NEAT1/miR-128-3p/SIRT1通路在自噬调控过程中的作用机制进行深入研究。
3. 结果分析实验结果显示,在类风湿关节炎患者中NEAT1表达水平升高,而miR-128-3p和SIRT1表达水平降低。
此外,研究还发现LncRNA NEAT1可以通过吸附miR-128-3p来抑制miR-128-3p的表达,从而增强SIRT1的表达,促进自噬进程。
4. 结论本研究表明,LncRNA NEAT1/miR-128-3p/SIRT1通路在类风湿关节炎自噬调控过程中具有重要的作用。
乌头汤在类风湿关节炎中的抗炎机制研究进展

乌头汤在类风湿关节炎中的抗炎机制研究进展杨静1王海东2苏小军2宁义菲1田雪梅21甘肃中医药大学中医临床学院甘肃兰州730000;2甘肃省中医院风湿骨病中心[摘要]类风湿关节炎(R A)是关节滑膜炎症,以侵袭关节软骨与骨质破坏为主要临床病理特征的慢性系统性自身免疫疾病炎症作为R A发病的核心病理环节和关键预后环节,影响着疾病的发展与转归,若滑膜炎症持续存在,最终会导致关节僵硬㊁变形㊁骨质破坏和功能丧失㊂乌头汤(WT D)可发挥温经益气㊁散寒宣痹的功效,是治疗寒湿痹阻型R A的基础方剂㊂本文通过运用文献综述的研究方法,对近年来WT D抗炎症机制的相关研究进行归纳整理,发现WT D可通过单味药物抗炎活性成分的协同作用调控炎症相关信号通路,继而调控炎症因子㊁炎症介质等发挥抗炎作用㊂[关键词]乌头汤类风湿关节炎抗炎机制综述[中图分类号] R285[文献标识码] A [文章编号]2095-2694(2024)01-001-06[D O I]10.19539/j.c n k i.2095-2694.2024.01.001R e s e a r c h p r o g r e s s o n t h e a n t i-i n f l a m m a t o r y m e c h a n i s m o f W u T o u D e c o c t i o n i n r h e u m a t o i d a r t h r i t i s Y a n g J i n g,W a n g H a i d o n g,S u X i a o j u n,e t a l(C l i n i c a l C o l l e g e o f T C M,G a n s u U n i v e r s i t y o f C h i n e s e M e d i c i n e,L a n z h o u730000,C h i n a)[A B S T R A C T] R h e u m a t o i d a r t h r i t i s(R A)i s a c h r o n i c s y s t e m a t i c a u t o i mm u n e d i s e a s e w i t h t h e m a i n c l i n i c a l a n d p a t h o l o g i c a l c h a r a c t e r i s t i c s o f s y n o v i a l i n f l a mm a t i o n a n d j o i n t c a r t i l a g e a n d b o n e d e s t r u c-t i o n.I n f l a mm a t i o n,a s t h e c o r e p a t h o l o g i c a l l i n k a n d k e y p r o g n o s t i c l i n k o f R A,a f f e c t s t h e d e v e l o p-m e n t a n d o u t c o m e o f t h e d i s e a s e.I f t h e s y n o v i a l i n f l a mm a t i o n p e r s i s t s,i t w i l l u l t i m a t e l y l e a d t o j o i n t s t i f f n e s s,d e f o r m a t i o n,b o n e d e s t r u c t i o n a n d f u n c t i o n a l l o s s.W u t o u D e c o c t i o n(WT D)c a n p l a y t h e r o l e o f w a r m i n g t h e c h a n n e l s,n o u r i s h i n g q i a n d d i s p e l l i n g c o l d a n d d a m p n e s s,a n d i s t h e b a s i c p r e-s c r i p t i o n f o r t h e t r e a t m e n t o f c o l d-d a m p a r t h r a l g i a t y p e R A.I n t h i s p a p e r,t h e r e s e a r c h m e t h o d s o f l i t e r a t u r e r e v i e w a r e u s e d t o s u mm a r i z e t h e r e c e n t r e s e a r c h o n t h e a n t i-i n f l a mm a t o r y m e c h a n i s m o f WT D.I t i s f o u n d t h a t WT D c a n r e g u l a t e i n f l a mm a t o r y c y t o k i n e s a n d i n f l a mm a t o r y m e d i a t o r s b y t h e s y n e r g i s t i c e f f e c t o f s i n g l e d r u g a n t i-i n f l a mm a t o r y a c t i v e i n g r e d i e n t s t o p l a y a n t i-i n f l a mm a t o r y e f f e c t. [K E Y W O R D S] W u t o u D e c o c t i o n.R h e u m a t o i d a r t h r i t i s.A n t i-i n f l a mm a t o r y m e c h a n i s m.R e v i e w乌头汤(W u T o u d e c o c t i o n,WT D)首载于医圣张仲景所著‘金匮要略“中,全方由乌头㊁麻黄㊁芍药㊁黄芪㊁炙甘草五味药物组成㊂方中乌头㊁麻黄相使为君,辛温散寒,宣痹止痛,效在温通;臣以黄芪益气固表㊁炙甘草缓急益气,两药相须配伍,发挥益气固本之效;佐以芍药补血活血,缓急止痛㊂WT D全方药少力专,互为助用㊂乌头㊁麻黄辛温散寒,宣痹止痛以治标,芪㊁ʌ基金项目ɔ国家重点研发计划(编号:2018Y F C1705203);甘肃省中医药项目(编号:G Z K Z-2021-3)㊂ʌ作者简介ɔ杨静(1998-),男,在读硕士研究生㊂研究方向:中医药防治风湿疾病㊂ʌ通讯作者ɔ田雪梅,E m a i l:h x h z234@q q.c o m芍㊁草三药益气补血,调和营卫以治本,标本兼顾,全方共奏温经益气㊁散寒宣痹之功[1]㊂该方适用于风寒湿邪侵犯人体所致痹证而寒湿偏胜者,是治疗寒湿痹阻型类风湿关节炎(R h e u m a-t o i d A r t h r i t i s,R A)的基础方剂㊂现代医学有关R A发病核心机制仍不明确,目前认为R A的发生主要与免疫细胞㊁炎症因子㊁基质金属蛋白酶(m a t r i x m e t a l l o p r o t e i n-a s e,MM P)㊁氧化应激异常㊁遗传㊁环境等因素相关[2],而炎症作为R A发病的核心病理环节和关键预后环节,影响着疾病的发展与转归㊂若滑膜炎症持续存在,会使自身抗体产生和促炎细胞因子的持续释放,导致滑膜细胞增生,破骨细胞活化㊁引起骨与软骨的破坏,最终导致关节僵硬㊁变形㊁骨质破坏和关节功能丧失㊂研究证明,WT D发挥温经益气㊁散寒宣痹的功效,可减轻R A患者的临床症状(关节V A S评分㊁晨僵时间㊁关节压痛指数㊁D A S28评分㊁H A Q 评分),降低实验室相关指标(血沉㊁C R P㊁R F㊁炎症因子等)[3-4]㊂近年来,越来越多的WT D 治疗R A的临床案例与相关研究被文献报道,但其抗炎机制研究尚缺乏较为系统总结㊂为了进一步明确WT D对R A的抗炎作用机制,本文通过阅读近年相关文献,综述如下,以期为WT D抗炎机制深入研究提供思路借鉴㊂1乌头汤中单味药物的抗炎机制乌头中抗炎药理活性最为活跃成分是二萜类生物碱,其中最具有代表性的是高乌甲素(l a p p a c o n i t i n e,L A),其能通过抑制核转录因子κB(n u c l e a r f a c t o r-k a p p a B,N F-κB)以及丝裂原激活蛋白激酶(m i t o g e n a c t i v a t i o n p r o t e i n k i-n a s e,MA P K)而抑制炎症信号通路的激活,下调炎症因子㊁趋化因子以及其他炎症介质的表达[5-6]㊂麻黄抗炎活性与伪麻黄碱含量密切相关,通过间接刺激α-肾上腺素能受体,使内源性去甲肾上腺素从神经元释放,直接刺激β-肾上腺素能受体,下调前列腺素E2(p r o s t a g l a n-d i n E2,P G E2)㊁肿瘤坏死因子-α(t u m o r n e c r o-s i s f a c t o r,T N F-α)㊁白介素(i n t e r l e u k i n,I L)-1β和I L-6的表达,上调I L-4和I L-10表达水平,既可抑制渗出性炎症,又抑制增殖性炎症[7-8]㊂黄芪发挥抗炎作用的主要成分是黄芪多糖和黄芪甲苷,目前在炎症性疾病中被广泛使用,二者呈剂量依赖性抑制I L-1β诱导的相关炎症因子的产生以及N F-κB信号转导通路的激活,以控制机体的炎症反应[9-10]㊂芍药有赤白之分,二者化学成分基本一致,仅是所含成分量的区别,均有抗炎作用,但白芍优于赤芍㊂徐佳新等[11-12]认为白芍通过抑制P G E2㊁环氧化酶-2(c y c l o o x y g e n a s e-2,C O X-2)㊁白三烯B4 (l e u k o t r i e n e B4,L T B4)㊁活性氧(R e a c t i v e o x y-g e n s p e c i e s,R O S)㊁一氧化氮(n i t r i c o x i d e, N O)等致炎因子的表达发挥抗炎作用,其抗炎作用主要与芍药苷㊁芍药内酯苷㊁苯甲酰芍药苷以及丹皮酚等活性成分有关㊂甘草总黄酮中的异甘草素是甘草抗炎活性成分之一,通过抑制MA P K通路㊁P P A Rγ通路,降低细胞N F-κB㊁白介素㊁C O X-2㊁T N F等多种因子的表达,以及产生抗氧化活性㊂同时,甘草水提液能作用于树突状细胞表面T o l l样受体4(T o l l-l i k e r e c e p-t o r4,T L R4),而影响下游MA P K和N F-κB信号通路,促进树突状细胞成熟,调节炎性细胞因子分泌,增强免疫细胞活性㊁调节免疫功能而发挥免疫调节和抗炎作用[13-14]㊂综上可知,WT D所含五味药物都有其特殊的抗炎活性成分,通过不同的途径调节炎症因子与炎症介质的表达,从而发挥抗炎作用㊂2乌头汤方对R A的抗炎药理机制炎症损伤的过程有大量细胞因子及炎症介质的参与,包括白细胞介素㊁T N F㊁干扰素(I n-t e r f e r o n,I F N)等,而信号通路通过受体㊁配体㊁和转录因子调控着这些细胞因子和炎症介质的表达,共同参与机体炎症反应㊁介导免疫组织损伤㊂WT D可调控多条炎症相关通路,通过多靶点㊁多层次调节免疫细胞功能,抑制多种炎症因子的表达,发挥抗炎作用㊂2.1抑制N F-κB信号通路 N F-κB是一种多效调节免疫的关键转录因子,在体内主要以p50和p65结合构成的异二聚体形式存在㊂促炎因子等细胞外刺激信号可激活转化生长因子-β激活激酶1(t r a n s f o r m i n g g r o w t h f a c t o r-β-a c t i v a t e d k i n a s e1,T A K1),使核转录因子抑制蛋白κB(N u c l e a r f a c t o r i n h i b i t o r y p r o t e i n,IκB)磷酸化而发生降解,活化后的异二聚体内移到细胞核内介导炎症因子的转录㊂N F-κB信号通路参与多种炎症的信号转导,其激活与否影响炎症基因的表达[15-16],与炎症因子㊁趋化因子㊁氧化应激㊁感染㊁微生物等密切相关,在免疫调节㊁细胞凋亡和炎症反应等方面发挥重要的作用㊂多项实验研究证实传统名方WT D能通过限制上游蛋白含量的表达与抑制N F-κB的磷酸化使N F-κB信号通路被抑制,减轻R A模型的炎症反应㊂如当上游Iκκ激酶(Iκκ)㊁IκB 激酶(IκB)㊁p65等蛋白的过度表达,N F-κB通路激活,使炎性细胞进入滑膜组织发生炎症[17],但WT D可降低N F-κB通路上游蛋白如I L-1β㊁I L-6㊁T N F-α和MM P-3等的表达,抑制N F-κB信号通路的活化,发挥抑制炎症的作用[18]㊂IκB是N F-κB的抑制蛋白,通常情况与N F-κB呈二聚体形式存在于体内,可抑制N F-κB通路活化㊂但当细胞因子㊁蛋白等刺激细胞时,IκB蛋白发生磷酸化,N F-κB核定位信号区暴露,促使N F-κB完成磷酸化,激活N F-κB通路,产生炎症反应;而IκB蛋白的磷酸化可被WT D抑制,进而发挥抑制N F-κB磷酸化的作用,减轻N F-κB信号通路介导的炎症反应,同时还可以通过增加核因子E2相关因子2(N u-c l e a r f a c t o r E2-r e l a t e d f a c t o r2,N r f2)的表达,强化其介导的抗氧化途径产生协同抗炎作用[19-20]㊂2.2调控P I3K/A K T信号通路3-磷酸肌醇激酶(p h o s p h o i n o s i t i d e-3-k i n a s e,P I3K)是脂质激酶家族成员,是由一个催化亚基(p110)和一个调节亚基(p85)组成的二聚体复合物蛋白,分为3种同工酶亚型(Ⅰ㊁Ⅱ㊁Ⅲ)㊂P I3K激活后使一系列下游底物如丝氨酸(S e r i n e/p r o t e i n k i n a s e B,A k t)磷酸化而介导细胞增殖㊁凋亡㊁促进血管生成㊁细胞癌性转化㊁调控滑膜炎,导致软骨损伤等[21-22]㊂研究表明,WT D可通过调节A K T-MA P激酶的激酶4(MA P k i n a s e k i n a s e4,MK K4)-终端激酶(c-J u n N-t e r m i n a l k i n a s e,J N K)-转录因子A P-1(J U N)炎症信号轴,增加A K T磷酸化蛋白的表达,减少MK K4㊁J N K和J U N磷酸化蛋白的表达量,从而起到抗炎止痛作用[23]㊂研究表明,WT D通过P I3K/A K T信号通路干预R A所致滑膜炎症及后续骨与软骨破坏进程,其中WT D中麻黄总生物碱可以增加A K T磷酸化水平,下调磷酸化N F-κB蛋白表达,从而降低关节中T N F-α㊁I L-1β等炎症因子的表达㊁抑制滑膜细胞增殖,发挥抗炎作用[24]㊂2.3调控其他炎症信号通路核苷酸结合寡聚化结构域样受体蛋白3(N O D-l i k e r e c e p t o r p r o t e i n3,N L R P3)炎症小体是人体免疫应答的重要组成部分㊂N L R P3炎性信号通路在R A的炎症病理发展过程中意义重大,可以识别或被多种危险信号主动激活,介导促炎细胞因子如I L-1β㊁T N F-α等表达而导致炎症发生[25-26]㊂研究发现,WT D能抑制N L R P3炎性体的异常活化,进而抑制滑膜组织中N L R P3㊁天冬氨酸特异性半胱氨酸蛋白酶-1(c a s p a s e-1)蛋白的表达㊁减少炎性细胞因子I L-1β㊁I L-18释放,缓解风寒湿痹型胶原诱导性关节炎(c o l-l a g e n i n d u c e d a r t h r i t i s,C I A)模型大鼠关节肿痛等炎性表现[27]㊂此外,芳香烃受体(A r y l h y d r o c a r b o n r e-c e p t o r,A h r)存在于人体的多种组织与细胞中,由805个氨基酸构成,属于碱性螺旋-环-螺旋转录因子家族,可以被许多内源性或外源性配体激活,A h r信号通路调节人正常生物学功能,与调控炎症㊁免疫㊁氧化应激㊁皮肤癌变㊁能量调节等有关[28-29]㊂交叉点接合蛋白1(s r c h o m o l o g y2d o m a i n c o n t a i n i n g t r a n s f o r m i n g p r o t e i n1,S H C1)基因与细胞凋亡㊁炎症和R O S 产生有关,A h r作为一种转录因子,激活后便从细胞质转入到细胞核,从而刺激L O C101928120基因的转录与表达,进而抑制S H C1基因表达,下调I L-1β等促炎因子的表达,而WT D可通过充当A h r转录配体,调控A h r/L O C101928120/S H C1信号通路,产生炎症级联反应,逆转I L-1β㊁R O S的产生,从而减轻R A大鼠关节炎症反应[30]㊂单核细胞趋化蛋白1(m o n o c y t e c h e m o t a c-t i c p r o t e i n1,M C P-1)可以与受体C C趋化因子受体2(C C C h e m o k i n e r e c e p t o r2,C C R2)结合,将细胞外信号调节激酶1/2(e x t r a c e l l u l a r-s i g n a l-r e g u l a t i o n e d k i n a s e s1/2,E R K1/2)磷酸化,激活N F-κB等炎症因子产生㊂研究者发现WT D能够抑制M C P-1/C C R2/E R K1/2信号转导,通过降低C I A大鼠血清及踝关节局部M C P-1的含量,减少踝关节中C C R2和E R K1/2磷酸化形式的表达水平,发挥减轻关节炎症的作用[31]㊂上述研究表明,WT D可通过多种抗炎活性成分之间的协同作用调控N F-κB与P I3K/ A K T等多条炎症相关信号通路,多靶点㊁多层次㊁多途径实现其对R A的抗炎作用㊂3小结与展望综上所述,炎症是R A病程的核心环节,一方面,炎症导致关节疼痛与肿胀,另一方面,炎症的持续状态最终会导致骨质破坏和关节功能丧失㊂WT D具有良好的抑制炎症反应㊁改善炎性症状的作用㊂在对其作用机制的研究中发现WT D所含丰富的药物活性成分之间协同作用,调控多条炎症相关信号通路,多靶点㊁多层次㊁多途径实现其抗炎作用㊂但是,目前WT D 对R A抗炎机制的研究仍存在不足之处:(1)与R A炎症相关的信号转导通路有许多,涉及N F-κB信号通路㊁P I3K/A K T信号通路㊁MA P K信号通路等多条不同的信号通路[32],但目前只涉及了N F-κB㊁P I3K/A K T两条信号通路,尚不能深刻揭示WT D治疗R A的抗炎机制,也无法体现中医药的多靶点治疗的优势㊂(2)WT D复方所产生的协同抗炎机制㊁抗炎力量的强弱与剂量㊁配伍之间的关系缺乏深入研究,使其难以在临床药物加减中实际运用㊂(3)目前R A炎症的研究已经涉及到细胞自噬㊁m i R N A等领域,如炎症可激活细胞自噬,而过度自噬又可以使滑膜细胞增殖㊁产生炎症介质,最终破坏患者的关节和软骨[33];m i R N A的过度表达提升炎症通路信号传导水平,使促炎细胞因子分泌增加而导致炎症加重[34],而运用中医药治疗R A炎症机制的相关研究较少㊂故在以上研究的基础上,今后应从以下几个方面进行深入挖掘:(1)根据网络药理学及计算机技术筛选有关抗炎信号通路和生物学介质并进行后续实验验证研究,以完善WT D抗炎机制理论㊂(2)通过拆方研究WT D中药物配伍比例与抗炎效应之间的关系㊂(3)可从调控自噬和m i R-N A等角度展开研究,以期深刻揭示乌头汤抗R A炎症的作用机制㊂参考文献[1]吴挺超,岳仁宋,何茗苠,等.基于医案数据挖掘探讨‘金匮要略“乌头汤的应用规律[J].中国中医基础医学杂志,2022,28(4):614-618. [2]杨丽,刘荣华,黄四碧,等.类风湿性关节炎的发病机制及治疗药物研究进展[J].中国药房,2021,32(17):2154-2159.[3]刘君,李洁芳,吴丹.乌头汤加味联合甲氨蝶呤治疗寒湿痹阻型类风湿关节炎疗效及对血清炎症因子的影响[J].现代中西医结合杂志,2022,31(1):96-99.[4]王静静,李俊.艾灸联合乌头汤治疗风寒湿阻型类风湿关节炎临床疗效观察及机制探讨[J].湖北中医杂志,2022,44(2):8-11.[5]石新卫,路强强,周亚福,等.高乌头中二萜生物碱成分及其生物活性研究[J].时珍国医国药,2020,31(9):2078-2081.[6]张尹,高召兵,辛晓明,等.高乌甲素药理活性的研究进展[J].生命科学,2021,33(9):1089-1095.[7]G l o w a c k a K,W i e l a-H o j e n s k a A.P s e u d o-e p h e d r i n e-B e n ef i t s a n d R i s k s[J].I n t J M o l S c i,2021,22(10):5146.[8]A h s a n H,I r f a n HM,A l a m g e e r,e t a l.A n t i-r h e u m a t i c a c t i v i t y o f p s e u d o e p h e d r i n e(a s u b-s t i t u t e d p h e n e t h y l a m i n e)i n c o m p l e t e F r e u n d'sa d j u v a n t-i n d u c e d a r t h r i t i c r a t sb y d o w n r e g u l a-t i n g I L-1β,I L-6a n d T N F-αa s w e l l a s u p r e g u-l a t i n g I L-4a n d I L-10[J].I n f l a mm o p h a r m a c o l-o g y,2021,29(3):673-682.[9]L i H,P e n g Y,W a n g X,e t a l.A s t r a g a l o s i d ei n h i b i t s I L-1β-i n d u c e d i n f l a mm a t o r y r e s p o n s e i n h u m a n o s t e o a r t h r i t i s c h o n d r o c y t e s a n d a m e l-i o r a t e s t h e p r o g r e s s i o n o f o s t e o a r t h r i t i s i n m i c e[J].I mm u n o p h a r m a c o l I mm u n o t o x i c o l,2019, 41(4):497-503.[10]范信晖,李科,杨一丹,等.基于分子量分布的黄芪多糖抗炎活性组分筛选及代谢组学调控机制研究[J].药学学报,2022,57(3):783-792. [11]徐佳新,许浚,曹勇,等.中药白芍现代研究进展及其质量标志物的预测分析[J].中国中药杂志, 2021,46(21):5486-5495.[12]杨山景,封安杰,孙越,等.白芍总苷的药理作用及机制研究进展[J].中国现代应用药学,2021, 38(13):1627-1633.[13]葛孚晶,曾晨鸣,严芳洁,等.甘草酸:一种治疗新型冠状肺炎的潜在药物[J].药学学报,2021, 56(5):1211-1216.[14]F u Y,J i a J.I s o l i q u i r i t i g e n i n C o n f e r s N e u r o-p r o t e c t i o n a n d A l l e v i a t e s A m y l o i d-β42-I n d u c e dN e u r o i n f l a mm a t i o n i n M i c r o g l i a b y R e g u l a t i n gt h e N r f2/N F-κB S i g n a l i n g[J].F r o n t N e u r o s c i, 2021,15:638772.[15]H a y d e n M S,G h o s h S.S h a r e d p r i n c i p l e s i nN F-k a p p a B s i g n a l i n g[J].C e l l,2008,132(3): 344-62.[16]梁霄,李娅兰,张筠昊,等.基于T L R2/p38MA P K/N F-κB信号通路探讨独活寄生汤对类风湿性关节炎大鼠的抗炎作用及机制[J].中国实验方剂学杂志,2023,29(11):43-52. [17]林婉娜,苏慧琳,李慧敏,等.黄芪桂枝五物汤抗类风湿性关节炎的作用机制[J].中国实验方剂学杂志,2022,28(9):9-15.[18]谢新宇,梅阳阳,付长龙,等.乌头汤对脂多糖诱导大鼠软骨细胞炎症反应的影响[J].风湿病与关节炎,2020,9(3):1-5+11.[19]陈昱江,杨茂,李腾仙,等.N F-κB信号通路关键蛋白I-κBα的磷酸化与结直肠癌组织发生发展的关联性[J].中国老年学杂志,2019,39(13): 3142-3144.[20]X i e Y,M a i C T,Z h e n g D C,e t a l.W u t o u d e-c o c t i o n a m e l i o r a t e s e x p e r i m e n t a l r h e u m a t o i da r t h r i t i s v i a r e g u l a t i n g N F-k B a n d N r f2:I n-t e g r a t i n g e f f i c a c y-o r i e n t e d c o m p a t i b i l i t y o f t r a-d i t i o n a l C h i ne s e m e d i c i n e[J].P h y t o m e d i c i n e,2021,85:153522.[21]S u n K,L u o J,G u o J,e t a l.T h e P I3K/A K T/m T O R s i g n a l i n g p a t h w a y i n o s t e o a r t h r i t i s:an a r r a t i v e r e v i e w[J].O s t e o a r t h r i t i s C a r t i l a g e, 2020,28(4):400-409.[22]邓欢,吕艺蓁,刘宣,等.P I3K/A K T信号通路调控骨关节疾病软骨细胞自噬及损伤的机制[J].西安交通大学学报(医学版),2022,43(2):309-314.[23]郭秋岩,李玮婕,王超,等.乌头汤缓解神经病理性疼痛的炎症网络调控机制研究[J].药学学报, 2019,54(6):1054-1061.[24]师钰琪,吴红艳,朱春燕,等.从B D N F/T r k B信号通路探讨乌头汤对神经病理性疼痛模型小鼠脑神经元的保护作用[J].中国实验方剂学杂志, 2020,26(7):23-30.[25]雷杰,张志文,贺梦吟,等.淫羊藿苷对类风湿关节炎小鼠N L R P3炎性小体信号通路的影响[J].现代中西医结合杂志,2020,29(29):3206-3211.[26]徐洪远,朱晨柳,杨洁净,等.N L R P3炎性小体研究进展及与消化系统疾病关系[J].辽宁中医药大学学报,2022,24(1):151-155. [27]张晨曦.基于N L R P3炎性体信号通路研究乌头汤对风寒湿痹证C I A大鼠模型的影响[D].山西:山西中医药大学,2019.[28]赵丽凤,沈建英,谭余庆,等.激活芳香烃受体信号通路对白癜风和糖尿病的治疗作用[J].中国现代医学杂志,2019,29(3):61-66. [29]刘茂林,钟晓春,陈功星.芳香烃受体在自身免疫疾病中的研究进展[J].江苏医药,2020,46(5):525-529.(下接第10页)暂停相关因素分析[J].吉林医学,2018,39(8): 1433-1434.[2]杨泽凯,刘西洋,姜岑.氨茶碱与枸橼酸咖啡因治疗对呼吸暂停新生儿神经行为和后期神经发育的影响[J].临床和实验医学杂志,2019,18 (11):1199-1202.[3]张磊,孙岩,孙建伟,等.枸橼酸咖啡因注射液与氨茶碱注射液治疗低体重呼吸暂停早产儿的临床研究[J].中国临床药理学杂志,2021,37(7): 816-819.[4]M i a o Y,Z h o u Y,Z h a o S,e t a l.C o m p a r a t i v ee f f i c a c y a n d s a f e t y o f c a f f e i n e c i t r a t e a n d a m i n-o p h y l l i n e i n t r e a t i n g a p n e a o f p r e m a t u r i t y:a s y s t e m a t i c r e v i e w a n d m e t a-a n a l y s i s[J].P L o S O n e,2022,17(9):e0274882.[5]金汉珍,黄德珉,官希吉.实用新生儿学第3版[M].北京:人民卫生出版社,2003:230-235.[6]孙传兴.临床疾病诊断依据治愈好转标准第2版[M].北京:人民军医出版社,1992:246. [7]张磊,孙岩,孙建伟,等.枸橼酸咖啡因注射液与氨茶碱注射液治疗低体重呼吸暂停早产儿的临床研究[J].中国临床药理学杂志,2021,37(7): 816-819.[8]蒋晓莉,张勤,刘磊.不同维持剂量枸橼酸咖啡因治疗新生儿呼吸暂停的临床效果[J].临床医学研究与实践,2022,7(12):107-109.[9]金宝,高翔羽,杨波,等.枸橼酸咖啡因联合双水平正压通气治疗早产儿呼吸窘迫综合征[J].中华妇幼临床医学杂志(电子版),2018,14(6): 656-662.[10]刘剑勇,黄倩芸,李梦琳,等.血浆N P Y和β-E P与阻塞性睡眠呼吸暂停综合征的相关性研究[J].中国中西医结合耳鼻咽喉科杂志,2022,30(1):6-9.[11]赵小燕,张帆,朱良梅,等.肺表面活性物质气管内滴入联合枸橼酸咖啡因治疗早产儿呼吸窘迫综合征疗效研究[J].创伤与急危重病医学, 2022,10(3):225-227+231.[12]鲁志力,杨超,李志鑫,等.枸橼酸咖啡因治疗早产儿呼吸窘迫综合征的临床疗效及对神经发育的影响[J].中南医学科学杂志,2020,48(1):42-44.[13]P u i a-D u m i t r e s c u M,S m i t h P B,Z h a o J,e t a l.D o s i n g a n d s a f e t y o f o f f-l a b e l u s e o f c a f f e i n ec i t r a t e i n p r e m a t u r e i n f a n t s[J].J P ed i a t r,2019,211:27-32.[14]刘秋梅,喻光燚,王晶,等.氨茶碱单剂量与多剂量给药在家兔体内的药动学研究[J].中国药物与临床,2018,18(2):171-174.[15]李志刚,顾阳,谭海,等.氨茶碱与柠檬酸盐协同作用促进环磷酸腺苷发酵生产[J].中国生物工程杂志,2021,41(7):50-57.(上接第5页)[30]W u D,L i X,L i u J,e t a l.W u t o u d e c o c t i o n a t-t e n u a t e s r h e u m a t o i d a r t h r i t i s b y m o d u l a t i n g t h eA h r/L O C101928120/S H C1p a t h w a y[J].P h a r m B i o l,2021;59(1):811-822. [31]郭晴晴,樊丹平,赵雨坤,等.乌头汤对C I A大鼠M C P-1/C C R2/E R K1/2信号的作用[J].辽宁中医杂志,2017,44(7):1504-1507. [32]L i u S,M a H,Z h a n g H,e t a l.R e c e n t a d v a n c e so n s i g n a l i n g p a t h w a y s a n d t h e i r i n h i b i t o r s i nr h e u m a t o i d a r t h r i t i s[J].C l i n I mm u n o l,2021,230:108793.[33]K a r a m i J,M a s o u m i M,K h o r r a m d e i a z a d H,e ta l.R o l e o f a u t o p h a g y i n t h e p a t h o g e n e s i s o fr h e u m a t o i d a r t h r i t i s:L a t e s t e v i d e n c e a n d t h e r a-p e u t i c a p p r o a c h e s[J].L i f e S c i,2020,254: 117734.[34]E v a n g e l a t o s G,F r a g o u l i s G E,K o u l o u r i V,e ta l.M i c r o R N A s i n r h e u m a t o i d a r t h r i t i s:F r o mp a t h o g e n e s i s t o c l i n i c a l i m p a c t[J].A u t o i mm u nR e v,2019,18(11):102391.。
姜黄素治疗类风湿关节炎作用机制研究进展

姜黄素治疗类风湿关节炎作用机制研究进展孙焱;于慧敏【摘要】Rheumatoid arthrhtis( RA) is a chronic autoimmune disease and the pathogenesis is still not clear.Curcumin has already become a hotspot for RA treatment.This article summarizes the mechanism of curcumin for RA treatment from two aspects:anti-inflammatory effect and self-cell and tissue in order to broaden our thoughts about RA treat-ment.%类风湿关节炎是一种慢性自身免疫性疾病,其发病机理尚不明确。
目前姜黄素已成为治疗类风湿的研究热点,本文针对近几年姜黄素治疗类风湿关节炎的作用机制进行总结,分别从其抗炎性及对自身细胞组织的影响两方面进行阐述。
希望在类风湿关节炎的治疗上进一步拓宽思路。
【期刊名称】《中医药学报》【年(卷),期】2015(000)006【总页数】4页(P113-116)【关键词】类风湿;姜黄素;细胞因子;成纤维样滑膜细胞【作者】孙焱;于慧敏【作者单位】哈尔滨医科大学附属第二医院中医科,黑龙江哈尔滨150086;哈尔滨医科大学附属第二医院中医科,黑龙江哈尔滨150086【正文语种】中文【中图分类】R285类风湿关节炎(Rheumatiod Athritis,RA)是一种病因不明的慢性炎症型自身免疫疾病,以对称的外周多发关节炎为特征。
它是慢性炎症性关节炎最常见的一种,并会导致关节损害和肢体残疾[1-2],给患者的身心带来极大的危害。
临床治疗以非甾体抗炎药、慢作用抗风湿药及生物制剂为主,患者对药物的治疗作用及副反应不同,预后也不尽相同。
静脉血栓栓塞性疾病实验室检测的研究进展

静脉血栓栓塞性疾病实验室检测的研究进展李琪;金红;富宏然;陈宏娟;李成威;闫海润【期刊名称】《中国实验诊断学》【年(卷),期】2016(000)001【总页数】4页(P158-161)【作者】李琪;金红;富宏然;陈宏娟;李成威;闫海润【作者单位】牡丹江医学院红旗医院检验科,黑龙江牡丹江 157011;牡丹江医学院红旗医院检验科,黑龙江牡丹江 157011;牡丹江医学院红旗医院检验科,黑龙江牡丹江 157011;牡丹江医学院红旗医院检验科,黑龙江牡丹江 157011;牡丹江医学院红旗医院检验科,黑龙江牡丹江 157011;牡丹江医学院红旗医院检验科,黑龙江牡丹江 157011【正文语种】中文静脉血栓栓塞性疾病(VTE)包括深静脉血栓(DVT)及肺栓塞(PE),当由各种原因造成血粘度升高,血流变学改变,血管壁受损时血液中的凝血系统异常激活造成肢体深静脉形成一个或多个血栓即为深静脉血栓,血栓从深静脉脱落形成栓子随血液行至肺部造成肺栓塞。
由于VTE在住院患者中发病率和致死率极高。
根据其临床症状进行诊断缺乏敏感性和特异性,通过临床症状疑诊VTE的患者实际发病率少于20%[1]。
而延误诊断会造成患者死亡,引发心肺功能失调严重影响病人的生活质量[2]。
为使临床可以及时准确的做出诊断,经过大量研究证实,实验室检查对VTE的诊断具有很高的价值,本文将对近年来的实验室检测指标进行综述。
VTE的实验室检测指标包括:凝血类标志物、炎性标志物两大类以及近年来提出几项新指标,凝血类标志物主要包括凝血酶(TG)、凝血因子、纤维蛋白单体(FM)、D-二聚体(DD),炎性标志物包括炎症因子IL-1β、6、8、10,C反应蛋白,P选择素。
新提出的有类风湿因子(RF)、载脂蛋白A(APOa)、微粒(MPs)。
VTE的发生是由于病理因素造成凝血纤溶系统平衡失调,从而引发血栓的形成,通过对在血栓形成以及纤溶过程中产生的物质进行检测研究,从而对VTE进行预测,即为凝血及纤溶类标志物的作用。
凝血酶敏感蛋白-1与肾脏疾病的研究进展14

凝血酶敏感蛋白-1与肾脏疾病的研究进展摘要】凝血酶敏感蛋白-1(thrombospondin-1,TSP-1)是一种多功能的细胞外基质糖蛋白,它的异常表达参与多种肾脏疾病,本文就其作一综述,为肾脏病的早期诊断和预后评价提供新的依据。
【关键词】凝血酶敏感蛋白-1;肾脏疾病【中图分类号】R446 【文献标识码】A 【文章编号】2095-1752(2016)11-0014-02Thrombin sensitive protein - 1 and the research progress of kidney disease Li Zhilan Chen Peihong, Ye Yumei..The Seventh People's Hospital of Shanghai City, Shanghai 200937, China【Abstract】Thrombin sensitive protein 1 (TSP-1) is a multifunctional extracellular matrix glycoprotein, its abnormal expression can cause many kinds of kidney diseases. This thesis summarized its,in order to for the early diagnosis and prognosis of kidney disease evaluation provides a new basis.【Key words】Thrombin sensitive protein - 1; Kidney disease1.TSP-1的结构凝血酶敏感蛋白-1,是20世纪70年代发现的一种细胞外基质糖蛋白,主要分布在血小板颗粒中。
由成纤维细胞、平滑肌细胞、巨噬细胞、单核细胞、内皮细胞等多种细胞合成[1]。
TSP-1抗血管生成机制研究进展
各种血管生成 因素 的刺 激反 应而抑制血管生长 。本文就 T P一1 S 抗血 管生成 机制 研究 进展做一综述 。
【 关键词 】 凝血酶敏感蛋 白 一 ;t 成机 制 ; 1S管生 肿瘤 【 中图分类号 】 702 1 R 3 .3 【 文献标识码】 A 【 文章编号 】62 49 一(07 0 1 2 0 17 — 92 20 )9— 3 — 3 4
广泛表达 。T P 主要在细胞表面表达 , Ss 其主要功能是调整细
T P一1 S 和大多 数 大蛋 白质 一样 , 外显 子 改组 和复 制 是
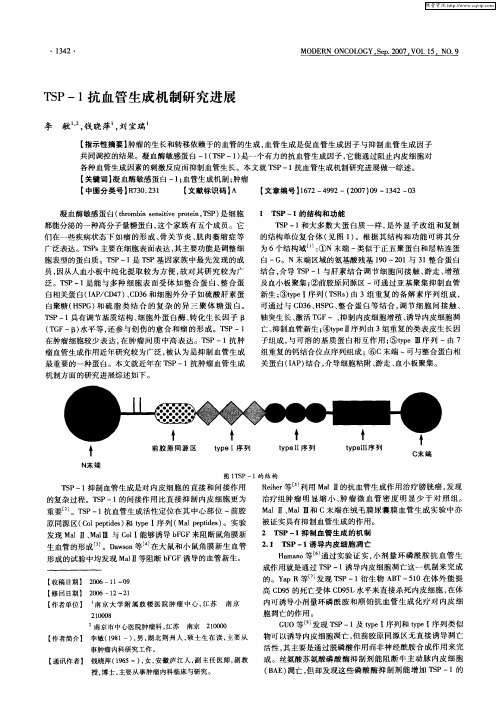
的结构单位 复合体 ( 见图 1 。根据 其结 构和功 能可 将其 分 ) 为 6个结构域 … : ①N末端 一类似于 正五聚蛋 白和层粘 连蛋
白 一G。N末 端区域的氨基酸残基 10~2 1与 3 整合 蛋 白 9 0 1 结合 , 介导 T P一1 S 与肝 素结 合调 节细 胞 间接 触 、 游走 、 殖 增
南京 2 00 100
6 2 【 回日期】 20o —1 —21 修
江 【 作者单位 】 南 京大 学 附属 鼓 楼 医院 肿瘤 中心 , 苏 南 京
21 o 8 0 O
生血管 的形 成 ] a sn等 在大 鼠和小 鼠角膜 新生 血管 。D w o
形成的试验 中均发现 Ma Ⅱ等阻断 b G l F F诱 导的血管新生。
6 【 收稿 日期】 2oo — 11 , a ao 小剂 量环 磷酰胺 抗 血管 生
凝血酶敏感蛋 白(ho bnsniv rt n T P 是细 胞 trm i e si po i ,S ) te e
凝血酶敏感蛋白1抗血管新生作用研究进展

序 列 及钙离 子结合 区( ' t eⅢ重复序 列 ) 成 ( 1  ̄ p 组 图 ) 其 中, N端结 构域是 肝 素结 构 区段 , T P1对 血小 与 S一 板聚集、 内皮 细胞增 殖和移 行 的调 节作用 密 切 相关 ; T Pl的 审 e I重 复 序列 (ho  ̄ pn i t e I r— s— p tr do odn y e r s p pa , S  ̄ 由三个 备解 素样 基序 ( o f 重 复 组成 , et T R ) s , t ̄ n i) 可结合 转化生 长 因 子 S等 多 种 蛋 白因子 , 认 为是 被 TPI S - 抑制 内皮 细胞增殖 、 导 内皮 细胞 凋 亡 和抑制 诱 血 管 新 生 等作 用 的结 构基 础 , 目前对 T P I 构与 S-结 功 能研 究 的重 点 集 中在 此 一 区段 , 它也 含有 肝 素结 台 位点 ;3 1 复序列 是 T P I 钙离 子结 合 的主 t3 1重  ̄e 3 S- 与 要 区域 ; 结构域 参与 T P l 内皮 细 胞移行 和血 C端 S— 对 小板 聚 集 的 调节 作 用 。T P 1 它 结 构 域 的功 S一其
v 2 2 Al 【 T
№ . 2 2O 02
凝血酶 敏 感 蛋 白 1抗血 管新 生作 用研 究进 展
刘 澎 综述 韩 忠朝 审技 c 中国医学科学院、 中国协和医科大学血蘸学研究所实验止灌学国家重点实验室, 天津 3o2J ooo 摘要 : 凝血酶敏感蛋 白 1t o lsodn11 1是 重要 的多肤 类 内源性血 管新生抑 制物。IP1的抗血 管新 生 (h m ̄ pni-, ) r "- S
血清sPD-1和sPD-L1对类风湿关节炎的诊断价值及其与疾病活动度的相关性

疾病活动度;相关性
[中图分类号]R59322 [文献标识码]A [文章编号]20968388(2021)07080507
DOI:10.19367/j.cnki.20968388.2021.07.010
805
贵 州 医 科 大 学 学 报
46卷
groupatthesametime.CollectingfastingperipheralvenousbloodinthemorningofRApatients(the followingdayadmittedtothehospital) andthenormalcontrolgroup(thedayreceivedphysical check).Enzymelinkedimmunoassay(ELISA) wasusedtodetecttheexpressionofsPD1 and sPDL1intheserum ofthreegroups,andthecompletebloodwhitebloodcell(WBC)countand erythrocytesedimentationrate(ESR)ofthethreegroupsweredetectedbyanautomaticbloodcell analyzerandanautomaticerythrocytesedimentationrateanalyzer.Usinganautomaticbiochemical analyzertodetecttheserum rheumatoidfactor(RF),alanineaminotransferase(ALT),aspartate aminotransferase(AST) and serum creatinine (SCr) levelsofallgroups, and the automatic electrochemiluminescenceanalyzertodetectserum Creactiveprotein(CRP).Thereceiveroperating characteristiccurve(ROC)wasusedtocalculatetheareaunderthecurve(AUC)andanalyzethe correlationbetweenserum sPD1/sPDL1 ofRA patientsand scoresofESR/CRP/DAS283 by Pearsoncoefficient.ThediagnosticvalueofsPD1andsPDL1onRA andthepredictivevalueof diseaseactivitywereanalyzed.Results TheserumsPD1levelofRApatientswassignificantlyhigher thanthatofthenormalcontrolgroup,andtheactivegroupwashigherthantheremissiongroup,the differencewasstatisticallysignificant(P<0.05);ESR(r=0.743,P<0.001),serumSPD1ofRA patientswereallpositivelycorrelatedwithCRP(r=0.672,P<0.001),DAS283score(r=0.946, P<0.001).ROCresultsshowedthatsPD1hadthegreatestdiagnosticvalueforRA,withanAUCof 0.904andthebestcutoffvalueof305.56μg/L;FollowedbythediagnosticvalueofRF.Thereare statisticallysignificantdifferencesbetweenthetwoindicatorsandantiCCPantibodies(P<0.001). sPD1hadthehighestpredictivevalueforRAdiseaseactivity,withAUCof0.974andthebestcutoff valueof370.75μg/L,secondbypredictivevalueofantiCCPantibody.Thedifferencesbetweenthe twoindicatorsandRFwerestatisticallysignificant(P<0.05).Conclusion Serum sPD1canbe usedasanewRAserologicalauxiliarydiagnosticindexandanevaluationindexforpredictingdisease activity. [Key words] arthritis,rheumatoid(RA); diagnosis; negativecooperativesignalingmolecules; solubleprogrammed celldeath1(sPD1); solubleprogrammed celldeath1 ligand1(sPDL1); diseaseactivity;correlation
基因转移技术在治疗类风湿性关节炎的应用

也 明显 降低 , 以这 种 抑 制 T FO是 很 有 前 途 的 一 所 N— t
种治 疗 方法 。 22 I一 I. 是 软骨损伤 的重要 介质 , 一 受体 . L1 L1 I1 L 拮抗 剂 能抑 制 I一 L1的炎症 前效 应 。H r ¨ u 等 将携 带 人 类 I .R 基 因 和 绿 色 荧 光 蛋 白 ( re u rse t L1 a g nf oecn e l po i , F ) 因 的重 组 A ( dhL 1 a G P 对 缺 rt n G P 基 e d A l一R / F ) 乏 I R 基 因的 Bl/ A 小 鼠进 行 踝 关 节 内注 射 。 L1 a a c b
间地表 达并 可 通 过 药 物 来 调 节 ; 较 少 引起 免 疫 反 抑制 破 骨细 胞 活 性 , 护 软 骨 细 胞 , 是 R ④ 保 它 A治 疗 的 应 。许 多实 验 已经 证 实 A V 可 有 效 地 转 染 滑 膜 细 重要 手 段 。H a 等 研 究 了 A 大 鼠模 型 中 I - A as A L4 胞 和人 软 骨 细胞 ¨ …。在 R 的 动 物 模 型 中 , 论 直 对血 管形 成 的 作用 。研 究 采 用携 带 编码 I4 基 因的 A 无 L 接 注入关 节 还 是 注 射 至 肌 肉均 可 有 效 地 利 用 A V A A d对大 鼠进行关节 内注射 , 然后取踝关节作体 内和 进行 基 因转移 ¨ 川。 向 CA 鼠模 型 的 肌 内注 射 能 表 体 外 的血 管 生 成 分 析 , 酶 联 免 疫 吸 附 试 验 检 测 蛋 I 用
结 果 表 明 , dhL1 aG P能 明 显 改 善 早期 炎 症 组 A l一R / F 的关 节炎 症 状 , 轻 爪 垫 肿 胀 程 度 。组 织 病 理 学 显 减 dhL 1 a G P治 疗 后 , 节 、 关 1 2 3 A V A V是 一种 缺 陷 型 非病 原 性 人 类 细 示 早 期 炎 症 组 接 受 A I一R / F . . A A 小病 毒 , 目前 发 现 的 最 小 、 构 最 简 单 的 D A病 足底 肿 胀程 度 、 膜 细 胞 增 生 程 度 及 炎 性 细 胞 浸 润 是 结 N 滑 毒 , 复制 依 赖 于 辅 助 病 毒 ( d或 单 纯 疱 疹 病 毒 ) 其 A , 可转染 分 裂 期 及 静 止 期 的细 胞 。A V A 2是 最 常 用 的 程 度都 明显减 轻 ;h 诱 导 的 IG a降低 ,h Tl g T2诱导 的 IG 升 高 , 明早 期 进 行 I一R g 表 L1 a基 因 治 疗 在 R 的 A
RA类风湿性关节炎 文献综述

毕业论文(设计)文献综述题目名称:中药对类风湿性关节炎关于信号传递影响题目类别:药理学系别:化学与生物工程学院专业班级:学生姓名:指导教师:辅导教师:完成日期:中药对类风湿性关节炎关于信号传递的影响摘要:目地研究不同中药对类风湿性关节炎关于信号传递的影响。
方法将各种中药材按照实验要求制备好,通过复制动物模型,采取灌胃的给药方式,观察各组大鼠的一系列生理反应。
结论中药对类风湿性关节炎关于信号传递有明显的抑制作用。
关键词:中药类风湿性关节炎信号传递影响类风湿性关节炎(RA)是一种以对称性、多关节炎为主要表现的慢性、全身性自身免疫性疾病.目前尚无特异治疗其发病率、致残率均较高严重危害人类健康[1]。
类风湿性关节炎( rheumatioid arthritis,RA) 主要侵袭外周关节,滑膜病理为滑膜增生炎性细胞浸润血管翳、侵蚀性软骨及骨组织损伤,导致关节结构破坏畸形和功能丧失,我国患病率约为0.32%~0.36%,男女比为3∶1[2]。
现阶段人们广泛采用中药来治疗和控制RA的蔓延,同时人们通过大量的实践,总结出了不少中药材对RA有明显的治疗和抑制作用。
1.RA的发病机制1.1 RANK/RANKL/OPG与RA骨侵蚀研究发现破骨细胞是骨侵蚀的主要因素,骨保护素(Osteop ro tegerin,OPG)-核因子-K B受体活化因子配机(Receptor activator of nuclear factor –kappaβligand,RANKL)-核因子-K B受体活化因子(Receptor activator ofnuclearfactor-kappaB,RANK)(OPG-RANKL-RANK)是破骨细胞分化过程中的重要信号传递通路,在破骨细胞生成、活化、发育、激活、成熟过程中起着决定性作用,是非常重要的破骨细胞分化调节信号因子。
而OPG作为RANKL的可溶性诱骗受体,其通过与RANKL结合,抑制RANKL与位于破骨细胞前体细胞表面的核因子K B受体激活剂结合,从而抑制破骨细胞前体细胞的分化以及成熟[3-7]。
ADAMTS-4与TAK1在骨关节炎软骨组织中表达的相关性研究

节软骨退变性疾病 , 其病理特征为关节软骨破坏和
关 节周 围骨 赘 的形成 。聚蛋 白多 糖 的 丢失 引起 软 骨
细胞外基质 ( e x t r a c e l l u l a r m a t i r x , E C M) 合成与分解 代谢 的失 衡是 O A软 骨破 坏 的重要 机 制 之一 l 1 j 。近 年来研究 显示 A D A M T S - 4 , 即带有血小板凝 血酶 敏感蛋 白样模体的解 整链 蛋 白金属蛋 白酶4, 在人 O A的聚蛋 白多糖 的降解 中起着主要作用。许多信 号通路参与 O A的发病过程 , 这 些信号通路通 过级 联放大作用 , 导致 E C M 中相关蛋 白酶及炎性成分变
化引起 软 骨 破 坏 ; 其 中 丝 裂 原 活 性 蛋 白激 酶 ( mi t o .
g e n a c t i v a t e d p r o t e i n k i n a s e s , MA P K s ) 途 径 和 核 因子 -
无病变。所有新鲜标本 一部分 以 1 0 % 中性福尔 马
点。
者 。① O A组 : 因膝 骨关节炎而行全膝关节置换术 中取材 的关 节软 骨标本 , 共2 0例 ( 男 5例 , 女1 5
例) , 年龄 4 9~8 2 ( 6 5 . 9 4 - 9 . 2 2 ) 岁 。纳 入 标 准 : O A
关键词
骨关节 炎 ; 软骨组织 ; A D A MT S - 4 ; T A K 1
x线 检查 关节 软 骨 面 光 滑 , 并 术 后 病 理 学 诊 断 关 节
文献标 志码 A 文章编号 1 0 0 0—1 4 9 2 ( 2 0 1 4 ) 0 3— 0 3 4 3—0 4
类风湿关节炎年度回顾

性红 斑狼疮 ( S L E ) 发病 相关 。有 研 究提 示 , 髓磷 脂 碱
基蛋 白( MB P ) 也 可 能是 R A候选 易 感基 因。此 外 , I L
一
、
R A 发 病 机 制
的敏 感 性有 所 提 高 , 利于 R A 的早 期 诊 断 , 但 其 特 异 性偏 低 , 假阳性率达 1 8 %, 在 临 床 应 用 中 尚欠 理 想 。 在“ 十一五 ”国家科 技 支 撑 计 划 的支 持 下 , 国 内建 立 了早 期 ( E)一R A分 类 诊 断标 准 , 敏 感 性 和 特 异 性 分
悉尼大学获博士学位 , 在美 国 哈 佛 大 学完 成 博 士后 。 在类 风 湿关 节 炎 、 系统性红斑狼 疮、 干燥 综 合 征 、 强 直 性 脊 柱 炎 及 血 管 炎 等 风 湿 病 的诊 断 和 治 疗 上 有 丰 富 的经 验 。主 要 研 究 方 向为 类 风 湿 关 节 炎 的 发 病 机 制 及 免 疫 治 疗 、 系统 性 红 斑 狼 疮 及 干 燥 综 合 征 的 早 期 诊 断 及 治 疗 。主 编 或 参 与 编 写 了 8部 风 湿 病 和 免 疫 学 专 著 。 目前 承 担 国 家 自然 科 学 基 金 ( 重 点 项 目) 、 “ 8 6 3 ” 项 目、 国家 杰 出青 年 基 金 、 教育部重点项 目、 中华 医学 专 项 人 才 基 金 及 教 育郡 跨 世 纪 优 秀 人 才 基 金 等 1 6项 科 研 项 目 。
的价值 。 筛选 R A血 清学 标 志 物 的研 究 显 示 , R A患 者 血
PT、APTT、FBG及AT-Ⅲ在类风湿性关节炎病情活动度监测中的意义

PT、APTT、FBG及AT Ⅲ在类风湿性关节炎病情活动度监测中的意义蔡聪颖(葫芦岛市中心医院检验科,辽宁葫芦岛125001)DOI:10.11748/bjmy.issn.1006-1703.2020.12.027收稿日期:2020 09 29;修回日期:2020 10 26作者简介:蔡聪颖(1970—),女,本科,副主任检验师。
研究方向为临检。
E mail:71879991@qq.com摘要:目的 通过对凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FBG)、抗凝血酶Ⅲ(AT Ⅲ)的检测,分析该四项指标评估类风湿性关节炎(RA)活动度的意义。
方法 纳入我院2017年5月至2020年5月间收治的RA患者97例,回顾并分析其病历资料,按病情活动度评分(DAS28)将研究对象归为A(稳定)、B(低活动度)、C(中等活动度)、D(高活动度)四组,依次是20、21、27、29例;对比各组患者PT、APTT、FBG、AT Ⅲ四项指标的测量结果,分析DAS28评分与该四项指标的相关性。
结果 四组PT对比:与A组相比,C、D组结果明显升高(P<0.05);与B组相比,D组结果显著升高(P<0.05);且D组检测结果比C组更高(P<0.05)。
四组APTT、FBG对比:D组比其他三组检测结果更高(P<0.05)。
四组AT Ⅲ对比:与A组相较,C、D组检测结果明显降低(P<0.05);与B组对比,C、D两组结果显著降低(P<0.05);D组结果明显比C组更低(P<0.05)。
结论 处于不同活动度的RA患者,其PT、APTT、FBG及AT Ⅲ指标检测结果有所差异,该四项指标均和RA活动度有一定相关性,临床可通过该四项指标对RA活动度实施监测。
关键词:凝血酶原时间; 活化部分凝血活酶时间; 纤维蛋白原; 抗凝血酶Ⅲ; 类风湿关节炎; 活动度中图分类号:R593.22 文献标识码:ASignificancesofPT,APTT,FBGandAT ⅢinMonitoringtheDiseaseActivityofRheumatoidArthritisCAICongying(DepartmentofLaboratory,HuludaoCentralHospital,Huludao125001,China)Abstract:ObjectiveToevaluatetheactivityofrheumatoidarthritis(RA)bydetectinglevelsofprothrombintime(PT),activatedpartialthromboplastintime(APTT),fibrinogen(FBG)andantithrombinIII(AT Ⅲ).MethodsRApatientswhowereadmittedinourhospitalbetweenMay,2017andMay,2020werereviewedandanalyzed.Accordingtothediseaseactivityscore(DAS28),thesubjectswereclassifiedintofourgroups:A(stable),B(lowactivity),C(moderateactivity),andD(highactivity),with20,21,27and29caseseach.WethencomparedthemeasurementresultsofPT,APTT,FBGandAT ⅢamongthesegroupandanalyzedthecorrelationbetweentheDAS28scoreandthefourindexes.ResultsPTcomparisonoffourgroupsshowedasfollowing:comparedwithAgroup,theresultsofCandDgroupweresignificantlyhigher(P<0.05).DgrouphadasignificantlyhigherresultcomparedwithBgroup(P<0.05).TheresultofDgroupwashigherthanthatofCgroup(P<0.05).APTandFBGcomparisonoffourgroupsshowedasfollowing:Dgroupwashigherthanthatoftheotherthreegroups(P<0.05).AT Ⅲcomparisonofthefourgroupsshowedasfollowing:comparedwiththeAgroup,thetestresultsoftheCandDgroupweresignificantlylower(P<0.05).TheresultsweresignificantlylowerinCandDcomparewithBgroup(P<0.05).DgrouphadasignificantlylowerresultsthanCgroup(P<0.05).ConclusionForRApatientswithdifferentdegreesofactivities,theirPT,APTT,FBGandAT Ⅲindicatorstestresultsaredifferent.ThefourindicatorshaveacertaincorrelationwithRAactivity,suggestingthatRAactivitycanbemonitoredthroughthefourindicators.Keywords:Prothrombintime; Activatedpartialthromboplastintime; Fibrinogen; AntithrombinIII; Rheumatoidarthritis; Activity8312LabeledImmunoassays&ClinMed,Dec.2020,Vol.27,No.12 类风湿关节炎(rheumatoidarthritis,RA)为发病机制尚不明确的一类病变,以滑膜炎为主[1 2]。
关于抗CCP抗体、RF和CRP联合检测在早期诊断类风湿关节炎中的作用分析

3讨论
目前,临床还尚未完全明确类风湿关节炎的发
病因素,但较多研究显示,上述疾病的发生和遗传、
性激素、感染等存在较强的相关性,发病机理主要
为间质大量炎性细胞浸润、滑膜衬里细胞增生等。
由于上述疾病可致残,故需尽早给予患者对症治
408
新疆医学
第51卷
疗,而早期诊断是早期救治的重要前提,血清学检 测是诊断类风湿关节炎的常用方法,具有操作简 单、检测速度快、可重复性强等特点,常用的指标有 抗CCP抗体、RF、CRP等。
对照组55例体检者年龄为41 -64 (52.69 ± 2.72)岁,男女分别为 23(41.82%).32(58.18%)例。
两组资料经统计得P > 0.05,可对比。 纳入标准:(1)患者均符合早期类风湿关节炎 诊断标准(病程不超过3个月,患者除软组织肿胀 外,双手未出现其他明显放射学骨破坏改变);(2) 18岁及以上者;(3)对研究知情者;(4)临床资料信
作者简介:古力娜尔•依司马依,女,主管检验师,研究方向:临床生化检验。
第4期
古力娜尔•依司马依;关于抗CCP抗体、RF和CRP联合检测在早期诊断类风湿关节炎中的作用分析
407
例早期类风湿关节炎患者及同期55例健康体检者 作为观察对象。
实验组55例患者年龄为42-65(52.75 士 2.68) 岁,男女分别为 21(38.18%).34(61.82%)例。
Key words: Rheumatoid; arthritis; anti CCP antibody; RF; CRP; diagnosis
类风湿性关节炎(RA, rheumatoid arthritis)属于 多系统炎症性自身免疫性疾病,以关节软骨侵蚀为 主,长期以往可导致关节软骨和骨质破坏,最终可 引发关节畸形,严重影响了患者运动功能叫有数据 显示叫我国上述疾病患病率为0.3 - 0.4%,在一定 程度上威胁了人群健康,故及时对上述疾病患者开 展有效诊断和救治十分关键。较多研究证实叫类风 湿性关节炎的发生、发展和类风湿因子、抗环瓜氨 酸肽抗体等存在较强的相关性,故较多学者认为,
风湿免疫疾病的凝血异常

REPORTING
目录
• 风湿免疫疾病概述 • 凝血系统生理功能及异常表现 • 风湿免疫疾病中凝血异常发生机制 • 常见风湿免疫疾病中凝血异常特点 • 凝血异常对风湿免疫疾病影响及临床意义 • 总结与展望
PART 01
风湿免疫疾病概述
REPORTING
定义与分类
定义
风湿免疫疾病是一类涉及关节、肌肉、骨骼及周围软组织,同时可能影响内脏 器官的慢性疾病。这类疾病多与自身免疫反应有关,导致炎症和组织损伤。
实验室指标异常
凝血异常患者的实验室检查结果可 能显示凝血时间延长、凝血因子活 性降低等。
实验室检查与评估
凝血时间测定
通过测定血液凝固所需时间来评估凝血功能,常用的方法 有活化部分凝血活酶时间(APTT)和凝血酶原时间(PT )。
血小板功能检测
通过测定血小板的聚集、黏附等功能来评估血风湿免疫疾病包括多种类型,如类风湿性关节炎、系统性红斑狼疮、强直性脊 柱炎、干燥综合征等。
发病原因及机制
遗传因素
许多风湿免疫疾病具有家族聚集性, 表明遗传因素在发病中起重要作用。
环境因素
免疫异常
自身免疫反应是风湿免疫疾病的核心 发病机制,涉及T细胞、B细胞等免疫 细胞的异常活化和相互作用,导致炎 症和组织损伤。
缓解关节疼痛和肿胀
通过改善凝血异常,可以减轻关节疼 痛和肿胀等症状,提高患者的生活质 量。
降低心脑血管事件风险
风湿免疫疾病患者存在较高的心脑血 管事件风险,改善凝血异常可以降低 这种风险,减少并发症的发生。
PART 06
总结与展望
REPORTING
当前存在问题和挑战
风湿免疫疾病凝血异 常的机制尚未完全阐 明,需要进一步深入 研究。
抗凝血酶Ⅲ、蛋白C水平与脓毒症患者病情严重程度及预后关系的临床研究

•临床研究-中国现代医生2020年11月第58卷第32期抗凝血酶芋、蛋白C水平与脓毒症患者病情严重程度及预后关系的临床研究董世笑山东大学齐鲁医院,山东济南250012[摘要]目的探讨抗凝血酶芋(anlilhrombin芋,AT芋)、蛋白C(ProLein C)水平与脓毒症的病情严重程度及预后的关系。
方法选择2010年11月耀2017年11月脓毒症患者200例,观察AT-芋、PC水平及根据脓毒症严重程度分为脓毒症组(S1)共59例,严重脓毒症组(S2)共86例,脓毒症休克组(S3)共55例,比较三组的AT-芋、PC水平。
根据患者28d预后情况分为存活组与死亡组,比较两组AT-芋、PC水平。
评价AT-芋、PC对脓毒症患者预后的判断价值。
结果(1)S2组、S3组AT-芋水平低于S1组,两组比较差异有统计学意义(P<0.05);S2组、S3组PC 水平低于S1组,两组比较差异有统计学意义(P<0.05);S3组AT-芋水平显著低于S2组,两组比较,差异有统计学意义(P<0.05);两组PC水平比较,差异无统计学意义(P>0.05)°(2)死亡组患者AT-芋、PC水平明显低于存活组,差异有统计学意义(P<0.05)°⑶AT-芋、PC、APACHE域评分预测脓毒症患者死亡的ROC曲线下面积分别为0.5901,0.6098,0.5901°当AT-芋取42.5%,为截断值时,其敏感度为21%,,特异度为91.3%,;当PC取49.5%,为截断值时,其敏感度为40.3%,特异度为81.2%遥结论脓毒症患者的AT-芋、PC水平较低,其与脓毒症的严重程度密切相关,并对其预后具有一定的指导意义。
[关键词]脓毒症;抗凝血酶-芋;蛋白C;预后[中图分类号]R459.7[文献标识码]B[文章编号]1673-9701(2020)32-0114-04Clinical study on the relationship between antithrombin皿and protein C levels and the severity and prognosis of sepsis patientsDONG ShixiaoQilu HospiLal of Shandong University,Ji'nan250012,China[Abstract]Objective To explore Lhe relationship beLween anLiLhrombin芋(AT芋),proLein C(PC)levels and Lhe severi-Ly of sepsis and iLs influence on Lhe prognosis.Methods A LoLal of200paLienLs wiLh sepsis admiLLed Lo our hospiLal from November2010to November2017were selected as research objects.According to the levels of AT-芋and PC and the severity of sepsis,they were divided into the sepsis group(n=59,S1),the severe sepsis group(n=86,S2),and the septic shock group(n=55,S3).The levels of AT-芋and PC in three groups were compared.According to the28-day prognosis,the patients were divided into the survival group and death group,and the levels of AT-芋and PC in the two groups were compared.The prognostic value of AT-芋and PC in patients with sepsis was evaluated.Results(1)The level of AT-III in S2and S3groups was lower than that in S1group,and the difference was statistically significant(P<0.05).The level of PC in S2and S3groups was lower Lhan LhaL in S1group,and Lhe difference was sLaLisLically signifi-cant(P<0.05).The level of AT-III in S3group was significantly lower than that in S2group,and the difference was statistically significant(P<0.05).There was no significant difference in PC level between the two groups(P>0.05).(2)The levels of AT-III and PC in the death group were significantly lower than those in the survival group,and the difference was statistically significant(P<0.05).(3)The areas under the ROC curve of AT-芋,PC and APACHE域scores for predicting the death of septic patients were0.5901,0.6098and0.5901,respectively.When42.5%was taken as cutoff value, the sensitivity of AT-芋was21%and the specificity was91.3%'.When49.5%was taken as cutoff value,the sensitivity of PC was40.3%and the specificity was81.2%、Conclusion The levels of AT-芋and PC are low in patients with sepsis,which are closely related to the severity of sepsis and have certain guiding significance for the prognosis.[Key words]Sepsis;Antithrombin-芋;Protein C;Prognosis[基金项目]山东大学齐鲁医学院科研基金(青年项目)(2017QLQN38)中国现代医生2020年11月第58卷第32期•临床研究-脓毒症是重症监护病房(Intensive care unit,ICU)常见的危重症,为感染导致的全身炎症反应,随着病情的加重可引发多器官功能衰竭,从而危害患者的生命健康。
TL—1A和IL—17在类风湿关节炎中的作用及其临床意义

TL—1A和IL—17在类风湿关节炎中的作用及其临床意义肿瘤坏死因子样配体1A(TL-1A)和白细胞介素17(IL-17)与类风湿关节炎(RA)发病和病情进展密切相关,还可能与生物制剂治疗RA的疗效差异有关。
本文就TL1A和IL-17在RA发病机制中的作用及其临床意义的相关研究作一综述。
标签:类风湿关节炎;肿瘤坏死因子样配体1A;白细胞介素-17;肿瘤坏死因子类风湿关节炎(RA)是一种以对称性多关节慢性炎症为特征的慢性自身免疫性疾病,致残率高。
RA的慢性炎症浸润,引起滑膜增生和血管翳形成,侵蚀关节软骨和软骨下骨,并最终导致关节畸形和功能丧失[1]。
目前,RA的病因和发病机制尚未明确。
既往研究认为,肿瘤坏死因子(TNF)与免疫细胞表面的TNF受体结合,进而启动RA炎症网络中的级联反应,导致过度的炎症反应、组织损伤和骨质破坏[2]。
近年来有研究发现,肿瘤坏死因子超家族成员——肿瘤坏死因子样配体1A(TL-1A)以及白细胞介素17(IL-17)与RA疾病活动度密切相关。
本文就TL-1A和IL-17在RA发病机制中的作用进行综述。
1 TL-1A的功能及与RA的关系1.1 TL-1A的生物学特性肿瘤坏死因子样配体1A(TNF-like ligand 1 aberrance,TL-1A)与TNF-α同属于TNF超家族成员,在炎性疾病的发生、发展中起重要作用。
TL-1A是肿瘤坏死因子受体和肿瘤坏死因子诱导受体的配体,其基因有两种转录方式,从而决定其两种不同的蛋白质亚型。
该基因由内皮细胞、单核细胞以及浆细胞丰富表达,但是在B淋巴细胞和T淋巴细胞中不表达。
TNF和IL-1α可以诱导该蛋白质的表达。
炎症因子也能上调血清中TL-1A水平。
TL-1A能激活丝裂酶原激活的蛋白(MAP)激酶,抑制内皮细胞增殖、抑制血管再生,并且在內皮细胞中具有介导细胞凋亡的作用。
TL-1A通过与其受体——死亡受体3(DR3)结合,影响T细胞的活化与增殖,从而进一步影响T淋巴细胞介导的炎症反应,由此在关节炎症反应、免疫应答中发挥重要作用[3]。
凝血酶敏感蛋白—1及其受体CD36在支气管肺发育不良患儿中的表达及临床意义

凝血酶敏感蛋白—1及其受体CD36在支气管肺发育不良患儿中的表达及临床意义目的:探讨凝血酶敏感蛋白-1(TSP-1)及其受体CD36在支气管肺发育不良(BPD)患儿血清、支气管肺泡灌洗液中的表达及临床意义。
方法:采用ELISA 法检测45例BPD患儿与32例非BPD新生儿血清、支气管肺泡灌洗液的TSP-1及CD36表达水平并进行比较,同时对BPD患儿的TSP-1及CD36表达进行相关性分析。
结果:BPD患儿血清、支气管肺泡灌洗液的TSP-1及CD36水平均高于正常儿童(P<0.05);BPD患儿血清、支气管肺泡灌洗液的TSP-1与CD36表达均呈正相关性关系(P<0.05)。
结论:TSP-1及其受体CD36可能参与了新生儿BPD的发病过程并起协同致病作用,具体机制有待进一步研究。
[Abstract] Objective:To investigate the expression and clinical significance of thrombospodin-1 (TSP-1)and its receptor CD36 in bronchopulmonary dysplasia (BPD)children serum and bronchoalveolar lavage fluid.Method:The expression of TSP-1 and CD36 in serum and bronchoalveolar lavage fluid of BPD children(n=45)and non-BPD neonatus(n=32)were detected by ELISA.Correlations of TSP-1 and CD36 levels and the comparisons between groups were analyzed respectively.Result:The expression of TSP-1 and CD36 in serum and bronchoalveolar lavage fluid of BPD children were significantly higher than those of non-BPD neonates respectively (P<0.05).There was a positive correlation relationship between the expression of TSP-1 and CD36 in serum and bronchoalveolar lavage fluid(P<0.05).Conclusion:TSP-1 and CD36 may play a role in the pathogenesis of neonatus BPD and act cooperatively through an unexplored mechanism,the specific mechanism needs further study.[Key words] Thrombospodin-1;CD36;Bronchopulmonary dysplasia;ELISA支气管肺发育不良(bronchopulmonary dysplasia,BPD)常见于因急性呼吸窘迫而进行机械通气和氧疗的早产儿,其病理特征为严重的肺泡和肺血管发育不良,但病因及发病机制至今仍未完全清楚。
HELLP综合征的研究进展

HELLP综合征的研究进展郝小强【摘要】HELLP综合征是妊娠期高血压疾病的严重并发症,常危及母婴生命,是导致孕产妇及围生儿死亡的原因之一.近年来,国内外学者对其发病机制进行了大量研究,有母胎免疫失衡,血小板聚集与消耗,血管内皮功能障碍及先天性固有脂肪酸氧化失调等学说,但其发病机制目前尚未阐明,可能是子痫前期或子痫的严重并发症,也可能是一种独立的疾病.%HELLP syndrome is a serious life-threatening complication of hypertensive disorders in pregnancy, which is one of the main causes of maternal and perinatal mortality. In recent years, domestic and foreign scholars have done a lot of studies about its pathogenesis, such as immune imbalance, platelet aggregation and consumption, endothelial dysfunction, congenital disorder of oxidation of fatty acid, but its pathogenesis is still not clarified. It may be an independent disease or aserious complication of preeclampsia or eclampsia.【期刊名称】《医学综述》【年(卷),期】2013(019)001【总页数】4页(P123-126)【关键词】HELLP综合征;人类白细胞抗原G;凝血酶敏感蛋白1;长链L-3-羟酰CoA脱氢酶;瘦素【作者】郝小强【作者单位】南京医科大学附属南京医院,南京市第一医院妇产科,南京,210006【正文语种】中文【中图分类】R714.25HELLP 综合征(hemolysis,elevated serum lever of liver enzymes,and low platelets syndrome,HELLP syndrome)为妊娠期高血压疾病的严重并发症,常危及母婴生命,在临床表现上主要以溶血、肝酶升高和血小板减少等多见。
血红素氧合酶1与类风湿关节炎相关性探讨

血红素氧合酶1与类风湿关节炎相关性探讨类风湿关节炎(rheumatoid arthritis,RA)是一种自身免疫性疾病,发病率逐年增加。
RA患者的免疫系统会攻击关节中的软组织,使得关节肿胀和疼痛。
除此之外,RA还会影响其他器官,例如脾脏、肺、心脏等等。
当前,RA的发病机制尚不完全了解,但是研究表明,氧化应激、炎症反应、免疫反应等因素在RA的发病过程中起着重要的作用。
本文将探讨血红素氧合酶-1(HO-1)在RA中的作用及其调节机制。
HO-1是一种能够将草酰化的血红素(heme)降解为反应性氧气(reactive oxygen species,ROS)和胆红素的酶。
HO-1在许多疾病中都有重要作用,在RA中也不例外。
一方面,HO-1能够通过降解heme产生的ROS,减轻氧化应激,从而保护细胞免受氧化损伤。
另一方面,HO-1还能够抑制炎症反应,降低免疫细胞的活性,从而减少免疫相关疾病的发生。
已有多项研究发现,RA患者的血液中HO-1的表达水平明显降低。
这一现象表明,HO-1可能在RA的发病机制中具有重要的作用。
研究表明,HO-1能够通过多种方式参与RA的发病过程。
例如,HO-1可以抑制T细胞和巨噬细胞的活性,从而减轻炎症反应和关节疼痛。
同时,HO-1还能够影响NF-κB、JNK等信号通路,从而调节细胞凋亡、细胞周期等过程。
除了HO-1的作用机制之外,研究还表明,HO-1的表达受多种调节因素的影响。
例如,HO-1的表达可以被一些化学物质、细胞因子(如IL-10、IL-4)等诱导。
此外,HO-1的表达还与许多转录因子(如Nrf2、AP-1等)的活性有关。
总的来说,HO-1的表达受到复杂的调节机制控制,在RA的研究中需要进一步研究HO-1的调节机制。
总之,HO-1在RA的发病过程中具有重要的作用,能够通过抑制炎症反应、调节信号通路等机制减轻RA的症状。
因此,研究HO-1在RA中的作用和调节机制,对深入了解RA的病因机制、开发新的治疗策略具有重要的意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中华内科学杂志2014-02-27发表评论分享
类风湿关节炎(RA)是一种病因不明的自身免疫病,多见于中年女性,我国大陆地区的患病率约为0.32%~0.36%。
主要表现为慢性、对称性、进行性多关节炎,最终导致关节畸形和功能丧失,严重影响患者的生活质量。
传统的改善病情抗风湿药疗效有限,副作用大。
近年来,以TNFα措抗剂为代表的生物制剂为RA治疗提供了更多选择,但临床发现部分患者停用TNF措抗剂后复发,此外,约30%的患者应用生物制剂治疗无效。
提示,除TNFα外,尚有其他细胞因子或介质参与RA的发生发展,故深人研究RA发病机制,寻找新的治疗靶点,是拓展RA治疗思路的关键。
在卵巢癌、胃癌等肿瘤性疾病中,凝血酶敏感蛋白-1(TSP1)/转化生长因子β(TGFβ)/结缔组织生长因子(CTGF)通路是促进血管增殖的重要信号通路。
近年研究发现,TSP1、TGFΒ和CTGF均参与RA的病理过程。
TSP1是具有促进细胞间相互作用能力的同源三聚体分子,是中性粒细胞的趋化分子,在滑膜组织中可促进中性粒细胞和内皮细胞结合并渗透到炎症反应部位。
包括中性粒细胞、成纤维细胞和内皮细胞在内的多种细胞和血小板在炎症反应过程中均可产生大量的TSP1。
RA急性期中性粒细胞激活后迁移至炎症部位,促进TSP1和内皮细胞生长因子(VEGF)等细胞因子的趋化作用。
RA患者血桨或滑膜组织中可检测到高水平的TSP1、TGFβ和CTGF。
在内皮细胞中TSP1是TGFβ的激活剂。
在RA动物模型的滑膜组织中TSP1可调节CTGF基因和蛋白表达。
CTGF是TGFβ诱导细胞外基质生成的必要下游分子,且在RA患者滑膜组织中高表达。
1.TSP1与RA:
TSP1最早于血小板中发现,随后证实其在成纤维细胞、血管平滑肌细胞、内皮细胞和中性粒细胞等中广泛表达,并参与细胞黏附、分化和血管新生等多种生物学过程。
尽管生理状态下TSP1具有抗血管增殖作用,但在一些RA动物模型中,TSP1作用与其生理功能相反。
体内和体外研究均证实,TSP1是RA病情进展的加速剂。
TSP1在RA滑膜组织和血桨中高表达,并参与RA发病过程。
高水平TSP1通过促进炎性细胞因子IL-1、IL-6和TNFα的分泌与释放加速RA病情进展。
在RA侵蚀性关节炎模型鼠的一侧脚踝注人TSP1可导致踝关节红肿,利用TSP1衍生肽治疗,或用多肽清除TSP1,或多肽阻断TSP1 与中性粒细胞的相互作用,可显著缓解RA模型鼠的关节炎症,使白细胞浸润减轻和新生血管数量减少,同时滑膜组织增厚程度减轻。
但在Ⅱ型胶原诱导的关节炎(CIA)鼠中,给予TSP1多肽治疗可显著抑制鼠滑膜组织CTGF蛋白表达,关节症状缓解,提示TSP1在RA不同的动物模型中可能引发不同的生物学效应。
最近蛋白质组学研究证实,体外培养的RA成纤维样滑膜细胞(FLS)表达血管形成相关蛋白TSP1增加,进一步说明TSP1可能参与RA血管增殖过程。
2.TGFβ/Smads途径与RA:
TGFβ是一种多功能细胞因子,活化的TGFβ具有调控血管内皮细胞生长和血管管腔形成、诱导炎性细胞趋化、促进成纤维细胞增生及细胞外基质合成等作用。
正常关节滑液中TGFβ呈低水平表达且以无生物活性形式存在,在RA中TGFβ可被TSP1和纤溶酶激活,活化的TGFβ与细胞膜受体结合发挥生物学活性。
研究证实,RAFLS在胞质内合成TGFβ,并通过胞膜分泌至关节腔中。
RA患者血桨、滑膜组织和体外培养的FLS上清液中均有大量活化的TGFβ,TGFΒ表达与高水平的TSP1有关。
体外实验发现,低浓度的TGFβ即可诱导FLS分泌促血管生成因子——碱性成纤维细胞生长因子(bFGF)和VEGF,促进滑膜血管内皮细胞分裂增殖。
给RA模型鼠输注TGFβ可诱导白细胞趋化,关节红肿和骨组织破坏,提示TGFβ在RA发病过程中可能起到重要作用。
TGFβ1是TGFΒ家族中活性最强的一种亚型,不仅能促进组织修复,抑制基质金属蛋白酶(MMPs)活性,还参与调控炎性细胞趋化、血管内皮细胞和成纤维细胞生长,以及肺纤维化和细胞外基质合成等病理过程。
TGFβ1通过结合TGFβ受体(TGFβR)I和TGFpRⅡ发挥生物学作用。
TGFβRⅡ是启动TGFΒ1/Smads信号转导的受体,TGFβRI需与TGFβRⅡ结合才可激活。
Smads蛋白是TGFΒ信号传导途径关键的下游信号分子,活化的TGFΒRI激酶可直接诱导Smad2/3磷酸化,后者与共同介质型Smads形成活性转录复合物,该复合物随即转移至细胞核内,并直接与DNA序列连接,特异性调控目的基因转录,在细胞水平介导TGFΒ1的生物学效应。
RA滑膜组织和FLS中TGFβ1、TGFpRI和TGFβRⅡ高表达,并随疾病发展的不同阶段而变化,提示TGFβ1通路活性增强与RA病情相关,抑制TGFβRⅡ表达,可下调
TGFβ1/SmadS活性,并明显减轻骨质破坏。
RA炎症反应早期TGFβ1聚集在炎症部位募集单核细胞,单核细胞又可分泌TGFβ1,进一步增加TGFβ1的浓度。
高浓度的TGFβ1使T细胞聚集于炎症部位,加剧滑膜炎症反应。
给佐剂诱导关节炎(AIA)大鼠输注TGFβ1可使滑膜炎症加重,导致血管翳形成。
在Lewis大鼠关节腔内注射TGFβ1导致白细胞浸润和激活,产生大量细胞因子,引起滑膜炎症,关节红肿,促使关节炎症进展,导致骨质破坏,同时促进IL-6、VEGF、IL-15和TNF 分泌,激活TGFβ/Smads信号通路,进一步加重RA的症状。
给大鼠关节腔内注射抗TGFβ1抗体可明显缓解关节肿胀,抑制白细胞浸润和血管翳形成,减轻骨质侵蚀和软骨破坏。
RA患者中TGFβ1还可通过影响FLS的有丝分裂,促进bcl-2表达和干扰FaS抗原介导的细胞凋亡,促进FLS增殖。
体外研究证实,TGFβRI和血小板源性生长因子(PDGF)拮抗剂可抑制TGFβ诱导的RAFLS增殖;体内研究发现,TG FβRI拮抗剂可抑制CIA鼠关节炎症反应,提东TGFβRI
措抗剂在RA中具有潜在的抗炎作用。
在肺损伤和炎症早期,TGFβ1可通过趋化炎性细胞、诱导炎性因子释放,上调胶原和纤维黏连蛋白的基因表达水平,促进成纤维细胞增殖导致肺纤维化。
在间充质细胞和成纤维细胞中,CTGF是TGFβ1/SmadS途径促纤维化进程的重要下游分子,但
TGFΒ1/SmadS/CTGF信号途径是否与RA患者肺间质纤维化有关尚不清楚。
总之,TGFβ可能通过促进RAFLS增殖和抑制FLS凋亡、调节血管生长相关因子表达及调控炎症反应等作用参与RA进程并发挥重要作用,但目前TGFΒ/Smab途径在RA中的具体作用机制商不清。
3.CTGF与RA:
CTGF是一种富含半胱氨酸的多功能生长因子,是CCN家族成员,于1991年首次作为分泌性蛋白从人脐静脉内皮细胞分离。
成骨细胞、软骨细胞和成纤维细等均可分泌CTGF。
它参与细胞生长、分化和凋亡,以及内源性血管生成、纤维化、动脉粥样硬化、软骨内骨化等多种生物学过程。
CTGF可调节血管生成分子bFGF和VEGF表达,影响胶原、MMP/和组织金属蛋白酶抑制剂(TIMP0等维持胞外基质完整性和稳定性的分子的活性。
体外研究证实,CTGF在RA中表达增加,并可通过激活异常破骨细胞和干扰软骨组织的稳定状态导致关节破坏。
给CIA鼠注射抗CTGF单克隆抗体,可抑制体内病理性T细胞导致的免疫反应,并清除异常破骨细胞,显著缓解小鼠关节症状,证明CTGF参与RA
滑膜炎的进程。
在小鼠胚胎发育过程中,CTGF表达于心血管系统等血管丰富组织的内皮系统中,提示CTGF在血管生成中起重要作用。
CTGF参与整合素αVβ3介导的血管内皮细胞黏附、
游走,诱导内皮细胞增殖和体内血管生成。
滑膜增殖依赖大量血管提供氧分,统的CTGF 表达能是诱导RA的因素。
最近研究证实,体外培养的单核细胞分泌的CTGF诱导血管内皮细胞黏附,导致动脉粥样硬化形成。
动脉粥样硬化在RA患者中的发生率较健康人高,CTGF很可能是这一进程的重要参与者。
鉴于这一信号分子作用的多样性及在RA滑膜组织中的过表达,进一步明确CTGF在RA中的作用和机制,尤其是对RA中血管新生、纤维化和动脉粥样硬化进程的影响十分必要。
TSP1、TGFβ和CTGF三种信号分子均在RA高表达,且均参与疾病病理过程,但它们的关系和信号传导方式仍不十分清楚。
目前尚不明确RA中活化的TGFβ如何调控CTGF表达,亦不清楚TSP1与TGFβ的相互作用方式。
针对该通路的研究将进一步明确RA的发病机制,在不同水平干预
TSP1/TGFβ/CTGF途径将为临床治疗提供新思路,并有可能成为RA治疗的新途径。
关键词:类风湿关节炎RA凝血酶敏感蛋白-1。
